Method Article
Label-Free Imaging di singole proteine secernuto dalle cellule viventi tramite iSCAT microscopia
In questo articolo
Riepilogo
Vi presentiamo un protocollo per il rilevamento ottico in tempo reale di singole proteine senza etichetta come essi sono secernuti dalle cellule viventi. Questo si basa su microscopia interferometrica scattering (iSCAT), che può essere applicata ad una varietà di diversi sistemi biologici e configurazioni.
Abstract
Dimostriamo la microscopia interferometrica scattering (iSCAT), un metodo in grado di rilevare singole proteine senza etichetta secernuti dalle cellule viventi individuali in tempo reale. In questo protocollo, copriamo i passaggi fondamentali per realizzare un microscopio iSCAT e integrarla con ulteriori canali di imaging per monitorare la fattibilità di una cella in fase di studio. A seguito di ciò, utilizziamo il metodo per il rilevamento in tempo reale di singole proteine come essi sono secreti da una cellula vivente che dimostriamo con una linea di B-cellule immortalizzata (Laz388). Misure necessarie riguardanti la preparazione del microscopio e campione nonché l'analisi dei dati registrati sono discussi. Il protocollo video dimostra che quello Microscopia iSCAT offre un metodo semplice per studiare la secrezione a livello di singola molecola.
Introduzione
Proteine secrete gioca un ruolo importante in vari processi fisiologici1. Per questo motivo, essi sono ordinariamente studiati come un collettivo ensemble (proteomica) o come singole entità2,3. Proteomica tradizionalmente indaga l'intero set di proteine presenti in un particolare sistema biologico tramite ad esempio, le analisi enzima-collegata dell'immunosorbente (ELISA), citometria a flusso o spettrometria di massa4,5, 6. Singole proteine, d'altra parte, in genere vengono rilevati utilizzando una varietà di tecniche che si basano sulla fluorescenza7,8, plasmonica9,10o criogenico elettrone11 microscopie. Tutte queste tecniche utilizzano strumenti complessi, etichettatura o entrambi e spesso mancano informazioni dinamiche come forniscono solo informazioni a lungo termine sul sistema oggetto di studio.
Qui usiamo iSCAT12,13 microscopia per singole proteine secretorie senso con frazioni di secondo risoluzione temporale14. D'importanza, la tecnica rileva il segnale di sparso debole intrinseci a ogni proteina12,14. La quantità di luce che disperde un piccolo bioparticle scale con sua polarizzabilità. Supponendo che la forma di una proteina può essere approssimata da un efficace dispersione sfera14,15,16e che diversa proteine hanno indici di rifrazione molto simili, il segnale misurato può essere direttamente collegato al peso molecolare (MW) della proteina. La calibrazione empirica di iSCAT contrasto contro il peso molecolare di misure di riferimento permette di distinguere le proteine di dimensioni diverse. iSCAT esperimenti possono essere integrati facilmente da microscopia di fluorescenza17,18, dell'immunosorbente reagenti, come pure le etichette fluorescenti o scattering per consentire una rilevazione specifica di tutta la proteina di interesse14 , 17 , 19.
In linea di principio, iSCAT funziona amplificando la luce sparsa debole di una proteina tramite miscelazione interferometriche con un'onda di riferimento secondario. L'intensità rilevata (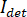 ) in un iSCAT microscopio è descritta da
) in un iSCAT microscopio è descritta da
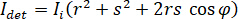
dove 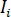 è l'intensità incidente,
è l'intensità incidente,  è un coefficiente per il contributo dell'onda di riferimento,
è un coefficiente per il contributo dell'onda di riferimento,  indica la forza di dispersione di nano-oggetto in fase di studio, e
indica la forza di dispersione di nano-oggetto in fase di studio, e 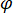 è lo sfasamento tra le sparse e di riferimento onde14. Sia trasmessa o riflessa indietro luce incidente è tipicamente usato come un'onda di riferimento, dove in ogni caso
è lo sfasamento tra le sparse e di riferimento onde14. Sia trasmessa o riflessa indietro luce incidente è tipicamente usato come un'onda di riferimento, dove in ogni caso 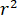 rappresenta per la trasmissività o riflettività della camera del campione, rispettivamente. Il termine
rappresenta per la trasmissività o riflettività della camera del campione, rispettivamente. Il termine 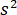 è proporzionale alla sezione trasversale di scattering la proteina e può essere trascurata rispetto al termine trasversale. Così, l'impostazione
è proporzionale alla sezione trasversale di scattering la proteina e può essere trascurata rispetto al termine trasversale. Così, l'impostazione 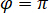 per interferenza distruttiva completa, la luce rilevata è dato da
per interferenza distruttiva completa, la luce rilevata è dato da 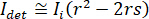 dove
dove 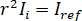 è l'intensità di riferimento e
è l'intensità di riferimento e 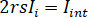 è l'intensità di interferenza.
è l'intensità di interferenza.
iSCAT microscopia offre un metodo eccellente per studiare i processi biologici a livello di singola molecola. Ad esempio, indaghiamo Laz388 cellule — trasformato un virus di Epstein - Barr (EBV) dei linfociti B cella linea20,21 — come essi secernono proteine quali gli anticorpi di IgG16. Tuttavia, il metodo è generale e può essere applicato ad una varietà di altri sistemi biologici. iSCAT è intrinsecamente non specifico e può rilevare qualsiasi proteina o nanoparticelle o esso può essere esteso ai comuni metodi di funzionalizzazione superficiale per rilevamento specifico o multiplex. Sua semplicità e la capacità di combinarsi con altre tecniche ottiche, come la microscopia a fluorescenza, fanno iSCAT un prezioso strumento complementare nella biologia delle cellule.
Protocollo
Attenzione: Si prega di leggere tutte le schede di sicurezza (MSDS) prima di utilizzare sostanze chimiche, osservare tutte le pratiche di sicurezza adeguati e indossare dispositivi di protezione individuale (occhiali di protezione laser, occhiali di protezione, guanti, camici da laboratorio) come necessario.
1. costruire il iSCAT microscopio16,18
Nota: Il microscopio iSCAT consiste tipicamente di un setup di microscopio invertito modificate. In breve, un laser è messo a fuoco sul piano focale posteriore di un obiettivo di alta apertura numerica (NA) e una lente per imaging consente di focalizzare la luce di retro-sparsi della particella su un chip di fotocamera. In generale, questo microscopio grandangolari può essere costruito da zero o basato su un microscopio invertito esistente. Questo protocollo riguarda i passi essenziali per realizzare il programma di installazione, mentre i cambiamenti dell'hardware utilizzato sono possibili. Una descrizione più dettagliata dell'Assemblea di un microscopio di iSCAT può essere trovata nell'opera di Arroyo et al. 18.
Attenzione: Un microscopio di iSCAT coinvolge una classe IIIB a sorgente di luce laser di classe IV. Protezione degli occhi adeguata è necessaria quando il montaggio e l'allineamento dell'ottica del microscopio. Durante l'Assemblea di microscopio, assicurarsi che il percorso del fascio laser rimane dritto e non è deviato come vengono aggiunti nuovi componenti ottici.
-
Impostare il percorso di illuminazione del microscopio.
- Utilizzando una tabella ottica smorzata e un blocco di metallo rigido, costruire un microscopio campione stage18 che incorpora un obiettivo di alta apertura numerica (NA) (100 X / 1,46 NA) e un'unità di traduzione che consente per esempio laterale di traduzione così come cambiamento di focus posizione dell'obiettivo.
Nota: Il funzionamento di un microscopio di iSCAT al limite di rilevazione di singole proteine è altamente suscettibile di vibrazioni esterne. Una fase di piezo centrosimmetrici che supporta il campione da tutti i lati è consigliabile limitare eccitazioni acustiche del campione che altrimenti avrebbe compromesso la stabilità laterale e focale. La figura 1 Mostra una fase di campione idoneo, tra cui l'unità di traduzione di piezo e l'obiettivo. Inoltre, è consigliabile per tutti i componenti ottici discussi nelle procedure seguenti vengono utilizzati supporti massicci e stabili. Tali componenti sono prontamente disponibili da fornitori di ottica commerciale. - Utilizzare una lente di singoletto di lunghezza focale di 50 cm (lenti grandangolari) e a 45° (verticale) accoppiamento specchio per mettere a fuoco la luce di un diodo laser a lunghezza d'onda 445 nm sul piano focale posteriore dell'obiettivo. Questo crea un fascio collimato avanti messa a fuoco dell'obiettivo e diventerà la fonte di illuminazione iSCAT. Se necessario, filtrare il laser nello spazio prima la lente di 50 cm tramite un 30 µm pinhole o fibra monomodale.
- Applicare una goccia di olio per immersione l'obiettivo e posizionare un coprioggetto in vetro nel piano campione del tavolino del microscopio. Questo si tradurrà in un fascio che riflette indietro giù attraverso l'obiettivo di formazione immagine.
Nota: La riflessione nasce dall'interfaccia aria-vetro sulla superficie superiore del campione coprivetrino e servirà come base per il fascio di riferimento iSCAT. Residui di sporco o polvere sulla superficie del coprivetrino darà luogo a fonti puntuali di scattering, che aiutano nella corretta messa a fuoco dell'obiettivo imaging nei passaggi successivi.
Attenzione: La maggior parte della luce laser trasmette attraverso il vetrino coprioggetto e viaggia verso l'alto dall'obiettivo. Collocare un diffusore opaco speculare (ad es., una carta di carta) sopra il vetrino coprioggetto per ridurre al minimo il rischio di lesioni dalla luce laser.
- Utilizzando una tabella ottica smorzata e un blocco di metallo rigido, costruire un microscopio campione stage18 che incorpora un obiettivo di alta apertura numerica (NA) (100 X / 1,46 NA) e un'unità di traduzione che consente per esempio laterale di traduzione così come cambiamento di focus posizione dell'obiettivo.

Figura 1: fase del campione di iSCAT. La fotografia mostra il blocco in alluminio massiccio sul quale è montata l'unità di traduzione di piezo (nero) così come il 100 centrato x obiettivo. La fase 3 assi piezo permette un posizionamento preciso del campione nel piano focale dell'obiettivo. Messa a fuoco grossolana viene effettuata ruotando un tubo filettato su cui è montato l'obiettivo (non raffigurato). Il blocco è posizionato sul tavolo ottico con quattro piedistalli in acciaio sopra lo specchio di accoppiamento di 45°. Clicca qui per visualizzare una versione più grande di questa figura.
-
Impostare il percorso di formazione immagine del microscopio.
- Introdurre un trattamento antiriflesso (AR)-rivestito divisore di fascio (riflessione del 70%, 30% trasmissione) ad un angolo di 45° rispetto al fascio incidente e circa 10 cm dopo le lenti grandangolari. Punto il rivestimento AR verso la sorgente laser. Questo trasmette il fascio incidente e riflette il riferimento e dispersi fasci verso il fascio incidente con un'angolazione di 90°.
Nota: AR-spalmato e/o incastrato beam splitter sono raccomandati come significativi effetti ghosting e frangia possono verificarsi quando si utilizza fascio spaccare cubi o non patinata planare beam splitter. Vedere la discussione per maggiori dettagli. Se lo si desidera, qualsiasi fascio riflesso indesiderato derivanti dal lato posteriore del divisore di fascio potrebbe essere bloccato da uso di un diaframma a iride. - Un divisore di fascio spessi introdurrà uno spostamento significativo fascio affinché il laser non potrebbe entrare l'obiettivo più dritto. Se necessario, riallineare il percorso del fascio laser prima il divisore di fascio per garantire la corretta propagazione attraverso l'obiettivo.
Nota: Il divisore di fascio potrebbe essere aggiunto anche prima l'ampia lente di campo e il tavolino del microscopio è posizionato (al punto 1.1.2.), così che il fascio non sarà spostato più tardi. - A questo punto, l'imaging braccio dell'interferometro a fuoco e assicurarsi che il piano di campione e la fotocamera sono parafocali. Posizionare un concavo f =-45 centimetri lente in una posizione 5 cm dopo la lente grandangolari nel percorso del fascio incidente. Questo si tradurrà in un fascio collimato entrando l'apertura posteriore dell'obiettivo.
- Con uno schermo posizionato nel riflesso braccio dell'interferometro, spostare l'obiettivo nella direzione verticale per trovare la posizione focale grossolana. L'obiettivo è a fuoco quando il fascio colpisce lo schermo è collimato.
Nota: La figura 2 Mostra lo schema di questo processo. - Rimuovere entrambi i f = lente-45 cm e lo schermo quando messa a fuoco grossolana è completa.
Nota: Invece di utilizzare una lente di lunghezza focale negativa, lo stesso obiettivo grandangolari può essere collocato su un supporto mobile e spostato fuori il percorso del raggio per questo passaggio. Tuttavia, per ottenere la configurazione più stabile del microscopio, è consigliabile tenere la lente di grandangolari in posizione fissa. - Aggiungere una seconda f = 50 cm singoletto lente per focalizzare la luce sparsa e collimare la luce riflessa sul sensore di una fotocamera CMOS. Assicuratevi che la lente sia posizionata 50 cm dal piano focale posteriore dell'obiettivo in modo da ri-collimare il fascio di riferimento e mettere a fuoco la luce sparsa.
- Posto il CMOS chip di 50 cm di distanza la f = lente di 50 cm e posizionare il fascio direttamente sul centro del chip.
Nota: I seguenti parametri vengono in genere utilizzati per l'imaging. La potenza di uscita del laser (lunghezza d'onda 445 nm) è impostata a 100 mW. Pinhole e beam splitter attenuano la luce trasmessa affinché il potere effettivo entrando l'obiettivo è di circa 9 mW. Il diametro del fascio alla posizione del campione ammonta a 6 µm. Con l'obiettivo di imaging utilizzato, l'efficace ingrandimento del sistema è circa 300 x. La dimensione dell'immagine sul chip CMOS è impostata su 128 × 128 pixel all'interno dell'area illuminata, risultante in un campo visivo di circa 5 × 5 µm2. La figura 3 Mostra un disegno schematico del microscopio iSCAT completamente assemblato.
- Introdurre un trattamento antiriflesso (AR)-rivestito divisore di fascio (riflessione del 70%, 30% trasmissione) ad un angolo di 45° rispetto al fascio incidente e circa 10 cm dopo le lenti grandangolari. Punto il rivestimento AR verso la sorgente laser. Questo trasmette il fascio incidente e riflette il riferimento e dispersi fasci verso il fascio incidente con un'angolazione di 90°.
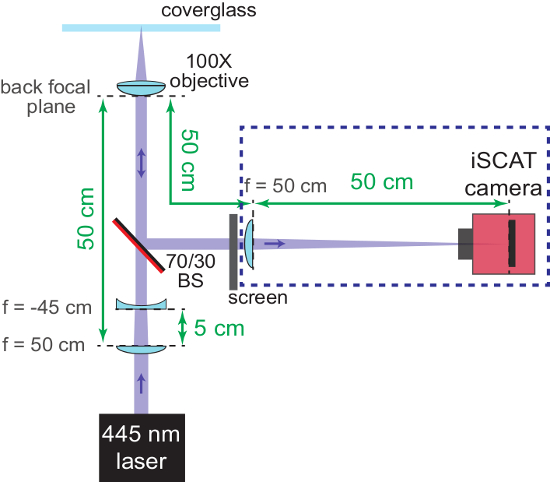
Figura 2: messa a fuoco grossolana del microscopio iSCAT. Lo schema mostra la disposizione delle ottiche per contribuire a portare il sistema a fuoco. Lato posteriore AR-rivestito del divisore di fascio (70/30 BS) è segnato in rosso. Distanze importanti sono forniti in verde. Vengono indicate le lunghezze focali (f) delle lenti usate. Componenti nella casella tratteggiata blu vengono aggiunti nei passaggi 1.2.6 - 1.2.7. La lente concava (utilizzato per ri-collimare il fascio di iSCAT convergenti) e lo schermo vengono rimossi più tardi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: microscopio iSCAT. Lo schema mostra il microscopio iSCAT completamente assemblato. Lato posteriore AR-rivestito del divisore di fascio (70/30 BS) è segnato in rosso. Distanze importanti sono forniti in verde. Vengono indicate le lunghezze focali (f) delle lenti usate. Clicca qui per visualizzare una versione più grande di questa figura.
-
Impostare ulteriori canali di formazione immagine.
Nota: Questa sezione aggiunge un altro percorso di formazione immagine del microscopio che permette l'osservazione di un'ampia area che circonda il laser iSCAT tramite microscopia in campo chiaro e per monitorare la vitalità cellulare tramite microscopia a fluorescenza.- Coppia l'output di una sorgente di luce LED (circa 500 nm < λ < 580 nm) in un lungo lavoro obiettivo NA distanza 20 X / 0,4 e installare componenti meccanici di sopra del pozzetto che consentono di messa a fuoco e posizionamento laterale dell'output LED sulla campione.
- Assicurarsi che il LED di output spettro copre la gamma di eccitazione del marcatore delle cellule morte (ioduro di propidio (PI)) e non interferisce con la sua fluorescenza (λ > 600 nm). Se necessario, utilizzare filtri ottici.
- Spostare lateralmente l'obiettivo superiore in modo che il superiore (grandangolari) e inferiore (iSCAT) gli obiettivi sono collineari. Questo è determinato posizionando uno schermo sotto l'obiettivo inferiore e massimizzare l'intensità della luce LED trasmessa sullo schermo. Posizionare un λ = 550 nm passa-breve specchio dicroico (SPDM) per dividere il trasmissione LED luce dal percorso laser iSCAT.
- Dividere questo fascio in due canali con un divisore di fascio trasmissivo di reflective/92% di 8% (BS). Il percorso di 92% è il canale di fluorescenza e il percorso di 8% è utilizzato per l'imaging in campo chiaro.
- Immagine brillante campo canale su una fotocamera CMOS utilizzando un f = 5cm doppietto acromatico lente.
- Immagine del canale di fluorescenza su una fotocamera CMOS separato utilizzando un f = 5cm doppietto acromatico lente e un λ = filtro passa-lungo di 600 nm per bloccare la luce di eccitazione. Figura 4a Mostra un disegno schematico del microscopio completamente assemblato compreso tutti i canali di formazione immagini.
- Coppia l'output di una sorgente di luce LED (circa 500 nm < λ < 580 nm) in un lungo lavoro obiettivo NA distanza 20 X / 0,4 e installare componenti meccanici di sopra del pozzetto che consentono di messa a fuoco e posizionamento laterale dell'output LED sulla campione.

Figura 4: microscopia iSCAT delle proteine secernuta dalle cellule singole. (a) schematica del microscopio descritto nel protocollo. Vedere sezione 1 per ulteriori informazioni. Abbreviazioni: LED, diodi emettitori di luce; SPF, filtro passa-breve; obj, obiettivo; SPDM, specchio dicroico passa-breve; BS, divisore di fascio; LPF, filtro passa-lungo; BF, campo chiaro; Fluor, fluorescenza; C1-C3, fotocamera 1-3. (b) Bright-campo immagine di un singolo Laz388 cellulare circa 4 µm dal iSCAT campo visivo (rappresentato da un quadrato bianco). Immagine ripresa dalla telecamera C3, barra della scala: 10 µm. (c) fluorescenza immagine della stessa regione illustrata in (b) con la posizione della cella contrassegnata da un cerchio bianco. L'assenza di fluorescenza indica che la cella è valida. Immagine ripresa dalla videocamera C2, barra della scala: 10 µm. (d) iSCAT Raw fotocamera immagine istantanea con tempo di esposizione di 80 µs. Immagine ripresa dalla telecamera C1. immagine di iSCAT (e) della stessa regione dopo la sottrazione sfondo spazio-temporale come descritto nella sezione discussione. L'immagine è stata integrata oltre 1000 crudo fotogrammi sequenziali (d) con un tempo di fotogramma finale di 400 ms e rivela la rugosità di superficie del vetrino coprioggetti. (f) corrispondente differenziale iSCAT immagine che mostra l'evento di associazione di 2 proteine sul vetrino coprioggetti. L'immagine è stata costruita sottraendo due immagini filtrate consecutivi (e). Scala bar in (d), (e) e (f): 1 µm. Questa figura è stata adattata da McDonald, M.P. et al. 16. copyright 2018 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.
-
Impostare il computer e il software.
- Collegare tutte le telecamere a un computer. Installare pacchetti driver rispettivi e ottenere/scrittura di software per il loro controllo.
Nota: Hardware adeguato è necessario per l'acquisizione ad alta velocità. Come minimo, un processore multi-core, 16 GB di RAM, una scheda frame grabber e un disco a stato solido per la memorizzazione dei dati sono raccomandati. - Osservare l'immagine di iSCAT sulla fotocamera CMOS e assicurarsi che sia a fuoco, trovando una particella di polvere o sporcizia residua sul vetrino coprioggetti. Verificare che l'immagine della particella è che un punto circolarmente simmetrico diffusa funzione (PSF).
Nota: Il motivo principale per un PSF non circolarmente simmetrico è che il raggio laser non entra l'obiettivo dritto, ma in un piccolo angolo rispetto all'asse ottico. Questo è corretto regolando l'angolo e la posizione del fascio incidente con lo specchio di accoppiamento di 45°. - Confrontare le immagini della telecamera del luminoso-campo e i canali di fluorescenza. Assicurarsi che entrambi sono a fuoco e visualizzare l'area stessa. Verificare che la posizione del laser iSCAT è approssimativamente nel centro dell'immagine e prendere nota della sua posizione per riferimento futuro. Vedi Figura 4b – 4f per immagini tipiche della fotocamera.
Nota: Utilizzare un campione di cellule o perline fluorescenti per trovare la messa a fuoco dei due canali. Rimuovere temporaneamente il filtro passa-lungo di fluorescenza per regolare il sistema. Lo stato attivo per l'imaging convenzionale delle cellule deve essere leggermente più alto rispetto al piano focale di iSCAT. Per compensare questo senza spostare l'obiettivo, spostare le telecamere dalle loro posizioni nel fuoco dei due rispettivi f = lenti di 5 cm. - Impostare i parametri necessari della telecamera. Utilizzare un tasso di telaio fisso e disabilitare strumenti di guadagno e la correzione di software.
Nota: Vengono utilizzati i seguenti parametri: la fotocamera iSCAT è impostata su 5000 fotogrammi al secondo (fps) con un tempo di esposizione di 80 µs. Come accennato in precedenza, la dimensione dell'immagine è di 128 × 128 pixel. Fluorescenza e campo chiaro telecamere funzionano con dimensione fotogramma completo (1280 × 1024 pixel). Bright-campo imaging avviene con un tempo di esposizione di 20 ms. La fotocamera di fluorescenza è impostata su 750 ms tempo di esposizione, e 5 fotogrammi consecutivi vengono accumulati per formare un'unica immagine finale. Bright-field e fluorescenza immagini vengono acquisite a intervalli di tempo s 20 fissi.
- Collegare tutte le telecamere a un computer. Installare pacchetti driver rispettivi e ottenere/scrittura di software per il loro controllo.
2. preparazione dell'esperimento
-
Preparare il mezzo di microscopia stock.
- Aggiungere 25 mL di soluzione tampone HEPES (1 mol/L) a 975 mL di medium RPMI 1640 per ottenere un finale 1 L di soluzione HEPES 25 mmol/L. In alternativa, usare un mezzo di tampone con HEPES già incluso.
Nota: HEPES viene utilizzato per mantenere il valore del pH del mezzo durante una misurazione in condizioni ambientali (ad es., all'esterno di un incubatore e senza costante alimentazione di CO2 ). - Prendere una parte aliquota della soluzione necessaria per un esperimento e lasciarlo caldo fino a temperatura ambiente. 2 mL di terreno è sufficiente. Tenere la soluzione stock rimanente a 4 ° C.
- Aggiungere 25 mL di soluzione tampone HEPES (1 mol/L) a 975 mL di medium RPMI 1640 per ottenere un finale 1 L di soluzione HEPES 25 mmol/L. In alternativa, usare un mezzo di tampone con HEPES già incluso.
-
Preparare la cuvetta di microscopio.
Nota: La procedura seguente descrive la procedura per un portacampioni su misura costituito da una piastra di base in alluminio e un piatto acrilico cuvetta che corregge il coprioggetto sia esso coppie al posizionatore 3D piezoelettrico. Piastre di coltura sterile disponibile in commercio con un fondo di vetro possono anche essere utilizzati.
Nota: La figura 5 Mostra fotografie del supporto del campione su misura.- Prendere un nuovo vetrino coprioggetto microscopia e sciacquare con acqua deionizzata (acqua deionizzata) e l'etanolo. Asciugare il vetrino con azoto o aria pressurizzata.
- Pulire il vetrino coprioggetto in un'atmosfera di ossigeno al plasma (0,3 mbar pressione del gas) per 10 min a 500 W RF potenza. Questo rimuove tutte le impurità organiche dalla superficie.
- Pulire il piatto acrilico cuvetta immergendolo in 0,2 mol/L di soluzione di NaOH per circa 10 minuti risciacquare con acqua deionizzata.
- Assemblare il portacampioni e coprirlo con una capsula di Petri fino a quando necessario nell'esperimento di plastica.

Figura 5: fuoriserie portacampioni. (a) campione di componenti di supporto: (1) piatto acrilico cuvetta; (2) piastra di base in alluminio; (3) viti di fissaggio; (4) in silicone o-ring; (5) vetrino coprioggetti. (b) completamente assemblato portacampioni. Clicca qui per visualizzare una versione più grande di questa figura.
-
Preparare il microscopio.
- Accendere il laser illuminazione iSCAT, il LED di illuminazione brillante-campo/fluorescenza, telecamere e computer/software di acquisizione. Bloccare il raggio laser verso una posizione prima l'obiettivo.
- Garantire che il 100x / 1,46 NA obiettivo è pulito. In caso contrario, utilizzare lente di pulizia etanolo e salviettine per pulire l'obiettivo secondo istruzioni del produttore.
- Applicare una goccia di olio per immersione sull'obiettivo del microscopio.
- Prendere il portacampioni (assemblato nella sezione 2.2) e attentamente montarlo sul palco piezo del microscopio iSCAT affinché il coprioggetto di campione è centrato l'obiettivo del microscopio. Essere attento e curato per non danneggiare la lente dell'obiettivo. Fissare l'unità al posizionatore piezoelettrico con viti ad alette, garantendo nel contempo che il produttore specificato non venga superata la coppia massima.
- Aggiungere 1 mL di mezzo di microscopia stock (preparato nella sezione 2.1.) nella cuvetta.
- Aggiungere 2 gocce di propidio ioduro macchia al medium come una cellula morte marcatore16,22.
- Sbloccare il laser e il sistema di mettere a fuoco. In primo luogo, verificare che l'obiettivo è posizionato alla giusta distanza da coprivetrino ripetendo i passaggi 1.2.3. – 1.2.5. (Figura 2). Quindi, mettere a punto la messa a fuoco con l'asse z della fase piezo.
- Confermare che tutte le impostazioni per le fonti di luce, telecamere e software siano impostate correttamente. Ciò include parametri quali la potenza del laser, intensità LED, fotocamera frame rate, tempi di esposizione della fotocamera o software di salvataggio di percorsi.
Nota: Salvataggio di video di frame rate elevati può produrre file di grandi dimensioni. Garantire sufficiente spazio libero su disco nel computer. - Bloccare nuovamente il raggio laser. Il microscopio è adesso pronto per un esperimento.
-
Preparare le cellule.
Nota: Laz388 cellule20 sono coltivate in RPMI 1640 supplementato con 10% siero fetale di vitello (FCS), aminoacidi, piruvato e antibiotici. Le cellule vengono incubate a 37 ° C e 5% CO2 e sono divisi e fornite con mezzo fresco ogni 2-3 giorni23.- Prendere il matraccio di cultura cellulare dall'incubatrice e aspirare mezzo contenente circa 1 x 106 cellule. Per determinare il volume corretto, è necessario quantificare la concentrazione della coltura delle cellule di uso di un emocitometro.
- Miscelare la soluzione di cella con 10 mL di terreno RPMI 1640 a temperatura ambiente e centrifugare il campione a 300 x g per 7 min.
- Con attenzione estrarre e scartare il surnatante, garantendo nel contempo che il pellet di cellule concentrate rimane indisturbato.
- Ripetere i passaggi 2.4.2. – 2.4.3. con il concentrato pellet di cellule.
- Risospendere le cellule in 0,5 mL di terreno di microscopia stock (preparato nella sezione 2.1.) e utilizzarli immediatamente in un esperimento.
3. iSCAT microscopia di cellule secernenti
- Assicurarsi che il raggio laser è bloccato per impedire alle cellule di essere esposti direttamente alla luce laser iSCAT.
- Iniettare le cellule in provetta del campione.
- Iniettare circa 3 µ l di campione cellulare (preparato in sezione 2.4.) leggermente fuori centro nella cuvetta del campione. Toccare delicatamente la punta della pipetta per il vetrino coprioggetto e iniettare lentamente la soluzione di cella. Permettono alle cellule di stabilirsi sul vetrino coprioggetti.
Nota: Utilizzare puntali di piccolo volume (10 µ l) o consigli di gel-caricamento lunghi, flessibile. - Assicurarsi che la densità delle cellule sia sotto circa 1 cella a 500 µm² modo che misure cella singola non sono influenzate da più celle nella zona circostante il laser iSCAT.
- Se il numero delle cellule è troppo basso, ripetere il passaggio 3.2.1. fino a quando un numero sufficiente è disponibile.
- Se la copertura delle cellule è troppo densa, è possibile utilizzare un'iniezione di circa 20 µ l di terreno di ulteriori microscopia per disperdere le cellule attraverso il vetrino coprioggetti.
- Iniettare circa 3 µ l di campione cellulare (preparato in sezione 2.4.) leggermente fuori centro nella cuvetta del campione. Toccare delicatamente la punta della pipetta per il vetrino coprioggetto e iniettare lentamente la soluzione di cella. Permettono alle cellule di stabilirsi sul vetrino coprioggetti.
- Utilizzando il posizionatore di piezo, spostare il campione lateralmente per posizionare una cella nelle vicinanze (circa 10 µm) per il campo di vista iSCAT. Assicurarsi che la cella non inserire il campo di vista iSCAT come esposizione diretta alla luce laser 445 nm potrebbe essere nocivo per la cella.
- Utilizzare immagini campo chiaro e fluorescenza per individuare e verificare attuabilità25 della cella.
Nota: Una cella valida ha una forma rotonda nell'immagine campo chiaro e non è fluorescente, mentre la morte delle cellule è indicata da segnali di forte fluorescenza derivanti dalla presenza di ioduro di propidio dentro la cella22. - Sbloccare il fascio laser iSCAT e assicurarsi che la superficie del vetrino coprioggetto sia ancora a fuoco. Racchiudere la tabella di isolamento per ridurre al minimo la deriva e accoppiamento acustico negli ambienti.
Nota: Quest'ultimo è realizzato con tende pesanti ottiche o pannelli acrilici che circondano il tavolo ottico. - Avviare la misurazione con l'acquisizione di immagini dalle telecamere iSCAT, campo chiaro e fluorescenza. Automatizzare e controllare il processo tramite software per massimizzare l'efficienza sperimentale. Controllare periodicamente la vitalità della cellula e la messa a fuoco del sistema.
Nota: A seconda della intensità del laser, componenti ottici e impostazioni di tempo di esposizione della fotocamera, il laser di iSCAT potrebbe interferire con la fotocamera di fluorescenza. Se questo comportamento è osservato, considera Casseforme il laser iSCAT temporaneamente durante acquisizioni di immagine di fluorescenza.
4. analisi dei dati
Nota: Dati sperimentali sono intrinsecamente rumorosi e iSCAT immagini non sono diversi. Ci sono diverse fonti di rumore in una misura tipica iSCAT, tra cui wavefront distorsioni in sorgente di luce incidente, rugosità di superficie del vetrino coprioggetto e rumorosità della fotocamera. La sezione qui sotto presenta alcuni modi in cui queste fonti di rumore sono sanate tramite post-elaborazione. Inoltre, instabilità laterale meccanica del setup portare a dati rumorosi e devono essere affrontate in conseguenza, come descritto nella sezione discussione qui sotto. Le analisi descritte vengono effettuate con script MATLAB personalizzati.
- Ridurre al minimo la rumorosità della fotocamera filtrando i dati grezzi con un filtro di Fourier bidimensionale che esclude alte frequenze spaziali. La dimensione del filtro deve essere regolato per adattarsi alla specifica configurazione sperimentale (determinata prevalentemente dalla apertura numerica del sistema).
Nota: Caratteristiche nell'immagine con frequenze spaziali superiori rispetto al sistema ottico provengono da fonti estranee (come il rumore di lettura di fotocamera) e possono essere trascurati. - Convertire le immagini in camera raw viene considerato in contrasto iSCAT.
Nota: Il segnale rilevato dalla telecamera è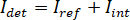 . iSCAT contrasto è definito come
. iSCAT contrasto è definito come 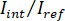 dove
dove 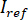 è l'intensità della luce di riferimento, in questo caso la parte riflessa dal vetrino coprioggetto, e
è l'intensità della luce di riferimento, in questo caso la parte riflessa dal vetrino coprioggetto, e 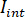 è l'interferenza tra
è l'interferenza tra 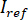 e l'intensità di dispersione (
e l'intensità di dispersione (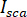 ).
).- Separare il segnale in
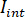 e
e 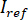 calcolando la media temporale dei fotogrammi particolare in cui le particelle di interesse non sono presenti. L'immagine risultante fornisce il segnale di riferimento
calcolando la media temporale dei fotogrammi particolare in cui le particelle di interesse non sono presenti. L'immagine risultante fornisce il segnale di riferimento 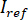 .
.
Nota: In alternativa, un passo di sottrazione sfondo attivo può essere eseguito come descritto nella discussione seguente. - Calcolare il contrasto secondo
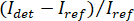 12,14,16.
12,14,16.
- Separare il segnale in
- Creare un'immagine differenziale rotolamento sottraendo ogni frame consecutivi dal suo successore.
Nota: Segnali di residuo dalla rugosità superficiale del coprivetrino e wavefront distorsioni vengono efficacemente rimossi in questo passaggio come sono costanti all'interno di fotogrammi consecutivi. Il differenziale di rotolamento rimuove questi segnali residui, lasciando solo le associazioni di proteina che si verificano da un fotogramma a quello successivo. Questa sottrazione di sfondo dinamico è vantaggiosa, in quanto esso non è sensibile a lungo termine campione derive. - Applicare un algoritmo di ricerca di picco per rilevare e indice singole particelle per ogni fotogramma e determinare il loro contrasto specifico e la posizione.
- Utilizzare le informazioni raccolte nel passaggio 4.4 creare istogrammi di associazione di eventi di proteine e loro estratti contrasti in relazione alla massa della proteina attraverso una curva di calibrazione compilata da proteina nota campioni14,24.
Risultati
Lo schema di un microscopio di iSCAT è mostrato in Figura 4a. Rappresentativo del luminoso-campo, fluorescenza e immagini raw iSCAT sono mostrati in Figura 4b, 4Ce 4D, rispettivamente16. Figura 4e e 4f Visualizza i risultati della rimozione dello sfondo e differenziale post-elaborazione; due proteine adsorbite sono visibili come macchie di diffrazione limitata in Figura 4f. La figura 6 Mostra un istogramma delle proteine rilevate nel corso della 125 s. Questi dati sono stati ottenuti mediante l'applicazione di un algoritmo di ricerca di picco per le immagini catturate per contare gli eventi di associazione e catalogo loro contrasto16. Un numero totale di 503 proteine sono stato rilevato.
Prossimi, secrete specie sono identificati dal confronto con riferimento misure effettuate sulle soluzioni di proteina purificata, o attraverso ulteriori misure con superfici funzionalizzate vetro14,16. I dati di iSCAT, così, direttamente visualizzare dinamiche di secrezione cellulare su una scala di subsecond16. Ad esempio, precedentemente abbiamo trovato che gli anticorpi di IgG sono una frazione importante del secretoma Laz388 e vengono rilasciati dalla cellula a una velocità di ca. 100 molecole al secondo16. Inoltre, altre particelle che si estende in un intervallo di 100 kDa - 1000 kDa sono secernuti dalle cellule16. Il metodo descritto può essere ulteriormente impiegati ad es., per indagare il gradiente di concentrazione spaziale delle secrezioni che circonda una cella16, o per determinare la dinamica temporale di lisi cellulare16.
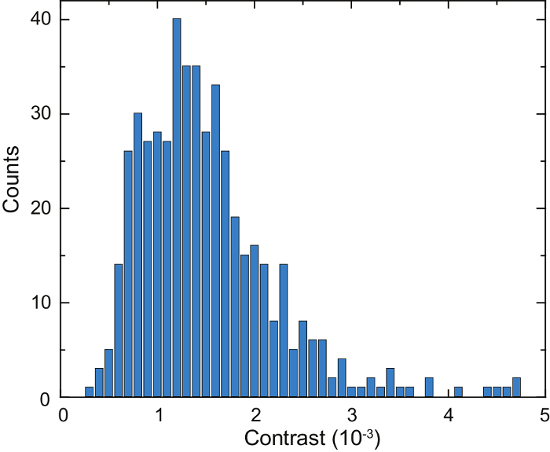
Figura 6: quantificazione delle proteine secrete da una singola cellula di Laz388. L'istogramma mostra proteine rilevate durante un periodo di tempo di 125 s. contrasto valori vengono accumulati in bidoni di 1 x 10-4 contrasto (barre blu). Un totale di 503 singole proteine sono stati contati durante la misurazione. L'esperimento fu ripetuto 10 volte con risultati simili. Questa figura è stata adattata da McDonald, M.P. et al. 16. copyright 2018 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Uno degli aspetti più cruciali per ottenere dati iSCAT utile è la capacità di trovare la giusta posizione focale sulla superficie del vetrino coprioggetto e, inoltre, a mantenere questa posizione per lunghi periodi di tempo. Non riuscendo a farlo si tradurrà in PSF ampliato, iSCAT deboli segnali e drift-collegata di artefatti nelle analisi dinamiche. Si scopre che trovare il piano focale su un vetrino coprioggetti pulito, bare superficie non è un compito facile come feature di superficie non sono visibili sullo sfondo fascio ampio riferimento (Vedi Figura 4 d).
Immagini RAW iSCAT sono spesso oscurate da segnali di fondo che derivano dalle impurità di fronte d'onda nella sorgente di eccitazione e possono ostacolare la capacità di trovare il corretto piano di formazione immagine. Wavefront attivo sottrazione è un modo utile per aggirare questo problema e successivamente monitorare lo stato di attivo iSCAT durante una misura16. Un modo per eseguire questa operazione è tramite modulazione spaziale del campione. In breve, un generatore di funzione si applica un'onda quadra 50 Hz per la porta di controllo esterna della fase piezo, risultante in una modulazione spaziale campione alla frequenza applicata (ampiezza 290 nm). Acquisizioni di fotocamera sincroni vengono attivati dalla stessa fonte e, quando combinato con serratura-in principi, risultato in un'immagine wavefront-compensato14,16. L'immagine risultante mostra tipicamente la rugosità superficiale del coprivetrino (Figura 4e). Piccole caratteristiche restanti sul vetro dopo la pulizia possono essere utilizzati per mettere a fuoco il microscopio. Parametri utilizzati per questo passaggio di sottrazione sfondo attivo possono essere cambiati secondo la frequenza dei fotogrammi, tempo di esposizione o hardware.
Come accennato in precedenza, è raccomandato l'uso di un divisore di fascio di alta qualità nel setup iSCAT (passo 1.2.1.), come manufatti come formazione immagine residua di imaging o interferenze derivanti da sottili planare beam splitter saranno influenzare l'immagine e disturbare la misurazione. La figura 7 Mostra un confronto tra un divisore di fascio di alta qualità e di bassa qualità. Entrambe le immagini raw iSCAT Visualizza la stessa area il coprioggetto contenente alcune particelle residue. La stessa impostazione di iSCAT è stata usata per catturare entrambe le immagini, solo il divisore di fascio è stato scambiato. Figura 7a Mostra l'immagine formata sulla fotocamera dall'uso di una più spessa (5 mm), divisore di fascio rivestite con AR e incastrato. Grazie al design incastrato, il fascio riflesso dalla superficie posteriore del divisore di fascio è anti-parallelo alla riflessione derivanti dalla superficie anteriore e non sta entrando l'obiettivo. Si verificano senza artefatti di interferenza. Figura 7b Mostra lo stesso campo di vista sul campione, ma questa volta è stato utilizzato un planare beam splitter più sottile (1 mm). I due riflessi da superfici anteriore e posteriore del divisore di fascio sono paralleli e propagano alla fotocamera. Manufatti di interferenza sono chiaramente visibili.
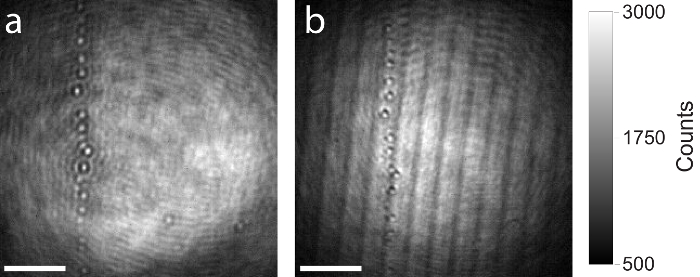
Figura 7: confronto di iSCAT immagini prodotte con alta e bassa qualità beam splitter. (a) immagine di iSCAT crudo derivanti dall'uso di un divisore di fascio di spessore, rivestite con AR e infilato di 5 mm. (b) risultante immagine raw iSCAT della stessa area di uso di un divisore di fascio planare spessore di 1 mm. Entrambi beam splitter hanno lo stesso rapporto scissione (riflessione 50%, 50% di trasmissione). Manufatti di interferenze derivanti dalle riflessioni di Fresnel sono chiaramente osservati nell'immagine producerat con il divisore di fascio planare spessore di 1 mm. Scala bar: 2 µm. Clicca qui per visualizzare una versione più grande di questa figura.
In questo protocollo Descriviamo un schema di illuminazione grandangolari per iSCAT come è veloce, facile da realizzare e permette un rilevamento parallelo sopra una grande zona14. Un altro approccio comune è quello di utilizzare acusto-ottico deflettori (od) e la scansione di un fascio confocale attraverso il campione12,17. Questo approccio evita la necessità di fronti d'onda di alta qualità ma è sperimentalmente più complesso rispetto all'imaging convenzionale di grandangolari. Inoltre, la velocità di illuminazione confocale è limitata da quella di ordinatori. A seconda dei parametri sperimentali desiderati, o schemi di illuminazione confocale o grandangolari possono, in linea di principio, essere utilizzati per rilevare singole proteine secernute dalle cellule viventi.
Come discusso in tutto il protocollo, è imperativo per minimizzare le oscillazioni meccaniche laterale nella fase del campione del microscopio. Anche il nanometro deviazioni nella posizione del campione possono portare a variazioni di fotogrammi consecutivi fotocamera e indurre significativi rumori estranei nell'immagine differenziale. Si raccomanda pertanto di utilizzare una fase di microscopio meccanicamente stabile e una tabella ottica smorzata (punto 1.1.1.) e per coprire l'installazione con ottiche tende o pannelli durante un esperimento (passo 3.5.).
Un regime di stabilizzazione attiva potrebbe anche essere considerato per misurazioni a lungo termine. In questo approccio, un laser secondo è incorporato al microscopio in una disposizione di riflessione interna totale (TIR) e successivamente ripreso su un fotodiodo di quadrante. Cambiamenti nella messa a fuoco del sistema si traducono in spostamenti laterali del laser TIR azzeccati il diodo di quadrante, che può quindi essere utilizzato in un ciclo di feedback attivo per controllare l'asse z del piezo tappa26. Effetti a lungo termine deriva verticale vengono così eliminati.
Diverse modifiche ed estensioni possono essere applicate alla tecnica presentata per soddisfare specifiche esigenze sperimentali. Ad esempio, microscopio commerciale fase incubatori sono disponibili che potrebbero essere facilmente inseriti in microscopio iSCAT per l'acquisizione a lungo termine delle cellule. Altre tecniche possono anche essere implementati per completare iSCAT di imaging, come confocale o TIR fluorescenza microscopie17. Per adattare il sistema in fase di studio, iSCAT secrezione possono essere misurati in altri mezzi di cella come DMEM o DPBS, tuttavia, l'indicatore di pH rosso fenolo dovrebbe essere evitato come può disturbare l'esperimento a causa dell'assorbimento della luce laser. Inoltre, i supplementi come siero fetale di vitello (FCS) o delle piastrine umane lisata (hPL) contengono proteine che potrebbero interferire con il rilevamento di iSCAT. A seconda della sensibilità desiderata dell'esperimento, questi supplementi dovrebbero escludersi dal mezzo di microscopia.
iSCAT si basa sulla capacità di un analita per diffondere la luce — una proprietà che è intrinseca a tutte le proteine — e quindi è intrinsecamente non specifici. Tuttavia, un certo grado di specificità è possibile come iSCAT segnali scala linearmente con proteina massa14,27,28. Ciò consente la calibrazione di un sistema di iSCAT utilizzando campioni di proteina standard, come ad esempio l'albumina di siero bovino (BSA) e fibrinogeno14,27,28. Infatti, molto recentemente, giovane et al. 28 hanno esteso sul lavoro di Piliarik & Sandoghdar14 e hanno dimostrato che iSCAT può essere utilizzato per determinare il peso molecolare delle proteine piccoli come streptavidina (53 kDa) con una risoluzione di massa di 19 kDa e una precisione di circa 5 kDa. Diversi approcci convenzionali possono integrare ulteriormente iSCAT fornendo un ulteriore livello di specificità. Come un esempio, analisi enzima-collegate dell'immunosorbente (ELISA), e/o altre modifiche di superficie, è necessario limitare gli eventi di associazione della proteina in modo che solo la proteina dell'obiettivo è rilevato16.
In questo protocollo, abbiamo descritto come microscopia di iSCAT può essere utilizzata per indagare le secrezioni cellulari a livello di singola proteina con subsecond risoluzione temporale16. La tecnica è generale e può essere implementata su qualsiasi microscopio commerciale o casa costruita. In contrasto con gli approcci di fluorescenza di singola molecola, il metodo non soffre di photobleaching o lampeggiante, ma effetti ancora raggiunge la sensibilità di singolo-proteina. Queste caratteristiche rendono iSCAT un potente strumento nel campo della microscopia e biosensori. Applicazioni future si concentreranno sul delucidamento complesse interazioni cellulari come risposta immunologica ad uno stimolo o comunicazione cellulare.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato dalla società Max Planck, una cattedra di Alexander-von-Humboldt e la Deutsche Forschungsgemeinschaft (CRC 1181). Ringraziamo Stefanie Schaffer presso Universitätsklinikum Erlangen per fornire alle cellule Laz388 e le discussioni utili. Ringraziamo Simone Ihloff e Maksim Schwab alla MPL per il supporto tecnico.
Materiali
| Name | Company | Catalog Number | Comments |
| Item/Device | |||
| 100x / 1.46 NA objective | Zeiss | 420792-9800-000 | alpha Plan Apochromat oil immersion |
| 20x / 0.4 NA objective | Leica | 566049 | N Plan |
| Piezo Stage | PI | P-517k020 | 3-axis stage with 100x100x10µm range |
| Diode laser (445 nm) | Lasertack | PD-01236 | |
| Optics/Optomechanics | Thorlabs/Newport | - | lenses, mirrors, posts, mounts |
| Pinhole | Thorlabs | P30H | |
| LED light source | Thorlabs | MCWHL5 | |
| Shortpass filter (580 nm) | Omega Optical | 580SP | to modify the spectrum of the LED for fluorescence excitation |
| Longpass filter (500 nm) | Thorlabs | FEL0500 | to modify the spectrum of the LED for fluorescence excitation |
| 70R/30T beam splitter | Newport | 20Q20BS.1 | |
| Economy beam splitter | Thorlabs | EBS1 | used for the comparison of fringe effects |
| Wedged plate beam splitter | Thorlabs | BSW26 | used for the comparison of fringe effects |
| Shortpass dichroic mirror (550 nm) | Edmund Optics | 66249 | |
| 8R/92T beam splitter | Thorlabs | BP108 | |
| CMOS camera | Photonfocus | MV1-D1024E-160-CL | for iSCAT aquisition |
| CMOS cameras | Mightex | SCE-B013-U | for bright field / fluorescence aquisition |
| Longpass filter (600 nm) | Thorlabs | FELH0600 | |
| Computer | Fujitsu Siemens | - | Core i7 Processor, 16 GB RAM, SSD |
| Acquisition Software | LabVIEW | - | LabVIEW 2016 Suite |
| Analysis Software | Matlab | - | Matlab 2014 Suite |
| Plasma Cleaner | Diener | Diener pico | |
| Incubator | Binder | Model CB | |
| Centrifuge | Eppendorf | 5810R | |
| Reagent/Material | |||
| RPMI 1640 medium | Gibco | 11835063 | without phenol red |
| HEPES Buffer Solution (1M) | Sigma Aldrich | 59205C | |
| Cover slides | Marienfeld | 107052 | |
| Glass bottom culture dishes | ibidi | 81158 | |
| Fluorescent Microspheres | Invitrogen | F8821 | used for calibration |
| Immersol immersion oil | Zeiss | 444960 | |
| Propidium iodide stain | Invitrogen | R37108 | |
| Small pipette tips | Eppendorf | 30075005 | |
| Flexible pipette tips | Eppendorf | 5242956003 | |
| Ethanol, 99.8% | Fisher Scientific | E/0650DF/15 | |
| Sodium hydroxide, pellets | Sigma Aldrich | 221465 | for preparing 0.2M NaOH solution |
Riferimenti
- Hathout, Y. Approaches to the study of the cell secretome. Expert Review of Proteomics. 4 (2), 239-248 (2007).
- Pandey, A., Mann, M. Proteomics to study genes and genomes. Nature. 405 (6788), 837-846 (2000).
- Makridakis, M., Vlahou, A. Secretome proteomics for discovery of cancer biomarkers. Journal of Proteomics. 73 (12), 2291-2305 (2010).
- Bantscheff, M., Schirle, M., Sweetman, G., Rick, J., Kuster, B. Quantitative mass spectrometry in proteomics: a critical review. Analytical and Bioanalytical Chemistry. 389 (4), 1017-1031 (2007).
- MacBeath, G. Protein microarrays and proteomics. Nature Genetics. 32, 526-532 (2002).
- Seder, R. A., Darrah, P. A., Roederer, M. T-cell quality in memory and protection: implications for vaccine design. Nature Reviews Immunology. 8 (4), 247-258 (2008).
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Borisov, S. M., Wolfbeis, O. S. Optical biosensors. Chemical Reviews. 108 (2), 423-461 (2008).
- Dantham, V. R., Holler, S., Barbre, C., Keng, D., Kolchenko, V., Arnold, S. Label-Free Detection of Single Protein Using a Nanoplasmonic-Photonic Hybrid Microcavity. Nano Letters. 13 (7), 3347-3351 (2013).
- Zijlstra, P., Paulo, P. M. R., Orrit, M. Optical detection of single non-absorbing molecules using the surface plasmon resonance of a gold nanorod. Nature Nanotechnology. 7 (6), 379-382 (2012).
- Rickgauer, J. P., Grigorieff, N., Denk, W. Single-protein detection in crowded molecular environments in cryo-EM images. eLife. 6, e25648 (2017).
- Lindfors, K., Kalkbrenner, T., Stoller, P., Sandoghdar, V. Detection and Spectroscopy of Gold Nanoparticles Using Supercontinuum White Light Confocal Microscopy. Physical Review Letters. 93 (3), 037401 (2004).
- Jacobsen, V., Stoller, P., Brunner, C., Vogel, V., Sandoghdar, V. Interferometric optical detection and tracking of very small gold nanoparticles at a water-glass interface. Optics Express. 14 (1), 405 (2006).
- Piliarik, M., Sandoghdar, V. Direct optical sensing of single unlabelled proteins and super-resolution imaging of their binding sites. Nature Communications. 5, 4495 (2014).
- Roux, K. H. Immunoglobulin Structure and Function as Revealed by Electron Microscopy. International Archives of Allergy and Immunology. 120 (2), 85-99 (1999).
- McDonald, M. P., et al. Visualizing Single-Cell Secretion Dynamics with Single-Protein Sensitivity. Nano Letters. 18 (1), 513-519 (2018).
- Kukura, P., Ewers, H., Müller, C., Renn, A., Helenius, A., Sandoghdar, V. High-speed nanoscopic tracking of the position and orientation of a single virus. Nature Methods. 6 (12), 923-927 (2009).
- Ortega Arroyo, J., Cole, D., Kukura, P. Interferometric scattering microscopy and its combination with single-molecule fluorescence imaging. Nature Protocols. 11 (4), 617-633 (2016).
- Spindler, S., et al. Visualization of lipids and proteins at high spatial and temporal resolution via interferometric scattering (iSCAT) microscopy. Journal of Physics D: Applied Physics. 49 (27), 274002 (2016).
- Lazarus, H., et al. Characterization of a unique cell line (LAZ 221) from human acute lymphocytic ("null" cell) leukemia. Cancer Research. 38 (5), 1362-1367 (1978).
- Mackensen, A., et al. Evidence for in situ amplification of cytotoxic T-lymphocytes with antitumor activity in a human regressive melanoma. Cancer Research. 53 (15), 3569-3573 (1993).
- Crowley, L. C., Scott, A. P., Marfell, B. J., Boughaba, J. A., Chojnowski, G., Waterhouse, N. J. Measuring cell death by propidium iodide uptake and flow cytometry. Cold Spring Harbor Protocols. 2016 (7), 647-651 (2016).
- Freshney, R. I. Primary Culture. Culture of Animal Cells. , (2005).
- Dahmardeh, M., et al. . Unpublished data. , (2018).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. American Journal of Pathology. 146 (1), 3-15 (1995).
- Bellve, K., Standley, C., Lifshitz, L., Fogarty, K. Design and Implementation of 3D Focus Stabilization for Fluorescence Microscopy. Biophysical Journal. 106 (2), 606a (2014).
- Liebel, M., Hugall, J. T., Van Hulst, N. F. Ultrasensitive Label-Free Nanosensing and High-Speed Tracking of Single Proteins. Nano Letters. 17 (2), 1277-1281 (2017).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon