Method Article
Sondeo de la función de Receptor nicotínico de la acetilcolina en rebanadas de cerebro de ratón mediante fotólisis de destello láser de la nicotina Photoactivatable
En este artículo
Resumen
Este artículo presenta un método para el estudio de los receptores acetilcolina nicotínicos (nAChRs) en rebanadas de cerebro de ratón por uncaging de nicotina. Cuando se combina con revisión simultánea abrazadera grabación y láser de 2 fotones microscopía, nicotina uncaging conecta función del receptor nicotínico con morfología celular, proporcionando una comprensión más profunda de la neurobiología colinérgico.
Resumen
Acetilcolina (ACh) actúa a través de receptores para modular una variedad de procesos neuronales, pero ha sido difícil vincular la función del receptor de ACh con localización subcelular dentro de las células donde se realiza esta función. Para estudiar la localización subcelular de los receptores ACh nicotínicos (nAChRs) en el tejido cerebral nativo, fue desarrollado un método óptico precisa liberación de nicotina en lugares discretos cerca de las membranas neuronales durante las grabaciones electrofisiológicas. Fijada por el parche de neuronas en cerebro rebanadas están llenos de tinte para visualizar su morfología durante microscopía láser 2 fotones, y nicotina uncaging se ejecuta con un flash de luz concentrándose un rayo de láser de 405 nm cerca de uno o más de las membranas celulares. Celulares actuales desviaciones se miden, y alta resolución imagen tridimensional (3D) de la neurona registrada está hecha para permitir la reconciliación de las respuestas del nAChR con morfología celular. Este método permite un análisis detallado de la distribución funcional nAChR en preparaciones de tejido complejo, prometiendo mejorar la comprensión de la neurotransmisión colinérgica.
Introducción
Señalización colinérgica modula numerosos procesos del cerebro, incluyendo el control atencional, el movimiento volitivo y recompensa1,2. Fármacos que mejoran la transmisión de acetilcolina (ACh) se utilizan para tratar el deterioro cognitivo asociado con la enfermedad de Alzheimer, lo que implica un papel importante para los sistemas colinérgicos en cognición3. Una mejor comprensión de los receptores colinérgicos y circuitos en Estados sanos y enfermos podría conducir a mejores enfoques terapéuticos para varias enfermedades neurológicos, trastornos.
Receptores de ACh nicotínicos (nAChRs) son una familia de canales ligand-bloqueados del ion que flujo de cationes en respuesta a ACh endógena o exógena nicotina de tabaco. Habida cuenta de que estaban entre los primeros receptores de neurotransmisores que describe4, farmacología nAChR y ubicación en las fibras musculares es bien entendido por los receptores de tipo muscular. Por el contrario, comparativamente poco se sabe sobre la farmacología y de la distribución subcelular de nAChRs nativo en el cerebro. Esta brecha en conocimiento recientemente se abordó mediante el desarrollo de una nueva sonda química que permite la activación espacial limitada y rápida de nAChRs en el tejido cerebral durante la proyección de imagen celular y grabación electrofisiológica5. Aquí, se describen los pasos metodológicos fundamentales en este enfoque, con el objetivo de aumentar la capacidad de conectar la función del nAChR con estructura neuronal.
Nicotina Photoactivatable (PA-Nic; nombre químico: 1-[7-[bis(carboxymethyl)-amino] cumarina-4-yl] metilo-nicotina) puede ser fotolizada con ~ 405 nm láser parpadea para eficientemente liberar nicotina5,6. Antes de uncaging, PA-Nic es estable en solución y exhibe ningún inconveniente características farmacológicas o fotoquímica5. Después de fotólisis, liberado de la nicotina activa como era de esperarse nAChRs y los derivados uncaging son farmacológicamente inerte5. Un láser de onda continua es utilizado como fuente de luz con una potencia de salida fotólisis > 1 mW medido en la muestra. Cuando localizada, Foto estimulación específica se combina con la capacidad para ubicar las membranas celulares con láser de 2 fotones microscopía (2PLSM), y se dieron cuenta de las dos principales ventajas de este enfoque: velocidad de fotólisis y precisión espacial.
En la mayoría de los respectos, fotólisis de PA-Nic es superior a otros métodos de entrega nAChR ligandos a receptores dentro de rebanadas de cerebro. Estos enfoques incluyen baño uso7 y local de la droga entrega a través de un soplador pipeta8. Mientras que el enfoque anterior tiende a insistir en los efectos a largo plazo de la droga aplicada, este último enfoque puede sufrir de la variabilidad en la cinética de la respuesta entre los ensayos y a través de las células. Ninguno de estos enfoques alternativos pueden distinguir adecuadamente las actividades del receptor en diferentes localizaciones celulares de la neurona misma. Optogenetically-activa la liberación de ACh se ha utilizado para la investigación del nAChRs nativa9,10,11, pero no ha probado útil para las localizaciones subcelulares nAChR asignación. Además, la mayoría de los estudios utilizando este enfoque ha confiado en expresar ChR2 cromosoma artificial bacteriano transgénico ratón con transmisión colinérgica anormal12,13,14, 15 , 16 , 17.
PA-Nic fotólisis no es el enfoque sólo óptico para el estudio de los receptores colinérgicos. Una jaula carbachol fue utilizado funcionalmente asignar actividades del receptor de ACh en células cultivadas rebanadas de cerebro y18 19, pero no estaba comercialmente disponible para estudios comparativos durante el desarrollo del PA-NIC. Un bis de rutenio (bipyridine)-complejo de nicotina (nicotina RuBi) fue divulgado para permitir la nicotina uncaging20, pero preparaciones comerciales de RuBi-nicotina resultado inferior a la PA-Nic en una comparación cabeza a cabeza el estudio5. Puede ser útil repetir tales experimentos comparativos con no-comercial, altamente purificada RuBi-nicotina, como su absorción visible podría complementar características PA-Nic estudios colinérgicos. Por último, nAChRs han también sido ópticamente manipulados usando una combinación de foto-conmutable ligandos y receptores modificados genéticamente21. Este enfoque es complementario a fotólisis PA-Nic en el tejido cerebral, con la capacidad/necesidad de selección genética de lo nAChR modificado visto como una ventaja y un inconveniente.
Cabe señalar algunos requisitos claves de este enfoque. En primer lugar, es necesario un método de visualización apropiado para localizar exactamente la membrana neuronal. Proyección de imagen con microscopía de epifluorescencia convencional puede ser suficiente al estudiar las células cultivadas, pero para la grabación de las neuronas en rebanadas de cerebro u otras preparaciones de tejido grueso, 2PLSM o microscopía confocal es un requisito. En segundo lugar, un método adecuado es necesario posicionar el rayo láser de fotólisis. Este enfoque utiliza una galvanómetro de doble exploración cabeza con dos espejos independientes x-y para el escaneo de trama de la imagen haz punto de fotoactivación con la uncaging laser viga22,23,24. Otros, más limitadas soluciones son posibles, tales como (1) una cabeza de escaneo galvanómetro solo que alternativamente trama explora el rayo de proyección de imagen y el haz uncaging o (2) simplemente dirigiendo el haz uncaging en el centro del campo de visión tal que la célula se lleva a esta posición para flash photolysis. En tercer lugar, un sistema es necesario para grabación electrofisiológica simultánea si se desea recoger señales fisiológicas durante los experimentos. Los requisitos anteriores se pueden resolver con una técnica de imagen todo óptico adecuada, como el recientemente descrito5. A continuación, se incluye un protocolo detallado que describe los pasos clave de este enfoque.
Protocolo
Trabajo relativas a la preparación de corte de cerebro fue revisado y aprobado por el cuidado de Animal de la Universidad Noroeste y uso (protocolo #IS00003604).
PRECAUCIÓN: Lasers usados para la foto-estimulación del punto son los láseres de clase IIIb visibles que tienen el potencial para causar daño a los ojos. 2PLSM requiere un laser del infrarrojo cercano (NIR) clase IV (> 500 mW), que tiene el potencial para causar daños graves a los ojos y quemaduras incluso en otros tejidos. Contención de haz de láser adecuada, bloqueos de sistema, además de controles de ingeniería y administrativos están obligados a asegurar la operación segura de equipos láser. Siempre buscan personal de seguridad de láser local cuando se trabaja con láser.
1. calibración y verificación de la oambos Uncaging
-
Cuantificar la potencia del láser a la muestra.
- Encienda el 405 nm láser (100 mW máxima potencia con señal de control de 5 V) y deje que el sistema de láser caliente durante unos 10 minutos.
Nota: El láser es todavía cerrado (con 0 unidad de V) y hay no hay potencia de salida hasta que el láser envía un voltaje de control para modular la potencia de salida. - Coloque un medidor de potencia en el plano de la muestra de tejido o en lugar de la lente del condensador. Manualmente el centro del medidor en relación con el camino/objetivo óptico.
- Ponga el medidor en el rango de longitud de onda correcta (400-1100 nm). A cero el medidor presionando el botón correspondiente.
- Con controles de software, seleccione 100 (fuera de máximo 1000; 1000 = 5 V) para la energía del laser 405 nm, que establece el láser en el 10% de potencia. Si lo desea, la tensión de control de láser también puede ser alimentada en la PrairieView sistema vía VoltageRecord para proporcionar un registro digital del comando de sincronización y nivel de potencia de la señal.
- Registrar la lectura del medidor de energía.
- Seleccionar 150 (15% de 1000 max) para la salida de potencia 405 nm láser y grabar la lectura del medidor de energía. Repita esto para las siguientes competencias de salida recoger una curva de potencia del láser: 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 y 1000.
- Encienda el 405 nm láser (100 mW máxima potencia con señal de control de 5 V) y deje que el sistema de láser caliente durante unos 10 minutos.
-
Calibrar los galvanómetros de láser uncaging. Ejecutar los siguientes pasos cada vez que hay un cambio en los componentes ópticos del sistema, cada vez que hay una preocupación por la colocación exacta del punto o regularmente cada mes.
- Instalar 60 x inmersión agua microscopio objetivo que se utilizará en la fotoestimulación y experimentos de proyección de imagen. En el software de adquisición/proyección de imagen, seleccione el 60 x lente objetiva y un zoom óptico de 1 (ver paso 3.1.4.2.).
- Marque un círculo lleno un portaobjetos de microscopio limpio de vidrio con un rotulador permanente rojo. Colocar el portaobjetos sobre la platina del microscopio, con el marcador hacia el objetivo.
- Pre-enfocar el microscopio sobre la región de marcador rojo con un 4 x o 10 x objetivo. Añadir 1-2 mL de agua a la parte superior del marcador rojo punto/punto y luego cambiar al objetivo 60 x y sumerja el objetivo en el agua. Enfocar el objetivo en la región de fina marcador rojo.
- Interruptor de 2 fotones láser escáner. Para la mayoría de los sistemas, mover la torreta a la posición #1, mover el prisma trinocular fuera de la trayectoria de la luz, mover el espejo principal de exploración al frente y establezca la longitud de onda de láser ~ 900 nm. Seleccione la opción de caja de 512 x 512 píxeles para los parámetros de adquisición de imagen, que es el elemento predeterminado de píxeles para la rutina de calibración del espejo de estimulación.
- Sistema del comienzo con la proyección de una imagen mayor que el mínimo de la energía del laser y afinar el enfoque objetivo hacia la capa de fluorescencia del marcador rojo delgado. Elegir un campo en el campo de fluorescencia libre de escombros y uniformemente cubierto con marcador.
Nota: La configuración de este protocolo utiliza el software de adquisición/proyección de imagen de PrairieView 5.4. - Abrir la función de Calibración Galvo Uncaging dentro del menú de herramientas de alineación de calibración del software. Paseo por el tutorial grabar spots para la calibración espacial del segundo par del galvanómetro de espejo.
- En el tutorial de grabar puntos , elegir el láser de 405 nm, seleccione una potencia de la estimulación láser de 400 y una duración de estímulo de 20 ms. esto debe generar pequeñas (~ 1-5 μm de diámetro) los agujeros en el marcador rojo.
Nota: Configuración como ~ 2-4 mW y 1-10 ms se suelen utilizar, pero los valores son determinados por la muestra. Configuración de energía PA-Nic foto estimulación suelen ser mucho menores que la energía necesaria durante la calibración para ablar un agujero visible en la diapositiva marcador rojo. Esta rutina de calibración es útil para localizar puntos de fotoestimulación pero no debe utilizarse para inferir la fotoestimulación absoluta volúmenes durante las respuestas fisiológicas. - Seleccione actualización para estimular y refrescar la imagen después de que el punto central quema y mover el indicador rojo redondo a la ubicación actual del lugar. Hacer esto para el punto central, el lugar de centro derecha, el punto central más bajo y finalmente para una cuadrícula de nueve puntos (todas las esquinas y bordes y el centro de la imagen).
Nota: El centro, a la derecha y posiciones spot corregidas inferiores determinan los voltajes de estimulación del galvanómetro para definir el verdadero centro y X e Y factores de escala para que coincida con el par de espejo de estimulación a la pareja proyección de imagen de espejo. El software de la escala y actualizar, todos los experimentos posteriores MarkPoints en ajustes de zoom el zoom de la calibración espacial diferentes.
- En el tutorial de grabar puntos , elegir el láser de 405 nm, seleccione una potencia de la estimulación láser de 400 y una duración de estímulo de 20 ms. esto debe generar pequeñas (~ 1-5 μm de diámetro) los agujeros en el marcador rojo.
- Abrir la ventana de MarkPoints y activar manualmente los parámetros de estimulación en spot(s) definido en una nueva área de la muestra para probar la calibración. Asegúrese de que el archivo correcto, última calibración se carga en la ventana de MarkPoints . Activar la función de MarkPoints o grupo o Serie de MarkPoints en un spot(s) definido o utilizar la característica de Vivo/ablación para derecha/izquierda, haga clic en el ratón en cualquier parte de la imagen durante la exploración vivo para aplicar un pulso de prueba y verificar la correcta calibración.
Nota: La quemadura de láser punto ahora debe estar perfectamente centrada en el indicador de MarkPoints . - Supervisar y registrar la activación de la energía del pulso láser y la duración temporal aprovechando el voltaje de la unidad el programa de VoltageRecord (vea el paso 1.1.4). Asimismo, registra la posición de cada punto de estimulación utilizando una señal de escala de voltaje de las señales de retroalimentación derivados del par de espejos de foto estimulación del galvanómetro.
2. preparación de la nicotina Photoactivatable (PA-Nic)
- Recuperar una parte alícuota de drogas photoactivatable liofilizado de almacenamiento.
Nota: El siguiente protocolo es específico para PA-Nic; ajuste como sea necesario para otras drogas photoactivatable. Aunque PA-Nic demuestra estabilidad excepcional5, tomar las precauciones razonables para proteger de la exposición a luz brillante durante la preparación o experimentos. Esto puede lograrse simplemente trabajando en condiciones de poca luz; no es necesario restringir a la roja luz filtrada. -
Realizar la aplicación local de PA-NIC.
- Tire de una micropipeta de vidrio con un diámetro de apertura de 20-40 μm con un extractor de pipeta programable.
- Filtro ~ 1 mL de solución de grabación con un filtro de 0,22 μm. Suspender una cantidad de PA-Nic en la solución de grabación filtrada para obtener una concentración final de 2 mM. Por ejemplo, disolver una alícuota de 100 nmol liofilizado en 50 μl de solución de grabación filtrada.
Nota: Una composición de la solución de grabación sugerida puede encontrarse en recientes publicaciones5,6 empleando PA-Nic fotólisis. - Espalda-llenar la pipeta de aplicación local con 50 μl de 2 mM PA-NIC.
- Asegure la pipeta de aplicación local en un soporte de pipeta, montado en un micromanipulador. Conectar la titular pipeta mediante tubería apropiada a un sistema de eyección de presión capaz de aplicaciones de baja presión sostenida (1 a 2 psi).
- Mediante el micromanipulador, maniobra de la pipeta de aplicación local en la solución de grabación extracelular y la posición de la punta un poco por encima del tejido de cerebro de ratón situado ~ 50 μm de la célula de interés. Consulte un informe anterior de un detallado protocolo de preparación de rebanada de cerebro de ratón y patch clamp grabaciones8.
- Comprobar los parámetros de aplicación aplicando brevemente (1-2 psi) de presión. Debe haber mínimo sin desplazamiento de la célula de interés. Si se producen movimiento significativo, vuelva a colocar la pipeta de aplicación local más lejos (en la dirección axial o lateral) de la célula de interés.
- Después de alcanzar la abrazadera del remiendo estable de células enteras (los datos de los que se incluyen en una publicación previa8), gire en aplicación de baja presión (1-2 psi) utilizando el interruptor manual correspondiente en el dispositivo de eyección de presión. Saturar el tejido que rodea la célula con el PA-Nic para 1-2 min antes de proceder al siguiente paso.
-
Realizar aplicación de baño (superfusion) de PA-Nic a la rebanada del cerebro.
- Disolver una cantidad de PA-Nic en un volumen de solución apropiado para recirculación continua obtener una concentración final de 100 μM de grabación. Por ejemplo, disolver una 1 μmol alícuota en 10 mL de solución de grabación mediante un tubo de 15 mL estándar.
- Comenzar la recirculación de la solución PA-Nic a un ritmo de 1.5-2 mL/min abriendo el control de flujo adecuada en el sistema de perfusión. Recirculación se produce durante la duración de la grabación. Para conservar la valiosa droga, minimizar el volumen de recirculación mediante el uso de tubos con un diámetro interior mínimo, o acortando la longitud total del tubo utilizado en el sistema de perfusión.
Nota: Al tomar estos pasos, puede reducirse el volumen de recirculación del baño a 5 mL de la solución PA-Nic. Soluciones PA-Nic a menudo pueden ser utilizadas para dos consecutivos días dentro de la misma semana de grabación si almacenado protegido de la luz a 4 ° C. - Durante la recirculación, continuamente la solución con carbogen (5% O2, 95% CO2) de la burbuja y mantener la temperatura del baño a 32 º C.
- Retener la rebanada del cerebro en la solución de grabación mientras trabajaba con el Nic de PA en condiciones de poca luz.
3. proyección de imagen de las neuronas con láser de 2 fotones microscopía
- Realizar visualización vivo de la célula.
- Identificar/visualizar una neurona intermedia habénula (MHb) usando luz transmitida o interferencia diferencial infra-rojo (IR/DIC) óptica y una cámara de vídeo de contraste y establecer una grabación de abrazadera de parche estable de células enteras. Refieren a un protocolo anterior para obtener más información sobre grabaciones de abrazadera del remiendo de las neuronas en el ratón preparado agudo cerebro rodajas8.
- Después de establecer la alta resistencia (> 1 GΩ) configuración de conexión de celular, pero antes de rodaje, el montaje y software a modo de exploración con láser.
- Después de robo, uso de escaneo láser para verificar que una proyección de imagen tinte (diluido a una concentración final de 100-200 μm en una solución de estándar pipeta intracelular descrito anteriormente8) es pasiva (por difusión) llenado la neurona. Permitir que el tinte (por ejemplo, Alexa Fluor 488 en verde photomultiplier tubo [PMT] canal, PMT 2; o Alexa Fluor 568 o 594 en canal rojo de la PMT, PMT 1) para llenar los compartimientos celulares para por lo menos 20-30 min antes de intentar experimentos que requieren la visualización de cualquier compartimentos celulares fuera el soma.
Nota: Compartimientos del distales (estructuras dendríticas, espinas, axones, etcetera.) puede requerir 30-40 min para llenar completamente el25. - Utilice el software Live Scan función para visualizar la neurona y el compartimento subcelular de interés. Elija parámetros de proyección de imagen que permiten la exacta visualización de funciones neuronales en vivo. Manipular varios ajustes para afectar o alterar la visualización de la pantalla (contraste), resolución, relación de señal a ruido (S/N) y tiempo de adquisición de marco de imagen:
-
Look up-table (LUT). Abra la ventana LUT utilizando el icono correspondiente en el lateral de cualquier ventana de la imagen. Una vez abierta, ajuste el LUT piso (min) y techo (máximo) de la configuración del canal de imagen específica para mejorar la visualización de contraste de la señal que se muestra en la pantalla. Baje el máximo valor a ~ 1000 (fuera de 12-bit 4096, detección), que le ayudará a sacar el dimmer señales cuando primero busca células señal y estructura.
Nota: Estos ajustes sólo afectan a la señal en pantalla, no los valores detectados/registrado. Ojos humanos por lo general sólo pueden hacer un contraste a niveles gris ~ 5026. -
Óptica zoom. Utilice controles de software para seleccionar 1 X zoom óptico y uso panorámica controles para localizar la zona deseada en el tejido. Este ajuste de zoom rinde la plaza más grande, explorado campo de visión y envía los ángulos de los voltajes/scan más grande, los espejos del galvanómetro.
Nota: La configuración por defecto es de un 12 mm x 12 mm campo de visión dentro de la cabeza de exploración que se traduce en 12 mm dividido por Ampliación objetiva dentro de la muestra. Por lo tanto, un 60 x rendimientos objetivo había analizado imágenes de 200 μm por cara en el 1 x de zoom óptico. Valores más altos de zoom óptico menos área de escaneo. 2 x de zoom óptico es a menudo el ajuste más útil para la visualización de neuronas todo. 4 x puede ser útil para visualizar aspectos subcelulares de las neuronas. -
Número de pixeles. Complemento 1 x zoom óptico, seleccione 1024 x 1024 píxeles por línea mediante controles de software. Establecer el número de píxeles por línea en la imagen capturada y mostrada para no perder posibles detalles de la lente del objetivo. Utilice los siguientes valores de pixel práctico para un x 60 / 1.0 objetivo de la apertura numérica (NA): 1024 x 1024 para el zoom de 1, 512 x 512 para zoom 2 y 256 x 256 de zoom 4. El tamaño de píxel final (~0.17 μm; 12 mm/ampliación/zoom/pixeles) debe ser la mitad o menos, de la resolución lateral definido por el objetivo.
Nota: La resolución de la imagen solamente es definido por la longitud de onda del láser y el objetivo de NA (resolución de 0.4 μm de dos fotones emocionado [2PE] con 920 nm y un objetivo de NA 1,0)27. Los criterios para la excitación completa NA, como se indica en el objetivo, que es la intensidad de2 1/e de los partidos de diámetro de haz de láser (o "llena") la pupila de entrada (2 x tubo lente distancia focal x NA / ampliación) de la lente del objetivo. La lente del tubo en el sistema descrito aquí tiene una distancia focal de 180 mm. -
Tiempo de permanencia de pixel . Utilizar controles de software para seleccionar 4 μs para el tiempo de permanencia de píxeles, un valor predeterminado útil.
Nota: El tiempo de permanencia del pixel no cambiar la señal media detectada; sólo afecta al intra-pixel promedio y estos cambios pueden ser visualizados a través de la calidad de imagen via S/N. El tiempo de permanencia de imagen pixel es siempre un múltiplo de 0,4 μs unidades, y para detención mayor veces la intensidad limitada de 12-bit valor de cada píxel de la imagen es el promedio de las muestras de 0,4 μs. Puesto que la relación señal/ruido mejora como la raíz cuadrada del número de muestras por tiempo de permanencia de pixel (4 μs equivale a diez muestras, o la 3.16-fold mejora en S/N), la mejora en la calidad de imagen alcanza decreciente para valores mucho más grandes que 12 μs. -
Análisis de rotación y la región de interés (ROI). Ajuste el ángulo de imagen a la rotación de 0°, utilizando controles de software (no acción puede necesitar, como la rotación de 0° es el valor predeterminado para la mayoría de sistemas de proyección de imagen). Si la muestra se coloca en una orientación "boca abajo", seleccionar la rotación de 180° para "voltear" la imagen.
Nota: Rotar la imagen, en cualquier ángulo dado, puede proporcionar un mejor ajuste para toda la zona de interés de una celda de rellenada. Rotación puede producir también una base clara para alinear los cambios estructurales y para realizar análisis posteriores. Seleccionar una región de interés dentro de la imagen escaneada en un ajuste de zoom determinado (paso 3.1.4.2) conserva el número de píxeles nativos (paso 3.1.4.3), pero la restricción en el número total de píxeles y puede aumentar notablemente la velocidad de fotogramas, proporcionando mejorar la resolución temporal de cambios de la señal. -
Con un promedio de marco. Seleccione una partida marco promedio de 2 fotogramas utilizando controles de software.
Nota: El contraste de la imagen final (S/N) se define por los fotones total recogido/detectado dentro de los píxeles de la señal de la imagen. Con un promedio de varios marcos de imagen puede mejorar la relación señal/ruido, siempre y cuando la muestra no se mueve o no se blanquea durante proyección de imagen. La señal de interés sigue siendo el mismo valor durante marco promedio mientras que el ruido en la imagen se reduce por la raíz cuadrada del número de marcos de un promedio de. Pequeñas estructuras en imágenes de fluorescencia a menudo requieren un promedio de entre píxeles, combinación de píxeles en la imagen (a menudo llamado ROIs), o marco un promedio de. Marco con un promedio de aumento de tiempo de exploración por el número de imágenes una elige promedio.
-
Look up-table (LUT). Abra la ventana LUT utilizando el icono correspondiente en el lateral de cualquier ventana de la imagen. Una vez abierta, ajuste el LUT piso (min) y techo (máximo) de la configuración del canal de imagen específica para mejorar la visualización de contraste de la señal que se muestra en la pantalla. Baje el máximo valor a ~ 1000 (fuera de 12-bit 4096, detección), que le ayudará a sacar el dimmer señales cuando primero busca células señal y estructura.
- Utilice las herramientas de Control Pan, Análisis de rotacióny Zoom óptico para orientar la localización de la muestra durante el escaneo. Si la manipulación del motor de la etapa es necesario colocar la muestra, evitar tamaños de paso grande para el eje X, Y y Z para evitar colisiones de objetivo/condensador, vibraciones o la exposición del haz láser a superficies reflectantes.
- Recoger un Z-stack. Con la herramienta de serie Z , seleccione un inicio y parada de posición que contiene la celda de interés. Seleccione un tamaño de paso (1 μm) y luego consecutivamente la neurona en cada plano de Z que contiene la célula de la imagen.
Nota: Ajustes de adquisición Z-stack varía entre el tipo de neurona y llenado de tinte. Parámetros óptimos para la adquisición de Z-stack deben determinarse independientemente de parámetros utilizados para la proyección de imagen vivo. Adquisición de Z-stack puede realizarse antes o después de los experimentos de optopharmacology. Si es posible, realizar la adquisición de Z-pila después de optopharmacology para evitar cualquier daño celular inducido por de 2PLSM y para permitir un llenado óptimo del tinte de pequeños compartimentos celulares.
4. laser Flash Photolysis durante las grabaciones electrofisiológicas
Nota: Aplicación de 405 nm o 473 nm láser poderes de ≥ 1 mW produce fosforescencia dentro del vidrio de las lentes objetivo y condensador. Esta luz genera está directamente relacionada con la energía de la iluminación del laser; la emisión está presente en las ventanas espectrales verdes y rojo y tiene vida de estado excitado en la gama ms. Este artefacto de estímulo de fondo se ve en todas las lentes probadas y en agua-inmersión lentes objetivo de los principales fabricantes de lentes del objetivo. Las lentes de condensador producen mucho mayor fosforescencia de lentes del objetivo. Esta "señal" motiva el uso de encofrados mecánico para protección catódica PMT sensible arseniuro de galio fosfuro (GaAsP) durante los eventos de la foto estimulación. Utilizando un obturador mecánico normalmente cerrado (cerrado cuando no activamente) representa la mejor solución para protección de PMTs de GaAsP refrescado.
- Para una geometría de haz de fotoestimulación de reloj de arena-tipo, retire cualquier lentes de enfoque en la óptica de la trayectoria de la luz que sería lo contrario estrecha/constrict el rayo láser como entra en la pupila de entrada objetivo.
- Uso de MarkPoints, seleccione solo punto.
Nota: Otros ajustes de foto estimulación (puntos múltiples, una rejilla de puntos, de espiral exploración) son posibles dentro de MarkPoints. Solo punto es el más simple. Objetivos experimentales y diferencias biológicas pueden requerir una configuración diferente. - Actualización de la imagen utilizando la opción de Live Scan brevemente la imagen y ubicar el área subcelular de interés. Actualizar periódicamente la imagen para identificar cualquier potencial pequeñas derivas en foco.
- Utilizar controles de software para aumentar el zoom óptico (es decir, seleccione un ajuste de zoom óptico mayor que el actual), si es necesario, para visualizar estructuras pequeñas (es decir, espinas o dendritas distales).
- Coloque la MarkPoints solo punto mira inmediatamente adyacente (~0.5 μm) a la membrana celular. No de lugar la foto estimulación punto directamente sobre una función celular, ya que esto podría conducir a fotoenvejecimiento.
- Definir los parámetros para foto-estimular mediante controles de software en MarkPoints. Aplicar las directrices de partida como sigue: 1-50 ms de duración, 1 a 4 mW láser potencia y ≥1 ensayo.
- Seleccione Ejecutar MarkPoints para iniciar el protocolo de MarkPoints y observar la adquisición de datos de electrofisiología en tiempo real.
- Repita los pasos del 4.2-4.7 varias veces para evaluar la consistencia y estabilidad, o falta de ella, de la amplitud de la respuesta y la cinética.
Resultados
Para la fotólisis estimulación, dosis de exposición (intensidad y tiempo), ubicación de la exposición y geometría de la viga son las variables clave. El sistema descrito en este artículo es capaz de dos vigas de diferentes fotoestimulación, ajustable a través de mover una lente en/fuera de la trayectoria de la luz de fotoestimulación antes la viga entra en el sistema del galvanómetro. Sin este objetivo, el rayo de fotoestimulación llena la pupila de entrada de 60 x / 1,0 NA agua-inmersión [60 x WD] objetivo, produciendo una cerca-difracción limitada, lugar sub-μm en el plano focal dentro de la muestra. Esto se asocia con fotoestimulación con forma de reloj de arena, que se extiende por encima y por debajo de la mancha focal simétrica con el eje óptico. Con la lente insertada en el camino, luz laser de la fotoestimulación se centra en la pupila de la entrada de la lente del objetivo y luego sale como un haz de lápiz. Este rayo, que se espera que sea ~ 10 μm de diámetro para un objetivo de 60 x, extiende uniformemente/verticalmente a lo largo de la muestra. En este modo, la intensidad de la luz en cualquier lugar dado en el punto de estimulación será ~ 1% de la intensidad de mancha pequeña cerca difracción limitada. Así, mayores potencias de láser deben por lo general cuando se utiliza estimulación punto de ~ 10 μm. Para todos los experimentos reportados en este artículo, se utilizó un haz de fotoestimulación tipo reloj de arena.
El poder de la muestra entregada puede trazar contra el ajuste de voltaje de entrada, después de medir la potencia del láser en la muestra usando un medidor de potencia. Estos estudios utilizan un 60 x objetivo de WD con una distancia de 2 mm, pero no está sumergido en el agua para mediciones de energía evitar posibles daños al elemento detector. Listados de objetivos con NA > 0,95 se miden en el aire (sin líquido de inmersión), puede haber pérdidas de reflexión interna total en el elemento de cara frontal de la lente debido al menor índice (aire). En este caso, para una medición más precisa energía de la muestra (para corregir las pérdidas de la reflexión interna total), aumentar la potencia medida por el 1,0 NA objetiva (1.0/0.95)2 medido en el aire. Figura 1a muestra una típica parcela de entrada/salida para 405 nm y láseres visibles de 473 nm que se incorporan en el láser de lanzan sistema en este estudio. Estos sistemas de láser son ideales para control de dosis de exposición de foto estimulación por las siguientes razones: (1) son previamente calibrados para proporcionar potencia lineal directamente en relación con la tensión de entrada (0-5 V), (2) que proporcionan un funcionamiento silencioso del obturador (no laser de la salida), y (3) tienen rápido, control de duración de pulso de intensidad sub-ms (0,1 ms de respuesta). Punto foto-estimulación con un sistema de laser/galvo, calibración rutinaria de MarkPoints puntos es una tarea esencial. Figura 1b (panel izquierdo) muestra un sistema que está fuera de calibración (punto deseado para foto-estimular resulta en estimulación exacta de ese punto, según lo indicado por la ubicación de los orificios de la quemadura), con un retorno a la posición exacta del punto después de la calibración ( Figura 1b, panel derecho).
PA-Nic es modestamente fluorescente (pico de emisión a ~ 510 nm), exhibiendo la eficaz excitación entre 350-450 nm (1 fotón excitación) o 700-900 nm (2 fotones excitación)5. Para visualizar PA-Nic en la aplicación local, PA-Nic (1 mM) se aplicó cerca de tejido cerebral seguido de la proyección de imagen simultánea del contexto de transmisión óptico seccionado de tejido (1) cerebro vía Dodt contraste y (2) la fluorescencia emitida de excitación (900 nm) de Fluorescencia de 2PE PA PA-NIC-Nic era fácilmente perceptible durante la eyección de la presión de una pipeta de aplicación local (Figura 2a). Nicotina y un monoalkylcoumarin, 7-carboxymethylamino-4-metil-cumarina, son los principales productos fotoquímicos de los PA-Nic photolysis de la reacción5. Utilizando la misma imagen ajustes/parámetros que fueron utilizados para la proyección de imagen de PA-Nic, el tejido era reflejado durante la entrega de nicotina (1 mM) o 7-carboxymethylamino-4-metil-cumarina (1 mM). No se detectó ninguna señal fluorescente (Figura 2a, paneles centrales e inferiores), demostrando la especificidad de los resultados de PA-Nic. Por último, PA-Nic se aplicó dentro del tejido de cerebro y emisión de fluorescencia de PA-Nic era reflejada (figura 2b). Este enfoque confirma que PA-Nic está presente en 100-200 μm de la pipeta de aplicación local. Juntos, estos datos confirman que efectivamente sea entregado PA-Nic cerebro tejido mediante aplicación local.
Grabaciones de electrofisiología con simultánea 2PLSM para la visualización de las estructuras celulares requiere al investigador a consideraciones de equilibrio de ambos componentes del experimento, y a menudo está disponible para una ventana de tiempo estrecho (~ 20 min) válido adquisición de datos de muestra de una célula de parcheado. Sin considerar la visualización celular, es mejor práctica para comenzar a grabar tan pronto como sea posible después de robo porque grabación estabilidad tiende a disminuir con el tiempo. Sin embargo, cuando la proyección de imagen es un requisito, consideraciones electrofisiológicas deben permitir suficiente tiempo para fluorescencia concentración aumenta en las estructuras de la pequeña y remota. Esto se ejemplifica mediante el examen de una concentración de colorante llenado curva28, que a veces es útil para derivar cuando un nuevo tipo de célula de la imagen. La figura 3 muestra varias neuronas ejemplo reflejada como Z-stacks via 2PLSM y se derrumbó en una proyección de intensidad máxima para fines de presentación. Figura 3a muestra imágenes de alta calidad donde morfología neuronal parece ser completa, se reduce al mínimo el ruido y escombros no interfieren con la interpretación de la morfología celular. Figura 3b muestra imágenes de baja calidad, debido a una baja relación de señal a fondo y restos substancial. Esta basura aparece a menudo como bolsas esféricas de fluorescencia intensa, derivadas de la expulsión de imágenes provenientes de la pipeta de parche al acercarse a la célula. En particular, inclusión de 100 μm PA-Nic en el baño (al realizar uso del baño) tiende a reducir la proporción de señal a fondo y conduce a contraste de la imagen óptima. Alexa Fluor 568 o 594 a menudo es muy útil en experimentos de aplicación local como un tinte de buscador o como una señal de referencia/normalización normalización 2 PED. Una longitud de onda efectiva para la excitación de dos fotones de estos tintes es ~ 780 nm27, que permite la visualización simultánea de PA-Nic e identificación de compartimentos celulares. Esta longitud de onda, sin embargo, no completamente evitar la fotólisis de dos fotones de PA-Nic5. Alexa Fluor 488 es ventajoso en los experimentos de aplicación de baño de PA-Nic; Cuando excitado con una longitud de onda conveniente ≥900 nm, dos fotones fotólisis de PA-Nic5 pueden evitarse manteniendo la adecuada visualización de los compartimentos celulares.
Figura 4 muestra los datos de ejemplo para localizado PA-Nic laser flash fotólisis en neuronas de MHb en rebanadas de cerebro. Figura 4a (paneles superiores) se muestra un ejemplo de una imagen de «referencia», que es una captura de pantalla de la última imagen de 2PLSM tomada antes de que se ejecutó el protocolo de MarkPoints , con la ubicación del punto de foto estimulación. Figura 4a (inferior paneles de imagen) muestra una vista ampliada de la foto estimulación punto superpuesto en la morfología celular. En los paneles inferiores de la figura 4ase muestra la respuesta electrofisiológica correlacionados de tiempo correspondiente a PA-Nic fotólisis. Trabajos previos demostraron que estas corrientes son sensibles al nAChR antagonistas5. Figura 4b muestra datos representativos de las diferentes células donde fotólisis punto único fue realizado en un intervalo de 1 s o 10 s. mientras que un intervalo de s 10 permitió suficiente tiempo de recuperación de la línea de fondo tenencia actual, un intervalo más corto de s 1 condujo a una aumento gradual de la explotación actual como protocolo procedió. El aumento actual sugiere que la nicotina no tenía suficiente tiempo para la difusión del sistema con el intervalo de 1 Hz29. Tal respuesta temporal análisis deben ser realizado de novo en cualquier nuevo tipo de célula en estudio, como la neurofarmacología del nAChRs puede diferir entre tipos de células.
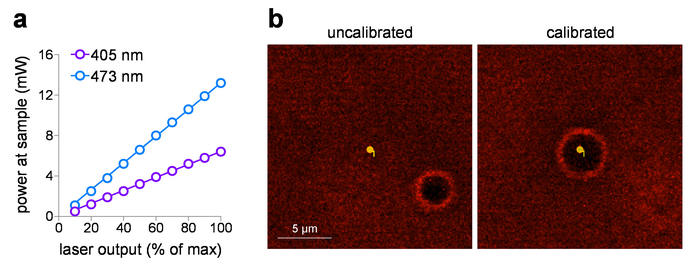
Figura 1: calibración de fotoestimulación láser. (una) foto estimulación láser potencia de salida. Energía en el plano de la muestra (a través de 60 x / 1.0 objetivo de inmersión en agua de NA) se midió de 405 nm y 473 nm foto estimulación láser en el ajuste de salida indicada. (b) calibración de láser de foto estimulación. Imágenes de captura de pantalla muestran la relación espacial entre el lugar de la foto estimulación previsto y la ubicación correspondiente donde foto estimulación ocurrió (burn-hole) antes (izquierda) y después de la calibración de corriente (derecha) en MarkPoints. Haga clic aquí para ver una versión más grande de esta figura.
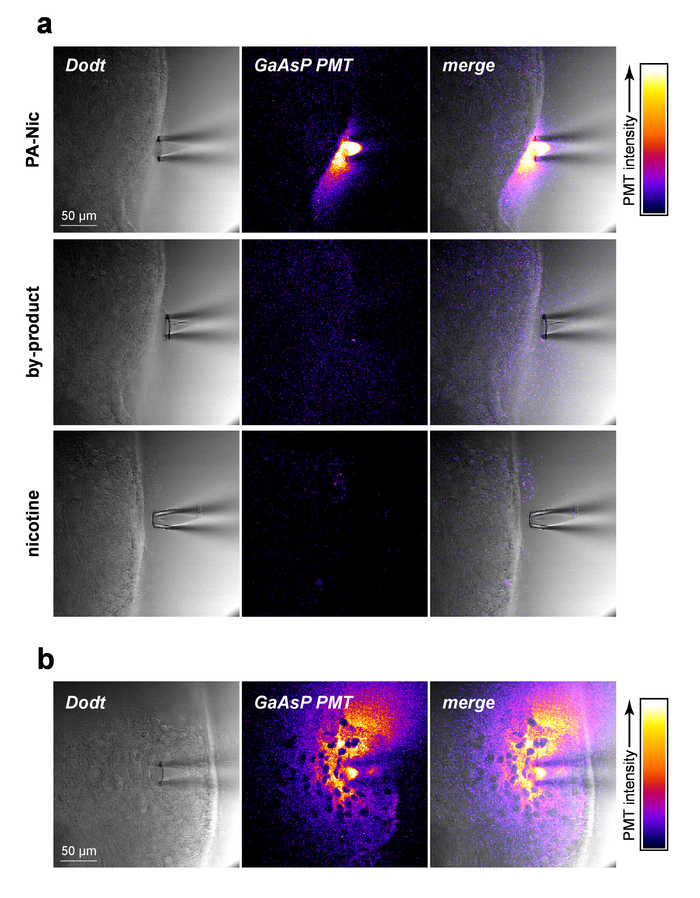
Figura 2: aplicación local PA-Nic. (a) detección de PA-Nic de un local aplicación pipeta. 1 mM PA-Nic, subproducto de la fotólisis o nicotina fueron disueltos en ACSF, carga en una pipeta de aplicación local y distribuido en el tejido cerebral durante 2PLSM (excitación de 900 nm) proyección de imagen usando la misma configuración de imágenes por cada medicamento. Láser de barrido Dodt contraste transmisión de imagen muestra la pipeta de tejido mientras que un cátodo de GaAsP PMT fue utilizado para capturar la emisión de fluorescencia. (b) PA-Nic (1 mM) fue inundada en tejido cerebral y reflejada a través de 2PLSM como (un) para mostrar la propagación lateral de PA-Nic utilizando su fluorescencia intrínseca. Haga clic aquí para ver una versión más grande de esta figura.
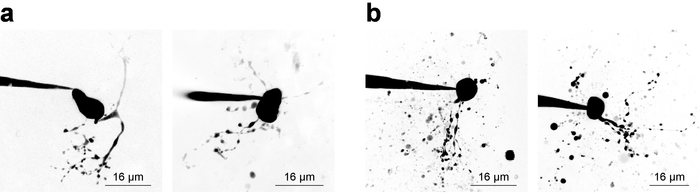
Figura 3: adquisición de imágenes de microscopía de escaneo de láser de 2 fotones. (a) Z-pilas de 2PLSM óptima. Dos ejemplos de proyecciones de máxima intensidad de 2PLSM Z-stack son aparece para MHb neuronas con dendritas bien resueltas y poco o sin residuos interferentes. (b) 2PLSM óptimo Z-pilas. Se muestran dos ejemplos de proyecciones de máxima intensidad de Z-stack 2PLSM MHb neuronas rodeadas de escombros (tinte expulsado de la pipeta durante el acercamiento de la célula). Este tipo de imágenes es más difícil de interpretar que imágenes como las que se muestran en (un). Haga clic aquí para ver una versión más grande de esta figura.
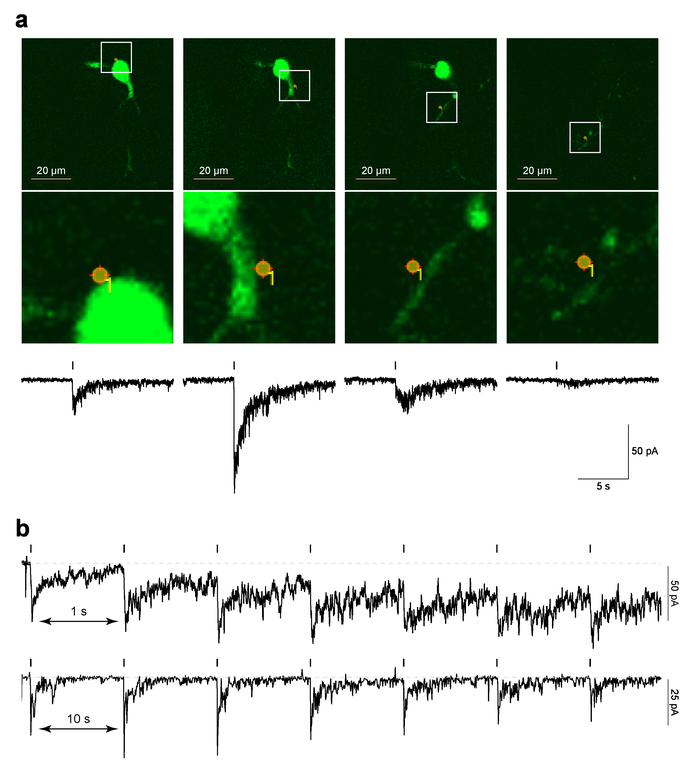
Figura 4: fotólisis de destello láser de PA-NIC. (una) referencia MarkPoints imágenes y corrientes hacia el interior por fotólisis PA-Nic. Para una neurona de MHb, imágenes de crudo de referencia se muestran ensayos de foto estimulación MarkPoints en un solo lugar celular (indicado). Tenga en cuenta que para algunos sitios de foto estimulación (la imagen de la derecha en esta serie), la estructura dendrítica está en foco pero el soma y una dendrita proximal no son. Debajo de cada imagen de referencia, se grafica la corriente hacia adentro uncaging-evocado de nicotina. (b) estímulo entre intervalos para PA-Nic fotólisis. Grabaciones de ejemplar se muestran para MHb neuronas donde fue repetidamente uncaged nicotina en el mismo lugar de perisomatic con un intervalo inter-estímulo de 1 s o 10 s. haga clic aquí para ver una versión más grande de esta figura.
Discusión
La elección del método de entrega de aplicaciones PA-Nic es el paso más crítico en esta técnica de foto-estimulación localizada. Los dos métodos, uso de baño y la perfusión local, cada una ofrece diferentes ventajas y limitaciones. La elección se ve afectada en gran medida por el nivel de expresión funcional del nAChR en el tipo de la célula de interés. A menudo es preferible utilizar la aplicación del baño cuando los niveles de expresión funcional son altos, como aplicación de baño permite una concentración de sonda uniforme que rodea la célula grabada, facilitando la interpretación de los datos. Aplicación de baño también elimina la necesidad de una segunda pipeta de perfusión en el tejido, facilitando todo el proceso. Sin embargo, aplicación de baño de costosos compuestos costos más por experimento.
Solución de problemas implica comúnmente, tratando de entender por qué ninguna activación nAChR es visto siguiente flash photolysis. Cuando se trabaja con un tipo de células que no se ha estudiado previamente con el PA-Nic, el investigador debe realizar puff-aplicación local de ACh o nicotina para determinar si suficientes receptores son funcionalmente expresado5. Para validar que el sistema es capaz de detectar respuestas de fotólisis, experimentos de control debe hacerse en medial de la habénula neuronas que expresan grandes cantidades de receptor30. En esta área del cerebro, PA-Nic baño aplicación es posible, que es preferible para los experimentos de validación. Sólo después de realizar estos experimentos de validación debería uno pasar a un tipo de células estudiadas. Si el sistema experimental ha sido validado y las respuestas siguen siendo muy pequeño o no detectable, puede estar justificado para aumentar la concentración de PA-Nic, aumentar la intensidad del flash o la duración del pulso, añadir un modulador alostérico positivo del nAChR mejorar nAChR actividad6, o alguna combinación de estos.
Ocasionalmente, uncaging las respuestas son demasiado grandes, con la activación del nAChR significativas dando por resultado la tensión indirecta privada Na+ canal activación y liberadas corrientes hacia el interior debido a la abrazadera del espacio pobre. Estos artefactos, que completamente oscurecen nAChR hacia corrientes y hacen imposible la interpretación de los datos, se pueden eliminar por la inclusión de QX-314 (2 mM) en la pipeta de la grabación. También puede ser eliminados mediante la reducción de la concentración de PA-Nic o reduciendo la intensidad del flash o la duración del pulso. En todos los experimentos de foto-estimulación de luz visible, se debe tener cuidado al seleccionar los sitios de estimulación para evitar estimulación involuntaria/fotólisis por encima o por debajo del plano focal deseado. Además y cuando proceda, la potencia del láser siempre debe ser graduada para reproducir respuestas fisiológicas. Es especialmente importante ser consciente de fotoestimulación del eje z cuando se trabaja con ligandos enjaulados, como ligandos que se activan por encima/por debajo el punto focal pueden todavía difuso e interactuar con el sistema biológico (es decir, receptores de, ) bajo estudio.
Fotólisis de destello láser PA-Nic puede no ser apropiado para todos los investigadores, existen varias limitaciones. El primero es el relativamente alto costo de una instalación adecuada. Cuando se trabaja con cortes de cerebro intacto, uncaging cerca de estructuras de diámetro pequeño como las dendritas requiere un sistema de visualización sofisticada como un microscopio de 2 fotones. Además el alto costo de una TI: zafiro, láser pulsado sintonizable de IR para realizar 2 fotones microscopía, un sistema de doble-galvanómetro capaz de posicionar independientemente dos rayos láser más incrementa el costo del sistema. Coste total del sistema puede reducirse mediante el uso de un sistema de fabricación casera si el investigador dispone de suficiente experiencia y tiempo para construir, solucionar problemas y mantener dicho sistema. Una segunda limitación a menudo implica la expresión funcional nAChR baja, que puede mitigarse parcialmente por pasos como se mencionó anteriormente, pero esto no puede garantizar el éxito. Por lo general, si uno no puede medir corrientes ligand-activado después de hojaldre-aplicación de agonistas, PA-Nic flash photolysis debajo de la abrazadera de tensión no puede producir resultados aceptables. Una tercera limitación implica la intrínseca fluorescencia de PA-NIC PA-Nic absorbe ~ 405 nm luz y emite en un rango similar como la proteína verde fluorescente (GFP) o Alexa 4885. Cuando las concentraciones de PA-Nic exceden ~ 1 mM, esta propiedad de fluorescencia puede hacer difícil visualizar simultáneamente estructuras neuronales. Para mitigar esto, es fundamental para poder controlar fácilmente el flujo de PA-Nic de la pipeta de la perfusión. Periódicamente, el flujo de PA-Nic se detuvo para permitir que moléculas fluorescentes a difuso lejos. Esto permite volver a la proyección de imagen de la neurona para el control de la posición del punto de la viga uncaging. Una cuarta limitación potencial mencionar consiste en el uso de 405 nm luz de fotólisis. Longitudes de onda más cortas como 405 nm son más propensos a la dispersión en el tejido complejo como un trozo de cerebro. Así, en una determinada intensidad del flash y la duración, uncaging amplitudes de respuesta y cinética del decaimiento pueden ser diferencialmente afectados por la profundidad de la uncaging dentro de la rebanada. Conclusiones sobre aspectos biológicos del nAChRs deben considerar esta importante ADVERTENCIA.
Esta técnica de fotólisis de destello láser localizado recientemente se ha utilizado para descubrir nuevos detalles sobre neurobiología del nAChR. Por ejemplo, la exposición crónica de la nicotina mejora perisomatic y función del nAChR dendríticas en medial de la habénula neuronas5. También fue utilizado para ayudar a demostrar, por primera vez, que las neuronas glutamato de área tegmental ventral expresan funcional nAChRs perisomatic y dendríticas compartimentos celulares6. Hay que muchas posibilidades de futuro uso de esta técnica, y el enfoque podría aplicarse a otros tipos de neurona clave que expresa nAChRs, como las neuronas piramidales corticales31 o interneuronas en la corteza cerebral32, estriado33 e hipocampo19. Esta técnica podría también combinarse con Farmacología o nAChR gene edición34 para localizar subtipos de receptores específicos a los diferentes compartimientos neuronales. El enfoque puede adaptarse fácilmente a otros compuestos de cumarina enjaulado, incluyendo pero no limitado a, los que se desarrollaron en paralelo con PA-Nic5. Finalmente, PA-Nic flash photolysis un de puede día utilizar en un animal despierto/comportamiento para estudiar la acción de la nicotina en paradigmas de la farmacología conductual novela.
Divulgaciones
D.L.W. sirve como consultor pagado para microscopía de fluorescencia de Bruker Nano.
Agradecimientos
Los autores agradecen a los miembros del laboratorio de los siguientes investigadores principales noroeste: Ryan Drenan, D. James Surmeier, Yevgenia Kozorovitskiy y contratista de Anis. Este trabajo fue apoyado por el nos institutos nacionales de salud (NIH) (becas DA035942 y DA040626 a R.M.D.), la Fundación PhRMA (beca a M.C.A.) y HHMI.
Materiales
| Name | Company | Catalog Number | Comments |
| Instruments, Consumables, and Miscellaneous Chemicals | |||
| Multiclamp 700B | Molecular Devices Corp. | Patch clamp amplifier | |
| Pneumatic Picopump | World Precision Instruments | PV820 | |
| Micropipette puller | Sutter Instrument Co | P-97 | |
| Temperature Controller | Warner Instruments | TC-324C | |
| Vibrating blade microtome | Leica Biosystems | VT1200S | |
| Ultrafree-MC Centrifugal Filter | MilliporeSigma | UFC30GV0S | internal solution filter |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B150F-4 | patch and local application pipette |
| (-)-Nicotine hydrogen tartrate salt | Glentham | GL9693 | nicotine salt |
| 7-carboxymethylamino-4-methyl coumarin | Janelia Research Campus | PA-Nic by-product | |
| 1-[7-[bis(carboxymethyl)- amino]coumarin-4-yl]methyl-nicotine | Janelia Research Campus | PA-Nic | |
| Euthasol (Pentobarbital Sodium and Phenytoin Sodium) | Virbac | ANADA #200-071 | |
| Alexa FluorTM 488 Hydrazide | ThermoFisher | A10436 | green fill dye |
| Alexa FluorTM 568 Hydrazide | ThermoFisher | A10437 | red fill dye |
| 6-carboxy-AF594 (Alexa Fluor 594) | Janelia Research Campus | red fill dye | |
| QX 314 chloride | Tocris | 2313 | voltage-gated sodium channel blocker |
| Power Meter | ThorLabs | S120C | |
| Name | Company | Catalog Number | Comments |
| Chemicals for Solutions | |||
| N-Methyl-D-glucamine | Sigma | M2004 | |
| Potassium chloride | Sigma | P3911 | |
| Sodium phosphate monobasic monohydrate | Sigma | S9638 | |
| Sodium bicarbonate | Sigma | S6014 | |
| HEPES | Sigma | H3375 | |
| D-(+)-Glucose | Sigma | G5767 | |
| (+)-Sodium L-ascorbate | Sigma | A4034 | |
| Thiourea | Sigma | T8656 | |
| Sodium pyruvate | Sigma | P2256 | |
| Magnesium sulfate heptahydrate | Sigma | 230391 | |
| Calcium chloride dihydrate | Sigma | 223506 | |
| Sodium chloride | Sigma | S9625 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma | E3889 | |
| Adenosine 5′-triphosphate magnesium salt | Sigma | A9187 | |
| Guanosine 5′-triphosphate sodium salt hydrate | Sigma | G8877 | |
| Name | Company | Catalog Number | Comments |
| Components of 2-Photon Microscope | |||
| Ultima Laser Scanner for Olympus BX51 Microscope | Bruker Nano, Inc. | imaging software and galvos | |
| Imaging X-Y galvanometers | Cambridge Technology | ||
| Mai Tai HP1040 | Spectra-Physics | Tuneable IR laser | |
| Pockels cell M350-80-02-BK with M302RM Driver | Conoptics, Inc. | for IR laser attenuation | |
| Integrating Sphere Photodiode Power Sensor | Thorlabs, Inc | laser power pick-off photodiode | |
| Uncaging X-Y galvanometers | Cambridge Technology | ||
| Helios 2-Line Laser Launch | Bruker Nano, Inc. | uncaging laser components | |
| OBIS LX/LS 405 nm (100 mW) | Coherent, Inc. | ||
| OBIS LX/LS 473 nm (75 mW) | Coherent, Inc. | ||
| Point-Photoactivation / Fiber Input Module for Limo Sidecar - Uncaging | Bruker Nano, Inc. | ||
| Name | Company | Catalog Number | Comments |
| Upright Microscope | Olympus | BX51WIF | Upright microscope chasis |
| Objective: Olympus M Plan FL 10x; NA 0.3 WD 11 mm | Olympus | 10x objective | |
| Objective: Olympus M Plan Fluorite 60x/1.0 WD=2mm NIR | Olympus | 60x water-dipping objective | |
| X-Cite 110, four-LED LLG coupled epi-fluorescence light source | Excelitas Technologies | LED Light Source | |
| Epi-Fluorescence Filter: ET-GFP (FITC/CY2) for Epi-Turret | Chroma Technologies | LED Filter for blue light excitation | |
| Epi-Fluorescence Filter: ET-DsRed (TRITC/CY3) for Epi-Turret | Chroma Technologies | LED Filter for green light excitation | |
| B&W CCD camera; Watec, 0.5in B/W CCD | Watec Co., LTD. | CCD camera for patch clamp recording | |
| Name | Company | Catalog Number | Comments |
| External Detectors - Dual Reflected Emission - Olympus Upright (Multi-Alkali, GaAsP) | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | red channel PMT |
| 595/50m | Chroma Technologies | red channel emission filter | |
| 565lpxr | Chroma Technologies | dichroic beam splitter | |
| GaAsP end-on PMT | Hamamatsu | 7422PA-40 | green channel PMT |
| 525/70m | Chroma Technologies | green channel emission filter | |
| High-Speed Shutter for Hamamatsu H7422 PMT | Vincent Associates / Bruker | 517329 | PMT shutter mount |
| Name | Company | Catalog Number | Comments |
| Dodt Gradient Contrast Transmission Detection Module | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | Dodt PMT |
Referencias
- Zhang, C., et al. Cholinergic tone in ventral tegmental area: Functional organization and behavioral implications. Neurochemistry International. 114, 127-133 (2018).
- Sarter, M., Parikh, V., Howe, W. M. Phasic acetylcholine release and the volume transmission hypothesis: time to move on. Nature Reviews Neuroscience. 10 (5), 383-390 (2009).
- Coyle, J. T., Price, D. L., DeLong, M. R. Alzheimer's disease: a disorder of cortical cholinergic innervation. Science. 219 (4589), 1184-1190 (1983).
- Katz, B., Thesleff, S. A study of the desensitization produced by acetylcholine at the motor end-plate. Journal of Physiology. 138 (1), 63-80 (1957).
- Banala, S., et al. Photoactivatable drugs for nicotinic optopharmacology. Nature Methods. 15 (5), 347-350 (2018).
- Yan, Y., et al. Nicotinic Cholinergic Receptors in VTA Glutamate Neurons Modulate Excitatory Transmission. Cell Reports. 23 (8), 2236-2244 (2018).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. α4α6β2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Molecular Pharmacology. 84 (3), 393-406 (2013).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. Journal of Visualized Experiments. (68), (2012).
- Ren, J., et al. Habenula "cholinergic" neurons co-release glutamate and acetylcholine and activate postsynaptic neurons via distinct transmission modes. Neuron. 69 (3), 445-452 (2011).
- Koppensteiner, P., Melani, R., Ninan, I. A Cooperative Mechanism Involving Ca(2+)-Permeable AMPA Receptors and Retrograde Activation of GABAB Receptors in Interpeduncular Nucleus Plasticity. Cell Reports. 20 (5), 1111-1122 (2017).
- Zhang, J., et al. Presynaptic Excitation via GABAB Receptors in Habenula Cholinergic Neurons Regulates Fear Memory Expression. Cell. 166 (3), 716-728 (2016).
- Chen, E., et al. Altered Baseline and Nicotine-Mediated Behavioral and Cholinergic Profiles in ChAT-Cre Mouse Lines. The Journal of Neuroscience. 38 (9), 2177-2188 (2018).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter increased acetylcholine release in the hippocampus. Neuroscience. 218, 1-11 (2012).
- Ting, J. T., Feng, G. Recombineering strategies for developing next generation BAC transgenic tools for optogenetics and beyond. Frontiers in Behavioral Neuroscience. 8, 111 (2014).
- Crittenden, J. R., Lacey, C. J., Lee, T., Bowden, H. A., Graybiel, A. M. Severe drug-induced repetitive behaviors and striatal overexpression of VAChT in ChAT-ChR2-EYFP BAC transgenic mice. Frontiers in Neural Circuits. 8, 57 (2014).
- Kolisnyk, B., et al. ChAT-ChR2-EYFP mice have enhanced motor endurance but show deficits in attention and several additional cognitive domains. The Journal of Neuroscience. 33 (25), 10427-10438 (2013).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter enhances dendritic complexity of adult-born hippocampal neurons and improves acquisition of spatial memory during aging. Neurobiology of Aging. 36 (5), 1881-1889 (2015).
- Denk, W. Two-photon scanning photochemical microscopy: mapping ligand-gated ion channel distributions. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6629-6633 (1994).
- Khiroug, L., Giniatullin, R., Klein, R. C., Fayuk, D., Yakel, J. L. Functional mapping and Ca2+ regulation of nicotinic acetylcholine receptor channels in rat hippocampal CA1 neurons. The Journal of Neuroscience. 23 (27), 9024-9031 (2003).
- Filevich, O., Salierno, M., Etchenique, R. A caged nicotine with nanosecond range kinetics and visible light sensitivity. Journal of Inorganic Biochemistry. 104 (12), 1248-1251 (2010).
- Tochitsky, I., et al. Optochemical control of genetically engineered neuronal nicotinic acetylcholine receptors. Nature Chemistry. 4 (2), 105-111 (2012).
- Wokosin, D. L., Squirrell, J. M., Eliceiri, K. W., White, J. G. Optical workstation with concurrent, independent multiphoton imaging and experimental laser microbeam capabilities. Review of Scientific Instruments. 74 (1), 193-201 (2003).
- Plotkin, J. L., Day, M., Surmeier, D. J. Synaptically driven state transitions in distal dendrites of striatal spiny neurons. Nature Neuroscience. 14 (7), 881-888 (2011).
- Galtieri, D. J., Estep, C. M., Wokosin, D. L., Traynelis, S., Surmeier, D. J. Pedunculopontine glutamatergic neurons control spike patterning in substantia nigra dopaminergic neurons. Elife. 6, (2017).
- Yasuda, R., et al. Imaging calcium concentration dynamics in small neuronal compartments. Science STKE. (219), pl5 (2004).
- Inoue, S., Spring, K. . Video microscopy: The fundamentals. , 163-186 (1997).
- Zipfel, W. R., Williams, R. M., Webb, W. W. Nonlinear magic: multiphoton microscopy in the biosciences. Nature Biotechnology. 21 (11), 1369-1377 (2003).
- Maravall, M., Mainen, Z. F., Sabatini, B. L., Svoboda, K. Estimating intracellular calcium concentrations and buffering without wavelength ratioing. Biophysical Journal. 78 (5), 2655-2667 (2000).
- Wathey, J. C., Nass, M. M., Lester, H. A. Numerical reconstruction of the quantal event at nicotinic synapses. Biophysical Journal. 27 (1), 145-164 (1979).
- Shih, P. Y., et al. Differential expression and function of nicotinic acetylcholine receptors in subdivisions of medial habenula. The Journal of Neuroscience. 34 (29), 9789-9802 (2014).
- Verhoog, M. B., et al. Layer-specific cholinergic control of human and mouse cortical synaptic plasticity. Nature Communications. 7, 12826 (2016).
- Koukouli, F., et al. Nicotine reverses hypofrontality in animal models of addiction and schizophrenia. Nature Medicine. 23 (3), 347-354 (2017).
- Xiao, C., et al. Chronic nicotine selectively enhances α4β2* nicotinic acetylcholine receptors in the nigrostriatal dopamine pathway. The Journal of Neuroscience. 29 (40), 12428-12439 (2009).
- Peng, C., et al. Gene Editing Vectors for Studying Nicotinic Acetylcholine Receptors in Cholinergic Transmission. European Journal of Neuroscience. , (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados