Method Article
Sonder la fonction des récepteurs nicotiniques de l’acétylcholine dans les coupes de cerveau de souris par photolyse éclair au Laser de la Nicotine Photoactivatable
Dans cet article
Résumé
Cet article présente une méthode pour l’étude des récepteurs nicotiniques de l’acétylcholine (Nachr) dans des coupes de cerveau de souris par la nicotine uncaging. Lorsqu’il est couplé avec enregistrement de simultanée patch clamp et 2 photons laser, microscopie à balayage, la nicotine uncaging relie fonction des récepteurs nicotiniques avec une morphologie cellulaire, offrant une meilleure compréhension de la neurobiologie cholinergique.
Résumé
L’acétylcholine (ACh) agit par l’intermédiaire de récepteurs pour moduler une variété de processus neuronaux, mais il a été difficile de lier la fonction des récepteurs ACh avec localisation subcellulaire dans les cellules où cette fonction est exercée. Afin d’étudier l’emplacement subcellulaire des récepteurs nicotiniques de ACh (Nachr) dans le tissu cérébral native, une méthode optique a été développée pour libération précise de nicotine à des endroits discrets près de membranes neuronales pendant les enregistrements électrophysiologiques. Patch clamp de neurones dans le cerveau sont remplis de tranches de teinture de visualiser leur morphologie en microscopie à balayage laser 2 photons, et la nicotine uncaging est exécutée avec un flash de lumière en focalisant un faisceau de laser 405 nm près d’une ou plusieurs membranes cellulaires. Déflexions actuelles cellulaires sont mesurées, et une image haute résolution de (3D) en trois dimensions du neurone enregistré est faite pour permettre la réconciliation des réponses de la CNCDH dont la morphologie cellulaire. Cette méthode permet une analyse détaillée de la CNCDH distribution fonctionnelle dans les préparations de tissu complexe, promettant d’améliorer la compréhension de la neurotransmission cholinergique.
Introduction
Signalisation cholinergiques module nombreux processus cérébraux, y compris le contrôle attentionnel, mouvement volontaire et récompense1,2. Les médicaments qui améliorent la transmission de l’acétylcholine (ACh) sont utilisés pour traiter des troubles cognitifs associés à la maladie d’Alzheimer, ce qui implique un rôle important pour des systèmes cholinergiques dans la cognition3. Une meilleure compréhension des récepteurs cholinergiques et circuits dans les États sains et malades pourrait conduire à meilleures approches thérapeutiques pour plusieurs maladies/troubles neurologiques.
Récepteurs nicotiniques de ACh (Nachr) sont une famille de canaux ioniques ligand-dépendants qui en réponse à l’ACh endogène ou exogène nicotine du tabac, les cations de flux. Compte tenu du fait qu’ils étaient parmi les premiers récepteurs neurotransmetteur décrit4, la CNCDH pharmacologie et l’emplacement dans les fibres musculaires sont bien comprises pour les récepteurs de type musculaire. En revanche, relativement peu est connu sur la pharmacologie et de la distribution subcellulaire des Nachr native dans le cerveau. Cette lacune dans la connaissance a été récemment adressée en développant une nouvelle sonde chimique qui permet pour l’activation rapide et dans l’espace restreinte de Nachr dans le tissu cérébral durant l’imagerie cellulaire et enregistrement électrophysiologique5. Ici, les principales étapes méthodologiques impliqués dans cette démarche sont décrits, dans le but d’accroître la capacité de connecter la CNCDH fonction avec structure neuronale.
La nicotine Photoactivatable (PA-Nic ; nom chimique : 1-[7-[bis(carboxymethyl)-amino] coumarine-4-yl] méthyl-nicotine) peuvent être photolysés avec ~ 405 nm laser clignote pour libérer efficacement la nicotine5,6. Avant uncaging, PA-Nic est stable en solution et montre aucune fâcheuse caractéristiques pharmacologiques ou photochimique5. Après la photolyse, libéré de la nicotine active prévisible Nachr et les sous-produits de libération sont pharmacologiquement inerte5. Un laser à onde continue est utilisé comme source lumineuse photolyse avec une puissance > 1 mW mesurée dans l’échantillon. Si localisés, photo-stimulation ciblée est combinée avec la possibilité de localiser les membranes cellulaires avec 2 photons microscopie à balayage laser (2PLSM), et les deux principaux avantages de cette approche sont pleinement réalisés : photolyse vitesse et précision spatiale.
À bien des égards, la photolyse du PA-Nic est supérieure aux autres méthodes de prestation CNCDH ligands récepteurs dans les tranches de cerveau. Ces approches comprennent bain demande7 et drogue local livraison via une pipette de puffer8. Alors que l’ancienne approche tend à trop insister sur les effets à long terme du médicament appliqué, cette dernière approche peut souffrir de variabilité de la cinétique de la réaction entre les essais et dans les cellules. Aucune de ces approches peut bien distinguer activités récepteur dans différents endroits cellulaires du même neurone. Optogenetically-activé la libération d’ACh a été utilisée pour enquête de native Nachr9,10,11, mais il n’a pas prouvé utile pour des emplacements de subcellulaire CNCDH cartographie. En outre, la plupart des études utilisant cette approche sont sont appuyés sur une souris transgénique exprimant le ChR2 chromosome artificiel bactérien avec transmission cholinergique anormal12,13,14, 15 , 16 , 17.
PA-Nic photolyse n’est pas l’approche seulement optique pour l’étude des récepteurs cholinergiques. Une "cage" carbachol a été utilisé pour mapper fonctionnellement ACh activités de récepteurs dans les cellules cultivées tranches de cerveau et18 19, mais n’était pas disponible dans le commerce pour les études comparatives pendant l’élaboration du PA-nic. Un bis de ruthénium (bipyridine)-complexe de la nicotine (RuBi-nicotine) a été signalée pour permettre la nicotine libération20, mais les préparations commerciales de RuBi-nicotine s’est avérée inférieure à PA-Nic dans une comparaison entre étudient5. Il peut être utile de répéter de telles expériences comparatives avec non-commerciale, hautement purifiée RuBi-nicotine, que son absorption dans le visible pourrait compléter caractéristiques de PA-Nic pour études cholinergiques. Enfin, Nachr ont également été optiquement manipulé à l’aide d’une combinaison des ligands photo-commutable et récepteurs génétiquement modifiés21. Cette approche est complémentaire à la photolyse de PA-Nic dans le tissu cérébral, avec la capacité/besoin de ciblage génétique de la CNCDH mis à jour le vue comme un avantage et un inconvénient.
A noter plusieurs exigences clés de cette approche. Tout d’abord, une méthode de visualisation approprié est nécessaire pour localiser avec précision la membrane neuronale. Imagerie en microscopie conventionnelle épifluorescente peut-être suffire lorsque l'on étudie les cellules cultivées, mais pour l’enregistrement de neurones dans des tranches de cerveau ou d’autres préparations de tissus épais, 2PLSM ou microscopie confocale est une exigence. En second lieu, une méthode appropriée est nécessaire pour positionner le faisceau laser de photolyse. Cette approche utilise une tête double-galvanomètre scan avec deux miroirs indépendants x-y pour raster balayage du faisceau d’imagerie et photoactivation de point en utilisant la libération laser faisceau22,23,24. Autres solutions plus limitées sont possibles, tels que (1) une tête de balayage unique-galvanomètre qu’alternativement raster scanne le faisceau d’imagerie et le faisceau de libération ou (2) tout simplement diriger le faisceau vers le centre du champ de vision de libération telle que la cellule est amenée à cette position pour la photolyse éclair. En troisième lieu, un système est nécessaire pour l’enregistrement électrophysiologique simultanée si l'on veut recueillir les signaux physiologiques au cours d’expériences. Les prescriptions ci-dessus peuvent être satisfaites avec une technique d’imagerie optique adaptée, comme l’a récemment décrit5. Ci-dessous, un protocole détaillé est inclus qui décrit les étapes clés de cette approche.
Protocole
Les travaux se rapportant à la préparation de tranches de cerveau a été examiné et approuvé par le Comité de l’urbanisme (protocole #IS00003604) et de Northwestern University animalier.
Mise en garde : Lasers utilisés pour la photo-stimulation de point sont des lasers de classe IIIb visibles qui ont le potentiel d’effets nocifs pour les yeux. 2PLSM nécessite un laser à proche infrarouge (NIR) classe IV (> 500 mW), qui a le potentiel de causer de graves des yeux et des brûlures même dans d’autres tissus. Confinement de faisceau laser approprié, interverrouillages de système, ainsi que des contrôles techniques et administratifs sont tenus de garantir l’exploitation sécuritaire de l’équipement à base de laser. Toujours chercher le personnel de sécurité laser local lorsque vous travaillez avec des lasers.
1. Etalonnage et vérification de la libération Laser(s)
-
Quantifier la puissance du laser à livrer à l’échantillon.
- Allumer le laser à 405 nm (100 mW puissance avec signal de commande 5 V) et laisser le système de laser chauffer pendant environ 10 min.
Remarque : Le laser est toujours fermé (avec 0 V unité) et il n’y a aucune puissance de sortie jusqu'à ce que le laser est envoyé à une tension de commande pour moduler la puissance de sortie. - Placer un compteur d’électricité dans le plan d’échantillon de tissu ou à la place de la lentille du condenseur. Manuellement au centre du compteur par rapport à la lentille optique chemin/objectif.
- Mettre le compteur sur la plage de la bonne longueur d’onde (nm 400-1100). Le compteur à zéro en appuyant sur le bouton approprié.
- Utiliser les commandes du logiciel, sélectionnez 100 (hors max 1000 ; 1000 = 5 V) pour la puissance du laser 405 nm, qui définit le laser à 10 % de la puissance totale. Si vous le souhaitez, la tension de commande du laser peut également alimenter le PrairieView système via VoltageRecord pour fournir un enregistrement numérique de la commande calendrier et le niveau de puissance du signal.
- Enregistrement de la lecture de l’indicateur de puissance.
- Sélectionnez 150 (15 % du max 1000) pour la sortie de puissance 405 nm laser et enregistrez la lecture du compteur électrique. Répétez ceci pour les puissances suivantes recueillir une courbe de puissance de laser : 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 et 1000.
- Allumer le laser à 405 nm (100 mW puissance avec signal de commande 5 V) et laisser le système de laser chauffer pendant environ 10 min.
-
Calibrer les libération galvanomètres de laser. Exécutez les étapes suivantes lorsqu’il y a un changement de composants optiques du système, chaque fois qu’il y a une préoccupation quant à un positionnement précis du spot, ou régulièrement chaque mois.
- Installer le 60 x eau à pendage microscope objectif qui sera utilisé dans la photostimulation et expériences d’imagerie. Dans le logiciel d’acquisition et d’imagerie, sélectionnez le 60 x lentille d’objectif et d’un valeur de zoom optique de 1 (voir l’étape 3.1.4.2.).
- Marquer un cercle plein sur une lame de microscope de verre propre avec un marqueur permanent rouge. Placez la lame sur la platine du microscope, avec le marqueur vers l’objectif.
- Pré-focus le microscope sur la région de feutre rouge avec un x 4 ou un objectif 10 x. Ajoutez 1 à 2 mL d’eau au début de la dot/tache de feutre rouge et puis passer à l’objectif 60 x et submerger l’objectif dans l’eau. Concentrer l’objectif sur la région de marqueur rouge mince.
- Placez-vous dans 2 photons laser à balayage. Pour la plupart des systèmes, déplacer la tourelle pour positionner les #1, déplacez le prisme trinoculaire hors de la trajectoire de lumière, déplacer le miroir tête de balayage vers l’avant et sélectionner la longueur d’onde laser ~ 900 nm. Sélectionnez l’option de boîte de 512 x 512 pixels pour les paramètres d’acquisition image, qui est l’élément par défaut de pixel pour la procédure d’étalonnage de stimulation miroir.
- Démarrer le système de numérisation avec une puissance de laser d’imagerie supérieure à minimum et affiner la mise au point objective sur la couche mince de marqueur rouge de la fluorescence. Choisissez un champ dans le domaine de la fluorescence clairement des débris et uniformément enduit avec le marqueur.
Remarque : Le programme d’installation dans le présent protocole utilise un logiciel d’acquisition/imagerie PrairieView 5.4. - Ouvrez la fonction de Libération Galvo calibrage dans le menu outils – étalonnage/alignement du logiciel. Parcourir le tutorial graver des taches pour la calibration spatiale de la seconde paire de miroir de galvanomètre.
- Dans le tutoriel de brûler les taches , choisissez les laser à 405 nm, choisissez une puissance de stimulation laser de 400 et une durée de stimulation de 20 m, cela devrait donner des petits (~ 1-5 µm de diamètre) des trous dans le marqueur rouge.
Remarque : Paramètres tels que le ~ 2-4 mW et 1 à 10 ms sont généralement utilisés, mais les paramètres sont déterminés par l’échantillon. Réglages de puissance PA-Nic photo-stimulation risquent d’être nettement inférieur à la puissance requise lors de l’étalonnage pour l’ablation d’un trou visible dans la diapositive du marqueur rouge. Cette routine de calibration est utile pour localiser la photostimulation taches mais ne doit pas être utilisée pour déduire les volumes photostimulation absolue au cours de réactions physiologiques. - Sélectionnez mise à jour de stimuler et d’actualiser l’image après que le point central brûle et déplacez le repère rouge rond sur l’emplacement réel du spot. Procéder ainsi pour le point central, la place de centre droit, le point central inférieur et enfin pour une grille de neuf points (tous les coins et bords ainsi que le centre de l’image).
Remarque : Le centre, à droite et emplacements inférieurs de spots corrigés déterminent les tensions de galvanomètre de stimulation pour définir le véritable centre et le X et le Y facteurs d’échelle pour correspondre à la paire de miroir de stimulation à la paire de miroir d’imagerie. Le logiciel à l’échelle et mettre à jour, toutes les expériences de MarkPoints ultérieures effectuées à des réglages de zoom différents du zoom de calibration spatiale.
- Dans le tutoriel de brûler les taches , choisissez les laser à 405 nm, choisissez une puissance de stimulation laser de 400 et une durée de stimulation de 20 m, cela devrait donner des petits (~ 1-5 µm de diamètre) des trous dans le marqueur rouge.
- Testez l’étalonnage en ouvrant la fenêtre MarkPoints et activer manuellement les paramètres de stimulation dans les zones définies dans une nouvelle zone de l’échantillon. S’assurer que le fichier correct, dernier étalonnage est chargé dans la fenêtre de MarkPoints . Activer la fonction MarkPoints/groupe ou d’une Série de MarkPoints à une souillure défini ou utiliser la fonction Live/Ablation droite/gauche, cliquez sur la souris n’importe où sur l’image pendant balayage direct pour appliquer une impulsion d’essai et à vérifier l’étalonnage correct.
Remarque : Maintenant, la gravure laser spot doit être parfaitement centrée sur l’indicateur MarkPoints . - Surveiller et enregistrer l’activation de la puissance des impulsions laser et de la durée temporelle en puisant au large de la tension dans le programme VoltageRecord (voir l’étape 1.1.4). De même, enregistrer la position de chaque point de stimulation à l’aide d’un signal de tension à l’échelle les signaux de rétroaction provenant de la paire de miroirs de galvanomètre de photo-stimulation.
2. préparation de la Nicotine Photoactivatable (PA-Nic)
- Extraire une partie aliquote de médicaments lyophilisés photoactivatable du stockage.
Remarque : Le protocole suivant est spécifique pour PA-Nic ; ajuster au besoin pour d’autres drogues photoactivatable. Bien que PA-Nic démontre une stabilité exceptionnelle5, prendre des précautions raisonnables pour protéger contre l’exposition à une lumière vive pendant la préparation et/ou expériences. Ceci peut être accompli en opérant simplement dans la pénombre ; Il n’est pas nécessaire de limiter à une lumière tamisée rouge. -
Effectuer une application locale de PA-nic.
- Tirez une micropipette de verre d’un diamètre de l’ouverture de 20 à 40 µm avec un extracteur de pipette programmable.
- Filtrer ~ 1 mL de solution d’enregistrement avec un filtre de 0,22 µm. Remettre en suspension une quantité de PA-Nic dans la solution d’enregistrement filtré pour obtenir une concentration finale de 2 mM. Par exemple, dissoudre une partie aliquote de 100 nmol lyophilisé dans 50 µL de solution d’enregistrement filtré.
Remarque : Une composition de la solution suggérée d’enregistrement se trouvent dans ces dernières publications5,6 , employant la photolyse PA-Nic. - Remblayer la pipette en application locale avec 50 µL de 2 mM PA-nic.
- Fixez la pipette d’application locale dans un porte-pipette monté sur un micromanipulateur. Raccordez le titulaire pipette via tuyau approprié à un système d’éjection de pression susceptible d’application basse pression soutenue (1 à 2 lb/po2).
- En utilisant le micromanipulateur, manœuvrer la pipette d’application locale dans la solution d’enregistrement extracellulaire et la position du bout de la pipette au-dessus du tissu de cerveau de souris situé environ 50 μm de la cellule d’intérêt. Consulter un rapport antérieur pour un protocole détaillé de préparation de tranches de cerveau de souris et patch clamp enregistrements8.
- Vérifiez que les paramètres de l’application en appuyant brièvement (1 à 2 lb/po2). Il devrait y avoir peu ou pas de déplacement de la cellule d’intérêt. En cas de déplacement important, repositionner la pipette d’application locale plus loin (dans le sens latéral ou axial) de la cellule d’intérêt.
- Après la réalisation de patch clamp de la cellule entière stable (détails qui figurent dans une publication antérieure8), tourner sur l’application de basse pression (1 à 2 livres par pouce carré) à l’aide de l’interrupteur manuel approprié sur le dispositif d’éjection. Saturer le tissu qui entoure la cellule avec PA-Nic pendant 1-2 min avant de passer à l’étape suivante.
-
Effectuer la demande de bain (surfusion) de PA-Nic à la tranche de cerveau.
- Dissoudre une quantité de PA-Nic dans un volume de solution appropriée pour la recirculation continue donner une concentration finale de 100 μM d’enregistrement. Par exemple, dissoudre un 1 μmol aliquote dans 10 mL de solution d’enregistrement à l’aide d’un tube standard de 15 mL.
- Commencer à recirculation de la solution de PA-Nic à raison de 1,5 à 2 mL/min en ouvrant le contrôle du flux approprié dans le système de perfusion. Recirculation se produit pendant la durée de l’enregistrement. Pour conserver la précieuse drogue, minimiser le volume de recirculation à l’aide de tubes avec un diamètre intérieur minimal, et/ou en raccourcissant la longueur totale du tuyau utilisé dans le système de perfusion.
Remarque : En prenant ces mesures, le volume de recirculation de bain peut être réduit à 5 mL de solution de PA-Nic. PA-Nic solutions peuvent souvent être utilisées pour les deux jours pendant la même semaine d’enregistrement si stocké abri de la lumière à 4 ° C. - Au cours de recyclage, sans interruption bulle la solution avec carbogen (5 % O2, 95 % CO2) et maintenir la température du bain à 32 ° C.
- Conserver la tranche de cerveau dans la solution d’enregistrement tout en travaillant avec PA-Nic en conditions de faible éclairage.
3. imagerie des neurones avec 2 photons Laser, microscopie à balayage
- Effectuer la visualisation direct de la cellule.
- Identifier/visualiser un neurone habenula médial (MHb) à l’aide de la lumière transmise ou infra-rouge interférentiel différentiel contraste optique (IR/DIC) et une caméra vidéo et d’établir un enregistrement de serrage patch stable à germes entiers. Consulter un protocole précédent pour plus d’informations sur les enregistrements de patch clamp de neurones dans le cerveau de souris parfaitement préparé tranches8.
- Après avoir établi la résistance élevée (> 1 GΩ) configuration de cellule-attachée, mais avant rodage, de changer la configuration et le logiciel pour le mode de balayage au laser.
- Après le rodage, utilisez numérisation laser pour vérifier qu’un colorant d’imagerie (diluée à une concentration finale de 100 à 200 µM dans une solution de pipetage intracellulaire par défaut décrit précédemment8) est passivement (par diffusion) remplir le neurone. Permettent de remplir les compartiments cellulaires pendant au moins 20-30 min avant de tenter des expériences qui nécessitent la visualisation de la teinture (p. ex., Alexa Fluor 488 en canal tube [PMT] vert photomultiplicateur, PMT 2 ; ou Alexa Fluor 568 ou 594 dans le canal rouge de PMT, PMT 1) les compartiments cellulaires en dehors du soma.
Remarque : Compartiments distaux (structures dendritiques, les épines, les axones, etc..) peut exiger de 30-40 min pour remplir complètement25. - Le logiciel Live Scan fonction permet de visualiser le neurone et le compartiment subcellulaire d’intérêt. Choisissez paramètres d’imagerie qui permettent juste vivent visualisation des fonctions neuronales. Manipuler des paramètres différents pour altérer ou de modifier la visualisation de l’affichage (contraste), résolution, rapport de signal-bruit (S/N) et temps d’acquisition image image :
-
Look-up-table (LUT). Ouvrez la fenêtre LUT à l’aide de l’icône appropriée sur le côté de n’importe quelle fenêtre de l’image. Une fois ouvert, ajuster la parole LUT (min) et plafond (max) réglage de la chaîne image spécifique pour améliorer la visualisation de contraste signal apparaît sur l’écran. Abaisser la valeur maximale de 1000 ~ (hors 4096, détection de 12 bits), ce qui aidera à sortir les signaux lors de la recherche tout d’abord pour les cellules, signal et structure gradateur.
Remarque : Ces paramètres affectent uniquement le signal affiché, pas les valeurs détecté/enregistré. L’oeil humain en général ne peut déposer contraste à niveaux de gris de ~ 5026. -
Zoom optique. Contrôles de logiciels permet de sélectionner 1 X zoom optique et utilisation panoramique contrôles pour localiser l’endroit désiré dans le tissu. Ce paramètre de zoom donne la plus grande place, analysés de champ et envoie les plus grands angles de tensions/balayage, des miroirs de galvanomètre.
Remarque : La configuration par défaut est pour un 12 x 12 mm champ de vision à l’intérieur de la tête de balayage qui se traduit par 12 mm divisé par le grossissement objectif à l’intérieur de l’échantillon. Par conséquent, un 60 x objectif rendements scanné images de 200 µm par face à 1 x zoom optique. Des valeurs plus élevées de zoom optique scan moins d’espace. zoom optique 2 x est souvent le réglage plus utile pour la visualisation de neurones ensemble. 4 x peut être utile pour visualiser les aspects subcellulaires des neurones. -
Nombre de pixels. En complément 1 x zoom optique, sélectionnez 1024 x 1024 pixels par ligne à l’aide de contrôles de logiciels. Définir le nombre de pixels par ligne dans l’image capturée et affiché de ne pas perdre possible de détails de la lentille de l’objectif. Utilisez les valeurs de pixel pratiques suivantes pour un x 60 / 1.0 objectif ouverture numérique (NA) : 1024 x 1024 pour zoom 1, 512 x 512 pour zoom 2 et 256 x 256 pour zoom 4. La taille de pixel de fin (~0.17 µm ; 12 mm/grossissement/zoom/pixels) devrait être la moitié ou moins de la résolution latérale définie par la lentille de l’objectif.
Remarque : La résolution de l’image n’est définie par la longueur d’onde du laser et le NA objective (0,4 µm résolution de deux photons excité [2PE] avec 920 nm et un objectif de NA 1,0)27. Les critères pour l’excitation complet NA, figurant sur l’objectif, c’est que l’intensité de2 1/e des matches de diamètre du faisceau laser (ou « remplit ») la pupille d’entrée (2 x tube longueur focale x NA / grossissement) du porte-objectif. La lentille du tube dans le système décrit ici a une longueur focale de 180 mm. -
Temps de pause de pixel . Contrôles de logiciels permet de sélectionner 4 µs pour le temps de pause de pixel, une valeur par défaut utile.
Remarque : Changer le temps de pause de pixels ne change pas le signal moyens détecté ; Il n’affecte que l’intra-pixel en moyenne et ces changements peuvent être visualisés par le biais de la qualité d’image via le S/N. Le temps de pause image pixel est toujours un multiple de 0,4 µs unités et pour habiter plu fois l’intensité 12-bit-limitée valeur de chaque pixel de l’image est la moyenne des échantillons 0,4 µs. Étant donné que le rapport signal/bruit s’améliore comme la racine carrée du nombre d’échantillons par temporisation pixel (4 µs équivaut à dix échantillons, ou 3.16-fold amélioration S/N), l’amélioration de la qualité d’image atteint des rendements décroissants des valeurs beaucoup plus grandes que 12 µs. -
Analyse de Rotation et la région d’intérêt (ROI). Régler l’angle de l’image à la rotation de 0° à l’aide de contrôles de logiciels (aucun action ne peuvent être nécessaires, comme la rotation 0° est le paramètre par défaut pour la plupart des systèmes d’imagerie). Si l’échantillon est placé dans une orientation « upside-down », sélectionnez rotation de 180° à l’image de « flip ».
Remarque : Rotation de l’image, à n’importe quel angle donné, peut fournir un meilleur ajustement pour toute la zone d’intérêt d’une cellule remplie. Rotation peut aussi donner une base plus claire pour l’alignement des changements structurels et pour effectuer des analyses ultérieures. En sélectionnant une région d’intérêt au sein de l’image numérisée à un paramètre de zoom donné (étape 3.1.4.2) conserve le nombre de pixels natif (étape 3.1.4.3), mais la restriction dans le nombre total de pixels et peut considérablement augmenter la cadence, fournissant meilleure résolution temporelle du signal change. -
Cadre en moyenne. Sélectionnez le réglage moyen départ cadre de 2 images à l’aide de contrôles de logiciels.
Remarque : Le contraste de l’image finale (S/N) est défini par les photons totales collecté/détectés dans les pixels de signal de l’image. Avec une moyenne de plusieurs trames d’images peut améliorer le rapport signal/bruit, pourvu que l’échantillon ne bouge pas ou n’est pas blanchie en imagerie. Le signal d’intérêt demeure la même valeur au cours de la trame en moyenne tandis que le bruit dans l’image est réduit par la racine carrée du nombre de cadres en moyenne. Petites structures dans des images de fluorescence nécessitent souvent inter-pixel en moyenne, combiner les pixels dans l’image (souvent appelés ROIs), et/ou cadre en moyenne. Cadre avec une moyenne de temps de numérisation par le nombre d’images une des augmentations choisit de moyenne.
-
Look-up-table (LUT). Ouvrez la fenêtre LUT à l’aide de l’icône appropriée sur le côté de n’importe quelle fenêtre de l’image. Une fois ouvert, ajuster la parole LUT (min) et plafond (max) réglage de la chaîne image spécifique pour améliorer la visualisation de contraste signal apparaît sur l’écran. Abaisser la valeur maximale de 1000 ~ (hors 4096, détection de 12 bits), ce qui aidera à sortir les signaux lors de la recherche tout d’abord pour les cellules, signal et structure gradateur.
- Utiliser les outils de Contrôle Pan Scan Rotationet Zoom optique pour orienter l’emplacement de l’échantillon pendant le balayage. Si moteur phase manipulation est nécessaire de positionner l’échantillon, éviter les tailles grand pas à l’axe X, Y et Z pour éviter les collisions objectif/condensateur, vibrations ou exposition du faisceau laser à surfaces réfléchissantes.
- Recueillir une Z-pile. À l’aide de l’outil Z-série , sélectionnez un départ et arrêt position qui contient la cellule d’intérêt. Sélectionnez une taille d’étape (1 µm) et puis l’image consécutivement le neurone dans chaque plan Z qui contient la cellule.
Remarque : Paramètres d’acquisition de Z-pile variera entre type de neurone et remplissage de colorant. Les paramètres optimaux pour l’acquisition de Z-pile doivent être déterminées indépendant des paramètres utilisés pour l’imagerie live. Acquisition de Z-pile peut être effectuée avant ou après les expériences d’optopharmacology. Si possible, faites acquisition Z-pile après optopharmacology pour éviter des dommages cellulaires induites par des 2PLSM et permettant un remplissage optimal de colorant de petits compartiments cellulaires.
4. laser la photolyse éclair durant les enregistrements électrophysiologiques
Remarque : Application de 405 nm ou puissances de laser 473 nm ≥ 1 mW produit phosphorescence l’intérieur du verre de lentilles d’objectif et condenseur. Cette lumière générée est directement liée à la puissance d’éclairage de laser ; l’émission est présente dans les fenêtres spectrales vertes et rouges et a des temps de vie des États excités dans la gamme de ms. Cet artefact de stimulation de fond est présentée dans tous les objectifs testés, dans l’eau à pendage lentilles de l’objectif de tous les grands fabricants de lentilles de l’objectif. Lentilles de condenseur produisent beaucoup phosphorescence plus élevé que les lentilles de l’objectif. Ce « signal » qui motive l’utilisation de coffrage mécanique pour la protection de la cathode PMT sensible l’arséniure de gallium phosphure (GaAsP) lors des événements de photo-stimulation. À l’aide d’un obturateur mécanique normalement fermé (fermé lors de la numérisation n’est pas activement) représente la meilleure solution pour la protection des refroidi GaAsP PMTs.
- Pour une géométrie de faisceau de type sablier photostimulation, enlever les lentilles de focalisation dans l’optique de rayon lumineux qui serait autrement étroit/se contracter le faisceau laser à son entrée dans la pupille d’entrée objectives.
- MarkPoints, sélectionnez le paramètre spot unique.
Remarque : Autres paramètres photo-stimulation (plusieurs spots, une grille de points, spirale balayage) sont possibles au sein de la MarkPoints. Seul point est la plus simple. Des buts expérimentaux et des différences biologiques peuvent nécessiter un réglage différent. - Mise à jour de l’image en utilisant l’option Live Scan image brièvement et de localiser la zone subcellulaire d’intérêt. Mettre à jour périodiquement l’image afin d’identifier toute potentielles dérives petites mise au point.
- Utilisez les commandes de logiciels pour augmenter le zoom optique (par ex., sélectionner un réglage de zoom optique plus élevé que celui en cours), si nécessaire, de visualiser les petites structures (c.-à-d., des épines ou des dendrites distaux).
- Placez le MarkPoints seul spot collimateur immédiatement adjacent (~0.5 μm) vers la membrane cellulaire. Pas lieu la photo-stimulation place directement sur une fonctionnalité cellulaire, car cela pourrait conduire à photovieillissement.
- Définir les paramètres de stimulation photo-utiliser les commandes de logiciels en MarkPoints. Appliquer les directives de départ comme suit : durée de 1 à 50 ms, 1-4 mW laser de puissance et ≥ 1 du procès.
- Sélectionnez Exécuter MarkPoints pour lancer le protocole MarkPoints et observer en temps réel d’acquisition de données électrophysiologie.
- Répétez les étapes 4.2-4,7 plusieurs fois pour évaluer la cohérence et la stabilité, ou absence de celui-ci, de l’amplitude de la réponse et la cinétique.
Résultats
Photolyse stimulation, la dose d’exposition (intensité et durée), lieu d’exposition et géométrie de la poutre sont des variables clés. Le système décrit dans cet article est capable de deux faisceaux de photostimulation différentes, réglables par déplacement une lentille/sortie du rayon lumineux photostimulation avant le faisceau pénètre dans le système de galvanomètre. Cette lentille, le faisceau de photostimulation asphyxiant la pupille d’entrée de la x 60 / 1,0 NA pendage vers l’eau [60 x WD] objectif, produisant un près-limitée par la diffraction, tache sub-µm dans le plan focal à l’intérieur de l’échantillon. Ceci est associé de photostimulation léger avec une forme de sablier, s’étendant au-dessus et en dessous le foyer symétriques par l’axe optique. Avec la lentille insérée dans le chemin d’accès, lumière laser photostimulation est axée sur la pupille d’entrée de l’objectif et s’arrête comme une poutre de type crayon. Ce faisceau, ce qui devrait être d’environ 10 µm de diamètre pour un objectif de 60 x, s’étend uniformément/verticalement tout au long de l’échantillon. Dans ce mode, l’intensité lumineuse à n’importe quel emplacement donné dans le spot de stimulation sera environ 1 % de l’intensité de ton petite près-diffraction-limited. Ainsi, des puissances supérieures de laser sont généralement requis lors de l’utilisation de ~ 10 µm tache stimulation. Pour toutes les expériences rapportées dans cet article, un faisceau de type sablier photostimulation servait.
La puissance de l’exemplaire livré peut être tracée contre le réglage de la tension d’entrée, après avoir mesuré la puissance du laser à l’échantillon à l’aide d’un wattmètre. Ces études utilisent un 60 x objectif WD avec une distance de travail de 2 mm, mais il n’est pas immergé dans l’eau pour les mesures de puissance afin d’éviter des dommages potentiels à l’élément détecteur. Lorsque les objectifs énumérés NA > 0,95 sont mesurées dans l’air (sans liquide d’immersion), il peut y avoir des pertes de réflexion totale interne à l’élément objectif de face avant en raison de l’indice inférieur (air). Dans ce cas, pour une mesure plus précise de puissance échantillon (pour corriger les pertes de réflexion totale interne), augmenter la puissance mesurée de la 1,0 NA objective (1.0/0,95)2 mesurée dans l’air. Figure 1 a montre un terrain typique d’entrée/sortie à 405 nm et 473 nm visible lasers qui sont incorporées dans le laser lancent système dans cette étude. Ces systèmes laser sont idéales pour le contrôle de dose de l’exposition photo-stimulation pour les raisons suivantes : (1) ils sont calibrés pour fournir la puissance directement linéaire par rapport à la tension d’entrée (0-5 V), (2) ils fournissent une opération obturateur silencieux (aucun laser sortie), et (3) ils ont rapide, contrôle de durée impulsion sub-ms intensité (réponse de 0,1 ms). Lorsque vous utilisez spot photo-stimulation avec un système laser/galvo, étalonnage systématique des taches de MarkPoints est une tâche essentielle. Figure 1 b (panneau de gauche) montre un système qui est hors d’étalonnage (point désiré de photo-stimuler n’entraîne pas une stimulation précise de ce point, comme indiqué par l’emplacement du burn-trou), avec un retour à un positionnement précis de la tache après l’étalonnage ( Figure 1 b, panneau de droite).
PA-Nic est modestement fluorescent (pic d’émission à ~ 510 nm), présentant une excitation efficace entre 350-450 nm (photons 1 excitation) ou 700-900 nm (excitation 2 photons)5. Pour visualiser des PA-Nic pendant l’application locale, PA-Nic (1 mM) a été appliqué près de tissu cérébral suivi d’imagerie simultanée du contexte de transmission sectionné optique (1) cerveau tissu via Dodt contraste et (2) la fluorescence émise d’excitation (900 nm) de PA-nic. PA-Nic 2PE fluorescence était facilement détectable au cours de l’éjection sous pression d’une pipette d’application locale (Figure 2 a). La nicotine et une monoalkylcoumarin, 7-carboxymethylamino-4-méthyl-coumarine, sont les principaux produits photochimiques de la réaction de photolyse PA-Nic5. En utilisant les mêmes paramètres/paramètres qui servaient aux PA-Nic d’imagerie d’imagerie, le tissu a été photographié lors de l’accouchement de la nicotine (1 mM) ou 7-carboxymethylamino-4-méthyl-coumarine (1 mM). Aucun signal fluorescent a été détectée (Figure 2 a, panneaux de moyennes et basses), démontrant la spécificité des résultats PA-Nic. Enfin, PA-Nic a été appliqué dans les tissus cérébraux et émission de fluorescence de PA-Nic était imagée (Figure 2 b). Cette approche confirme que PA-Nic est présente au sein de 100 à 200 µm de la pipette d’application locale. Ensemble, ces données confirment que PA-Nic est effectivement livré à cerveau tissulaire par application locale.
Enregistrements d’électrophysiologie avec 2PLSM simultanées pour la visualisation des structures cellulaires nécessite l’enquêteur à des considérations d’équilibre aux deux volets de l’expérience, et une fenêtre de temps étroit (~ 20 min) est souvent disponible pour valide acquisition de données échantillon provenant d’une cellule patchée. Sans tenir compte de visualisation cellulaire, il est conseillé pour commencer l’enregistrement dès que possible après que le rodage car enregistrement stabilité tend à diminuer avec le temps. Toutefois, quand l’imagerie est une exigence, considérations électrophysiologiques doivent permettre suffisamment de temps pour les augmentations de concentration de fluorescence en structures petites et éloignées. Ceci est illustré par l’examen d’une concentration de colorant remplissage courbe28, qui est parfois utile pour calculer quand un nouveau type de cellule d’imagerie. La figure 3 illustre plusieurs neurones exemple imagé comme Z-piles via 2PLSM et s’est effondrée dans une projection de l’intensité maximale à des fins de présentation. Figure 3 a montre des images de haute qualité où la morphologie neuronale semble être complet, bruit est réduit au minimum et débris n’interfère pas avec l’interprétation de la morphologie cellulaire. Figure 3 b montre des images d’une qualité inférieure, en raison d’un rapport de signal-à-fond inférieur et débris substantielle. Ces débris apparaît souvent sous la forme sphériques poches de fluorescence intense, résultant de l’éjection de l’imagerie de colorant de la pipette alors qu’il approchait de la cellule. Notamment, inclusion de 100µm PA-Nic dans le bain (lors de l’exécution des applications de bain) tend à réduire le ratio signal-à-fond et mène au contraste de l’image moins qu’optimales. Alexa Fluor 568 ou 594 est souvent très utile dans les expériences d’application locale comme un colorant finder ou comme un signal de référence/normalisation 2PE normalisant. Une longueur d’onde efficace pour l’excitation biphotonique de ces colorants est ~ 780 nm27, qui permet la visualisation simultanée de PA-Nic et identification des compartiments cellulaires. Cependant, cette longueur d’onde, n’évite pas complètement deux photons photolyse de PA-Nic5. Alexa Fluor 488 est avantageuse dans les expériences de bain-demande de PA-Nic ; lorsqu’il est excité avec un longueur d’onde adaptée ≥900 nm, photolyse de deux photons de PA-Nic5 peut être évitée tout en conservant de visualisation appropriée des compartiments cellulaires.
La figure 4 illustre les données d’exemple pour la photolyse éclair au laser PA-Nic localisée au MHb neurones dans des tranches de cerveau. Figure 4 a (panneaux supérieurs) montre un exemple d’une image de « référence », qui est une capture d’écran de la dernière image de 2PLSM prise avant que le protocole de MarkPoints a été exécuté, recouvert à l’emplacement de spot de photo-stimulation. Figure 4 a (abaisser panneaux image) montre une vue agrandie de la photo-stimulation spot superposées sur la morphologie cellulaire. La réponse électrophysiologique correspondante temps-corrélé à la photolyse PA-Nic est affichée dans le panneau du bas de la Figure 4 a. Des travaux antérieurs ont démontré que ces courants sont sensibles à la CNCDH antagonistes5. Figure 4 b montre des données représentatives de différentes cellules où photolyse spot unique ont été effectuée à un intervalle de 1 s ou 10 s. considérant qu’un intervalle de s 10 laisser des temps de récupération suffisant pour la ligne de base tenant actuel, un intervalle plus court de s 1 conduit à un augmentation progressive de l’exploitation actuelle alors que le protocole se dirigeait. L’augmentation actuelle suggère que la nicotine n’avaient pas assez de temps pour diffuser les éloigner du système avec l' intervalle de 1 Hz29. Cette réponse temporelle des analyses doivent être effectuées de novo sur n’importe quel nouveau type de cellule à l’étude, comme la neuropharmacologie de Nachr peut-être différer entre les types de cellules.
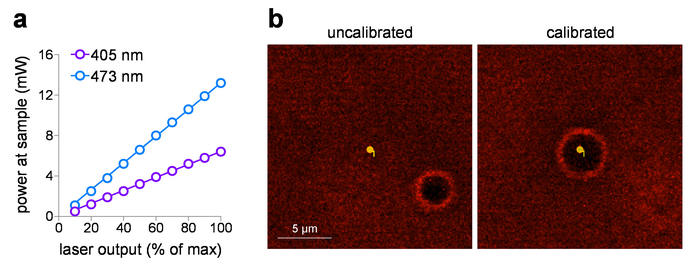
Figure 1 : étalonnage de laser de Photostimulation. (a) puissance de Photo-stimulation laser. Puissance sur le plan de l’échantillon (par un x 60 / 1.0 objectif de pendage vers l’eau NA) a été mesurée pour 405 nm et lasers de photo-stimulation à 473 nm lors du réglage de sortie indiquée. (b) Photo-stimulation laser tarage. Capture d’écran images montrent la relation spatiale entre l’endroit conforme photo-stimulation et l’emplacement correspondant où photo-stimulation qui s’est produite (burn-trou) avant (à gauche) et après (à droite) étalonnage en cours d’exécution dans MarkPoints. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
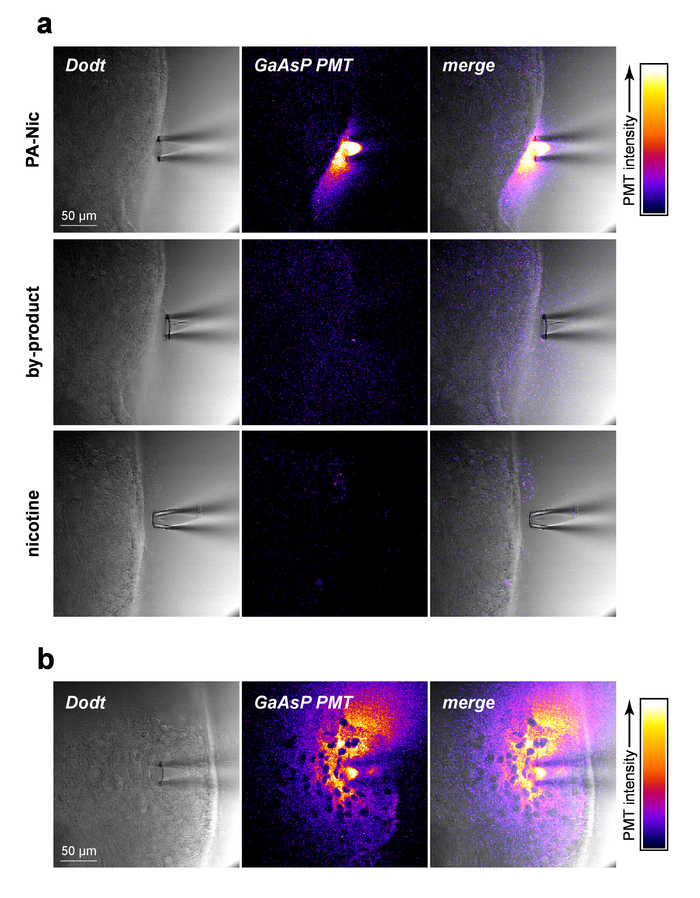
Figure 2 : PA-Nic locale application. (un) détection de PA-Nic un local application pipette. 1 mM PA-Nic, sous-produit de la photolyse ou la nicotine ont été dissous dans l’ACSF, chargé dans une pipette d’application locale et distribué sur les tissus du cerveau au cours de la 2PLSM (excitation de 900 nm) d’imagerie utilisant les mêmes paramètres d’imagerie pour chaque médicament. Image de Dodt contraste transmission à balayage laser indique la tissu/pipette alors qu’une cathode GaAsP PMT a été utilisée pour capturer l’émission de fluorescence. (b), PA-Nic (1 mM) a été perfusé dans les tissus cérébraux et imagé par l’intermédiaire de 2PLSM comme (un) pour montrer la propagation latérale de PA-Nic à l’aide de sa fluorescence intrinsèque. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
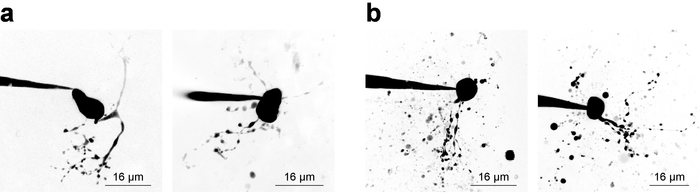
Figure 3 : Acquisition d’images de microscopie à balayage de 2 photons laser. (a) Z 2PLSM optimale-piles. Deux exemples de projections de 2PLSM Z-pile intensité maximale sont constatées pour MHb neurones avec dendrites bien résolues et peu ou pas de débris interférentes. (b) 2PLSM sous-optimal Z-piles. Deux exemples de projections de 2PLSM Z-pile intensité maximale sont indiqués pour les neurones MHb entourés de débris (colorant expulsé de la pipette au cours de l’approche de la cellule). Ces images sont plus difficiles à interpréter que les images comme celles montrées dans (un). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
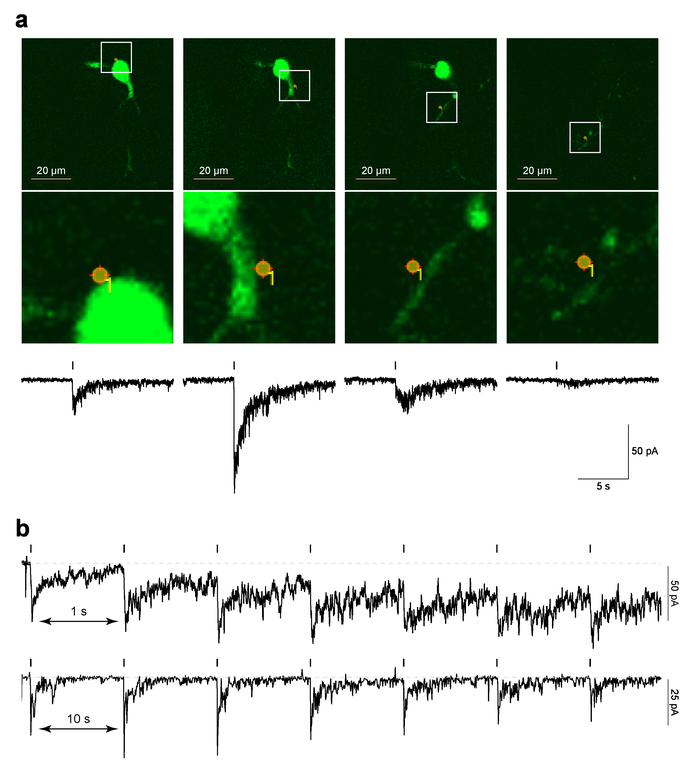
Figure 4 : photolyse éclair au Laser de PA-NIC (un) MarkPoints référence les images et les courants entrants évoquées par photolyse de PA-Nic. À un neurone MHb, images de référence brut sont représentées MarkPoints essais de photo-stimulation à un seul endroit cellulaire (indiqué). Notez que pour certains emplacements de photo-stimulation (l’image de droite dans cette série), la structure dendritique est au point mais le soma et la dendrite proximal ne le sont pas. En dessous de chaque image de référence, le courant entrant uncaging évoquée par la nicotine est tracé. (b), inter-stimulus intervalles pour PA-Nic photolyse. Enregistrements Exemplar sont indiqués pour les neurones MHb où la nicotine a été à plusieurs reprises uncaged au même endroit perisomatic avec un intervalle de relance inter de 1 s ou 10 s. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Le choix de la méthode d’application/livraison PA-Nic est l’étape la plus critique avec cette technique de photo-stimulation localisée. Les deux méthodes, la demande de bain et la perfusion locale, chacune offre des limitations et des avantages distincts. Le choix est largement affecté par le niveau d’expression fonctionnelle CNCDH dans le type de cellules d’intérêt. Il est souvent préférable d’utiliser l’application bain lorsque les niveaux d’expression fonctionnelle sont élevés, comme application de bain permet une concentration uniforme sonde entourant la cellule enregistrée, facilitant l’interprétation des données. Application de bain élimine également le besoin d’une deuxième pipette de perfusion dans les tissus, faciliter l’ensemble du processus. Toutefois, l’application bain de cher composés coûtera plus cher par expérience.
Communément, dépannage consiste à essayer de comprendre pourquoi aucune activation de la CNCDH n’est vu la photolyse éclair suivante. Lorsque vous travaillez avec un type de cellule qui n’a pas été étudié précédemment avec PA-Nic, l’enquêteur doit exécuter puff-application locale d’acétylcholine ou la nicotine pour déterminer si les récepteurs suffisantes sont fonctionnellement exprimé5. Pour valider que le système est capable de détecter les réponses de la photolyse, expériences de contrôle doit être effectuées dans les neurones habenula médial qui expriment des grandes quantités de récepteurs30. Dans cette région du cerveau, application de bain PA-Nic est possible, ce qui est préférable pour des expériences de validation. Seulement après l’exécution de ces expériences de validation doit on passer à un type de cellules peu étudiée. Si le système expérimental a été validé et réponses restent très petites ou indétectable, il peut être justifié d’augmenter la concentration de PA-Nic, augmenter l’intensité du flash ou la durée de l’impulsion, ajouter un modulateur allostériques positifs CNCDH pour améliorer la CNCDH activité6, ou une combinaison de ceux-ci.
Occasionnellement, libération de réponses sont trop grandes, avec activation de la CNCDH significative résultant en tension indirecte gated Na+ canal activation et debloquées courants entrants en raison de la pince espace pauvre. Ces artefacts, qui complètement occulter la CNCDH courants entrants et rendent l’interprétation des données, peuvent être éliminés par l’inclusion de QX-314 (2 mM) dans la pipette de l’enregistrement. Ils peuvent également être éliminés en réduisant la concentration de PA-Nic ou en réduisant l’intensité du flash ou la durée de l’impulsion. Dans toutes les expériences de stimulation-photo lumière visible, doit être attentif lors du choix des sites de stimulation afin d’éviter les imprévus stimulation/photolyse au-dessus ou au-dessous du plan focal désiré. De plus et quand il y a lieu, la puissance du laser doit toujours être titrée afin de reproduire les réactions physiologiques. Il est particulièrement important d’être conscient de l’axe z photostimulation lorsque vous travaillez avec des ligands en cage, comme ligands qui sont activés au-dessus/en dessous le foyer peuvent encore diffus et interagir avec le système biologique (c.-à-d. les récepteurs, ) à l’étude.
La photolyse éclair laser PA-Nic peut ne pas convenir pour tous les enquêteurs, comme plusieurs limitations existent. Le premier est le coût relativement élevé d’une installation convenable. Lorsque vous travaillez avec des tranches de cerveau intact, uncaging près de structures de faible diamètre, comme dendrites nécessite un système de visualisation sophistiquées comme un microscope 2 photons. Mis à part le coût élevé d’un TI : Sapphire, tunable laser pulsé de l’IR pour la microscopie 2 photons performante, un système de double-galvanomètre capable de deux faisceaux laser de positionnement indépendamment plus augmente les coûts de système. Les coûts du système total peuvent être réduites en utilisant un système de construction artisanale si l’enquêteur a suffisamment expertise et le temps de construire, de dépanner et maintenir un tel système. Une autre limite souvent implique l’expression fonctionnelle CNCDH faible, qui peut être partiellement atténuée par la démarche comme mentionné ci-dessus, mais cela ne peut pas garantir le succès. En général, si on ne peut pas mesurer les courants de ligand-activé après puff-application d’agonistes, photolyse éclair PA-Nic sous bride de tension ne peuvent pas donner des résultats acceptables. Une troisième limite implique l’intrinsèque fluorescence de PA-nic. PA-Nic absorbe la lumière de ~ 405 nm et émet dans la même gamme que la protéine fluorescente verte (GFP) ou Alexa 4885. Lorsque les concentrations de PA-Nic dépassent ~ 1 mM, cette propriété de fluorescence peut rendre difficile de visualiser simultanément les structures neuronales. Pour atténuer ce, il est essentiel d’être en mesure de contrôler facilement le débit de PA-Nic de la pipette de perfusion. Périodiquement, le flux de PA-Nic a été arrêté pour permettre à des molécules fluorescentes diffuser loin. Cela a permis redéfinition du neurone pour vérifier la position au comptant de la poutre de libération. Une quatrième limitation potentielle de mentionner implique l’utilisation de 405 nm lumière de photolyse. Courtes longueurs d’onde comme 405 nm sont plus sujettes à la dispersion dans le tissu complex comme une tranche de cerveau. Ainsi, à une intensité donnée du flash et la durée, libération des amplitudes de réponse et cinétique de la décomposition peuvent être affectées différemment par la profondeur de la libération de la mise au point au sein de la tranche. Conclusions sur les aspects biologiques de Nachr devraient tenir compte de cette mise en garde importante.
Cette technique de photolyse éclair laser localisée a récemment été utilisée afin de découvrir de nouveaux détails sur la neurobiologie de la CNCDH. Par exemple, l’exposition chronique à la nicotine améliore perisomatic et fonction de la CNCDH dendritiques en médial habenula neurones5. Il était également utilisé pour aider à démontrer, pour la première fois, que les neurones glutamatergiques de l’aire tegmentale ventrale expriment Nachr fonctionnels dans leur perisomatic et les compartiments cellulaires dendritiques6. Il y a que beaucoup de potentiels futurs usages de cette technique, et l’approche pourrait être appliquée à d’autres types de neurones clés qui sont connues pour Nachr exprès, comme les neurones pyramidaux du cortex31 ou interneurones dans le cortex cérébral32, striatum33 et hippocampe19. Cette technique pourrait également être combinée avec gène pharmacologie et/ou CNCDH édition34 pour localiser les sous-types de récepteurs spécifiques aux différents compartiments neuronales. L’approche peut être facilement adaptée à d’autres composés de coumarine-cage, y compris, mais non limité à, ceux qui sont développés en parallèle avec PA-Nic5. Enfin, la photolyse éclair PA-Nic pourrait un jour être utilisé chez un animal éveillé/se comporter pour étudier l’action de la nicotine dans les paradigmes nouveaux pharmacologie comportementale.
Déclarations de divulgation
D.L.W. est un consultant rémunéré pour la microscopie de Fluorescence Bruker Nano.
Remerciements
Les auteurs remercient les membres du laboratoire des chercheurs principaux du Nord-Ouest suivants : Ryan Drenan, D. James Surmeier, Yevgenia Kozorovitskiy et entrepreneur de l’Anis. Ce travail a été soutenu par le nous National Institutes of Health (NIH) (subventions DA035942 et DA040626 à MDM), la Fondation PhRMA (bourse à M.C.A) et HHMI.
matériels
| Name | Company | Catalog Number | Comments |
| Instruments, Consumables, and Miscellaneous Chemicals | |||
| Multiclamp 700B | Molecular Devices Corp. | Patch clamp amplifier | |
| Pneumatic Picopump | World Precision Instruments | PV820 | |
| Micropipette puller | Sutter Instrument Co | P-97 | |
| Temperature Controller | Warner Instruments | TC-324C | |
| Vibrating blade microtome | Leica Biosystems | VT1200S | |
| Ultrafree-MC Centrifugal Filter | MilliporeSigma | UFC30GV0S | internal solution filter |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B150F-4 | patch and local application pipette |
| (-)-Nicotine hydrogen tartrate salt | Glentham | GL9693 | nicotine salt |
| 7-carboxymethylamino-4-methyl coumarin | Janelia Research Campus | PA-Nic by-product | |
| 1-[7-[bis(carboxymethyl)- amino]coumarin-4-yl]methyl-nicotine | Janelia Research Campus | PA-Nic | |
| Euthasol (Pentobarbital Sodium and Phenytoin Sodium) | Virbac | ANADA #200-071 | |
| Alexa FluorTM 488 Hydrazide | ThermoFisher | A10436 | green fill dye |
| Alexa FluorTM 568 Hydrazide | ThermoFisher | A10437 | red fill dye |
| 6-carboxy-AF594 (Alexa Fluor 594) | Janelia Research Campus | red fill dye | |
| QX 314 chloride | Tocris | 2313 | voltage-gated sodium channel blocker |
| Power Meter | ThorLabs | S120C | |
| Name | Company | Catalog Number | Comments |
| Chemicals for Solutions | |||
| N-Methyl-D-glucamine | Sigma | M2004 | |
| Potassium chloride | Sigma | P3911 | |
| Sodium phosphate monobasic monohydrate | Sigma | S9638 | |
| Sodium bicarbonate | Sigma | S6014 | |
| HEPES | Sigma | H3375 | |
| D-(+)-Glucose | Sigma | G5767 | |
| (+)-Sodium L-ascorbate | Sigma | A4034 | |
| Thiourea | Sigma | T8656 | |
| Sodium pyruvate | Sigma | P2256 | |
| Magnesium sulfate heptahydrate | Sigma | 230391 | |
| Calcium chloride dihydrate | Sigma | 223506 | |
| Sodium chloride | Sigma | S9625 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma | E3889 | |
| Adenosine 5′-triphosphate magnesium salt | Sigma | A9187 | |
| Guanosine 5′-triphosphate sodium salt hydrate | Sigma | G8877 | |
| Name | Company | Catalog Number | Comments |
| Components of 2-Photon Microscope | |||
| Ultima Laser Scanner for Olympus BX51 Microscope | Bruker Nano, Inc. | imaging software and galvos | |
| Imaging X-Y galvanometers | Cambridge Technology | ||
| Mai Tai HP1040 | Spectra-Physics | Tuneable IR laser | |
| Pockels cell M350-80-02-BK with M302RM Driver | Conoptics, Inc. | for IR laser attenuation | |
| Integrating Sphere Photodiode Power Sensor | Thorlabs, Inc | laser power pick-off photodiode | |
| Uncaging X-Y galvanometers | Cambridge Technology | ||
| Helios 2-Line Laser Launch | Bruker Nano, Inc. | uncaging laser components | |
| OBIS LX/LS 405 nm (100 mW) | Coherent, Inc. | ||
| OBIS LX/LS 473 nm (75 mW) | Coherent, Inc. | ||
| Point-Photoactivation / Fiber Input Module for Limo Sidecar - Uncaging | Bruker Nano, Inc. | ||
| Name | Company | Catalog Number | Comments |
| Upright Microscope | Olympus | BX51WIF | Upright microscope chasis |
| Objective: Olympus M Plan FL 10x; NA 0.3 WD 11 mm | Olympus | 10x objective | |
| Objective: Olympus M Plan Fluorite 60x/1.0 WD=2mm NIR | Olympus | 60x water-dipping objective | |
| X-Cite 110, four-LED LLG coupled epi-fluorescence light source | Excelitas Technologies | LED Light Source | |
| Epi-Fluorescence Filter: ET-GFP (FITC/CY2) for Epi-Turret | Chroma Technologies | LED Filter for blue light excitation | |
| Epi-Fluorescence Filter: ET-DsRed (TRITC/CY3) for Epi-Turret | Chroma Technologies | LED Filter for green light excitation | |
| B&W CCD camera; Watec, 0.5in B/W CCD | Watec Co., LTD. | CCD camera for patch clamp recording | |
| Name | Company | Catalog Number | Comments |
| External Detectors - Dual Reflected Emission - Olympus Upright (Multi-Alkali, GaAsP) | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | red channel PMT |
| 595/50m | Chroma Technologies | red channel emission filter | |
| 565lpxr | Chroma Technologies | dichroic beam splitter | |
| GaAsP end-on PMT | Hamamatsu | 7422PA-40 | green channel PMT |
| 525/70m | Chroma Technologies | green channel emission filter | |
| High-Speed Shutter for Hamamatsu H7422 PMT | Vincent Associates / Bruker | 517329 | PMT shutter mount |
| Name | Company | Catalog Number | Comments |
| Dodt Gradient Contrast Transmission Detection Module | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | Dodt PMT |
Références
- Zhang, C., et al. Cholinergic tone in ventral tegmental area: Functional organization and behavioral implications. Neurochemistry International. 114, 127-133 (2018).
- Sarter, M., Parikh, V., Howe, W. M. Phasic acetylcholine release and the volume transmission hypothesis: time to move on. Nature Reviews Neuroscience. 10 (5), 383-390 (2009).
- Coyle, J. T., Price, D. L., DeLong, M. R. Alzheimer's disease: a disorder of cortical cholinergic innervation. Science. 219 (4589), 1184-1190 (1983).
- Katz, B., Thesleff, S. A study of the desensitization produced by acetylcholine at the motor end-plate. Journal of Physiology. 138 (1), 63-80 (1957).
- Banala, S., et al. Photoactivatable drugs for nicotinic optopharmacology. Nature Methods. 15 (5), 347-350 (2018).
- Yan, Y., et al. Nicotinic Cholinergic Receptors in VTA Glutamate Neurons Modulate Excitatory Transmission. Cell Reports. 23 (8), 2236-2244 (2018).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. α4α6β2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Molecular Pharmacology. 84 (3), 393-406 (2013).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. Journal of Visualized Experiments. (68), (2012).
- Ren, J., et al. Habenula "cholinergic" neurons co-release glutamate and acetylcholine and activate postsynaptic neurons via distinct transmission modes. Neuron. 69 (3), 445-452 (2011).
- Koppensteiner, P., Melani, R., Ninan, I. A Cooperative Mechanism Involving Ca(2+)-Permeable AMPA Receptors and Retrograde Activation of GABAB Receptors in Interpeduncular Nucleus Plasticity. Cell Reports. 20 (5), 1111-1122 (2017).
- Zhang, J., et al. Presynaptic Excitation via GABAB Receptors in Habenula Cholinergic Neurons Regulates Fear Memory Expression. Cell. 166 (3), 716-728 (2016).
- Chen, E., et al. Altered Baseline and Nicotine-Mediated Behavioral and Cholinergic Profiles in ChAT-Cre Mouse Lines. The Journal of Neuroscience. 38 (9), 2177-2188 (2018).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter increased acetylcholine release in the hippocampus. Neuroscience. 218, 1-11 (2012).
- Ting, J. T., Feng, G. Recombineering strategies for developing next generation BAC transgenic tools for optogenetics and beyond. Frontiers in Behavioral Neuroscience. 8, 111 (2014).
- Crittenden, J. R., Lacey, C. J., Lee, T., Bowden, H. A., Graybiel, A. M. Severe drug-induced repetitive behaviors and striatal overexpression of VAChT in ChAT-ChR2-EYFP BAC transgenic mice. Frontiers in Neural Circuits. 8, 57 (2014).
- Kolisnyk, B., et al. ChAT-ChR2-EYFP mice have enhanced motor endurance but show deficits in attention and several additional cognitive domains. The Journal of Neuroscience. 33 (25), 10427-10438 (2013).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter enhances dendritic complexity of adult-born hippocampal neurons and improves acquisition of spatial memory during aging. Neurobiology of Aging. 36 (5), 1881-1889 (2015).
- Denk, W. Two-photon scanning photochemical microscopy: mapping ligand-gated ion channel distributions. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6629-6633 (1994).
- Khiroug, L., Giniatullin, R., Klein, R. C., Fayuk, D., Yakel, J. L. Functional mapping and Ca2+ regulation of nicotinic acetylcholine receptor channels in rat hippocampal CA1 neurons. The Journal of Neuroscience. 23 (27), 9024-9031 (2003).
- Filevich, O., Salierno, M., Etchenique, R. A caged nicotine with nanosecond range kinetics and visible light sensitivity. Journal of Inorganic Biochemistry. 104 (12), 1248-1251 (2010).
- Tochitsky, I., et al. Optochemical control of genetically engineered neuronal nicotinic acetylcholine receptors. Nature Chemistry. 4 (2), 105-111 (2012).
- Wokosin, D. L., Squirrell, J. M., Eliceiri, K. W., White, J. G. Optical workstation with concurrent, independent multiphoton imaging and experimental laser microbeam capabilities. Review of Scientific Instruments. 74 (1), 193-201 (2003).
- Plotkin, J. L., Day, M., Surmeier, D. J. Synaptically driven state transitions in distal dendrites of striatal spiny neurons. Nature Neuroscience. 14 (7), 881-888 (2011).
- Galtieri, D. J., Estep, C. M., Wokosin, D. L., Traynelis, S., Surmeier, D. J. Pedunculopontine glutamatergic neurons control spike patterning in substantia nigra dopaminergic neurons. Elife. 6, (2017).
- Yasuda, R., et al. Imaging calcium concentration dynamics in small neuronal compartments. Science STKE. (219), pl5 (2004).
- Inoue, S., Spring, K. . Video microscopy: The fundamentals. , 163-186 (1997).
- Zipfel, W. R., Williams, R. M., Webb, W. W. Nonlinear magic: multiphoton microscopy in the biosciences. Nature Biotechnology. 21 (11), 1369-1377 (2003).
- Maravall, M., Mainen, Z. F., Sabatini, B. L., Svoboda, K. Estimating intracellular calcium concentrations and buffering without wavelength ratioing. Biophysical Journal. 78 (5), 2655-2667 (2000).
- Wathey, J. C., Nass, M. M., Lester, H. A. Numerical reconstruction of the quantal event at nicotinic synapses. Biophysical Journal. 27 (1), 145-164 (1979).
- Shih, P. Y., et al. Differential expression and function of nicotinic acetylcholine receptors in subdivisions of medial habenula. The Journal of Neuroscience. 34 (29), 9789-9802 (2014).
- Verhoog, M. B., et al. Layer-specific cholinergic control of human and mouse cortical synaptic plasticity. Nature Communications. 7, 12826 (2016).
- Koukouli, F., et al. Nicotine reverses hypofrontality in animal models of addiction and schizophrenia. Nature Medicine. 23 (3), 347-354 (2017).
- Xiao, C., et al. Chronic nicotine selectively enhances α4β2* nicotinic acetylcholine receptors in the nigrostriatal dopamine pathway. The Journal of Neuroscience. 29 (40), 12428-12439 (2009).
- Peng, C., et al. Gene Editing Vectors for Studying Nicotinic Acetylcholine Receptors in Cholinergic Transmission. European Journal of Neuroscience. , (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon