Method Article
Зондирование никотиновых ацетилхолиновых рецепторов функции срезы мозга мыши через лазерной вспышки фотолиза Photoactivatable никотина
В этой статье
Резюме
Эта статья представляет метод для изучения никотиновых ацетилхолиновых рецепторов (nAChRs) в срезы мозга мыши, никотин uncaging. При сочетании с одновременным патч зажим записи и 2-Фотон лазерной сканирующей микроскопии, никотин uncaging соединяет никотиновых рецепторов функция с клеточной морфологии, обеспечивая более глубокое понимание холинергических нейробиологии.
Аннотация
Ацетилхолин (ACh) действует через рецепторов модулируют разнообразные нейронные процессы, но она была сложной связать функции рецепторов ACh с субцеллюлярные расположение внутри клетки, где эта функция осуществляется. Для изучения субцеллюлярные расположение никотиновых рецепторов ACh (nAChRs) в родной мозговой ткани, оптический метод был разработан для точного выхода никотина в отдельных местах вблизи нейрональных мембран во время электрофизиологических записи. Патч зажат нейронов в мозге, ломтики заполнены с красителя визуализировать их морфология во время 2-Фотон лазерная сканирующая микроскопия, и никотин uncaging выполняется с вспышка, сосредоточив внимание луч лазера 405 нм у одного или нескольких клеточных мембран. Сотовый текущего отклонения измеряются, и трехмерные (3D) изображения с высоким разрешением записанные нейрона производится чтобы примирение nAChR ответы с клеточной морфологии. Этот метод позволяет для детального анализа функционального распределения nAChR в сложных ткани препаратов, перспективных для расширения понимания холинергических синапсах.
Введение
Холинергических сигнализации модулирует многочисленные процессы мозга, включая внимания управления, волевые движения и вознаграждение1,2. Препаратов, улучшающих передачи ацетилхолина (ACh) используются для лечения когнитивных нарушений, связанных с болезнью Альцгеймера, подразумевая важную роль для холинергических систем в познании3. Улучшение понимания холинергических рецепторов и схем в государствах, здорового и больного может привести к более терапевтические подходы для нескольких неврологических заболеваний/расстройств.
Никотиновых рецепторов ACh (nAChRs) — семейство лиганд закрытый ионных каналов, которые поток катионы в ответ ACh эндогенных или экзогенных никотина от табачных изделий. Учитывая тот факт, что они были среди первых нейромедиатора рецепторов к быть описано4, nAChR фармакологии и расположение в мышечных волокон понятных для мышц типа рецепторов. Напротив сравнительно мало что известно о фармакологии и внутриклеточных распределение родной nAChRs в мозге. Этот пробел в знаниях выступил недавно развивающихся роман химической зонд, который позволяет пространственно ограниченных и быстрой активации nAChRs в ткани мозга во время сотовой изображений и электрофизиологические записи5. Здесь описаны ключевые методологические этапы такой подход, с учетом общей цели укрепления способности для подключения nAChR функция с нейронные структуры.
Photoactivatable никотина (ПА-Nic; химическое название: 1-[7-[bis(carboxymethyl)-амино] кумарина-4-ил] метил никотин) могут быть photolyzed с ~ 405 нм лазер вспышки эффективно выпустить никотина5,6. До uncaging, ПА-Nic стабилен в растворе и экспонаты не неприятных фармакологических или фотохимического особенности5. После фотолиз выпущенный никотина предсказуемо активирует nAChRs и uncaging побочные продукты являются фармакологически инертных5. Непрерывном лазер используется в качестве источника света фотолиза с выходной мощностью > 1 МВт измеряется на образце. При локализации, целенаправленных фото стимуляции сочетается с возможность обнаружения клеточных мембран с 2-Фотон лазерной сканирующей микроскопии (2PLSM), и два ключевых преимущества этого подхода будут полностью реализованы: скорость фотолиз и пространственной точностью.
Во многих отношениях фотолиз PA-Nic превосходит другие методы доставки nAChR лиганды рецепторов в пределах срезы мозга. Такие подходы включают ванна приложения7 и локальных доставки через фугу дозатор8. Первый подход, как правило, переоценить долгосрочные эффекты препарата прикладной, в то время как последний подход может страдать от изменчивости в ответ кинетики между испытаниями и ячейках. Ни один из этих альтернативных подходов адекватно могут различать рецептор деятельность в разных местах сотовой от же нейрона. Optogenetically активированный выпуска ACh был использован для исследования родной nAChRs9,10,11, но не оказалось полезным для сопоставления внутриклеточных nAChR мест. Кроме того большинство исследований с использованием этого подхода основывались на ChR2-выражая бактериальных искусственных хромосом трансгенные мыши с ненормальным холинергических передачи12,13,14, 15 , 16 , 17.
PA-Nic фотолиз является не только оптические подход для изучения холинергических рецепторов. Клетке Карбахол использовался для функционально сопоставления ACh рецептор мероприятия в культивируемых клеток мозга и18 ломтики19, но не был коммерчески доступных для сравнительных исследований в ходе разработки PA-Nic. Рутений бис (бипиридин)-никотин комплекс (RuBi никотин) было сообщено для никотина uncaging20, но коммерческие препараты Руби никотин оказались хуже ПА-Nic в прямом сравнении исследование5. Это может быть полезно повторить такие сравнительные эксперименты с не коммерческих, высоко очищенный Руби никотин, как его видимым поглощения могут комплимент функций ПА-Nic для холинергических исследований. Наконец nAChRs также оптически манипулируют с помощью комбинации фото переключаемый лигандов и генетически модифицированные рецепторов21. Этот подход дополняет ПА-Nic фотолиз в ткани мозга, способность/требование генетических ориентации на изменение nAChR, рассматривается как преимущество и недостаток.
Следует отметить несколько ключевых требований этого подхода. Во-первых соответствующие визуализации метод необходим для точного поиска нейрональных мембран. Томограф с обычными epi флуоресцентной микроскопии может быть достаточно при изучении культивируемых клеток, но для записи от нейронов мозга ломтиками или других препаратов толстые ткани, 2PLSM или confocal микроскопии является требованием. Во-вторых подходящий метод необходим для позиции фотолиз лазерного луча. Этот подход использует двойной гальванометра сканирования головы с двумя независимыми x-y зеркала для сканирования растровых изображений луча и photoactivation точки, с помощью uncaging лазерный луч22,,23-24. Возможны другие, более ограниченные решения, например (1 один гальванометра сканирования головы, что альтернативно растровых сканирование изображений луча и uncaging пучка или (2) просто направляя uncaging луч в центре поля зрения, таким образом, что ячейка доводится до Эта позиция для flash фотолиза. В-третьих система необходима для одновременного электрофизиологических записи, если один хочет, чтобы собрать физиологических сигналов во время экспериментов. Вышеуказанные требования можно встретился с подходящей все оптических изображений техники, как недавно описан5. Ниже, подробный протокол включен, описываются ключевые шаги этого подхода.
протокол
Работы, относящиеся к подготовке срез мозга был рассмотрен и одобрен Северо-Западного университета животное уход и использование Комитетом (протокол #IS00003604).
ОСТОРОЖНОСТЬЮ: Лазеры, используемые для точки фото стимуляции являются видимыми класса IIIb лазеров, которые могут причинить вред для глаз. 2PLSM требует ближней ИК-области спектра (NIR) класса IV лазер (> 500 МВт), который имеет потенциал, чтобы нанести серьезный вред для глаз и даже ожоги в других тканях. Надлежащего лазерный луч сдерживания, системы блокировки, плюс инженерии и административного контроля необходимы для обеспечения безопасной эксплуатации на основе лазерного оборудования. Всегда искать местные лазерной безопасности персонала при работе с лазерами.
1. Калибровка и поверка Uncaging Laser(s)
-
Количественно мощность лазера будет доставлен в образце.
- Включите 405 нм лазер (100 МВт максимальная мощность с 5 V управляющего сигнала) и пусть лазерной системы прогреться в течение примерно 10 минут.
Примечание: Лазер-прежнему ставнями (с 0 V диск) и нет никакой Выходная мощность до тех пор, пока лазер отправляется управления напряжения для модуляции максимальная выходная мощность. - Место измеритель мощности в плоскости образцов ткани или вместо линзы конденсатора. Вручную-центр метр относительно оптический путь/объектива.
- Метр для задания правильного волны диапазона (400-1100 Нм). Нулевой метр, нажав соответствующую кнопку.
- С помощью программного обеспечения управления, выберите пункт 100 (выход Макс 1000; 1000 = 5 V) для 405 нм мощности лазера, который устанавливает лазер до 10% от полной мощности. При желании, управляющее напряжение лазера также может быть использована в PrairieView системы через VoltageRecord для обеспечения цифровой записи команды сигнал сроков и уровня мощности.
- Запись показаний от измерителя мощности.
- Выберите 150 (15% от Макс 1000) Выходная мощность лазера 405 нм и запись чтение из измеритель мощности. Повторите это действие для следующих выходной мощности для сбора кривой мощности лазера: 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 и 1000.
- Включите 405 нм лазер (100 МВт максимальная мощность с 5 V управляющего сигнала) и пусть лазерной системы прогреться в течение примерно 10 минут.
-
Калибровка uncaging Гальванометры лазера. Выполните следующие шаги, когда есть изменения оптических компонентов системы, когда есть озабоченность по поводу точного позиционирования месте или регулярно, каждый месяц.
- Установите 60 x объектив цель микроскоп с погружением в воду, которая будет использоваться в фотостимуляцией и визуализации экспериментов. В приобретение/изображений программное обеспечение, выберите 60 x объектив и оптического масштаб 1 (см. шаг 3.1.4.2.).
- Марк заполненный круг на слайд микроскопии чистого стекла с красной перманентный маркер. Место слайда на микроскопа, с отметкой к цели.
- Предварительно сфокусировать Микроскоп на красный маркер региона с 4 x или цель 10 x. Добавить 1-2 мл воды в верхней части красный маркер точка/спот и затем переключиться на 60 x цели и погружать цель в воду. Фокус объектива на тонкий красный маркерного региона.
- Переключиться на 2-фотона лазерного сканирования. Для большинства систем, переместите башни положение #1, переместить тринокулярные Призма из светового луча, перемещение сканирования головы зеркало на фронт и установите длина волны лазера ~ 900 нм. Выберите параметр поле 512 x 512 пикселей для параметров получения изображений, который является элементом пикселей по умолчанию для стимуляции зеркало калибровки рутины.
- Система запуска сканирования изображений больше, чем минимальная мощность лазера и тонкой настройки объективных фокус на слой флуоресцирования тонкий красный маркер. Выберите поле в поле флуоресценции очищают от мусора и равномерно покрытые с маркером.
Примечание: Установки в этот протокол использует PrairieView 5.4 приобретение/изображений программное обеспечение. - Откройте функцию Uncaging гальво калибровки в пределах меню Сервис – калибровки/выравнивание программного обеспечения. Прогулка через сжечь пятна учебник для пространственной калибровке второй пары зеркальный гальванометр.
- В пределах сжечь пятна учебник, выбрать 405 нм лазер, выберите лазерной стимуляции мощностью 400 и стимуляции, продолжительностью 20 мс, это должно принести небольшой (~ 1-5 мкм диаметр) отверстий в красный маркер.
Примечание: Параметры таких ~ 2-4 МВт и 1-10 мс обычно используются, но параметры определяются образца. Параметры питания фото стимуляции PA-Nic, вероятно, будет гораздо ниже, чем мощность требуется удалять видно отверстие в красный маркер слайд во время калибровки. Эта процедура калибровки полезен для обнаружения фотостимуляции пятна, но не должны использоваться для выведения абсолютной фотостимуляции томов во время физиологические реакции. - Выберите Обновление , чтобы стимулировать и обновить изображение после того, как центр месте сжигать и переместите круглый красный индикатор фактическое место расположение. Сделать это для центра пятно, пятно справа по центру, Нижняя центр пятно и наконец для сетки из девяти точек (все углы и края плюс центр изображения).
Примечание: Центр, справа и Нижняя исправленное место местах определяют стимуляции гальванометра напряжений для определения истинной центр и X и Y, коэффициенты масштабирования, чтобы соответствовать стимуляции зеркальной пары изображений зеркальной пары. Программное обеспечение будет масштабироваться и обновление, все последующие MarkPoints эксперименты, проведенные на масштаб отображения отличается от масштаба пространственной калибровке.
- В пределах сжечь пятна учебник, выбрать 405 нм лазер, выберите лазерной стимуляции мощностью 400 и стимуляции, продолжительностью 20 мс, это должно принести небольшой (~ 1-5 мкм диаметр) отверстий в красный маркер.
- Протестируйте калибровка открытия окна MarkPoints и вручную активировав параметров стимуляции в определенных spot(s) в новой области образца. Убедитесь, что правильно, последней калибровки файл загружается в окне MarkPoints . Активировать функцию MarkPoints/группа или Серии MarkPoints на определенный spot(s) или использовать функцию Live/абляции справа/слева щелкнуть мышью на изображение во время живой сканирование применять тестовый импульс и для проверки правильной калибровки.
Примечание: Лазер сжечь месте теперь должен быть совершенно центризован на индикаторе MarkPoints . - Отслеживать и записывать активации мощности лазерного импульса и временной длительности путем выстукивать снятия напряжения диск в VoltageRecord программу (см. шаг 1.1.4). Аналогичным образом запишите позицию каждого стимуляции пятно с помощью масштабной напряжения сигнала от сигналов обратной связи, производный от пары фото стимуляции гальванометра зеркал.
2. Подготовка Photoactivatable никотина (ПА Nic)
- Извлекать Алиготе лиофилизированные photoactivatable препарата из хранилища.
Примечание: Следующий протокол для PA-Nic; корректировать по мере необходимости для других photoactivatable препаратов. Хотя ПА-Nic демонстрирует исключительную стабильность5, примите разумные меры предосторожности, чтобы защитить его от воздействия яркого света во время подготовки и/или экспериментов. Это может быть достигнуто, просто работая в условиях низкой освещенности; ограничение для отфильтрованных красный свет не является необходимым. -
Выполнить местное применение ПА-Nic.
- Вытяните микропипеткой стекла с отверстие диаметром 20-40 мкм с программируемой пипеткой съемник.
- Фильтр записи с помощью фильтра 0.22 мкм ~ 1 мл. Ресуспензируйте количество PA-Nic в решение отфильтрованные записи приносить конечная концентрация 2 мм. Например Растворите 100 нмоль лиофилизированный Алиготе в 50 мкл раствора отфильтрованные записи.
Примечание: Предлагаемые записи решение композиции можно найти в последних публикаций5,6 , используя ПА-Nic фотолиз. - Обратно заполните местное применение пипетки с 50 мкл 2 мм ПА-Nic.
- Закрепите местное применение пипетки в пипетку держатель установлен на микроманипулятор. Подключите держатель пипеткой через соответствующие трубы к давление выброса системы, способной применения устойчивой низкого давления (1-2 psi).
- С помощью микроманипулятор, маневр местное применение пипетки в решение внеклеточного записи и положение кончика пипетки чуть выше ткани мозга мыши расположен ~ 50 мкм от клетки интереса. Обратитесь за подробный протокол подготовки срез мозга мыши и патч зажим записи8предыдущего доклада.
- Проверка параметров приложения, кратко, применяя давление (1-2 psi). Там должно быть минимальным не перемещение ячейки интерес. Если возникают значительные движения, переместите локальное приложение пипеткой далее (в направлении боковой или осевой) от клетки интереса.
- После достижения стабильных клеточных патч зажим (подробности которых включены в предварительной публикации8), включите низкого давления (1-2 МПа) приложения, используя соответствующие ручной переключатель на устройство отстрела давления. Насыщают ткани, окружающие клетки с PA-Nic для 1-2 мин перед переходом к следующему шагу.
-
Выполняют применения (superfusion) Ванна ПА-Nic срез мозга.
- Растворите некоторое количество PA-Nic в объеме записи раствор, для непрерывной рециркуляции приносить конечная концентрация 100 мкм. Например Растворите 1 мкмоль аликвота в 10 мл раствора записи, используя стандартный 15 мл.
- Начните рециркуляции ПА-Nic раствора со скоростью 1,5-2 мл/мин, открыв соответствующий поток управления в системе перфузии. Рециркуляция происходит на время записи. Чтобы сохранить ценные наркотиков, свести к минимуму объем рециркуляции с помощью трубки с минимальным внутренним диаметром, и/или путем сокращения общей продолжительности труб, используемых в системе перфузии.
Примечание: Принимая эти меры, объем рециркуляции ванна может уменьшиться до 5 мл раствора ПА-Nic. PA-Nic решения часто может использоваться для двух последовательных записи дней в течение той же недели, если хранить защищены от света при 4 ° C. - Во время рециркуляции непрерывно пузыря решение с Карбоген (5% O2, 95% CO2) и поддерживать ванны температура 32 ° c.
- Сохраните фрагмент мозга в записи решение во время работы с PA-Nic в условиях низкой освещенности.
3. томография нейронов с 2-Фотон лазерная сканирующая микроскопия
- Выполняют живой визуализации ячейки.
- Идентифицировать и визуализировать нейрон медиальный habenula (MHb) с помощью пропускаемого света или инфра красный дифференциальной помехи контраст (IR/DIC) Оптика и видео камеры и создать запись зажим патч стабильных клеточных. Обратитесь к предыдущий протокол для подробной информации о записи зажим патч от нейронов в прекрасно подготовленных мыши мозга ломтиками8.
- После установления высокого сопротивления (> 1 GΩ) придает ячейки конфигурации, но до взлома, переключать настройки и программное обеспечение для лазерной режим сканирования.
- После обкатки, использовать лазерное сканирование для проверки тепловизионных краситель (разбавляют до конечной концентрации 100-200 мкм в стандартной внутриклеточных пипеткой раствор описанные ранее8) осуществляется пассивно (Диффузия) заполнение нейрона. Позволяет заполнить сотовой отсеков для по крайней мере 20-30 мин перед эксперименты, которые требуют визуализация краситель (например, Alexa Fluor 488 в зеленых фотоэлектронный умножитель трубки [ПЛТ] канал, PMT 2; или Alexa Fluor 568 или 594 в красный ПЛТ канал, 1 ПЛТ) любой сотовой отсеков вне сома.
Примечание: Дистальная отсеков (дендритных структур, колючки, аксоны, и т.д..) может потребоваться 30-40 минут, чтобы полностью заполнить25. - Использование программного обеспечения Live сканирования функция для визуализации нейрон и внутриклеточных отсек интерес. Выбор изображений параметров, которые позволяют для точной жить Визуализация функций нейронов. Манипулировать различные параметры влияют на или изменять отображение визуализации (контраст), резолюции, соотношение сигнал шум (S/N) и время приобретения кадра изображения:
-
Смотреть вверх таблицы (LUT). Откройте окно LUT, используя соответствующий значок на стороне любого окна изображения. После открытия, отрегулировать LUT этаж (мин) и потолок (Макс.) Настройка конкретного изображения канала для улучшения визуализации контраст сигнал, на экране. Нижняя максимальное значение ~ 1000 (из 4096, 12-битный обнаружения), который поможет вывести диммер сигналов первый ища для клеток, сигнал и структуры.
Примечание: Эти параметры влияют только на отображаемого сигнала, не обнаружена Записанная значения. Глаз человека может обычно только сделать контраст ~ 50 уровни серого26. -
Оптический зум. Используйте программное обеспечение управления для выбора 1 X оптическим зумом и использовать панорамирование элементы управления, чтобы найти нужную область в ткани. Этот масштаб дает большой площади, отсканированные поле зрения и отправляет крупнейших напряжения/проверки углов, гальванометра зеркала.
Примечание: Конфигурация по умолчанию предназначен для 12 мм х 12 мм поле зрения внутри сканирования головы, который переводит до 12 мм, разделенные цель увеличения внутри образца. Таким образом 60 x объектив дает отсканированные изображения 200 мкм на стороне 1 x оптическим зумом. Более высокие значения оптический зум меньше область сканирования. 2 x оптический зум параметр часто наиболее полезны для визуализации всего нейронов. 4 x может быть полезным для визуализации субцеллюлярные аспекты нейронов. -
Количество пикселов. В дополнение к 1 x оптическим зумом, выберите 1024 x 1024 пикселей в строке с помощью программного обеспечения управления. Установите количество пикселов в строке в захваченных и отображать изображения не потерять детали можно дальше от объектива. Используйте следующие значения практических пикселей для 60 x / 1.0 числовой апертуры (NA) Цель: 1024 x 1024 для масштаба 1, 512 x 512 для масштабирования 2 и 256 x 256 для масштабирования 4. Конечный размер пикселя (~0.17 мкм; 12 мм/масштаб/масштаб/пикселей) должно быть половина, или меньше, боковые резолюции определяется объектива.
Примечание: Разрешение изображения определяется только длина волны лазера и объективных NA (0,4 мкм резолюции из возбужденных двух ФОТОН [2PE] с 920 Нм и 1,0 Цель NA)27. Критерии для полной возбуждения NA, как указано на объектив, что 1/e2 интенсивность лазерного луча диаметр матчей (или «заполняет») входного зрачка (2 x фокусного расстояния объектива трубки x NA / увеличение) объектива. Трубка объектива в системе, описанной здесь имеет фокусное расстояние в 180 мм. -
Время нахождения пикселей . Используйте программное обеспечение управления для выбора 4 МКС для пикселя продолжительность, полезное значение по умолчанию значение.
Примечание: Время задержки пиксела изменения означает сигнал обнаружен; оно влияет только на внутри пиксель усреднения, и эти изменения могут быть визуализированы через качество изображения через S/N. Время выдержки пикселя изображения всегда кратно 0,4 МКС единиц, и больше останавливаться раз 12-бит ограниченной интенсивности каждого пикселя изображения значение в среднем 0,4 МКС образцов. Поскольку коэффициент S/N улучшает как квадратный корень из числа выборок на время нахождения пиксель (4 МКС составляет десять образцов или 3.16-fold улучшения в S/N), улучшение качества изображения достигает убывающего для значений намного больше, чем 12 МКС. -
Проверять вращение и региона интерес (ROI). Задайте угол 0° вращения с помощью программного обеспечения управления (никаких действий может потребоваться, как 0° поворота является значением по умолчанию для большинства систем тепловидения). Если образец помещается в ориентации «вверх вниз», выберите Поворот на 180° в «зеркальное отражение».
Примечание: Поворот изображения на любой заданный угол, может обеспечить лучше подходят для всей области интереса заполненные ячейки. Вращение может также дать четкую основу для согласования структурных изменений и для последующего анализа. Выбор региона интерес внутри отсканированного изображения в настройку заданного масштабирования (шаг 3.1.4.2), сохраняет родной пикселах (шаг 3.1.4.3), но ограничение в общее количество области и пикселей может значительно увеличить частоту кадров, предоставляя повышение временным разрешением изменения сигнала. -
Усреднение кадров. Выберите начальный кадр средний 2 кадров с помощью программного обеспечения управления.
Примечание: Контраст изображения (S/N) определяется общая фотоны собранных/обнаружены в пределах сигнала пикселов изображения. Усреднение нескольких кадров изображения можно улучшить коэффициент S/N, условии, что образец не перемещать или не отбеленные во время визуализации. Сигнал интерес при усреднение в то время как шум в изображении сокращается на квадратный корень числа кадров в среднем остается то же значение. Малых структур в флуоресценции изображения часто требуют межучрежденческой пиксель усреднения, сочетая пикселов в пределах изображения (часто называемый ROI), и/или усреднение кадра. Кадр, усреднение увеличивает время сканирования на количество изображений одного выбирает в среднем.
-
Смотреть вверх таблицы (LUT). Откройте окно LUT, используя соответствующий значок на стороне любого окна изображения. После открытия, отрегулировать LUT этаж (мин) и потолок (Макс.) Настройка конкретного изображения канала для улучшения визуализации контраст сигнал, на экране. Нижняя максимальное значение ~ 1000 (из 4096, 12-битный обнаружения), который поможет вывести диммер сигналов первый ища для клеток, сигнал и структуры.
- Используйте инструменты Управления панорамированием, Проверять вращениеи Оптическим зумом сориентироваться положение образца при сканировании. Если мотор стадии манипуляции необходима для позиционирования образца, Избегайте размеров большой шаг к оси X, Y и Z для предотвращения столкновений цель/конденсатора, вибрации или воздействия лазерного луча до отражающих поверхностей.
- Собирайте Z-стека. Используя инструмент Z-серии , выберите Пуск и остановка позицию, содержащий ячейку, являющуюся интерес. Выберите размер шага (1 мкм) и затем последовательно образ нейрон в каждой плоскости Z, содержащий ячейку.
Примечание: Z-стек приобретения параметры будет варьироваться между типа нейрон и заполнение краска. Оптимальные параметры для Z-стек приобретения должны быть определены независимо от параметров, используемых для живых изображений. Z-стек приобретение может выполняться до или после optopharmacology экспериментов. Если возможно выполняют приобретение Z-стек после того, как optopharmacology, чтобы избежать любых клеточных повреждений индуцированных 2PLSM и разрешить для оптимального краситель заполнения небольших сотовой отсеков.
4. Лазерная Flash фотолиз в ходе электрофизиологического записи
Примечание: Применяя 405 нм или 473 Нм лазер полномочия ≥ 1 МВт производит фосфоресценция внутри стекла объективных и конденсатор линз. Этот созданный свет непосредственно связана с мощность лазера освещение; излучение присутствует в красный и зеленый спектральные окна и имеет время жизни возбужденного состояния в диапазоне ms. Этот артефакт стимуляции фон рассматривается все линзы протестированы и погружением в воду объективов от всех основных производителей объективов. Конденсатор линзы производят гораздо выше фосфоресценция чем объективов. Этот «сигнал» мотивирует использование механических опалубки для защиты чувствительных арсенид галлия фосфид (Хаасп) ПЛТ катодов во время фото стимуляции событий. С помощью нормально закрытый механический затвор (закрыт при сканировании не активно) представляет собой лучшее решение для защиты охлажденной Хаасп ПМЦ.
- Для геометрии пучка фотостимуляции Песочные часы типа удалите любые фокусировки линз в оптике пути света, который бы в противном случае узкой/сжиматься лазерный луч как он входит цель входного зрачка.
- С помощью MarkPoints, выберите параметр один пятно.
Примечание: Другие параметры фото стимуляции (несколько пятен, сетка пятен, спираль сканирование) возможно в рамках MarkPoints. Одном месте является наиболее простым. Экспериментальных целей и биологические различия может потребовать другой параметр. - Обновите образ с помощью параметра Live сканирования кратко изображения и найдите субцеллюлярные области интереса. Периодически обновите изображение для выявления любых потенциальных небольшие сугробы в фокусе.
- Использовать программное обеспечение управления для увеличения оптический зум (то есть, выберите более высокое значение оптический зум, чем нынешний), если необходимо, чтобы визуализировать малых структур (т.е., шипы или дистальной дендритов).
- Место MarkPoints одно пятно перекрестье непосредственно примыкает (~0.5 мкм) для клеточной мембраны. Не место фото стимулирование пятно непосредственно над сотовой функция, как это может привести к фотоповреждения.
- Установите параметры для фото стимуляция с помощью программного обеспечения управления в MarkPoints. Применять начиная руководство следующим образом: 1-50 мс продолжительность, 1-4 МВт мощности лазера и ≥1 Суда.
- Выберите Запустить MarkPoints начать MarkPoints протокол и наблюдать электрофизиологии сбора данных в режиме реального времени.
- Повторите шаги с 4.2-4.7 несколько раз для оценки последовательности и стабильности, или отсутствие таковых, амплитуда ответа и кинетики.
Результаты
Для фотолиза стимуляции, дозы облучения (интенсивности и времени), расположение экспозиции и геометрии пучка являются основными переменными. Система, описанная в этой статье способен двух разных фотостимуляции балок, регулируемые через перемещение объектив/из фотостимуляции легкие пути, прежде чем луч входит в систему гальванометра. Без этого объектива, фотостимуляцией луч заполняет входного зрачка 60 x / 1.0 NA, вода окуная [60 x WD] цель, производство вблизи дифракционный, суб мкм пятно в фокальной плоскости внутри образца. Это связано с фотостимуляцией света с Песочные часы форму, расширяя выше и ниже фокуса месте симметричный с оптической оси. С объективом, вставляется в путь фотостимуляцией лазерный свет ориентирован в входного зрачка объектива и завершает как карандаш как луч. Этот луч, который ожидается ~ 10 мкм в диаметре 60 x цели, распространяется равномерно/вертикально всей выборки. В этом режиме интенсивности света в любой данной точке в стимуляции пятно будет ~ 1% вблизи дифракционный небольшое пятно интенсивности. Таким образом высшие силы лазерного обычно требуются при использовании ~ 10 мкм пятно стимуляции. Для всех экспериментов, сообщили в этой статье была использована фотостимуляции Песочные часы тип пучка.
Поставленный образец питания могут быть отображены против входного напряжения настройки, после измерения мощности лазера на образце с помощью измерителя мощности. Эти исследования используют 60 x WD цель с рабочим расстоянием 2 мм, но не он погружен в воду для измерения мощности во избежание повреждения к элементу детектор. Когда цели с перечисленных NA > 0,95 измеряются в воздухе (без погружения жидкости), может быть потери полного внутреннего отражения на элемент передней линзы благодаря низким индексом (воздуха). В этом случае, для более точного измерения мощности образца (для исправления для полного внутреннего отражения потерь) увеличения измеренной мощности 1.0 NA объективных (1.0/0,95)2 измеряется в воздухе. На рисунке 1a показана типичный участок ввода/вывода для 405 нм и 473 Нм видимых лазеров, которые встроены в лазер запуск системы в этом исследовании. Эти лазерные системы идеально подходят для фото стимуляции дозы экспозиции по следующим причинам: (1) они предварительно откалиброванные предоставлять непосредственно линейная мощность относительно входного напряжения (0-5 V), (2) они обеспечивают молчание затвора операции (не лазер выход), и (3) они имеют быстрый, суб ms интенсивности импульса продолжительность управления (0,1 мс ответ). При использовании место фото стимуляции с лазер/Гальво-системы, регулярной калибровки MarkPoints пятен является важной задачей. Рисунок 1b (левая панель) демонстрирует систему, которая из калибровки (требуемую точку для фото стимулировать не привести точные стимуляция этой точки, как указано место ожога отверстие), с возвращением к точное позиционирование пятна после калибровки ( Рисунок 1b, правая панель).
PA-Nic скромно флуоресцентные (пик выбросов на ~ 510 нм), участниц эффективную возбуждения между 350-450 Нм (1-Фотон возбуждения) или 700-900 нм (2-Фотон возбуждения)5. Чтобы визуализировать ПА-Nic во время локального приложения, ПА-Nic (1 мм) был применен вблизи ткани мозга, следуют одновременные снимки (1) мозг ткани секционного светопропускания контекста через Dodt контраст и (2 испускаемого флуоресценции от возбуждения (900 нм) от PA-Nic. ПА-Nic 2PE флуоресценции было легко обнаружить во время давление выброса из локального приложения пипетки (рис. 2a). Никотин и monoalkylcoumarin, 7-карбоксиметиламин-4-метил кумарина, являются основной продукцией фотохимические реакции фотолиза ПА-Nic5. Используя те же параметры, которые использовались для PA-Nic визуализации изображений, ткани был воспроизведен образ во время доставки никотина (1 мм) или 7-карбоксиметиламин-4-метил кумарина (1 мм). Флуоресцентный сигнал не обнаружен (Рисунок 2a, средней и нижней панели), демонстрируя специфичность результатов ПА-Nic. Наконец, ПА-Nic был применен в ткани мозга и ПА-Nic флуоресценции выбросов был воспроизведен образ (Рисунок 2Б). Этот подход подтверждает, что ПА-Nic присутствует в пределах 100-200 мкм пипеткой локального приложения. Вместе эти данные подтверждают, что ПА-Nic эффективно доставляется в ткани мозга через локальное приложение.
Электрофизиологии записей с одновременным 2PLSM для визуализации клеточных структур требует следователь баланс соображений для обоих компонентов эксперимента, и часто узкие время окна (~ 20 мин) доступен для допустимых сбор данных в образец из исправленной ячейки. Без учета сотовой визуализации, это лучший способ начать запись как можно скорее после обкатки, потому что запись стабильности стремится сокращаться с течением времени. Однако когда изображений является обязательным требованием, электрофизиологические соображения должны отвести достаточно времени для флуоресценции концентрация увеличивается в малых/удаленный структур. Это является примером путем изучения концентрации красителя, заполнения кривой28, который иногда полезно извлечь при визуализации нового типа ячейки. Рисунок 3 показывает несколько пример нейронов образы как Z-стеки через 2PLSM и рухнул в максимальной интенсивности проекции для целей представления. На рисунке 3a показывает высокое качество изображения, где морфологией нейронов, как представляется, быть полным, сводится к минимуму шум, и мусора не вмешиваться с толкованием клеточной морфологии. Рисунок 3b показывает изображения низкого качества, благодаря более низкий коэффициент сигнал фон и существенной мусора. Этот мусор часто появляется в виде сферических очагов интенсивной флуоресценции, вытекающих из изгнания изображений краситель из пипетки патч при подходе к ячейке. Примечательно включение 100 мкм ПА-Nic в бане (при выполнении приложения ванна) стремится уменьшить коэффициент сигнал фон и приводит к югу оптимального изображения контрастность. Alexa Fluor 568 или 594 часто является весьма полезным в местном применении эксперименты как краситель finder или как сигнал ссылку/нормализация нормализация 2PE. Эффективной длины волны для возбуждения двух Фотон этих красителей — ~ 780 нм27, которая позволяет одновременно визуализация PA-Nic и идентификации клеточных отсеков. Однако, эта длина волны, не полностью избежать двух Фотон фотолиза ПА-Nic5. Alexa Fluor 488 выгодно в ПА-Nic баня приложения экспериментов; при возбуждении с подходящей длине волны ≥900 нм, два Фотон фотолиза ПА-Nic5 можно избежать, сохраняя подходит визуализации клеточных отсеков.
Рисунок 4 показывает пример данных для локализованных ПА-Nic лазерной вспышки фотолиз в MHb нейронов в мозге ломтиками. На рисунке 4a (верхняя панели) показан пример изображения «ссылка», который является захват экрана последнего изображения 2PLSM, принятых перед запуском MarkPoints протокол, обложил с фото стимуляции место места. На рисунке 4a (ниже изображение панели) показывает увеличенное представление фото стимуляции месте накладывается на клеточной морфологии. Соответствующие коррелированных по времени электрофизиологических ответ на PA-Nic фотолиз показано на нижней панели рисунок 4a. Предыдущая работа продемонстрировала, что эти токи чувствительны к nAChR антагонисты5. Рисунок 4b показывает репрезентативных данных из различных клеток, где одно пятно фотолиз была выполнена с интервалом 1 s или s. 10, тогда как 10 s интервал допускается достаточное количество времени восстановления для проведения текущего базового, короткий интервал 1 s привело к постепенное увеличение тока как протокол проведения продолжалась. Увеличение текущей свидетельствует о том, что никотин не было достаточно времени для диффузного от системы с интервалом 1 Гц29. Такой временной ответ, что анализы должны быть выполнены de novo на любой новый тип клеток изучается, как neuropharmacology nAChRs могут различаться в разных типов клеток.
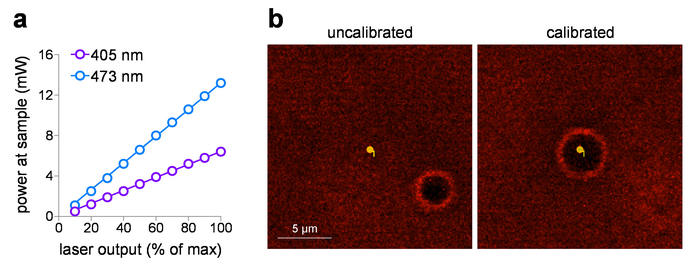
Рисунок 1: Лазерная калибровка фотостимуляции. () Выходная мощность лазера фото стимуляции. Мощность на плоскости образца (через 60 x / 1,0 Цель погружения воды NA) был измерен для 405 нм и 473 нм лазеры фото стимуляции в указанный выходной параметр. (b) Фото стимуляции лазерные устройства для калибровки. Экран захвата изображения показывают пространственные отношения между местом предполагаемого фото стимуляции и соответствующее расположение, место фото стимуляции (ожог отверстие) до (слева) и после (справа) работает калибровки в MarkPoints. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
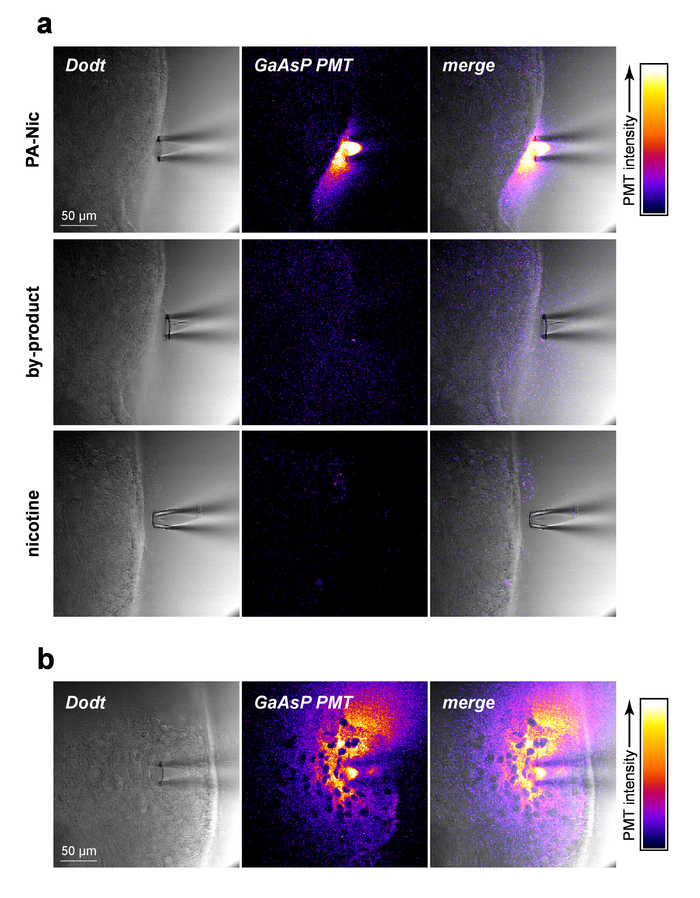
Рисунок 2: PA-Nic локальное приложение. пипетки () обнаружения PA-Nic с локального приложения. 1 мм ПА-Nic, фотолиз побочного продукта или никотина растворяют в фаго, загружается в местное применение пипетки и обойтись на ткани головного мозга во время 2PLSM (900 нм возбуждения) изображений, используя те же параметры обработки изображений для каждого препарата. Лазерное сканирование Dodt контраст передачи изображения показывает пипеткой ткани, тогда как Хаасп катод ПЛТ был использован для захвата флуоресценции выбросов. (b) ПА-Nic (1 мм) был увлажненную в ткани мозга и образы через 2PLSM как (), чтобы показать бокового распространения PA-Nic с помощью встроенных флуоресценции. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
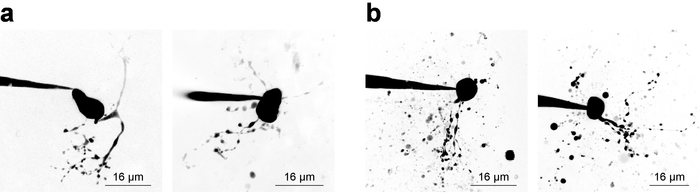
Рисунок 3: приобретение 2-Фотон лазерной сканирующей микроскопии изображений. Z () оптимального 2PLSM-стеки. Два примера 2PLSM Z-стек максимальная интенсивность прогнозы отображаются для MHb нейронов с хорошо решен дендритов и практически не мешая мусора. (b) субоптимальных 2PLSM Z-стеки. Два примера 2PLSM Z-стек максимальная интенсивность прогнозы отображаются для нейронов MHb, окруженный мусора (краска, изгнаны из пипетки в ячейки подход). Такие изображения являются более трудно интерпретировать, чем изображения, как показано на (). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
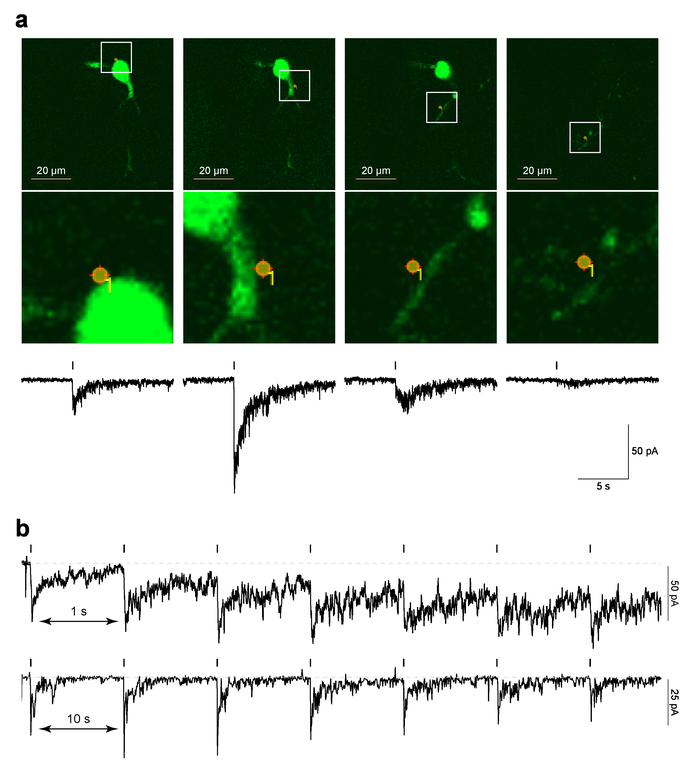
Рисунок 4: лазерной вспышки фотолиза PA-Nic. () ссылка MarkPoints изображения и внутрь течения, вызванные PA-Nic фотолиза. Для одного нейрона MHb необработанные ссылки изображений отображаются для MarkPoints фото стимуляции процессов в одном месте (указанных) сотовых. Обратите внимание, что для некоторых мест фото стимуляции (самый правый изображения в этой серии), дендритных структура находится в фокусе, но сома и проксимальной дендритов не являются. Ниже каждого эталонного образа никотин, uncaging вызвала внутрь ток строится. (b) между стимулом интервалы для PA-Nic фотолиза. Образец записи отображаются для нейронов MHb где никотин был неоднократно отключенную в том же месте perisomatic с интервалом между стимул 1 s или 10 s. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Выбор способа доставки приложений ПА-Nic является наиболее важным этапом в этой технике локализованных фото стимуляции. Два метода, Ванна приложения и местные перфузии, каждый предлагают преимущества и ограничения. Выбор во многом повлияли nAChR уровня функциональные выражения в тип ячейки интереса. Часто бывает предпочтительнее использовать Ванна приложения при функциональных выражение уровни высоки, как ванна приложение позволяет для единообразного зонд концентрации, окружающих записанные ячейки, облегчения интерпретации данных. Ванна приложения также устраняет необходимость второго перфузии пипетки в ткани, что делает весь процесс легче. Однако Ванна применения дорогих соединений стоит больше за эксперимент.
Обычно устранение неполадок включает пытается понять, почему не nAChR активации видны следующие flash фотолиза. При работе с типом ячеек, который ранее не изучена с PA-Nic, следователь должен выполнять местные слоеного применение ACh или никотина, чтобы определить, являются ли достаточными рецепторов функционально выразил5. Чтобы проверить, что система способна обнаруживать фотолиз ответы, эксперименты контроля должно быть сделано в медиальной habenula нейронов, которые выражают большое количество рецепторов30. В этой области мозга ПА-Nic Ванна применение возможно, который является предпочтительным для проверки экспериментов. Только после выполнения этих экспериментов проверки следует один перейти к тип неизученный ячейки. Если экспериментальная система протестирована и ответы остаются очень малых или обнаружить, оно может быть оправдано увеличивают концентрацию PA-Nic, увеличение интенсивности вспышки или длительность импульса, добавьте nAChR положительные аллостерический модулятор для повышения nAChR деятельность6, или некоторое сочетание этих.
Иногда uncaging ответы являются слишком большими, с значительным nAChR активацию, приводящую к косвенным напряжения закрытом Na+ активации и unclamped внутрь течений из-за плохой пространства зажим. Эти артефакты, которые полностью скрывать внутрь токов nAChR и сделать невозможным интерпретации данных, могут быть устранены путем включения QX-314 (2 мм) в записи пипеткой. Они также могут быть устранены путем уменьшения концентрации PA-Nic или путем снижения интенсивности вспышки или длительность импульса. В всех видимый свет фото стимуляции экспериментах необходимо проявлять осторожность при выборе стимуляции сайты, чтобы избежать непреднамеренного стимуляции/фотолиз выше или ниже желаемого фокальной плоскости. Кроме того и когда применимо, мощность лазера должен всегда титруют воспроизвести физиологические реакции. Это особенно важно, необходимо знать о z-axis фотостимуляции при работе с клетке лигандов, как лиганды, которые активируются выше/ниже фокуса месте могут по-прежнему диффузный и взаимодействовать с биологической системы (т.е., рецепторов) изучается.
PA-Nic лазерной вспышки фотолиз может не подходить для всех следователей, как существуют некоторые ограничения. Во-первых, относительно высокая стоимость подходящие настройки. При работе с фрагментами нетронутыми мозга, uncaging вблизи малого диаметра структур как дендриты требует сложной визуализации системы как 2-Фотон микроскопа. Помимо высокой стоимости Ti: Sapphire, Перестраиваемый лазер импульсной IR для выполнения 2-Фотон микроскопии, двойной гальванометра системы, способной самостоятельно позиционирования двух лазерных пучков далее увеличивает стоимость системы. Расходы всего системы может быть уменьшена с помощью системы, дом построен, если следователь имеет достаточно опыта и времени для конструирования, устранения неполадок и поддержания такой системы. Второе ограничение часто предполагает низкий nAChR функциональных выражение, которое можно частично избежать, шаги, как упоминалось выше, но это не может гарантировать успеха. Как правило если одно не может измерить лиганд активированный течений после слоеного применение агонистов, ПА-Nic flash фотолиза под мембраной может не дать приемлемые результаты. Третье ограничение включает внутреннюю флуоресценции ПА-Nic. ПА-Nic поглощает свет ~ 405 нм и излучает в ряду аналогичных как Зеленый флуоресцентный белок (ГПУП) или Alexa 4885. Когда па-Nic концентрации превышают ~ 1 мм, это свойство флуоресцирования можно сделать это сложно одновременно визуализировать нейрональных структур. Чтобы избежать этого, важно иметь возможность легко управлять потоком PA-Nic из пипетки перфузии. Периодически ПА-Nic поток был остановлен разрешить флуоресцентных молекул для диффузного прочь. Это разрешается повторно изображений нейрона для проверки позиции месте uncaging луча. Четвертый потенциальным ограничением упоминать предполагает использование 405 нм света для фотолиза. Более короткие длины волн например 405 нм более подвержены рассеяния в сложные ткани, такие, как кусок мозга. Таким образом в данной флеш интенсивности и продолжительности, uncaging ответ амплитуд и Кинетика распада могут быть различной степени затронуты глубины uncaging фокуса внутри фрагмента. Выводы о биологических аспектах nAChRs следует учитывать этот важный нюанс.
Эта техника flash фотолиз локализованных лазерной недавно был использован раскрыть новые подробности о nAChR нейробиологии. Например хронический никотина воздействия повышает perisomatic и дендритных nAChR функции в медиальной habenula нейронов5. Он также использовался для помочь продемонстрировать, в первый раз, вентральной вентральная область глутамата нейронов Экспресс функциональных nAChRs в их perisomatic и дендритных сотовой отсеков6. Есть много потенциал будущего использования этой техники, и подход может быть применен к другим типам ключевых нейрон, которые известны Экспресс nAChRs, таких как корковых нейронов пирамидальный31 или интернейронов в коре32, стриатума33 и гиппокампа19. Этот метод может также сочетаться с фармакологии и/или nAChR гена, редактирование34 локализовать специфическим рецептором подтипы для различных нейрональных отсеков. Этот подход может быть легко адаптирована для других соединений, кумарина в клетке, включая, но не ограничиваясь, разработанные параллельно с PA-Nic5. Наконец ПА-Nic flash фотолиз может один день использоваться в Пробудитесь ведет себя животное для изучения действия никотина в Роман поведенческой фармакологии парадигм.
Раскрытие информации
D.L.W. служит платных консультанта для микроскопии флуоресцирования Bruker Nano.
Благодарности
Авторы благодарят лаборатории членов следующих северо-Главные исследователи: Райан Drenan, D. Джеймс Surmeier, Евгения Kozorovitskiy и Анис подрядчика. Эта работа была поддержана нас национальных институтов здравоохранения (НИЗ) (гранты DA035942 и DA040626 к Р.М.Д.БРИДСОН**), PhRMA Foundation (стипендии M.C.A.) и HHMI.
Материалы
| Name | Company | Catalog Number | Comments |
| Instruments, Consumables, and Miscellaneous Chemicals | |||
| Multiclamp 700B | Molecular Devices Corp. | Patch clamp amplifier | |
| Pneumatic Picopump | World Precision Instruments | PV820 | |
| Micropipette puller | Sutter Instrument Co | P-97 | |
| Temperature Controller | Warner Instruments | TC-324C | |
| Vibrating blade microtome | Leica Biosystems | VT1200S | |
| Ultrafree-MC Centrifugal Filter | MilliporeSigma | UFC30GV0S | internal solution filter |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B150F-4 | patch and local application pipette |
| (-)-Nicotine hydrogen tartrate salt | Glentham | GL9693 | nicotine salt |
| 7-carboxymethylamino-4-methyl coumarin | Janelia Research Campus | PA-Nic by-product | |
| 1-[7-[bis(carboxymethyl)- amino]coumarin-4-yl]methyl-nicotine | Janelia Research Campus | PA-Nic | |
| Euthasol (Pentobarbital Sodium and Phenytoin Sodium) | Virbac | ANADA #200-071 | |
| Alexa FluorTM 488 Hydrazide | ThermoFisher | A10436 | green fill dye |
| Alexa FluorTM 568 Hydrazide | ThermoFisher | A10437 | red fill dye |
| 6-carboxy-AF594 (Alexa Fluor 594) | Janelia Research Campus | red fill dye | |
| QX 314 chloride | Tocris | 2313 | voltage-gated sodium channel blocker |
| Power Meter | ThorLabs | S120C | |
| Name | Company | Catalog Number | Comments |
| Chemicals for Solutions | |||
| N-Methyl-D-glucamine | Sigma | M2004 | |
| Potassium chloride | Sigma | P3911 | |
| Sodium phosphate monobasic monohydrate | Sigma | S9638 | |
| Sodium bicarbonate | Sigma | S6014 | |
| HEPES | Sigma | H3375 | |
| D-(+)-Glucose | Sigma | G5767 | |
| (+)-Sodium L-ascorbate | Sigma | A4034 | |
| Thiourea | Sigma | T8656 | |
| Sodium pyruvate | Sigma | P2256 | |
| Magnesium sulfate heptahydrate | Sigma | 230391 | |
| Calcium chloride dihydrate | Sigma | 223506 | |
| Sodium chloride | Sigma | S9625 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma | E3889 | |
| Adenosine 5′-triphosphate magnesium salt | Sigma | A9187 | |
| Guanosine 5′-triphosphate sodium salt hydrate | Sigma | G8877 | |
| Name | Company | Catalog Number | Comments |
| Components of 2-Photon Microscope | |||
| Ultima Laser Scanner for Olympus BX51 Microscope | Bruker Nano, Inc. | imaging software and galvos | |
| Imaging X-Y galvanometers | Cambridge Technology | ||
| Mai Tai HP1040 | Spectra-Physics | Tuneable IR laser | |
| Pockels cell M350-80-02-BK with M302RM Driver | Conoptics, Inc. | for IR laser attenuation | |
| Integrating Sphere Photodiode Power Sensor | Thorlabs, Inc | laser power pick-off photodiode | |
| Uncaging X-Y galvanometers | Cambridge Technology | ||
| Helios 2-Line Laser Launch | Bruker Nano, Inc. | uncaging laser components | |
| OBIS LX/LS 405 nm (100 mW) | Coherent, Inc. | ||
| OBIS LX/LS 473 nm (75 mW) | Coherent, Inc. | ||
| Point-Photoactivation / Fiber Input Module for Limo Sidecar - Uncaging | Bruker Nano, Inc. | ||
| Name | Company | Catalog Number | Comments |
| Upright Microscope | Olympus | BX51WIF | Upright microscope chasis |
| Objective: Olympus M Plan FL 10x; NA 0.3 WD 11 mm | Olympus | 10x objective | |
| Objective: Olympus M Plan Fluorite 60x/1.0 WD=2mm NIR | Olympus | 60x water-dipping objective | |
| X-Cite 110, four-LED LLG coupled epi-fluorescence light source | Excelitas Technologies | LED Light Source | |
| Epi-Fluorescence Filter: ET-GFP (FITC/CY2) for Epi-Turret | Chroma Technologies | LED Filter for blue light excitation | |
| Epi-Fluorescence Filter: ET-DsRed (TRITC/CY3) for Epi-Turret | Chroma Technologies | LED Filter for green light excitation | |
| B&W CCD camera; Watec, 0.5in B/W CCD | Watec Co., LTD. | CCD camera for patch clamp recording | |
| Name | Company | Catalog Number | Comments |
| External Detectors - Dual Reflected Emission - Olympus Upright (Multi-Alkali, GaAsP) | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | red channel PMT |
| 595/50m | Chroma Technologies | red channel emission filter | |
| 565lpxr | Chroma Technologies | dichroic beam splitter | |
| GaAsP end-on PMT | Hamamatsu | 7422PA-40 | green channel PMT |
| 525/70m | Chroma Technologies | green channel emission filter | |
| High-Speed Shutter for Hamamatsu H7422 PMT | Vincent Associates / Bruker | 517329 | PMT shutter mount |
| Name | Company | Catalog Number | Comments |
| Dodt Gradient Contrast Transmission Detection Module | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | Dodt PMT |
Ссылки
- Zhang, C., et al. Cholinergic tone in ventral tegmental area: Functional organization and behavioral implications. Neurochemistry International. 114, 127-133 (2018).
- Sarter, M., Parikh, V., Howe, W. M. Phasic acetylcholine release and the volume transmission hypothesis: time to move on. Nature Reviews Neuroscience. 10 (5), 383-390 (2009).
- Coyle, J. T., Price, D. L., DeLong, M. R. Alzheimer's disease: a disorder of cortical cholinergic innervation. Science. 219 (4589), 1184-1190 (1983).
- Katz, B., Thesleff, S. A study of the desensitization produced by acetylcholine at the motor end-plate. Journal of Physiology. 138 (1), 63-80 (1957).
- Banala, S., et al. Photoactivatable drugs for nicotinic optopharmacology. Nature Methods. 15 (5), 347-350 (2018).
- Yan, Y., et al. Nicotinic Cholinergic Receptors in VTA Glutamate Neurons Modulate Excitatory Transmission. Cell Reports. 23 (8), 2236-2244 (2018).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. α4α6β2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Molecular Pharmacology. 84 (3), 393-406 (2013).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. Journal of Visualized Experiments. (68), (2012).
- Ren, J., et al. Habenula "cholinergic" neurons co-release glutamate and acetylcholine and activate postsynaptic neurons via distinct transmission modes. Neuron. 69 (3), 445-452 (2011).
- Koppensteiner, P., Melani, R., Ninan, I. A Cooperative Mechanism Involving Ca(2+)-Permeable AMPA Receptors and Retrograde Activation of GABAB Receptors in Interpeduncular Nucleus Plasticity. Cell Reports. 20 (5), 1111-1122 (2017).
- Zhang, J., et al. Presynaptic Excitation via GABAB Receptors in Habenula Cholinergic Neurons Regulates Fear Memory Expression. Cell. 166 (3), 716-728 (2016).
- Chen, E., et al. Altered Baseline and Nicotine-Mediated Behavioral and Cholinergic Profiles in ChAT-Cre Mouse Lines. The Journal of Neuroscience. 38 (9), 2177-2188 (2018).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter increased acetylcholine release in the hippocampus. Neuroscience. 218, 1-11 (2012).
- Ting, J. T., Feng, G. Recombineering strategies for developing next generation BAC transgenic tools for optogenetics and beyond. Frontiers in Behavioral Neuroscience. 8, 111 (2014).
- Crittenden, J. R., Lacey, C. J., Lee, T., Bowden, H. A., Graybiel, A. M. Severe drug-induced repetitive behaviors and striatal overexpression of VAChT in ChAT-ChR2-EYFP BAC transgenic mice. Frontiers in Neural Circuits. 8, 57 (2014).
- Kolisnyk, B., et al. ChAT-ChR2-EYFP mice have enhanced motor endurance but show deficits in attention and several additional cognitive domains. The Journal of Neuroscience. 33 (25), 10427-10438 (2013).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter enhances dendritic complexity of adult-born hippocampal neurons and improves acquisition of spatial memory during aging. Neurobiology of Aging. 36 (5), 1881-1889 (2015).
- Denk, W. Two-photon scanning photochemical microscopy: mapping ligand-gated ion channel distributions. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6629-6633 (1994).
- Khiroug, L., Giniatullin, R., Klein, R. C., Fayuk, D., Yakel, J. L. Functional mapping and Ca2+ regulation of nicotinic acetylcholine receptor channels in rat hippocampal CA1 neurons. The Journal of Neuroscience. 23 (27), 9024-9031 (2003).
- Filevich, O., Salierno, M., Etchenique, R. A caged nicotine with nanosecond range kinetics and visible light sensitivity. Journal of Inorganic Biochemistry. 104 (12), 1248-1251 (2010).
- Tochitsky, I., et al. Optochemical control of genetically engineered neuronal nicotinic acetylcholine receptors. Nature Chemistry. 4 (2), 105-111 (2012).
- Wokosin, D. L., Squirrell, J. M., Eliceiri, K. W., White, J. G. Optical workstation with concurrent, independent multiphoton imaging and experimental laser microbeam capabilities. Review of Scientific Instruments. 74 (1), 193-201 (2003).
- Plotkin, J. L., Day, M., Surmeier, D. J. Synaptically driven state transitions in distal dendrites of striatal spiny neurons. Nature Neuroscience. 14 (7), 881-888 (2011).
- Galtieri, D. J., Estep, C. M., Wokosin, D. L., Traynelis, S., Surmeier, D. J. Pedunculopontine glutamatergic neurons control spike patterning in substantia nigra dopaminergic neurons. Elife. 6, (2017).
- Yasuda, R., et al. Imaging calcium concentration dynamics in small neuronal compartments. Science STKE. (219), pl5 (2004).
- Inoue, S., Spring, K. . Video microscopy: The fundamentals. , 163-186 (1997).
- Zipfel, W. R., Williams, R. M., Webb, W. W. Nonlinear magic: multiphoton microscopy in the biosciences. Nature Biotechnology. 21 (11), 1369-1377 (2003).
- Maravall, M., Mainen, Z. F., Sabatini, B. L., Svoboda, K. Estimating intracellular calcium concentrations and buffering without wavelength ratioing. Biophysical Journal. 78 (5), 2655-2667 (2000).
- Wathey, J. C., Nass, M. M., Lester, H. A. Numerical reconstruction of the quantal event at nicotinic synapses. Biophysical Journal. 27 (1), 145-164 (1979).
- Shih, P. Y., et al. Differential expression and function of nicotinic acetylcholine receptors in subdivisions of medial habenula. The Journal of Neuroscience. 34 (29), 9789-9802 (2014).
- Verhoog, M. B., et al. Layer-specific cholinergic control of human and mouse cortical synaptic plasticity. Nature Communications. 7, 12826 (2016).
- Koukouli, F., et al. Nicotine reverses hypofrontality in animal models of addiction and schizophrenia. Nature Medicine. 23 (3), 347-354 (2017).
- Xiao, C., et al. Chronic nicotine selectively enhances α4β2* nicotinic acetylcholine receptors in the nigrostriatal dopamine pathway. The Journal of Neuroscience. 29 (40), 12428-12439 (2009).
- Peng, C., et al. Gene Editing Vectors for Studying Nicotinic Acetylcholine Receptors in Cholinergic Transmission. European Journal of Neuroscience. , (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены