Method Article
活性型のニコチンのレーザー フラッシュ ・ フォトリシス法によるマウス脳切片でのニコチン性アセチルコリン受容体の機能を探る
要約
この記事は、ニコチンの調査によるマウス脳切片でニコチン性アセチルコリン受容体 (nAChRs) を研究するための方法を示します。同時パッチ ・ クランプ記録および多光子励起レーザ走査型顕微鏡と組み合わせることで、ニコチンの調査は、コリン作動性神経の生物学のより深い理解を提供し、細胞の形態とニコチン性受容体機能を接続します。
要約
さまざまな神経プロセスを調節する受容体を介して機能するアセチルコリン (ACh) が、この関数が行われる場所の細胞内の細胞内の局在と ACh 受容体機能をリンクにチャレンジしております。ニコチン性 ACh 受容体 (nAChRs) ネイティブの脳組織中の細胞レベル下の場所を研究するには、光学的手法は電気生理学的記録中に神経細胞膜近く離れた場所でニコチンの正確なリリースのために開発されました。2 光子レーザー顕微鏡、中にその形態を視覚化するスライスが満ちている脳内のニューロンのパッチ クランプを染めるし、光のフラッシュで実行する 1 つまたは複数の細胞膜近くの 405 nm のレーザ光の焦点を当て、ニコチンの調査。携帯電話の現在のたわみを測定、記録されたニューロンの高分解能三次元 (3 D) 画像は nAChR 応答細胞形態との和解を許可させます。このメソッドは、複雑なティッシュの準備、コリン作動性神経伝達の理解を高めることを約束の nAChR 機能分布の詳細な分析できます。
概要
コリン作動性シグナル伝達注意制御、随意運動と報酬1,2を含む多数の脳のプロセスを調節します。アセチルコリン (ACh) の伝送を向上させる薬は、アルツハイマー病、認知3におけるコリン作動系の重要な役割を意味に関連する認知機能障害を治療するために使用されます。コリン作動性受容体と健康と病気の状態の回路の改善された理解は、いくつかの神経学的疾患/障害に対するより良い治療法につながる可能性があります。
ニコチン性 ACh 受容体 (nAChRs) は、たばこ製品からの内因性 ACh または外因性のニコチンに応答中の陽イオンをフラックス リガンド依存性イオン チャネルの家族です。説明4非常に最初の神経伝達物質受容体の間であったという事実を考えると、nAChR 薬理学および筋線維内の場所は筋肉型受容体の周知。対照的に、比較的少しは薬理学およびネイティブ nAChRs 脳内の細胞内分布について知られています。知識で、このギャップは最近細胞イメージング、電気生理学的記録5の中に脳組織の nAChRs の空間的制限と急速な活性化を可能にする化学プローブを開発することによって解決されました。ここでは、神経構造を持つ nAChR 機能を接続する能力を高めの全体的な目標と、このアプローチの重要な方法論的手順はとおりです。
活性型ニコチン (PA Nic; 化学名: 1-[7-[bis(carboxymethyl) - アミノ] クマリン-4-イル] メチル ニコチン) 効率的にニコチン5,6をリリースする 〜 405 nm レーザー フラッシュと photolyzed をすることができます。調査、前に PA Nic にソリューションで安定し厄介な薬理学的または光化学機能5を示さない。光分解後に、リリースされたニコチンは予想通り nAChRs をアクティブにし、uncaging 神経の副産物が薬理学的に不活性5。連続発振レーザーは出力電力が光分解光源として使用される > 1 mW がサンプルで測定されます。ローカライズ対象の光刺激が多光子励起レーザ走査型顕微鏡 (2PLSM) の細胞膜を検索する機能と組み合わされて、このアプローチの 2 つのキー利点は、完全に実現: 光分解速度と空間的な精度。
ほとんどの点で PA Nic の光分解は nAChR 配位子を脳スライス内の受容体に配信する他の方法より優れています。このようなアプローチは、風呂アプリケーション7および薬剤の局所配信を介してフグ ピペット8に含まれます。前者のアプローチは応用の薬剤の長期効果が過度に強調する傾向があり、一方後者は試験間および細胞応答動態の変動に苦しむことができます。これらの代替アプローチのどちらも適切に同じニューロンから別の細胞の場所で受容体の活動を区別できます。ACh の放出を生じる活性化は、ネイティブの nAChRs9,10,11の調査のため使用されていますが、それはないマッピングの細胞内局在の nAChR 場所が役立っています。さらに、ほとんどの研究がこのアプローチを利用して依存している ChR2 表現の細菌人工染色体・遺伝子改変マウス コリン作動性透過率の異常12,13,14,15,16,17。
PA Nic の光分解は、コリン作動性受容体を研究するため唯一の光学的方法ではありません。ケージ カルバコール機能的細胞18と脳スライスの19、ACh 受容体活性をマップに使用されたが PA nic の開発中には比較用に市販なかった(ビピリジン) ルテニウム bis-ニコチン複雑な (ルビ-ニコチン) はニコチン uncaging 神経20、ように報告されましたが、頭に頭の比較では PA Nic に劣る証明したルビ ニコチンの商業準備研究5。非営利でこのような比較実験を繰り返す便利なことがありますその可視吸収はコリン作動性研究 PA Nic 機能をほめることができるよう、ルビ ニコチンを高度精製します。最後に、nAChRs も操作されている光学写真切替可能なリガンドと受容体の遺伝子組み換え21の組み合わせを使用しています。このアプローチの利点と欠点を見て変更された nAChR の遺伝子ターゲティングの能力/要件と、脳組織の PA Nic 光分解に補足であります。
このアプローチのいくつかの要件は、注意してください。まず、適切な可視化法は神経細胞膜を正確に特定する必要です。培養細胞の研究と従来のエピ蛍光顕微鏡を用いたイメージングで十分かもしれませんが、脳スライスまたはその他の厚いティッシュの準備のニューロンから記録、2PLSM または共焦点顕微鏡が必要。第二に、光分解レーザー ビームを配置する適切な方法が必要です。このアプローチは、ラスター スキャン イメージングのビームおよび uncaging 神経レーザー ビーム22,23,24を使用してポイントの photoactivation のため 2 つの独立した x と y ミラー付きデュアル ガルバノ スキャン ヘッドを採用しています。他より限定されたソリューションが可能であれば、代わりにラスター スキャンする画像のビームと uncaging 神経ビームまたはそのセルを連れて (2) 単にビューのフィールドの中央に uncaging 神経のビームを演出 (1) 単一ガルバノ スキャン ヘッドなどフラッシュ ・ フォトリシス法のこの位置。第三に、システムは、実験中に生体信号を収集する希望する場合は同時に電気生理学的記録のため必要です。最近説明5として適切な全光イメージングと上記の要件を満たすことが。以下では、詳細なプロトコルが含まれているはこのアプローチの主要な手順について説明します。
プロトコル
脳スライス標本に係る業務が見直され、北西大学動物ケアおよび使用委員会 (#IS00003604 ・ プロトコル) によって承認されました。
注意:ポイント光刺激用レーザは、目に害を引き起こす可能性がある表示クラス IIIb のレーザーです。2PLSM 近赤外線 (NIR) クラス IV レーザーが必要です (> 500 mW)、他の組織の目とも火傷に深刻な害を引き起こす可能性があります。適切なレーザー ビーム封じ込め、システム インター ロックに加え、設計と管理コントロールは、レーザー ベースの機器の安全な操作を確保するため必要があります。レーザーを操作するとき、常にローカル レーザーの安全担当者を求めてください。
1. 校正と uncaging 神経 Laser(s) の検証
-
サンプルに配信するためのレーザー出力を定量化します。
- 405 nm レーザー (100 5 V 制御信号と mW 最大電力) をオンにし、レーザー システムのウォーム アップに、約 10 分。
注:レーザーはまだ (0 V ドライブ) を閉鎖、レーザーの出力を調整する制御電圧が送られるまで、出力はありません。 - 組織サンプル平面またはコンデンサー レンズの代わりに電力計を配置します。手動で中央に光パス/対物レンズを基準にしてメーター。
- 正しい波長範囲 (400-1100 nm) にメーターを設定します。適切なボタンを押すことによってメーターをゼロに。
- ソフトウェアのコントロールを使用して、選択 100 (最大 1000 のうち; 1000 = 5 V) 405 nm レーザー電力では、レーザーをフルパワーの 10% に設定します。レーザー制御電圧、 PrairieViewシステムを介してコマンドのデジタル記録を提供するVoltageRecordに供給することも必要な場合、信号のタイミング、電力レベル。
- 電力計からの読み取りを記録します。
- 405 nm レーザー出力の 150 (最大 1000 の 15%) を選択し、電力計からの読み取りを記録します。レーザーのパワーカーブを収集する次の出力電力のこの手順を繰り返します: 200 250 300, 350, 400、450、500、550、600、650、700、750、800、850、900、950、1000。
- 405 nm レーザー (100 5 V 制御信号と mW 最大電力) をオンにし、レーザー システムのウォーム アップに、約 10 分。
-
Uncaging 神経レーザー検流計を調整します。正確なスポット位置決めまたは毎月定期的に懸念があるときシステムの光学部品に変更があるときに、次の手順を実行します。
- 組むとイメージング実験水浸漬顕微鏡の対物レンズに使用する x 60 をインストールします。集録/イメージング ソフトウェアで 60 倍対物レンズと 1 の光学ズーム設定を選択 (ステップ 3.1.4.2 を参照)。
- 赤い油性ペンできれいなガラス顕微鏡スライド上に塗りつぶされた円をマークします。目的に向かってマーカーを持つ顕微鏡ステージにスライドを配置します。
- 事前に赤いマーカー領域 4 倍または 10 倍目的の顕微鏡を焦点します。赤いマーカー ドット/スポットの上部に 1-2 mL の水を追加し、60 × 対物に切り替え、目的を水の中に水没します。薄い赤マーカーの領域に対物レンズの焦点を合わせます。
- 2 光子レーザーのスキャンに切り替えます。ほとんどのシステムでスキャン ヘッド ミラーをフロントに移動位置 1、光路から三眼プリズムを移動するタレットを移動、~ 900 にレーザ波長を設定 nm。刺激ミラー校正ルーチンの既定のピクセル要素である画像集録パラメーターの 512 x 512 ピクセル ボックスのオプションを選択します。
- 最小値より大きな画像のレーザ走査システムを起動し、薄い赤いマーカー蛍光層上に目的のフォーカスを微調整します。マーカーで破片の明確かつ均等にコーティングされた蛍光フィールドでフィールドを選択します。
注:このプロトコルの設定は、 PrairieView 5.4 集録/イメージング ソフトウェアを使用します。 - ソフトウェアの校正/アライメント ツールメニュー内uncaging 神経のガルボ ・ キャリブレーション機能を開きます。2 番目のガルバノ メーター ミラー ペアの空間のキャリブレーションのためのスポットを書き込むチュートリアルについて説明します。
- スポットを書き込むチュートリアル 405 nm レーザーを選択、400 のレーザー刺激力 20 さんこれを小さな得られるはずの刺激期間を選択 (1 ~ 5 μ m 径) 赤いマーカーの穴。
注:設定など 2 ~ 4 mW と 1-10 ms は通常使用されます、しかし、設定は、サンプルによって決まります。PA Nic 写真刺激電源設定は、校正中に赤いマーカー スライド内に可視の穴をアブレーションに必要な電力よりもはるかに低い可能性があります。この校正ルーチン組むスポットを見つける場合に便利ですが、生理中に絶対組むボリュームを推論するは使用しないでください。 - 刺激し、センター スポットを書き込むし、丸い赤のインジケーターを実際の場所に移動した後に、画像を更新する更新プログラムを選択します。これを行うセンター スポット、右中央のスポット、低いセンター スポット、最終的に 9 つのスポット (すべてのコーナーとエッジ プラス イメージの中心) のグリッドの。
注:中央、右、および下の場所に修正されたスポットは、真の中心と X と Y は、イメージングのミラー ペア刺激ミラー ペアを一致するようにスケーリング要因を定義する刺激検流計電圧を決定します。ソフトウェアは、拡張、および更新、すべてのそれに続くMarkPoints実験空間キャリブレーション ズームから異なるズーム設定で実行されます。
- スポットを書き込むチュートリアル 405 nm レーザーを選択、400 のレーザー刺激力 20 さんこれを小さな得られるはずの刺激期間を選択 (1 ~ 5 μ m 径) 赤いマーカーの穴。
- MarkPointsウィンドウを開き、サンプルの新しい領域に定義されたこすって刺激パラメーターを手動でアクティブにするキャリブレーションをテストします。MarkPointsウィンドウに正しい、最新の校正ファイルが読み込まれることを確認します。定義されたこすってMarkPoints/グループまたはMarkPoints シリーズの機能をアクティブ化または右/左クリックしてテスト パルスを適用する中ライブ スキャン画像の任意の場所マウスのライブ/アブレーション機能を利用正しい校正を確認します。
注:スポットのレーザー書き込みは今MarkPointsインジケーターに完全に集中する必要があります。 - 監視し、駆動電圧をVoltageRecordプログラムに叩くことによって活性化レーザー パルス電源と時間を記録 (1.1.4 の手順を参照してください)。同様に、光刺激ガルバノ メーター ミラーのペアから派生したフィードバック信号からスケールされた電圧信号を用いた刺激スポットの位置を記録します。
2. 活性型ニコチン (PA-Nic) の準備
- 凍結乾燥活性型薬剤の因数をストレージから取得します。
注:次のプロトコルは PA-Nic; の特定他の活性型薬剤のために必要に応じて調整します。PA Nic は、優れた安定性5を示してが準備や実験の中に明るい光への暴露からそれを保護するために合理的な予防措置を取る。これは単に低光の中で実現できます。赤い光を制限することは必要ではありません。 -
PA nic のローカル アプリケーションを実行します。
- プログラム可能なピペットの引き手と 20-40 μ m の開口径をガラス マイクロ ピペットを引き出します。
- 0.22 μ m のフィルターで解決策を記録する 〜 1 mL をフィルター処理します。2 mM の最終濃度を生成するフィルター処理された録音ソリューションで PA Nic の数量を再懸濁します。たとえば、フィルター処理された録音ソリューションの 50 μ L で凍結乾燥 100 nmol 因数を解散します。
注:最近出版物5,6 PA Nic 光分解を用いた推奨記録ソリューション構成を見つけることができます。 - 埋戻し 2 mM PA の nic の 50 μ L でローカル アプリケーション ピペット
- マイクロマニピュレーターにマウントされているピペット ホルダーにローカル アプリケーション ピペットを固定します。圧力放出システムの持続的な低圧アプリケーション (1-2 psi) の対応に適切なチューブを介してピペット ホルダーを接続します。
- 細胞外記録ソリューションおよびマウス脳組織をやや上回るピペット チップを位置の興味のセルから ~ 50 μ m にローカル アプリケーション ピペットを操縦するマニピュレーターを使用して。マウスの脳スライス標本とパッチ クランプ録音8の詳細なプロトコルの以前のレポートを参照してください。
- 簡単に (1-2 psi) の圧力を適用することによってアプリケーションのパラメーターを確認します。興味のセルのない変位を最小限に抑えてあるはずです。重要な動きが発生した場合興味のセルからさらに離れて (横方向アキシアル方向) のローカル アプリケーション ピペット位置を変更します。
- パッチク ランプ安定したセル全体を達成した後 (の詳細は前の発行8に含まれている)、圧力放出デバイスで適切な手動スイッチを使用して低圧 (1-2 p.s.i.) アプリケーションを有効にします。次のステップに進む前に 1-2 分の PA Nic とセルの周囲組織を飽和させます。
-
脳スライスに PA Nic の風呂アプリケーション (スパーフュー ジョン法) を実行します。
- 100 μ M の最終的な集中をもたらす連続再循環の適切なソリューションを録音のボリュームで PA Nic の量を溶解します。たとえば、分注 1 μmol を標準的な 15 mL チューブを用いた記録溶液 10 mL に溶解します。
- 灌流系における適切なフロー制御を開くことによって 1.5-2 mL/分の速度で PA Nic ソリューションの再循環を開始します。記録の期間の再循環が発生します。貴重な薬を節約、最小内径のチューブを使用しておよび/または灌流システムで使用したチューブの全長を短縮することによって、循環量を最小限にします。
注:これらの手順に従って、PA Nic 溶液 5 mL に風呂循環用のボリュームを削減できます。PA Nic ソリューションは、連続する 2 つのよく使用できます 4 ° C で光から保護されて保存されている場合は、同じ週内で日を記録 - 循環、中に継続的にバブル (5% O295% CO2) カーボゲン ・ ソリューション、32 ° C の温度でお風呂を維持
- 録音ソリューション PA Nic での低光の条件で作業中の脳のスライスを保持します。
3. 2 光子レーザー顕微鏡で神経細胞のイメージング
- セルのライブの視覚化を実行します。
- 透過光を用いた内側 habenula (MHb) ニューロンを識別/可視化または赤外線微分干渉コントラスト (IR/DIC) の光学、ビデオカメラと安定した全細胞のパッチク ランプを確立します。鋭く作製したマウスの脳スライス8のニューロンからパッチ クランプ録音の詳細については以前の議定書を参照してください。
- 高抵抗を確立した後 (> 1 GΩ) セル接続構成、侵入前にセットアップとスキャン モードをレーザーにソフトウェアを切り替える。
- 慣らしでは、染料を使用してレーザ走査機能を確認して、イメージング (100-200 の最終濃度に希釈して標準的な細胞内ピペット ソリューションに μ M 前述8) 受動的 (拡散) により、ニューロンを充填します。染料 (例えば、 Alexa Fluor 488 赤 PMT チャンネル、光電子増倍管 1 の 594 または Alexa Fluor 568 PMT 2; 緑光電子増倍管 [PMT] チャネル) の可視化を必要とする実験を試みる前に、少なくとも 20-30 分の細胞コンパートメントを記入できるように任意の細胞コンパートメント、相馬の外。
注:末梢コンパートメント (樹状構造、棘、軸索、等.)25を完全に埋めるための 30-40 分を必要とする場合があります。 - ソフトウェアスキャン ライブ機能を使用して、ニューロンおよび興味の細胞レベル下コンパートメントを視覚化します。正確な撮像パラメーター ライブ神経機能の可視化を選択します。影響を与えるまたは表示の可視化 (コントラスト)、解像度、信号対雑音 (S/N) 比、および画像フレームの取込時間を変更する各種の設定を操作するには。
-
ルックアップ テーブル (LUT)。イメージ ウィンドウの側面に適切なアイコンを使用して LUT ウィンドウを開きます。一度開いて、LUT 床 (分) と天井 (最大) の設定特定の画像チャネルの信号のコントラストに表示画面の可視化を向上させる調整。~ 1000 (4096、12 ビット検出)、調光器の最初のセルを検索するときの信号、信号、および構造を抜くのに役立ちますに最大値を下げます。
注: これらの設定は、検出された記録された値ではなく表示されている信号をのみ影響します。人間の目通常できるのみコントラストを 50 〜 灰色レベル26です。 -
光学ズームします。ソフトウェアのコントロールを使用すると、1 X 光学ズームとパンの組織で必要な領域を検索するのにコントロールの使用を選択します。このズーム設定最大の広場を生成、ビューのフィールドをスキャンし、最大電圧/スキャン角度をガルバノ メーター ミラーに送信します。
注:既定の構成は、12 mm のサンプル中の対物レンズの倍率で割った値に変換スキャン頭の中 12 mm × 12 mm の視野です。したがって、対物レンズ収量 x 60 は 1 光学ズーム × サイドあたり 200 μ m の画像をスキャンしました。高い光学ズーム値より少ない区域をスキャンします。2 倍光学ズームはしばしば最も役に立つ設定全体のニューロンを可視化です。4 x では、ニューロンの細胞内の側面を可視化することができます。 -
ピクセル数。光学ズーム × 1 を補うためには、1024 x 1024 ピクセル/ソフトウェアのコントロールを使用して、行を選択します。対物レンズからの詳細を可能な限り失うことにキャプチャおよび表示されている画像のラインあたりのピクセル数を設定します。60 x の次の実用的なピクセル値を使用/1.0 開口数 (NA) 目的: 1024 x 1024 ズーム 1、ズーム 2、512 x 512 256 x 256 のためのズーム 4。最後のピクセル サイズ (~0.17 μ m; 12 mm/倍率/ズーム/ピクセル) は、半分、または少ない、対物レンズによって定義された横方向の解像度のはずです。
注:画像の解像度はレーザーの波長と客観的 NA によって定義のみ (920 の 2 光子励起 [2PE] から 0.4 μ m の解像度 nm と 1.0 NA 目的)27。条件における励起 NA、レンズに記載されている、レーザー ビーム径マッチの 1/e2強度は、(または「塗り潰し」) 入射瞳 (チューブ レンズ焦点距離 x 2 x の NA/倍率) 対物レンズの。ここで説明したシステムでチューブ レンズは、180 mm の焦点距離を持っています。 -
ピクセルのドウェル時間.ソフトウェアのコントロールを使用して、ピクセルの滞留時間、既定値の 4 μ s を選択します。
注:ピクセル ドウェル時間変更適用されません平均信号が検出されました。それだけ影響を与える内ピクセルの平均化と SN 比による画質的にこれらの変更を視覚化できます。イメージのピクセルのドウェル時間は常に 0.4 μ s 単位の倍数と 12 ビット限定強度回大きいドエル各イメージ ピクセルの値が 0.4 μ s のサンプルの平均値。ピクセル滞留時間 (4 μ 秒に等しい 10 サンプル、または S/N の改善を 3.16-fold) あたりのサンプル数の平方根として S/N 比が向上するので、画像品質の改善は 12 μ s よりもはるかに大きい値の逓減を達する。 -
回転と利子 (率 ROI) の領域をスキャンします。ソフトウェア コントロール (操作する必要はありません、0 ° 回転はほとんどのイメージング システムの既定の設定) を使用して、0 ° 回転する画像の角度を設定します。サンプルを「逆さま」方向に配置すると、「フリップ」のイメージを 180 ° 回転を選択します。
注:回転、任意の特定の角度で塗りつぶされたセルの関心の領域の全体のためのより良いフィットを提供できます。回転はまた明確に構造変化を合わせ、その後の分析を実行するためをもたらすことができます。ネイティブ画素数 (手順 3.1.4.3)、保持(ステップ 3.1.4.2) 特定のズームの設定でスキャンした画像内で関心の領域を選択するが、エリアとピクセルの合計数に制限が提供するフレーム レートを増やすことができます劇的に改良時間分解能信号変化。 -
フレームの平均です。ソフトウェア コントロールを使用して 2 つのフレームの開始フレームの平均設定を選択します。
注:最終的なイメージのコントラスト (S/N) は画像の信号のピクセル内に収集/検出合計光子によって定義されます。複数画像フレームの平均はサンプルが動かない又はイメージング中に無漂白は S/N 比を改善できます。興味の信号フレーム平均平均フレーム数の平方根で画像のノイズを低減しながら中に同じ値のままです。蛍光画像の小さい構造イメージ (ROIs とも呼ばれる) や平均フレーム内のピクセルを結合間のピクセルが平均化が必要です。フレーム画像の 1 つの数によってスキャン時間の増加の平均は、平均を選択します。
-
ルックアップ テーブル (LUT)。イメージ ウィンドウの側面に適切なアイコンを使用して LUT ウィンドウを開きます。一度開いて、LUT 床 (分) と天井 (最大) の設定特定の画像チャネルの信号のコントラストに表示画面の可視化を向上させる調整。~ 1000 (4096、12 ビット検出)、調光器の最初のセルを検索するときの信号、信号、および構造を抜くのに役立ちますに最大値を下げます。
- パン コントロール、回転のスキャン、および光学ズームツールを使用して、スキャンしながらサンプルの場所を方向づけます。モーター ステージの操作はサンプルを配置する必要がある場合は、反射面に衝突目的/コンデンサー、振動、またはレーザー光の露出を防ぐために X、Y、および Z 軸に大きなステップ サイズを避けてください。
- Z スタックを収集します。Z シリーズのツールを使用して、開始を選択し、目的のセルを格納する位置を停止します。ステップ サイズ (1 μ m) を選択し、セルを含むあらゆる Z 平面でニューロンを連続画像します。
注:Z スタック取得設定はニューロンの種類と色素を充填によって異なります。ライブ イメージング用パラメーターに関係なく、Z スタックの取得の最適なパラメーターを願います。Optopharmacology 実験の前後に、Z スタックの取得を実行できます。可能であれば、任意の細胞の損傷を避けるために optopharmacology による 2PLSM から、最適な色素を埋めるのための小さな細胞コンパートメントを許可する後 Z スタックの取得を実行します。
4. 電気生理学的記録中レーザー フラッシュ ・ フォトリシス法
注:405 を適用する nm または 473 nm レーザーの ≥ 1 mW を生成する目的とコンデンサー レンズのガラスの内部の燐光。この生成された光はレーザーの照明電源に直接関係します。排出量では緑と赤のスペクトル windows に存在、ms の範囲で励起状態の寿命。この背景刺激の成果物は、テストしたすべてのレンズと対物レンズのすべての主要なメーカーから水浸対物レンズに見られています。コンデンサー レンズは、対物レンズよりも多くのより高い燐光を生成します。この「信号」の光刺激のイベント中に敏感なガリウムヒ素リン (GaAsP) 光電子増倍管冷陰極の保護のため機械式シャッターの使用を動機します。(積極的にスキャンする場合は休業) ノーマルク メカニカル シャッターを使用して冷却 GaAsP 光電子増倍管の保護に最適なソリューションを表します。
- 砂時計型光のビームのジオメトリでは、それ以外の場合狭い/収縮を引き起こすとレーザ光に入る目的の入射瞳と光パス光学系の任意の集光レンズを削除します。
- MarkPointsで、1 つのスポットの設定を選択します。
注:その他の光刺激の設定 (複数のスポット、観光スポット、スパイラル走査のグリッド) がMarkPoints内で可能です。単一のスポットは、最も簡単です。実験的目標と生物学的差異は、別の設定が余儀なくされるかもしれませんが。 - 簡単にイメージを作成し、関心のある細胞内領域を検索ライブ スキャンオプションを使用してイメージを更新します。フォーカスの任意の潜在的な小さなドリフトを識別する画像を定期的に更新します。
- ソフトウェア コントロールを使用して光学ズームを拡大 (すなわち、現在のものよりもより高い光学ズーム設定を選択)、必要に応じて、小さな構造体 (すなわち、棘や樹状突起先端部) を可視化します。
- MarkPoints単一スポット クロスヘア カーソル隣接 (~0.5 μ m) が細胞膜を配置します。行う場所写真刺激スポットない直接細胞機能の上これにつながる光損傷。
- 光刺激のパラメーターを設定MarkPointsのソフトウェア コントロールを使用します。次のように開始のガイドラインを適用する: 1-50 ms の期間、1-4 mw レーザーおよび ≥ 1 トライアル。
- MarkPointsプロトコルを開始し、リアルタイムで電気生理学データ集録を観察MarkPoints の実行を選択します。
- 一貫性と安定性を評価または応答振幅と速度の欠如に数回 4.2 4.7 の手順を繰り返します。
結果
光分解の刺激、被曝線量 (強度と時間)、露出場所、および梁のジオメトリは、キーの変数です。この資料に記載さシステムの調整を介してビーム検流計システムに入る前に、光の光路のレンズ/アウトを移動、2 つの異なる光ビームが可能です。このレンズなし光ビームいっぱい 60 x の入射瞳/水浸漬 [60 x WD] 1.0 NA 近く-回折-限られた、サンプル中のフォーカル プレーンでサブ μ m スポットを作り出す目的。これは、光刺激の上と下の焦点と光軸対称の拡張、砂時計の形で光に関連付けられます。パスに挿入レンズ、光レーザー光は、対物レンズの入射瞳に焦点を当ててして鉛筆のようなビームとして終了します。直径 60 x の目的のために 〜 10 μ m にする予定です、このビームを均一/垂直方向にサンプル全体をとおして拡張します。このモードで刺激スポット内で任意の場所に光の強度は回折限界に近い小さなスポット強度の ~ 1% になります。したがって、~ 10 μ m スポットの刺激を使用する場合、高いレーザーが通常必要です。この記事で報告するすべての実験の砂時計型光ビームが使用されました。
配信されるサンプルの電源は、レーザー出力の電源メーターを使用してサンプルを測定後、入力電圧設定に対してプロットできます。これらの研究は、2 mm の作動距離の WD 目的 x 60 を使用して、それは電力測定器の要素に潜在的な損傷を防ぐために水に浸漬されません。目標を挙げて NA > 0.95 は空気 (せずに浸漬液) で測定される、下位のインデックス (空気) のためレンズ前面の要素の全内部反射損失をすることができます。(総内面反射の損失を補正) により正確なサンプル パワー測定の場合、1.0 NA 客観的 (1.0/0.95)2大気中で測定した電力を増加します。図 1 aは、405 の典型的な入力/出力プロットを示しています nm、473 nm 可視光レーザー レーザーに組み込まれている本研究ではシステムを起動します。これらのレーザー システムは、次の理由により光刺激露出量制御に最適な: (1) 入力電圧を基準にして直接線形電力出力を提供するために事前に校正されている (0-5 V)、(ないレーザーを用いたサイレント シャッター操作を提供 (2)出力)、(3) は急速なサブ ms 強度パルス持続時間制御 (0.1 ms 応答)。レーザー/ガルバノ システムとスポット光刺激を使用している場合MarkPointsスポットのルーチン調整は欠かせない作業です。図 1b(左側のパネル) 適合外にあるシステムを示します (写真刺激するために必要なポイントは発生しませんそのポイントの正確な刺激やけど穴の位置によって示される)、(のキャリブレーション後スポットの正確な位置決めに戻ると図 1 b、右側のパネル)。
PA Nic は控えめな蛍光 (発光ピーク ~ 510 nm)、350-450 nm (1 光子励起) または 700-900 nm (2 光子励起)5の間効果的な加振を展示します。ローカル アプリケーション中に PA Nic を視覚化、PA-Nic (1 mM) を続く (1) 脳組織切片光通信コンテキストの同時イメージング Dodt コントラストと (2)、放出される蛍光励起から脳組織に近い適用 (900 nm) のPA の nic PA-Nic 2PE 蛍光の間にあったローカル アプリケーション ピペット (図 2 a) からの圧力取り出し容易に検出できます。ニコチンと monoalkylcoumarin、7-carboxymethylamino-4-メチル クマリンは、PA Nic 光分解反応5の主な光化学製品です。同じ設定/PA-Nic イメージングに使用されたパラメーターをイメージングを使用して、組織はニコチン (1 mM) または 7-carboxymethylamino-4-メチル クマリン (1 mM) のいずれかの配信中にイメージしました。蛍光シグナルが検出されません (図 2 a、中間と下部パネル)、PA Nic 結果の特異性を示します。最後に、PA Nic 脳組織内で適用し、PA Nic 蛍光発光をイメージしました (図 2 b)。このアプローチは、PA-Nic が 100-200 μ m のローカル アプリケーション ピペット内に存在ことを確認します。一緒に、これらのデータは、PA-Nic が効果的にローカル アプリケーション経由で脳組織に配信されることを確認します。
細胞構造の可視化のための同時2PLSM で録音を電気生理学実験の両方のコンポーネントのバランス考慮事項を治験責任医師を必要とし、しばしば狭い時間枠 (~ 20 分) は利用有効パッチを適用したセルからサンプル データ集録。細胞の可視化を考慮せず安定性を記録するため時間とともに減少する傾向がある侵入後、できるだけ早く記録を開始するベスト プラクティスです。ただし、イメージングが要件と、電気生理学的考察は小/リモート構造で蛍光濃度増加に十分な時間を許可する必要があります。これは、充填曲線28、新しいセル型撮像時の取得に有用ある色素の濃度を調べることによって例証されます。図 3は、いくつかの例ニューロン Z スタックとして 2PLSM を介してイメージを作成、プレゼンテーション目的のため最大強度投影に折りたたまれているを示しています。図 3 aは、どこ神経形態表示完了するのに、ノイズを最小限に抑える、破片は細胞形態の解釈と干渉しない高品質の画像を示しています。図 3 bは、下のシグナル/バック グラウンド比および実質的な破片のための低品質の画像を示しています。この残骸は、しばしば強烈な蛍光、セルに近づいている間パッチ ピペットから染料をイメージングの取り出しから生じる球面ポケットとして表示されます。特に、100 μ M のお風呂 (お風呂アプリケーションを実行する) ときに PA Nic は信号-バック グラウンド比率を削減する傾向がある、サブ最適な画像のコントラストにつながります。Alexa Fluor 568 または 594 はローカル アプリケーションの実験で非常に有用が多いファインダー染料としてまたは正規化 2PE 参照/正規化信号として。これらの染料の 2 光子励起波長 〜 780 nm です27、PA Nic の同時可視化と細胞コンパートメントの同定を可能にします。この波長ただしがない完全に避ける PA Nic5の 2 光子光分解。Alexa Fluor 488 は PA Nic 浴適用実験; に有利であります。適切な波長 ≥900 nm で励起されると、細胞コンパートメントの適切な可視化を維持しながら PA Nic5の 2 光子光分解を回避できます。
図 4は、脳スライスの MHb ニューロンでローカライズされた PA Nic レーザー フラッシュ ・ フォトリシス法のデータの例を示します。図 4 a(上部パネル) 写真刺激スポット場所を重ねて、 MarkPointsプロトコルが実行された前に最後の 2PLSM 画像の画面キャプチャは、「参照」イメージの例を示しています。図 4 a(下方の画像パネル) 細胞形態に重ねてスポット光刺激の拡大ビューを表示します。PA Nic 光分解に対応する時間相関のとれた電気生理学的応答は、図 4 aの下のパネルに表示されます。前作は、これらの流れが nAChR 拮抗薬5に敏感であることを示した。図 4 bは、どちらかの 1 の間隔でシングル スポット光分解を行った別のセルから代表的なデータを示しています s または 10 秒の 10 秒間隔保持電流基準の十分な回復時間を許可されるに対し、1 秒間隔を短くをもたらした、プロトコルとして現在の持株の緩やかな増加が進んだ。現在増加ニコチンが 1 Hz 間隔29とシステムから拡散する十分な時間を持っていなかったことを示唆しています。そんなの時間応答特性を解析する必要がありますは、nAChRs の神経薬理学は細胞の種類によって異なるかもしれませんが、検討されている任意の新しいセル型の de novo を実行しました。
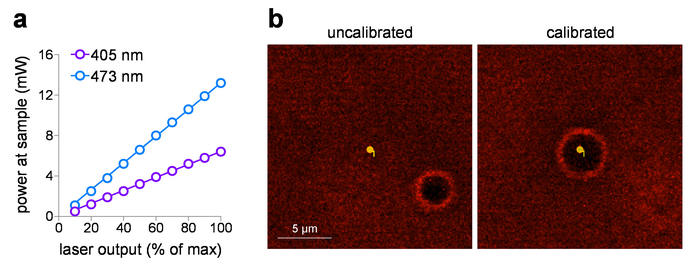
図 1: 組むレーザー校正します。(、) 写真刺激レーザー出力。試料面で電源 (60 x を/1.0 NA 水浸漬の目的) 405 の測定した nm と 473 nm の光刺激レーザー出力設定で。(b) 写真刺激レーザー校正。画面キャプチャ画像が意図した写真刺激スポットと光刺激が前 (左) に、(書き込み穴) を発生する対応する位置の空間関係を表示およびMarkPointsの (右) 実行されている校正後。この図の拡大版を表示するのにはここをクリックしてください。
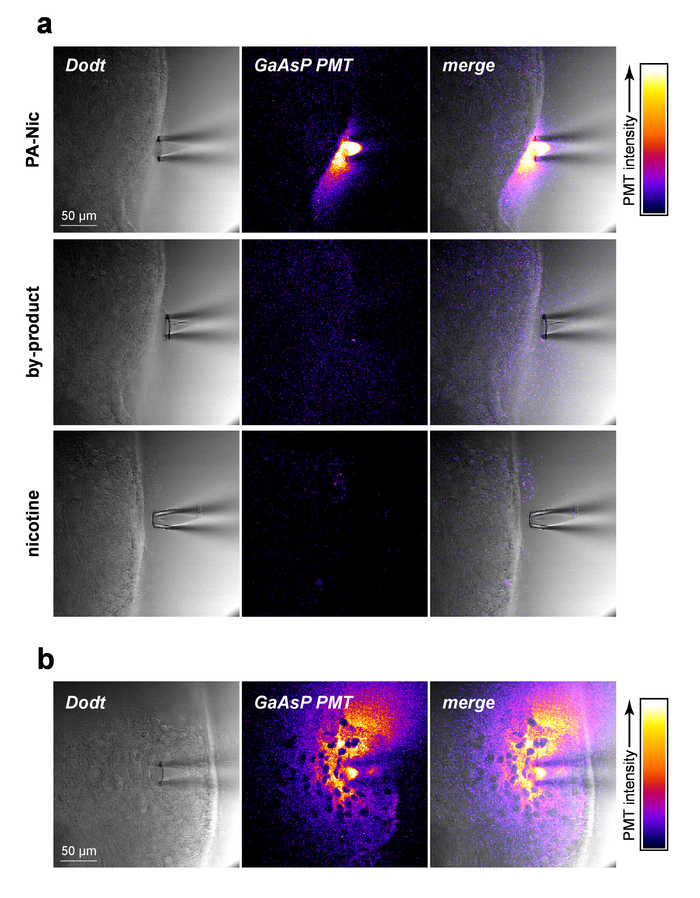
図 2: PA Nic のローカル アプリケーション。(、) PA Nic 検出のローカル アプリケーション ピペット。1 mM PA Nic、光分解副産物またはニコチンがアプライドに溶解し、ローカル アプリケーション ピペットに読み込まれ、2PLSM 中に脳組織の上に分配される (900 nm 励起) 各薬剤の同時イメージング設定を用いたイメージングします。GaAsP 陰極光電子増倍管は蛍光性の放出をキャプチャする使用されたに対し、Dodt コントラスト透過像を走査型レーザーは組織/ピペットを示しています。(b) PA Nic (1 mM) は脳組織灌流され、その本質的な蛍光を用いた PA Nic の横方向の広がりを表示する (、) のように 2PLSM を介してイメージを作成します。この図の拡大版を表示するのにはここをクリックしてください。
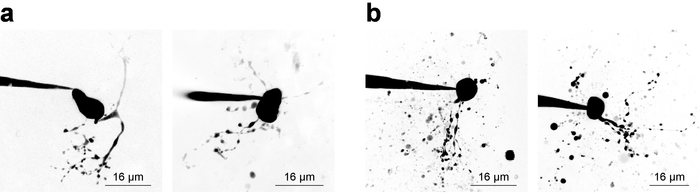
図 3: 2 光子レーザーのスキャン顕微鏡画像の集録します。(、) の最適な 2PLSM Z-スタック。MHb よく解決樹枝状結晶ニューロンの示す 2PLSM Z スタック最大強度突起の 2 つの例は、ない干渉の破片はほとんど。(b) 準最適 2PLSM Z スタック。2PLSM Z スタック最大強度突起の 2 つの例の MHb ニューロン (色素細胞のアプローチの中にピペットから追放) の残骸に囲まれています。このような画像は (、) に示すようなイメージよりもを解釈するより困難です。この図の拡大版を表示するのにはここをクリックしてください。
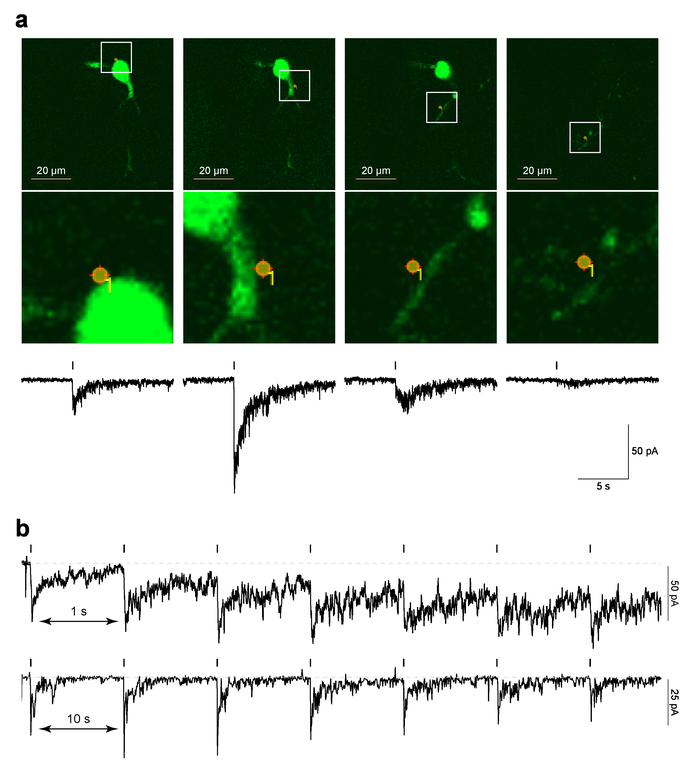
図 4: PA nic のレーザー フラッシュ ・ フォトリシス法(、) MarkPoints参照画像と PA Nic 光分解により誘発される内向きの電流。一つの MHb ニューロン 1 つ (示されている) 細胞の場所でMarkPoints光刺激試験生参照画像が表示されます。メモいくつかの光刺激の場所 (このシリーズで一番右の画像)、樹状構造は、フォーカスしますが、相馬と近位樹状突起はありません。下の各参照画像ニコチン調査誘発内向き電流がプロットされます。(b) 刺激間間隔 PA Nic 光分解のため。1 の刺激間間隔と同じ perisomatic の場所でニコチンが繰り返しケージ MHb ニューロンの手本録音が表示されます s または 10 s.この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
PA Nic アプリケーション/配送方法の選択は、このローカライズされた光刺激法の最も重要なステップです。2 つの方法、風呂アプリケーションおよび局所灌流それぞれの明確な利点と制限事項を提供しています。選択主、興味のセル型で nAChR 機能発現レベルに影響されます。よく、バス アプリケーションの均一なプローブ濃度データの解釈を促進する、記録されたセルを囲むことができ、機能発現レベルが高いとき、お風呂のアプリケーションを使用することをお勧めします。お風呂アプリケーションも全体のプロセスを容易にして、組織の 2 番目の灌流ピペットの必要があります。ただし、高価なバス アプリケーション化合物実験あたりのコストの。
一般的に、トラブルシューティング nAChR 活性化に見られる次のせん光がない理由を理解しようとして含まれます。捜査官が ACh のローカル パフ アプリケーションを実行する必要があります PA Nic と以前に検討されていないセル型を操作する場合、または十分な受容体が機能的かどうかニコチン5を表明しました。システムが光分解反応を検出できることを検証するため内側 habenula ニューロン受容体30の大量を表す制御実験を行う必要があります。この脳領域では、PA Nic 風呂アプリケーションは検証実験のために望ましいである可能です。これらの検証実験を実行した後のみ 1 つに進みます巧まないセルタイプ。NAChR を強化する nAChR 正アロステリック変調器を追加それは PA Nic の濃度を高める、フラッシュ強度やパルス持続時間増加する正当化されるかもしれない実験システムの検証し、応答残る非常に少ないか検出できなかった場合「アクティビティ6」、またはこれらのいくつかの組み合わせ。
時折、uncaging 神経応答が大きすぎて、間接電圧の結果として重要な nAChR 活性化ゲート Na+チャネルの活性化と貧しい空間クランプによりアンクランプの内向きの電流。完全に無名の nAChR 内向きの電流とデータ解釈は不可能、これらのアーティファクトを記録ピペットで QX-314 (2 mM) を含めることによって回避できます。PA Nic の濃度を減らすことによってまたはフラッシュの発光量や脈拍の持続期間を減らすことによっても廃止される可能性があります。すべての可視光写真刺激実験の意図しない刺激光/分解目的の焦点面の上下を避けるために刺激部位を選択するときにケアを行使しなければなりません。さらに、該当するレーザー出力の必要があります常に滴定する生理学的応答を再現します。特に z 軸組む上/下の焦点スポット活性化配位子がまだ拡散し、調査の下で生物学的システム (すなわち,受容体) との対話にケージの配位子を扱うときに注意することが重要です。
いくつかの制限が存在すると、PA Nic レーザー フラッシュ ・ フォトリシス法はすべての調査官のことは適さない場合があります。最初の適切なセットアップのコストが比較的高いです。そのまま脳スライスを使用するとき樹状突起は、2 光子励起顕微鏡など高度な可視化システムを必要とするような小径構造近く調査。チタンサファイアレーザー、実行する 2 光子顕微鏡用可変 IR パルス レーザーのコストが高いは別としてさらに 2 つのレーザー光の位置を独立してできるデュアル検流計システム システム コストが増えます。捜査官に十分な専門知識と構築、トラブルシューティング、およびそのようなシステムを維持する時間あればホームが構築したシステムを使用して、システム全体のコストを削減できます。しばしば第 2 の制限は、低 nAChR の機能発現は、部分的に前述の手順を実行して軽減することができます、しかし、これは成功を保証しないかもしれない。通常、1 つはアゴニストのパフを申請リガンド活性化電流を測定できない、電圧クランプ下 PA Nic せん光は、ないその許容可能な結果をもたらす可能性があります。第 3 の制限を含む組み込み蛍光 PA PA の nic Nic の 〜 405 nm の光を吸収して緑色蛍光タンパク質 (GFP) またはアレクサ 4885として類似の範囲で出力します。PA Nic 濃度超える 〜 1 mM と、この蛍光特性が同時に神経細胞の構造を視覚化する挑戦的な行うことができます。これを緩和するには、灌流ピペットから PA Nic の流れを簡単に制御することができることが重要です。定期的に、PA Nic 流れはすぐ拡散する蛍光分子を許可する停止しました。これは uncaging 神経のビーム スポット位置をチェックするためのニューロンの再イメージ化が許可されます。言及する第 4 の潜在的な制限には、光分解の 405 nm の光の使用が含まれます。405 など短い波長 nm は、脳スライスなど複雑な組織散乱しやすい。したがって、特定のフラッシュの発光量、期間、uncaging 神経応答振幅と減衰機構差分による影響はスライス内 uncaging 神経の焦点深度。NAChRs の生物学的側面についての結論では、この重要な注意点を考慮する必要があります。
このローカライズされたレーザー フラッシュ光分解手法は nAChR 神経生物学に関する新たな詳細を明らかにする最近使用されています。たとえば、慢性ニコチン曝露は、perisomatic と内側 habenula ニューロン5樹状 nAChR 機能を高めます。それはまた perisomatic の樹状細胞コンパートメント6機能 nAChRs を腹側被蓋野グルタミン酸ニューロンに表現を最初に示すために使用されました。これから多くの可能性をこの技術の使用があるし、知られている大脳皮質錐体細胞31など大脳皮質の32、介在ニューロンのエクスプレス nAChRs 線条体33 他のキーのニューロン タイプにアプローチを適用できます。、および海馬19。この手法は、薬理学および/または nAChR の遺伝子が異なる神経細胞のコンパートメントに特定の受容体サブタイプをローカライズする34の編集とも組み合わせることができます。アプローチ、PA Nic5と並行して開発されたものに限定されないなどの他のクマリン ケージ化合に容易に適応があります。最後に、PA Nic せん光 5 月 1 日使用目を覚まし行動動物の行動薬理学の新しいパラダイムの中でニコチンのアクションを勉強します。
開示事項
D.L.W. は、ブルカー ナノ蛍光顕微鏡の雇われたコンサルタントとして提供しています。
謝辞
著者次北西部主任の研究室メンバーに感謝: ライアン Drenan、D. ジェームス Surmeier、オストモロワ Kozorovitskiy、アニスの建築業者。この作品は、米国国立衛生研究の健康 (NIH) (DA035942、R.M.D.、DA040626 の補助金)、PhRMA 財団 (M.C.A. に交わり) と HHMI によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Instruments, Consumables, and Miscellaneous Chemicals | |||
| Multiclamp 700B | Molecular Devices Corp. | Patch clamp amplifier | |
| Pneumatic Picopump | World Precision Instruments | PV820 | |
| Micropipette puller | Sutter Instrument Co | P-97 | |
| Temperature Controller | Warner Instruments | TC-324C | |
| Vibrating blade microtome | Leica Biosystems | VT1200S | |
| Ultrafree-MC Centrifugal Filter | MilliporeSigma | UFC30GV0S | internal solution filter |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B150F-4 | patch and local application pipette |
| (-)-Nicotine hydrogen tartrate salt | Glentham | GL9693 | nicotine salt |
| 7-carboxymethylamino-4-methyl coumarin | Janelia Research Campus | PA-Nic by-product | |
| 1-[7-[bis(carboxymethyl)- amino]coumarin-4-yl]methyl-nicotine | Janelia Research Campus | PA-Nic | |
| Euthasol (Pentobarbital Sodium and Phenytoin Sodium) | Virbac | ANADA #200-071 | |
| Alexa FluorTM 488 Hydrazide | ThermoFisher | A10436 | green fill dye |
| Alexa FluorTM 568 Hydrazide | ThermoFisher | A10437 | red fill dye |
| 6-carboxy-AF594 (Alexa Fluor 594) | Janelia Research Campus | red fill dye | |
| QX 314 chloride | Tocris | 2313 | voltage-gated sodium channel blocker |
| Power Meter | ThorLabs | S120C | |
| Name | Company | Catalog Number | Comments |
| Chemicals for Solutions | |||
| N-Methyl-D-glucamine | Sigma | M2004 | |
| Potassium chloride | Sigma | P3911 | |
| Sodium phosphate monobasic monohydrate | Sigma | S9638 | |
| Sodium bicarbonate | Sigma | S6014 | |
| HEPES | Sigma | H3375 | |
| D-(+)-Glucose | Sigma | G5767 | |
| (+)-Sodium L-ascorbate | Sigma | A4034 | |
| Thiourea | Sigma | T8656 | |
| Sodium pyruvate | Sigma | P2256 | |
| Magnesium sulfate heptahydrate | Sigma | 230391 | |
| Calcium chloride dihydrate | Sigma | 223506 | |
| Sodium chloride | Sigma | S9625 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma | E3889 | |
| Adenosine 5′-triphosphate magnesium salt | Sigma | A9187 | |
| Guanosine 5′-triphosphate sodium salt hydrate | Sigma | G8877 | |
| Name | Company | Catalog Number | Comments |
| Components of 2-Photon Microscope | |||
| Ultima Laser Scanner for Olympus BX51 Microscope | Bruker Nano, Inc. | imaging software and galvos | |
| Imaging X-Y galvanometers | Cambridge Technology | ||
| Mai Tai HP1040 | Spectra-Physics | Tuneable IR laser | |
| Pockels cell M350-80-02-BK with M302RM Driver | Conoptics, Inc. | for IR laser attenuation | |
| Integrating Sphere Photodiode Power Sensor | Thorlabs, Inc | laser power pick-off photodiode | |
| Uncaging X-Y galvanometers | Cambridge Technology | ||
| Helios 2-Line Laser Launch | Bruker Nano, Inc. | uncaging laser components | |
| OBIS LX/LS 405 nm (100 mW) | Coherent, Inc. | ||
| OBIS LX/LS 473 nm (75 mW) | Coherent, Inc. | ||
| Point-Photoactivation / Fiber Input Module for Limo Sidecar - Uncaging | Bruker Nano, Inc. | ||
| Name | Company | Catalog Number | Comments |
| Upright Microscope | Olympus | BX51WIF | Upright microscope chasis |
| Objective: Olympus M Plan FL 10x; NA 0.3 WD 11 mm | Olympus | 10x objective | |
| Objective: Olympus M Plan Fluorite 60x/1.0 WD=2mm NIR | Olympus | 60x water-dipping objective | |
| X-Cite 110, four-LED LLG coupled epi-fluorescence light source | Excelitas Technologies | LED Light Source | |
| Epi-Fluorescence Filter: ET-GFP (FITC/CY2) for Epi-Turret | Chroma Technologies | LED Filter for blue light excitation | |
| Epi-Fluorescence Filter: ET-DsRed (TRITC/CY3) for Epi-Turret | Chroma Technologies | LED Filter for green light excitation | |
| B&W CCD camera; Watec, 0.5in B/W CCD | Watec Co., LTD. | CCD camera for patch clamp recording | |
| Name | Company | Catalog Number | Comments |
| External Detectors - Dual Reflected Emission - Olympus Upright (Multi-Alkali, GaAsP) | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | red channel PMT |
| 595/50m | Chroma Technologies | red channel emission filter | |
| 565lpxr | Chroma Technologies | dichroic beam splitter | |
| GaAsP end-on PMT | Hamamatsu | 7422PA-40 | green channel PMT |
| 525/70m | Chroma Technologies | green channel emission filter | |
| High-Speed Shutter for Hamamatsu H7422 PMT | Vincent Associates / Bruker | 517329 | PMT shutter mount |
| Name | Company | Catalog Number | Comments |
| Dodt Gradient Contrast Transmission Detection Module | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | Dodt PMT |
参考文献
- Zhang, C., et al. Cholinergic tone in ventral tegmental area: Functional organization and behavioral implications. Neurochemistry International. 114, 127-133 (2018).
- Sarter, M., Parikh, V., Howe, W. M. Phasic acetylcholine release and the volume transmission hypothesis: time to move on. Nature Reviews Neuroscience. 10 (5), 383-390 (2009).
- Coyle, J. T., Price, D. L., DeLong, M. R. Alzheimer's disease: a disorder of cortical cholinergic innervation. Science. 219 (4589), 1184-1190 (1983).
- Katz, B., Thesleff, S. A study of the desensitization produced by acetylcholine at the motor end-plate. Journal of Physiology. 138 (1), 63-80 (1957).
- Banala, S., et al. Photoactivatable drugs for nicotinic optopharmacology. Nature Methods. 15 (5), 347-350 (2018).
- Yan, Y., et al. Nicotinic Cholinergic Receptors in VTA Glutamate Neurons Modulate Excitatory Transmission. Cell Reports. 23 (8), 2236-2244 (2018).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. α4α6β2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Molecular Pharmacology. 84 (3), 393-406 (2013).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. Journal of Visualized Experiments. (68), (2012).
- Ren, J., et al. Habenula "cholinergic" neurons co-release glutamate and acetylcholine and activate postsynaptic neurons via distinct transmission modes. Neuron. 69 (3), 445-452 (2011).
- Koppensteiner, P., Melani, R., Ninan, I. A Cooperative Mechanism Involving Ca(2+)-Permeable AMPA Receptors and Retrograde Activation of GABAB Receptors in Interpeduncular Nucleus Plasticity. Cell Reports. 20 (5), 1111-1122 (2017).
- Zhang, J., et al. Presynaptic Excitation via GABAB Receptors in Habenula Cholinergic Neurons Regulates Fear Memory Expression. Cell. 166 (3), 716-728 (2016).
- Chen, E., et al. Altered Baseline and Nicotine-Mediated Behavioral and Cholinergic Profiles in ChAT-Cre Mouse Lines. The Journal of Neuroscience. 38 (9), 2177-2188 (2018).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter increased acetylcholine release in the hippocampus. Neuroscience. 218, 1-11 (2012).
- Ting, J. T., Feng, G. Recombineering strategies for developing next generation BAC transgenic tools for optogenetics and beyond. Frontiers in Behavioral Neuroscience. 8, 111 (2014).
- Crittenden, J. R., Lacey, C. J., Lee, T., Bowden, H. A., Graybiel, A. M. Severe drug-induced repetitive behaviors and striatal overexpression of VAChT in ChAT-ChR2-EYFP BAC transgenic mice. Frontiers in Neural Circuits. 8, 57 (2014).
- Kolisnyk, B., et al. ChAT-ChR2-EYFP mice have enhanced motor endurance but show deficits in attention and several additional cognitive domains. The Journal of Neuroscience. 33 (25), 10427-10438 (2013).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter enhances dendritic complexity of adult-born hippocampal neurons and improves acquisition of spatial memory during aging. Neurobiology of Aging. 36 (5), 1881-1889 (2015).
- Denk, W. Two-photon scanning photochemical microscopy: mapping ligand-gated ion channel distributions. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6629-6633 (1994).
- Khiroug, L., Giniatullin, R., Klein, R. C., Fayuk, D., Yakel, J. L. Functional mapping and Ca2+ regulation of nicotinic acetylcholine receptor channels in rat hippocampal CA1 neurons. The Journal of Neuroscience. 23 (27), 9024-9031 (2003).
- Filevich, O., Salierno, M., Etchenique, R. A caged nicotine with nanosecond range kinetics and visible light sensitivity. Journal of Inorganic Biochemistry. 104 (12), 1248-1251 (2010).
- Tochitsky, I., et al. Optochemical control of genetically engineered neuronal nicotinic acetylcholine receptors. Nature Chemistry. 4 (2), 105-111 (2012).
- Wokosin, D. L., Squirrell, J. M., Eliceiri, K. W., White, J. G. Optical workstation with concurrent, independent multiphoton imaging and experimental laser microbeam capabilities. Review of Scientific Instruments. 74 (1), 193-201 (2003).
- Plotkin, J. L., Day, M., Surmeier, D. J. Synaptically driven state transitions in distal dendrites of striatal spiny neurons. Nature Neuroscience. 14 (7), 881-888 (2011).
- Galtieri, D. J., Estep, C. M., Wokosin, D. L., Traynelis, S., Surmeier, D. J. Pedunculopontine glutamatergic neurons control spike patterning in substantia nigra dopaminergic neurons. Elife. 6, (2017).
- Yasuda, R., et al. Imaging calcium concentration dynamics in small neuronal compartments. Science STKE. (219), pl5 (2004).
- Inoue, S., Spring, K. . Video microscopy: The fundamentals. , 163-186 (1997).
- Zipfel, W. R., Williams, R. M., Webb, W. W. Nonlinear magic: multiphoton microscopy in the biosciences. Nature Biotechnology. 21 (11), 1369-1377 (2003).
- Maravall, M., Mainen, Z. F., Sabatini, B. L., Svoboda, K. Estimating intracellular calcium concentrations and buffering without wavelength ratioing. Biophysical Journal. 78 (5), 2655-2667 (2000).
- Wathey, J. C., Nass, M. M., Lester, H. A. Numerical reconstruction of the quantal event at nicotinic synapses. Biophysical Journal. 27 (1), 145-164 (1979).
- Shih, P. Y., et al. Differential expression and function of nicotinic acetylcholine receptors in subdivisions of medial habenula. The Journal of Neuroscience. 34 (29), 9789-9802 (2014).
- Verhoog, M. B., et al. Layer-specific cholinergic control of human and mouse cortical synaptic plasticity. Nature Communications. 7, 12826 (2016).
- Koukouli, F., et al. Nicotine reverses hypofrontality in animal models of addiction and schizophrenia. Nature Medicine. 23 (3), 347-354 (2017).
- Xiao, C., et al. Chronic nicotine selectively enhances α4β2* nicotinic acetylcholine receptors in the nigrostriatal dopamine pathway. The Journal of Neuroscience. 29 (40), 12428-12439 (2009).
- Peng, C., et al. Gene Editing Vectors for Studying Nicotinic Acetylcholine Receptors in Cholinergic Transmission. European Journal of Neuroscience. , (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved