Method Article
Photoactivatable 니코틴의 레이저 플래시 Photolysis를 통해 마우스 뇌 조각에서 Nicotinic 아 세 틸 콜린 수용 체 기능을 프로 빙
요약
이 문서는 니코틴 uncaging에 의해 마우스 뇌 조각에서 nicotinic 아 세 틸 콜린 수용 체 (nAChRs) 공부에 대 한 메서드를 제공 합니다. 동시 패치 클램프 기록 및 2 광자 레이저 스캐닝 현미경 검사 법으로 사용할 경우 해 신경 생물학의 깊은 이해를 제공 하는 세포 형태학 nicotinic 수용 체 기능을 연결 니코틴 uncaging 합니다.
초록
아 세 틸 콜린 (ACh) 수용 체 신경 프로세스의 다양 한 변조를 통해 작동 하지만이 함수를 실시 하는 세포 내 subcellular 위치 ACh 수용 체 기능을 연결할 도전 되었습니다. Nicotinic ACh 수용 체 (nAChRs) 네이티브 뇌 조직에서의 subcellular 위치, 공부 하는 광학 방법 electrophysiological 녹음 하는 동안 개별 위치 신경 막 근처에서 니코틴의 정확한 출시 위해 개발 되었습니다. 패치 클램프 뉴런 뇌 조각으로 가득 차 있습니다 염색 2 광자 레이저 스캐닝 현미경 검사 법, 동안 그들의 형태학을 시각화 하 고 하나 이상의 세포 막 근처 405 nm 레이저 빔을 초점 빛 플래시 실행 됩니다 니코틴 uncaging. 세포질 현재 심한, 측정 그리고 기록 된 신경의 고해상도 3 차원 (3D) 이미지 nAChR 반응과 세포 형태학의 화해 수 있도록 이루어집니다. 이 메서드는 복잡 한 조직 준비, cholinergic neurotransmission의 이해를 강화 하는 약속에 nAChR 기능 배포의 상세한 분석에 대 한 수 있습니다.
서문
해 신호 attentional 제어, 지 운동, 및 보상1,2를 포함 하 여 수많은 두뇌 프로세스를 조절 한다. 아 세 틸 콜린 (ACh) 전송 향상 약물 인지3해 시스템에 대 한 중요 한 역할을 암시 하는 Alzheimer의 질병과 관련 된 인지 장애를 치료 하는 데 사용 됩니다. 해 수용 체와 건강 및 질병 상태에서 회로의 향상 된 이해는 여러 가지 신경 질병/장애에 대 한 더 나은 치료 접근으로 이어질 수 있습니다.
Nicotinic ACh 수용 체 (nAChRs) 양이온 또는 응답으로 생 ACh exogenous 니코틴 담배 제품에서 유출 하는 ligand 문을 단 이온 채널의 가족입니다. 설명4첫 신경 전달 물질 수용 체 가운데 그들이 사실을 감안할 때, nAChR 약리학 및 위치 근육 섬유에 근육 형 수용 체에 대 한 파악 이다. 대조적으로, 비교적 작은 약리학 및 두뇌에서 네이티브 nAChRs의 subcellular 배포에 대 한 알려져 있다. 지식에이 격차는 최근 세포 이미징 및 electrophysiological 기록5중 뇌 조직에서 nAChRs의 공간적으로 제한 하 고 급속 한 활성화에 대 한 있도록 새로운 화학 프로브를 개발 하 여 해결 됩니다. 여기,이 접근에 관련 된 주요 방법론 단계 설명, 신경 구조와 nAChR 함수를 연결 하는 기능 향상의 전반적인 목표와 함께 합니다.
Photoactivatable 니코틴 (PA-Nic; 화학 이름: 1-[7-[bis(carboxymethyl)-아미노] coumarin-4-yl] 메 틸 니코틴) photolyzed ~ 405 nm 레이저 섬광 효율적으로 니코틴5,6출시 될 수 있습니다. Uncaging, 이전 펜 실바 니 아-Nic 솔루션에서 안정적 이며 전시 아니 형편이 약리학 또는 광화학 기능5. Photolysis, 후 출시 된 니코틴은 예상 대로 nAChRs 활성화 되며 uncaging 부산물 약리학 불활성5. 연속파 레이저는 출력 전력 photolysis 광원으로 사용 > 1 mW 샘플에서 측정. 지역화, 타겟된 사진-자극은 및 결합 된 2 광자 레이저 스캐닝 현미경 검사 법 (2PLSM), 세포 막으로 찾을 수 있는이 방법의 두 가지 주요 장점을 완벽 하 게 실현: photolysis 속도 공간 정밀도.
대부분의 측면에서 PA Nic의 photolysis 뇌 조각 내 수용 체에 ligands nAChR 제공의 다른 방법에 우량 하다. 이러한 접근 등 목욕 응용 프로그램7 지역 마약 배달 통해 호흡기 피 펫8입니다. 전 접근-적용된 약물의 장기 효과 강조 하는 경향이, 반면 후자의 접근 시련과 셀에 걸쳐 응답 속도에 변화에서 겪을 수 있다. 이 다른 접근의 둘 다 적절 하 게 동일한 신경 세포에서 다른 세포 위치에 수용 체 활동을 구분할 수 있습니다. 하지만 ACh의 릴리스 Optogenetically 활성화 네이티브 nAChRs9,,1011의 조사를 위해 사용 되는 매핑 subcellular nAChR 위치에 대 한 유용한 입증 되지 않은. 게다가,이 접근을 이용 하 여 대부분 연구 비정상적인 해 전송12,,1314, 와 ChR2을 표현 세균성 인공적인 염색체 유전자 변형 마우스에 의존 해야 15 , 16 , 17.
PA Nic photolysis 해 수용 체를 공부만 광학 접근 아니다. 갇힌된 carbachol 기능 배양된 세포18 과 뇌 조각19, ACh 수용 체 활동을 매핑하는 데 사용 했다 하지만 PA 상태가의 개발 하는 동안 비교 연구를 위해 상용 되었다 루 테 늄 bis (bipyridine)-복잡 한 니코틴 (RuBi-니코틴) 니코틴 uncaging20에 대 한 허용 것으로 알려졌다 하지만 RuBi-니코틴 머리 비교에서 PA Nic에 열 등 한 입증의 상업적인 준비 연구5. 비-상업와 같은 비교 실험을 반복 하는 것이 유용할 수 있습니다 높은 RuBi 니코틴을 정화 하는 그것의 보이는 흡수 해 연구에 대 한 PA-Nic의 기능을 칭찬 수로. 마지막으로, nAChRs가 또한 되었습니다 광학 조작 사진 전환 ligands의 수용 체 유전자 변형21조합을 사용 하 여. 이 방식은 수정된 nAChR 장점 및 단점으로 볼의 대상으로 유전자의 기능/요구 사항으로 뇌 조직에 PA-Nic photolysis를 보완 합니다.
이 방법의 몇 가지 주요 요구 사항은 주목 해야 한다. 첫째, 적절 한 시각화 방법 신경 막 정확 하 게 찾이 필요 합니다. 배양된 세포, 공부를 할 때 기존의 피-형광 현미경 검사 법으로 이미징 충분 한 될 수 있지만 뇌 조각 또는 다른 두꺼운 조직 준비에 뉴런에서 녹음, 2PLSM 또는 confocal 현미경 검사 법은 요구 사항. 둘째, 적당 한 방법 photolysis 레이저 빔 위치 필요 합니다. 이 방법은 래스터 이미징 빔 및 포인트 photoactivation uncaging 레이저 빔22,,2324를 사용 하 여 검색을 위한 두 개의 독립적인 x-y 거울으로 듀얼 검 류 계 스캔 헤드를 활용 합니다. 다른, 더 많은 제한 된 솔루션 또는 래스터 스캔 이미징 빔 및 uncaging 광속, 또는 (2) 간단 하 게 되도록 셀 가져 시야의 센터에 uncaging 빔을 감독 (1) 단일-검 류 계 스캔 머리와 같은 가능 하다 플래시 photolysis을 위한이 위치. 셋째, 시스템은 필요 하나 실험 동안 생리 신호를 수집 하고자 하는 경우 동시 electrophysiological 기록. 위의 요구 사항 적합 한 모든 광학 이미징 기술, 최근 설명된5로 만나게 될 수 있습니다. 다음, 상세한 프로토콜은 포함 하는이 방법의 주요 단계를 설명 합니다.
프로토콜
뇌 슬라이스 준비에 관련 된 작업 검토 되었고 노스웨스턴 대학 동물 관리 및 사용 위원회 (#IS00003604 프로토콜)에 의해 승인.
주의: 포인트 사진-자극을 위해 사용 하는 레이저는 눈에 해를 입힐 가능성이 있는 표시 클래스 IIIb 레이저. 2PLSM 근 적외선 (NIR) 클래스 4 레이저 필요 (> 500 mW), 다른 조직에서 눈, 심지어 화상에 심각한 해를 입힐 가능성이 있다. 적절 한 레이저 빔 봉쇄, 시스템 인터록, 플러스 조작 및 관리 제어 레이저 기반 장비의 안전한 작동을 보장 하기 위해 필요 합니다. 레이저를 작업할 때 항상 로컬 레이저 안전 요원을 찾는.
1. 교정 및 확인 Uncaging Laser(s)
-
레이저 파워 샘플 배달를 계량.
- 405 nm 레이저 (100 mW 최대 전력 5 V 제어 신호)를 켜고 약 10 분 워밍업 레이저 시스템.
참고: 레이저는 여전히 (0 V 드라이브)와 폐쇄 하 고 레이저 출력을 조절 하는 제어 전압을 보낼 때까지 출력 전력이 있다. - 조직 샘플 평면에서 또는 콘덴서 렌즈 대신 전력 측정기를 놓습니다. 수동으로 광학 경로/목표 렌즈 기준으로 미터 센터.
- 정확한 파장 범위 (400-1100 nm)에 미터를 설정 합니다. 적절 한 버튼으로 미터를 0.
- 100을 선택 소프트웨어 제어를 사용 하 여 (최대 1000의; 1000 = 5 V)로 설정 되는 레이저 전체 전력의 10 %405 nm 레이저 파워에 대 한. 레이저 제어 전압은 PrairieView 시스템 을 통해 VoltageRecord 명령의 디지털 기록을 제공 하기에 또한 먹이 수 있습니다 원하는 경우, 타이밍 및 전력 레벨 신호.
- 파워 미터에서 독서를 기록 합니다.
- 405 nm 레이저 전원 출력 150 (최대 1000의 15%)을 선택 하 고 전원 측정기에서 독서 기록. 레이저 파워 커브를 수집 다음 출력 파워에 대 한이 단계를 반복: 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 및 1000 년.
- 405 nm 레이저 (100 mW 최대 전력 5 V 제어 신호)를 켜고 약 10 분 워밍업 레이저 시스템.
-
Uncaging 레이저 비치 보정. 정확한 자리 위치, 또는 매달 정기적으로 대 한 우려 있을 때마다 시스템의 광학 부품을 변경 때마다 다음 단계를 실행 합니다.
- Photostimulation 및 이미징 실험에 물 담그고 현미경 렌즈 사용 될 x 60을 설치 합니다. 인수/이미징 소프트웨어에서 선택 렌즈와 광학 줌 설정 1 x 60 (단계 3.1.4.2 참조.).
- 깨끗 한 유리 현미경 슬라이드에 채워진된 원형 빨간 영구 마커 표시 합니다. 목표를 향해 표시와 함께 현미경 스테이지에 슬라이드를 놓습니다.
- 미리 초점을 4 배 또는 10 배 목표와 빨간 표시자 영역에 현미경. 빨간 표시 점/스팟의 정상에 물 1-2 mL를 추가 하 고 60 x 목표 전환 목적 물에 잠수함. 얇은 빨간 표시자 영역에 대물 렌즈의 초점을 맞춥니다.
- 2 광자 레이저 스캔으로 전환 합니다. 대부분의 시스템에 대 한 포 탑 앞, 스캔 헤드 미러 이동 이동 빛 경로에서 trinocular 프리즘 #1 위치를 이동 하 고 ~ 900 레이저 파장을 설정 nm. 즉 자극 미러 교정 루틴에 대 한 기본 픽셀 요소 이미지 수집 매개 변수에 대 한 512 x 512 픽셀 상자 옵션을 선택 합니다.
- 시스템 이미징 레이저 파워 최소 보다 스캔을 시작 하 고 얇은 빨간 표시자 형광 층에 객관적인 초점 미세 조정. 표시와 함께 파편의 명확 하 고 균일 하 게 코팅 형광 필드에는 필드를 선택 합니다.
참고: 이 프로토콜에 설치 PrairieView 5.4 수집/이미징 소프트웨어를 사용합니다. - 소프트웨어의 도구-교정/맞춤 메뉴 내에서 Uncaging Galvo 보정 기능을 엽니다. 두 번째 검 류 계 미러 쌍의 공간 교정에 대 한 관광 명소를 구울 튜토리얼을 통해 도보.
- 관광 명소를 구울 자습서 내 405 nm 레이저를 선택, 400의 레이저 자극 파워와이 작은 양보 해야 하는 20 양 자극 기간 선택 (1 ~ 5 µ m 직경) 빨간색 표시자에 구멍.
참고: 설정 2 ~ 4 mW 및 1-10 ms는 일반적으로 사용, 하지만 설정을 샘플에 의해 결정 됩니다. PA Nic 사진 자극 전원 설정은 지금까지 레드 마커 슬라이드에 보이는 구멍을 ablate을 교정 하는 동안 필요한 전력 보다 낮은 될 가능성이 있습니다. 이 교정 루틴 photostimulation 관광 명소를 찾는 데 유용 하지만 생리 응답 중 절대 photostimulation 볼륨을 유추 하는 사용할 수 없습니다. - 업데이트 자극 하 고 센터 자리 레코딩하고 둥근 빨간 표시기 실제 자리 위치를 이동 후 이미지를 새로 고침을 선택 합니다. 센터 자리, 오른쪽 센터 자리, 낮은 센터 자리 이렇게 그리고 마지막으로 9 개 관광 명소 (모든 모서리와 모서리 이미지의 중심)의 눈금에 대 한.
참고: 가운데, 오른쪽, 및 더 낮은 교정된 자리 위치 자극 검 류 계 전압 진정한 중심 및 X 및 Y 배율 계수 이미징 미러 쌍을 자극 미러 쌍을 일치 하도록 정의를 결정 합니다. 소프트웨어 규모, 하 고 업데이트 하 고, 다른 공간 보정 줌 줌 설정에서 수행 하는 모든 후속 MarkPoints 실험.
- 관광 명소를 구울 자습서 내 405 nm 레이저를 선택, 400의 레이저 자극 파워와이 작은 양보 해야 하는 20 양 자극 기간 선택 (1 ~ 5 µ m 직경) 빨간색 표시자에 구멍.
- MarkPoints 창 열고 수동으로 샘플의 새로운 영역에 정의 된 현장에 자극 매개 변수를 활성화 하 여 보정을 테스트 합니다. 정확한, 최신 교정 파일 MarkPoints 창으로 로드 되는 확인 하십시오. 정의 된 현장에서 MarkPoints/그룹 또는 MarkPoints 시리즈 기능을 활성화 또는 오른쪽/왼쪽 이미지 동안 라이브 스캔 적용 테스트 펄스에서 마우스를 클릭 하 여 라이브/제거 기능을 활용 그리고 정확한 보정을 확인 합니다.
참고: 레이저 화상 자리 MarkPoints 표시기에 완벽 하 게 중심 한다 지금. - 모니터와 드라이브 전압 VoltageRecord 프로그램 활용 하 여 레이저 펄스 전원 및 임시 기간 활성화를 기록 (1.1.4 단계 참조). 마찬가지로, 사진-자극 검 류 계 거울의 쌍에서 파생 하는 피드백 신호에서 축소 전압 신호를 사용 하 여 각 자극 스팟의 위치를 기록 합니다.
2. Photoactivatable 니코틴 (PA-Nic)의 준비
- 저장소에서 동결 건조 된 photoactivatable 약물의 약 수를 검색 합니다.
참고: 다음 프로토콜은 PA-Nic;에 대 한 특정 다른 photoactivatable 약물에 대 한 필요에 따라 조정 합니다. PA Nic 뛰어난 안정성5보여줍니다, 하지만 준비 및 실험 하는 동안 밝은 빛에 노출 로부터 보호 하기 위해 합리적인 예방 조치. 이 단순히 낮은 조명;에서 협력 하 여 달성 될 수 있다 빨간 필터링 된 빛을 제한 하는 것은 필요가 없습니다. -
PA 상태가의 로컬 응용 프로그램 수행
- 프로그래밍 가능한 피 펫 끌어당기는 사람와 20-40 µ m의 개방 직경을 가진 유리 제 micropipette 당겨.
- 0.22 μ m 필터 솔루션 녹화의 ~ 1 mL를 필터링 합니다. 2mm의 최종 농도를 필터링 된 기록 솔루션에 PA-Nic의 수량 resuspend 예를 들어 필터링 된 기록 솔루션의 50 µ L에서 100 nmol 동결 건조 된 약 수를 분해.
참고: 제안 된 녹음 솔루션 구성 최근 간행물,5,6 PA Nic photolysis 채용에서 찾을 수 있습니다. - 다시-채우기 2 mm PA 상태가 50 µ L로 로컬 응용 프로그램 피 펫
- 로컬 응용 프로그램 피 펫 피 펫 홀더는 micromanipulator에 장착으로 보안. 지속적인된 저압 응용 프로그램 (1-2 psi)의 압력 방출 시스템에 적절 한 튜브를 통해 피 펫 홀더를 연결 합니다.
- micromanipulator를 사용 하 여 세포 외 기록 솔루션 및 약간 마우스 뇌 조직 위의 피 펫 팁 위치 ~ 50 μ m에서의 셀 위치에 로컬 응용 프로그램 피펫으로 책략. 마우스 뇌 슬라이스 준비 및 패치 클램프 기록8의 자세한 프로토콜에 대 한 이전 보고서를 참조 하십시오.
- 짧게 압력 (1-2 psi)을 적용 하 여 응용 프로그램 매개 변수를 확인 합니다. 관심의 셀의 아무 변위를 최소한의 이어야 한다. 중요 한 운동 발생 하는 경우 관심의 세포에서 더 멀리 (측면 또는 축 방향)에서 로컬 응용 프로그램 피펫으로 위치를 변경할.
- 안정적인 전체 셀 패치 클램프를 달성 한 후 (세부 정보는 이전 게시8에 포함), 압력 방출 장치에 적합 한 수동 스위치를 사용 하 여 낮은 압력 (1-2 p.s.i.) 응용 프로그램을 켜십시오. 다음 단계로 진행 하기 전에 1-2 분 PA Nic와 셀을 둘러싼 조직 포화.
-
목욕 응용 프로그램 (superfusion) PA-Nic의 두뇌 분할을 수행 합니다.
- 100 μ M의 최종 농도를 연속 재순환에 대 한 적절 한 솔루션을 녹음의 볼륨에 PA-Nic의 수량을 디졸브. 예를 들어 표준 15 mL 튜브를 사용 하 여 녹음 솔루션의 10 mL에 1 μmol aliquot를 분해.
- 관류 시스템에서 적절 한 흐름 제어를 열어서 1.5-2 mL/min의 속도로 PA Nic 솔루션의 재순환을 시작 합니다. 재순환 녹음 하는 동안 발생합니다. 귀중 한 마약을 절약 하기 위해 최소 내경으로 튜브를 사용 하 여 또는 관류 시스템에 사용 되는 튜브의 전체 길이 단축 하 여 재순환 볼륨을 최소화 합니다.
참고: 이 단계를 수행 하 여 Nic PA 솔루션의 5 mL을 목욕 재순환에 대 한 볼륨을 줄일 수 있습니다. PA Nic 솔루션 자주 사용 될 수 있습니다 2 연속 4 ° c.에 빛 으로부터 보호 저장 하는 경우 같은 한 일을 기록 - 재순환, 동안 지속적으로 거품 carbogen (5% O2, 95% CO2) 솔루션 및 목욕 온도 32 ° c.에 유지
- 솔루션 낮은 조명 조건에서 PA Nic와 함께 작업 하는 동안 기록에 두뇌 슬라이스를 유지 합니다.
3. 2 광자 레이저 스캐닝 현미경 검사 법으로 신경 세포 이미징
- 셀의 라이브 시각화를 수행 합니다.
- 전송 된 빛을 사용 하 여 중간 habenula (MHb) 신경 식별/시각화 또는 적외선 미분 간섭 (IR/DIC) 광학과 비디오 카메라와 안정적인 전체 셀 패치 클램프 기록 수립. 심하게 준비 마우스 뇌 조각8에 뉴런에서 패치 클램프 기록에 대 한 내용은 이전 프로토콜을 참조 하십시오.
- 높은 저항을 설정한 후 (> 1 GΩ) 셀 연결 구성, 침입, 전에 설치 및 소프트웨어 레이저 스캐닝 모드를 전환할.
- 침입, 후 사용 하는 레이저 스캔을 확인 하는 이미징 염료 (100-200의 최종 농도에 희석 µ M 표준 세포내 피펫은 솔루션으로 앞서 설명한8)은 수 동적으로 (확산) 신경 작성. 염료 (예를 들어, 알 렉 사 Fluor 488 녹색 광 전 증폭 관 관 [PMT] 채널, PMT 2; 또는 알 렉 사 Fluor 568 또는 빨간색 PMT 채널, PMT 1 594)의 시각화를 필요로 하는 실험을 시도 하기 전에 적어도 20-30 분에 대 한 세포질 구획을 채울 수 있게 soma 외부 객실 모든 셀룰러 칸
참고: 원심 구획 (수지상 구조, 등뼈, 축 삭, 등등.) 30-40 분25을 완전히 채우기 위해 필요할 수 있습니다. - 소프트웨어 라이브 스캔 기능을 사용 하 여 신경 및 관심의 subcellular 구획을 시각화. 이미지 매개 변수를 정확한 수 사는 신경 기능의 시각화를 선택 합니다. 에 영향을 미칠 또는 변경 디스플레이 시각화 (대조), 해상도, 신호 대 잡음 (S/N) 비율, 및 이미지 프레임 획득 시간을 다양 한 설정을 조작:
-
조회 업-테이블 (LUT). 적절 한 아이콘을 사용 하 여 모든 이미지 창 측면 LUT 창을 엽니다. 한 번 열, LUT (최소) 바닥과 천장 (최대) 설정의 특정 이미지 채널의 화면에 표시 하는 신호 대비의 시각화 를 향상 시키기 위해 조정. ~ 1000 (4096, 12-비트 탐지), 중 주차 때 첫 번째 셀에 대 한 검색 신호, 신호, 및 구조를 꺼내 도움이 될 것 입 최대 값을 낮춥니다.
참고:이 설정은 표시 신호 검출/기록 값이 아니라 적용. 인간의 눈을 만들 수 있습니다 일반적으로 대비 50 회색 레벨26에. -
광학 확대/축소합니다. 사용 하는 소프트웨어 컨트롤 1 X 광학 줌 및 패닝 컨트롤 조직에서 원하는 영역을 찾으려면 사용을 선택 합니다. 이 확대/축소 설정을 가장 큰 광장을 생성, 보기의 필드를 검색 하 고 검 류 계 거울 최대 전압/스캔 각도, 전송 합니다.
참고: 기본 구성은 시료 내 객관적인 확대로 나눈 12 m m 변환 스캔 헤드 내부 보기 12 m m x 12 m m 필드입니다. 따라서, 렌즈 수익률 x 60 x 광학 줌 1 면 당 200 µ m의 이미지 스캔. 광학 확대/축소 값이 높을수록 더 적은 영역 스캔. 2 배 광학 줌은 종종 전체 뉴런을 시각화에 대 한 가장 유용한 설정입니다. 4 x 뉴런의 subcellular 측면을 시각화에 대 한 유용할 수 있습니다. -
픽셀 수. 보완 하기 위해 1 배 광학 줌, 줄 소프트웨어 컨트롤을 사용 하 여 1024 x 1024 픽셀을 선택 합니다. 대물 렌즈에서 세부 사항을 가능한 잃지를캡처 및 표시 된 이미지에 라인 당 픽셀 수를 설정 합니다. 60 x에 대 한 다음과 같은 실용적인 픽셀 값을 사용 하 여 1.0 / 수 가늠 구멍 (NA) 목표: 확대/축소 1, 확대/축소 2에 대 한 512 x 512와 256 x 256 1024 x 1024 확대 4. 최종 픽셀 크기 (~0.17 µ m, 12 mm/배율/줌/픽셀) 절반, 또는 더 적은, 측면 분해능 대물 렌즈에 의해 정의 되어야 합니다.
참고: 이미지 해상도 레이저 파장 및 객관적인 나만 정의 (920 2 광 양자 흥분된 [2PE]에서 0.4 µ m 해상도 및 1.0 나 목표)27. 기준 전체 여기 나, 렌즈에 나열 된, 레이저 빔 직경 선수의 1/e2 강도 (또는 "채우기") 입구 눈동자 (튜브 렌즈 초점 거리 x 2 나 x / 확대) 대물 렌즈의. 여기서 설명 하는 시스템에서 튜브 렌즈 180 m m의 초점 거리는 있습니다. -
픽셀의 유지 시간 . 소프트웨어 제어를 사용 하 여 4 µs 픽셀의 유지 시간, 유용한 기본값에 대 한 선택.
참고: 픽셀의 유지 시간을 변경 해도 평균 신호 감지;는 변경 되지 않습니다. 그것만 평균 내 픽셀에 영향을 하 고 이러한 변화는 S/북을 통해 이미지 품질을 통해 구상 될 수 있다 이미지 픽셀의 유지 시간 항상 0.4 μ s 단위의 배수 이며 12 비트 제한 강도 번 큰 거 각 이미지 픽셀의 값은 0.4 µs 샘플의 평균입니다. 때문에 S/N 비 향상 픽셀 유지 시간 (4 µs 같음 10 샘플, 또는 S/N 3.16-fold 향상) 당 샘플 수의 제곱근으로, 화질에서 개선 12 µs 보다 훨씬 더 큰 값에 대 한 체감에 도달 합니다. -
회전 및 관심 (ROI) 영역 스캔. 소프트웨어 컨트롤 (조치가 필요할 수 있습니다, 0 ° 회전은 대부분 이미징 시스템에 대 한 기본 설정)를 사용 하 여 0 ° 회전을 이미지 각도 설정 합니다. 샘플 "거꾸로" 방향에 배치 됩니다, "플립" 이미지를 180 ° 회전을 선택 합니다.
참고: 어떤 주어진 각도로 이미지를 회전의 채워진된 셀의 전체 영역에 대 한 더 나은 적합을 제공할 수 있습니다. 회전도 구조적인 변화를 정렬 하기 위한 고 후속 분석을 수행 하기 위한 명확 하 게 기초를 얻을 수 있습니다. 기본 픽셀 값 (단계 3.1.4.3), 유지 특정된 확대/축소 (단계 3.1.4.2) 설정에서 스캔 한 이미지 내 관심 하지만 제공 영역 및 픽셀의 총 수에 제한 프레임 속도 증가 극적으로 수의 영역을 선택 하 향상 된 시간 해상도 신호 변경의. -
프레임 평균. 소프트웨어 컨트롤을 사용 하 여 2 프레임의 시작 프레임 평균 설정을 선택 합니다.
참고: 최종 이미지 대비 (S/N)는 이미지의 신호 픽셀 내에서 수집/검색 총 광자에 의해 정의 됩니다. 여러 이미지 프레임의 평균 샘플 이동 하지 않습니다 또는 이미징 동안 표백 하지 제공 S/N 비율을 높일 수 있습니다. 관심의 신호는 프레임 이미지에 노이즈가 평균 프레임 수의 제곱근에 의해 감소 하는 동안 평균 하는 동안 동일한 값을 남아 있다. 형광 이미지에 작은 구조는 종종 간 픽셀 평균, 이미지 (ROIs 라고도 함) 또는 평균 프레임 내의 픽셀을 결합 필요 합니다. 증가 한 이미지의 수에 의해 시간을 스캔 평균 프레임 평균을 선택 합니다.
-
조회 업-테이블 (LUT). 적절 한 아이콘을 사용 하 여 모든 이미지 창 측면 LUT 창을 엽니다. 한 번 열, LUT (최소) 바닥과 천장 (최대) 설정의 특정 이미지 채널의 화면에 표시 하는 신호 대비의 시각화 를 향상 시키기 위해 조정. ~ 1000 (4096, 12-비트 탐지), 중 주차 때 첫 번째 셀에 대 한 검색 신호, 신호, 및 구조를 꺼내 도움이 될 것 입 최대 값을 낮춥니다.
- 팬 제어, 회전 검사, 및 광학 줌 도구를 사용 하 여 스캔 하는 동안 샘플 위치 하. 모터 단계 조작 샘플 위치, 반사 표면에 목표/콘덴서 충돌, 진동, 또는 레이저 광선의 노출을 방지 하기 위해 X, Y 및 Z 축에 큰 단계 크기를 방지 하는 데 필요한 경우.
- Z-스택을 수집 합니다. Z-시리즈 도구를 사용 하 여 시작을 선택 하 고 중지의 셀을 포함 하는 위치. 스텝 크기 (1 µ m)을 선택 하 고 셀을 포함 하는 모든 Z-평면에서 뉴런을 연속적으로 이미지.
참고: Z-스택 수집 설정을 신경 유형 및 염료를 채우는 사이 달라 집니다. Z-스택 수집에 대 한 최적의 라이브 이미징에 사용 되는 매개 변수의 독립적인 결정 되어야 합니다. Z-스택 수집 하기 전에 또는 optopharmacology 실험 후 수행할 수 있습니다. 만약에 가능 하다 면, 어떤 세포 손상을 방지 하는 optopharmacology 2PLSM에서 그리고 작은 세포질 구획의 최적의 염료 충전 수 있도록 유도 후 Z-스택 수집을 수행 합니다.
4. 레이저 플래시 Photolysis Electrophysiological 녹음 중
참고: 적용 405 nm 또는 473 nm 레이저 힘 ≥ 1의 mW 생산 목표 및 콘덴서 렌즈의 유리 안에 인광. 생성 된 빛이 레이저 조명 전원; 직결 되 방출 녹색과 적색 스펙트럼 윈도우에 있으며 흥분 상태 수명 ms 범위에 있습니다. 이 배경 자극 유물 물 찍기 렌즈 렌즈의 모든 주요 제조 업체와 모든 렌즈 테스트에서 볼 수 있다. 콘덴서 렌즈 렌즈 보다 훨씬 더 높은 인광을 생산. 이 "신호" 동기 사진 자극 이벤트 기간 동안 민감한 갈륨 인 (GaAsP) PMT 음극의 보호에 대 한 기계적 폐쇄의 사용. 평상시 기계식 셔터 (폐쇄 하지 적극적으로 검색 하는 경우)를 사용 하 여 냉각된 GaAsP Pmt의 보호를 위한 최고의 솔루션을 나타냅니다.
- 모래 시계 형 photostimulation 빔 형상 것 이다 그렇지 않으면 좁은/수축 레이저 빔으로 그것은 객관적인 입구 눈동자 빛 광학에 어떤 초점 렌즈를 제거 합니다.
- MarkPoints를 사용 하 여 단일 자리 설정을 선택 합니다.
참고: 다른 사진-자극 설정 (여러 관광 명소, 명소, 나선형 스캐닝의 그리드) MarkPoints에서 가능 하다. 한 자리는 간단한입니다. 실험 목표 및 생물 학적 차이 다른 설정을 해야 수 있습니다. - 짧게 이미지 찾아서 관심의 subcellular 영역을 라이브 스캔 옵션을 사용 하 여 이미지를 업데이트 합니다. 정기적으로 초점에 어떤 잠재적인 작은 드리프트를 식별 하기 위해 이미지를 업데이트 합니다.
- 소프트웨어 컨트롤을 사용 하 여 광학 줌 증가 (즉, 현재 보다 더 높은 광학 확대/축소 설정 선택), 경우 (즉, 등뼈 또는 원심 dendrites) 작은 구조를 시각화 하는 데 필요한.
- MarkPoints 단일 자리 십자선 인접 한 (~0.5 μ m) 세포 막에 놓습니다. 할 하지 장소 사진 자극 자리 직접 세포 기능을 통해이 같은 발생할 수 있습니다 photodamage.
- 사진-자극에 대 한 매개 변수를 설정 MarkPoints의 소프트웨어 컨트롤을 사용 하 여. 시작 지침을 다음과 같이 적용: 1-50 ms 기간, 1-4 mW 레이저 전력, 및 ≥1 예 심.
- 실행 MarkPoints MarkPoints 프로토콜을 시작 하 고 관찰 하는 실시간으로 전기 생리학 데이터 수집을 선택 합니다.
- 일관성과 안정성을 평가 하거나, 응답 진폭 및 활동의 부족 단계 4.2-4.7 여러 번을 반복 합니다.
결과
Photolysis에 대 한 자극, 노출 복용량 (강도 및 시간), 노출 위치 및 빔 형상은 주요 변수. 이 문서에서 설명 하는 시스템은 두 개의 다른 photostimulation 빔, 가변을 통해 광선 검 류 계 시스템을 입력 하기 전에 렌즈 / photostimulation 빛 경로 이동 가능 합니다. 이 렌즈 없이 photostimulation 빔 채웁니다 60 x의 입구 눈동자 / 물 찍기 [60 x WD] 1.0 나 목표, 근처-회절-제한 된, 시료 내 초점면에서 sub-µ m 자리를 생산. 이것은 photostimulation 확장 초점 광학 축 대칭 위아래는 모래 시계 모양으로 빛에 연관 된다. 경로에 삽입 하는 렌즈 photostimulation 레이저 광 대물 렌즈의 입구 눈동자에 초점을 맞추고와 연필 모양의 빔으로 종료 됩니다. ~ 10 µ m 직경 60 x 목표에 대 한 예정 이다,이 빔 균일/세로 샘플을 통해 확장 합니다. 이 모드에서는 자극 자리 내의 어떤 주어진된 위치에서 빛의 강도 회절 제한 근처 작은 자리 강도의 ~ 1% 될 것입니다. 따라서 높은 레이저 능력은 ~ 10 µ m 자리 자극을 사용 하는 경우에 일반적으로 필요한. 이 문서에서 보고 하는 모든 실험, 모래 시계 형 photostimulation 빔 사용 되었습니다.
입력된 전압 설정 후 전력 측정기를 사용 하 여 샘플에서 레이저 전력 측정에 대 한 배달된 샘플 파워를 그릴 수 있습니다. 이러한 연구 2 mm의 작동 거리와 WD 목표 x 60을 사용 하지만 그것은 하지 전력 측정 감지기 요소에 손상을 방지 하기 위해 물에 잠긴. 목표와 나열 하기 > 0.95 (침수 액체) 없이 측정, 낮은 인덱스 (공기)로 인해 렌즈 앞 얼굴 요소에서 총 내부 반사 손실 될 수 있습니다. 이 경우에, 더 정확한 샘플 전력 측정 (총 내부 반사 손실에 대 한 수정)에 대 한 1.0 나 객관적인 (1.0/0.95)2 공기에서 측정 하 여 측정 된 힘을 증가. 그림 1a 보여줍니다 405에 대 한 일반적인 입/출력 음모 및 473 nm 보이는 레이저는 레이저에 통합 실행이 연구. 이 레이저 시스템은 다음과 같은 이유로 사진 자극 노출 복용량 제어에 적합: (1) 그들은 입력된 전압을 기준으로 직접 선형 전원 출력을 제공 하는 사전 보정 (0-5 V), (2) 그들은 (아무 레이저로 자동 셔터 동작을 제공 출력), 그리고 (3) 그들은 빠른, 하위-ms 강도 펄스 기간 제어 (0.1 ms 응답). 레이저/galvo 시스템과 현장 사진-자극을 사용 하 여, MarkPoints 관광 명소의 일상적인 보정 필수 작업입니다. 그림 1b (왼쪽된 패널) 교정은 시스템을 보여 줍니다 (사진 자극을 원하는 지점 초래 하지 않습니다 그 포인트의 정확한 자극 화상 구멍 위치에 표시 된 대로), 교정 ( 후의 정확한 위치에 복귀와 함께 그림 1b, 오른쪽 패널).
PA-Nic는 겸손 하 게 형광 (방출 피크 ~ 510 nm), 350-450 nm (1-광자 여기) 또는 700-900 nm (2 광자 여기)5사이 효과적인 여기 전시. 로컬 응용 프로그램 동안 PA-Nic를 시각화 하기 위해 PA-Nic (1 mM) 뇌 조직의 동시 영상 (1) 뇌 조직 광학 sectioned 전송 컨텍스트 Dodt 대비 및 (2) 내보낸된 형광을 통해 여기에서 뒤 근처 적용 (900 nm)의 PA 상태가 PA-Nic 2PE 형광 로컬 응용 프로그램 피 펫 (그림 2a)에서 압력 방출 동안 쉽게 감지 했다. 니코틴과 monoalkylcoumarin, 7-carboxymethylamino-4-메 틸 coumarin PA Nic photolysis 반응5주요 광화학 제품입니다. 같은 설정/매개 변수 PA-Nic 이미징에 사용 된 이미지를 사용 하 여 조직 되었다 니코틴 (1 mM) 또는 7-carboxymethylamino-4-메 틸 coumarin (1mm)의 전달 중 몇 군데. 형광 신호 감지 되었습니다 (그림 2a, 중간과 더 낮은 패널), PA Nic 결과의 특이성을 보여주는. 마지막으로, 펜 실바 니 아-Nic 뇌 조직 내에서 적용 하 고 PA Nic 형광 방출은 몇 군데 (그림 2b). 이 방법은 PA-Nic는 로컬 응용 프로그램 피 펫의 100-200 μ m 내에서 존재 하는지 확인 합니다. 함께, 이러한 데이터 확인 PA Nic 로컬 응용을 통해 뇌 조직에 효과적으로 전달 합니다.
세포질 구조의 시각화를 위한 동시 2PLSM와 전기 생리학 기록 요구는 실험의 두 구성 요소에 대 한 균형 고려 사항 조사 이며 종종 좁은 시간 창 (~ 20 분)에 사용할 수 있는 유효한 패치 셀에서 샘플 데이터 취득입니다. 세포질 시각화를 고려 하지 않고 그것은 침입 기록 안정성 때문에 시간과 함께 감소 경향이 후 가능한 한 빨리 기록 시작 하. 그러나, 이미징 요구 때 electrophysiological 고려는 작은/원격 구조에 형광 농도 증가 대 한 충분 한 시간을 허용 해야 합니다. 이 파생 셀 신형 이미징 때 때때로 유용 곡선28, 작성 염료 농도 검사 하 여 exemplified입니다. 그림 3 은 몇 가지 예를 들어 신경 2PLSM 통해 Z 더미로 몇 군데와 프레 젠 테이 션을 위해 최대 강도 투영으로 축소를 보여준다. 그림 3a 높은 품질 이미지 어디 신경 형태학 완료 될 것으로 보인다, 잡음을 최소화 하 고, 파편 세포 형태학의 해석에 방해가 되지 않습니다 보여줍니다. 그림 3b 는 낮은 신호 대 배경 비율 및 내용이 풍부한 파편 때문에 낮은 품질의 이미지를 보여줍니다. 이 파편은 종종 셀을 접근 하는 동안 패치 피 펫에서 염료를 이미징의 방출에서 발생 하는 강렬한 형광의 구형 주머니로 나타납니다. 특히, 100 µ M의 PA-Nic 목욕 (목욕 응용 프로그램 수행) 하는 경우에 신호-배경 비율을 감소 하는 경향이 있으며 최적의 이미지 대비 리드. 알 렉 사 Fluor 568 또는 594는 파인더 염료로 또는 정규화 2PE 참조/정규화로 종종 로컬 응용 프로그램 실험에 매우 유용 합니다. 이러한 염료의 2 광 양자 흥분에 대 한 효과적인 파장 ~ 780 nm27, PA-Nic의 동시 시각화 및 세포질 구획의 식별을 허용 하는. 그러나이 파장 않습니다 하지 완전히 하지 마십시오 PA Nic5의 2 광자 photolysis를. 알 렉 사 Fluor 488 이다 PA Nic 목욕 응용 실험; 적당 한 파장 ≥900 nm, 흥분 할 때 PA Nic5 의 2 광자 photolysis 세포질 구획의 적합 한 시각화 유지 하면서 피할 수 있습니다.
그림 4 뇌 조각에 MHb 뉴런에서 지역화 된 PA Nic 레이저 플래시 photolysis에 대 한 예제 데이터를 보여 줍니다. 그림 4a (상위 패널) MarkPoints 프로토콜 실행, 사진-자극 자리 위치와 겹쳐 전에 찍은 마지막 2PLSM 이미지의 화면 캡처 "참조" 이미지의 예를 보여 줍니다. 그림 4a (낮은 이미지 패널) 표시 사진 자극의 확대 보기 자리 세포 형태학에 중첩. PA Nic photolysis에 해당 시간 상관 electrophysiological 응답 그림 4a의 아래쪽 패널에 표시 됩니다. 이전 작품 시연이 현재 nAChR 길 항 근5에 민감합니다. 다른 셀 단일 자리 photolysis 1의 간격에서 수행 되었다에서 대표 데이터를 표시 하는 그림 4b s 또는 10 s. 10 s 간격 현재 보유 기준선에 대 한 충분 한 회복 시간을 허용 하는 반면, 짧은 1 s 간격에 지도 프로토콜로 현재 지주에 점진적 증가 하였다. 증가 하는 현재 제안 니코틴 1 Hz 간격29와 시스템에서 확산에 충분 한 시간이 없 었 어 요. 이러한 시간 응답 분석 해야 드 노 보 공부 되 고, 어떤 새로운 셀 형식에 수행 nAChRs의 neuropharmacology 세포 유형 사이 다를 수 있습니다.
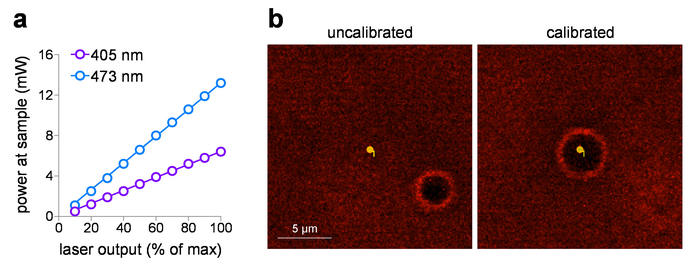
그림 1: Photostimulation 레이저 교정. (한) 사진-자극 레이저 전원 출력. 샘플 평면에서 (60 x 통해 1.0 / 나 물 찍기 목표) 405에 대 한 측정 및 표시 출력 설정에서 473 nm 사진 자극 레이저. (b) 사진-자극 레이저 교정. 화면 캡처 이미지 표시 의도 사진-자극 자리 사진 자극 발생 (화상-구멍) 하기 전 (왼쪽) 해당 위치 사이의 공간적 관계와 MarkPoints에서 (오른쪽) 실행 교정 후. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
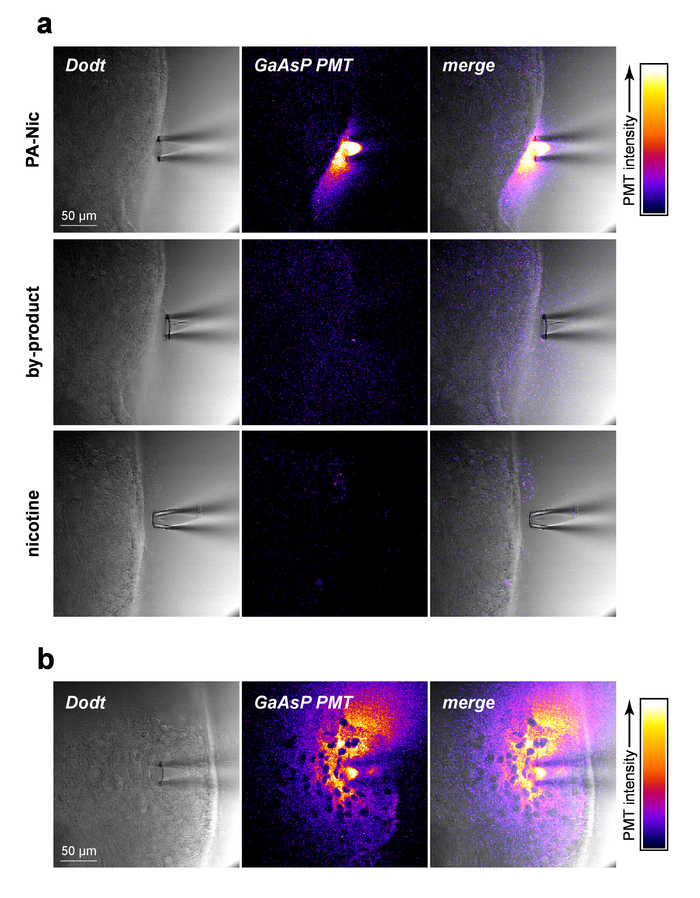
그림 2: PA-Nic 로컬 응용 프로그램. (한) 탐지의 PA-Nic 로컬에서 응용 프로그램 피 펫. 1mm PA-Nic, photolysis 부산물, 또는 니코틴 실제에 녹아, 로컬 응용 프로그램 피 펫에 로드 되었고 2PLSM 동안 뇌 조직에 적절 하 게 (900 nm 여기) 각 약물에 대 한 동일한 이미지 설정을 사용 하 여 이미징. 레이저 Dodt 대비 전송 이미지 스캐닝 GaAsP 음극 PMT는 형광 방출을 캡처하는 데 사용 하는 반면 조직/피 펫을 보여 줍니다. (b) PA-Nic (1 mM) 뇌 조직으로 끼얹는다 고 PA-Nic 사용 하 여 그것의 본질적인 형광의 측면 확산 표시 (a)와 같이 2PLSM를 통해 몇 군데. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
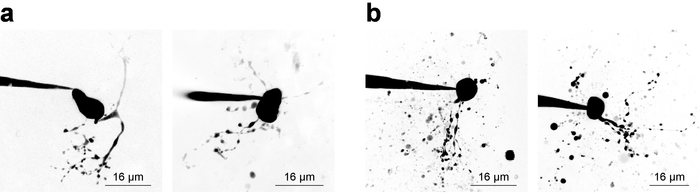
그림 3: 2-광자 레이저 스캐닝 현미경 검사 법 심상의 수집. (한) 최적의 2PLSM Z-누적 됩니다. 2PLSM Z-스택 최대 강도 계획의 두 가지 예 잘 해결된 dendrites와 MHb 뉴런에 대 한 표시 되며 거의 아무 간섭 파편. (b) 최적의 2PLSM Z-누적 됩니다. 2PLSM Z-스택 최대 강도 계획의 두 가지 예는 파편 (염료 셀 접근 동안 피펫으로에서 추방)으로 둘러싸인 MHb 뉴런에 대 한 표시 됩니다. 이러한 이미지는 이미지 (a)에 표시 한 것과 같은 보다 해석 하기가 더 어렵습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
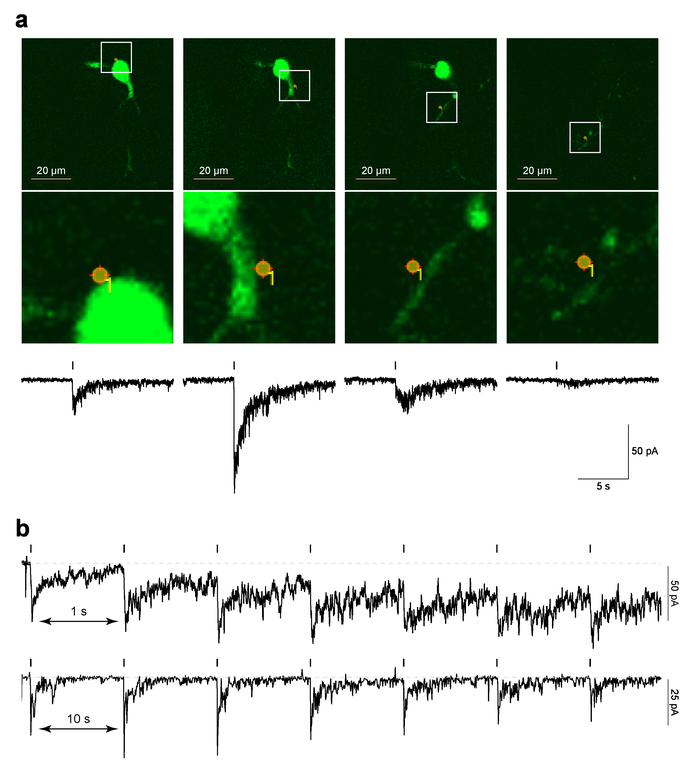
그림 4: PA 상태가의 레이저 플래시 photolysis (한) MarkPoints 참조 이미지 및 내부 전류 PA Nic photolysis에 의해 불러 일으켰다. MHb 뉴런 하나에 대 한 원시 참조 이미지 MarkPoints 사진 자극 재판 한 (표시 된) 세포 위치에 표시 됩니다. 일부 사진-자극 위치 (이 시리즈의 맨 오른쪽 이미지)에 대 한 유의 수지상 구조 초점에서 하지만 소마와 근 모 수석. 각 참조 이미지 아래 니코틴 uncaging 갖는 내부 전류 플롯 됩니다. PA Nic photolysis에 대 한 (b) 간 자극 간격입니다. 표본 녹음 MHb 뉴런에 대 한 표시 됩니다 어디 니코틴 아니었다 반복적으로 갇힌 1 간 자극 간격 동일한 perisomatic 위치에 s 또는 10 미 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
PA Nic 응용 프로그램/전달 방법의 선택이 지역화 된 사진-자극 기법에서 가장 중요 한 단계입니다. 두 가지 방법, 목욕 응용 프로그램 및 로컬 관류, 각 고유한 장점과 한계를 제공 합니다. 선택은 셀 유형의 관심 nAChR 기능 식 수준에 의해 크게 영향을. 그것은 종종 목욕 응용 프로그램 데이터 해석을 용이 하 게 기록 된 셀을 둘러싼 유니폼 프로브 농도 대 한 허용 기능 식 수준 높은 때 목욕 응용 프로그램을 사용 하는 것이 좋습니다. 목욕 응용 프로그램 또한 전체 과정을 쉽게 조직에 두 번째 관류 피 펫에 대 한 필요성을 제거 합니다. 그러나, 비싼 목욕 응용 실험 당 더 많은 비용이 화합물.
일반적으로, 문제 해결 이해 왜 아무 nAChR 활성화 본된 다음 플래시 photolysis 하려고 포함 됩니다. PA Nic와 이전 공부 하지는 셀 형식으로 작업할 때 탐정 ACh의 로컬 퍼프-응용 프로그램을 수행 해야 또는 여부를 충분 한 수용 체는 기능적으로 결정 하는 니코틴 표현5. 시스템 photolysis 응답을 감지 할 수 확인 하려면 제어 실험 중간 habenula 신경 수용 체30의 표현에서 행해져야 한다. 이 두뇌 지역에서 PA Nic 목욕 응용 프로그램은 가능, 유효성 검사 실험 하는 것이 좋습니다. 이러한 유효성 검사 실험을 수행한 후만 하나 이동 한다 unstudied 셀 형식. PA-Nic의 농도 증가, 플래시 강도 또는 펄스 기간 증가를 보증 수 있습니다 실험적인 시스템을 검증 하는 경우 응답 남아 매우 작은 또는 탐지 nAChR 긍정적인 allosteric 변조기 nAChR 향상을 추가합니다 활동6또는 이들의 어떤 조합.
때때로, uncaging은 너무 커서, 간접 전압의 결과로 상당한 nAChR 활성화 문이 나+ 채널 활성화와 가난한 공간 클램프 인해 클램프되지 내부 전류. 이러한 아티팩트는 완전히 무명 nAChR 안쪽으로 전류와 데이터 해석 불가능 하 게, 기록 피 펫에 QX-314 (2 mM)의 포함에 의해 제거할 수 있습니다. 그들은 또한 PA-Nic의 농도 감소 시켜 또는 플래시 강도 또는 펄스 기간을 줄여 제거 될 수 있습니다. 모든 보이는 빛 사진 자극 실험에서 자극을 피하기 위해 의도 하지 않은 자극/photolysis 위 또는 원하는 초점 비행기 아래 사이트를 선택할 때 배려를 행사 해야 합니다. 또한 고 때 해당 레이저 전원 해야 합니다 항상 수 적정 생리 적인 응답을 재현 하. 그것은 특히 z 축 photostimulation의 위/아래 초점 자리 활성화는 ligands 수 있습니다 여전히 확산 하 고 연구는 생물 학적 시스템 (예:, 수용 체)와 상호 작용으로 갇힌된 ligands, 작업할 때 알고 있어야 하는 것이 중요.
PA Nic 레이저 플래시 photolysis 수 없습니다 모든 수사에 대 한 적절 한 몇 가지 제한이 존재. 첫 번째는 적절 한 설정의 상대적으로 높은 비용입니다. 그대로 뇌 조각으로 작업할 때 dendrites 필요 2 광자 현미경 같은 정교한 시각화 시스템 처럼 작은 직경 구조 근처 uncaging. Ti:sapphire, 공연 2 광자 현미경에 대 한 가변 적외선 펄스 레이저의 높은 비용 이외는 듀얼 검 류 계 시스템 독립적으로 위치 하지 두 개의 레이저 광선 더 시스템 비용을 증가 시킵니다. 조사는 충분 한 전문성과 시간을 구성, 문제 해결, 이러한 시스템을 유지 하는 경우 집에서 만든 시스템을 사용 하 여 전체 시스템 비용을 줄일 수 있습니다. 종종 두 번째 제한 포함 낮은 nAChR 기능 식, 부분적으로 위에서 언급 한 단계를 취 함으로써 완화 될 수 있습니다, 하지만이 성공 하지 못할 수 있습니다. 일반적으로, 하나 agonists의 퍼프-응용 프로그램을 다음 ligand 활성화 전류를 측정할 수 없다, 만약 PA Nic 플래시 photolysis 전압 클램프 아래 하지 허용 결과 얻을 수 있습니다. 세 번째 제한 포함 본질적인 형광 PA 상태가 PA-Nic의 ~ 405 nm 빛을 흡수 하 고 녹색 형광 단백질 (GFP) 또는 알 렉 사 4885비슷한 범위에서 방출. PA Nic 농도 ~ 1 mM를 초과 하는 경우이 형광 속성 동시에 신경 구조를 시각화 도전 할 수 있습니다. 이 줄이기 위해 쉽게 관류 피 펫에서 PA-Nic의 흐름을 제어할 수 중요 하다. 정기적으로, PA Nic 흐름 멀리 확산 형광 분자를 허용 하도록 중단 됐다. 이 다시 uncaging 광속의 자리 위치를 확인 하기 위한 신경의 이미징 허용. 4 잠재적인 제한 언급 하는 photolysis에 대 한 405 nm 빛의 사용을 포함. 405와 같은 짧은 파장 nm 두뇌 분할 같은 복잡 한 조직에 더 산란 하는 경향이 있다. 따라서, 주어진된 플래시 강도 및 기간에 uncaging 응답 진폭 및 감퇴 속도 론 수 수 차동 영향을 조각 내 uncaging 초점의 깊이. NAChRs의 생물 학적 측면에 대 한 결론으로이 중요 한 경고를 해야한다.
이 지역화 된 레이저 플래시 photolysis 기술은 최근 nAChR 신경 생물학에 대 한 새로운 정보를 밝히기 위해 사용 되었습니다. 예를 들어 만성 니코틴 노출 perisomatic 및 중간 habenula 뉴런5수지상 nAChR 기능을 향상 시킵니다. 그것은 또한 복 부 tegmental 지역 조미료 신경 그들의 perisomatic에 수지상 세포 구획6기능 nAChRs 익스프레스 처음으로 보여줄 수 있도록 사용 되었다. 이 기술을 사용 하는 많은 잠재적인 미래 그리고 접근에는 있는 대뇌 피 질의 각 추 모양 신경31 등 대뇌 피 질32, 수 표현 nAChRs가33 다른 주요 신경 종류에 적용할 수 있습니다. , 그리고 해 마19. 이 기술은 또한34 다른 신경 구획을 특정 수용 체 하위 지역화를 편집 하는 약리학 또는 nAChR 유전자와 결합 수 있었다. 접근 포함 하 되이 제한 되지 않고, 그 PA Nic5와 병렬로 개발 다른 coumarin 갇힌 화합물에 쉽게 적용할 수 있습니다. 마지막으로, 펜 실바 니 아-Nic 플래시 photolysis 5 월 1 일에서에서 사용할 수 깨어/행동 동물 소설 행동 약리학 패러다임에 니코틴의 행동을 연구.
공개
D.L.W. 관련 나노 형광 현미경 검사 법에 대 한 유료 컨설턴트 역할을 합니다.
감사의 말
저자 감사 다음 북서부 주 수 사관 들의 실험실 구성원: Ryan Drenan, D. 제임스 Surmeier, Yevgenia Kozorovitskiy, 그리고 Anis 계약자. 이 작품은 미국 국립 보건원 (NIH) (보조금 DA035942와 R.M.D. DA040626), PhRMA 재단 (친목 M.C.A.), 그리고 HHMI에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| Instruments, Consumables, and Miscellaneous Chemicals | |||
| Multiclamp 700B | Molecular Devices Corp. | Patch clamp amplifier | |
| Pneumatic Picopump | World Precision Instruments | PV820 | |
| Micropipette puller | Sutter Instrument Co | P-97 | |
| Temperature Controller | Warner Instruments | TC-324C | |
| Vibrating blade microtome | Leica Biosystems | VT1200S | |
| Ultrafree-MC Centrifugal Filter | MilliporeSigma | UFC30GV0S | internal solution filter |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B150F-4 | patch and local application pipette |
| (-)-Nicotine hydrogen tartrate salt | Glentham | GL9693 | nicotine salt |
| 7-carboxymethylamino-4-methyl coumarin | Janelia Research Campus | PA-Nic by-product | |
| 1-[7-[bis(carboxymethyl)- amino]coumarin-4-yl]methyl-nicotine | Janelia Research Campus | PA-Nic | |
| Euthasol (Pentobarbital Sodium and Phenytoin Sodium) | Virbac | ANADA #200-071 | |
| Alexa FluorTM 488 Hydrazide | ThermoFisher | A10436 | green fill dye |
| Alexa FluorTM 568 Hydrazide | ThermoFisher | A10437 | red fill dye |
| 6-carboxy-AF594 (Alexa Fluor 594) | Janelia Research Campus | red fill dye | |
| QX 314 chloride | Tocris | 2313 | voltage-gated sodium channel blocker |
| Power Meter | ThorLabs | S120C | |
| Name | Company | Catalog Number | Comments |
| Chemicals for Solutions | |||
| N-Methyl-D-glucamine | Sigma | M2004 | |
| Potassium chloride | Sigma | P3911 | |
| Sodium phosphate monobasic monohydrate | Sigma | S9638 | |
| Sodium bicarbonate | Sigma | S6014 | |
| HEPES | Sigma | H3375 | |
| D-(+)-Glucose | Sigma | G5767 | |
| (+)-Sodium L-ascorbate | Sigma | A4034 | |
| Thiourea | Sigma | T8656 | |
| Sodium pyruvate | Sigma | P2256 | |
| Magnesium sulfate heptahydrate | Sigma | 230391 | |
| Calcium chloride dihydrate | Sigma | 223506 | |
| Sodium chloride | Sigma | S9625 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma | E3889 | |
| Adenosine 5′-triphosphate magnesium salt | Sigma | A9187 | |
| Guanosine 5′-triphosphate sodium salt hydrate | Sigma | G8877 | |
| Name | Company | Catalog Number | Comments |
| Components of 2-Photon Microscope | |||
| Ultima Laser Scanner for Olympus BX51 Microscope | Bruker Nano, Inc. | imaging software and galvos | |
| Imaging X-Y galvanometers | Cambridge Technology | ||
| Mai Tai HP1040 | Spectra-Physics | Tuneable IR laser | |
| Pockels cell M350-80-02-BK with M302RM Driver | Conoptics, Inc. | for IR laser attenuation | |
| Integrating Sphere Photodiode Power Sensor | Thorlabs, Inc | laser power pick-off photodiode | |
| Uncaging X-Y galvanometers | Cambridge Technology | ||
| Helios 2-Line Laser Launch | Bruker Nano, Inc. | uncaging laser components | |
| OBIS LX/LS 405 nm (100 mW) | Coherent, Inc. | ||
| OBIS LX/LS 473 nm (75 mW) | Coherent, Inc. | ||
| Point-Photoactivation / Fiber Input Module for Limo Sidecar - Uncaging | Bruker Nano, Inc. | ||
| Name | Company | Catalog Number | Comments |
| Upright Microscope | Olympus | BX51WIF | Upright microscope chasis |
| Objective: Olympus M Plan FL 10x; NA 0.3 WD 11 mm | Olympus | 10x objective | |
| Objective: Olympus M Plan Fluorite 60x/1.0 WD=2mm NIR | Olympus | 60x water-dipping objective | |
| X-Cite 110, four-LED LLG coupled epi-fluorescence light source | Excelitas Technologies | LED Light Source | |
| Epi-Fluorescence Filter: ET-GFP (FITC/CY2) for Epi-Turret | Chroma Technologies | LED Filter for blue light excitation | |
| Epi-Fluorescence Filter: ET-DsRed (TRITC/CY3) for Epi-Turret | Chroma Technologies | LED Filter for green light excitation | |
| B&W CCD camera; Watec, 0.5in B/W CCD | Watec Co., LTD. | CCD camera for patch clamp recording | |
| Name | Company | Catalog Number | Comments |
| External Detectors - Dual Reflected Emission - Olympus Upright (Multi-Alkali, GaAsP) | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | red channel PMT |
| 595/50m | Chroma Technologies | red channel emission filter | |
| 565lpxr | Chroma Technologies | dichroic beam splitter | |
| GaAsP end-on PMT | Hamamatsu | 7422PA-40 | green channel PMT |
| 525/70m | Chroma Technologies | green channel emission filter | |
| High-Speed Shutter for Hamamatsu H7422 PMT | Vincent Associates / Bruker | 517329 | PMT shutter mount |
| Name | Company | Catalog Number | Comments |
| Dodt Gradient Contrast Transmission Detection Module | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | Dodt PMT |
참고문헌
- Zhang, C., et al. Cholinergic tone in ventral tegmental area: Functional organization and behavioral implications. Neurochemistry International. 114, 127-133 (2018).
- Sarter, M., Parikh, V., Howe, W. M. Phasic acetylcholine release and the volume transmission hypothesis: time to move on. Nature Reviews Neuroscience. 10 (5), 383-390 (2009).
- Coyle, J. T., Price, D. L., DeLong, M. R. Alzheimer's disease: a disorder of cortical cholinergic innervation. Science. 219 (4589), 1184-1190 (1983).
- Katz, B., Thesleff, S. A study of the desensitization produced by acetylcholine at the motor end-plate. Journal of Physiology. 138 (1), 63-80 (1957).
- Banala, S., et al. Photoactivatable drugs for nicotinic optopharmacology. Nature Methods. 15 (5), 347-350 (2018).
- Yan, Y., et al. Nicotinic Cholinergic Receptors in VTA Glutamate Neurons Modulate Excitatory Transmission. Cell Reports. 23 (8), 2236-2244 (2018).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. α4α6β2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Molecular Pharmacology. 84 (3), 393-406 (2013).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. Journal of Visualized Experiments. (68), (2012).
- Ren, J., et al. Habenula "cholinergic" neurons co-release glutamate and acetylcholine and activate postsynaptic neurons via distinct transmission modes. Neuron. 69 (3), 445-452 (2011).
- Koppensteiner, P., Melani, R., Ninan, I. A Cooperative Mechanism Involving Ca(2+)-Permeable AMPA Receptors and Retrograde Activation of GABAB Receptors in Interpeduncular Nucleus Plasticity. Cell Reports. 20 (5), 1111-1122 (2017).
- Zhang, J., et al. Presynaptic Excitation via GABAB Receptors in Habenula Cholinergic Neurons Regulates Fear Memory Expression. Cell. 166 (3), 716-728 (2016).
- Chen, E., et al. Altered Baseline and Nicotine-Mediated Behavioral and Cholinergic Profiles in ChAT-Cre Mouse Lines. The Journal of Neuroscience. 38 (9), 2177-2188 (2018).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter increased acetylcholine release in the hippocampus. Neuroscience. 218, 1-11 (2012).
- Ting, J. T., Feng, G. Recombineering strategies for developing next generation BAC transgenic tools for optogenetics and beyond. Frontiers in Behavioral Neuroscience. 8, 111 (2014).
- Crittenden, J. R., Lacey, C. J., Lee, T., Bowden, H. A., Graybiel, A. M. Severe drug-induced repetitive behaviors and striatal overexpression of VAChT in ChAT-ChR2-EYFP BAC transgenic mice. Frontiers in Neural Circuits. 8, 57 (2014).
- Kolisnyk, B., et al. ChAT-ChR2-EYFP mice have enhanced motor endurance but show deficits in attention and several additional cognitive domains. The Journal of Neuroscience. 33 (25), 10427-10438 (2013).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter enhances dendritic complexity of adult-born hippocampal neurons and improves acquisition of spatial memory during aging. Neurobiology of Aging. 36 (5), 1881-1889 (2015).
- Denk, W. Two-photon scanning photochemical microscopy: mapping ligand-gated ion channel distributions. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6629-6633 (1994).
- Khiroug, L., Giniatullin, R., Klein, R. C., Fayuk, D., Yakel, J. L. Functional mapping and Ca2+ regulation of nicotinic acetylcholine receptor channels in rat hippocampal CA1 neurons. The Journal of Neuroscience. 23 (27), 9024-9031 (2003).
- Filevich, O., Salierno, M., Etchenique, R. A caged nicotine with nanosecond range kinetics and visible light sensitivity. Journal of Inorganic Biochemistry. 104 (12), 1248-1251 (2010).
- Tochitsky, I., et al. Optochemical control of genetically engineered neuronal nicotinic acetylcholine receptors. Nature Chemistry. 4 (2), 105-111 (2012).
- Wokosin, D. L., Squirrell, J. M., Eliceiri, K. W., White, J. G. Optical workstation with concurrent, independent multiphoton imaging and experimental laser microbeam capabilities. Review of Scientific Instruments. 74 (1), 193-201 (2003).
- Plotkin, J. L., Day, M., Surmeier, D. J. Synaptically driven state transitions in distal dendrites of striatal spiny neurons. Nature Neuroscience. 14 (7), 881-888 (2011).
- Galtieri, D. J., Estep, C. M., Wokosin, D. L., Traynelis, S., Surmeier, D. J. Pedunculopontine glutamatergic neurons control spike patterning in substantia nigra dopaminergic neurons. Elife. 6, (2017).
- Yasuda, R., et al. Imaging calcium concentration dynamics in small neuronal compartments. Science STKE. (219), pl5 (2004).
- Inoue, S., Spring, K. . Video microscopy: The fundamentals. , 163-186 (1997).
- Zipfel, W. R., Williams, R. M., Webb, W. W. Nonlinear magic: multiphoton microscopy in the biosciences. Nature Biotechnology. 21 (11), 1369-1377 (2003).
- Maravall, M., Mainen, Z. F., Sabatini, B. L., Svoboda, K. Estimating intracellular calcium concentrations and buffering without wavelength ratioing. Biophysical Journal. 78 (5), 2655-2667 (2000).
- Wathey, J. C., Nass, M. M., Lester, H. A. Numerical reconstruction of the quantal event at nicotinic synapses. Biophysical Journal. 27 (1), 145-164 (1979).
- Shih, P. Y., et al. Differential expression and function of nicotinic acetylcholine receptors in subdivisions of medial habenula. The Journal of Neuroscience. 34 (29), 9789-9802 (2014).
- Verhoog, M. B., et al. Layer-specific cholinergic control of human and mouse cortical synaptic plasticity. Nature Communications. 7, 12826 (2016).
- Koukouli, F., et al. Nicotine reverses hypofrontality in animal models of addiction and schizophrenia. Nature Medicine. 23 (3), 347-354 (2017).
- Xiao, C., et al. Chronic nicotine selectively enhances α4β2* nicotinic acetylcholine receptors in the nigrostriatal dopamine pathway. The Journal of Neuroscience. 29 (40), 12428-12439 (2009).
- Peng, C., et al. Gene Editing Vectors for Studying Nicotinic Acetylcholine Receptors in Cholinergic Transmission. European Journal of Neuroscience. , (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유