Method Article
Funzione del recettore nicotinico dell'acetilcolina in fettine di cervello del Mouse tramite Laser fotolisi di nicotina fuse di sondaggio
In questo articolo
Riepilogo
Questo articolo presenta un metodo per lo studio dei recettori nicotinici per l'acetilcolina (nAChR) nelle fette del cervello del mouse di nicotina uncaging. Quando accoppiato con simultanea patch clamp registrazione e microscopia a scansione laser di 2 fotoni, nicotina uncaging collega la funzione del recettore nicotinico con morfologia cellulare, fornendo una più profonda comprensione della neurobiologia colinergico.
Abstract
Acetilcolina (ACh) atti tramite i ricevitori per modulare una varietà di processi neuronali, ma esso è stato impegnativo per collegare la funzione del recettore ACh con subcellulare posizione all'interno delle cellule dove questa funzione è svolta. Per studiare la posizione subcellulare dei recettori nicotinici ACh (nAChR) in tessuto cerebrale nativo, un metodo ottico è stato sviluppato per uscita precisa di nicotina a luoghi discreti vicino a membrane di un neurone durante registrazioni elettrofisiologiche. Patch-premuta di neuroni nel cervello fette sono pieni di tingono di visualizzare la loro morfologia durante la microscopia a scansione laser 2-fotone e nicotina uncaging viene eseguito con un lampo di luce puntando un raggio laser di nanometro 405 vicino a uno o più membrane cellulari. Cellulare attuale deviazioni sono misurati, e immagine in alta risoluzione tridimensionale (3D) del neurone registrato è fatto per permettere la riconciliazione delle risposte dei nAChR con morfologia cellulare. Questo metodo permette l'analisi dettagliata della distribuzione funzionale dei nAChR nelle preparazioni di tessuto complesso, promettente per migliorare la comprensione della neurotrasmissione colinergica.
Introduzione
Segnalazione colinergici modula numerosi processi cerebrali, tra cui controllo attentivo, movimento volitivo e ricompensa1,2. Farmaci che migliorano la trasmissione dell'acetilcolina (ACh) sono usati per trattare deficit cognitivo associato a malattia di Alzheimer, che implica un ruolo importante per i sistemi colinergici nella cognizione3. Una migliore comprensione dei recettori colinergici e circuiti negli stati sani e malati potrebbe portare a migliori approcci terapeutici per varie malattie neurologiche.
Recettori nicotinici di ACh (nAChR) sono una famiglia di canali ionici ligando che flusso di cationi in risposta a ACh endogeno o esogena nicotina da prodotti del tabacco. Dato il fatto che essi erano tra i recettori del neurotrasmettitore molto primi di essere descritto4, farmacologia dei nAChR e posizione nelle fibre muscolari è ben capito per recettori di tipo muscolare. Al contrario, comparativamente piccolo è conosciuto circa la farmacologia e la distribuzione subcellulare di nativo recettori nicotinici nel cervello. Questa lacuna nella conoscenza è stato recentemente affrontata attraverso lo sviluppo di una sonda chimica romanzo che permette per spazialmente limitato e rapida attivazione di recettori nicotinici nel tessuto cerebrale durante imaging cellulare e registrazioni elettrofisiologiche5. Qui, sono descritti i passaggi metodologici chiave coinvolti in questo approccio, con l'obiettivo generale di rafforzare la capacità di collegare dei nAChR funzione con struttura di un neurone.
Fuse nicotina (PA-Nic; nome chimico: 1-[7-[bis(carboxymethyl)-ammino] cumarina-4-yl] metile-nicotina) possono essere photolyzed con ~ 405 nm laser lampeggia per rilasciare in modo efficiente nicotina5,6. Prima del uncaging, PA-Nic è stabile in soluzione ed esibisce senza spiacevoli caratteristiche farmacologiche o fotochimica5. Dopo fotolisi, nicotina rilasciata prevedibilmente attiva i nAChR e i sottoprodotti uncaging sono farmacologicamente inerte5. Un laser continuo-fluttuano è utilizzato come la sorgente luminosa di fotolisi con potenza > 1 mW misurata al campione. Quando localizzate, foto-stimolazione mirata è combinata con la capacità di individuare le membrane cellulari con laser 2-fotone microscopia (2PLSM), e i due vantaggi chiavi di questo approccio sono pienamente realizzati: fotolisi velocità e precisione spaziale.
In molti aspetti, la fotolisi di PA-Nic sono superiore ad altri metodi di consegna dei nAChR ligandi per recettori all'interno di fette del cervello. Tali approcci includono vasca applicazione7 e droga locale consegna tramite una pipetta di palla8. Considerando che il primo approccio tende a enfatizzare eccessivamente gli effetti a lungo termine del farmaco applicato, quest'ultimo approccio può soffrire di variabilità nella cinetica di risposta tra prove e attraverso le cellule. Nessuno di questi approcci alternativi in grado di distinguere adeguatamente attività del ricevitore in luoghi diversi cellulari dal neurone stesso. Optogenetically-attiva il rilascio di ACh è stato utilizzato per le indagini di nAChR nativi9,10,11, ma non si è dimostrato utile per percorsi di mapping subcellulare dei nAChR. Inoltre, la maggior parte degli studi che utilizzano questo approccio hanno contato su un topo di transgenico artificiali batterici del cromosoma ChR2-esprimendo con trasmissione colinergica anormale12,13,14, 15 , 16 , 17.
PA-Nic fotolisi non sono l'approccio solo ottica di studio dei recettori colinergici. Una gabbia carbachol era utilizzato per il mapping funzionale attività di recettore ACh in cellule coltivate18 e cervello fette19, ma non era disponibile in commercio per studi comparativi durante lo sviluppo del PA-nic. Un bis di rutenio (bipyridine)-nicotina complessa (RuBi-nicotina) è stata segnalata per consentire nicotina uncaging20, ma le preparazioni commerciali di RuBi-nicotina si è rivelata inferiore a PA-Nic in un confronto testa a testa studiano5. Può essere utile ripetere tali esperimenti comparativi con non-commerciale, altamente purificato RuBi-nicotina, come suo assorbimento visibile potrebbe complimento caratteristiche di PA-Nic per studi colinergici. Infine, i nAChR sono anche stati otticamente manipolati utilizzando una combinazione di foto-commutabile ligandi e recettori geneticamente21. Questo approccio è complementare alla PA-Nic fotolisi in tessuto cerebrale, con il requisito di capacità di targeting genetici per i nAChR modificate visto come sia un vantaggio e uno svantaggio.
Diversi requisiti chiavi di questo approccio dovrebbero essere notati. In primo luogo, un metodo di visualizzazione appropriato è necessario per individuare con precisione la membrana di un neurone. Imaging con microscopia convenzionale epi-fluorescenza può essere sufficiente quando studiare cellule coltivate, ma per la registrazione da neuroni in fettine di cervello o altre preparazioni di tessuto spesso, 2PLSM o la microscopia confocale è un requisito. In secondo luogo, è necessario un metodo adatto per posizionare il raggio laser fotolisi. Questo approccio utilizza una testa di scansione dual-galvanometro con due specchi indipendente x-y per raster scansione del fascio imaging e punto fotoattivazione utilizzando il uncaging laser fascio22,23,24. Altri, più limitati soluzioni sono possibili, come (1) una testa di scansione single-galvanometro che in alternativa raster analizza il fascio di imaging e il fascio uncaging o (2) semplicemente dirigere il fascio uncaging al centro del campo di vista tale che la cella è portata a Questa posizione per fotolisi. In terzo luogo, occorre un sistema per la registrazione simultanea di elettrofisiologici se si vuole raccogliere segnali fisiologici durante gli esperimenti. I suddetti requisiti possono essere soddisfatte con una tecnica di imaging ottico adatta, come recentemente descritto5. Di seguito è incluso un protocollo dettagliato che descrive i passaggi chiave di questo approccio.
Protocollo
Lavori relativi alla preparazione di fetta di cervello è stato esaminato e approvato dal comitato di uso (protocollo #IS00003604) e Northwestern University Animal Care.
Attenzione: Laser utilizzati per punto foto-stimolazione sono visibile laser di classe IIIb che hanno il potenziale di causare danni agli occhi. 2PLSM richiede un laser di vicino infrarosso (NIR) classe IV (> 500 mW), che ha il potenziale per causare gravi danni agli occhi e ustioni anche in altri tessuti. Contenimento di fascio laser adeguata, sistema interblocchi, oltre a controlli amministrativi e derivati dal sono tenuti a garantire un funzionamento sicuro delle apparecchiature basate su laser. Cercano sempre personale addetto alla sicurezza laser locale quando si lavora con i laser.
1. taratura e verifica del Laser(s) Uncaging
-
Quantificare la potenza del laser per essere consegnati al campione.
- Accendere il laser di 405 nm (massima potenza di 100 mW con segnale di comando 5 V) e lasciare che il sistema laser riscaldare per circa 10 min.
Nota: Il laser è ancora chiuse (con 0 V drive) e non c'è nessuna potenza di uscita fino a quando il laser viene inviato una tensione di controllo per modulare la potenza in uscita. - Inserire un misuratore di potenza sul piano del campione di tessuto o al posto della lente condensatore. Centro manualmente il contatore rispetto alla lente del percorso ottico/obiettivo.
- Impostare il contatore per l'intervallo di lunghezza d'onda corretta (400-1100 nm). Zero il contatore premendo l'apposito pulsante.
- Utilizzando il software di controllo, selezionare 100 (out di max 1000; 1000 = 5 V) per la potenza del laser 405 nm, che imposta il laser al 10% di piena potenza. Se lo si desidera, la tensione di controllo laser può anche essere alimentata nel PrairieView sistema tramite VoltageRecord per fornire una registrazione digitale del comando tempistica e il livello di potenza del segnale.
- Registrare la lettura del misuratore di potenza.
- Selezionare 150 (15% di 1000 max) per l'uscita di potenza di 405 nm laser e registrare la lettura del misuratore di potenza. Ripetere questa operazione per i seguenti poteri di uscita raccogliere una curva di potenza del laser: 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 e 1000.
- Accendere il laser di 405 nm (massima potenza di 100 mW con segnale di comando 5 V) e lasciare che il sistema laser riscaldare per circa 10 min.
-
Calibrare i uncaging galvanometri di laser. Eseguire i passaggi seguenti ogni volta che c'è un cambiamento per i componenti ottici del sistema, ogni volta che c'è una preoccupazione per il posizionamento accurato del posto, o regolarmente ogni mese.
- Installare il 60 x acqua-immersione microscopio obiettivo che verrà utilizzato in esperimenti imaging e fotostimolazione. Il software di acquisizione/imaging, selezionare il 60 x diametro obiettivo e un'impostazione di zoom ottico di 1 (v. punto 3.1.4.2).
- Contrassegnare un cerchio pieno su un vetrino pulito di microscopia con un pennarello rosso. Porre il vetrino sul palco microscopio, con l'indicatore verso l'obiettivo.
- Pre-attenzione al microscopio sulla regione del marcatore rosso con una x 4 o obiettivo 10x. Aggiungere 1-2 mL di acqua nella parte superiore dell'indicatore rosso puntino/sensibile e quindi passare all'obiettivo 60x e immergere l'obiettivo nell'acqua. Focalizzare l'obiettivo sulla regione del marcatore rosso sottile.
- Passare alla scansione laser 2-fotone. Per la maggior parte dei sistemi, spostare torretta alla posizione #1, spostare il prisma trinoculare fuori dal percorso della luce, spostare lo specchio di testa di scansione in fronte e impostata la lunghezza d'onda laser ~ 900 nm. Selezionare l'opzione casella di 512 x 512 pixel per i parametri di acquisizione immagine, che è l'elemento di pixel predefinito per la routine di calibrazione specchio di stimolazione.
- Sistema di inizio scansione con un imaging laser di potenza superiore al minimo e mettere a punto il focus oggettivo sul livello di fluorescenza sottile pennarello rosso. Scegliere un campo nel campo di fluorescenza libero da detriti e uniformemente rivestito con pennarello.
Nota: L'installazione in questo protocollo utilizza software di acquisizione/imaging PrairieView 5.4. - Aprire la funzione di Uncaging Galvo calibrazione all'interno del menu strumenti – calibrazione/allineamento del software. Camminare attraverso il tutorial per la calibrazione spaziale del secondo paio specchio galvanometro bruciare macchie .
- All'interno il tutorial masterizzare macchie , scegliere il laser di 405 nm, selezionare una potenza di stimolazione laser di 400 e una durata di stimolazione di 20 ms, questo dovrebbe produrre piccolo (~ 1-5 micron di diametro) buchi nel marcatore rosso.
Nota: Impostazioni quali ~ 2-4 mW e 1-10 ms sono tipicamente utilizzati, ma le impostazioni sono determinate dal campione. Impostazioni di alimentazione PA-Nic foto-stimolazione rischiano di essere molto inferiore alla potenza necessaria durante la calibrazione per l'ablazione di un foro visibile nella diapositiva indicatore rosso. Questa routine di calibrazione è utile per individuare punti di fotostimolazione ma non deve essere utilizzata per dedurre assoluta fotostimolazione volumi durante risposte fisiologiche. - Selezionare aggiornamento per stimolare e rinfrescare l'immagine dopo il punto centrale brucia e spostate l'indicatore rosso rotondo l'effettiva posizione spot. Eseguire questa operazione per il punto centrale, il punto di centro-destra, il punto centrale più basso e infine per una griglia di nove punti (tutti gli angoli e bordi più al centro dell'immagine).
Nota: Il centro, a destra e posizioni spot corretti inferiore determinano le tensioni del galvanometro di stimolazione per definire il vero centro e X e Y fattori di scala per abbinare la coppia di specchio di stimolazione per la coppia di mirror imaging. Il software di scala e aggiornamento, tutti i successivi esperimenti di MarkPoints eseguiti alle impostazioni di zoom diverse dallo zoom di calibrazione spaziale.
- All'interno il tutorial masterizzare macchie , scegliere il laser di 405 nm, selezionare una potenza di stimolazione laser di 400 e una durata di stimolazione di 20 ms, questo dovrebbe produrre piccolo (~ 1-5 micron di diametro) buchi nel marcatore rosso.
- Verificare la taratura aprendo la finestra di MarkPoints e l'attivazione manuale dei parametri di stimolazione in spot(s) definite in una nuova area del campione. Assicurarsi che il file di calibrazione corretta, più tardi viene caricato nella finestra di MarkPoints . Attivare la caratteristica MarkPoints/gruppo o Serie di MarkPoints a un spot(s) definito o utilizzare la funzionalità di Live/ablazione destra/sinistra cliccare il mouse ovunque sull'immagine durante la scansione diretta per applicare un impulso di test e per verificare la corretta taratura.
Nota: L'ustione di laser spot dovrebbe ora essere perfettamente centrato sull'indicatore MarkPoints . - Monitorare e registrare l'attivazione del potere di impulso del laser e della durata temporale toccando la tensione di unità nel programma VoltageRecord (Vedi punto 1.1.4). Allo stesso modo, registrare la posizione di ogni spot di stimolazione utilizzando un segnale di tensione in scala dai segnali di feedback derivato dalla coppia di specchi galvanometro foto-stimolazione.
2. preparazione del nicotina fuse (PA-Nic)
- Recuperare un'aliquota di farmaco liofilizzato fuse dal deposito.
Nota: Il seguente protocollo è specifico per PA-Nic; regolare per altre droghe di fuse. Anche se PA-Nic dimostra una stabilità eccezionale5, prendere ragionevoli precauzioni per proteggerla dall'esposizione alla luce intensa durante la preparazione e/o esperimenti. Questo può essere realizzato semplicemente lavorando in condizioni di scarsa luminosità; non è necessario limitare al rosso luce filtrata. -
Eseguire l'applicazione locale di PA-nic.
- Tirare una micropipetta di vetro con un diametro di apertura di 20-40 µm con un estrattore di pipetta programmabile.
- Filtro ~ 1 mL di soluzione di registrazione con un filtro da 0,22 µm. Risospendere una quantità di PA-Nic nella soluzione filtrata la registrazione per ottenere una concentrazione finale di 2 mM. Ad esempio, sciogliere un'aliquota di 100 nmol liofilizzato in 50 µ l di soluzione filtrata per la registrazione.
Nota: Una composizione di soluzione di registrazione suggerite si trovano in recenti pubblicazioni5,6 che impiegano PA-Nic fotolisi. - Retro-riempire la pipetta di applicazione locale con 50 µ l di 2mm PA-nic.
- Fissare la pipetta di applicazione locale in un supporto di pipetta montato su un micromanipolatore. Collegare la pipetta titolare via appropriato un sistema di espulsione di pressione capace di applicazione a bassa pressione sostenuta (1-2 psi).
- Utilizzando il micromanipolatore, manovrare la pipetta di applicazione locale in soluzione di registrazione extracellulare e il puntale della pipetta leggermente di sopra del tessuto di cervello del mouse posizione ~ 50 μm dalla cella di interesse. Per un dettagliato protocollo di preparazione da fetta di cervello del mouse e patch morsetto registrazioni8, consultare un rapporto precedente.
- Verificare i parametri di applicazione applicando brevemente pressione (psi 1-2). Ci dovrebbe essere minimo a nessuno spostamento della cellula di interesse. Se si verifica un movimento significativo, riposizionare la pipetta di applicazione locale ulteriore distanza (in direzione laterale e/o assiale) dalla cella di interesse.
- Dopo il raggiungimento della pinza patch stabile a cellula intera (dettagli per i quali sono inclusi in una precedente pubblicazione8), girare su applicazione a bassa pressione (1-2 p.s.i.) tramite l'interruttore manuale appropriato del dispositivo di espulsione di pressione. Saturare il tessuto che circonda la cella con PA-Nic per 1-2 minuti prima di procedere al passaggio successivo.
-
Eseguire l'applicazione di vasca (superfusione) di PA-Nic per la fetta di cervello.
- Sciogliere una quantità di PA-Nic in un volume di registrazione soluzione appropriata per ricircolo continuo ottenere una concentrazione finale di 100 μM. Ad esempio, sciogliere un 1 µmol aliquotare in 10 mL di soluzione di registrazione utilizzando un tubo standard da 15 mL.
- Iniziate ricircolo della soluzione PA-Nic ad un tasso di 1.5-2 mL/min aprendo il controllo appropriato flusso nel sistema di perfusione. Ricircolo si verifica per tutta la durata della registrazione. Per risparmiare prezioso farmaco, ridurre al minimo il volume di ricircolo utilizzando tubi con un diametro interno minimo, e/o accorciando la lunghezza totale della tubazione utilizzata nel sistema di perfusione.
Nota: Adottando queste misure, il volume per il ricircolo del bagno può ridursi a 5 mL di soluzione di PA-Nic. PA-Nic soluzioni spesso possono essere utilizzati per due volte consecutive registrazione giorni nella stessa settimana se conservato al riparo dalla luce a 4 ° C. - Durante il ricircolo, continuamente bolla la soluzione con carbogen (5% O2, 95% CO2) e mantenere la temperatura del bagno a 32 ° C.
- Mantenere la fetta di cervello in soluzione di registrazione mentre si lavora con PA-Nic in condizioni di scarsa illuminazione.
3. i neuroni con microscopia a scansione Laser di 2 fotoni di imaging
- Eseguire la visualizzazione live della cella.
- Identificare/visualizzare un neurone habenula mediale (MHb) utilizzando la luce trasmessa o interferenza differenziale infra-rosso a contrasto (IR/DIC) ottica e una videocamera e stabilire una registrazione di stabile a cellula intera patch clamp. Fare riferimento a un protocollo precedente per i dettagli sulle registrazioni di patch clamp da neuroni nel cervello del mouse acutamente preparato fette8.
- Dopo aver stabilito l'ad alta resistenza (> 1 GΩ) configurazione di cella-associata, ma prima effrazione, passare il set-up e software per il modo di scansione laser.
- Dopo il rodaggio, utilizzare scansione laser per verificare che un colorante imaging (diluito ad una concentrazione finale di 100-200 µM in una soluzione standard pipetta intracellulare descritto in precedenza8) è passivamente (per diffusione) il neurone di riempimento. Consentire il colorante (ad es., Alexa Fluor 488 in canale di verde photomultiplier tube [PMT], PMT 2; o Alexa Fluor 568 o 594 nel canale rosso di PMT, PMT 1) riempire i compartimenti cellulari per almeno 20-30 minuti prima di effettuare esperimenti che richiedono la visualizzazione di qualsiasi compartimenti cellulari di fuori del soma.
Nota: Compartimenti distali (strutture dendritiche, spine, assoni, ecc.) può richiedere 30-40 min per riempire completamente il25. - Utilizzare il software Live Scan funzione per visualizzare il neurone e compartimento subcellulare di interesse. Scegliere parametri di imaging che consentono accurati vivono visualizzazione delle caratteristiche di un neurone. Modificare varie impostazioni per influenzare o alterare la visualizzazione visualizzazione (contrasto), la risoluzione, rapporto di segnale-rumore (S/N) e tempo di acquisizione di immagine frame:
-
Look-up-table (LUT). Aprire la finestra LUT utilizzando l'icona appropriata sul lato di ogni finestra immagine. Una volta aperto, regolare il piano LUT (min) e soffitto (max) impostazione del canale immagine specifica per migliorare la visualizzazione di contrasto segnale mostrato sullo schermo. Abbassare il valore massimo di ~ 1000 (su un totale di 4096, rilevamento di 12 bit), che vi aiuterà a tirare fuori il dimmer segnali durante la prima ricerca di cellule, segnale e struttura.
Nota: Queste impostazioni influenzano solo il segnale visualizzato, non i valori rilevati/registrato. Occhi umani in genere possono solo fare contrasto a livelli di grigio ~ 5026. -
Zoom ottico. Utilizzare software di controllo per selezionare 1 X uso controlli per individuare l'area desiderata nel tessuto di panning e zoom ottico. Questa impostazione di zoom produce la più grande piazza, scansione di campo e invia i più grandi angoli di tensioni/esplorazione, agli specchi galvanometro.
Nota: La configurazione predefinita è per un 12 x 12 mm campo visivo all'interno della testa di scansione che si traduce in 12 mm diviso da ingrandimento dell'obiettivo all'interno del campione. Di conseguenza, un 60 x lente obiettiva rendimenti immagini scansionate di 200 µm per lato a 1 x zoom ottico. Valori più elevati di zoom ottico meno area di scansione. 2 x zoom ottico è spesso l'impostazione più utile per la visualizzazione interi neuroni. 4 x può essere utile per la visualizzazione di aspetti subcellulari dei neuroni. -
Numero di pixel. Per completare 1 x zoom ottico, selezionare 1024 x 1024 pixel per riga utilizzando i controlli del software. Impostare il numero di pixel per riga nell'immagine acquisita e visualizzata a non perdere possibili dettagli dalla lente dell'obiettivo. Utilizzare i seguenti valori di pixel pratico per un x 60 / 1.0 obiettivo apertura numerica (NA): 1024 x 1024 per zoom 1, 512 x 512 per zoom 2 e 256 x 256 per zoom 4. La dimensione in pixel fine (~0.17 µm; 12 mm/ingrandimento/zoom/pixel) dovrebbe essere la metà, o meno, della risoluzione laterale definita dalla lente dell'obiettivo.
Nota: La risoluzione dell'immagine è definita solo la lunghezza d'onda del laser e l'oggettiva NA (0,4 µm risoluzione da due-fotone eccitato [2PE] con 920 nm e un 1.0 obiettivo NA)27. I criteri per l'eccitazione completo NA, come elencato sulla lente, che è l'intensità di2 1/e le corrispondenze di diametro del fascio laser (o "riempie") la pupilla di entrata (2 x tubo lunghezza focale x NA / ingrandimento) della lente dell'obiettivo. L'obiettivo di tubo nel sistema descritto qui ha una lunghezza focale di 180mm. -
Tempo di permanenza del pixel . Utilizzare software di controllo per selezionare 4 µs per il tempo di permanenza di pixel, un valore predefinito utile.
Nota: Modifica il tempo di permanenza di pixel non cambia il segnale medio rilevato; interessa solo la media dei intra-pixel e questi cambiamenti possono essere visualizzati attraverso la qualità dell'immagine tramite il S/N. Il tempo di permanenza del pixel di immagine è sempre un multiplo di 0,4 µs unità e per soffermarmi più volte l'intensità 12-bit limitata valore di ogni pixel dell'immagine è la media dei campioni di 0,4 µs. Poiché il rapporto S/N migliora come la radice quadrata del numero di campioni al tempo di permanenza di pixel (4 µs uguale a dieci campioni, o il 3.16-fold miglioramento in S/N), il miglioramento nella qualità dell'immagine raggiunge rendimenti decrescenti per valori molto più grandi di 12 µs. -
Scansione di rotazione e la regione di interesse (ROI). Impostare l'angolo di immagine a 0° la rotazione utilizzando controlli software (nessuna azione può essere necessaria, come rotazione di 0° è l'impostazione predefinita per la maggior parte dei sistemi di imaging). Se il campione è posto in un orientamento "upside-down", selezionare la rotazione di 180° per "Capovolgere" l'immagine.
Nota: Rotazione dell'immagine, a qualsiasi angolo dato, in grado di fornire una migliore vestibilità per l'intera area di interesse di una cella piena. Rotazione può anche produrre una base più chiara per l'allineamento delle modifiche strutturali e per l'esecuzione di analisi successiva. Selezionando una regione di interesse entro l'immagine acquisita a un impostazione di zoom specificato (passo 3.1.4.2) mantiene il numero di pixel nativa (punto 3.1.4.3), ma la limitazione nel numero totale di pixel e area può aumentare drammaticamente il frame rate, fornendo una migliore risoluzione temporale dei cambiamenti del segnale. -
Averaging a frame. Selezionare un'impostazione media di partenza telaio di 2 fotogrammi utilizzando controlli software.
Nota: Il contrasto dell'immagine finale (S/N) è definito dai fotoni totali raccolto/rilevato all'interno del pixel del segnale dell'immagine. Con una media di più frame di immagine può migliorare il rapporto S/N, purché il campione non si muove o non è sbiancato durante la formazione immagine. Il segnale di interesse rimane lo stesso valore durante averaging frame mentre il rumore nell'immagine è ridotto per la radice quadrata del numero di fotogrammi in media. Piccole strutture in immagini di fluorescenza richiedono spesso una media di Inter-pixel, combinando pixel all'interno l'immagine (spesso chiamato ROIs), e/o frame in media. Cornice media aumenta tempo di scansione per il numero di immagini una sceglie di media.
-
Look-up-table (LUT). Aprire la finestra LUT utilizzando l'icona appropriata sul lato di ogni finestra immagine. Una volta aperto, regolare il piano LUT (min) e soffitto (max) impostazione del canale immagine specifica per migliorare la visualizzazione di contrasto segnale mostrato sullo schermo. Abbassare il valore massimo di ~ 1000 (su un totale di 4096, rilevamento di 12 bit), che vi aiuterà a tirare fuori il dimmer segnali durante la prima ricerca di cellule, segnale e struttura.
- Utilizzare gli strumenti di Controllo Pan, Rotazione Scane Zoom ottico per orientare la posizione del campione durante la scansione. Se la manipolazione di fase motore è necessaria posizionare il campione, evitare dimensioni grande passo per l'asse X, Y e Z per evitare collisioni di obiettivo/condensatore, vibrazioni o l'esposizione del fascio laser di superfici riflettenti.
- Raccogliere uno Z-stack. Utilizzando lo strumento di serie Z , selezionare un inizio e fermare la posizione che contiene la cella di interesse. Selezionare una dimensione di passaggio (1 µm) e quindi immagine consecutivamente il neurone in ogni piano Z che contiene la cella.
Nota: Impostazioni di acquisizione dello stack Z varierà tra tipo di neurone e tintura di riempimento. Parametri ottimali per l'acquisizione di Z-stack dovrebbero essere determinati indipendente dei parametri utilizzati per l'imaging in vivo. Acquisizione dello stack Z può essere eseguita prima o dopo gli esperimenti optopharmacology. Se possibile, effettuare l'acquisizione di Z-stack dopo optopharmacology per evitare qualsiasi danno cellulare indotto da 2PLSM e consentire per il riempimento ottimale della tintura dei piccoli compartimenti cellulari.
4. laser fotolisi durante registrazioni elettrofisiologiche
Nota: L'applicazione di 405 nm o 473 nm laser poteri ≥ 1 mW produce fosforescenza all'interno del vetro delle lenti obiettivo e condensatore. Questa luce generata è direttamente correlata alla potenza di illuminazione del laser; l'emissione è presente in windows spettrale verde e rosso e ha stato eccitato i corsi della vita nella gamma ms. Questo artefatto di stimolazione di sfondo è visto in tutti gli obiettivi testati e in immersione in acqua lenti dell'obiettivo da tutti i principali produttori di lenti dell'obiettivo. Condensatore lenti producono molto fosforescenza superiore rispetto alle lenti obiettivo. Questo "segnale" motiva l'uso di casseforme meccanici per la protezione dei catodi PMT sensibili arseniuro di gallio (GaAsP) il fosfuro durante eventi foto-stimolazione. Utilizzando un otturatore meccanico normalmente chiuso (chiuso quando non attivamente scansione) rappresenta la migliore soluzione per la protezione di raffreddato GaAsP PMT.
- Per un tipo di clessidra fotostimolazione geometria della trave, rimuovere eventuali lenti messa a fuoco nell'ottica percorso di luce che sarebbe altrimenti stretto/restringono il raggio laser, che entra la pupilla di entrata oggettiva.
- Utilizzando MarkPoints, selezionare l'impostazione punto singolo.
Nota: Altre impostazioni di foto-stimolazione (punti multipli, una griglia di punti, scansione a spirale) sono possibili all'interno di MarkPoints. Singolo punto è il più semplice. Obiettivi sperimentali e le differenze biologiche possono richiedere una diversa impostazione. - Aggiornare l'immagine utilizzando l'opzione di Scansione Live per brevemente di immagine e individuare l'area subcellulare di interesse. Aggiornare periodicamente l'immagine per identificare eventuali potenziali piccole derive a fuoco.
- Utilizzare controlli software per aumentare lo zoom ottico (cioè, selezionare un'impostazione di zoom ottico superiore di quello attuale), se necessario, per visualizzare le piccole strutture (cioè, spine o dendriti distale).
- Posto MarkPoints singolo spot mirino immediatamente adiacente (~0.5 μm) alla membrana cellulare. Non posto la foto-stimolazione posto direttamente su una funzione cellulare, come questo potrebbe portare a photodamage.
- Impostare i parametri per foto-stimolazione utilizzando controlli software in MarkPoints. Applicare le indicazioni di partenza come segue: 1-50 ms di durata, 1-4 mW di potenza laser e prova ≥ 1.
- Selezionare MarkPoints eseguire per avviare il protocollo di MarkPoints e osservare elettrofisiologia acquisizione dati in tempo reale.
- Ripetere i passaggi da 4.2-4.7 diverse volte per valutare la consistenza e la stabilità, o la mancanza della stessa, dell'ampiezza della risposta e cinetica.
Risultati
Per fotolisi stimolazione, la dose di esposizione (intensità e tempo), posizione di esposizione e geometria della trave sono variabili chiave. Il sistema descritto in questo articolo è capace di due fasci diversi fotostimolazione, regolabile tramite lo spostamento di una lente in e out della fotostimolazione luce percorso prima il fascio entra nel sistema di galvanometro. Senza questo obiettivo, il fascio di fotostimolazione riempie la pupilla di entrata della x 60 / 1,0 NA acqua-immersione [60 x WD] obiettivo, producendo una vicino-diffrazione limitata, sub-µm posto al piano focale all'interno del campione. Questo è associato con fotostimolazione luce con una forma a clessidra, che si estende sopra e sotto la macchia focale simmetrica con l'asse ottico. Con la lente inserita nel percorso, luce laser fotostimolazione è focalizzata nella pupilla di entrata della lente dell'obiettivo e poi esce come un fascio di matita-come. Questa trave, che dovrebbe essere di circa 10 µm di diametro per un obiettivo 60 x, si estende uniformemente/verticalmente in tutto il campione. In questa modalità, l'intensità della luce in qualsiasi luogo all'interno lo spot di stimolazione sarà ~ 1% dell'intensità spot piccolo vicino-diffrazione limitata. Quindi, potenze laser superiori sono in genere richiesti quando si utilizza ~ 10 µm stimolazione punto. Per tutti gli esperimenti riportati in questo articolo, è stato usato un fascio di fotostimolazione clessidra-tipo.
La potenza di campione trasportato può essere tracciata contro l'impostazione di tensione in ingresso, dopo aver misurato la potenza del laser al campione utilizzando un misuratore di potenza. Questi studi utilizzano un 60 x diametro obiettivo WD con una distanza di 2 mm, ma non è sommerso in acqua per misure di potenza evitare potenziali danni all'elemento rivelatore. Quando gli obiettivi con elencati NA > 0.95 sono misurati in aria (senza liquido di immersione), possono esserci perdite di riflessione interna totale presso l'elemento frontale dell'obiettivo a causa dell'indice inferiore (aria). In questo caso, per una più accurata misura di potenza di campione (per correggere le perdite di riflessione interna totale), aumentare la potenza misurata da 1,0 NA oggettivi (1.0/0,95)2 misurata nell'aria. Figura 1a Mostra un tipico grafico di ingresso/uscita per 405 nm e laser visibile di 473 nm che sono incorporati nel laser lanciare il sistema in questo studio. Questi sistemi laser sono ideali per controllo di dose di esposizione foto-stimolazione per i seguenti motivi: (1) sono pre-tarati per fornire output di potenza direttamente lineare alla tensione in ingresso (0-5 V), (2) sono dotate di un'operazione di scatto silenzioso (con nessun laser in uscita), e (3) hanno rapida, controllo di sub-ms intensità impulso durata (risposta di 0,1 ms). Quando si utilizza foto-stimolazione punto con un sistema laser/galvo, calibrazione di routine di MarkPoints spot è un compito essenziale. Figura 1b (pannello di sinistra) di seguito viene illustrato un sistema che è fuori taratura (punto desiderato per stimolare la foto non provocare accurata stimolazione di quel punto, come indicato dalla posizione del burn-foro), con un ritorno a un posizionamento accurato dello spot dopo la calibrazione ( Figura 1b, pannello di destra).
PA-Nic è modestamente fluorescente (picco di emissione a ~ 510 nm), che esibiscono efficace eccitazione tra 350-450 nm (1-fotone eccitazione) o 700-900 nm (2-fotone eccitazione)5. Per visualizzare PA-Nic durante l'applicazione locale, PA-Nic (1 mM) è stato applicato nei pressi di tessuto cerebrale, seguito da formazione immagine simultanea del contesto di trasmissione ottica sezionato del tessuto (1) cervello via Dodt contrasto e (2) la fluorescenza emessa dall'eccitazione (900 nm) di PA PA-Nic-Nic 2PE fluorescenza era facilmente rilevabile durante l'espulsione di pressione da una pipetta di applicazione locale (Figura 2a). Nicotina e un monoalkylcoumarin, 7-carboxymethylamino-4-metil cumarina, sono i principali prodotti fotochimici del PA-Nic fotolisi reazione5. Utilizzando le stesse impostazioni/parametri che sono stati utilizzati per PA-Nic imaging di imaging, il tessuto era imaged durante la consegna di nicotina (1 mM) o 7-carboxymethylamino-4-metil cumarina (1 mM). È stato rilevato alcun segnale fluorescente (Figura 2a, pannelli di medio e Bassi), dimostrando la specificità dei risultati PA-Nic. Infine, PA-Nic è stato applicato all'interno del tessuto cerebrale e l'emissione di fluorescenza PA-Nic era imaged (Figura 2b). Questo approccio conferma che PA-Nic è presente all'interno di 100-200 µm della pipetta applicazione locale. Insieme, questi dati confermano che la PA-Nic efficacemente sia consegnato al cervello del tessuto tramite applicazione locale.
Registrazioni di elettrofisiologia con simultanea 2PLSM per la visualizzazione di strutture cellulari richiede al ricercatore di considerazioni di equilibrio per entrambe le componenti dell'esperimento, e spesso è disponibile per una finestra di tempo stretto (~ 20 min) valido acquisizione di dati di esempio da una cella con patch. Senza considerare la visualizzazione cellulare, è consigliabile iniziare la registrazione appena possibile dopo il rodaggio perché registrazione stabilità tende a diminuire con il tempo. Tuttavia, quando la formazione immagine è un requisito, elettrofisiologici considerazioni devono consentire tempo sufficiente per l'aumento di concentrazione di fluorescenza in strutture di piccole/remoto. Questo è esemplificato esaminando una concentrazione di tintura riempimento curva28, che a volte è utile per derivare quando un nuovo tipo di cella di imaging. La figura 3 Mostra diversi neuroni esempio imaged come Z-stack tramite 2PLSM e crollato in una proiezione di massima intensità per scopi di presentazione. Figura 3a Mostra le immagini di alta qualità dove morfologia neuronale sembra essere completo, è ridotto al minimo rumore e detriti non interferiscano con l'interpretazione della morfologia cellulare. Figura 3b Mostra le immagini di qualità inferiore, a causa di un rapporto di segnale--fondo inferiore e detriti sostanziali. Questo detriti compare spesso come tasche sferiche della fluorescenza intensa, derivanti da espulsione di imaging colorante dalla pipetta patch mentre si avvicina la cella. In particolare, l'inclusione di 100 µM PA-Nic nel bagno (durante l'esecuzione dell'applicazione bagno) tende a ridurre il rapporto segnale--fondo e conduce al contrasto dell'immagine ottimale. Alexa Fluor 568 o 594 è spesso molto utile negli esperimenti di applicazione locale come un colorante finder o come un segnale di riferimento/normalizzazione 2PE normalizzante. Un'efficace lunghezza d'onda per l'eccitazione del due-fotone di questi coloranti è ~ 780 nm27, che consente la visualizzazione simultanea dei PA-Nic e identificazione dei compartimenti cellulari. Questa lunghezza d'onda, tuttavia, non completamente evitare fotolisi del due-fotone di PA-Nic5. Alexa Fluor 488 è vantaggioso negli esperimenti di bagno-applicazione del PA-Nic; Quando sono eccitati con un nm di lunghezza d'onda adatta ≥900, fotolisi del due-fotone di PA-Nic5 possono essere evitato mantenendo comunque adatto visualizzazione dei compartimenti cellulari.
La figura 4 Mostra i dati di esempio per localizzata PA-Nic laser fotolisi a neuroni MHb nelle fette del cervello. Figura 4a (pannelli superiori) viene illustrato un esempio di un'immagine di "riferimento", che è un bloccaggio di schermo dell'ultima immagine 2PLSM preso prima il protocollo MarkPoints è stato eseguito, sovrapposti con la posizione del punto di foto-stimolazione. Figura 4a (pannelli di immagine in basso) Mostra una vista ingrandita della foto-stimolazione spot sovrapposta la morfologia cellulare. La risposta elettrofisiologica correlati nel tempo corrispondente a PA-Nic fotolisi è mostrata nei pannelli inferiori di Figura 4a. Lavoro precedente ha dimostrato che queste correnti sono sensibili a nAChR antagonisti5. Figura 4b Mostra dati rappresentativi da diverse cellule dove singolo spot fotolisi è stata eseguita ad intervalli di 1 s o 10 s. considerando che un intervallo di 10 s consentito sufficiente tempo di recupero per la linea di base corrente di tenuta, un intervallo più breve 1 s ha condotto ad un aumento graduale nell'azienda corrente come il protocollo procedeva. L'aumento attuale suggerisce che la nicotina non aveva abbastanza tempo per diffondersi lontano dal sistema con l' intervallo di 1 Hz29. Tale risposta temporale di analisi devono essere eseguita de novo su qualsiasi nuovo tipo di cella in fase di studio, come la Neurofarmacologia di nAChR può differire tra tipi cellulari.
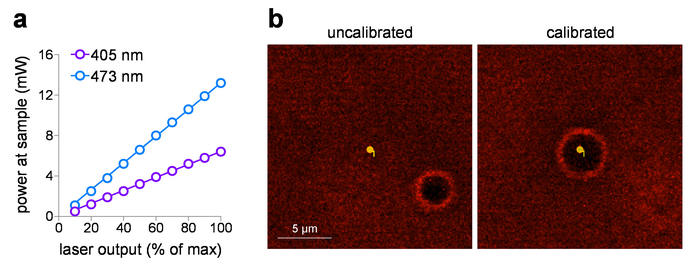
Figura 1: Calibrazione laser fotostimolazione. (una) foto-stimolazione laser potenza di uscita. Potenza piano di campione (attraverso un x 60 / 1.0 obiettivo di immersione in acqua di NA) è stato misurato per 405 nm e 473 nm foto-stimolazione laser presso l'impostazione di output indicato. (b) Calibrazione laser foto-stimolazione. Schermo cattura immagini mostrano la relazione spaziale tra il luogo di destinazione foto-stimolazione e la corrispondente posizione dove foto-stimolazione si è verificato (burn-hole) prima (a sinistra) e dopo (a destra) in esecuzione calibrazione in MarkPoints. Clicca qui per visualizzare una versione più grande di questa figura.
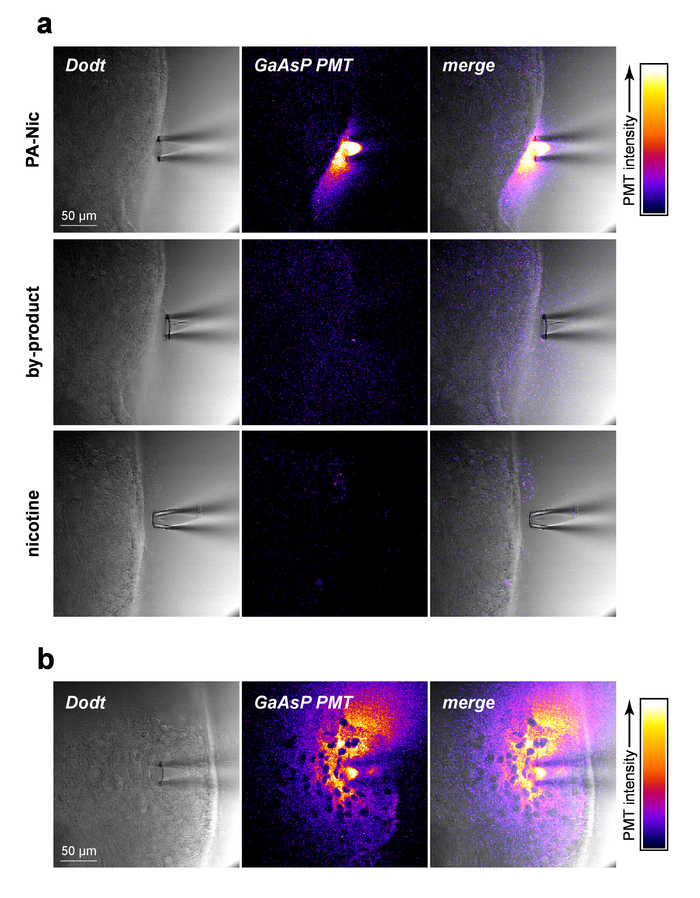
Figura 2: PA-Nic locale applicazione. (a) rilevazione del PA-Nic da un locale applicazione pipetta. 1 mM PA-Nic, sottoprodotto di fotolisi o nicotina sono stati disciolti in ACSF, caricati in una pipetta di applicazione locale ed erogata sul tessuto cerebrale durante 2PLSM (eccitazione 900 nm) imaging utilizzando le stesse impostazioni di formazione immagine per ogni farmaco. Scansione immagine Dodt contrasto trasmissione laser Mostra il tessuto/pipetta mentre un catodo GaAsP PMT è stato usato per catturare l'emissione di fluorescenza. (b), PA-Nic (1 mM) è stato irrorato nel tessuto cerebrale ed imaged tramite 2PLSM come (un) per mostrare la diffusione laterale di PA-Nic usando la fluorescenza intrinseca. Clicca qui per visualizzare una versione più grande di questa figura.
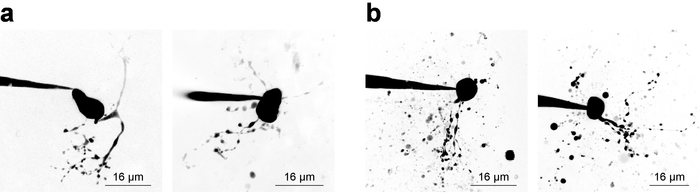
Figura 3: acquisizione di immagini di microscopia a scansione laser di 2 fotoni. (un) ottimale 2PLSM Z-stack. Due esempi di proiezioni di intensità massima dello stack Z 2PLSM sono mostrato per i neuroni di MHb con dendriti ben risolti e poco o nessun detriti d'interferenza. (b) sub-ottimale 2PLSM Z-stack. Due esempi di proiezioni di intensità massima dello stack Z 2PLSM sono indicati per i neuroni di MHb circondati da detriti (tintura espulso dalla pipetta durante l'approccio delle cellule). Tali immagini sono più difficili da interpretare rispetto alle immagini come quelli mostrati in (un). Clicca qui per visualizzare una versione più grande di questa figura.
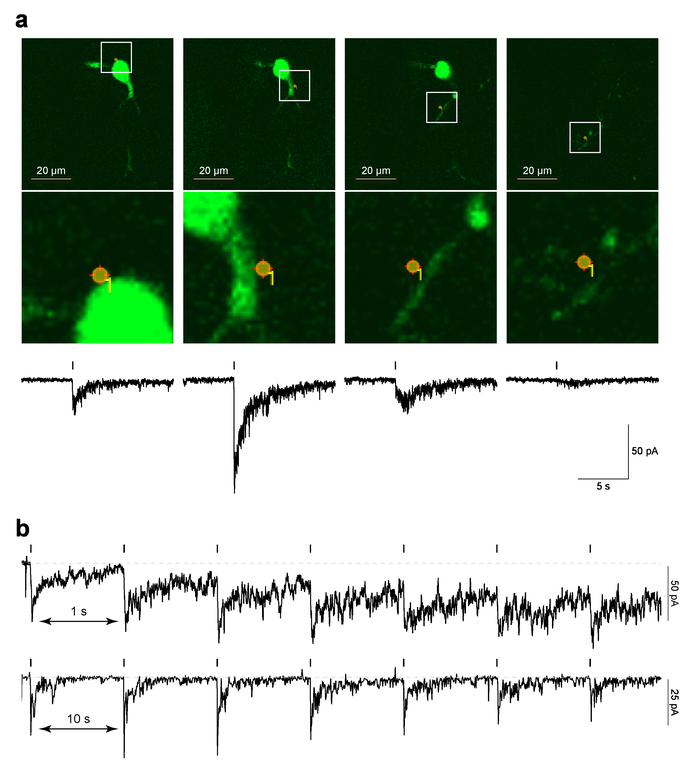
Figura 4: Laser fotolisi di PA-NIC (un) MarkPoints riferimento immagini e correnti interne evocate da PA-Nic fotolisi. Per un neurone di MHb, immagini raw riferimento sono indicati per le prove di foto-stimolazione MarkPoints in un'unica sede cellulare (indicata). Si noti che per alcune località di foto-stimolazione (l'immagine più a destra in questa serie), la struttura dendritica è a fuoco ma il soma e dendrite prossimale non sono. Sotto ogni immagine di riferimento, viene tracciata la corrente entrante nicotina uncaging-evocati. (b) Inter-stimolo intervalli per fotolisi PA-Nic. Registrazioni di esemplare sono indicate per MHb neuroni dove nicotina era ripetutamente uncaged nella stessa posizione di perisomatic con un intervallo di Inter-stimolo di 1 s o 10 s. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La scelta del metodo di applicazione/consegna PA-Nic è il punto più critico in questa tecnica di foto-stimolazione localizzata. I due metodi, applicazione vasca e perfusione locale, ciascuno offrono diversi vantaggi e limitazioni. La scelta è in gran parte influenzata dal livello di espressione funzionale di nAChR nel tipo di cella di interesse. Spesso è preferibile utilizzare bagno applicazione quando i livelli di espressione funzionale sono alti, come vasca applicazione permette una concentrazione uniforme sonda che circonda la cella registrata, facilitando l'interpretazione dei dati. Applicazione di vasca elimina anche la necessità di una seconda pipetta di aspersione nel tessuto, rendendo l'intero processo più facile. Tuttavia, applicazione vasca dei costosi composti costi ulteriori per esperimento.
Risoluzione dei problemi coinvolge comunemente, cercando di capire perché nessuna attivazione dei nAChR è visto fotolisi seguente. Quando si lavora con un tipo di cellula che precedentemente non è stato studiato con PA-Nic, l'investigatore deve eseguire puff-applicazione locale di ACh o nicotina per determinare se sufficienti recettori sono funzionalmente espresso5. Per convalidare che il sistema è in grado di rilevare le risposte fotolisi, esperimenti di controllo dovrebbe essere fatto in neuroni habenula mediale che esprimono grandi quantità di recettori30. In questa zona del cervello, PA-Nic vasca applicazione è possibile, che è preferibile per esperimenti di convalida. Solo dopo aver eseguito questi esperimenti di convalida dovrebbe uno spostare un tipo di cella. Se il sistema sperimentale è stato convalidato e le risposte rimangono molto piccoli o non rilevabili, esso può essere giustificata per aumentare la concentrazione di PA-Nic, aumentare l'intensità del flash o la durata dell'impulso, aggiungere un modulatore allosterico positivo di nAChR ad usufruire dei nAChR attività6, o una combinazione di questi.
Occasionalmente, uncaging risposte sono troppo grandi, con attivazione dei nAChR significativo conseguente indiretto tensione gated Na+ canale attivazione e sbloccaggio correnti interne a causa di morsetto povero spazio. Questi manufatti, che completamente oscurano correnti interne dei nAChR e rendono impossibile la interpretazione dei dati, possono essere eliminati con l'inclusione di QX-314 (2 mM) nella pipetta di registrazione. Essi possono anche essere eliminati riducendo la concentrazione di PA-Nic o riducendo l'intensità del flash o la durata dell'impulso. In tutti gli esperimenti di foto-stimolazione luminosa visibile, si deve prestare attenzione quando si seleziona siti di stimolazione per evitare indesiderate stimolazione/fotolisi sopra o sotto il piano focale desiderato. Inoltre e quando applicabile, la potenza del laser deve essere titolata sempre per riprodurre risposte fisiologiche. È particolarmente importante essere consapevoli di fotostimolazione asse z quando si lavora con ligandi in gabbia, come ligandi che vengono attivate sopra/sotto la macchia focale possono ancora diffusa e interagire con il sistema biologico (cioè recettori, ) in fase di studio.
PA-Nic laser fotolisi potrebbe non essere appropriato per tutti gli investigatori, come esistono diverse limitazioni. Il primo è il costo relativamente elevato di un allestimento adatto. Quando si lavora con le fette di cervello intatto, uncaging vicino a strutture di piccolo diametro come dendriti richiede un sistema di visualizzazione sofisticata come un microscopio 2-fotone. A parte il costo elevato di una ti, tunable laser pulsato IR per microscopia 2-fotone performante, un sistema dual-galvanometro capace di indipendentemente due fasci laser di posizionamento ulteriormente aumenta il costo del sistema. Costo totale del sistema può essere ridotto utilizzando un sistema casa costruita se il ricercatore ha sufficiente competenza e tempo per costruire, risolvere i problemi e mantenere un tale sistema. Una seconda limitazione spesso comporta dei nAChR bassa espressione funzionale, che può essere parzialmente mitigato adottando misure come accennato in precedenza, ma questo non può garantire il successo. In genere, se uno non può misurare correnti ligando-attivati seguendo puff-applicazione di agonisti, PA-Nic fotolisi sotto morsetto di tensione non può produrre risultati accettabili. Un terzo limite comporta l'intrinseca fluorescenza del PA-NIC PA-Nic assorbe la luce di ~ 405 nm ed emette in una gamma simile come proteina fluorescente verde (GFP) o Alexa 4885. Quando le concentrazioni di PA-Nic superano ~ 1 mM, questa proprietà di fluorescenza può rendere difficile da visualizzare contemporaneamente strutture neuronali. Per ovviare a questo inconveniente, è fondamentale essere in grado di controllare facilmente il flusso di PA-Nic dalla pipetta aspersione. Periodicamente, il flusso di PA-Nic è stata interrotta per consentire molecole fluorescenti diffondere la distanza. Questo permesso di re-imaging del neurone per controllare la posizione spot del fascio uncaging. Una limitazione potenziale quarta parlare implica l'uso di 405 nm luce per fotolisi. Lunghezze d'onda più corta come 405 nm sono più inclini a dispersione nel complesso tessuto come una fetta di cervello. Così, a una determinata intensità del flash e durata, uncaging risposta ampiezze e cinetica di decadimento possono differenzialmente risentire la profondità del fuoco uncaging all'interno della slice. Conclusioni sugli aspetti biologici di nAChR dovrebbero tener conto questo avvertimento importante.
Questa tecnica di fotolisi localizzata laser è stata utilizzata recentemente per scoprire nuovi dettagli sulla neurobiologia dei nAChR. Ad esempio, esposizione cronica alla nicotina migliora la perisomatic e la funzione dei nAChR dendritiche in habenula mediale neuroni5. È stato utilizzato anche per aiutare a dimostrare, per la prima volta, che area tegmentale ventrale del glutammato neuroni esprimono recettori nicotinici funzionale nel loro perisomatic e compartimenti cellulari dendritiche6. Ci sono che molti potenziali futuri usi di questa tecnica, e l'approccio potrebbe essere applicato ad altri tipi di neurone chiave che sono noti per i nAChR espresso, quali neuroni piramidali corticali31 o interneuroni in corteccia cerebrale32, striato33 e ippocampo19. Questa tecnica potrebbe anche essere combinata con gene farmacologia e/o dei nAChR34 per localizzare i sottotipi recettoriali specifici per diversi compartimenti neuronali di editing. L'approccio può essere facilmente adattato ad altri composti di cumarina-messo in gabbia, tra cui, ma non limitati a, quelle sviluppate in parallelo con PA-Nic5. Infine, PA-Nic fotolisi un giorno potrebbe essere utilizzato in un animale sveglio/comportarsi per studiare l'azione di nicotina in paradigmi di romanzo farmacologia comportamentale.
Divulgazioni
D.L.W. funge da consulente pagato per Bruker Nano microscopia di fluorescenza.
Riconoscimenti
Gli autori ringraziano i membri di laboratorio dei seguenti ricercatori principali nord-occidentale: Ryan Drenan, D. James Surmeier, Yevgenia Kozorovitskiy e Anis appaltatore. Quest'opera era supportata da il noi National Institutes of Health (NIH) (sovvenzioni DA035942 e DA040626 a R.M.D.), PhRMA Foundation (fellowship per M.C.A) e HHMI.
Materiali
| Name | Company | Catalog Number | Comments |
| Instruments, Consumables, and Miscellaneous Chemicals | |||
| Multiclamp 700B | Molecular Devices Corp. | Patch clamp amplifier | |
| Pneumatic Picopump | World Precision Instruments | PV820 | |
| Micropipette puller | Sutter Instrument Co | P-97 | |
| Temperature Controller | Warner Instruments | TC-324C | |
| Vibrating blade microtome | Leica Biosystems | VT1200S | |
| Ultrafree-MC Centrifugal Filter | MilliporeSigma | UFC30GV0S | internal solution filter |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B150F-4 | patch and local application pipette |
| (-)-Nicotine hydrogen tartrate salt | Glentham | GL9693 | nicotine salt |
| 7-carboxymethylamino-4-methyl coumarin | Janelia Research Campus | PA-Nic by-product | |
| 1-[7-[bis(carboxymethyl)- amino]coumarin-4-yl]methyl-nicotine | Janelia Research Campus | PA-Nic | |
| Euthasol (Pentobarbital Sodium and Phenytoin Sodium) | Virbac | ANADA #200-071 | |
| Alexa FluorTM 488 Hydrazide | ThermoFisher | A10436 | green fill dye |
| Alexa FluorTM 568 Hydrazide | ThermoFisher | A10437 | red fill dye |
| 6-carboxy-AF594 (Alexa Fluor 594) | Janelia Research Campus | red fill dye | |
| QX 314 chloride | Tocris | 2313 | voltage-gated sodium channel blocker |
| Power Meter | ThorLabs | S120C | |
| Name | Company | Catalog Number | Comments |
| Chemicals for Solutions | |||
| N-Methyl-D-glucamine | Sigma | M2004 | |
| Potassium chloride | Sigma | P3911 | |
| Sodium phosphate monobasic monohydrate | Sigma | S9638 | |
| Sodium bicarbonate | Sigma | S6014 | |
| HEPES | Sigma | H3375 | |
| D-(+)-Glucose | Sigma | G5767 | |
| (+)-Sodium L-ascorbate | Sigma | A4034 | |
| Thiourea | Sigma | T8656 | |
| Sodium pyruvate | Sigma | P2256 | |
| Magnesium sulfate heptahydrate | Sigma | 230391 | |
| Calcium chloride dihydrate | Sigma | 223506 | |
| Sodium chloride | Sigma | S9625 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma | E3889 | |
| Adenosine 5′-triphosphate magnesium salt | Sigma | A9187 | |
| Guanosine 5′-triphosphate sodium salt hydrate | Sigma | G8877 | |
| Name | Company | Catalog Number | Comments |
| Components of 2-Photon Microscope | |||
| Ultima Laser Scanner for Olympus BX51 Microscope | Bruker Nano, Inc. | imaging software and galvos | |
| Imaging X-Y galvanometers | Cambridge Technology | ||
| Mai Tai HP1040 | Spectra-Physics | Tuneable IR laser | |
| Pockels cell M350-80-02-BK with M302RM Driver | Conoptics, Inc. | for IR laser attenuation | |
| Integrating Sphere Photodiode Power Sensor | Thorlabs, Inc | laser power pick-off photodiode | |
| Uncaging X-Y galvanometers | Cambridge Technology | ||
| Helios 2-Line Laser Launch | Bruker Nano, Inc. | uncaging laser components | |
| OBIS LX/LS 405 nm (100 mW) | Coherent, Inc. | ||
| OBIS LX/LS 473 nm (75 mW) | Coherent, Inc. | ||
| Point-Photoactivation / Fiber Input Module for Limo Sidecar - Uncaging | Bruker Nano, Inc. | ||
| Name | Company | Catalog Number | Comments |
| Upright Microscope | Olympus | BX51WIF | Upright microscope chasis |
| Objective: Olympus M Plan FL 10x; NA 0.3 WD 11 mm | Olympus | 10x objective | |
| Objective: Olympus M Plan Fluorite 60x/1.0 WD=2mm NIR | Olympus | 60x water-dipping objective | |
| X-Cite 110, four-LED LLG coupled epi-fluorescence light source | Excelitas Technologies | LED Light Source | |
| Epi-Fluorescence Filter: ET-GFP (FITC/CY2) for Epi-Turret | Chroma Technologies | LED Filter for blue light excitation | |
| Epi-Fluorescence Filter: ET-DsRed (TRITC/CY3) for Epi-Turret | Chroma Technologies | LED Filter for green light excitation | |
| B&W CCD camera; Watec, 0.5in B/W CCD | Watec Co., LTD. | CCD camera for patch clamp recording | |
| Name | Company | Catalog Number | Comments |
| External Detectors - Dual Reflected Emission - Olympus Upright (Multi-Alkali, GaAsP) | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | red channel PMT |
| 595/50m | Chroma Technologies | red channel emission filter | |
| 565lpxr | Chroma Technologies | dichroic beam splitter | |
| GaAsP end-on PMT | Hamamatsu | 7422PA-40 | green channel PMT |
| 525/70m | Chroma Technologies | green channel emission filter | |
| High-Speed Shutter for Hamamatsu H7422 PMT | Vincent Associates / Bruker | 517329 | PMT shutter mount |
| Name | Company | Catalog Number | Comments |
| Dodt Gradient Contrast Transmission Detection Module | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | Dodt PMT |
Riferimenti
- Zhang, C., et al. Cholinergic tone in ventral tegmental area: Functional organization and behavioral implications. Neurochemistry International. 114, 127-133 (2018).
- Sarter, M., Parikh, V., Howe, W. M. Phasic acetylcholine release and the volume transmission hypothesis: time to move on. Nature Reviews Neuroscience. 10 (5), 383-390 (2009).
- Coyle, J. T., Price, D. L., DeLong, M. R. Alzheimer's disease: a disorder of cortical cholinergic innervation. Science. 219 (4589), 1184-1190 (1983).
- Katz, B., Thesleff, S. A study of the desensitization produced by acetylcholine at the motor end-plate. Journal of Physiology. 138 (1), 63-80 (1957).
- Banala, S., et al. Photoactivatable drugs for nicotinic optopharmacology. Nature Methods. 15 (5), 347-350 (2018).
- Yan, Y., et al. Nicotinic Cholinergic Receptors in VTA Glutamate Neurons Modulate Excitatory Transmission. Cell Reports. 23 (8), 2236-2244 (2018).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. α4α6β2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Molecular Pharmacology. 84 (3), 393-406 (2013).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. Journal of Visualized Experiments. (68), (2012).
- Ren, J., et al. Habenula "cholinergic" neurons co-release glutamate and acetylcholine and activate postsynaptic neurons via distinct transmission modes. Neuron. 69 (3), 445-452 (2011).
- Koppensteiner, P., Melani, R., Ninan, I. A Cooperative Mechanism Involving Ca(2+)-Permeable AMPA Receptors and Retrograde Activation of GABAB Receptors in Interpeduncular Nucleus Plasticity. Cell Reports. 20 (5), 1111-1122 (2017).
- Zhang, J., et al. Presynaptic Excitation via GABAB Receptors in Habenula Cholinergic Neurons Regulates Fear Memory Expression. Cell. 166 (3), 716-728 (2016).
- Chen, E., et al. Altered Baseline and Nicotine-Mediated Behavioral and Cholinergic Profiles in ChAT-Cre Mouse Lines. The Journal of Neuroscience. 38 (9), 2177-2188 (2018).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter increased acetylcholine release in the hippocampus. Neuroscience. 218, 1-11 (2012).
- Ting, J. T., Feng, G. Recombineering strategies for developing next generation BAC transgenic tools for optogenetics and beyond. Frontiers in Behavioral Neuroscience. 8, 111 (2014).
- Crittenden, J. R., Lacey, C. J., Lee, T., Bowden, H. A., Graybiel, A. M. Severe drug-induced repetitive behaviors and striatal overexpression of VAChT in ChAT-ChR2-EYFP BAC transgenic mice. Frontiers in Neural Circuits. 8, 57 (2014).
- Kolisnyk, B., et al. ChAT-ChR2-EYFP mice have enhanced motor endurance but show deficits in attention and several additional cognitive domains. The Journal of Neuroscience. 33 (25), 10427-10438 (2013).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter enhances dendritic complexity of adult-born hippocampal neurons and improves acquisition of spatial memory during aging. Neurobiology of Aging. 36 (5), 1881-1889 (2015).
- Denk, W. Two-photon scanning photochemical microscopy: mapping ligand-gated ion channel distributions. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6629-6633 (1994).
- Khiroug, L., Giniatullin, R., Klein, R. C., Fayuk, D., Yakel, J. L. Functional mapping and Ca2+ regulation of nicotinic acetylcholine receptor channels in rat hippocampal CA1 neurons. The Journal of Neuroscience. 23 (27), 9024-9031 (2003).
- Filevich, O., Salierno, M., Etchenique, R. A caged nicotine with nanosecond range kinetics and visible light sensitivity. Journal of Inorganic Biochemistry. 104 (12), 1248-1251 (2010).
- Tochitsky, I., et al. Optochemical control of genetically engineered neuronal nicotinic acetylcholine receptors. Nature Chemistry. 4 (2), 105-111 (2012).
- Wokosin, D. L., Squirrell, J. M., Eliceiri, K. W., White, J. G. Optical workstation with concurrent, independent multiphoton imaging and experimental laser microbeam capabilities. Review of Scientific Instruments. 74 (1), 193-201 (2003).
- Plotkin, J. L., Day, M., Surmeier, D. J. Synaptically driven state transitions in distal dendrites of striatal spiny neurons. Nature Neuroscience. 14 (7), 881-888 (2011).
- Galtieri, D. J., Estep, C. M., Wokosin, D. L., Traynelis, S., Surmeier, D. J. Pedunculopontine glutamatergic neurons control spike patterning in substantia nigra dopaminergic neurons. Elife. 6, (2017).
- Yasuda, R., et al. Imaging calcium concentration dynamics in small neuronal compartments. Science STKE. (219), pl5 (2004).
- Inoue, S., Spring, K. . Video microscopy: The fundamentals. , 163-186 (1997).
- Zipfel, W. R., Williams, R. M., Webb, W. W. Nonlinear magic: multiphoton microscopy in the biosciences. Nature Biotechnology. 21 (11), 1369-1377 (2003).
- Maravall, M., Mainen, Z. F., Sabatini, B. L., Svoboda, K. Estimating intracellular calcium concentrations and buffering without wavelength ratioing. Biophysical Journal. 78 (5), 2655-2667 (2000).
- Wathey, J. C., Nass, M. M., Lester, H. A. Numerical reconstruction of the quantal event at nicotinic synapses. Biophysical Journal. 27 (1), 145-164 (1979).
- Shih, P. Y., et al. Differential expression and function of nicotinic acetylcholine receptors in subdivisions of medial habenula. The Journal of Neuroscience. 34 (29), 9789-9802 (2014).
- Verhoog, M. B., et al. Layer-specific cholinergic control of human and mouse cortical synaptic plasticity. Nature Communications. 7, 12826 (2016).
- Koukouli, F., et al. Nicotine reverses hypofrontality in animal models of addiction and schizophrenia. Nature Medicine. 23 (3), 347-354 (2017).
- Xiao, C., et al. Chronic nicotine selectively enhances α4β2* nicotinic acetylcholine receptors in the nigrostriatal dopamine pathway. The Journal of Neuroscience. 29 (40), 12428-12439 (2009).
- Peng, C., et al. Gene Editing Vectors for Studying Nicotinic Acetylcholine Receptors in Cholinergic Transmission. European Journal of Neuroscience. , (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon