Method Article
Sondieren Nikotinsäure Acetylcholin-Rezeptor-Funktion in Maus Gehirnscheiben per Laser Flash Photolyse von Photoactivatable Nikotin
In diesem Artikel
Zusammenfassung
Dieser Artikel stellt eine Methode zur Untersuchung von Nikotinsäure Acetylcholin-Rezeptoren (nAChRs) in Maus Hirnschnitten von Nikotin uncaging. Wenn gepaart mit gleichzeitiger Patch Clamp Aufnahme und 2-Photonen-Laser-scanning-Mikroskopie, verbindet Nikotin uncaging Nikotinsäure Rezeptor-Funktion mit zellulären Morphologie, bietet ein tieferes Verständnis der cholinergen Neurobiologie.
Zusammenfassung
Acetylcholin (ACh) wirkt durch Rezeptoren eine Vielzahl von neuronalen Prozessen zu modulieren, aber es ist eine Herausforderung gewesen, um ACh-Rezeptor-Funktion mit subzelluläre Lage innerhalb der Zellen zu verknüpfen, wo diese Funktion durchgeführt wird. Um die subzelluläre Lage von Nikotinsäure ACh-Rezeptoren (nAChRs) im nativen Hirngewebe zu untersuchen, wurde eine optische Methode für die genaue Version von Nikotin an diskreten stellen in der Nähe von neuronalen Membranen bei elektrophysiologische Aufnahmen entwickelt. Patch eingespannten Neuronen im Gehirn, die Scheiben mit gefüllt sind färben ihre Morphologie während 2-Photonen-Laser-scanning-Mikroskopie zu visualisieren und Nikotin uncaging mit einem hellen Blitz durch die Konzentration einer 405 nm-Laser-Strahl in der Nähe von einem oder mehreren Zellmembranen ausgeführt. Zelluläre aktuelle Umlenkungen werden gemessen, und eine hochauflösende dreidimensionale (3D) Darstellung der aufgezeichneten Neuron erfolgt um Versöhnung der nAChR Antworten mit zellulären Morphologie zu ermöglichen. Diese Methode ermöglicht detaillierte Analyse der nAChR funktionale Verteilung in komplexen Gewebe Vorbereitungen, verspricht, das Verständnis der cholinerge Neurotransmission zu verbessern.
Einleitung
Cholinerge Signal moduliert zahlreiche Vorgänge im Gehirn, einschließlich Aufmerksamkeitskontrolle, willentlichen Bewegung und Belohnung1,2. Medikamente, die Acetylcholin (ACh) Übertragung zu verbessern sind zur Behandlung von kognitiven Beeinträchtigung, die Alzheimer-Krankheit, was bedeutet eine wichtige Rolle für die cholinerge Systeme in Wahrnehmung3zugeordnet. Ein verbessertes Verständnis von cholinergen Rezeptoren und Schaltungen in gesunden und Kranken Staaten könnten bessere therapeutische Ansätze für verschiedene neurologische Krankheiten/Störungen.
Nicotinsäure ACh-Rezeptoren (nAChRs) sind eine Familie der Liganden-gated Ionenkanäle, die kationen auf endogene ACh oder exogene Nikotin von Tabakerzeugnissen flux. Angesichts der Tatsache, dass sie zu den allerersten Neurotransmitter-Rezeptoren beschrieben4gehörten, ist nAChR Pharmakologie und Lage in Muskelfasern für Muskel-Typ Rezeptoren gut verstanden. Im Gegensatz dazu, ist über die Pharmakologie und subzelluläre Verteilung von native nAChRs im Gehirn vergleichsweise wenig bekannt. Diese Wissenslücke wurde vor kurzem durch eine neuartige chemische Sonde, die räumlich beschränkt und schnelle Aktivierung der nAChRs im Gehirngewebe während zelluläre Bildgebung und elektrophysiologische Aufnahme5ermöglicht die Entwicklung behoben. Hier werden die wichtigsten methodischen Schritte beteiligt in diesem Ansatz beschrieben, mit dem übergeordneten Ziel der Verbesserung der Fähigkeit, nAChR Funktion mit neuronalen Struktur zu verbinden.
Photoactivatable Nikotin (PA-Nic; chemische Bezeichnung: 1-[7-[bis(carboxymethyl)-amino] Cumarin-4-Yl] Methyl-Nikotin) können Photolyzed mit ~ 405 nm Laserblitze effizient Nikotin5,6veröffentlichen werden. Vor uncaging, PA-Nic ist in Lösung stabil und weist keine unerwünschten pharmakologischen oder photochemische Funktionen5. Nach Photolyse freigesetzte Nikotin aktiviert wie vorauszusehen war nAChRs und die uncaging Nebenprodukte sind pharmakologisch inert5. Ein Dauerstrich-Laser dient als die Photolyse Lichtquelle mit einer Leistung > 1 mW an der Probe gemessen. Wenn lokalisiert, gezielte Foto-Stimulation wird kombiniert mit der Fähigkeit, die Zellmembranen mit 2-Photonen-Laser-scanning-Mikroskopie (2PLSM) zu finden, und die zwei wichtigsten Vorteile dieses Ansatzes sind vollständig realisiert: Photolyse Geschwindigkeit und räumliche Präzision.
In den meisten Punkten ist Photolyse von PA-Nic besser als andere Methoden liefern nAChR Liganden an Rezeptoren im Gehirnscheiben. Solche Ansätze sind Bad Anwendung7 und lokalen Medikament Lieferung über ein Kugelfisch Pipette8. Während die ehemaligen Ansatz neigt dazu, die langfristigen Auswirkungen des angewandten Medikaments genug betonen, leiden Letzteres Variabilität in der Reaktionskinetik zwischen Studien und zellenübergreifend. Keiner dieser alternative Ansätze können angemessen Rezeptor-Aktivitäten in verschiedenen zellulären Orten aus der gleichen Neuron unterscheiden. Optogenetically-aktivierte Version von ACh dient zur Untersuchung von native nAChRs9,10,11, aber es hat sich nicht bewährt für Zuordnung subzelluläre nAChR Standorte. Darüber hinaus haben die meisten Studien unter Verwendung dieser Ansatz auf eine ChR2 exprimierenden bakterielle künstliches Chromosom transgenen Maus mit abnormen cholinerge Übertragung12,13,14, verlassen. 15 , 16 , 17.
PA-Nic Photolyse ist nicht nur optische Ansatz für das Studium von cholinerger Rezeptoren. Ein Käfig Carbachol wurde verwendet, um funktionell ACh-Rezeptor-Aktivitäten in kultivierten Zellen18 und Gehirn Scheiben19zuzuordnen, aber wurde nicht im Handel erhältlich für vergleichende Studien während der Entwicklung des PA-NIC. Ein Ruthenium-BIZ (Bipyridine)-Nikotin-Komplex (RuBi-Nikotin) wurde berichtet, dass Nikotin uncaging20zu ermöglichen, aber kommerzielle Vorbereitungen von RuBi-Nikotin erwies sich schlechter als PA-Nic in einem Direktvergleich studieren5. Es kann sinnvoll sein, solche vergleichende Versuche mit nicht-kommerziellen, wiederholen hoch gereinigt RuBi-Nikotin, wie seine sichtbare Absorption PA-Nic-Funktionen für cholinerge Studien ergänzen könnte. Schließlich wurden nAChRs auch optisch manipuliert mit einer Kombination von Foto-schaltbare Liganden und Rezeptoren genetisch veränderten21. Dieser Ansatz ist komplementär zur PA-Nic Photolyse im Hirngewebe, mit der Fähigkeit/Anforderung der genetischen Angriffe auf die veränderten nAChR als einen Vorteil und einen Nachteil.
Mehrere wichtige Anforderungen dieses Ansatzes hingewiesen. Zunächst wird eine geeignete Visualisierungsmethode musste die neuronale Membran genau zu lokalisieren. Bildgebung mit konventionellen Epi-Fluoreszenz-Mikroskopie kann ausreichend sein, wenn man kultivierte Zellen studiert, aber für die Aufnahme von Neuronen im Gehirnscheiben oder andere dicke Gewebe-Präparate, 2PLSM oder der konfokalen Mikroskopie ist eine Voraussetzung. Zweitens ist eine geeignete Methode erforderlich, um die Photolyse Laserstrahl zu positionieren. Dieser Ansatz nutzt einen Dual-Galvanometer Scankopf mit zwei unabhängige X-y-Spiegel für das Raster Scannen der bildgebenden Strahl und Punkt Photoaktivierungen mit dem uncaging Laser Beam22,23,24. Begrenzte Lösungen sind möglich, z. B. (1) eine Single-Galvanometer Scankopf, dass Alternativ Raster scannt der bildgebenden Strahl und der uncaging Strahl oder (2) einfach Regie des uncaging Strahls in die Mitte des Sichtfeldes, so dass die Zelle gebracht wird Diese Position für Flash Photolyse. Drittens ist ein System für gleichzeitige elektrophysiologische aufzeichnen will man physiologische Signale während der Experimente zu sammeln. Die oben genannten Anforderungen können mit einem geeigneten rein optischen bildgebendes Verfahren, wie kürzlich beschriebenen5erfüllt werden. Unten ist ein detailliertes Protokoll enthalten, beschreibt die wichtigsten Schritte dieses Ansatzes.
Protokoll
Arbeit im Zusammenhang mit Gehirn Slice Vorbereitung wurde überprüft und genehmigt von der Northwestern University Animal Care und Use Committee (Protokoll #IS00003604).
Vorsicht: Laser für Punkt Foto-Stimulation sind sichtbare Klasse IIIb-Lasern, die das Potenzial haben, die Augen schädigen. 2PLSM erfordert einen Nah-Infrarot (NIR) Klasse IV Laser (> 500 mW), die hat des Potenzials, in anderen Geweben schwere Schäden an den Augen und sogar Verbrennungen verursachen. Richtige Laser Beam Containment, System-Verriegelungen, sowie technische und administrative Kontrollen müssen zum sicheren Betrieb von Laser-basierten Geräten zu gewährleisten. Immer versuchen Sie, aus lokalen Laser Sicherheitspersonal beim Arbeiten mit Lasern.
(1) Kalibrierung und Verifizierung von Uncaging Laser
-
Quantifizieren Sie Laserleistung zur Probe geliefert werden.
- 405 nm Laser (100 mW maximale Leistung mit 5 V-Steuersignal) schalten und das Lasersystem ca. 10 min. warmlaufen lassen.
Hinweis: Der Laser ist noch Fensterläden (mit 0 V-Laufwerk) und es gibt keine Ausgangsleistung bis der Laser eine Steuerspannung zu modulieren, die Ausgangsleistung gesendet wird. - Legen Sie einen Leistungsmesser in der Gewebe-Probe-Ebene oder an deren Stelle die Kondensorlinse. Das Messgerät im Verhältnis zu der optischen Pfad/Objektiv manuell zu zentrieren.
- Legen Sie das Messgerät auf den richtigen Wellenlängenbereich (400-1100 nm). Das Gerät durch Drücken der entsprechenden Taste auf Null.
- Software-Steuerelemente verwenden, wählen Sie 100 (Out-of-max 1000; 1000 = 5 V) für die 405 nm Laserleistung, die den Laser auf 10 % der vollen Ladung festgelegt. Falls gewünscht, kann auch die Laser-Steuerspannung in der PrairieView System über VoltageRecord als digitale Aufzeichnung des Befehls eingespeist werden signal Timing und Leistungsstufe.
- Aufzeichnung der Lesung aus der Leistungsmesser.
- Wählen Sie 150 (15 % von max. 1000) für die 405 nm Laser-Ausgangsleistung und notieren Sie die Lesung aus den Leistungsmesser. Wiederholen Sie dies für die folgenden Ausgangsleistungen, eine Laser-Leistungskurve zu sammeln: 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, und 1000.
- 405 nm Laser (100 mW maximale Leistung mit 5 V-Steuersignal) schalten und das Lasersystem ca. 10 min. warmlaufen lassen.
-
Uncaging Laser-Galvanometers zu kalibrieren. Führen Sie die folgenden Schritte aus, wann immer es eine Änderung der optischen Komponenten des Systems, wann immer es eine Sorge um genaue Positionierung vor Ort, oder regelmäßig jeden Monat.
- Installieren Sie die 60 x Wasser eintauchen Mikroskop Objektiv, die verwendet werden in Photostimulation und bildgebenden Experimenten. In der Akquisition/Imaging Software, wählen Sie die 60 x Objektiv und ein optischer Zoom-Einstellung von 1 (siehe Schritt 3.1.4.2.).
- Markieren Sie einen ausgefüllten Kreis in ein sauberes Glas-Mikroskopie-Folie mit einem roten Permanentmarker. Legen Sie die Folie auf den Mikroskoptisch mit Markierung in Richtung Ziel.
- Pre-Fokus auf den roten Marker-Region mit einem 4 X oder 10 X Objektiv des Mikroskops. Oben auf den roten Marker Dot/Spot fügen Sie 1-2 mL Wasser hinzu und dann wechseln Sie zu der 60 X Objektiv und Tauchen Sie das Ziel in das Wasser ein. Konzentrieren Sie das Objektiv auf den dünnen roten Marker-Region.
- Wechseln Sie zur 2-Photonen-Laser-scanning. Für die meisten Systeme bewegen Turm #1 zu positionieren, bewegen das Trinocular Prisma aus dem Strahlengang der Scan-Kopf-Spiegel nach vorne bewegen und die Wellenlänge des Lasers auf ~ 900 nm. Die Option 512 x 512 Pixel-Box für die Bildparameter Erwerb ist die Default-Pixel-Element für die Stimulation Spiegel Kalibrierroutine.
- Starten Sie System-Scan mit einem bildgebenden Laserleistung größer als Minimum und Feinabstimmung des Objektive Fokus auf die dünnen roten Marker-Fluoreszenz-Schicht. Wählen Sie ein Feld im Feld Fluoreszenz frei von Schmutz und gleichmäßig beschichtet mit Marker.
Hinweis: Das Setup in diesem Protokoll verwendet PrairieView 5.4 Erwerb/Imaging Software. - Öffnen Sie die Uncaging Galvo-Kalibrierung -Funktion im Menü Extras – Kalibrierung/Ausrichtung der Software. Spaziergang durch das brennen Flecken Tutorial für die räumlichen Kalibrierung des zweiten Paares Galvanometer Spiegel.
- Innerhalb der Spots brennen Tutorial wählen die 405 nm-Laser, eine Stimulation Laserleistung von 400 und einer Stimulation-Dauer von 20 ms sollte dies kleine Ausbeute (~ 1 bis 5 µm Durchmesser) Löcher in den roten Marker.
Hinweis: Einstellungen wie z. B. ~ 2 bis 4 mW und 1-10 ms werden normalerweise verwendet, aber die Einstellungen richten sich nach der Probe. PA-Nic Foto-Stimulation Energieeinstellungen dürften weit geringer als die Leistung während der Kalibrierung erforderlich, um eine sichtbare Loch auf den roten Marker Folie abtragen. Diese Kalibrierroutine eignet sich zur Ortung von Photostimulation Flecken aber sollten nicht verwendet werden, um absolute Photostimulation Volumen während der physiologischen Reaktionen abzuleiten. - Wählen Sie Update zu stimulieren, um das Bild zu aktualisieren, nachdem das Zentrum vor Ort brennen und das runde rote Kennzeichen an den eigentlichen Ort Speicherort verschieben. Dies gilt für das Zentrum vor Ort, die richtigen Zentrum vor Ort, der unteren Zentrum vor Ort, und schließlich für ein Raster mit neun Spots (alle Ecken und Kanten sowie die Mitte des Bildes).
Hinweis: Die Mitte, rechts, und untere korrigierte spot Standorte bestimmen die Stimulation Galvanometer Spannungen, die wahre Zentrum und X und Y Skalierungsfaktoren Stimulation Spiegel paar der bildgebenden Spiegel paar entsprechend definieren. Die Software skaliert und alle nachfolgenden Mäler Experimente an verschieden von den räumlichen Kalibrierung Zoom Zoom-Einstellungen zu aktualisieren.
- Innerhalb der Spots brennen Tutorial wählen die 405 nm-Laser, eine Stimulation Laserleistung von 400 und einer Stimulation-Dauer von 20 ms sollte dies kleine Ausbeute (~ 1 bis 5 µm Durchmesser) Löcher in den roten Marker.
- Testen Sie die Kalibrierung durch Öffnen des Fensters Mäler und die manuelle Aktivierung der Stimulationsparameter in definierten Stelle in einem neuen Bereich der Probe. Stellen Sie sicher, dass die korrekten, aktuellen Kalibrierdatei Mäler Fenster geladen ist. Aktivieren Sie die Mäler/Gruppe oder Mäler Serie Funktion an einer definierten Stelle oder nutzen Sie die Funktion Live/Ablation rechts/links klicken mit der Maus irgendwo auf das Bild während der live Scannen um einen Testpuls zu übernehmen und korrekten Kalibrierung zu überprüfen.
Hinweis: Die Laser brennen vor Ort sollte jetzt perfekt auf die Mäler Anzeige zentriert werden. - Überwachen und aufzeichnen die Aktivierung der Puls Laserleistung und zeitliche Dauer durch Antippen aus der Ansteuerspannung in das VoltageRecord -Programm (siehe Schritt 1.1.4). In ähnlicher Weise nehmen Sie Stellung jede Anregung-Spot mit einer skalierten Spannungssignal aus den Feedback-Signale, abgeleitet aus dem Paar Foto-Stimulation Galvanometer Spiegel auf.
2. Vorbereitung des Photoactivatable Nikotin (PA-Nic)
- Eine aliquote lyophilisierten Photoactivatable Droge aus dem Speicher abzurufen.
Hinweis: Das folgende Protokoll ist spezifisch für PA-Nic. passen Sie bei Bedarf für andere Photoactivatable Substanzen. Obwohl PA-Nic außergewöhnliche Stabilität5zeigt, nehmen Sie angemessene Vorkehrungen zum Schutz vor Exposition gegenüber hellem Licht während der Vorbereitung und/oder Experimente. Dies kann erreicht werden, indem Sie einfach arbeiten bei schwachem Licht; Beschränkung auf roten gefiltertes Licht ist nicht erforderlich. -
Führen Sie lokale Anwendung von PA-NIC.
- Ziehen Sie ein Glas Mikropipette mit einem Öffnungsdurchmesser von 20-40 µm mit einem programmierbaren Pipette Abzieher.
- Filtern Sie ~ 1 mL Aufzeichnungslösung mit 0,22 µm Filter. Erneut eine Menge von PA-Nic im gefilterten Aufnahmelösung um eine Endkonzentration von 2 mM zu erzielen. Beispielsweise ein 100 Nmol lyophilisiert aliquoten in 50 µL der gefilterten Aufzeichnungslösung auflösen.
Hinweis: Eine vorgeschlagene Aufnahme Lösung Zusammensetzung finden Sie in den letzten Publikationen5,6 PA-Nic Photolyse beschäftigt. - Rücken-Füllung die lokale Anwendung Pipette mit 50 µL 2 mM PA-NIC.
- Die lokale Anwendung Pipette in eine Pipette Halter montiert auf einem Mikromanipulator zu sichern. Schließen Sie die Pipette Halter über geeignete Schläuche an eine Druck-Auswurf-System nachhaltig Niederdruck anwendbar (1-2 Psi).
- Mit dem Mikromanipulator, die lokale Anwendung Pipette in die extrazelluläre Aufzeichnungslösung und Position, dass die Pipettenspitze knapp oberhalb der Maus Hirngewebe ~ 50 μm aus der Zelle von Interesse gelegen zu manövrieren. Ein detailliertes Protokoll der Maus Gehirn Slice Vorbereitung und Patch-Clamp-Aufnahmen-8finden Sie in einem früheren Bericht.
- Überprüfen Sie die Anwendungsparameter durch kurz Druck (1-2 Psi). Es sollte minimal, keine Verschiebung der Zelle von Interesse sein. Wenn nennenswerte Bewegung auftritt, positionieren Sie die lokale Anwendung Pipette weiter entfernt (in seitlichen und/oder axiale Richtung) aus der Zelle von Interesse.
- Nach dem Erreichen der stabilen ganze Zelle Patch Clamp (Details für die sind in einer Vorveröffentlichung8enthalten), Niederdruck (1-2 p.s.i.) Anwendung mit dem entsprechenden Handschalter auf dem Druck-Auswurf-Gerät einschalten. Sättigen Sie das Gewebe rund um die Zelle mit PA-Nic für 1-2 min bevor Sie mit dem nächsten Schritt fortfahren.
-
Führen Sie Bad Anwendung (Superfusion) PA-Nic auf die Gehirn-Scheibe.
- Lösen Sie eine Menge von PA-Nic in einem Volumen von Aufzeichnungslösung für kontinuierliche Rückführung um eine Endkonzentration von 100 μM zu erzielen. Zum Beispiel lösen Sie ein 1 μmol aliquoten in 10 mL Aufnahmelösung mit einem standard 15 mL Tube auf.
- Beginnen Sie Rückführung der PA-Nic-Lösung mit einer Rate von 1,5 bis 2 mL/min durch die Eröffnung der entsprechenden Flusssteuerung in der Perfusion System. Rezirkulation tritt für die Dauer der Aufnahme. Um wertvolle Droge zu sparen, minimieren Sie die Rezirkulation Lautstärke mittels Schlauch mit minimalen Innendurchmesser und/oder durch die Verkürzung der Gesamtlänge der Rohre in der Perfusion System verwendet.
Hinweis: Durch diese Maßnahmen kann die Lautstärke für Bad Rückführung bis 5 mL PA-Nic-Lösung reduziert werden. PA-Nic-Lösungen eignen sich oft für zwei aufeinander folgende Tage in derselben Woche aufnehmen, wenn gespeichert lichtgeschützt bei 4 ° c - Während der Rückführung kontinuierlich sprudeln Sie die Lösung mit Carbogen (5 % O2, 95 % CO2) und pflegen Sie die Badtemperatur bei 32 ° C.
- Behalten Sie die Gehirn-Scheibe in Aufzeichnungslösung während der Arbeit mit PA-Nic bei schlechten Lichtverhältnissen.
(3) Bildgebung Neuronen mit 2-Photonen-Laser-Scanning-Mikroskopie
- Führen Sie live Visualisierung der Zelle.
- Identifizieren/visualisieren eine mediale Habenulae (MHb) Neuron mit Durchlicht oder Infrarot-differential Interferenz Kontrast (IR/DIC) Optik und einer Videokamera und eine stabile ganze Zelle Patch Clamp Aufnahme zu etablieren. Beziehen sich auf einen vorherigen Protokoll Details zu Patch-Clamp-Aufnahmen von Neuronen in akut vorbereitet Maus Gehirn Scheiben8.
- Nach der Gründung der hochohmige (> 1 GΩ) Zelle-attached Konfiguration, aber vor Einbruch, schalten Sie die Set-up und Software zur laser-Scan-Modus.
- Nach Einbruch, verwenden Sie Laserscanning zu prüfen, ob eine bildgebende Farbstoff (verdünnt, um eine Endkonzentration von 100-200 µM in einem standard intrazellulären Pipette Lösung zuvor beschriebenen8) ist passiv (durch Diffusion) füllen das Neuron. Erlauben Sie, dass des Farbstoffs (z. B. Alexa Fluor 488 in grünen Photomultiplier Tube [Rate] Kanal, RMZ 2; oder Alexa Fluor 568 oder 594 im Rotkanal PMT, PMT 1) füllen die zellulare Fächer für mindestens 20-30 min bevor Sie versuchen, Experimente, die Visualisierung von erfordern Jede zelluläre Fächer außerhalb der Soma.
Hinweis: Distale Fächer (dendritischen Strukturen, Stacheln, Axone, etc..) erfordern 30-40 min25vollständig auszufüllen. - Verwenden Sie die Software Live-Scan -Funktion, um das Neuron und subzelluläre Fach von Interesse zu visualisieren. Wählen Sie imaging Parameter, mit denen für genaue Visualisierung neuronaler Funktionen Leben. Verschiedene Einstellungen zu beeinflussen oder verändern die Anzeige Visualisierung (Kontrast), Auflösung, Signal-Rausch-Verhältnis (S/N) und Bild Frame Erfassungszeit zu manipulieren:
-
Guck-Tabelle (LUT). Die LUT-Fenster mit dem entsprechenden Symbol auf der Seite jedes Bildfenster geöffnet. Nach dem Öffnen Sie, stellen Sie die LUT Stock (min) und Decke (max) Einstellung des spezifischen Bildkanal , Visualisierung von Signal-Kontrast auf dem Bildschirm angezeigt zu verbessern. Senken Sie den Maximalwert auf ~ 1000 (aus 4096, 12-Bit-Erkennung), das hilft, ziehen Sie den dimmer Signale bei der ersten Suche nach Zellen, Signal- und Struktur.
Hinweis: Diese Einstellungen wirken sich nur auf das angezeigte Signal nicht erkannt/aufgezeichneten Werte. Das menschliche Auge können in der Regel nur Kontrast bis ~ 50 Graustufen26ausmachen. -
Optischen zoom. 1 X optischer Zoom und Nutzung schwenken Steuerelemente, um den gewünschten Bereich im Gewebe zu finden wählen Sie mit Software steuert. Diese Zoomeinstellung ergibt sich den größten Platz, Sichtfeld gescannt und sendet die größten Spannungen/Scan-Winkel der Galvanometer-Spiegel.
Hinweis: Die Standardkonfiguration ist für ein 12 x 12 mm-Sichtfeld in den Scankopf 12 mm geteilt durch objektive Vergrößerung innerhalb der Probe übersetzt. Daher, eine 60 x Objektiv Erträge gescannte Bilder von 200 µm pro Seite 1 x optischer Zoom. Höheren optischen Zoom-Werte Scannen weniger Fläche. 2 x optischer Zoom ist oft die nützlichste Einstellung zur Visualisierung von ganzer Neuronen. 4 X kann zur Visualisierung von subzellulären Aspekte der Neuronen. -
Anzahl der Pixel. Wählen Sie ergänzend 1 x optischer Zoom, 1024 x 1024 Pixel pro Zeile mit Software steuert. Legen Sie die Anzahl der Pixel pro Zeile in die eingefangen und angezeigte Bild Details möglich vor das Objektiv nicht zu verlieren. Verwenden Sie die folgenden praktischen Pixelwerte für ein 60 X / 1,0 numerische Apertur (NA) Ziel: 1024 x 1024 für Zoom 1, Zoom 2 512 x 512 und 256 x 256 für zoom 4. Die Ende Pixelgröße (~0.17 µm; 12 mm/Vergrößerung/Zoom/Pixel) sollte die Hälfte oder weniger, die laterale Auflösung durch das Objektiv definiert werden.
Hinweis: Die Bildauflösung wird nur durch die Wellenlänge des Lasers und der objektiven NA definiert (0,4 µm Auflösung von zwei-Photonen aufgeregt [2PE] mit 920 nm und ein 1,0 NA Ziel)27. Die Kriterien für die volle Erregung NA, als an der Linse ist, dass die 1/e2 Intensität der Laserstrahl Durchmesser Spiele (oder "füllt") der Eintrittspupille (2 x Rohr Objektivbrennweite x NA / Vergrößerung) der Objektivlinse. Das Rohr-Objektiv in dem hier beschriebenen System hat eine Brennweite von 180 mm. -
Pixel-Verweildauer . Verwenden Sie Software steuert 4 µs für die Pixel-Verweilzeit, eine nützliche Standardwert auswählen.
Hinweis: Ändern die Verweilzeit Pixel ändert nicht das mittlere Signal erkannt; Es betrifft nur die Intra-Pixel Durchschnitt und diese Veränderungen visualisiert werden, durch die Bildqualität über die S/N. Die Bild-Pixel-Verweilzeit ist immer ein Vielfaches von 0,4 µs Einheiten, und für die größere Verweildauer Mal die 12-Bit begrenzte Intensität Wert jeder Bildpunkt ist der Durchschnitt der 0,4 µs Proben. Da das S/N-Verhältnis als die Quadratwurzel aus der Anzahl der Samples pro Pixel Verweilzeit (4 µs entspricht zehn Proben oder 3.16-fold Verbesserung der S/N) verbessert, erreicht die Verbesserung der Bildqualität abnehmende für Werte größer als 12 µs. -
Scannen, Rotation und Region of Interest (ROI). Legen Sie den Bildwinkel auf 0° Rotation mit Software-Steuerungen (keine Aktion erforderlich werden als 0 ° Drehung die Standardeinstellung für die meisten bildgebenden Systemen ist,). Wenn die Probe in eine "Upside-Down"-Orientierung steht, wählen Sie 180°-Drehung zu "Bild drehen".
Hinweis: Drehen des Bildes in jedem möglichem gegebenen Winkel bieten eine bessere Passform für das gesamte Gebiet des Interesses einer gefüllte Zelle. Rotation kann auch eine klarere Grundlage für die Ausrichtung von struktureller Veränderungen und für spätere Analysen ergeben. Auswahl eines Bereichs von Interesse im gescannten Bild an einer bestimmten Zoom (Schritt 3.1.4.2) Einstellung behält die nativen Pixel-Anzahl (Schritt 3.1.4.3), aber die Einschränkung in der Gesamtzahl der Gegend und Pixel kann die Frame-Rate drastisch erhöhen, vorausgesetzt Verbesserte Zeitauflösung von Signaländerungen. -
Rahmen von durchschnittlich. Wählen Sie eine Start Frame durchschnittliche Einstellung von 2 Frames mit Software steuert.
Hinweis: Der endgültige Bildkontrast (S/N) wird durch die totale Photonen innerhalb der Signal-Pixel des Bildes gesammelt/erkannt definiert. Mittelwertbildung aus mehreren Bildrahmen kann das S/N-Verhältnis verbessern, sofern die Probe sich nicht bewegt oder wird während der Aufnahme nicht gebleicht. Das Signal des Interesses bleibt den gleichen Wert im Rahmen von durchschnittlich, während das Rauschen im Bild durch die Quadratwurzel der Anzahl der Frames im Durchschnitt reduziert wird. Kleine Strukturen in Fluoreszenzbilder erfordern oft Inter Pixel Durchschnitt, Kombination von Pixeln im Bild (häufig genannt ROIs) und/oder Frame im Durchschnitt. Im Durchschnitt erhöht, die Scan-Zeit durch die Anzahl der Bilder ein Rahmen wählt Durchschnitt.
-
Guck-Tabelle (LUT). Die LUT-Fenster mit dem entsprechenden Symbol auf der Seite jedes Bildfenster geöffnet. Nach dem Öffnen Sie, stellen Sie die LUT Stock (min) und Decke (max) Einstellung des spezifischen Bildkanal , Visualisierung von Signal-Kontrast auf dem Bildschirm angezeigt zu verbessern. Senken Sie den Maximalwert auf ~ 1000 (aus 4096, 12-Bit-Erkennung), das hilft, ziehen Sie den dimmer Signale bei der ersten Suche nach Zellen, Signal- und Struktur.
- Werkzeugen Sie zur Pan-Regler, Scannen Rotationund Optische Zoom , um die Probe Lage während des Scannens zu orientieren. Wenn motor Phase Manipulation notwendig ist, positionieren Sie die Probe, vermeiden große Schrittweiten zur X-, Y- und Z-Achse, Ziel/Kondensator Kollisionen, Vibrationen oder Exposition des Laserstrahls auf reflektierenden Oberflächen zu verhindern.
- Einen Z-Stack zu sammeln. Mit dem Z-Serie -Werkzeug wählen Sie einen Start und stop Position, die die Zelle von Interesse enthält. Wählen Sie eine Schrittweite (1 µm) und dann nacheinander Bild das Neuron in jedem Z-Ebene, die die Zelle enthält.
Hinweis: Z-Stapel Erwerb Einstellungen variieren zwischen Neuron Typ und Farbe zu füllen. Optimale Parameter für die Z-Stapel Erwerb sollte unabhängig von für live Imaging verwendeten Parameter bestimmt werden. Z-Stapel Erwerb kann vor und/oder nach Optopharmacology Experimente durchgeführt werden. Wenn möglich, durchführen Sie Z-Stapel Erwerb nach Optopharmacology Zellschäden zu vermeiden von 2PLSM und damit für optimale Farbstoff Füllung aus kleinen zellulären Kompartimenten induzierte.
4. Laser Flash Photolyse bei elektrophysiologische Aufnahmen
Hinweis: Anwenden von 405 nm oder 473 nm Laserleistungen von ≥ 1 mW produziert Phosphoreszenz im Inneren des Glases von Ziel und Kondensator-Objektive. Das erzeugte Licht ist in direktem Zusammenhang mit der Laserleistung Beleuchtung; die Emission ist in den grünen und roten spektralen Fenstern und aufgeregt-Staat leben im Bereich von ms hat. Diesem Hintergrund Stimulation Artefakt ist in allen objektiven getestet und in Wasser eintauchen Objektive aller namhaften Hersteller von Objektiven gesehen. Kondensator-Objektive produzieren viel höhere Phosphoreszenz als Objektive. Dieses "Signal" motiviert die Verwendung von mechanischen Schalung für Schutz der sensiblen Gallium-Arsenid Phosphid (GaAsP) PMT-Kathoden bei Foto-Stimulation Veranstaltungen. Mit einem Ruhekontakt mechanischen Verschluss (geschlossen beim Scannen nicht aktiv) ist die beste Lösung für den Schutz der gekühlten GaAsP PMTs.
- Entfernen Sie für eine Sanduhr-Typ Photostimulation Strahlgeometrie keine Fokussierung Linsen in der Lichtweg-Optik, die ansonsten schmal/der Laserstrahl beim Eintritt in die Objektive Eintrittspupille verengen würde.
- Mälerverwenden, wählen Sie die einzigen vor Ort.
Hinweis: Weitere Foto-Stimulation (mehrere Spots, ein Raster von Spots, Spirale Scannen) sind innerhalb Mälermöglich. Am einfachsten ist die einzige Stelle. Experimentelle Ziele und biologische Unterschiede erfordern eine andere Einstellung. - Aktualisieren Sie das Bild mit der Live-Scan -Option zu kurz Bild und suchen den subzellulären Bereich von Interesse. In regelmäßigen Abständen aktualisieren Sie das Bild, um jede mögliche kleine Drifts im Fokus zu identifizieren.
- Software-Steuerelemente verwenden, um den optischen Zoom zu erhöhen (d.h., wählen Sie eine höhere optische Zoomeinstellung als die jetzige), falls notwendig, um kleine Strukturen (d.h., Stacheln oder distalen Dendriten) sichtbar zu machen.
- Mäler einzigen Ort Fadenkreuz unmittelbar benachbart (~0.5 μm) an der Zellmembran zu platzieren. Kein Ort der Foto-Stimulation vor Ort direkt über eine zelluläre Funktion als dies lichtbedingten führen zu können.
- Legen Sie die Parameter für die Foto-Stimulation mit Software steuert in Mäler. Gelten die ab Richtlinien wie folgt: 1-50 ms Dauer, 1 bis 4 mW Laserleistung und ≥1 Testversion.
- Wählen Sie Run Mäler zu initiieren Mäler Protokoll und Elektrophysiologie Datenerfassung in Echtzeit zu beobachten.
- Wiederholen Sie die Schritte 4,2-4,7 mehrmals Konsistenz und Stabilität zu bewerten, oder deren, die Antwort Amplitude und Kinetik fehlen.
Ergebnisse
Für die Photolyse sind Stimulation, die Strahlendosis (Intensität und Zeit), Exposition Lage und Strahlgeometrie Schlüsselvariablen. Das System in diesem Artikel beschriebenen ist in der Lage, zwei unterschiedliche Photostimulation Strahlen, einstellbar über Linsen in/Out von den Lichtweg Photostimulation verschieben, bevor der Strahl das Galvanometer-System gelangt. Ohne dieses Objektiv die Photostimulation Strahl füllt die Eintrittspupille des 60 X / 1,0 NA Wasser-tauchen [60 X WD] Ziel, produziert eine in der Nähe-Beugung begrenzte, Sub-µm-Spot in der Brennebene innerhalb der Probe. Dies ist leicht mit der Form einer Sanduhr, erweitern, oben und unten mit der optischen Achse symmetrisch Brennfleck Photostimulation zugeordnet. Mit dem Objektiv in den Pfad eingefügt Photostimulation Laserlicht konzentriert sich in der Eintrittspupille des Objektivs und beendet sich dann als Bleistift-wie Balken. Dieser Strahl, die ~ 10 µm im Durchmesser für ein 60 X Ziel sein soll, erweitert gleichmäßig/vertikal im gesamten Beispiel. In diesem Modus wird die Lichtintensität an einem bestimmten Ort innerhalb der Stimulation Spot ~ 1 % der kleine Ort Intensität in der Nähe von Beugung begrenzt sein. Somit sind höhere Laserleistungen in der Regel erforderlich, wenn ~ 10 µm spot Stimulation verwendet. Für alle Experimente, die in diesem Artikel berichtet wurde eine Sanduhr-Typ Photostimulation Balken verwendet.
Die gelieferten Probe macht kann gegen die Eingangsspannung Einstellung, nach der Messung der Laserleistung auf die Probe mit einem Leistungsmesser geplottet werden. Diese Studien eine 60 x WD Ziel mit einem Arbeitsabstand von 2 mm verwenden, aber es ist nicht untergetaucht im Wasser für Leistungsmessungen auf mögliche Beschädigung der Detektorelement zu vermeiden. Wenn Ziele mit NA aufgeführt kann > 0,95 in Luft (ohne Immersionflüssigkeit) gemessen werden, es Totalreflexion Verluste an der Vorderseite Linsenelement aufgrund der niedrigeren Index (Luft). In diesem Fall für eine genauere Probe Leistungsmessung (, Totalreflexion Verluste zu korrigieren) erhöhen die gemessene Leistung von 1,0 NA Objektive (1.0/0.95)2 in Luft gemessen. Abbildung 1a zeigt einen typischen input-/Output-Plot für 405 nm und 473 nm sichtbar Laser, die in den Laser integriert werden System in dieser Studie starten. Diese Lasersysteme sind ideal für Foto-Stimulation Belichtungssteuerung Dosis aus den folgenden Gründen: (1) sie sind vorkalibriert bieten direkt lineare Leistungsabgabe im Vergleich zu Eingangsspannung (0-5 V), (2) sie bieten einen Stille Verschluss-Betrieb (kein Laser Ausgang), und (3) sie haben schnelle, Sub-ms Intensität Dauer Impulsregelung (0,1 ms Reaktionszeit). Wenn Sie vor Ort Foto-Stimulation mit einem Laser/Galvo-System verwenden, ist regelmäßige Kalibrierung der Mäler Spots eine wesentliche Aufgabe. Abbildung 1 b (links) zeigt ein System, das aus der Kalibrierung (gewünschten Punkt Foto stimulieren führt nicht präzise Stimulation von diesem Punkt, wie Burn-Loch Standort angegeben), mit einer Rückkehr zur exakten Positionierung der Ort nach der Kalibrierung ( Abbildung 1 b, rechts).
PA-Nic ist bescheiden fluoreszierende (Emission Peak bei ~ 510 nm), wirksame Erregung zwischen 350-450 nm (1-Photon Erregung) oder 700-900 nm (2-Photon Erregung)5ausstellen. PA-Nic bei lokaler Anwendung visualisieren, PA-Nic (1 mM) in der Nähe von Hirngewebe, gefolgt von simultane Bildgebung (1) Gehirn Gewebe optische geschnittenen Übertragung Kontext über Dodt Kontrast und (2) die emittierte Fluoreszenz von Erregung angewendet wurde (900 nm) des PA-NIC PA-Nic 2PE Fluoreszenz war beim Druck Auswerfen von einer lokalen Anwendung Pipette (Abb. 2a) leicht nachweisbar. Nikotin und ein Monoalkylcoumarin, 7-Carboxymethylamino-4-Methyl Cumarin, sind die wichtigsten photochemische Produkte der PA-Nic Photolyse Reaktion5. Mit dem gleichen imaging Einstellungsparameter, die für PA-Nic Bildgebung verwendet wurden, wurde das Gewebe während der Geburt von Nikotin (1 mM) oder 7-Carboxymethylamino-4-Methyl Cumarin (1 mM) abgebildet. Kein Fluoreszenzsignal erkannt wurde (Abbildung 2a, mittleren und unteren Platten), Nachweis der Spezifität der PA-Nic-Ergebnisse. Zu guter Letzt PA-Nic im Hirngewebe angewendet wurde und PA-Nic Fluoreszenzemission abgebildet war (Abb. 2 b). Dieser Ansatz bestätigt, dass PA-Nic im 100-200 µm der lokalen Anwendung Pipette vorhanden ist. Zusammen, bestätigen diese Daten, dass PA-Nic effektiv auf Gehirn Gewebe über lokale Anwendung geliefert wird.
Elektrophysiologie Aufnahmen mit gleichzeitiger 2PLSM zur Visualisierung der Zellstrukturen benötigt des Prüfers Gleichgewicht Erwägungen für beide Komponenten des Experiments, und oft eine schmale Zeitfenster (~ 20 min) steht für gültig Probe-Datenerfassung aus einer gepatchten Zelle. Ohne Rücksicht auf zelluläre Visualisierung, ist es empfehlenswert, mit der Aufnahme so bald wie möglich nach Einbruch, weil Stabilität Aufnahme tendenziell mit der Zeit sinken. Wenn Bildgebung erforderlich ist, müssen elektrophysiologische Überlegungen jedoch ausreichend Zeit für die Fluoreszenz Konzentration steigt in kleinen/Fernbedienung Strukturen ermöglichen. Dies kommt zum Ausdruck durch die Untersuchung einer Farbstoff-Konzentration füllen Kurve28, die ist manchmal nützlich, ableiten, wenn eine neue Zelle Art imaging. Abbildung 3 zeigt einige Beispiel Neuronen abgebildet als Z-Stapel über 2PLSM und stürzte in eine maximale Intensität Projektion für Präsentationszwecke. Abbildung 3a zeigt qualitativ hochwertige Bilder wo neuronale Morphologie erscheint auf Vollständigkeit, Lärm minimiert und Schutt Interpretation der zellulären Morphologie nicht stört. Abbildung 3 b zeigt Bilder von geringerer Qualität, aufgrund einer geringeren Signal-Hintergrund-Verhältnis und erheblichen Rückstand. Diese Ablagerungen erscheint oft als kugelförmige Taschen der intensive Fluoreszenz, Auswurf von imaging-Farbstoff aus der Patch-Pipette beim Anflug auf der Zelle aus. Insbesondere, Aufnahme von 100 µM PA-Nic in der Badewanne (bei Bad Anwendung) neigt dazu, das Signal-Hintergrund-Verhältnis reduzieren und führt zu suboptimalen Bildkontrast. Alexa Fluor 568 oder 594 ist oft sehr nützlich bei lokaler Anwendung versuchen, als Finder Farbstoff oder als Normalisierung 2PE Referenz/Normalisierung Signal. Eine effektive Wellenlänge für zwei-Photon Erregung dieser Farbstoffe ist ~ 780 nm27, die gleichzeitige Visualisierung von PA-Nic und Identifizierung von zellulären Kompartimenten ermöglicht. Diese Wellenlänge, jedoch nicht vollständig zwei-Photonen-Photolyse von PA-Nic5vermeiden. Alexa Fluor 488 ist vorteilhaft in PA-Nic Bad-Anwendung Experimente; Wenn mit einer geeigneten Wellenlänge ≥900 nm angeregt, kann zwei-Photonen-Photolyse von PA-Nic5 unter Beibehaltung geeignete Visualisierung der zellulären Kompartimenten vermieden werden.
Abbildung 4 zeigt die Beispieldaten für lokalisierte PA-Nic Laser Flash Photolyse bei MHb Neuronen im Gehirnscheiben. Abbildung 4a (oberen Platten) zeigt ein Beispiel für ein "Referenz"-Image, das ist ein Screenshot des letzten 2PLSM Bildes vor Mäler Protokoll überlagert mit dem Foto-Stimulation vor Ort Standort ausgeführt wurde, getroffen. Abbildung 4a (untere Bild Platten) zeigt eine vergrößerte Ansicht der Foto-Stimulation vor Ort überlagert, die zellulären Morphologie. Die unteren Platten Abbildung4a zeigt die entsprechende Zeit korreliert elektrophysiologische Antwort auf PA-Nic Photolyse. Frühere Arbeiten gezeigt, dass diese Ströme nAChR Antagonisten5anfällig sind. Abbildung 4 b zeigt repräsentative Daten aus verschiedenen Zellen, wo einzelne spot Photolyse in einem Intervall von entweder 1 erfolgte, s oder 10 s. 10 s-Intervall ausreichend Erholungszeit für die Basislinie Haltestrom gestattet, ein kürzeres Intervall für 1 s führte zu einer schrittweise Erhöhung der Haltestrom als das Protokoll ging. Der ansteigende Strom legt nahe, dass Nikotin nicht genug Zeit haben, vom System mit 1 Hz Intervall29zu verbreiten. Diese zeitliche Antwort, die analysiert werden müssen durchgeführt de Novo auf jede neue Zelle Art untersucht, da die Neuropharmacology nAChRs zwischen Zelltypen unterscheiden kann.
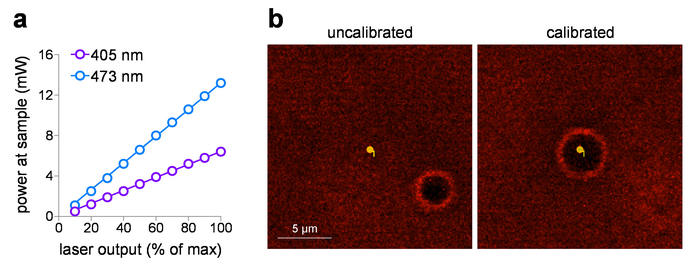
Abbildung 1: Photostimulation Laser Kalibrierung. (ein) Foto-Stimulation Laser Ausgangsleistung. Macht auf die Probe-Ebene (durch ein 60 X / 1,0 NA Wasser eintauchen Ziel) wurde gemessen, für 405 nm und 473 nm-Foto-Stimulation-Laser bei der angegebenen Ausgabeeinstellung. (b) Foto-Stimulation Laser Kalibrierung. Screen Capture Bilder zeigen die räumliche Beziehung zwischen der beabsichtigten Foto-Stimulation und die entsprechende Position wo Foto-Stimulation aufgetreten (Burn-Loch) vor (links ist) und nach (rechts) laufenden Kalibrierung in Mäler. Bitte klicken Sie hier für eine größere Version dieser Figur.
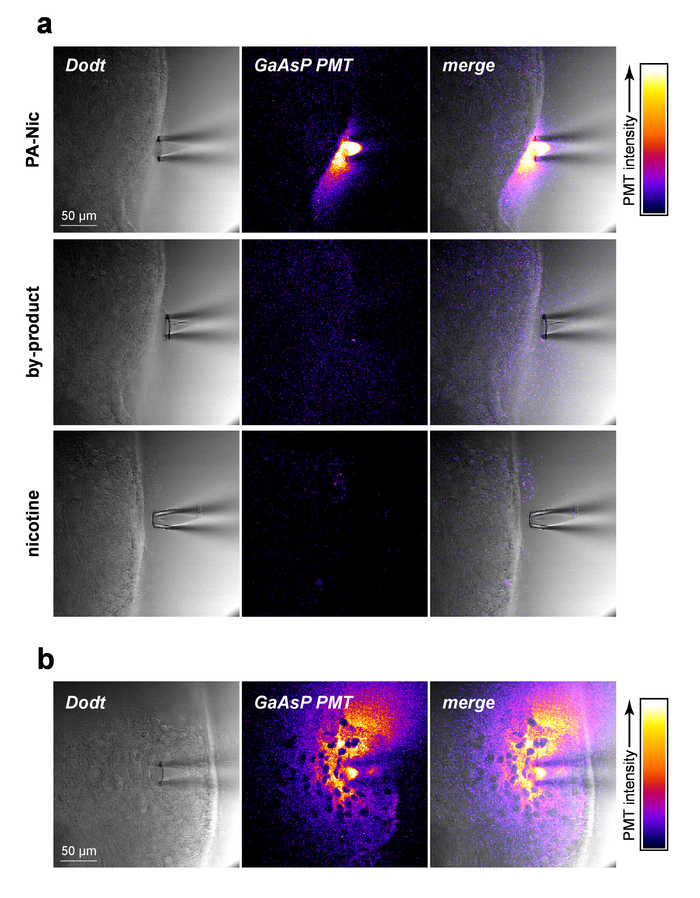
Abbildung 2: lokale Anwendung PA-Nic. (ein) Erkennung von PA-Nic von einer lokalen Anwendung Pipette. 1 mM PA-Nic, Photolyse Nebenprodukt oder Nikotin in ACFS aufgelöst, in einer lokalen Anwendung Pipette geladen und verzichtet auf Gehirngewebe während 2PLSM (900 nm Anregung) imaging mit den gleichen bildgebenden Einstellungen für jedes Medikament. Laser-scanning-Dodt Kontrast Übertragung Bild zeigt die Gewebe/Pipette während eine GaAsP Kathode PMT verwendet wurde, um Fluoreszenzemission zu erfassen. (b) PA-Nic (1 mM) wurde in das Gehirngewebe durchblutet und abgebildet über 2PLSM wie (ein), die seitliche Ausbreitung von PA-Nic mit seiner intrinsische Fluoreszenz zeigen. Bitte klicken Sie hier für eine größere Version dieser Figur.
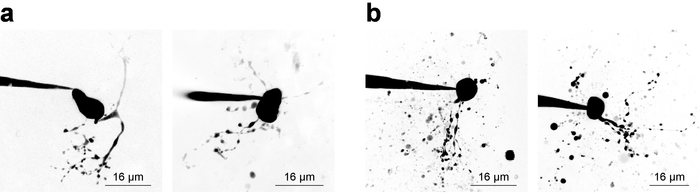
Abbildung 3: Erwerb der 2-Photonen-Laser-scanning-Mikroskopie Bilder. (ein) optimale 2PLSM Z-Stapel. Zwei Beispiele für 2PLSM Z-Stapel Beihilfehöchstintensität Projektionen sind gezeigt für MHb Neuronen mit gut gelöst Dendriten und wenig bis keine störenden Ablagerungen. (b) suboptimal 2PLSM Z-Stapel. Zwei Beispiele für 2PLSM Z-Stapel Beihilfehöchstintensität Projektionen sind für MHb Neuronen umgeben von Schutt (Farbstoff vertrieben aus der Pipette in Zelle Ansatz). Solche Bilder sind schwieriger zu interpretieren als Bilder wie in (einem) gezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.
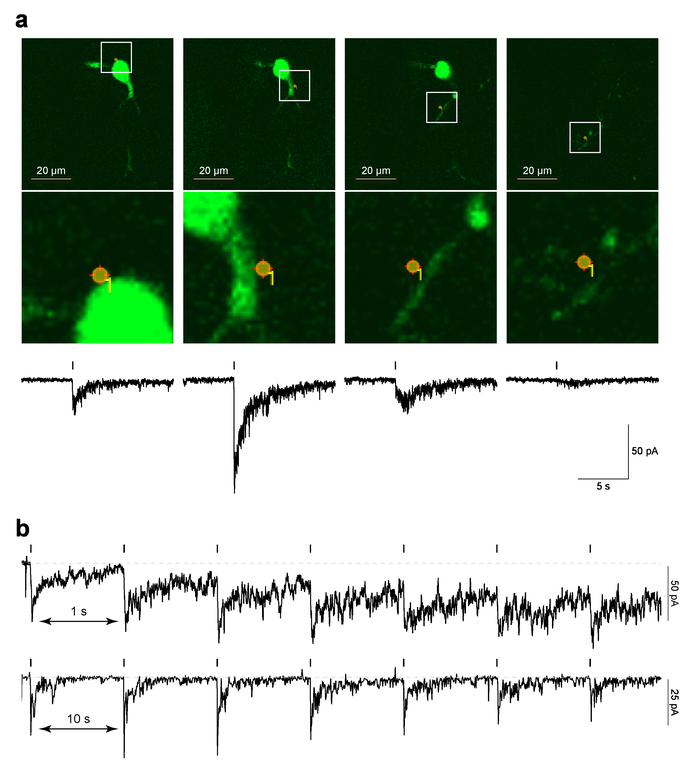
Abbildung 4: Laser Flash Photolyse PA-NIC (ein) Mäler Referenz Bilder und nach innen Ströme, hervorgerufen durch PA-Nic Photolyse. Ein MHb Neuron werden roh Referenzbilder für Mäler Foto-Stimulation Versuche an einem Standort (angegebenen) zellulären gezeigt. Beachten Sie, dass für ein paar Foto-Stimulation Orte (das am weitesten rechts Bild in dieser Serie), die dendritische Struktur steht im Mittelpunkt der Soma und proximalen Dendriten nicht sind. Unter dem jeweiligen Referenzbild ist die Nikotin uncaging-evozierten nach innen aktuelle aufgetragen. (b) inter-Stimulus Intervalle für PA-Nic Photolyse. Vorbild-Aufnahmen sind zeigte für MHb Neuronen wo Nikotin wiederholt uncaged an der gleichen Stelle der Perisomatic mit einem inter-Stimulus-Intervall von 1 s oder 10 s. Klicken Sie bitte hier, um eine größere Version dieser Figur.
Diskussion
Die Wahl der PA-Nic Anwendungsbereitstellung/Methode ist der wichtigste Schritt in diese lokalisierten Foto-Stimulationstechnik. Zwei Methoden, Bad Anwendung und lokalen Perfusion, bietet jedes deutliche Vorteile und Einschränkungen. Die Wahl wird weitgehend durch die nAChR funktionelle Expression in der Zelle Art von Interesse beeinflusst. Es empfiehlt sich, Bad-Anwendung zu verwenden, wenn funktionelle Expression Ebenen hoch sind, denn Bad Anwendung eine einheitliche Sonde Konzentration rund um die aufgezeichneten Zelle ermöglicht, Interpretation der Daten zu erleichtern. Bad Anwendung beseitigt auch die Notwendigkeit einer zweiten Perfusion Pipette in das Gewebe, so dass des gesamten Prozess leichter. Bad Anwendung von teuren Verbindungen jedoch kostet mehr pro Versuch.
Im Allgemeinen beinhaltet Problembehandlung versuchen zu verstehen, warum keine nAChR Aktivierung gesehen folgende Flash Photolyse. Umgang mit einem Zelltyp, die zuvor nicht mit PA-Nic untersucht wurden, sollten die Ermittler lokale Blätterteig-Anwendung von ACh durchführen oder Nikotin um festzustellen, ob genügende Rezeptoren funktional sind ausgedrückt5. Um zu überprüfen, dass das System in der Lage erkennen Photolyse Antworten sollten Experimente in medialen Habenulae Neuronen erfolgen, die große Mengen an Rezeptor30ausdrücken. In diesem Bereich des Gehirns ist PA-Nic Bad Anwendung möglich, was für Validierung Experimente vorzuziehen. Erst nach dieser Validierung experimentieren sollte man auf ein rezenter Zelltyp bewegen. Fügen Sie wenn das experimentelle System validiert wurde und Antworten sehr klein oder nicht nachweisbar bleiben, kann es gerechtfertigt sein, zur Erhöhung der Konzentration von PA-Nic, erhöhen die Blitzintensität oder Pulsdauer, eine nAChR positive allosterische Modulator nAChR verbessern Aktivität-6, oder eine Kombination davon.
Gelegentlich uncaging Antworten sind zu groß, mit signifikanten nAChR Aktivierung wiederum indirekte Spannung gated Na+ Kanal Aktivierung und ausgespannt nach innen Ströme aufgrund schlechter Platz Klemme. Diese Artefakte, die vollständig verdecken nAChR nach innen Strömungen und Interpretation der Daten unmöglich machen, können durch die Aufnahme von QX-314 (2 mM) in die Aufnahme Pipette beseitigt werden. Sie können auch durch eine Verringerung der Konzentration von PA-Nic oder durch eine Verringerung der Blitzintensität oder Pulsdauer beseitigt werden. In allen sichtbaren Foto-Lichtstimulation versuchen müssen die Sorgfalt bei der Auswahl der Stimulation Websites, um unbeabsichtigte Stimulation/Photolyse oberhalb oder unterhalb der gewünschten Brennebene zu vermeiden. Zusätzlich und wenn zutreffend, die Laserleistung muss immer titriert werden, um physiologische Reaktionen zu reproduzieren. Es ist besonders wichtig zu wissen der z-Achse Photostimulation beim Arbeiten mit Käfig Liganden als Liganden, die oberhalb/unterhalb der Brennfleck aktiviert werden können noch diffus und Interaktion mit dem biologischen System (d. h., Rezeptoren) untersucht.
PA-Nic Laser Flash Photolyse möglicherweise nicht geeignet für alle Forscher, wie mehrere Einschränkungen vorhanden sind. Die erste ist die relativ hohen Kosten für eine geeignete Einrichtung. Beim Arbeiten mit intakten Gehirnscheiben uncaging in der Nähe von kleinem Durchmesser Strukturen wie Dendriten erfordert eine ausgefeilte Visualisierung wie ein 2-Photonen-Mikroskop. Abgesehen von der hohen Kosten für eine Exklusivrepräsentation abstimmbaren IR gepulsten Lasers für leistungsstarke 2-Photonen-Mikroskopie, erhöht ein Dual-Galvanometer-System in der Lage, selbständig Positionierung zwei Laserstrahlen weiter die Systemkosten. Gesamtsystem Kosten können reduziert werden, mit einem selbstgebauten System, wenn die Ermittler verfügt über ausreichend Fachwissen und Zeit zu konstruieren, zu beheben und pflegen ein solches System. Eine zweite Einschränkung oft beinhaltet niedrige nAChR funktionelle Expression, die teilweise entschärft werden kann, durch Maßnahmen wie oben erwähnt, aber dies kann keine Garantie für Erfolg. In der Regel einem Liganden aktiviert Strömungen nach Blätterteig-Anwendung des Agonisten nicht messen kann, können PA-Nic Flash Photolyse unter Spannung Klemme nicht akzeptable Ergebnissen führen. Eine dritte Einschränkung betrifft die intrinsische Fluoreszenz von PA-NIC PA-Nic ~ 405 nm Licht absorbiert und strahlt in einem ähnlichen Bereich wie grün fluoreszierendes Protein (GFP) oder Alexa 488-5. Wenn PA-Nic Konzentrationen ~ 1 mM überschreiten, machen diese Fluoreszenz-Eigenschaft eine Herausforderung, gleichzeitig neuronale Strukturen visualisieren es. Um dies zu mindern, ist es wichtig, den Fluss der PA-Nic aus der Perfusion Pipette leicht kontrollieren zu können. In regelmäßigen Abständen wurde die PA-Nic-Strömung gestoppt, um fluoreszierende Moleküle entfernt diffundieren zu lassen. Dies erlaubt die Neuerstellung des Neurons für die Überprüfung der Kassaposition des uncaging Strahls. Eine vierte mögliche Einschränkung zu erwähnen beinhaltet die Verwendung von 405 nm Licht für Photolyse. Kürzere Wellenlängen wie 405 nm sind anfälliger für Streuung in komplexen Gewebe wie ein Gehirn-Scheibe. So bei einem bestimmten Flash-Intensität und Dauer, können uncaging Resonanz-Amplituden und Verfall Kinetik differentiell die Schärfentiefe der uncaging innerhalb der Schicht betroffen sein. Rückschlüsse auf biologische Aspekte der nAChRs sollte diese wichtige Einschränkung berücksichtigt werden.
Diese lokalisierten Laser Flash Photolyse Technik hat kürzlich neue Details über nAChR Neurobiologie aufzudecken eingesetzt. Zum Beispiel verbessert chronische Nikotinexposition Perisomatic und dendritischen nAChR Funktion im medialen Habenulae Neuronen5. Es wurde auch verwendet, um zum ersten Mal zu demonstrieren, dass ventralen Haubengebiet Glutamat Nervenzellen funktionalen nAChRs in ihren Perisomatic und dendritischen Zellen Fächer6ausdrücken. Gibt es viele mögliche zukünftige dieser Technik verwendet, und der Ansatz angewandt werden, zu anderen wichtigen Neuron, die ausdrückliche nAChRs wie kortikale pyramidale Neuronen31 oder Interneuronen in der Großhirnrinde32, Striatum33 bekannt sind , und Hippocampus19. Diese Technik kann auch mit Pharmakologie und/oder nAChR gen Bearbeiten34 zum spezifischen Rezeptor-Subtypen zu verschiedenen neuronalen Kompartimenten lokalisieren kombiniert werden. Der Ansatz kann an andere Cumarin-Käfig Verbindungen, einschließlich, aber nicht beschränkt auf, diejenigen mit PA-Nic5parallel entwickelt leicht angepasst werden. Zu guter Letzt werden PA-Nic Flash Photolyse vielleicht eines Tages verwendet ein Tier wach/Verhalten, um Nikotin Aktion im Roman Verhaltens Pharmakologie Paradigmen zu studieren.
Offenlegungen
D.L.W. dient als bezahlte Berater für die Bruker Nano-Fluoreszenz-Mikroskopie.
Danksagungen
Die Autoren danken Labor-Mitglieder der folgenden nordwestlichen Hauptprüfer: Ryan Drenan, D. James Surmeier, Yevgenia Kozorovitskiy und Anis Auftragnehmer. Diese Arbeit wurde durch die US National Institute of Health (NIH) (Zuschüsse, DA035942 und DA040626, R.M.D.), der PhRMA Stiftung (Stipendium, M.C.A) und HHMI unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Instruments, Consumables, and Miscellaneous Chemicals | |||
| Multiclamp 700B | Molecular Devices Corp. | Patch clamp amplifier | |
| Pneumatic Picopump | World Precision Instruments | PV820 | |
| Micropipette puller | Sutter Instrument Co | P-97 | |
| Temperature Controller | Warner Instruments | TC-324C | |
| Vibrating blade microtome | Leica Biosystems | VT1200S | |
| Ultrafree-MC Centrifugal Filter | MilliporeSigma | UFC30GV0S | internal solution filter |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B150F-4 | patch and local application pipette |
| (-)-Nicotine hydrogen tartrate salt | Glentham | GL9693 | nicotine salt |
| 7-carboxymethylamino-4-methyl coumarin | Janelia Research Campus | PA-Nic by-product | |
| 1-[7-[bis(carboxymethyl)- amino]coumarin-4-yl]methyl-nicotine | Janelia Research Campus | PA-Nic | |
| Euthasol (Pentobarbital Sodium and Phenytoin Sodium) | Virbac | ANADA #200-071 | |
| Alexa FluorTM 488 Hydrazide | ThermoFisher | A10436 | green fill dye |
| Alexa FluorTM 568 Hydrazide | ThermoFisher | A10437 | red fill dye |
| 6-carboxy-AF594 (Alexa Fluor 594) | Janelia Research Campus | red fill dye | |
| QX 314 chloride | Tocris | 2313 | voltage-gated sodium channel blocker |
| Power Meter | ThorLabs | S120C | |
| Name | Company | Catalog Number | Comments |
| Chemicals for Solutions | |||
| N-Methyl-D-glucamine | Sigma | M2004 | |
| Potassium chloride | Sigma | P3911 | |
| Sodium phosphate monobasic monohydrate | Sigma | S9638 | |
| Sodium bicarbonate | Sigma | S6014 | |
| HEPES | Sigma | H3375 | |
| D-(+)-Glucose | Sigma | G5767 | |
| (+)-Sodium L-ascorbate | Sigma | A4034 | |
| Thiourea | Sigma | T8656 | |
| Sodium pyruvate | Sigma | P2256 | |
| Magnesium sulfate heptahydrate | Sigma | 230391 | |
| Calcium chloride dihydrate | Sigma | 223506 | |
| Sodium chloride | Sigma | S9625 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma | E3889 | |
| Adenosine 5′-triphosphate magnesium salt | Sigma | A9187 | |
| Guanosine 5′-triphosphate sodium salt hydrate | Sigma | G8877 | |
| Name | Company | Catalog Number | Comments |
| Components of 2-Photon Microscope | |||
| Ultima Laser Scanner for Olympus BX51 Microscope | Bruker Nano, Inc. | imaging software and galvos | |
| Imaging X-Y galvanometers | Cambridge Technology | ||
| Mai Tai HP1040 | Spectra-Physics | Tuneable IR laser | |
| Pockels cell M350-80-02-BK with M302RM Driver | Conoptics, Inc. | for IR laser attenuation | |
| Integrating Sphere Photodiode Power Sensor | Thorlabs, Inc | laser power pick-off photodiode | |
| Uncaging X-Y galvanometers | Cambridge Technology | ||
| Helios 2-Line Laser Launch | Bruker Nano, Inc. | uncaging laser components | |
| OBIS LX/LS 405 nm (100 mW) | Coherent, Inc. | ||
| OBIS LX/LS 473 nm (75 mW) | Coherent, Inc. | ||
| Point-Photoactivation / Fiber Input Module for Limo Sidecar - Uncaging | Bruker Nano, Inc. | ||
| Name | Company | Catalog Number | Comments |
| Upright Microscope | Olympus | BX51WIF | Upright microscope chasis |
| Objective: Olympus M Plan FL 10x; NA 0.3 WD 11 mm | Olympus | 10x objective | |
| Objective: Olympus M Plan Fluorite 60x/1.0 WD=2mm NIR | Olympus | 60x water-dipping objective | |
| X-Cite 110, four-LED LLG coupled epi-fluorescence light source | Excelitas Technologies | LED Light Source | |
| Epi-Fluorescence Filter: ET-GFP (FITC/CY2) for Epi-Turret | Chroma Technologies | LED Filter for blue light excitation | |
| Epi-Fluorescence Filter: ET-DsRed (TRITC/CY3) for Epi-Turret | Chroma Technologies | LED Filter for green light excitation | |
| B&W CCD camera; Watec, 0.5in B/W CCD | Watec Co., LTD. | CCD camera for patch clamp recording | |
| Name | Company | Catalog Number | Comments |
| External Detectors - Dual Reflected Emission - Olympus Upright (Multi-Alkali, GaAsP) | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | red channel PMT |
| 595/50m | Chroma Technologies | red channel emission filter | |
| 565lpxr | Chroma Technologies | dichroic beam splitter | |
| GaAsP end-on PMT | Hamamatsu | 7422PA-40 | green channel PMT |
| 525/70m | Chroma Technologies | green channel emission filter | |
| High-Speed Shutter for Hamamatsu H7422 PMT | Vincent Associates / Bruker | 517329 | PMT shutter mount |
| Name | Company | Catalog Number | Comments |
| Dodt Gradient Contrast Transmission Detection Module | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | Dodt PMT |
Referenzen
- Zhang, C., et al. Cholinergic tone in ventral tegmental area: Functional organization and behavioral implications. Neurochemistry International. 114, 127-133 (2018).
- Sarter, M., Parikh, V., Howe, W. M. Phasic acetylcholine release and the volume transmission hypothesis: time to move on. Nature Reviews Neuroscience. 10 (5), 383-390 (2009).
- Coyle, J. T., Price, D. L., DeLong, M. R. Alzheimer's disease: a disorder of cortical cholinergic innervation. Science. 219 (4589), 1184-1190 (1983).
- Katz, B., Thesleff, S. A study of the desensitization produced by acetylcholine at the motor end-plate. Journal of Physiology. 138 (1), 63-80 (1957).
- Banala, S., et al. Photoactivatable drugs for nicotinic optopharmacology. Nature Methods. 15 (5), 347-350 (2018).
- Yan, Y., et al. Nicotinic Cholinergic Receptors in VTA Glutamate Neurons Modulate Excitatory Transmission. Cell Reports. 23 (8), 2236-2244 (2018).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. α4α6β2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Molecular Pharmacology. 84 (3), 393-406 (2013).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. Journal of Visualized Experiments. (68), (2012).
- Ren, J., et al. Habenula "cholinergic" neurons co-release glutamate and acetylcholine and activate postsynaptic neurons via distinct transmission modes. Neuron. 69 (3), 445-452 (2011).
- Koppensteiner, P., Melani, R., Ninan, I. A Cooperative Mechanism Involving Ca(2+)-Permeable AMPA Receptors and Retrograde Activation of GABAB Receptors in Interpeduncular Nucleus Plasticity. Cell Reports. 20 (5), 1111-1122 (2017).
- Zhang, J., et al. Presynaptic Excitation via GABAB Receptors in Habenula Cholinergic Neurons Regulates Fear Memory Expression. Cell. 166 (3), 716-728 (2016).
- Chen, E., et al. Altered Baseline and Nicotine-Mediated Behavioral and Cholinergic Profiles in ChAT-Cre Mouse Lines. The Journal of Neuroscience. 38 (9), 2177-2188 (2018).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter increased acetylcholine release in the hippocampus. Neuroscience. 218, 1-11 (2012).
- Ting, J. T., Feng, G. Recombineering strategies for developing next generation BAC transgenic tools for optogenetics and beyond. Frontiers in Behavioral Neuroscience. 8, 111 (2014).
- Crittenden, J. R., Lacey, C. J., Lee, T., Bowden, H. A., Graybiel, A. M. Severe drug-induced repetitive behaviors and striatal overexpression of VAChT in ChAT-ChR2-EYFP BAC transgenic mice. Frontiers in Neural Circuits. 8, 57 (2014).
- Kolisnyk, B., et al. ChAT-ChR2-EYFP mice have enhanced motor endurance but show deficits in attention and several additional cognitive domains. The Journal of Neuroscience. 33 (25), 10427-10438 (2013).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter enhances dendritic complexity of adult-born hippocampal neurons and improves acquisition of spatial memory during aging. Neurobiology of Aging. 36 (5), 1881-1889 (2015).
- Denk, W. Two-photon scanning photochemical microscopy: mapping ligand-gated ion channel distributions. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6629-6633 (1994).
- Khiroug, L., Giniatullin, R., Klein, R. C., Fayuk, D., Yakel, J. L. Functional mapping and Ca2+ regulation of nicotinic acetylcholine receptor channels in rat hippocampal CA1 neurons. The Journal of Neuroscience. 23 (27), 9024-9031 (2003).
- Filevich, O., Salierno, M., Etchenique, R. A caged nicotine with nanosecond range kinetics and visible light sensitivity. Journal of Inorganic Biochemistry. 104 (12), 1248-1251 (2010).
- Tochitsky, I., et al. Optochemical control of genetically engineered neuronal nicotinic acetylcholine receptors. Nature Chemistry. 4 (2), 105-111 (2012).
- Wokosin, D. L., Squirrell, J. M., Eliceiri, K. W., White, J. G. Optical workstation with concurrent, independent multiphoton imaging and experimental laser microbeam capabilities. Review of Scientific Instruments. 74 (1), 193-201 (2003).
- Plotkin, J. L., Day, M., Surmeier, D. J. Synaptically driven state transitions in distal dendrites of striatal spiny neurons. Nature Neuroscience. 14 (7), 881-888 (2011).
- Galtieri, D. J., Estep, C. M., Wokosin, D. L., Traynelis, S., Surmeier, D. J. Pedunculopontine glutamatergic neurons control spike patterning in substantia nigra dopaminergic neurons. Elife. 6, (2017).
- Yasuda, R., et al. Imaging calcium concentration dynamics in small neuronal compartments. Science STKE. (219), pl5 (2004).
- Inoue, S., Spring, K. . Video microscopy: The fundamentals. , 163-186 (1997).
- Zipfel, W. R., Williams, R. M., Webb, W. W. Nonlinear magic: multiphoton microscopy in the biosciences. Nature Biotechnology. 21 (11), 1369-1377 (2003).
- Maravall, M., Mainen, Z. F., Sabatini, B. L., Svoboda, K. Estimating intracellular calcium concentrations and buffering without wavelength ratioing. Biophysical Journal. 78 (5), 2655-2667 (2000).
- Wathey, J. C., Nass, M. M., Lester, H. A. Numerical reconstruction of the quantal event at nicotinic synapses. Biophysical Journal. 27 (1), 145-164 (1979).
- Shih, P. Y., et al. Differential expression and function of nicotinic acetylcholine receptors in subdivisions of medial habenula. The Journal of Neuroscience. 34 (29), 9789-9802 (2014).
- Verhoog, M. B., et al. Layer-specific cholinergic control of human and mouse cortical synaptic plasticity. Nature Communications. 7, 12826 (2016).
- Koukouli, F., et al. Nicotine reverses hypofrontality in animal models of addiction and schizophrenia. Nature Medicine. 23 (3), 347-354 (2017).
- Xiao, C., et al. Chronic nicotine selectively enhances α4β2* nicotinic acetylcholine receptors in the nigrostriatal dopamine pathway. The Journal of Neuroscience. 29 (40), 12428-12439 (2009).
- Peng, C., et al. Gene Editing Vectors for Studying Nicotinic Acetylcholine Receptors in Cholinergic Transmission. European Journal of Neuroscience. , (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten