Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Reconstitución asistida por detergente de Drosophila Atlastin recombinante en liposomas para ensayos de mezcla de lípidos
En este artículo
Resumen
La fusión de membranabiológica es catalizada por proteínas de fusión especializadas. La medición de las propiedades fusogénicas de las proteínas se puede lograr mediante ensayos de mezcla de lípidos. Presentamos un método para purificar la Drosophila atlastin recombinante, una proteína que media la fusión homotípica de la sala de urgencias, reconstituyéndola a liposomas preformados, y probando la capacidad de fusión.
Resumen
La fusión de membranas es un proceso crucial en la célula eucariota. Las proteínas especializadas son necesarias para catalizar la fusión. Las atlastinas son proteínas residentes de retículo endoplasmático (ER) implicadas en la fusión homotípica del ER. Aquí detallamos un método para purificar una glutatión S-transferasa (GST) y poli-histidina etiquetada Drosophila atlastin por dos rondas de cromatografía de afinidad. El estudio in vitro de las reacciones de fusión requiere que las proteínas de fusión purificadas se inserten en una bicapa lipídica. Los liposomas son membranas modelo ideales, ya que la composición y el tamaño de los lípidos pueden ajustarse. Con este fin, describimos un método de reconstitución mediante la eliminación de detergente para Drosophila atlastin en liposomas preformados. Si bien hay varios métodos de reconstitución disponibles, la reconstitución mediante eliminación de detergente tiene varias ventajas que lo hacen adecuado para atlastinas y otras proteínas similares. La ventaja de este método incluye un alto rendimiento de reconstitución y una orientación correcta de la proteína reconstituida. Este método se puede extender a otras proteínas de membrana y para otras aplicaciones que requieren proteoliposomas. Además, describimos un ensayo de mezcla de lípidos basado en FRET de proteoliposomas utilizados como medida de la fusión de membranas.
Introducción
La fusión de membranas es un proceso crítico en muchas reacciones biológicas. En condiciones biológicas, la fusión de membranas no es espontánea y requiere proteínas de fusión especializadas para catalizar tales reacciones1. La fusión de membrana homotípica ER está mediada en animales por la gtamin relacionada con GTPase atlastin2. El papel de Atlastin en la fusión homotípica es fundamental para las uniones de tres vías en ER periférico, que constituye una gran red interconectada de túbulos que se extienden a lo largo de la célula. Las atlastinas tienen una morfología de dominio conservada que consiste en una gran GTPase, un dominio medio de tres helix, un ancla de membrana hidrofóbica y una cola c-terminal citoplasmática corta3. Estudios in vitro con Drosophila atlastin recombinante han demostrado que cuando se reconstituye a liposomas, mantiene sus propiedades fusogénicas. Otras atlastinas, incluidos los homólogos humanos, no han podido recapitular la fusión in vitro. Aquí describimos una metodología para purificar un GST y polihistidina etiquetado sorcombinante Drosophila atlastin, reconstituirlo en liposomas, y decir fusión.
El estudio de la fusión de membrana in vitro presenta un desafío, ya que las proteínas fusogénicas suelen tener un anclaje de membrana. Para estudiarlos, es necesario reconstituirlos en bicapas de lípidos modelo. Las vesículas unilamelares grandes (LUV) son una herramienta útil para estudiar las interacciones con proteínas lipídicas. Presentamos aquí un sistema para hacer LUVs de diferentes composiciones lipídicas para la reconstitución de proteínas y ensayos de fusión. La reconstitución de proteínas integrales en LUVs puede lograrse mediante una variedad de métodos, entrelos que se incluyen la reconstitución orgánica mediada por disolventes, los mecanismos mecánicos o la reconstitución asistida por detergente 4. Aquí presentamos un método para reconstituir Drosophila atlastin en liposomas preformados mediante la eliminación de detergente. Las ventajas de este método de reconstitución incluyen altos rendimientos de reconstitución y la orientación adecuada de la atlastina en la bicapa lipídica. Además, a través de este método, la proteína no se seca ni se expone a disolventes orgánicos, manteniendo así la estructura y la función. Entre sus desventajas, la presencia de detergentes puede no ser ideal para todas las proteínas y los proteoliposomas finales pueden tener algún detergente incorporado en la bicapa lipídica. Se puede utilizar más diálisis para eliminar más detergente. Sin embargo, la diálisis puede tardar mucho tiempo y, por lo tanto, puede conducir a la pérdida de actividad proteica.
La evaluación de la actividad de fusión de atlastin se puede determinar mediante ensayos de mezcla de lípidos como se describió anteriormente2. Aquí, delineamos un método para medir la fusión mediada por atlastina a través de N-(7-nitrobenz-2-oxa-1,3-diazol-4-yl (NBD)/Lissamine rhodamine-B sulfonyl (rhodamine) lípidos etiquetados. Este ensayo requiere la fusión de proteoliposomas de donante (etiquetados) y proteoliposomas aceptadores (sin etiquetar). Una liberación de FRET se puede medir durante la reacción como la dilución de un par donante-aceptador de liposomas "etiquetados" a liposomas "sin etiquetar" como resultado de la mezcla de lípidos durante la fusión de membranas (Figura1)5. Si bien este ensayo sirve como un proxy para la fusión de membranas, se limita a distinguir entre la fusión de membrana y la hefusión, un estado en el que sólo se mezclan los foliolos exteriores. Para abordar este problema, una alternativa es el enfriamiento externo del prospecto de NBD por ditonita. Siguiendo la misma metodología que los ensayos de mezcla de lípidos NBD/rhodamine, al poner en temple el prospecto exterior cualquier liberación de NBD FRET por fusión se deba a la mezcla interna de hilos8.
Ensayos de fusión alternativos por dirección de mezcla de contenido acuoso interno de fusión completa sólo5. Ejemplos de esto son ensayos de terbium (Tb)/ácido dipicolinico (DPA) y ensayos de ácido trisulfónico aminonaftaleno (ANTS)/p-xileno bis(piridinium) bromuro (DPX). En los ensayos Tb/DPA, un grupo de liposomas con Tb encapsulado se mezclan y se fusionan con liposomas con DPA encapsulado; tras la fusión, la fluorescencia aumenta mediante la transferencia interna de energía de DPA a Tb dentro del complejo de 3 quelaciones [Tb(DPA)3]3- complejo de quelación6. Por el contrario, para los ensayos ANTS/DPX, la fluorescencia ANTS se aplaca con DPX7. Mientras que estos sistemas abordan la mezcla de contenido interno, se requiere una preparación más profunda de los liposomas para la eliminación de reactivos no encapsulados, así como la interacción no intencional de los fluoróforos.
Protocolo
1. Purificación de GST-DAtl-His8
-
Expresión de proteínas y preparación de lisados
- Transforme BL21 (DE3) E. coli con la construcción GST-DAtl-His8 en pGEX4-T32 y seleccione en una placa de ampicilina.
- Seleccione un solo transformador e incubar 5 ml de LB + ampicilina (5 l de 100 mg/ml de ampicilina) en un tubo de cultivo de 14 ml e incubar a 25 oC con agitación a 200 rpm durante 6-8 h.
NOTA: Debido a la expresión con fugas, no se recomienda incubar a temperaturas más altas. El crecimiento a 25oC reduce la agregación de proteínas durante este período de crecimiento. - Inocular 200 ml de LB + ampicilina con 1 ml del cultivo de 5 ml e incubar durante la noche (-15–18 h) a 25oC.
- A la mañana siguiente, cosechar las células por centrifugación (2.000 x g durante 10 min) y resuspender en 5 ml de LB.
- Inocular 4 L de LB + ampicilina y medir OD600 (0.05–0.15). Incubar a 25oC con agitación.
NOTA: Reserve algunos medios para que sirvan como espacio en blanco para las mediciones de OD600 antes de agregar bacterias. - Mida600 OD cada hora hasta que llegue a una OD entre 0,4 y 0,5. En este punto, reduzca la temperatura a 16 oC.
- Inducir con IPTG de 0,2 mM (800 ml de 1 M de stock), 10 min después de que la incubadora alcance los 16 oC. Incubar durante la noche (-15–18 h) a 16oC.
NOTA: La temperatura más baja mejora el rendimiento de la proteína funcional al reducir la agregación de atastrotina. - A la mañana siguiente, cosechar las células centrifugando a 7.500 x g a 4 oC.
- Resuspender las células en 200 mL de A200 (25 mM HEPES (pH 7.4) y 200 mM DeKC).
- Centrifugar las células a 11.000 x g durante 5 min a 4oC.
- Resuspenda el pellet en 40 ml de tampón de rotura (A200 más 10% glicerol, 2 mM 2-mercaptoetanol, 4% Triton X-100 (TX100), 40mM de imidazol y una tableta de cóctel inhibidor de proteasa libre de EDTA).
NOTA: Añadir TX-100 después de la resuspending para evitar la generación de burbujas y espuma. - Pasar a través de una aguja de 18 G y pasar las células a través de un disruptor de células tres veces a 10.000 psi.
- Centrifugar el extracto a 125.000 x g durante 1 h.
NOTA: Opcionalmente, disuelva el pellet 1:2 (w:v) en urea de 8 M y nutate a temperatura ambiente durante la noche. La urea como desnaturalizante disolverá lentamente cualquier proteína peletada insoluble para el análisis SDS-PAGE. Ahorre 1 l para el análisis de manchas SDS-PAGE y Coomassie. - Filtrar el extracto a través de un filtro de membrana estéril de nitrato de celulosa de 0,45 m para eliminar bacterias y grandes desechos bacterianos.
NOTA: Opcionalmente, guarde 1 l para el análisis de manchas SDS PAGE y Coomassie.
-
Purificación de proteínas por cromatografía de afinidad
- Cargue el lisado filtrado en una columna de resina de cromatografía de afinidad de metal inmovilizado (IMAC) cargada con Ni2+,preequilibrada con tampón de imidazol bajo (A100 más 10% de glicerol, 2 mM 2-mercaptoetanol, 1% TX-100, 40 mM imidazol) a una velocidad de 1 mL/ a 4oC.
- Lavar la columna con 25 ml de A100 más 10% glicerol, 2 mM 2-mercaptoetanol, 0,1% Anapoe X-100, 40 mM de imidazol con una tasa de 1 ml/min a 4oC. Eluir la proteína con un gradiente lineal de 30 ml de imidazol de 40 mM a 500 mM, y un lavado final de 5 ml a 500 mM.
- Piscina fracciones pico e incubar durante 1 h a 4 oC con cuentas hinchadas GSH-Agarose, previamente hinchadas en agua y equilibradas en A100 con 10% de glicerol, 2 mM 2-mercaptoetanol, 0.1% Anapoe X-100, y 1 mM EDTA.
NOTA: Las perlas GSH-Agarose pueden hincharse en 50 ml de agua el día anterior e incubarse durante la noche a 4oC, o durante 1 h a RT. Para eliminar el agua y el tampón de equilibrio, centrífuga en un rotor de cucharón oscilante a 500 x g durante 1 min sin freno. Aspirar el sobrenadante con una aguja de 26 G. - Pellet GSH-Agarose perlas centrifugando en un rotor de cucharón oscilante a 500 x g sin freno y retire el sobrenadante de lisado por aspiración con una aguja de 26 G.
- Transfiera las perlas a una columna de poliprep de 10 ml y lave cinco veces con 5 ml de tampón de equilibrio (A100 con 10% de glicerol, 2 mM 2-mercaptoetanol, 0.1% Anapoe X-100, y 1 mM EDTA) centrifugando a 500 x g.
- Elute la proteína con 1-1,5 ml de tampón de equilibrio complementado con 10 mM de glutatión reducido. Proteína eluted alícuota y congelación de flash en nitrógeno líquido. La proteína se puede almacenar a -80 oC indefinidamente.
NOTA: Ajuste el pH del búfer de elución a 7.4. - Cuantifique la concentración de proteínas mediante el ensayo de proteínas negras de amido9 y evalúe la pureza mediante la tinción SDS-PAGE y Coomassie.
2. Reconstitución de Atlastin recombinante en liposomas
- Producción de liposomas por método de extrusión 10
- Hacer reservas de mezcla de lípidos en cloroformo (10 mM de lípidos totales). Los lípidos necesarios son 1-palmitoyl-2-oleoyl-glicero-3-fosocolina (POPC), 1,2-dioleoyl-sn-glicero-3-phospho-L-serina (DOPS), 1,2-dioleoyl-sn-glicero-3-fosfoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (NBD-DPPE), y 1,2- dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-(lissamine rhodamine B sulfonyl) (Rh-DPPE). Los liposomas de los acceptores consisten en POPC: DOPS (85:15 molar ratio) y liposomas de donantes de POPC:DOPS:Rh-PE:NBD-PE (83:15:1.5:1.5 relación molar).
NOTA: Mientras que las mezclas de lípidos POPC:DOPS se han utilizado tradicionalmente para ensayos de mezcla de lípidos in vitro, las composiciones alternativas de lípidos pueden adaptarse para diferentes propósitos experimentales. POPC: los liposomas DOPS son muy estables y más difíciles de fusionar, por lo tanto es un sistema muy estricto para la fusión. - Añadir 1 ci/ml de L--dipalmitoyl-fosfatidilcolina (colina metil-3H) a las mezclas de lípidos con el fin de determinar las concentraciones de lípidos en pasos posteriores por recuento de centelleo líquido. Reservar al menos 8 l de este stock.
- Transfiera la cantidad deseada de mezclas de lípidos a tubos de vidrio de sílex.
- Seque las mezclas de lípidos bajo una corriente suave de gas N2 durante 10 min hasta que no se pueda ver más cloroformo.
- Seque aún más la película lipídica en un desecador aspirando durante 30 min.
- Añadir suficiente A100 acuoso con 10% de glicerol, 2 mM 2-mercaptoetanol, y 1 mM EDTA a la película lipídica y devolver la concentración a 10 mM. Resuspende la película lipídica vórtina ligeramente durante 15 minutos a temperatura ambiente. Se recomienda un vórtice que pueda acomodar tubos de vidrio de sílex.
- Congele y descongela los lípidos hidratados en nitrógeno líquido diez veces. Después de congelar en nitrógeno líquido, descongelar los liposomas dejando que la solución se sente a temperatura ambiente durante 30 s, luego transfiera al agua para una descongelación más rápida. Este ciclo de congelación-descongelación minimizará las vesículas multilamellar.
PRECAUCION: Los tubos pueden agrietarse si contienen volúmenes superiores a 0,5 ml y si se transfieren directamente a agua de nitrógeno líquido. - Pasar el lípido a través de filtros de policarbonato con 100 nm tamaño de poro 19 veces utilizando mini extrusor.
- Determinar la concentración total de lípidos de liposomas mediante el recuento de centelleo
NOTA: Algunos de los lípidos pueden quedar atrás en tubos de vidrio y en miniextrusor.- Añadir 4 l de lípidos y liposomas en 3 ml de cóctel de centelleo.
- Mida los recuentos medios por minuto (CPMA) para stock y liposomas. Y calcula la concentración de liposomas con la siguiente fórmula:
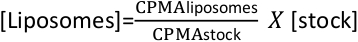
- Almacene los liposomas a 4 oC durante un máximo de una semana. No se recomienda un almacenamiento más largo, ya que los liposomas pueden acumularse con el tiempo, disminuyendo la eficiencia de la reconstitución.
- Hacer reservas de mezcla de lípidos en cloroformo (10 mM de lípidos totales). Los lípidos necesarios son 1-palmitoyl-2-oleoyl-glicero-3-fosocolina (POPC), 1,2-dioleoyl-sn-glicero-3-phospho-L-serina (DOPS), 1,2-dioleoyl-sn-glicero-3-fosfoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (NBD-DPPE), y 1,2- dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-(lissamine rhodamine B sulfonyl) (Rh-DPPE). Los liposomas de los acceptores consisten en POPC: DOPS (85:15 molar ratio) y liposomas de donantes de POPC:DOPS:Rh-PE:NBD-PE (83:15:1.5:1.5 relación molar).
- Reconstitución por incorporación asistida por detergente en liposomas preformados
- Calcule la cantidad de tampón, proteína, liposomas y detergente adicional que se mezclarán:
- Determine el volumen total deseado. Este volumen se compone de tampón A100 con 10% de glicerol, 2 mM 2-mercaptoetanol y 1 mM EDTA. Los volúmenes inferiores a 250 ml no se mezclan bien en tubos de microcentrífuga de 0,5 ml.
- Calcular el volumen de liposomas necesarios para dar una concentración final de lípidos de aproximadamente 1 mM. Reste el volumen del volumen del búfer.
- Calcular el volumen de proteína necesario para dar la relación molar de proteína a lípido deseada (generalmente 1:400). Disminuya el volumen del búfer en consecuencia.
- Determinar cuánto detergente adicional debe añadirse para saturar los liposomas conel objetivo de obtener una relación eficaz entre detergente y lípidos (R eff) entre 0,64–0,8. Recuerde tener en cuenta el detergente que se añade con la proteína. La (Reff) está
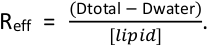 determinada por la ecuación Dtotal es la concentración total de detergente y elagua D es la concentración de detergente monomérico (0,18 mM para TX-100 y Anapoe X-100 en presencia de detergente)4, 11.
determinada por la ecuación Dtotal es la concentración total de detergente y elagua D es la concentración de detergente monomérico (0,18 mM para TX-100 y Anapoe X-100 en presencia de detergente)4, 11.
- Mezcle las soluciones en un tubo de 0,5 ml en el siguiente orden: tampón, detergente, proteína y liposomas. Añadir los liposomas rápidamente y vórtice inmediatamente durante 5 s para homogeneizar la mezcla.
- Incubar la reacción en un nutator durante 1 h a 4oC.
- Hacer 0,2 g/mL de perla de poliestireno no polar adsorbente "slurry" en agua.
NOTA: Hacer que el cordón adsorbente de poliestireno "slurry" durante la incubación de 1 h en el paso 2.2.3. - Pesar 0,2 g de perlas adsorbentes de poliestireno y transferirlas a un tubo de microcentrífuga.
- Desgasifigas las perlas añadiendo 1 ml de metanol al tubo y mezclar durante 1 min. Las cuentas desgasifadas se hundirán.
- Aspira rinde al metanol y añade agua a las cuentas. Deje que las cuentas se mezclen con agua durante 5 minutos, luego aspire el agua. Repita cuatro veces, luego lleve el cordón adsorbente de poliestireno "slurry" a 1 ml de volumen con agua y una concentración final de 0,2 g/ml.
NOTA: Las cuentas aún deben asentarse en la parte inferior del tubo. Si no lo hacen, desgasifique de nuevo. Utilice una aguja de 21 G o superior para aspirar metanol y agua de cuentas. - Calcular la cantidad de perlas adsorbentes de poliestireno necesarias para absorber todo el detergente de cada muestra. 1 g de perlas adsorbentes de poliestireno absorbe 70 mg de TX-100. Para calcular el volumen de lodos de perlas de poliestireno adsorbentes necesarias para cada reacción, divida el detergente total en la reacción (paso 2.2.1.4) por 70 mg y, a continuación, por la concentración de la suspensión de perlas (0,2 g/ml (paso 2.2.7).
- Transfiera la cantidad calculada de perlas de perlas de poliestireno adsorbente a un tubo de 0,5 ml y aspirar el agua.
NOTA: Corte el extremo de una punta de 20-200 l para transferir las perlas, vórtice el tubo justo antes de pipetear para resuspender las cuentas asentadas. - Añadir las muestras al tubo de 0,5 ml que contiene perlas adsorbentes de poliestireno e incubar la muestra de nuez durante 1 h a 4 oC.
- Repita dos veces dejando atrás cuentas viejas y transfiriendo la muestra a cuentas frescas.
- Añadir la muestra a un cuarto tubo con perlas frescas e incubar durante la noche (15–18 h) a 4oC.
- Calcule la cantidad de tampón, proteína, liposomas y detergente adicional que se mezclarán:
- Por la mañana, retire la muestra de las perlas adsorbentes de poliestireno y los agregados de proteína insoluble sin pellets centrifugando durante 10 min a 16.000 x g a 4 oC.
- Recuperar el sobrenadante y determinar la concentración final de lípidos mediante el recuento de centelleo líquido (ver paso 2.1.9.2). Opcionalmente, la concentración de proteínas puede determinarse mediante el ensayo de proteína negra amido9.
NOTA: Para los proteoliposomas de atlastina, se deben realizar ensayos enzimáticos con liposomas frescos. El almacenamiento prolongado a 4 oC o la congelación conduce a una pérdida significativa en la actividad de atlastina.
3. Ensayos de mezcla de lípidos
- Llevar el donante y el aceptador proteoliposomas a una concentración de 0,15 mM cada uno en A100 con 10% glicerol, 2 mM de mercaptoetanol, 1 mM EDTA y 5 mM MgCl2. Cada reacción (50 l) se debe añadir a un pozo en una placa de pozo blanca plana de 96 adecuada para lecturas de fluorescencia. Prepare al menos 4 reacciones, incluyendo un triplicado, y un control negativo sin GTP.
- Coloque la placa en un lector de placas precalentado a 37 oC. Medir la fluorescencia NBD (excitación 460 nm y emisión 535 nm) durante 5 min cada min.
- Inducir la fusión añadiendo 5 mM GTP (5 l de 50 mM GTP).
- Mida la fluorescencia NBD cada minuto durante 1 h.
- Añadir 5 sL de 2,5% p/v n-Dodecíl-D-maltoside para disolver los proteoliposomas y medir la fluorescencia máxima de NBD. Lea la fluorescencia NBD durante 15 min cada minuto.
4. Flotación liposoma en el degradado discontinuo de Iohexol12
- (opcional) Analizar la eficiencia de la reconstitución mediante ensayos de flotación13.
- Preparar un 80% y un 30% w/v iohexol en A100 con 10% glicerol, 2 mM 2-mercaptoetanol, y 1 mM EDTA. El iohexol no se disuelve fácilmente, por lo que debe prepararse un día antes mediante la nuez durante la noche a 4 oC.
- Mezclar a fondo 150 l de 80% de material de iohexol con 150 éL de muestra de proteoliposomas para llevarlo a un 40% de iohexol. Añadir esto a un tubo ultra-claro de 5 x 41 mm2 evitando burbujas.
- Capa 250 l de 30% de material de iohexol lentamente en la parte superior de la muestra para hacer una capa media. Evita las burbujas y perturba la capa inferior. En la parte superior de la capa media, agregue lentamente 50 ml de A100 con 2 mM de 2-mercaptoetanol y 1 mM edTA.
- Centrifugar el gradiente en un rotor de cucharón oscilante a 220.000 x g durante 4 h a 4oC con aceleración lenta y sin rotura.
- Cosecha las capas del degradado y analiza por tinción SDS-PAGE y Coomassie, la cuantificación se puede realizar por densitometría. La proteína reconstituida debe flotar hasta la capa superior, mientras que los agregados de proteínas y lípidos se sedimentarán en la parte inferior o en la capa media.
5. Análisis de la orientación de la proteína reconstituida por proteólisis de trombina
NOTA: La construcción de atlastina reportada aquí tiene un sitio de corte de trombina entre el extremo de la etiqueta N-terminal GST y el comienzo de atlastin. La atlastrina en la orientación correcta tendrá este sitio de corte accesible a la proteasa, mientras que la proteína en la orientación incorrecta estará protegida por la bicapa lipídica.
- Para el ensayo de orientación de proteoliposoma de atolina, reserve al menos 8 ml de proteoliposomas reconstituidos reconstituidos frescos.
- Añadir 8 s de proteoliposomas y 1 l de 1 U/L de trombina. Incubar a 37oC durante 1 h.
- Quench la proteasa con 1 l de 5 mg/ml de cóctel inhibidor de proteasa libre de EDTA e incubar durante 30 min a 37 oC.
- Analice la muestra por tinción SDS-PAGE y Coomassie. La proporción de proteínas sin levadura y sin levadura puede determinarse por la densitometría.
Resultados
La eficacia de la reconstitución de atlastin alastinas se presenta en la Figura2. Los proteoliposomas reconstituidos flotaron en un gradiente discontinuo de iohexol. La proteína no incorporada se sedimentó en la capa inferior (B) o en la capa media (M). La proteína reconstituida flotaría hasta la capa superior (T). Las muestras del gradiente fueron cosechadas y analizadas por tinción SDS-PAGE y Coomassie. La cuantificación del gel por densitometría muestra una eficiencia muy alta de ...
Discusión
Los métodos aquí delinean un método eficiente para purificar, reconstituir y medir la actividad de fusión de atlastina recombinante. Para garantizar altos rendimientos de atlastin funcional se deben considerar algunos pasos críticos. La expresión de atlastina debe realizarse a bajas temperaturas (16oC) para evitar la agregación y se debe apuntar a una concentración final entre 0,4-1,5 mg/ml. La proteína muy diluida no se reconstituirá de forma óptima en una proporción de proteína 1:400 a lípidos. La eficien...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos al Dr. Michael Stern y a su laboratorio sus ideas y comentarios sobre proyectos relacionados con atlastin. Este trabajo fue apoyado por el Instituto Nacional de Ciencias Médicas Generales [R01GM101377] y el Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares [R01NS102676].
Materiales
| Name | Company | Catalog Number | Comments |
| 10 mL poly-prep chromatography columns | Biored | 731-1550 | |
| 10 x 75 mm Flint glass tubes | VWR | 608225-402 | |
| 47 mm diameter, 0.45um pore whatman sterile membrane filters | Whatman | 7141 104 | |
| 96 well white plate | NUNC | 437796 | |
| Anapoe X-100 | Anatrace | 9002-931-1 | |
| Cell disrupter | Avestin | Avestin Emulsiflex C3 | |
| DOPS (1,2-dioleoyl-sn-glycero-3-phospho-L-serine (sodium salt)) | Avanti | 840035P-10mg | DOPS |
| EDTA | Research organics inc. | 6381-92-6 | Ethylenediaminetetraacetic acid |
| EDTA-free protease inhibitor cocktail | Roche | 11873580001 | Complete protease inhibitor |
| Extruder | Sigma Aldrich | Z373400 | Liposofast Basic Extruder |
| GE Akta Prime liquid chromatography system | GE Pharmacia | 8149-30-0006 | |
| Glutathione agarose beads | Sigma aldrich | G4510-50ml | |
| Glycerol | EMD | GX0185-5 | |
| GTP | Sigma Aldrich | 36051-31-7 | Guanosine 5' triphosphate sodium salt hydrate |
| HEPES, acid free | Omnipur | 5330 | |
| Imidazole | fluka | 5670 | |
| Immobilized metal affinity chromatography (IMAC) resin column | GE Healthcare | 17040801 | 1 mL HiTrap Chelating HP immobilized metal affinity chromatography columns |
| Iohexol | Accurate chemical and scientific corporation | AN 7050 BLK | Accudenz/Nycodenz |
| IPTG | Research products international corp. | I56000-100.0 | IPTG, dioxane free |
| L-Glutathione reduced | Sigma-Aldrich | G4251-5g | |
| Magnesium chloride | Fisher | 7791-18-6 | |
| Methanol | Omnisolv | MX0488-1 | |
| NBD-DPPE (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (ammonium salt)) | Avanti | 236495 | NBD-DPPE |
| n-Dodecyl β-D-maltoside | Chem-Impex International | 21950 | |
| Nonpolar polystyrene adsorbent beads | BioRad | 152-3920 | SM2 Biobeads |
| Nuclepore track-etch polycarbonate 19 mm 0.1 um pore membrane | Whatman | 800309 | |
| Optima LE80K Ultra centrifuge | Beckman Coulter | ||
| Phosphatidylcholine, L-α-dipalmitoyl [choline methyl-3H] | ARC | ART0284 | Titriated lipids |
| Plate reader | TECAN | TECAN infinite M200 plate reader | |
| POPC (1-palmitoyl-2-oleoyl-glycero-3-phosphocholine) | Avanti | 850457C-25mg | POPC |
| Potassium chloride | MP | 151944 | |
| Rh-DPPE (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-(lissamine rhodamine B sulfonyl) (ammonium salt)) | Avanti | 236495 | Rh-DPPE |
| Scintillation Cocktail | National Diagnostics | LS-272 | Ecoscint XR Scintillation solution for aqueous or non-aqueous samples |
| Scintillation vials | Beckman | 592928 | Fast turn cap Mini Poly-Q Vial |
| Thrombin | Sigma | T1063-1kU | Thrombin from human plasma |
| Triton X-100 | Fisher | BP151-500 | |
| Ultra-clear centrifuge tubes 5 x 41 mm | Beckman | 344090 | |
| Vortex 9 to 13mm Tube Holder | VWR | 58816-138 | Insert for vortexing flint glass tubes |
| Vortex Insert Retainer | VWR | 58816-132 | Retainer needed for vortex tube holder |
| Vortexer | VWR | 2.235074 | Vortex Genie 2 model G560 |
| β-mercaptoethanol molecular biology grade | Calbiochem | 444203 |
Referencias
- Chernomordik, L. V., Kozlov, M. M. Mechanics of membrane fusion. Nature Structural and Molecular Biology. 15, 675-683 (2008).
- Orso, G., et al. Homotypic fusion of ER membranes requires the dynamin-like GTPase Atlastin. Nature. 460, 978-983 (2009).
- McNew, J. A., Sondermann, H., Lee, T., Stern, M., Brandizzi, F. GTP-dependent membrane fusion. Annual Review of Cell and Developmental Biology. 29, 529-550 (2013).
- Rigaud, J. L., Pitard, B., Levy, D. Reconstitution of membrane proteins into liposomes: application to energy-transducing membrane proteins. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1231, 223-246 (1995).
- Düzgüneş, N. Fluorescence Assays for Liposome Fusion. Methods in Enzymology. 372, 260-274 (2003).
- Wilschut, J., Duzgunes, N., Fraley, R., Papahadjopoulos, D. Studies on the mechanism of membrane fusion: kinetics of calcium ion induced fusion of phosphatidylserine vesicles followed by a new assay for mixing of aqueous vesicle contents. Biochemistry. 19, 6011-6021 (1980).
- Ellens, H., Bentz, J., Szoka, F. C. Proton- and calcium-induced fusion and destabilization of liposomes. Biochemistry. 24, 3099-3106 (1985).
- Meers, P., Ali, S., Erukulla, R., Janoff, A. S. Novel inner monolayer fusion assays reveal differential monolayer mixing associated with cation-dependent membrane fusion. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1467, 277-243 (2000).
- Schaffner, W., Weissmann, C. A rapid, sensitive, and specific method for the determination of protein in dilute solution. Analytical Biochemistry. 56, 502-514 (1973).
- MacDonald, R. C., et al. Small-volume extrusion apparatus for preparation of large, unilamellar vesicles. Biochimica Et Biophysica Acta. 1061, 297-303 (1991).
- Paternostre, M. T., Roux, M., Rigaud, J. L. Mechanisms of membrane protein insertion into liposomes during reconstitution procedures involving the use of detergents. 1. Solubilization of large unilamellar liposomes (prepared by reverse-phase evaporation) by Triton X-100, octyl glucoside, and sodium cholate. Biochemistry. 27, 2668-2677 (1988).
- Scott, B. L., et al. Liposome Fusion Assay to Monitor Intracellular Membrane Fusion Machines. Methods in Enzymology. 372, 274-300 (2003).
- Zhang, W., et al. Crystal structure of an orthomyxovirus matrix protein reveals mechanisms for self-polymerization and membrane association. PNAS. 114, 8550-8555 (2017).
- Parlati, F., et al. Rapid and efficient fusion of phospholipid vesicles by the α-helical core of a SNARE complex in the absence of an N-terminal regulatory domain. PNAS. 96, 12565-12570 (1999).
- Sugiura, S., Mima, J. Physiological lipid composition is vital for homotypic ER membrane fusion mediated by the dynamin-related GTPase Sey1p. Scientific Reports. 6, 20407 (2016).
- Powers, R. E., Wang, S., Liu, T. Y., Rapoport, T. A. Reconstitution of the tubular endoplasmic reticulum network with purified components. Nature. 543, 257-260 (2017).
- Betancourt-Solis, M. A., Desai, T., McNew, J. A. The atlastin membrane anchor forms an intramembrane hairpin that does not span the phospholipid bilayer. Journal of Biological Chemistry. 293, 18514-18524 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados