Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Una lesión de globo segmentario controlada por presión arterial carótida de rata con aplicación terapéutica periavential
En este artículo
Resumen
La lesión del globo arterial carótido de rata imita el procedimiento clínico de angioplastia realizado para restaurar el flujo sanguíneo en vasos ateroscleróticos. Este modelo induce la respuesta a lesiones arteriales al desprestir la pared arterial, y desnudar la capa intimal de las células endoteliales, causando en última instancia remodelación y una respuesta hiperplástica intimal.
Resumen
Las enfermedades cardiovasculares siguen siendo la principal causa de muerte y discapacidad en todo el mundo, en parte debido a la aterosclerosis. La placa aterosclerótica estrecha la superficie luminal en las arterias, reduciendo así el flujo sanguíneo adecuado a órganos y tejidos distales. Clínicamente, los procedimientos de revascularización como la angioplastia con o sin colocación de stent tienen como objetivo restaurar el flujo sanguíneo. Aunque estos procedimientos restablecen el flujo sanguíneo reduciendo la carga de la placa, dañan la pared del vaso, lo que inicia la respuesta de curación arterial. La respuesta curativa prolongada causa restenosis arterial, o rea estrechamiento, limitando en última instancia el éxito a largo plazo de estos procedimientos de revascularización. Por lo tanto, los modelos animales preclínicos son integrales para analizar los mecanismos fisiológicos que impulsan la restenosis, y proporcionan la oportunidad de probar nuevas estrategias terapéuticas. Los modelos murinos son más baratos y fáciles de operar que los modelos animales grandes. Las lesiones por balón o alambre son las dos modalidades de lesiones comúnmente aceptadas utilizadas en modelos murinos. Los modelos de lesiones por balón en particular imitan el procedimiento de angioplastia clínica y causan daños adecuados a la arteria para el desarrollo de la restenosis. Aquí describimos los detalles quirúrgicos para realizar y analizar histológicamente el modelo modificado de lesión del globo arterial carótido de rata controlado por presión. Además, este protocolo destaca cómo la aplicación periavential local de terapias se puede utilizar para inhibir la hiperplasia neointimal. Por último, presentamos la microscopía de fluorescencia de la hoja de luz como un enfoque novedoso para la toma de imágenes y la visualización de la lesión arterial en tres dimensiones.
Introducción
Las enfermedades cardiovasculares (ECV) siguen siendo la principal causa de muerte en todo el mundo1. La aterosclerosis es la causa subyacente de la mayor parte de la morbilidad y mortalidad relacionadas con la ECV. La aterosclerosis es la acumulación de placa dentro de las arterias que resulta en un lumen estrechado, dificultando la perfusión adecuada de sangre a los órganos y tejidos distales2. Las intervenciones clínicas para el tratamiento de la aterosclerosis grave incluyen angioplastia con o sin colocación de stent. Esta intervención consiste en avanzar un catéter de globo hacia el lugar de la placa, e inflar el globo para comprimir la placa a la pared arterial, ensanchando el área luminal. Este procedimiento daña la arteria, sin embargo, iniciando la respuesta a lesiones arteriales3. La activación prolongada de esta respuesta a lesiones conduce a la restenosis arterial, o rea estrechamiento, secundaria a la hiperplasia neointimal y la remodelación de los vasos. Durante la angioplastia, la capa intimal se denuda de células endoteliales que conducen al reclutamiento inmediato de plaquetas y a la inflamación local. La señalización local induce cambios fenotípicos en las células musculares lisas vasculares (VSMC) y fibroblastos adventitiales. Esto conduce a la migración y proliferación de VSMC y fibroblastos hacia adentro hacia el lumen, lo que conduce a la hiperplasia neointimal4,5. Las células progenitoras circulantes y las células inmunes también contribuyen al volumen total de restenosis6. En su caso, los stents que eluden fármacos (DES) son el estándar actual para inhibir la restenosis7. Sin embargo, el DES inhibe la redotelización arterial, creando así un ambiente pro-trombótico que puede resultar en trombosis tardía en el stent8. Por lo tanto, los modelos animales son integrales tanto para entender la fisiopatología de la restenosis, como para desarrollar mejores estrategias terapéuticas para prolongar la eficacia de los procedimientos de revascularización.
Varios modelos animales grandes y pequeños9 se utilizan para estudiar esta patología. Estos incluyen lesión de balón3,10 o lesión de alambre11 del lado luminal de una arteria, así como ligadura parcial12 o colocación del manguito13 alrededor de la arteria. Tanto el balón como la lesión del alambre denudan la capa endotelial de la arteria, imitando lo que ocurre clínicamente después de la angioplastia. En particular, los modelos de lesiones por balón utilizan herramientas similares a las del entorno clínico (es decir, catéter de globo). La lesión del globo se realiza mejor en modelos de ratas, ya que las arterias de rata son de un tamaño adecuado para los catéteres de globo disponibles comercialmente. Aquí describimos una lesión arterial segmental controlada por presión, una versión bien establecida y modificada de la lesión del globo arterial carótido de rata. Este enfoque controlado por presión imita estrechamente el procedimiento de angioplastia clínica, y permite la formación reproducible de hiperplasia neointimal dos semanas después de la lesión14,15. Además, esta lesión arterial controlada por presión resulta en una restauración completa de la capa endotelial 2 semanas después de la cirugía16. Esto contrasta directamente con el modelo original de lesiones en globo, descrito por Clowes, donde la capa endotelial nunca vuelve a la cobertura completa3.
Después de la cirugía, las terapias pueden aplicarse o dirigirse hacia la arteria lesionada a través de varios enfoques. El método descrito aquí utiliza la aplicación periavential de una molécula pequeña incrustada en una solución de gel plurónico. En concreto, aplicamos una solución de 100 μM de aldehído cinámico en gel Pluronic-F127 al 25% inmediatamente después de una lesión para inhibir la formación de hiperplasia neointimal15. Pluronic-F127 es un gel termo reversible no tóxico capaz de suministrar medicamentos localmente de forma controlada17. Mientras tanto, la lesión arterial es local, por lo tanto la administración local permite probar un principio activo mientras minimiza los efectos fuera del objetivo. Sin embargo, la entrega efectiva de un método terapéutico con este método dependerá de la química de la molécula pequeña o biológico utilizado.
Protocolo
Todos los métodos descritos aquí han sido aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Carolina del Norte en Chapel Hill.
1. Procedimientos preoperatorios
- Esterilizar instrumentos quirúrgicos. Autoclave todos los instrumentos quirúrgicos antes de la cirugía. Si realiza varias cirugías el mismo día, esterilizar instrumentos entre cirugías utilizando un esterilizador de cuentas secas.
- Preparar terapéutico en gel Pluronic-127 al 25% (diluido en agua destilada estéril).
- Coloque un catéter de globo Fogarty de 2F en el insuflador y coloque el extremo del globo del catéter en una jeringa de 1 ml llena de solución salina.
- Induzca la anestesia colocando la rata en una cámara con un 5% de isoflurano.
- Retire la rata de la cámara y registre el peso de la rata. Use cortapelas para afeitarse el pelaje en la región ventral del cuello.
- Coloque la rata de nuevo en la cámara con un 5% de isoflurano para asegurar la inducción de anestesia.
- Coloque la rata supina en una plataforma quirúrgica, insertando la cara en el cono nasal para que la cara de la rata esté hacia el cirujano.
- Reduzca la anestesia inhalacional al 1,5% de isoflurano. Verifique la profundidad de la anestesia mediante un reflejo de pellizcar los dedos del pie en los cuatro pies.
- Tape las cuatro patas hasta la plataforma quirúrgica.
- Encienda la lámpara de calor.
- Inyectar Atropina (0,01 mg/kg) subcutáneamente para reducir las secreciones de las vías respiratorias.
- Inyectar carprofeno (5 mg/kg) por vía subcutánea para el control profiláctico del dolor. Si los antiinflamatorios no son aceptables para el experimento, consulte los pasos 3.2.2 y 3.2.3.
- Aplique ungüento ocular lubricante en ambos ojos con un hisopo de algodón estéril para evitar que las córneas se sequen durante la cirugía.
- Frotar el cuello tres veces en un movimiento circular alternando entre un 70% de alcohol etílico seguido de Betadine desde el centro de la región afeitada hacia afuera para esterilizar el sitio de la incisión.
- Infiltrarse en la línea de incisión s.c. con 0.25% bupivacaína.
- Ponte guantes quirúrgicos estériles antes de manipular instrumentos y suministros quirúrgicos estériles.
- Poner todos los instrumentos quirúrgicos autoclavados en una hoja quirúrgica estéril.
- Cortar tres hebras independientes de 1 pulgada de sutura estéril de 7-0 Prolene.
- Coloque hisopos de algodón y gasa en la hoja quirúrgica.
- Cubre a la rata con una lámina quirúrgica estéril que solo expone la región esterilizada del cuello.
- Corte una abertura pequeña adicional en la hoja que expone parte del cono nasal. Este será el sitio para grabar el catéter del globo durante la lesión.
2. Procedimientos operativos
- Durante todo el procedimiento quirúrgico, evalúe la profundidad de la anestesia mediante el seguimiento de la frecuencia respiratoria (la tasa debe ser consistente y considerada normal), así como pellizcar los dedos del pie cada 15 minutos. Si la frecuencia respiratoria aumenta o hay una respuesta a la pellizco del dedo del pie, entonces detenga la manipulación quirúrgica y aumente el isoflurano hasta un 2,5%.
- Exponer la arteria carótida común (CCA).
- Haga una incisión superficial, recta y longitudinal del escote entre los huesos de la mandíbula de la rata. La incisión tendrá aproximadamente 1,5-2 cm de longitud.
- Haga una incisión a través del tejido conectivo debajo de la piel hasta que la capa muscular esté expuesta. Desplazar las glándulas salivales debajo de la piel para acceder al tejido muscular.
- Separe sin rodeos el tejido conectivo del músculo insertando tijeras cerradas entre la capa muscular y el tejido conectivo y abriendo suavemente la tijera mientras tira de la piel hacia arriba.
- Diseccionar los dos músculos visibles (esternohiide y esternóstoide) longitudinalmente a lo largo del lado izquierdo de la tráquea hasta que se observa un tercer músculo (omohído) que corre perpendicular a los dos músculos superficiales.
- Utilice fórceps para crear una ventana que separa este músculo perpendicular (omohído) del músculo longitudinal (estenohído) corriendo sobre la tráquea. Realice suavemente esta separación para evitar traumatismos contundentes en la tráquea.
- Alcanza fórceps debajo del músculo perpendicular y corta para separar los dos músculos longitudinales y exponer el CCA.
- Diseccionar el CCA.
- Diseccionar la CCA cerca de la bifurcación hasta que se expongan la arteria carótida interna (ICA) y la arteria carótida externa (ECA).
- Diseccionar la arteria tiroidea superior (STA), que se ramifica del TCE.
- Utilizando las suturas de proleno precortado, ligar el STA y el TCE cerca de su respectiva bifurcación. Deje la mayoría de la sutura a un lado del nudo y agarre cada sutura con una hemostat curva.
- Termina de diseccionar alrededor del ICA, alcanza fórceps debajo y alrededor del ICA, y usa una abrazadera vascular no aplastante para lograr el control distal. Sujete la arteria occipital junto con el ICA.
- Disecciona el CCA proximal a la bifurcación, asegurando separar el nervio vago de la CCA.
- Alcanza fórceps debajo y alrededor de la CCA y usa una abrazadera vascular no aplastante para lograr un control proximal. Coloque la abrazadera al menos 5 mm de la bifurcación.
- Realice lesiones en el globo.
- Maniobrar los hemostats curvos que sostienen cada rama de arteria ligada para exponer la bifurcación entre el TCE y la rama superior.
- Disecciona suavemente el tejido en la bifurcación y luego hace una incisión de arteriotomía entre el TCE y la rama superior usando tijeras de microdisección.
- Use un hisopo de algodón para sacar toda la sangre de la CCA y limpiar el sitio de arteriotomía.
- Inserte el catéter de globo sin inflar a través de la arteriotomía y avance hacia la CCA hasta que el extremo proximal del globo haya pasado la bifurcación.
- Cinta catéter al cono nasal para que el globo no se escape de la arteria durante la inflación.
- Infla lentamente el balón a 5 atmósferas de presión y deja en la CCA durante 5 minutos para inducir lesiones arteriales. Asegúrese de que la presión se mantenga constante durante todo el 5 min.
- Después de 5 min, desinflar el globo y retirar suavemente de la CCA a través de la arteriotomía.
- Enjuague el CCA apretando suavemente la abrazadera en el CCA. No retire la abrazadera.
- Ligar el TCE proximal a la arteriotomía y luego retirar las abrazaderas de la CCA y el ICA para restaurar el flujo sanguíneo a través de la CCA al ICA. Asegúrese de que no haya sangrado visible alrededor de la arteriotomía y de que el CCA esté pulsando.
- Aplicar 100 μL de vehículo de gel terapéutico o plurónico solo periaventialmente a lo largo de la CCA lesionada. Para ello, aplique 50 μL en el lado izquierdo de la CCA y, a continuación, 50 μL en el lado derecho de la CCA para garantizar el recubrimiento uniforme de la arteria lesionada.
- Cierre el sitio de la herida.
- Corte el exceso de suturas de proleno.
- Cierre la herida usando capas de vicryl interrumpidas 4-0 o 6-0 a lo largo del tejido conectivo.
- Termina de cerrar la herida usando sutura de nylon 4-0 a lo largo de la piel.
3. Procedimientos postoperatorios
- Coloque a la rata sola en una jaula limpia con la mitad de la jaula debajo de una lámpara de calefacción y monitoree hasta que la rata recupere suficiente conciencia para mantener la recumbencia severa. Mantenga a la rata en una jaula separada hasta que el animal esté completamente alerta y móvil antes de transferirla de vuelta a su jaula original.
- Monitoree la rata diariamente durante los próximos tres días y luego tres veces por semana hasta la eutanasia. Eutanasia usando sobredosis de isoflurano seguida de toracotomía bilateral como se describe a continuación.
- Utilizar el Centro Nacional para el Refinamiento de Reemplazo y Reducción de Animales en La Investigación (NC3R) escala de mueca para identificar los niveles de dolor postoperatorio. Si algún animal parece estar experimentando dolor o desarrollar algún compromiso neurológico, transfiére inmediatamente.
- Para animales que no reciben carprofeno, administrar paracetamol 6 mg/ml en su agua potable 24 h antes de la cirugía a través de 48 h después de la cirugía. El paracetamol proporciona analgesia con efectos antiinflamatorios mínimos.
- Alternativamente, se pueden utilizar otras estrategias de analgesia con efectos antiinflamatorios mínimos, como la buprenorfina o la liberación prolongada de buprenorfina. Consulte al equipo veterinario de su institución.
4. Cosecha de tejidos e imágenes
- Dos semanas después de la cirugía, eutanasia a la rata por sobredosis de anestesia (5% isoflurano). Alternativamente, eutanasiar ratas en un momento anterior para analizar los diversos aspectos de la respuesta a lesiones arteriales.
- Una vez que la respiración se detiene realizar la toracotomía bilateral como un método secundario de eutanasia.
- Hacer una incisión lateral a través del abdomen, y luego cortar hacia arriba, a través del diafragma y las costillas, exponiendo la cavidad torácica.
- Perfundir y arreglar las arterias.
- Inserte una cánula de 18 G unida a un sistema gravitacional de fijación de perfusión a través del ventrículo izquierdo. Mantenga una presión equivalente entre ratas marcando la altura del sistema de perfusión en relación con la sobremesa (elevación de 120 cm, equivalente a 91 ± 3 mmHg).
- Sujete la cánula junto con el ventrículo con una hemostat curva.
- Hacer un corte en el atrio derecho, abrir el circuito vascular, y comenzar la perfusión con PBS seguido de 2-4% paraformaldehído (alrededor de 250 mL cada uno).
- Preparar paraformaldehído diluido en PBS el día del sacrificio, o como mucho la noche antes del sacrificio. Si se prepara el día del sacrificio, asegúrese de que el paraformaldehído se haya enfriado a temperatura ambiente antes de comenzar la perfusión. Almacene paraformaldehído a 4 °C.
- Después de la fijación, extraiga las arterias carótidas izquierda y derecha y guárdelas a 4 °C durante 2 h en 2-4% paraformaldehído.
- Transfiera las arterias al 30% de sacarosa y almacene durante la noche a 4 °C.
- Después de 16-24 h, incrustar las arterias en el compuesto de temperatura de corte óptima (OCT) y congelar bloques de arterias incrustadas en OCT.
- Acondicione las arterias en OCT a temperatura ambiente durante 10 minutos. Coloque la arteria paralela al plano del criomold lleno de OCT, marcando el lado de la criomold a la que se enfrenta la bifurcación arterial. Congelación de nitrógeno líquido.
- Almacene bloques congelados a largo plazo a -80 °C.
- Sección bloques congelados usando un criostato.
- Recoger seis secciones transversales arteriales de 5 μm de espesor por diapositiva, con la diapositiva 1 a partir de la bifurcación.
- Sección bloques congelados hasta que la hiperplasia ya no sea visible (alrededor de 100 diapositivas).
- La mancha de hematoxilina y eosina (H&E) se desliza18
- Encuentra el área de lesiones manchando uno de cada diez toboganes a lo largo de toda la arteria a partir de la bifurcación (por ejemplo, diapositivas 1, 10, 20, 30, 40, 50, 60, 70, 80, 90 y 100).
- Manchar diapositivas adicionales alrededor del sitio de las lesiones para encontrar el tobogán con oclusión máxima (por ejemplo, las diapositivas 20, 30 y 40 tenían hiperplasia visible, por lo que las diapositivas de manchas 15, 25, 35 y 45).
- Manchar y cuantificar el tobogán con oclusión máxima y deslizamientos equidistantes antes y después de la diapositiva de oclusión pico (por ejemplo, oclusión pico que se encuentra en la diapositiva 35, luego manchar y cuantificar diapositivas 25, 45, etc.) para un total de 3-10 diapositivas por rata.
- Para imágenes de microscopía de fluorescencia de lámina de luz, almacene las arterias durante la noche a 4 °C después de la fijación en el paso 4.4.
- Arteria de sonda con dilución de 1:500 de anticuerpo primario anti-CD31 de conejo en diluyente (pH 7.4) durante 3 días. A continuación, contrarresta la arteria con 1:500 dilución del anticuerpo secundario Alexa Fluor 647 del antitulato durante 2 días19.
- Borre la arteria con iDISCO+20.
- Imagen de la arteria utilizando una lámina de luz microscopio de fluorescencia21. Renderice imágenes utilizando software (por ejemplo, Imaris)19.
- Cuantificar la hiperplasia neointimal. Realice la cuantificación de forma cegada si es posible.
- Utilice el software ImageJ para trazar el perímetro de la intima, lamina elástica interna (IEL) y lamina elástica externa (ANGUILA) de una arteria en cada una de las diapositivas 3-10 determinadas anteriormente (paso 4.8.3).
- Cuantifique el área de cada región trazada en ImageJ y exporte estos valores. La traza intima produce el área de lúmenes, la traza IEL produce el área IEL, y la traza EEL produce el área EEL.
- Promedia los valores obtenidos de las diapositivas de 3-10 para obtener la lesión promedio (% oclusión, relación intima:media (I:M), hiperplasia neointimal) por arteria carótida de rata.
Hiperplasia neointimal = área IEL - Área de Lumen
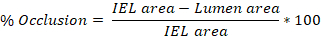
Resultados
La Figura 1 muestra todos los materiales y herramientas quirúrgicas utilizadas para realizar esta cirugía. La tinción de hematoxilina y eosina (H&E) de secciones transversales arteriales lesionadas de dos semanas permite una visualización clara de la hiperplasia neointimal. La Figura 2 muestra imágenes representativas de las secciones transversales arteriales manchadas de H&E de una arteria sana, herida y tratada. La Figura 2 t...
Discusión
La lesión del globo arterial carótido de rata es uno de los modelos animales de restenosis más utilizados y estudiados. Tanto el modelo original de lesión de globo3 como la variación de lesiones segmentales modificada controlada por presión10 han informado de muchos aspectos de la respuesta a lesiones arteriales que también se produce en los seres humanos, siendo las pocas limitaciones que rara vez se desarrolla el trombo rico en fibrina y la inflamación local es m?...
Divulgaciones
Los autores declaran que no hay conflictos de interés con respecto a la publicación de este manuscrito.
Agradecimientos
N.E.B. recibió el apoyo de una beca de capacitación del Instituto Nacional de Ciencias de la Salud Ambiental (5T32ES007126-35, 2018), y una beca predoctoral de la Asociación Americana del Corazón (20PRE35120321). E.S.M.B. fue un académico de KL2 parcialmente apoyado por el Programa de Académicos clínicos y traslacionales de la UNC (KL2TR002490, 2018), y el Instituto Nacional del Corazón, los Pulmones y la Sangre (K01HL145354). Los autores agradecen al Dr. Pablo Ariel del Laboratorio de Servicios de Microscopía de la UNC por ayudar con LSFM. La microscopía de fluorescencia de lámina de luz se realizó en el Laboratorio de Servicios de Microscopía. El Laboratorio de Servicios de Microscopía, Departamento de Patología y Medicina de Laboratorio, es apoyado en parte por P30 CA016086 Cancer Center Core Support Grant al UnC Lineberger Comprehensive Cancer Center.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | Fisher | 14955450 | |
| 1 mL Syringe with needle | BD | 309626 | |
| 2 French Fogarty Balloon Embolectomy Catheter | Edwards LifeSciences | 120602F | |
| 4-0 Ethilon (Nylon) Suture | Ethicon Inc | 662H | |
| 4-0 Vicryl Suture | Ethicon Inc | J214H | |
| 7-0 Prolene Suture | Ethicon Inc | 8800H | |
| 70% ethyl alcohol | |||
| Anti-Rabbit Alexa Fluor 647 | Thermo Fisher Scientific | A21245 | |
| Atropine Sulfate | Vedco Inc | for veterinary use | |
| Cotton Swabs | Puritan | 806-WC | |
| Curved Hemostats | Fine Science Tools | 13009-12 | |
| Fine Curved Forceps | Fine Science Tools | 11203-25 | |
| Fine Scissors | Fine Science Tools | 14090-11 | |
| Gauze | Covidien | 2252 | |
| IHC-Tek Diluent (pH 7.4) | IHC World | IW-1000 | |
| Insufflator | Merit Medical | IN4130 | |
| Iodine solution | |||
| Lubricating Eye Ointment | Dechra | for veterinary use | |
| Mayo Scissors | Fine Science Tools | 14010-15 | |
| Micro Serrefines | Fine Science Tools | 18055-05 | |
| Microdissection Scissors | Fine Science Tools | 15004-08 | |
| Micro-Serrefine Clamp Applying Forceps | Fine Science Tools | 18057-14 | |
| Needle Holder | Fine Science Tools | 12003-15 | |
| Pluronic-127 (diluted in sterile water) | Sigma-Aldrich | P2443 | 25% prepared |
| Rabbit Anti-CD31 | Abcam | ab28364 | |
| Retractor | Bent paper clips work well | ||
| Rimadyl (Carprofen) | Zoetis Inc | for veterinary use | |
| Saline solution | |||
| Standard Forceps | Fine Science Tools | 11006-12 | |
| Sterile Drape | Dynarex | 4410 | |
| T-Pins |
Referencias
- American Heart Association. Cardiovascular Disease: A Costly Burden for America, Projections Through 2035. American Heart Association CVD Burden Report. , (2017).
- Singh, R. B., Mengi, S. A., Xu, Y. J., Arneja, A. S., Dhalla, N. S. Pathogenesis of atherosclerosis: A multifactorial process. Experimental and Clinical Cardiology. 7 (1), 40-53 (2002).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Mechanisms of stenosis after arterial injury. Laboratory Investigation. 49 (2), 208-215 (1983).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Kinetics of cellular proliferation after arterial injury. I. Smooth muscle growth in the absence of endothelium. Laboratory Investigation. 49 (3), 327-333 (1983).
- Sartore, S., et al. Contribution of adventitial fibroblasts to neointima formation and vascular remodeling: from innocent bystander to active participant. Circulation Research. 89 (12), 1111-1121 (2001).
- Tanaka, K., et al. Circulating progenitor cells contribute to neointimal formation in nonirradiated chimeric mice. The FASEB Journal. 22 (2), 428-436 (2008).
- Henry, M., et al. Carotid angioplasty and stenting under protection. Techniques, results and limitations. The Journal of Cardiovascular Surgery. 47 (5), 519-546 (2006).
- Kounis, N. G., et al. Thrombotic responses to coronary stents, bioresorbable scaffolds and the Kounis hypersensitivity-associated acute thrombotic syndrome. Journal of Thoracic Disease. 9 (4), 1155-1164 (2017).
- Jackson, C. L. Animal models of restenosis. Trends in Cardiovascular Medicine. 4 (3), 122-130 (1994).
- Shears, L. L., et al. Efficient inhibition of intimal hyperplasia by adenovirus-mediated inducible nitric oxide synthase gene transfer to rats and pigs in vivo. Journal of the American College of Surgeons. 187 (3), 295-306 (1998).
- Takayama, T., et al. A murine model of arterial restenosis: technical aspects of femoral wire injury. Journal of Visualized Experiments. (97), (2015).
- Zhang, L. N., Parkinson, J. F., Haskell, C., Wang, Y. X. Mechanisms of intimal hyperplasia learned from a murine carotid artery ligation model. Current Vascular Pharmacology. 6 (1), 37-43 (2008).
- Jahnke, T., et al. Characterization of a new double-injury restenosis model in the rat aorta. Journal of Endovascular Therapy. 12 (3), 318-331 (2005).
- Gregory, E. K., et al. Periadventitial atRA citrate-based polyester membranes reduce neointimal hyperplasia and restenosis after carotid injury in rats. American Journal of Physiology-Heart and Circulatory Physiology. 307 (10), 1419-1429 (2014).
- Buglak, N. E., Jiang, W., Bahnson, E. S. M. Cinnamic aldehyde inhibits vascular smooth muscle cell proliferation and neointimal hyperplasia in Zucker Diabetic Fatty rats. Redox Biology. 19, 166-178 (2018).
- Bahnson, E. S., et al. Long-term effect of PROLI/NO on cellular proliferation and phenotype after arterial injury. Free Radical Biology and Medicine. 90, 272-286 (2016).
- Gilbert, J. C. W., Davies, M. C., Hadgraft, J. The behaviour of Pluronic F127 in aqueous solution studied using fluorescent probes. International Journal of Pharmaceutics. 40 (1-2), 93-99 (1987).
- Tulis, D. A. Histological and morphometric analyses for rat carotid balloon injury model. Methods in Molecular Medicine. 139, 31-66 (2007).
- Buglak, N. E., et al. Light Sheet Fluorescence Microscopy as a New Method for Unbiased Three-Dimensional Analysis of Vascular Injury. Cardiovascular Research. , (2020).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Ariel, P. . UltraMicroscope II - A User Guide. , (2018).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Xiangdong, L., et al. Animal models for the atherosclerosis research: a review. Protein Cell. 2 (3), 189-201 (2011).
- Chen, H., Li, D., Liu, M. Novel Rat Models for Atherosclerosis. Journal of Cardiology and Cardiovascular Sceinces. 2 (2), 29-33 (2018).
- Xing, D., Nozell, S., Chen, Y. F., Hage, F., Oparil, S. Estrogen and mechanisms of vascular protection. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (3), 289-295 (2009).
- Tulis, D. A. Rat carotid artery balloon injury model. Methods in Molecular Medicine. 139, 1-30 (2007).
- Pellet-Many, C., et al. Neuropilins 1 and 2 mediate neointimal hyperplasia and re-endothelialization following arterial injury. Cardiovascular Research. 108 (2), 288-298 (2015).
- Wu, B., et al. Perivascular delivery of resolvin D1 inhibits neointimal hyperplasia in a rat model of arterial injury. Journal of Vascular Surgery. 65 (1), 207-217 (2017).
- Tan, J., Yang, L., Liu, C., Yan, Z. MicroRNA-26a targets MAPK6 to inhibit smooth muscle cell proliferation and vein graft neointimal hyperplasia. Scientific Reports. 7, 46602 (2017).
- Pearce, C. G., et al. Beneficial effect of a short-acting NO donor for the prevention of neointimal hyperplasia. Free Radical Biology and Medicine. 44 (1), 73-81 (2008).
- Cao, T., et al. S100B promotes injury-induced vascular remodeling through modulating smooth muscle phenotype. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1863 (11), 2772-2782 (2017).
- Madigan, M., Entabi, F., Zuckerbraun, B., Loughran, P., Tzeng, E. Delayed inhaled carbon monoxide mediates the regression of established neointimal lesions. Journal of Vascular Surgery. 61 (4), 1026-1033 (2015).
- Khurana, R., et al. Angiogenesis-dependent and independent phases of intimal hyperplasia. Circulation. 110 (16), 2436-2443 (2004).
- Tsihlis, N. D., Vavra, A. K., Martinez, J., Lee, V. R., Kibbe, M. R. Nitric oxide is less effective at inhibiting neointimal hyperplasia in spontaneously hypertensive rats. Nitric Oxide. 35, 165-174 (2013).
- Chen, J., et al. Inhibition of neointimal hyperplasia in the rat carotid artery injury model by a HMGB1 inhibitor. Atherosclerosis. 224 (2), 332-339 (2012).
- Mano, T., Luo, Z., Malendowicz, S. L., Evans, T., Walsh, K. Reversal of GATA-6 downregulation promotes smooth muscle differentiation and inhibits intimal hyperplasia in balloon-injured rat carotid artery. Circulation Research. 84 (6), 647-654 (1999).
- Becher, T., et al. Three-Dimensional Imaging Provides Detailed Atherosclerotic Plaque Morphology and Reveals Angiogenesis after Carotid Artery Ligation. Circulation Research. 126 (5), 619-632 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados