È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Una lesione segmentale del palloncino segmentale controllato dalla pressione carotide del ratto con applicazione terapeutica periadventitiale
In questo articolo
Riepilogo
La lesione del palloncino dell'arteria carotide del ratto imita la procedura di angioplastica clinica eseguita per ripristinare il flusso sanguigno nei vasi aterosclerotici. Questo modello induce la risposta alle lesioni arteriose tendendo la parete arteriosa e denudendo lo strato intimale delle cellule endoteliali, causando infine rimodellamento e una risposta iperplastica intimale.
Abstract
Le malattie cardiovascolari rimangono la principale causa di morte e disabilità in tutto il mondo, in parte a causa dell'aterosclerosi. La placca aterosclerotica restringe la superficie luminare nelle arterie riducendo così un adeguato flusso sanguigno agli organi e ai tessuti distali. Clinicamente, le procedure di rivascolarizzazione come l'angioplastica del palloncino con o senza posizionamento dello stent mirano a ripristinare il flusso sanguigno. Sebbene queste procedure ristabiliscono il flusso sanguigno riducendo il carico della placca, danneggiano la parete del vaso, che avvia la risposta di guarigione arteriosa. La risposta curativa prolungata causa la restenosi arteriosa, o restringimento, limitando infine il successo a lungo termine di queste procedure di rivascolarizzazione. Pertanto, i modelli animali preclinici sono parte integrante per l'analisi dei meccanismi fisiopatologici che guidano la restenosi e offrono l'opportunità di testare nuove strategie terapeutiche. I modelli Murine sono più economici e facili da usare rispetto ai grandi modelli animali. Le lesioni da palloncino o filo sono le due modalità di lesione comunemente accettate utilizzate nei modelli murini. I modelli di lesioni da palloncino in particolare imitano la procedura di angioplastica clinica e causano danni adeguati all'arteria per lo sviluppo della restenosi. Qui descriviamo i dettagli chirurgici per eseguire e analizzare istologicamente il modello modificato di lesione del palloncino carotide del ratto controllato a pressione. Inoltre, questo protocollo evidenzia come l'applicazione periadventitiale locale delle terapie può essere utilizzata per inibire l'iperplasia neointimica. Infine, presentiamo la microscopia a fluorescenza della scheda luminosa come un nuovo approccio per l'imaging e la visualizzazione della lesione arteriosa in tre dimensioni.
Introduzione
Le malattie cardiovascolari (CVD) rimangono la principale causa di morte in tutto ilmondo 1. L'aterosclerosi è la causa alla base della morbilità e della mortalità legate alla CVD. L'aterosclerosi è l'accumulo di placca all'interno delle arterie che si traduce in un lume ristretto, ostacolando una corretta perfusione sanguigna agli organi e ai tessuti distali2. Gli interventi clinici per il trattamento dell'aterosclerosi grave includono angioplastica a palloncino con o senza posizionamento dello stent. Questo intervento prevede l'avanzamento di un catetere a palloncino verso il sito della placca e l'gonfiamento del palloncino per comprimere la placca alla parete arteriosa, allargando l'area luminare. Questa procedura danneggia l'arteria, tuttavia, avviando la risposta alle lesioni arteriosa3. L'attivazione prolungata di questa risposta alle lesioni porta alla restenosi arteriosa, o restringimento, secondaria all'iperplasia neointimica e al rimodellamento dei vasi. Durante l'angioplastica lo strato intimale viene denudato di cellule endoteliali che portano al reclutamento immediato delle piastrine e all'infiammazione locale. La segnalazione locale induce cambiamenti fenotipiche nelle cellule muscolari lisce vascolari (VSMC) e nei fibroblasti accidentali. Ciò porta alla migrazione e alla proliferazione di VSMC e fibroblasti verso l'interno verso il lume, portando all'iperplasia neointimica4,5. Le cellule progenitrici circolanti e le cellule immunitarie contribuiscono anche al volume complessivo della restenosi6. Se del caso, gli stent di eluizione dei farmaci (DES) sono lo standard attuale per inibire la restenosi7. Il DES inibisce la rialtelializzazione arteriosa, tuttavia, creando così un ambiente pro-trombotico che può causare trombosi late in-stent8. Pertanto, i modelli animali sono parte integrante sia per comprendere la fisiopatologia della restenosi, sia per sviluppare migliori strategie terapeutiche per prolungare l'efficacia delle procedure di rivascolarizzazione.
Diversi modelli animali grandi epiccoli 9 sono utilizzati per studiare questa patologia. Questi includono la lesione delpalloncino 3,10 o lesione delfilo 11 del lato luminare di un'arteria, così come la legatura parziale12 o il posizionamento del polsino13 intorno all'arteria. Il palloncino e la lesione del filo denudano entrambi lo strato endoteliale dell'arteria, imitando ciò che accade clinicamente dopo l'angioplastica. In particolare, i modelli di lesioni da palloncino utilizzano strumenti simili a quello dell'ambiente clinico (ad esempio, catetere a palloncino). La lesione del palloncino è meglio eseguita nei modelli di ratti, poiché le arterie del ratto sono di dimensioni appropriate per i cateteri a palloncino disponibili in commercio. Qui descriviamo una lesione arteriosa segmentale controllata dalla pressione, una versione ben consolidata e modificata della lesione del palloncino dell'arteria carotide del ratto. Questo approccio controllato dalla pressione imita da vicino la procedura di angioplastica clinica e consente la formazione di iperplasia neointimica riproducibile due settimane dopo lalesione 14,15. Inoltre, questa lesione arteriosa controllata dalla pressione si traduce in un completo ripristino dello strato endoteliale entro 2 settimane dall'interventochirurgico 16. Ciò contrasta direttamente con il modello originale di lesione del palloncino, descritto da Clowes, dove lo strato endoteliale non ritorna mai alla coperturacompleta 3.
Dopo l'intervento chirurgico, le terapie possono essere applicate o dirette verso l'arteria ferita attraverso diversi approcci. Il metodo descritto nel presente documento utilizza l'applicazione periadivenzionale di una piccola molecola incorporata in una soluzione di gel pluronico. Nello specifico, applichiamo una soluzione di aldeide cinnamica da 100 μM nel gel Pluronic-F127 al 25% all'arteria immediatamente dopo la lesione per inibire la formazione di iperplasia neointimica15. Pluronic-F127 è un gel atossico e termo-reversibile in grado di fornire farmaci localmente in modo controllato17. Nel frattempo, le lesioni arteriosa sono locali, quindi l'amministrazione locale consente di testare un principio attivo riducendo al minimo gli effetti fuori bersaglio. Tuttavia, l'erogazione efficace di una terapia utilizzando questo metodo dipenderà dalla chimica della piccola molecola o del biologico utilizzato.
Protocollo
Tutti i metodi qui descritti sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) dell'Università della Carolina del Nord a Chapel Hill.
1. Procedure preoperatorie
- Sterilizzare gli strumenti chirurgici. Autoclave tutti gli strumenti chirurgici prima dell'intervento chirurgico. Se si eseguono più interventi chirurgici lo stesso giorno, sterilizzare gli strumenti tra gli interventi chirurgici utilizzando uno sterilizzatore di perline secche.
- Preparare terapeutico in gel Pluronic-127 al 25% (diluito in acqua distillata sterile).
- Impostare un catetere a palloncino 2F Fogarty sull'insufflator e posizionare l'estremità del palloncino del catetere in una siringa da 1 ml riempita con soluzione salina.
- Indurre l'anestesia posizionando il ratto in una camera con il 5% di isoflurane.
- Rimuovere il topo dalla camera e registrare il peso del topo. Usa le tosaerba per radere la pelliccia sulla regione del collo ventrale.
- Riposizionare il topo nella camera con il 5% di isoflurane per garantire l'induzione dell'anestesia.
- Posizionare la supina del topo su una piattaforma chirurgica, inserendo il viso nel cono del naso in modo che il viso del topo sia verso il chirurgo.
- Ridurre l'anestesia inalatoria all'1,5% di isoflurane. Verificare la profondità dell'anestesia con un riflesso del dito del piede su tutti e quattro i piedi.
- Nastro tutte e quattro le gambe fino alla piattaforma chirurgica.
- Accendere la lampada termica.
- Iniettare atropina (0,01 mg/kg) per ridurre sottocutaneamente le secrezioni delle vie aeree.
- Iniettare carprofene (5 mg/kg) per la gestione del dolore profilattico. Se i farmaci antinfiammatori non sono accettabili per l'esperimento, fare riferimento ai passaggi 3.2.2 e 3.2.3.
- Applicare un unguento per gli occhi lubrificante su entrambi gli occhi utilizzando un batuffolo di cotone sterile per evitare che le cornee si asciughino durante l'intervento chirurgico.
- Tamponare il collo tre volte con un movimento circolare alternato tra il 70% di alcol etilico seguito da Betadine dal centro della regione rasata verso l'esterno per sterilizzare il sito di incisione.
- Infiltrarsi nella linea di incisione .c. con 0,25% di bupivacaina.
- Indossare guanti chirurgici sterili prima di maneggiare strumenti chirurgici sterili e forniture.
- Disporre tutti gli strumenti chirurgici autoclavati su un foglio chirurgico sterile.
- Tagliare tre fili indipendenti da 1 pollice di sutura sterile 7-0 Prolene.
- Posizionare tamponi di cotone e garza su un foglio chirurgico.
- Drappeggiare il topo con un foglio chirurgico sterile che espone solo la regione del collo sterilizzata.
- Tagliare un'ulteriore piccola apertura nel foglio che espone parte del cono del naso. Questo sarà il sito per la nastratura del catetere del palloncino durante l'infortunio.
2. Procedure operative
- Durante l'intera procedura chirurgica, valutare la profondità dell'anestesia monitorando la frequenza respiratoria (la frequenza deve essere coerente e considerata normale) anche con il dito del piedi ogni 15 minuti. Se la frequenza respiratoria aumenta o c'è una risposta al dito del piedi, metti in pausa la manipolazione chirurgica e aumenta l'isoflurane fino al 2,5%.
- Esporre l'arteria carotide comune (CCA).
- Fai un'incisione superficiale, dritta e longitudinale della scollatura tra le ossa della mascella del topo. L'incisione sarà lunga circa 1,5-2 cm.
- Fare un'incisione attraverso il tessuto connettivo sotto la pelle fino a quando lo strato muscolare è esposto. Spostare le ghiandole salivari sotto la pelle per accedere al tessuto muscolare.
- Separare senza mezzi termini il tessuto connettivo dal muscolo inserendo forbici chiuse tra lo strato muscolare e il tessuto connettivo e aprendo delicatamente la forbice mentre si tira la pelle verso l'alto.
- Sezionare i due muscoli visibili (sternoioide e sternomastoide) longitudinalmente lungo il lato sinistro della trachea fino a quando non si osserva un terzo muscolo (omoioide) che corre perpendicolare ai due muscoli superficiali.
- Utilizzare le flessione per creare una finestra che separa questo muscolo perpendicolare (omoioide) dal muscolo longitudinale (sternoioide) che corre in cima alla trachea. Eseguire delicatamente questa separazione per prevenire traumi contundenti alla trachea.
- Raggiungi le flessione sotto il muscolo perpendicolare e taglia per separare i due muscoli longitudinali ed esporre il CCA.
- Sezionare il CCA.
- Sezionare il CCA vicino alla biforcazione fino a quando non vengono esposte l'arteria carotide interna (ICA) e l'arteria carotide esterna (ECA).
- Sezionare l'arteria tiroidea superiore (STA), che si ramica dalla Corte dei conti europea.
- Utilizzando le suture prolene pretaglio, ligate lo STA e l'ECA vicino alla loro rispettiva biforcazione. Lasciare la maggior parte della sutura su un lato del nodo e afferrare ogni sutura con un emostato curvo.
- Finire la sezionatura intorno all'ICA, raggiungere le pinze sotto e intorno all'ICA e utilizzare un morsetto vascolare non frantumante per ottenere il controllo distale. Blocca l'arteria occipitale insieme all'ICA.
- Sezionare il CCA prossimale alla biforcazione, assicurandosi di separare il nervo vago dal CCA.
- Raggiungi le pinze sotto e intorno al CCA e usa un morsetto vascolare non schiacciante per ottenere il controllo prossimale. Posizionare il morsetto ad almeno 5 mm dalla biforcazione.
- Eseguire lesioni al palloncino.
- Manovra gli hemostat curvi che tengono ogni ramo dell'arteria legata per esporre la biforcazione tra l'ECA e il ramo superiore.
- Sezionare delicatamente il tessuto alla biforcazione e quindi fare un'incisione dell'arteriotomia tra l'ECA e il ramo superiore usando forbici a microdissezione.
- Usa un batuffolo di cotone per spingere tutto il sangue fuori dal CCA e ripulire il sito di arteriotomia.
- Inserire il catetere a palloncino non gonfiato attraverso l'arteriotomia e avanzare nel CCA fino a quando l'estremità prossimale del palloncino non supera la biforcazione.
- Catetere a nastro al cono del naso in modo che il palloncino non scivoli fuori dall'arteria durante l'inflazione.
- Gonfiare lentamente il palloncino a 5 atmosfere di pressione e lasciare nel CCA per 5 minuti per indurre lesioni arteriosa. Assicurarsi che la pressione rimanga costante per tutti i 5 minuti.
- Dopo 5 minuti, sgonfiare il palloncino e rimuovere delicatamente dal CCA attraverso l'arteriotomia.
- Sciacquare il CCA spremendo delicatamente il morsetto al CCA. Non rimuovere il morsetto.
- Legare l'ECA prossimale all'arteriotomia e quindi rimuovere i morsetti dal CCA e dall'ICA per ripristinare il flusso sanguigno attraverso il CCA all'ICA. Assicurarsi che non vi sia sanguinamento visibile intorno all'arteriotomia e che il CCA pulsante.
- Applicare da solo 100 μL di veicolo in gel terapeutico o Pluronic periadventitially lungo il CCA ferito. Farlo applicando 50 μL sul lato sinistro del CCA e poi 50 μL sul lato destro del CCA per garantire un rivestimento uniforme dell'arteria ferita.
- Chiudi il sito della ferita.
- Tagliare le suture di Prolene in eccesso.
- Chiudere la ferita utilizzando strati interrotti di 4-0 o 6-0 vicril lungo il tessuto connettivo.
- Termina di chiudere la ferita usando la sutura di nylon 4-0 lungo la pelle.
3. Procedure postoperatorie
- Posizionare il topo da solo in una gabbia pulita con metà della gabbia sotto una lampada riscaldante e monitorare fino a quando il ratto non riacquista sufficiente coscienza per mantenere la rimpanza sternale. Tenere il topo in una gabbia separata fino a quando l'animale non è completamente vigile e mobile prima di tornare alla gabbia originale.
- Monitorare il topo ogni giorno per i prossimi tre giorni e poi tre volte a settimana fino all'eutanasia. Eutanasia mediante sovradosaggio di isoflurane seguita da toracotomia bilaterale come descritto di seguito.
- Utilizza il Centro nazionale per la raffinazione e la riduzione sostitutiva degli animali nella scala delle smorfie (NC3R) per identificare i livelli di dolore postoperatorio. Se un animale sembra provare dolore o sviluppare qualsiasi compromesso neurologico, sacrificarsi immediatamente.
- Per gli animali che non ricevono carprofene, somministrare acetaminofene 6 mg/mL nell'acqua potabile 24 ore prima dell'intervento chirurgico attraverso 48 ore dopo l'intervento chirurgico. Acetaminofene fornisce analgesia con effetti antinfiammatori minimi.
- In alternativa, possono essere utilizzate altre strategie di analgesia con effetti antinfiammatori minimi, come buprenorfina o rilascio prolungato di buprenorfina. Consulta il team veterinario del tuo istituto.
4. Raccolta e imaging dei tessuti
- Due settimane dopo l'intervento chirurgico, eutanasiare il topo per overdose di anestesia (5% isoflurane). In alternativa, eutanasiare i ratti in un momento precedente per analizzare i vari aspetti della risposta alle lesioni arteriosa.
- Una volta che la respirazione smette di eseguire la toracotomia bilaterale come metodo secondario di eutanasia.
- Fare un'incisione laterale attraverso l'addome, e quindi tagliare verso l'alto, attraverso il diaframma e le costole, esponendo la cavità toracica.
- Perfondere e riparare le arterie.
- Inserire una cannula da 18 G attaccata a un sistema gravitazionale di fissazione della perfusione attraverso il ventricolo sinistro. Mantenere una pressione equivalente tra i ratti contrassegnando l'altezza del sistema di perfusione rispetto al banco (120 cm di elevazione, equivalente a 91 ± 3 mmHg).
- Bloccare la cannula insieme al ventricolo usando un emostato curvo.
- Effettuare un taglio nell'atrio destro, aprendo il circuito vascolare, e iniziare la perfusione con PBS seguita da paraformaldeide al 2-4% (circa 250 mL ciascuna).
- Prepara la paraformaldeide diluita nel PBS il giorno del sacrificio, o al massimo la notte prima del sacrificio. Se si prepara il giorno del sacrificio, assicurarsi che la paraformaldeide si sia raffreddata a temperatura ambiente prima di iniziare la perfusione. Conservare la paraformaldeide a 4 °C.
- Dopo la fissazione, estrarre le arterie carotidi sinistra e destra e conservare a 4 °C per 2 ore in paraformaldeide al 2-4%.
- Trasferire le arterie al 30% di saccarosio e conservare durante la notte a 4 °C.
- Dopo 16-24 ore, incorporare le arterie in un composto a temperatura di taglio ottimale (OCT) e congelare i blocchi di arteria incorporati nello OCT.
- Condizionare le arterie in OCT a temperatura ambiente per 10 minuti. Posizionare l'arteria parallela al piano del cryomold riempito di OCT, segnando il lato del criomoldo a cui si trova la biforcazione arteriosa. Congelamento a scatto nell'azoto liquido.
- Conservare i blocchi congelati a lungo termine a -80 °C.
- Se sezione blocchi congelati utilizzando un criostato.
- Raccogliere sei sezioni trasversali arteriosa spesse 5 μm per scivolo, con scorrimento 1 a partire dalla biforcazione.
- Se sezione blocchi congelati fino a quando l'iperplasia non è più visibile (circa 100 diapositive).
- Diapositive di macchie di ematossilina ed eosina (H&E)18
- Trova l'area della lesione macchiando uno diapositiva su dieci lungo l'intera arteria a partire dalla biforcazione (ad esempio, diapositive 1, 10, 20, 30, 40, 50, 60, 70, 80, 90 e 100).
- Macchiare ulteriori diapositive intorno al sito di lesione per trovare la diapositiva con occlusione di picco (ad esempio, le diapositive 20, 30 e 40 avevano iperplasia visibile, quindi le diapositive di macchie 15, 25, 35 e 45).
- Collare e quantificare lo scivolo con occlusione di picco e diapositive equidistanti prima e dopo lo scivolo di occlusione di picco (ad esempio, occlusione di picco trovata allo scivolo 35, quindi macchiare e quantificare le diapositive 25, 45, ecc.) per un totale di 3-10 diapositive per ratto.
- Per l'imaging della microscopia a fluorescenza a fogli leggeri, conservare le arterie durante la notte a 4 °C dopo la fissazione nel passaggio 4.4.
- Arteria sonda con diluizione 1:500 di anticorpo primario anti-CD31 del coniglio in diluente (pH 7.4) per 3 giorni. Quindi controsostene l'arteria con 1:500 diluizione dell'anticorpo secondario anti-coniglio Alexa Fluor 647 per 2giorni 19.
- Cancellare l'arteria utilizzando iDISCO+20.
- Immagine dell'arteria utilizzando un microscopio a fluorescenza a foglioluminoso 21. Eseguire il rendering di immagini utilizzando software (ad esempio, Imaris)19.
- Quantificare l'iperplasia neointimica. Eseguire la quantificazione in modo accecato, se possibile.
- Utilizzare il software ImageJ per tracciare il perimetro dell'intima, della lamina elastica interna (IEL) e della lamina elastica esterna (EEL) di un'arteria su ciascuna delle 3-10 diapositive sopra determinate (passaggio 4.8.3).
- Quantificare l'area di ogni area tracciata in ImageJ ed esportare questi valori. La traccia intima produce l'area del lume, la traccia IEL produce l'area IEL e la traccia EEL produce l'area EEL.
- Media i valori ottenuti dalle diapositive 3-10 per ottenere la lesione media (% occlusione, rapporto intima:media (I:M), iperplasia neointimica) per arteria carotide di ratto.
Iperplasia neointimica = area IEL - Area di Lumen
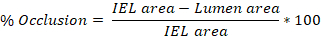
Risultati
La figura 1 mostra tutti i materiali e gli strumenti chirurgici utilizzati per eseguire questo intervento chirurgico. La colorazione di ematossilina ed eosina (H&E) di sezioni trasversali arteriosa ferite di due settimane consente una chiara visualizzazione dell'iperplasia neointimica. La figura 2 mostra immagini rappresentative di sezioni trasversali arteriosa macchiate di H&E di un'arteria sana, ferita e trattata. La figura 2 desc...
Discussione
La lesione del palloncino dell'arteria carotide di ratto è uno dei modelli animali di restenosi più ampiamente utilizzati e studiati. Sia la lesione del palloncino originalemodello 3 che la variazione di lesione segmentale controllata dalla pressionemodificata 10 hanno informato molti aspetti della risposta alle lesioni arteriosa che si verifica anche nell'uomo, con le pochelimitazioniche il trombo ricco di fibrina si sviluppa raramente e l'infiamm...
Divulgazioni
Gli autori dichiarano che non vi sono conflitti di interesse per quanto riguarda la pubblicazione di questo manoscritto.
Riconoscimenti
N.E.B. è stato supportato da una borsa di formazione del National Institute of Environmental Health Sciences (5T32ES007126-35, 2018) e da una borsa di studio pre-dottorato dell'American Heart Association (20PRE35120321). E.S.M.B. è stato uno studioso KL2 parzialmente supportato dall'UNC Clinical and Translational Science Award-K12 Scholars Program (KL2TR002490, 2018) e dal National Heart, Lung, and Blood Institute (K01HL145354). Gli autori ringraziano il Dott. Pablo Ariel del Laboratorio servizi di microscopia UNC per l'assistenza con LSFM. La microscopia a fluorescenza a fogli leggeri è stata eseguita presso il Laboratorio servizi di microscopia. Il Laboratorio servizi di microscopia, Dipartimento di Patologia e Medicina di Laboratorio, è supportato in parte da P30 CA016086 Cancer Center Core Support Grant all'UNC Lineberger Comprehensive Cancer Center.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | Fisher | 14955450 | |
| 1 mL Syringe with needle | BD | 309626 | |
| 2 French Fogarty Balloon Embolectomy Catheter | Edwards LifeSciences | 120602F | |
| 4-0 Ethilon (Nylon) Suture | Ethicon Inc | 662H | |
| 4-0 Vicryl Suture | Ethicon Inc | J214H | |
| 7-0 Prolene Suture | Ethicon Inc | 8800H | |
| 70% ethyl alcohol | |||
| Anti-Rabbit Alexa Fluor 647 | Thermo Fisher Scientific | A21245 | |
| Atropine Sulfate | Vedco Inc | for veterinary use | |
| Cotton Swabs | Puritan | 806-WC | |
| Curved Hemostats | Fine Science Tools | 13009-12 | |
| Fine Curved Forceps | Fine Science Tools | 11203-25 | |
| Fine Scissors | Fine Science Tools | 14090-11 | |
| Gauze | Covidien | 2252 | |
| IHC-Tek Diluent (pH 7.4) | IHC World | IW-1000 | |
| Insufflator | Merit Medical | IN4130 | |
| Iodine solution | |||
| Lubricating Eye Ointment | Dechra | for veterinary use | |
| Mayo Scissors | Fine Science Tools | 14010-15 | |
| Micro Serrefines | Fine Science Tools | 18055-05 | |
| Microdissection Scissors | Fine Science Tools | 15004-08 | |
| Micro-Serrefine Clamp Applying Forceps | Fine Science Tools | 18057-14 | |
| Needle Holder | Fine Science Tools | 12003-15 | |
| Pluronic-127 (diluted in sterile water) | Sigma-Aldrich | P2443 | 25% prepared |
| Rabbit Anti-CD31 | Abcam | ab28364 | |
| Retractor | Bent paper clips work well | ||
| Rimadyl (Carprofen) | Zoetis Inc | for veterinary use | |
| Saline solution | |||
| Standard Forceps | Fine Science Tools | 11006-12 | |
| Sterile Drape | Dynarex | 4410 | |
| T-Pins |
Riferimenti
- American Heart Association. Cardiovascular Disease: A Costly Burden for America, Projections Through 2035. American Heart Association CVD Burden Report. , (2017).
- Singh, R. B., Mengi, S. A., Xu, Y. J., Arneja, A. S., Dhalla, N. S. Pathogenesis of atherosclerosis: A multifactorial process. Experimental and Clinical Cardiology. 7 (1), 40-53 (2002).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Mechanisms of stenosis after arterial injury. Laboratory Investigation. 49 (2), 208-215 (1983).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Kinetics of cellular proliferation after arterial injury. I. Smooth muscle growth in the absence of endothelium. Laboratory Investigation. 49 (3), 327-333 (1983).
- Sartore, S., et al. Contribution of adventitial fibroblasts to neointima formation and vascular remodeling: from innocent bystander to active participant. Circulation Research. 89 (12), 1111-1121 (2001).
- Tanaka, K., et al. Circulating progenitor cells contribute to neointimal formation in nonirradiated chimeric mice. The FASEB Journal. 22 (2), 428-436 (2008).
- Henry, M., et al. Carotid angioplasty and stenting under protection. Techniques, results and limitations. The Journal of Cardiovascular Surgery. 47 (5), 519-546 (2006).
- Kounis, N. G., et al. Thrombotic responses to coronary stents, bioresorbable scaffolds and the Kounis hypersensitivity-associated acute thrombotic syndrome. Journal of Thoracic Disease. 9 (4), 1155-1164 (2017).
- Jackson, C. L. Animal models of restenosis. Trends in Cardiovascular Medicine. 4 (3), 122-130 (1994).
- Shears, L. L., et al. Efficient inhibition of intimal hyperplasia by adenovirus-mediated inducible nitric oxide synthase gene transfer to rats and pigs in vivo. Journal of the American College of Surgeons. 187 (3), 295-306 (1998).
- Takayama, T., et al. A murine model of arterial restenosis: technical aspects of femoral wire injury. Journal of Visualized Experiments. (97), (2015).
- Zhang, L. N., Parkinson, J. F., Haskell, C., Wang, Y. X. Mechanisms of intimal hyperplasia learned from a murine carotid artery ligation model. Current Vascular Pharmacology. 6 (1), 37-43 (2008).
- Jahnke, T., et al. Characterization of a new double-injury restenosis model in the rat aorta. Journal of Endovascular Therapy. 12 (3), 318-331 (2005).
- Gregory, E. K., et al. Periadventitial atRA citrate-based polyester membranes reduce neointimal hyperplasia and restenosis after carotid injury in rats. American Journal of Physiology-Heart and Circulatory Physiology. 307 (10), 1419-1429 (2014).
- Buglak, N. E., Jiang, W., Bahnson, E. S. M. Cinnamic aldehyde inhibits vascular smooth muscle cell proliferation and neointimal hyperplasia in Zucker Diabetic Fatty rats. Redox Biology. 19, 166-178 (2018).
- Bahnson, E. S., et al. Long-term effect of PROLI/NO on cellular proliferation and phenotype after arterial injury. Free Radical Biology and Medicine. 90, 272-286 (2016).
- Gilbert, J. C. W., Davies, M. C., Hadgraft, J. The behaviour of Pluronic F127 in aqueous solution studied using fluorescent probes. International Journal of Pharmaceutics. 40 (1-2), 93-99 (1987).
- Tulis, D. A. Histological and morphometric analyses for rat carotid balloon injury model. Methods in Molecular Medicine. 139, 31-66 (2007).
- Buglak, N. E., et al. Light Sheet Fluorescence Microscopy as a New Method for Unbiased Three-Dimensional Analysis of Vascular Injury. Cardiovascular Research. , (2020).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Ariel, P. . UltraMicroscope II - A User Guide. , (2018).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Xiangdong, L., et al. Animal models for the atherosclerosis research: a review. Protein Cell. 2 (3), 189-201 (2011).
- Chen, H., Li, D., Liu, M. Novel Rat Models for Atherosclerosis. Journal of Cardiology and Cardiovascular Sceinces. 2 (2), 29-33 (2018).
- Xing, D., Nozell, S., Chen, Y. F., Hage, F., Oparil, S. Estrogen and mechanisms of vascular protection. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (3), 289-295 (2009).
- Tulis, D. A. Rat carotid artery balloon injury model. Methods in Molecular Medicine. 139, 1-30 (2007).
- Pellet-Many, C., et al. Neuropilins 1 and 2 mediate neointimal hyperplasia and re-endothelialization following arterial injury. Cardiovascular Research. 108 (2), 288-298 (2015).
- Wu, B., et al. Perivascular delivery of resolvin D1 inhibits neointimal hyperplasia in a rat model of arterial injury. Journal of Vascular Surgery. 65 (1), 207-217 (2017).
- Tan, J., Yang, L., Liu, C., Yan, Z. MicroRNA-26a targets MAPK6 to inhibit smooth muscle cell proliferation and vein graft neointimal hyperplasia. Scientific Reports. 7, 46602 (2017).
- Pearce, C. G., et al. Beneficial effect of a short-acting NO donor for the prevention of neointimal hyperplasia. Free Radical Biology and Medicine. 44 (1), 73-81 (2008).
- Cao, T., et al. S100B promotes injury-induced vascular remodeling through modulating smooth muscle phenotype. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1863 (11), 2772-2782 (2017).
- Madigan, M., Entabi, F., Zuckerbraun, B., Loughran, P., Tzeng, E. Delayed inhaled carbon monoxide mediates the regression of established neointimal lesions. Journal of Vascular Surgery. 61 (4), 1026-1033 (2015).
- Khurana, R., et al. Angiogenesis-dependent and independent phases of intimal hyperplasia. Circulation. 110 (16), 2436-2443 (2004).
- Tsihlis, N. D., Vavra, A. K., Martinez, J., Lee, V. R., Kibbe, M. R. Nitric oxide is less effective at inhibiting neointimal hyperplasia in spontaneously hypertensive rats. Nitric Oxide. 35, 165-174 (2013).
- Chen, J., et al. Inhibition of neointimal hyperplasia in the rat carotid artery injury model by a HMGB1 inhibitor. Atherosclerosis. 224 (2), 332-339 (2012).
- Mano, T., Luo, Z., Malendowicz, S. L., Evans, T., Walsh, K. Reversal of GATA-6 downregulation promotes smooth muscle differentiation and inhibits intimal hyperplasia in balloon-injured rat carotid artery. Circulation Research. 84 (6), 647-654 (1999).
- Becher, T., et al. Three-Dimensional Imaging Provides Detailed Atherosclerotic Plaque Morphology and Reveals Angiogenesis after Carotid Artery Ligation. Circulation Research. 126 (5), 619-632 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon