Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Periadventitial Terapötik Uygulama ile Sıçan Karotis Arter Basınç Kontrollü Segmental Balon Yaralanması
Bu Makalede
Özet
Sıçan şahdamar balonu yaralanması, aterosklerotik damarlarda kan akışını geri kazanmak için yapılan klinik anjiyoplasti prosedürünü taklit eder. Bu model, arteriyel duvarı dağıtarak ve endotel hücrelerinin intimal tabakasını indirgeyerek arteriyel yaralanma yanıtını indükler, sonuçta yeniden şekillendirmeye ve intimal hiperplastik yanıta neden olur.
Özet
Kardiyovasküler hastalık, kısmen ateroskleroz nedeniyle dünya çapında önde gelen ölüm ve sakatlık nedeni olmaya devam etmektedir. Aterosklerotik plak arterlerdeki ışıklı yüzey alanını daraltır, böylece organlara ve distal dokulara yeterli kan akışını azaltır. Klinik olarak stentli veya stentsiz balon anjiyoplasti gibi revaskülarizasyon işlemleri kan akışını geri getirmeyi amaçlamaktadır. Bu işlemler plak yükünü azaltarak kan akışını yeniden kursa da damar duvarına zarar verir ve bu da arteriyel iyileşme yanıtını başlatır. Uzun süreli iyileşme yanıtı arteriyel restenoza veya yeniden daralmaya neden olur ve sonuçta bu revaskülarizasyon prosedürlerinin uzun vadeli başarısını sınırlar. Bu nedenle, preklinik hayvan modelleri, restenoza yol eden patofizyolojik mekanizmaları analiz etmek için ayrılmaz bir bütün olandır ve yeni terapötik stratejileri test etme fırsatı sağlar. Murine modelleri büyük hayvan modellerine göre daha ucuz ve kullanımı daha kolaydır. Balon veya tel yaralanması, murine modellerinde yaygın olarak kabul edilen iki yaralanma yöntemidir. Özellikle balon yaralanma modelleri klinik anjiyoplasti prosedürünü taklit eder ve arterde restenoz gelişimi için yeterli hasara neden olur. Burada modifiye edilmiş, basınç kontrollü sıçan şahdamar balonu yaralanma modelinin gerçekleştirilmesi ve histolojik olarak analiz edilmesi için cerrahi detayları açıklıyoruz. Ek olarak, bu protokol, neointimal hiperplaziyi inhibe etmek için terapötiklerin lokal periadventitial uygulamasının nasıl kullanılabileceğini vurgulamaktadır. Son olarak, arteriyel hasarın üç boyutlu olarak görüntülenmesi ve görselleştirilmesi için yeni bir yaklaşım olarak ışık tabakası floresan mikroskopisini sunuyoruz.
Giriş
Kardiyovasküler hastalık (CVD) dünya çapında önde gelen ölüm nedeni olmaya devam etmektedir1. Ateroskleroz, CVD'ye bağlı morbidite ve mortalitenin çoğunun altında gelen nedendir. Ateroskleroz, arterlerin içindeki plağın birikmesidir, bu da daralmış bir lümenle sonuçlanır, organlara ve distal dokulara uygun kan perfüzyonunu engeller2. Şiddetli ateroskleroz tedavisi için klinik müdahaleler arasında stentli veya stentsiz balon anjiyoplasti saydır. Bu müdahale, bir balon kateterinin plak bölgesine ilerletmeyi ve plak arteriyel duvara sıkıştırmak için balonu şişirmeyi, ışık alanını genişletmeyi içerir. Bu prosedür artere zarar verir, ancak arteriyel yaralanma yanıtını başlatır3. Bu yaralanma yanıtının uzun süreli aktivasyonu, neointimal hiperplazi ve damar remodelingine sekonder arteriyel restenoza veya yeniden daralmaya yol açar. Anjiyoplasti sırasında intimal tabaka, hemen trombosit alımına ve lokal inflamasyona yol açan endotel hücrelerinden indirilir. Lokal sinyalizasyon, vasküler düz kas hücrelerinde (VSMC) ve maceracı fibroblastlarda fenotipik değişikliklere neden olur. Bu, VSMC ve fibroblastların lümene doğru göç etmesine ve çoğalmasına yol açar ve neointimal hiperplazi4,5 .5'eyol açar. Dolaşımdaki progenitör hücreler ve bağışıklık hücreleri de restenozun genel hacmine katkıda bulunur6. Uygulanabilir olduğunda, ilaçlı stentler (DES) restenozun inhibe etmek için mevcut standarttır7. DES arteriyel yeniden endotelyalizasyonu inhibe eder, ancak böylece geç stent trombozu ile sonuçlanabilecek pro-trombotik bir ortam yaratır8. Bu nedenle, hayvan modelleri hem restenozun patofizyolojisini anlamak hem de revaskülarizasyon prosedürlerinin etkinliğini uzatmak için daha iyi terapötik stratejiler geliştirmek için ayrılmaz bir bütündür.
Bu patolojiyi incelemek için birkaç büyük ve küçük hayvan modeli9 kullanılmaktadır. Bunlar arasında bir atardamarın ışıklı tarafının balon yaralanması3,10 veya tel yaralanması11' in yanı sıra arter çevresinde kısmi ligasyon12 veya manşet yerleşimi13 bulunur. Balon ve tel yaralanması, arterin endotel tabakasını denude eder ve anjiyoplastiden sonra klinik olarak meydana gelenleri taklit eder. Özellikle balon yaralanması modelleri klinik ortamdakine (yani balon kateter) benzer aletler kullanır. Balon yaralanması en iyi sıçan modellerinde gerçekleştirilir, çünkü sıçan arterleri piyasada bulunan balon kateterleri için uygun bir boyuttur. Burada, sıçan şahdamar balonu yaralanmasının iyi kurulmuş, değiştirilmiş bir versiyonu olan basınç kontrollü segmental arteriyel yaralanmayı tarif ediyoruz. Bu basınç kontrollü yaklaşım klinik anjiyoplasti prosedürünü yakından taklit eder ve yaralanmadan iki hafta sonra tekrarlanabilir neointimal hiperplazi oluşumuna izin verir14,15. Ek olarak, bu basınç kontrollü arteriyel yaralanma, ameliyattan 2 hafta sonra tam endotel tabakası restorasyonu ile sonuçlanır16. Bu, endotel katmanının hiçbir zaman tam kapsama alanına dönmediği Clowes tarafından tanımlanan orijinal balon yaralanması modeline doğrudan zıttır3.
Ameliyattan sonra terapötikler çeşitli yaklaşımlarla yaralı artere uygulanabilir veya bu artere yönlendirilebilir. Burada açıklanan yöntem, Pluronik jel çözeltiye gömülü küçük bir molekülün periadventitial uygulamasını kullanır. Özellikle, neointimal hiperplazi oluşumunu inhibe etmek için yaralanmadan hemen sonra artere% 25 Pluronic-F127 jelinde 100 μM cinnamik aldehit çözeltisi uyguluyoruz15. Pluronic-F127, ilaçları kontrollü bir şekilde yerel olarak teslim edebilen toksik olmayan, termo-geri dönüşümlü bir jeldir17. Bu arada, arteriyel yaralanma lokaldir, bu nedenle yerel yönetim hedef dışı etkileri en aza indirirken aktif bir prensibi test etmeyi sağlar. Bununla birlikte, bu yöntemi kullanarak bir terapötikin etkili bir şekilde verilmesi, kullanılan küçük molekülün veya biyolojiklerin kimyasına bağlı olacaktır.
Protokol
Burada açıklanan tüm yöntemler Chapel Hill'deki Kuzey Carolina Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanmıştır.
1. Ameliyat öncesi prosedürler
- Cerrahi aletleri sterilize edin. Ameliyattan önce tüm cerrahi aletleri otoklavlayın. Aynı gün birden fazla ameliyat yapıyorsanız, ameliyatlar arasındaki aletleri kuru boncuk sterilizatörü kullanarak sterilize edin.
- % 25 Pluronic-127 jelinde terapötik hazırlayın (steril damıtılmış suda seyreltilir).
- Altöre bir 2F Fogarty balon kateteri kurun ve kateterin balon ucını tuzlu su çözeltisi ile dolu 1 mL şırınna yerleştirin.
- Sıçanı% 5 izofluran içeren bir odaya yerleştirerek anesteziye neden olabilir.
- Sıçanı odadan çıkarın ve sıçanın ağırlığını kaydedin. Ventral boyun bölgesinde kürk tıraş etmek için saç kesme makinesi kullanın.
- Anestezinin indüksiyonunu sağlamak için sıçanı% 5 izofluran ile odaya geri yerleştirin.
- Sıçan supine'i cerrahi bir platforma yerleştirin, yüzü burun konisine yerleştirin, böylece sıçan yüzü cerraha doğru olacaktır.
- İnhalasyon anestezisini %1,5 izoflurane düşürün. Anestezinin derinliğini dört ayak üzerinde bir ayak parmağı sıkıştırma refleksi ile doğrulayın.
- Dört ayağını da cerrahi platforma bantla.
- Isı lambasını aç.
- Hava yolu salgılarını azaltmak için Atropin (0.01 mg/kg) deri altından enjekte edin.
- Profilaktik ağrı yönetimi için carprofen (5 mg/kg) deri altından enjekte edin. Antienflamatuar ilaçlar deney için kabul edilemezse, 3.2.2 ve 3.2.3 adımlarına bakın.
- Ameliyat sırasında korneaların kurumasını önlemek için steril pamuklu çubuk kullanarak her iki göze de yağlayıcı göz merhemi uygulayın.
- Kesi bölgesini sterilize etmek için tıraşlı bölgenin merkezinden Betadine'i takip eden% 70 etil alkol arasında değişen dairesel bir hareketle boynu üç kez sürün.
- %0.25 bupivacaine ile kesi hattı s.c.
- Steril cerrahi aletleri ve malzemeleri kullanmadan önce steril cerrahi eldivenleri takin.
- Tüm otoklavlı cerrahi aletleri steril bir cerrahi levhaya koyun.
- Steril 7-0 Prolene dikişin üç bağımsız 1 inç telini kesin.
- Pamuklu çubukları ve gazlı bezi cerrahi tabakaya yerleştirin.
- Sıçanı sadece sterilize edilmiş boyun bölgesini açığa çıkaran steril bir cerrahi tabaka ile örtün.
- Burun konisinin bir kısmını açığa çıkaran ek bir küçük açıklığı tabaka halinde kesin. Burası yaralanma sırasında balon kateterini bantlama yeri olacaktır.
2. Operatif prosedürler
- Tüm cerrahi işlem sırasında, solunum hızını izleyerek anestezi derinliğini değerlendirin (oran tutarlı olmalı ve normal kabul edilmelidir) ve her 15 dakikada bir ayak parmağı çimdikleyerek. Solunum hızı artarsa veya ayak parmağı sıkışmasına bir yanıt varsa, cerrahi manipülasyonu duraklatın ve izofluranları% 2,5'e kadar artırın.
- Ortak şahdamarını (CCA) açığa çıkar.
- Sıçanın çene kemikleri arasında yüzeysel, düz, boyuna bir yaka kesisi yapın. Kesi yaklaşık 1,5-2 cm uzunluğunda olacaktır.
- Kas tabakası açığa olana kadar cildin altındaki bağ dokusundan bir kesi yapın. Kas dokusuna erişmek için cildin altındaki tükürük bezlerini yerinden sökün.
- Kas tabakası ile bağ dokusu arasına kapalı makas sokarak ve cildi yukarı doğru çekerken makası hafifçe açarak bağ dokusunu kastan kesin olarak ayırın.
- İki yüzeysel kaslara dik çalışan üçüncü bir kas (omohyoid) gözlenene kadar, iki görünür kası (sternohyoid ve sternomastoid) trakeanın sol tarafı boyunca uzunlamasına parçalara ayrılın.
- Bu dik kası (omohyoid) nefes borusunun üzerinde çalışan boyuna kastan (sternohyoid) ayıran bir pencere oluşturmak için önseçim kullanın. Nefes borusuna künt travmayı önlemek için bu ayrımı nazikçe gerçekleştirin.
- Dik kasın altındaki asalara ulaşın ve iki uzunlamasına kası ayırmak ve CCA'yı ortaya çıkarmak için kesin.
- CCA'yı parçalara ayrıştırın.
- İç karotis arter (ICA) ve dış karotis arter (ECA) açığa çıkana kadar CCA'yı çatallanmanın yakınında parçalara ayırın.
- ECA'dan dallanan üstün tiroid arterini (STA) parçalara ayırın.
- Önceden kesilmiş Prolene dikişlerini kullanarak STA ve ECA'yı kendi çatallanmalarının yakınında birleşin. Dikişin çoğunu düğümün bir tarafına bırakın ve her dikişi kavisli bir hemostatla tutun.
- ICA'nın etrafında diseksiyon yapmayı bitirin, ICA'nın altındaki ve etrafındaki tokalara ulaşın ve distal kontrol elde etmek için ezilmeyen bir vasküler kelepçe kullanın. Oksipital arteri ICA ile birlikte kenetleyin.
- CCA proksimalini çatallamaya ayırarak vagus sinirinin CCA'dan ayrılmasını sağlayın.
- CCA'nın altında ve çevresinde tokalara ulaşın ve proksimal kontrol elde etmek için ezilmeyen bir vasküler kelepçe kullanın. Çatallanmadan en az 5 mm uzakta kelepçe yerleştirin.
- Balon yaralanması gerçekleştirin.
- ECA ve üstün dal arasındaki çatallanmayı ortaya çıkarmak için her bir liglenmiş arter dalını tutan kavisli hemostatları manevra.
- Çatallanmadaki dokuyu hafifçe parçalara ayırın ve ardından mikrodiseksiyon makası kullanarak ECA ile üst dal arasında arteriotomi kesisi yapın.
- Tüm kanı CCA'dan dışarı itmek ve arteriotomi bölgesini temizlemek için pamuklu çubuk kullanın.
- Şişirilmemiş balon kateterini arteriotomiden geçirin ve balonun proksimal ucu çatallanmayı geçene kadar CCA'ya ilerleyin.
- Burun konisine bant kateteri, böylece balon şişirme sırasında arterden kaymaz.
- Balonu yavaşça 5 basınç atmosferine şişirin ve arteriyel yaralanmaya neden olmak için CCA'da 5 dakika bekletin. Basıncın 5 dakika boyunca sabit kaldığından emin olun.
- 5 dakika sonra balonu söndür ve arteriyotomi yoluyla CCA'dan hafifçe çıkarın.
- CCA'daki kelepçeyi hafifçe sıkarak CCA'yı yıkayın. Kelepçeyi çıkarmayın.
- ECA proksimalini arteriotomiye bağlayın ve ardından CCA'dan ICA'ya kan akışını geri yüklemek için kelepçeleri CCA ve ICA'dan çıkarın. Arteriotomi çevresinde gözle görülür kanama olmadığından ve CCA'nın nabzının atmasını sağlayın.
- Yaralı CCA boyunca periadventitially tek başına terapötik veya Pluronic jel araç 100 μL uygulayın. Yaralı arterin eşit şekilde kaplanmasını sağlamak için CCA'nın sol tarafına 50 μL ve ardından CCA'nın sağ tarafına 50 μL uygulayarak bunu yapın.
- Yara bölgesini kapatın.
- Fazla Prolene dikişlerini kesin.
- Yarayı bağ dokusu boyunca 4-0 veya 6-0 vicryl katmanlarını keserek kapatın.
- Cilt boyunca 4-0 naylon dikiş çalıştırarak yarayı kapatmayı bitirin.
3. Ameliyat sonrası prosedürler
- Sıçanı tek başına bir ısıtma lambasının altındaki kafesin yarısı ile temiz bir kafese yerleştirin ve sıçan sternal reumbency'yi korumak için yeterli bilinci geri kazanana kadar izleyin. Sıçanı, orijinal kafeslerine geri aktarmadan önce hayvan tamamen uyanık ve hareketli olana kadar ayrı bir kafeste tutun.
- Sıçanı önümüzdeki üç gün boyunca günlük olarak izleyin ve sonra ötanaziye kadar haftada üç kez izleyin. İzofluran aşırı doz kullanarak ötenazi ve ardından aşağıda açıklandığı gibi bilateral torakotomi.
- Ameliyat sonrası ağrı seviyelerini belirlemek için Araştırmada Hayvanların Değiştirilmesi ve Azaltılması için Ulusal Merkezi (NC3Rs) grimace ölçeğini kullanın. Herhangi bir hayvan ağrı yaşıyor gibi görünüyorsa veya herhangi bir nörolojik uzlaşma geliştiriyorsa, derhal fedakarlık edin.
- Karprofen almayan hayvanlar için, ameliyat sonrası 48 saat boyunca ameliyattan 24 saat önce içme sularında asetaminofen 6 mg / mL verin. Asetaminofen, en az antienflamatuar etki ile analjezi sağlar.
- Alternatif olarak, buprenorfin veya buprenorfin genişletilmiş salınımı gibi en az antienflamatuar etkiye sahip diğer analjezi stratejileri kullanılabilir. Kurumunuzdaki veteriner ekibine danışın.
4. Doku hasadı ve görüntüleme
- Ameliyattan iki hafta sonra, sıçanı aşırı dozda anestezi ile ötenazi (%5 izofluran). Alternatif olarak, arteriyel yaralanma yanıtının çeşitli yönlerini analiz etmek için sıçanları daha erken bir zamanda ötenazi.
- Solunum durduktan sonra bilateral torakotomi ötanazinin ikincil bir yöntemi olarak gerçekleştirilir.
- Karından yanal bir kesi yapın ve sonra torasik boşluğu açığa çıkararak diyafram ve kaburgalardan yukarı doğru kesin.
- Atardamarları perfuse ve sabitleyin.
- Sol ventrikülden yerçekimsel perfüzyon fiksasyon sistemine bağlı 18 G kanül yerleştirin. Perfüzyon sisteminin yüksekliğini tezgah tepesine göre işaretleyerek sıçanlar arasındaki eşdeğer basıncı koruyun (120 cm yükseklik, 91 ± 3 mmHg'ye eşdeğer).
- Kavisli bir hemostat kullanarak damarı ventrikül ile birlikte kenetleyin.
- Sağ kulakçıkta bir kesim yapın, vasküler devreyi açarak PBS ile perfüzyona başlayın ve ardından% 2-4 paraformaldehit (her biri yaklaşık 250 mL).
- Kurban günü veya en fazla kurbandan önceki gece PBS'de seyreltilmiş paraformaldehit hazırlayın. Kurban gününde hazırlanıyorsanız, perfüzyona başlamadan önce paraformaldehitin oda sıcaklığına soğuduğunu sağlayın. Paraformaldehiti 4 °C'de saklayın.
- Fiksasyondan sonra, sol ve sağ şahdamarlarını çıkarın ve% 2-4 paraformaldehitte 2 saat boyunca 4 °C'de saklayın.
- Arterleri% 30 sakkaroza aktarın ve gece boyunca 4 ° C'de saklayın.
- 16-24 saat sonra, arterleri optimum kesme sıcaklığı (OCT) bileşiğine gömün ve OCT gömülü arter bloklarını dondurun.
- OCT'deki arterleri 10 dakika boyunca oda sıcaklığında koşullandır. Arteri, atardamar çatallanmasının karşı karşıya olduğu kriyomoldun tarafını işaretleyerek, OCT ile doldurulmuş kriyomold düzlemine paralel yerleştirin. Sıvı nitrojende çıtlatma.
- Dondurulmuş blokları -80 °C'de uzun süreli depolayın.
- Kriyostat kullanarak bölüm dondurulmuş bloklar.
- Slayt başına altı adet 5 μm kalınlığında arteriyel kesit toplayın, slayt 1 çatallanmadan başlar.
- Hiperplazi artık görünmeyene kadar bölüm donmuş bloklar (yaklaşık 100 slayt).
- Hematoksilin ve eozin (H&E) leke slaytları18
- Çatallanmadan başlayarak tüm arter boyunca her on slayttan birini boyayarak yaralanma bölgesini bulun (örneğin, slaytlar 1, 10, 20, 30, 40, 50, 60, 70, 80, 90 ve 100).
- Tepe tıkanıklığı olan slaydı bulmak için yaralanma bölgesinin etrafındaki ek slaytları lekeleyin (örneğin, slaytlar 20, 30 ve 40 görünür hiperplaziye sahipti, böylece 15, 25, 35 ve 45'i lekeler).
- Sıçan başına toplam 3-10 slayt için en yüksek tıkanıklık kaydırağından önce ve sonra (örneğin, slayt 35'te bulunan tepe tıkanıklığı, ardından slayt 25, 45, vb.) önce ve sonra en yüksek tıkanıklık ve eşitlikçi slaytlarla slaydı lekeleyin ve ölçün.
- Işık tabakası floresan mikroskopi görüntüleme için, 4.4 adımda fiksasyondan sonra arterleri gece boyunca 4 °C'de saklayın.
- 3 gün boyunca seyrelticide (pH 7.4) tavşan anti-CD31 birincil antikorunun 1:500 seyreltilmesi ile prob arteri. Daha sonra 2günboyunca anti-tavşan Alexa Fluor 647 ikincil antikor 1:500 seyreltme ile arter karşıt.
- iDISCO+20kullanarak atardamarı temizleyin.
- Bir ışık tabakası floresan mikroskobu kullanarak arteri görüntüleyin21. Görüntüleri yazılım kullanarak işle (örneğin, İmaris)19.
- Neointimal hiperplaziyi ölçün. Mümkünse kör bir şekilde nicelik gerçekleştirin.
- Yukarıda belirlenen 3-10 slaytın her birinde bir arterin intima, iç elastik lamina (IEL) ve dış elastik lamina (EEL) çevresini izlemek için ImageJ yazılımını kullanın (adım 4.8.3).
- ImageJ'de izlenen her bölgenin alanını ölçün ve bu değerleri dışa aktarın. İntima izi lümen alanını, IEL izi IEL alanını ve EEL izi EEL alanını verir.
- Sıçan şahdamar başına ortalama yaralanma (% oklüzyon, intima:media (I:M) oranı, neointimal hiperplazi) elde etmek için 3-10 slayttan elde edilen değerlerin ortalamasını alın.
Neointimal Hiperplazi = IEL alanı - Lümen alanı
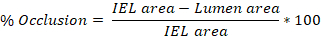
Sonuçlar
Şekil 1'de bu ameliyatı yapmak için kullanılan tüm malzemeler ve cerrahi aletler gösterdir. İki haftalık yaralı arteriyel kesitlerin hematoksilin ve eozin (H&E) lekelenmesi neointimal hiperplazinin net bir şekilde görselleştirilmesini sağlar. Şekil 2 sağlıklı, yaralı ve tedavi edilmiş bir arterin H&E lekeli arteriyel kesitlerinin temsili görüntülerini göstermektedir. Şekil 2 ayrıca, yaygın olarak kullanıla...
Tartışmalar
Sıçan şahdamar balon yaralanması en yaygın kullanılan ve çalışılan restenoz hayvan modellerinden biridir. Hem orijinal balon yaralanma modeli3 hem de modifiye basınç kontrollü segmental yaralanma varyasyonu10, insanlarda da meydana gelen arteriyel yaralanma yanıtının birçok yönünü bilgilendirmiş olup, birkaç sınırlama fibrin bakımından zengin trombüsin nadiren gelişmesi ve lokal iltihabın hiperkolletemik tavşan veya porsin modelleri
Açıklamalar
Yazarlar bu makalenin yayımlanması ile ilgili herhangi bir çıkar çatışması olmadığını beyan eder.
Teşekkürler
N.E.B., Ulusal Çevre Sağlığı Bilimleri Enstitüsü 'nden (5T32ES007126-35, 2018) bir eğitim hibesi ve Amerikan Kalp Derneği doktora öncesi bursu (20PRE35120321) ile desteklendi. E.S.M.B., UNC Klinik ve Çeviri Bilimi Ödülü-K12 Bursiyerleri Programı (KL2TR002490, 2018) ve Ulusal Kalp, Akciğer ve Kan Enstitüsü (K01HL145354) tarafından kısmen desteklenen bir KL2 bursiyeriydi. Yazarlar, UNC Mikroskopi Hizmetleri Laboratuvarı'ndan Dr. Pablo Ariel'e LSFM'ye yardımcı olduğu için teşekkür ediyor. Mikroskopi Hizmetleri Laboratuvarı'nda Işık Sac Floresan Mikroskopisi yapıldı. Patoloji ve Laboratuvar Tıbbı Anabilim Dalı Olan Mikroskopi Hizmetleri Laboratuvarı, kısmen UNC Lineberger Kapsamlı Kanser Merkezi'ne P30 CA016086 Kanser Merkezi Çekirdek Destek Hibesi ile desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | Fisher | 14955450 | |
| 1 mL Syringe with needle | BD | 309626 | |
| 2 French Fogarty Balloon Embolectomy Catheter | Edwards LifeSciences | 120602F | |
| 4-0 Ethilon (Nylon) Suture | Ethicon Inc | 662H | |
| 4-0 Vicryl Suture | Ethicon Inc | J214H | |
| 7-0 Prolene Suture | Ethicon Inc | 8800H | |
| 70% ethyl alcohol | |||
| Anti-Rabbit Alexa Fluor 647 | Thermo Fisher Scientific | A21245 | |
| Atropine Sulfate | Vedco Inc | for veterinary use | |
| Cotton Swabs | Puritan | 806-WC | |
| Curved Hemostats | Fine Science Tools | 13009-12 | |
| Fine Curved Forceps | Fine Science Tools | 11203-25 | |
| Fine Scissors | Fine Science Tools | 14090-11 | |
| Gauze | Covidien | 2252 | |
| IHC-Tek Diluent (pH 7.4) | IHC World | IW-1000 | |
| Insufflator | Merit Medical | IN4130 | |
| Iodine solution | |||
| Lubricating Eye Ointment | Dechra | for veterinary use | |
| Mayo Scissors | Fine Science Tools | 14010-15 | |
| Micro Serrefines | Fine Science Tools | 18055-05 | |
| Microdissection Scissors | Fine Science Tools | 15004-08 | |
| Micro-Serrefine Clamp Applying Forceps | Fine Science Tools | 18057-14 | |
| Needle Holder | Fine Science Tools | 12003-15 | |
| Pluronic-127 (diluted in sterile water) | Sigma-Aldrich | P2443 | 25% prepared |
| Rabbit Anti-CD31 | Abcam | ab28364 | |
| Retractor | Bent paper clips work well | ||
| Rimadyl (Carprofen) | Zoetis Inc | for veterinary use | |
| Saline solution | |||
| Standard Forceps | Fine Science Tools | 11006-12 | |
| Sterile Drape | Dynarex | 4410 | |
| T-Pins |
Referanslar
- American Heart Association. Cardiovascular Disease: A Costly Burden for America, Projections Through 2035. American Heart Association CVD Burden Report. , (2017).
- Singh, R. B., Mengi, S. A., Xu, Y. J., Arneja, A. S., Dhalla, N. S. Pathogenesis of atherosclerosis: A multifactorial process. Experimental and Clinical Cardiology. 7 (1), 40-53 (2002).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Mechanisms of stenosis after arterial injury. Laboratory Investigation. 49 (2), 208-215 (1983).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Kinetics of cellular proliferation after arterial injury. I. Smooth muscle growth in the absence of endothelium. Laboratory Investigation. 49 (3), 327-333 (1983).
- Sartore, S., et al. Contribution of adventitial fibroblasts to neointima formation and vascular remodeling: from innocent bystander to active participant. Circulation Research. 89 (12), 1111-1121 (2001).
- Tanaka, K., et al. Circulating progenitor cells contribute to neointimal formation in nonirradiated chimeric mice. The FASEB Journal. 22 (2), 428-436 (2008).
- Henry, M., et al. Carotid angioplasty and stenting under protection. Techniques, results and limitations. The Journal of Cardiovascular Surgery. 47 (5), 519-546 (2006).
- Kounis, N. G., et al. Thrombotic responses to coronary stents, bioresorbable scaffolds and the Kounis hypersensitivity-associated acute thrombotic syndrome. Journal of Thoracic Disease. 9 (4), 1155-1164 (2017).
- Jackson, C. L. Animal models of restenosis. Trends in Cardiovascular Medicine. 4 (3), 122-130 (1994).
- Shears, L. L., et al. Efficient inhibition of intimal hyperplasia by adenovirus-mediated inducible nitric oxide synthase gene transfer to rats and pigs in vivo. Journal of the American College of Surgeons. 187 (3), 295-306 (1998).
- Takayama, T., et al. A murine model of arterial restenosis: technical aspects of femoral wire injury. Journal of Visualized Experiments. (97), (2015).
- Zhang, L. N., Parkinson, J. F., Haskell, C., Wang, Y. X. Mechanisms of intimal hyperplasia learned from a murine carotid artery ligation model. Current Vascular Pharmacology. 6 (1), 37-43 (2008).
- Jahnke, T., et al. Characterization of a new double-injury restenosis model in the rat aorta. Journal of Endovascular Therapy. 12 (3), 318-331 (2005).
- Gregory, E. K., et al. Periadventitial atRA citrate-based polyester membranes reduce neointimal hyperplasia and restenosis after carotid injury in rats. American Journal of Physiology-Heart and Circulatory Physiology. 307 (10), 1419-1429 (2014).
- Buglak, N. E., Jiang, W., Bahnson, E. S. M. Cinnamic aldehyde inhibits vascular smooth muscle cell proliferation and neointimal hyperplasia in Zucker Diabetic Fatty rats. Redox Biology. 19, 166-178 (2018).
- Bahnson, E. S., et al. Long-term effect of PROLI/NO on cellular proliferation and phenotype after arterial injury. Free Radical Biology and Medicine. 90, 272-286 (2016).
- Gilbert, J. C. W., Davies, M. C., Hadgraft, J. The behaviour of Pluronic F127 in aqueous solution studied using fluorescent probes. International Journal of Pharmaceutics. 40 (1-2), 93-99 (1987).
- Tulis, D. A. Histological and morphometric analyses for rat carotid balloon injury model. Methods in Molecular Medicine. 139, 31-66 (2007).
- Buglak, N. E., et al. Light Sheet Fluorescence Microscopy as a New Method for Unbiased Three-Dimensional Analysis of Vascular Injury. Cardiovascular Research. , (2020).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Ariel, P. . UltraMicroscope II - A User Guide. , (2018).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Xiangdong, L., et al. Animal models for the atherosclerosis research: a review. Protein Cell. 2 (3), 189-201 (2011).
- Chen, H., Li, D., Liu, M. Novel Rat Models for Atherosclerosis. Journal of Cardiology and Cardiovascular Sceinces. 2 (2), 29-33 (2018).
- Xing, D., Nozell, S., Chen, Y. F., Hage, F., Oparil, S. Estrogen and mechanisms of vascular protection. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (3), 289-295 (2009).
- Tulis, D. A. Rat carotid artery balloon injury model. Methods in Molecular Medicine. 139, 1-30 (2007).
- Pellet-Many, C., et al. Neuropilins 1 and 2 mediate neointimal hyperplasia and re-endothelialization following arterial injury. Cardiovascular Research. 108 (2), 288-298 (2015).
- Wu, B., et al. Perivascular delivery of resolvin D1 inhibits neointimal hyperplasia in a rat model of arterial injury. Journal of Vascular Surgery. 65 (1), 207-217 (2017).
- Tan, J., Yang, L., Liu, C., Yan, Z. MicroRNA-26a targets MAPK6 to inhibit smooth muscle cell proliferation and vein graft neointimal hyperplasia. Scientific Reports. 7, 46602 (2017).
- Pearce, C. G., et al. Beneficial effect of a short-acting NO donor for the prevention of neointimal hyperplasia. Free Radical Biology and Medicine. 44 (1), 73-81 (2008).
- Cao, T., et al. S100B promotes injury-induced vascular remodeling through modulating smooth muscle phenotype. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1863 (11), 2772-2782 (2017).
- Madigan, M., Entabi, F., Zuckerbraun, B., Loughran, P., Tzeng, E. Delayed inhaled carbon monoxide mediates the regression of established neointimal lesions. Journal of Vascular Surgery. 61 (4), 1026-1033 (2015).
- Khurana, R., et al. Angiogenesis-dependent and independent phases of intimal hyperplasia. Circulation. 110 (16), 2436-2443 (2004).
- Tsihlis, N. D., Vavra, A. K., Martinez, J., Lee, V. R., Kibbe, M. R. Nitric oxide is less effective at inhibiting neointimal hyperplasia in spontaneously hypertensive rats. Nitric Oxide. 35, 165-174 (2013).
- Chen, J., et al. Inhibition of neointimal hyperplasia in the rat carotid artery injury model by a HMGB1 inhibitor. Atherosclerosis. 224 (2), 332-339 (2012).
- Mano, T., Luo, Z., Malendowicz, S. L., Evans, T., Walsh, K. Reversal of GATA-6 downregulation promotes smooth muscle differentiation and inhibits intimal hyperplasia in balloon-injured rat carotid artery. Circulation Research. 84 (6), 647-654 (1999).
- Becher, T., et al. Three-Dimensional Imaging Provides Detailed Atherosclerotic Plaque Morphology and Reveals Angiogenesis after Carotid Artery Ligation. Circulation Research. 126 (5), 619-632 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır