JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
쥐 경동맥 압력 제어 세그먼트 풍선 부상 과식 치료 응용 프로그램
요약
쥐 경동맥 풍선 부상은 죽상 경화성 혈관에서 혈류를 복원하기 위해 수행 된 임상 혈관 성형술 절차를 모방합니다. 이 모델은 동맥 벽을 손상시키고 내피 세포의 친밀감 층을 비명하여 동맥 손상 반응을 유도하여 궁극적으로 리모델링 및 친밀한 과플라스틱 반응을 일으킵니다.
초록
심혈 관 질환은 죽상 경화증으로 인해 전 세계적으로 사망과 장애의 주요 원인으로 남아 있습니다. 죽상 경화성 플라크는 동맥의 발광 표면적을 좁히어 장기및 탈조직에 대한 적절한 혈류를 줄입니다. 임상적으로, 풍선 혈관 성형술과 같은 변조 절차는 스텐트 배치의 유무에 관계없이 혈류를 회복하는 것을 목표로합니다. 이러한 절차는 플라크 부담을 줄여 혈류를 재확립하지만, 동맥 치유 반응을 시작하는 혈관 벽을 손상시킵니다. 장기간 치유 반응은 동맥 재결석을 일으키거나 다시 좁히며 궁극적으로 이러한 재혈관화 절차의 장기적인 성공을 제한합니다. 따라서, 전임상 동물 모델은 레스테노시스를 구동하는 병리학적 메커니즘을 분석하는 데 필수적이며, 새로운 치료 전략을 시험할 기회를 제공한다. Murine 모델은 대형 동물 모델보다 저렴하고 조작하기 쉽습니다. 풍선 또는 와이어 부상은 뮤린 모델에 사용되는 두 가지 일반적으로 허용되는 부상 양식입니다. 특히 풍선 상해 모델은 임상 혈관 성형술 절차를 모방하고 restenosis의 발달을 위한 동맥에 적당한 손상을 일으키는 원인이 됩니다. 본원에서 우리는 변형된 압력 조절 쥐 경동맥 풍선 상해 모형을 수행하고 조직학적으로 분석하기 위한 수술 세부 사항을 기술합니다. 추가적으로, 이 프로토콜은 치료의 현지 periadventitial 응용이 어떻게 신자극성 과대증을 억제하기 위하여 이용될 수 있는지 강조합니다. 마지막으로, 우리는 3 차원으로 동맥 상해를 화상 진찰하고 시각화하기위한 새로운 접근법으로 가벼운 시트 형광 현미경 검사를 제시합니다.
서문
심혈관 질환(CVD)은 전 세계적으로 사망의 주요 원인으로 남아있다. 죽상 동맥 경화증은 대부분의 CVD 관련 이환율및 사망의 근본 원인입니다. 죽상 동맥 경화증은 좁은 루멘을 초래하는 동맥 내부의 플라크가 축적되어 장기및 탈구 조직에 적절한 혈액 관류를 방해합니다2. 심한 죽상 동맥 경화증 치료에 대 한 임상 개입 포함 풍선 혈관 성형술 또는 스텐트 배치 없이. 이 개입은 플라크의 사이트에 풍선 카테터를 진행하고, 동맥 벽에 플라크를 압축풍선을 팽창, 발광 영역을 확대 포함. 그러나 이 절차는 동맥 손상 반응을 시동하는 동맥을 손상시다3. 이 상해 반응의 장기간 활성화는 동맥 재분비, 또는 재협화, 신자극성 증식 및 혈관 리모델링에 이차로 이끌어 냅니다. 혈관 성형술 동안 친밀감 층은 즉각적인 혈소판 모집 및 국소 염증으로 이어지는 내피 세포의 탈모된다. 국시 신호는 혈관 원활한 근육 세포 (VSMC) 및 출현 섬유 아세포에 있는 현상 변을 유도합니다. 이것은 VSMC와 섬유아세포의 이주 및 증식으로 이끌어 내고, 신동성증식4,5로이끌어 냅니다. 순환 선조 세포 및 면역 세포는 또한 restenosis6의전반적인 부피에 기여한다. 해당되는 경우, 약물 용출 스텐트 (DES)는 restenosis7을억제하기위한 현재 표준이다. DES는 동맥 재내피화를 억제하지만, 따라서 늦은 스텐트 혈전증8을초래할 수 있는 프로 혈전환경을 조성한다. 따라서 동물 모델은 restenosis의 병리학을 이해하고, 개정 절차의 효능을 연장하기 위한 더 나은 치료 전략을 개발하기 위한 데 필수적입니다.
몇몇 크고 작은 동물 모형9는 이 병리학을 공부하기 위해 이용됩니다. 여기에는 동맥의 발광 측의 풍선 부상3,10 또는 와이어 부상11, 동맥 주위의 부분 결찰12 또는 커프배치(13)가 포함됩니다. 풍선과 와이어 부상은 혈관 성형술 후 임상적으로 발생하는 것을 모방하여 동맥의 내피 층을 디누드합니다. 특히, 풍선 부상 모델은 임상 설정(즉, 풍선 카테터)과 유사한 도구를 사용합니다. 쥐 동맥은 시판되는 풍선 카테터에 적합한 크기이기 때문에 풍선 부상은 쥐 모델에서 가장 잘 수행됩니다. 본원에서 우리는 압력 제어 세그먼트 동맥 손상, 쥐 경동맥 풍선 부상의 잘 확립, 변형 된 버전을 설명합니다. 이러한 압력 제어 접근법은 임상 혈관 성형술 절차를 밀접하게 모방하고 부상 후 2주 후에 재현 가능한 신자극성 증식형성을가능하게 한다14,15. 추가적으로, 이 압력 통제 동맥 상해는 수술16후에 2 주에 의하여 완전한 내피 층 복원결과. 이것은 클로즈에 의해 설명 된 원래 풍선 부상 모델을 직접 대조하며, 내피 층이 전체 커버리지3로돌아오지 않습니다.
수술 후, 치료는 여러 가지 접근을 통해 부상당한 동맥에 적용되거나 방향화 될 수 있습니다. 본 명세서에서 기재된 방법은 Pluronic 젤 용액에 내장된 작은 분자의 회림적 적용을 사용합니다. 구체적으로, 100μM 계피 알데히드의 용액을 25% 황토-F127 젤로 25% 발동하여 부상 직후 동맥에 적용하여 신자극 성 증식형성(15)을억제한다. Pluronic-F127은17에국소적으로 약물을 전달할 수 있는 무독성, 열 가역성 젤이다. 한편, 동맥 상해는 현지, 따라서 지방 행정은 오프 대상 효과를 최소화하면서 활성 원칙을 테스트 할 수 있습니다. 그럼에도 불구하고, 이 방법을 이용한 치료의 효과적인 전달은 사용되는 작은 분자 또는 생물학적 제제의 화학에 달려 있다.
프로토콜
여기에 설명 된 모든 방법은 채플 힐에서 노스 캐롤라이나 대학의 기관 동물 관리 및 사용위원회 (IACUC)에 의해 승인되었습니다.
1. 수술 전 절차
- 수술 기구를 살균합니다. 수술 전에 모든 수술 기구를 자동 클로브하십시오. 같은 날 여러 번 수술을 하는 경우, 드라이 비드 멸균제를 사용하여 수술 사이에 기기를 멸균하십시오.
- 25% 물루론-127 젤 (멸균 증류수로 희석)로 치료 준비.
- 2F 포가티 풍선 카테터를 insufflator에 설치하고 카테터의 풍선 끝을 식염수 용액으로 채워진 1 mL 주사기에 놓습니다.
- 5% 이소플루란으로 챔버에 쥐를 배치하여 마취를 유도한다.
- 챔버에서 쥐를 제거하고 쥐의 무게를 기록합니다. 모발 클리퍼를 사용하여 복부 목 부위의 모피를 면도합니다.
- 마취의 유도를 보장하기 위해 5 % 이소플루란으로 다시 챔버에 쥐를 배치합니다.
- 쥐 의 얼굴이 외과 의사를 향해 되도록, 수술 플랫폼에 쥐 supine을 배치, 코 콘에 얼굴을 삽입.
- 흡입 마취를 1.5%로 감소시다. 4피트 모두에 발가락 핀치 반사로 마취의 깊이를 확인합니다.
- 네 다리를 수술 플랫폼으로 테이프로 바냅니다.
- 열 램프를 켭니다.
- 기도 분비물 감소시키기 위해 Atropine (0.01 mg/kg)를 피하하십시오.
- 예방 적 통증 관리를 위해 Carprofen (5 mg / kg)을 피하하십시오. 항염증제가 실험에 허용되지 않는 경우 단계 3.2.2 및 3.2.3단계를 지칭한다.
- 수술 중 각막이 건조되는 것을 방지하기 위해 멸균 면 봉면을 사용하여 윤활유 눈 연고를 두 눈에 적용하십시오.
- 목을 70% 에틸 알코올사이로 번갈아 가며 원을 그리며 목을 세 번 면봉한 다음, 면도 부위의 중심에서 Betadine이 바깥쪽으로 분리 부위를 살균합니다.
- 침절선 .c 침투하여 0.25%의 부피바카인을 장착합니다.
- 멸균 수술 기구 및 소모품을 취급하기 전에 멸균 수술 장갑을 착용하십시오.
- 멸균 수술 시트에 모든 자동 수술 기구를 배치합니다.
- 멸균 7-0 Prolene 봉합사의 세 개의 독립적 인 1 인치 가닥을 잘라.
- 수술 시트에 면봉과 거즈를 놓습니다.
- 살균 된 목 부위만 노출시키는 멸균 수술 시트로 쥐를 드레이프하십시오.
- 코 콘의 일부를 노출 시트에 추가 작은 구멍을 잘라. 이것은 부상 중에 풍선 카테터를 녹화하기위한 사이트가 될 것입니다.
2. 수술 절차
- 전체 외과 수술 동안, 호흡 속도를 모니터링하여 마취의 깊이를 평가 (속도는 일관되고 정상으로 간주되어야한다) 뿐만 아니라 발가락 핀치에 의해 15 분마다. 호흡률이 증가하거나 발가락 핀치에 대한 반응이있는 경우 외과 적 조작을 일시 중지하고 이소플루란을 최대 2.5 %까지 증가시킵니다.
- 일반적인 경동맥(CCA)을 노출한다.
- 쥐의 턱 뼈 사이에 피상적이고 직선적이며 세로적인 네크라인 절개를 합니다. 절개는 길이약 1.5~2cm입니다.
- 근육 층이 노출 될 때까지 피부 아래 결합 조직을 통해 절개를합니다. 근육 조직에 접근하기 위하여 피부 의 밑에 타액 샘을 대체합니다.
- 근육 층과 결합 조직 사이에 닫힌 가위를 삽입하고 피부를 위쪽으로 당기면서 가위를 부드럽게 열어 근육에서 결합 조직을 무뚝뚝하게 분리합니다.
- 두 개의 표면 근육에 수직으로 실행되는 제3 근육(omohyoid)이 관찰될 때까지 기관좌를 따라 두 개의 눈에 보이는 근육(sternohyoid 및 흉골)을 세로로 해부한다.
- 집게를 사용하여 기관 꼭대기에서 실행되는 세로 근육 (sternohyoid)에서이 수직 근육 (omohyoid)을 분리하는 창을 만듭니다. 기관지에 무딘 외상을 방지하기 위해 부드럽게이 분리를 수행합니다.
- 수직 근육 아래 집게에 도달하고 두 종방향 근육을 분리하고 CCA를 노출절단.
- CCA를 해부합니다.
- 내부 경동맥(ICA) 및 외부 경동맥(ECA)이 노출될 때까지 양분 부근의 CCA를 해부한다.
- ECA에서 분기 우수한 갑상선 동맥 (STA)을 해부.
- 미리 절단 된 Prolene 봉합사를 사용하여 STA와 ECA를 각각의 분기 근처에 리게이트하십시오. 대부분의 봉합사를 매듭의 한쪽으로 두고 곡선된 헤스테트와 함께 각 봉합사를 잡습니다.
- ICA 주변의 해부를 완료하고 ICA 아래와 주변의 집게에 도달하고 분쇄되지 않는 혈관 클램프를 사용하여 해부 제어를 달성하십시오. ICA와 함께 황두 동맥을 고정합니다.
- CCA 근위를 분기로 해부하여 미주 신경을 CCA로부터 분리합니다.
- CCA 아래와 주변의 집게에 도달하고 분쇄되지 않는 혈관 클램프를 사용하여 근위 제어를 달성하십시오. 분기에서 최소 5mm 의 클램프를 놓습니다.
- 풍선 부상을 수행합니다.
- 각 리게티드 동맥 가지를 들고 구부러진 헤모스타트를 기동하여 ECA와 우수한 분기 사이의 분기를 노출시하십시오.
- 양면에서 조직을 부드럽게 해부한 다음 미세 절제 가위를 사용하여 ECA와 우수한 분기 사이에 동맥 절개를 합니다.
- 면 봉면을 사용하여 모든 혈액을 CCA에서 밀어 내고 동맥 절제술 부위를 청소하십시오.
- 부풀린 풍선 카테터를 동맥 절제술을 통해 삽입하고 풍선의 근위 끝이 분기를 지나갈 때까지 CCA로 진군합니다.
- 테이프 카테터는 코 콘에 테이프 카테터를 통해 팽창시 동맥에서 풍선이 미끄러지지 않도록 합니다.
- 천천히 풍선을 5 대기로 팽창시키고 5 분 동안 CCA에 방치하여 동맥 손상을 유발합니다. 압력이 전체 5분 동안 일정하게 유지되도록 합니다.
- 5 분 후, 풍선을 수축하고 동맥 절제술을 통해 CCA에서 부드럽게 제거합니다.
- CCA의 클램프를 부드럽게 압착하여 CCA를 플러시하십시오. 클램프를 제거하지 마십시오.
- ECA 근위를 동맥 절제술로 리게이트한 다음 CCA 및 ICA에서 클램프를 제거하여 CCA를 통해 ICA로의 혈류를 복원합니다. 동맥 절제술 주위에 눈에 보이는 출혈이 없고 CCA가 맥동되고 있는지 확인하십시오.
- 치료 또는 플루론 젤 차량의 100 μL을 부상당한 CCA를 따라 페리어드벤처로만 적용하십시오. CCA의 왼쪽에 50 μL을 적용한 다음 CCA의 오른쪽에 50 μL을 적용하여 부상당한 동맥의 코팅도 보장합니다.
- 상처 부위를 닫습니다.
- 초과 프롤렌 봉합사를 잘라.
- 결합 조직을 따라 중단 된 4-0 또는 6-0 비릴 층을 사용하여 상처를 닫습니다.
- 피부를 따라 4-0 나일론 봉합사를 실행하여 상처를 닫습니다.
3. 수술 후 절차
- 쥐가 흉미를 유지하기에 충분한 의식을 회복 할 때까지 가열 램프 아래에 절반 케이지와 깨끗한 케이지에 혼자 쥐를 배치하고 모니터. 동물이 완전히 경고하고 원래 케이지로 다시 전송하기 전에 이동 될 때까지 별도의 케이지에 쥐를 유지합니다.
- 다음 3 일 동안 매일 쥐를 모니터링 한 다음 안락사까지 일주일에 세 번 모니터링할 수 있습니다. 이소플루란 과다 복용을 사용하여 안락사 하 고 아래 설명 된 양자 thoracotomy 다음.
- 연구 중 동물의 대체 정제 및 감소에 대 한 국립 센터를 활용 (NC3Rs) 근육 규모 수술 후 통증 수준을 식별 하기 위해. 어떤 동물이 고통을 경험하거나 신경학적 타협을 개발하는 것으로 보인다면, 즉시 희생하십시오.
- 카프로펜을 받지 않는 동물의 경우 수술 후 48시간 동안 수술 전 24시간 전에 식수에서 아세트아미노펜 6 mg/mL을 투여하십시오. 아세트아미노펜은 항염증 효과를 최소화하여 진통증을 제공합니다.
- 대안적으로, 최소한의 항염증 효과를 가진 그밖 진통 전략은 buprenorphine 또는 buprenorphine 확장 방출과 같은 이용될 수 있습니다. 교육기관에서 수의학팀과 상의하십시오.
4. 조직 수확 및 이미징
- 수술 후 2 주, 마취의 과다 복용에 의해 쥐를 안락사 (5% 이소플루란). 대안적으로, 동맥 상해 반응의 다양한 양상을 분석하기 위하여 이전 시점에서 쥐를 안락사시.
- 일단 호흡 정지는 안락사의 보조 방법으로 양측 thoracotomy를 수행합니다.
- 복부를 통해 측면 절개를 한 다음 횡격막과 갈비뼈를 통해 위쪽으로 자르고 흉부 구멍을 노출시십시오.
- 동맥을 퍼퓨즈하고 수정하십시오.
- 좌심실을 통해 중력 관류 고정 시스템에 부착된 18G 캐뉼라를 삽입합니다. 벤치탑(120cm 고도, 91± 3mmHg에 상응하는)을 기준으로 관류 시스템의 높이를 표시하여 쥐 간의 동등한 압력을 유지한다.
- 곡선 된 hemostat를 사용하여 심실과 함께 캐뉼라를 고정합니다.
- 오른쪽 아트리움에서 절단을 하고 혈관 회로를 열고 PBS로 관류를 시작하고 2-4% 파라포름알데히드(각각 약 250mL)가 뒤따릅니다.
- 희생의 날, 또는 희생 전날 밤 PBS에서 희석된 파라포름알데히드를 준비한다. 희생당일을 준비하는 경우, 관류를 시작하기 전에 파라포름알데히드가 실온으로 냉각되었는지 확인하십시오. 파라포름알데히드를 4°C에 보관하십시오.
- 고정 후, 좌우 경동맥을 추출하고 4°C에서 2-4% 파라포름알데히드에 2시간 동안 저장한다.
- 동맥을 30% 자당으로 옮기고 4°C에서 하룻밤 을 보관하십시오.
- 16-24 시간 후, 최적의 절삭 온도 (OCT) 화합물에 동맥을 포함하고 OCT 임베디드 동맥 블록을 동결.
- 10 월에 10 분 동안 실온에서 동맥을 조건. 10월로 가득 찬 극저온의 평면과 평행하게 동맥을 배치하여 동맥 분양이 직면하고 있는 극저온의 측면을 표시합니다. 액체 질소의 스냅 동결.
- -80°C에서 장기적으로 냉동 블록을 저장합니다.
- 극저온을 사용하여 섹션을 냉동 블록.
- 슬라이드당 6개의 5μm 두께의 동맥 횡단면을 수집하고, 슬라이드 1은 분기에서 시작됩니다.
- 단면도가 더 이상 보이지 않게 될 때까지 블록이 얼어 붙습니다(약 100슬라이드).
- 헤마톡시린 & 에오신(H&E) 스테인 슬라이드18
- 분기부터 시작하여 전체 동맥을 따라 10개의 슬라이드마다 염색하여 부상 부위를 찾습니다(예: 슬라이드 1, 10, 20, 30, 40, 50, 60, 70, 80, 90 및 100).
- 부상 부위 주변의 스테인 추가 슬라이드는 피크 오클루전을 가진 슬라이드를 찾습니다(예: 슬라이드 20, 30 및 40은 눈에 보이는 증식을 가졌고, 따라서 얼룩 슬라이드 15, 25, 35 및 45).
- 스테인 및 피크 오클루전 슬라이드 전후피크 오클루전 슬라이드(예: 슬라이드 35에서 발견된 피크 오클루전, 스테인 및 정량화 슬라이드 25, 45 등) 전후의 피크 오클루전 및 등거리 슬라이드로 슬라이드를 정량화하여 쥐 당 총 3-10 슬라이드를 제공합니다.
- 광시트 형광 현미경 이미징의 경우 4.4 단계에서 고정 후 4°C에서 동맥을 하룻밤 동안 보관하십시오.
- 3일 동안 희석제(pH 7.4)에서 토끼 항 CD31 1차 항체의 1:500 희석을 가진 동맥을 조사한다. 그런 다음 2 일19일 동안 안티 토끼 알렉사 플루어 647 이차 항체의 1:500 희석과 카운터 스테인 동맥.
- iDISCO +20을사용하여 동맥을 지웁다.
- 광시트 형광현미경(21)을이용하여 동맥을 이미지한다. 소프트웨어(예: Imaris)19를사용하여 이미지를 렌더링합니다.
- 정량화 신자극성 증식. 가능하면 눈이 멀게 정량화를 수행하십시오.
- ImageJ 소프트웨어를 사용하여 위의 결정된 3-10 슬라이드(Step 4.8.3)에 동맥의 인티마, 내부 탄성 라미나(IEL) 및 외부 탄성 라미나(EEL)의 둘레를 추적한다.
- ImageJ에서 추적된 각 영역의 영역을 정량화하고 이러한 값을 내보냅니다. 인티마 트레이스는 루멘 영역을 산출하고, IEL 추적은 IEL 영역을 산출하고, EEL 추적은 EEL 영역을 산출합니다.
- 쥐 경동맥 당 평균 부상 (% 폐색, intima:media (I:M) 비율, 신자극증을 얻기 위해 3-10 슬라이드에서 얻은 값을 평균.
네오인티멘 증식 = IEL 지역 - 루멘 지역
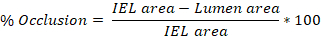
결과
그림 1은 이 수술을 수행하는 데 사용되는 모든 재료와 수술 도구를 보여줍니다. 헤마톡시린 & 에오신 (H&E) 2 주 부상 동맥 단면의 염색은 신자극증의 명확한 시각화를 허용합니다. 그림 2는 건강하고, 다치고, 취급된 동맥의 H&E 염색 동맥 단면의 대표적인 영상을 보여줍니다. 도 2는 또한 널리 사용되는 이미지 프로세싱 소프트웨어...
토론
쥐 경동맥 풍선 부상은 가장 광범위하게 사용되고 연구 된 restenosis 동물 모델 중 하나입니다. 원래 풍선 상해 모델3과 변형 된 압력 제어 세그먼트 상해변화(10)는 인간에서도 발생하는 동맥 상해 반응의 많은 측면을 통보했으며, 몇 가지 제한사항은 피브린이 풍부한 혈전이 거의 발생하지 않으며 국소 염증은 콜레스테롤 토끼 또는 돼지 모델9,<...
공개
저자는이 원고의 출판에 대한 이해의 충돌이 없다고 선언합니다.
감사의 말
N.E.B.는 국립 환경 보건 과학 연구소 (5T32ES007126-35, 2018)와 미국 심장 협회 전 박사 과정 펠로우십 (20PRE35120321)의 교육 보조금에 의해 지원되었습니다. E.S.M.B는 UNC 임상 및 번역 과학 상-K12 학자 프로그램(KL2TR002490, 2018),국립 심장, 폐 및 혈액 연구소(K01HL145354)가 부분적으로 지원하는 KL2 학자입니다. 저자는 LSFM을 지원한 UNC 현미경 서비스 연구소의 파블로 아리엘 박사에게 감사드립니다. 광시트 형광 현미경 검사는 현미경 서비스 실험실에서 수행되었다. 현미경 서비스 실험실, 병리학 및 실험실 의학의 학과는 UNC Lineberger 종합 암 센터에 P30 CA016086 암 센터 핵심 지원 교부금에 의해 부분적으로 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | Fisher | 14955450 | |
| 1 mL Syringe with needle | BD | 309626 | |
| 2 French Fogarty Balloon Embolectomy Catheter | Edwards LifeSciences | 120602F | |
| 4-0 Ethilon (Nylon) Suture | Ethicon Inc | 662H | |
| 4-0 Vicryl Suture | Ethicon Inc | J214H | |
| 7-0 Prolene Suture | Ethicon Inc | 8800H | |
| 70% ethyl alcohol | |||
| Anti-Rabbit Alexa Fluor 647 | Thermo Fisher Scientific | A21245 | |
| Atropine Sulfate | Vedco Inc | for veterinary use | |
| Cotton Swabs | Puritan | 806-WC | |
| Curved Hemostats | Fine Science Tools | 13009-12 | |
| Fine Curved Forceps | Fine Science Tools | 11203-25 | |
| Fine Scissors | Fine Science Tools | 14090-11 | |
| Gauze | Covidien | 2252 | |
| IHC-Tek Diluent (pH 7.4) | IHC World | IW-1000 | |
| Insufflator | Merit Medical | IN4130 | |
| Iodine solution | |||
| Lubricating Eye Ointment | Dechra | for veterinary use | |
| Mayo Scissors | Fine Science Tools | 14010-15 | |
| Micro Serrefines | Fine Science Tools | 18055-05 | |
| Microdissection Scissors | Fine Science Tools | 15004-08 | |
| Micro-Serrefine Clamp Applying Forceps | Fine Science Tools | 18057-14 | |
| Needle Holder | Fine Science Tools | 12003-15 | |
| Pluronic-127 (diluted in sterile water) | Sigma-Aldrich | P2443 | 25% prepared |
| Rabbit Anti-CD31 | Abcam | ab28364 | |
| Retractor | Bent paper clips work well | ||
| Rimadyl (Carprofen) | Zoetis Inc | for veterinary use | |
| Saline solution | |||
| Standard Forceps | Fine Science Tools | 11006-12 | |
| Sterile Drape | Dynarex | 4410 | |
| T-Pins |
참고문헌
- American Heart Association. Cardiovascular Disease: A Costly Burden for America, Projections Through 2035. American Heart Association CVD Burden Report. , (2017).
- Singh, R. B., Mengi, S. A., Xu, Y. J., Arneja, A. S., Dhalla, N. S. Pathogenesis of atherosclerosis: A multifactorial process. Experimental and Clinical Cardiology. 7 (1), 40-53 (2002).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Mechanisms of stenosis after arterial injury. Laboratory Investigation. 49 (2), 208-215 (1983).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Kinetics of cellular proliferation after arterial injury. I. Smooth muscle growth in the absence of endothelium. Laboratory Investigation. 49 (3), 327-333 (1983).
- Sartore, S., et al. Contribution of adventitial fibroblasts to neointima formation and vascular remodeling: from innocent bystander to active participant. Circulation Research. 89 (12), 1111-1121 (2001).
- Tanaka, K., et al. Circulating progenitor cells contribute to neointimal formation in nonirradiated chimeric mice. The FASEB Journal. 22 (2), 428-436 (2008).
- Henry, M., et al. Carotid angioplasty and stenting under protection. Techniques, results and limitations. The Journal of Cardiovascular Surgery. 47 (5), 519-546 (2006).
- Kounis, N. G., et al. Thrombotic responses to coronary stents, bioresorbable scaffolds and the Kounis hypersensitivity-associated acute thrombotic syndrome. Journal of Thoracic Disease. 9 (4), 1155-1164 (2017).
- Jackson, C. L. Animal models of restenosis. Trends in Cardiovascular Medicine. 4 (3), 122-130 (1994).
- Shears, L. L., et al. Efficient inhibition of intimal hyperplasia by adenovirus-mediated inducible nitric oxide synthase gene transfer to rats and pigs in vivo. Journal of the American College of Surgeons. 187 (3), 295-306 (1998).
- Takayama, T., et al. A murine model of arterial restenosis: technical aspects of femoral wire injury. Journal of Visualized Experiments. (97), (2015).
- Zhang, L. N., Parkinson, J. F., Haskell, C., Wang, Y. X. Mechanisms of intimal hyperplasia learned from a murine carotid artery ligation model. Current Vascular Pharmacology. 6 (1), 37-43 (2008).
- Jahnke, T., et al. Characterization of a new double-injury restenosis model in the rat aorta. Journal of Endovascular Therapy. 12 (3), 318-331 (2005).
- Gregory, E. K., et al. Periadventitial atRA citrate-based polyester membranes reduce neointimal hyperplasia and restenosis after carotid injury in rats. American Journal of Physiology-Heart and Circulatory Physiology. 307 (10), 1419-1429 (2014).
- Buglak, N. E., Jiang, W., Bahnson, E. S. M. Cinnamic aldehyde inhibits vascular smooth muscle cell proliferation and neointimal hyperplasia in Zucker Diabetic Fatty rats. Redox Biology. 19, 166-178 (2018).
- Bahnson, E. S., et al. Long-term effect of PROLI/NO on cellular proliferation and phenotype after arterial injury. Free Radical Biology and Medicine. 90, 272-286 (2016).
- Gilbert, J. C. W., Davies, M. C., Hadgraft, J. The behaviour of Pluronic F127 in aqueous solution studied using fluorescent probes. International Journal of Pharmaceutics. 40 (1-2), 93-99 (1987).
- Tulis, D. A. Histological and morphometric analyses for rat carotid balloon injury model. Methods in Molecular Medicine. 139, 31-66 (2007).
- Buglak, N. E., et al. Light Sheet Fluorescence Microscopy as a New Method for Unbiased Three-Dimensional Analysis of Vascular Injury. Cardiovascular Research. , (2020).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Ariel, P. . UltraMicroscope II - A User Guide. , (2018).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Xiangdong, L., et al. Animal models for the atherosclerosis research: a review. Protein Cell. 2 (3), 189-201 (2011).
- Chen, H., Li, D., Liu, M. Novel Rat Models for Atherosclerosis. Journal of Cardiology and Cardiovascular Sceinces. 2 (2), 29-33 (2018).
- Xing, D., Nozell, S., Chen, Y. F., Hage, F., Oparil, S. Estrogen and mechanisms of vascular protection. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (3), 289-295 (2009).
- Tulis, D. A. Rat carotid artery balloon injury model. Methods in Molecular Medicine. 139, 1-30 (2007).
- Pellet-Many, C., et al. Neuropilins 1 and 2 mediate neointimal hyperplasia and re-endothelialization following arterial injury. Cardiovascular Research. 108 (2), 288-298 (2015).
- Wu, B., et al. Perivascular delivery of resolvin D1 inhibits neointimal hyperplasia in a rat model of arterial injury. Journal of Vascular Surgery. 65 (1), 207-217 (2017).
- Tan, J., Yang, L., Liu, C., Yan, Z. MicroRNA-26a targets MAPK6 to inhibit smooth muscle cell proliferation and vein graft neointimal hyperplasia. Scientific Reports. 7, 46602 (2017).
- Pearce, C. G., et al. Beneficial effect of a short-acting NO donor for the prevention of neointimal hyperplasia. Free Radical Biology and Medicine. 44 (1), 73-81 (2008).
- Cao, T., et al. S100B promotes injury-induced vascular remodeling through modulating smooth muscle phenotype. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1863 (11), 2772-2782 (2017).
- Madigan, M., Entabi, F., Zuckerbraun, B., Loughran, P., Tzeng, E. Delayed inhaled carbon monoxide mediates the regression of established neointimal lesions. Journal of Vascular Surgery. 61 (4), 1026-1033 (2015).
- Khurana, R., et al. Angiogenesis-dependent and independent phases of intimal hyperplasia. Circulation. 110 (16), 2436-2443 (2004).
- Tsihlis, N. D., Vavra, A. K., Martinez, J., Lee, V. R., Kibbe, M. R. Nitric oxide is less effective at inhibiting neointimal hyperplasia in spontaneously hypertensive rats. Nitric Oxide. 35, 165-174 (2013).
- Chen, J., et al. Inhibition of neointimal hyperplasia in the rat carotid artery injury model by a HMGB1 inhibitor. Atherosclerosis. 224 (2), 332-339 (2012).
- Mano, T., Luo, Z., Malendowicz, S. L., Evans, T., Walsh, K. Reversal of GATA-6 downregulation promotes smooth muscle differentiation and inhibits intimal hyperplasia in balloon-injured rat carotid artery. Circulation Research. 84 (6), 647-654 (1999).
- Becher, T., et al. Three-Dimensional Imaging Provides Detailed Atherosclerotic Plaque Morphology and Reveals Angiogenesis after Carotid Artery Ligation. Circulation Research. 126 (5), 619-632 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유