Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine Ratte Carotis Arterie Druck-kontrollierte segmentale Ballonverletzung mit periadventitialen therapeutischen Anwendung
In diesem Artikel
Zusammenfassung
Die Ratten-Carotis-Arterie Ballon-Verletzung imitiert das klinische Angioplastie-Verfahren zur Wiederherstellung des Blutflusses in atherosklerotischen Gefäßen. Dieses Modell induziert die arterielle Verletzungsreaktion, indem es die arterielle Wand distend und die Intimschicht von Endothelzellen denudiert, was letztlich zu einer Umgestaltung und einer intimalen hyperplastischen Reaktion führt.
Zusammenfassung
Herz-Kreislauf-Erkrankungen sind nach wie vor die häufigste Todesursache und Behinderung weltweit, zum Teil aufgrund von Arteriosklerose. Atherosklerotische Plaque verengt die luminale Oberfläche in den Arterien und reduziert so den ausreichenden Blutfluss zu Organen und distalen Geweben. Klinisch zielen Revaskularisationsverfahren wie Ballonangioplastie mit oder ohne Stentplatzierung darauf ab, den Blutfluss wiederherzustellen. Obwohl diese Verfahren den Blutfluss wieder herstellen, indem sie die Plaquebelastung reduzieren, beschädigen sie die Gefäßwand, die die arterielle Heilungsreaktion einleitet. Die verlängerte Heilungsreaktion verursacht arterielle Resensibilisierung oder eine erneute Verengung, was letztlich den langfristigen Erfolg dieser Revaskularisationsverfahren einschränkt. Daher sind präklinische Tiermodelle integraler Bestandteil für die Analyse der pathophysiologischen Mechanismen, die die Restenose antreiben, und bieten die Möglichkeit, neuartige therapeutische Strategien zu testen. Murine Modelle sind billiger und einfacher zu bedienen als große Tiermodelle. Ballon- oder Drahtverletzungen sind die beiden allgemein akzeptierten Verletzungsmodalitäten, die in murinen Modellen verwendet werden. Insbesondere Ballonverletzungsmodelle imitieren das klinische Angioplastieverfahren und verursachen ausreichende Schäden an der Arterie für die Entwicklung der Restenose. Hierin beschreiben wir die chirurgischen Details für die Durchführung und histologische Analyse des modifizierten, druckgesteuerten Ratten-Carotis-Arterien-Verletzungsmodells. Darüber hinaus zeigt dieses Protokoll, wie lokale periadventitelle Anwendung von Therapeutika verwendet werden kann, um neointimale Hyperplasie zu hemmen. Schließlich präsentieren wir die Lichtbogenfluoreszenzmikroskopie als neuartigen Ansatz zur Abbildung und Visualisierung der arteriellen Verletzung in drei Dimensionen.
Einleitung
Herz-Kreislauf-Erkrankungen (CVD) bleibt weltweit die häufigste Todesursache1. Atherosklerose ist die zugrunde liegende Ursache für die meisten CVD-bedingten Morbiditätunden. Atherosklerose ist die Ansammlung von Plaque in arterien, die in einem verengten Lumen führt, die ordnungsgemäße Blutdurchblutung zu Organen und distalen Geweben behindert2. Klinische Interventionen zur Behandlung schwerer Arteriosklerose sind Ballonangioplastie mit oder ohne Stentplatzierung. Diese Intervention beinhaltet das Vorrücken eines Ballonkatheters an die Stelle der Plaque, und das Aufblasen des Ballons, um die Plaque auf die arterielle Wand zu komprimieren, die Die Luminalfläche zu verbreitern. Dieses Verfahren schadet jedoch der Arterie und initiiert die arterielleVerletzungsreaktion 3. Eine längere Aktivierung dieser Verletzungsreaktion führt zu arterieller Resetnose oder Re-Verengung, sekundär zu neointimer Hyperplasie und Gefäßumbau. Während der Angioplastie wird die Intimschicht von Endothelzellen denudiert, was zu einer sofortigen Thrombozytenrekrutierung und lokalen Entzündungen führt. Lokale Signalisierung induziert phänotypische Veränderungen in vaskulären glatten Muskelzellen (VSMC) und adventlichen Fibroblasten. Dies führt zur Migration und Verbreitung von VSMC und Fibroblasten nach innen zum Lumen, was zu neointimer Hyperplasie4,5führt. Zirkulierende Vorläuferzellen und Immunzellen tragen ebenfalls zum Gesamtvolumen der Restenose6bei. Gegebenenfalls sind drogeneluierende Stents (DES) der aktuelle Standard zur Hemmung der Restenose7. DES hemmt jedoch eine arterielle Reendothelisierung und schafft so eine prothrombotische Umgebung, die zu einer späten In-Stent-Thrombose führen kann8. Daher sind Tiermodelle sowohl für das Verständnis der Pathophysiologie der Restenose als auch für die Entwicklung besserer therapeutischer Strategien zur Verlängerung der Wirksamkeit von Revaskularisationsverfahren von wesentlicher Bedeutung.
Mehrere große und kleine Tiermodelle9 werden für das Studium dieser Pathologie verwendet. Dazu gehören Ballon-Verletzung3,10 oder Draht-Verletzung11 der luminalen Seite einer Arterie, sowie Teilligation12 oder Manschettenplatzierung13 um die Arterie. Die Ballon- und Drahtverletzung verleugnen die Endothelschicht der Arterie und imitieren, was klinisch nach der Angioplastie geschieht. Insbesondere verwenden Ballonverletzungsmodelle ähnliche Werkzeuge wie im klinischen Umfeld (d. h. Ballonkatheter). Die Ballonverletzung wird am besten in Rattenmodellen durchgeführt, da Rattenarterien eine geeignete Größe für handelsübliche Ballonkatheter sind. Hierin beschreiben wir eine druckgesteuerte segmentale Arterienverletzung, eine etablierte, modifizierte Version der Rattenkarotisarterienballonverletzung. Dieser druckgesteuerte Ansatz imitiert das klinische Angioplastieverfahren und ermöglicht eine reproduzierbare neointimale Hyperplasiebildung zwei Wochen nach Derverletzung14,15. Darüber hinaus führt diese druckgesteuerte arterielle Verletzung zu einer vollständigen Endothelschichtwiederherstellung um 2 Wochen nach der Operation16. Dies steht direkt im Gegensatz zum ursprünglichen Ballonverletzungsmodell, das von Clowes beschrieben wird, wo die Endothelschicht nie wieder vollständig abgedeckt wird3.
Nach der Operation können Therapeutika auf die verletzte Arterie durch mehrere Ansätze angewendet oder auf sie gerichtet werden. Das hier beschriebene Verfahren verwendet die periadventitelle Anwendung eines kleinen Moleküls, das in eine Pluronic-Gellösung eingebettet ist. Insbesondere wenden wir eine Lösung von 100 'M cinnamic aldehyd in 25% Pluronic-F127 Gel auf die Arterie unmittelbar nach der Verletzung an, um die neointimale Hyperplasiebildung zu hemmen15. Pluronic-F127 ist ein ungiftiges, thermoreversibles Gel, das in der Lage ist, Medikamente lokal kontrolliert zu liefern17. In der Zwischenzeit ist die arterielle Verletzung lokal, daher ermöglicht die lokale Verwaltung das Testen eines Aktivenprinzips bei gleichzeitiger Minimierung von Off-Target-Effekten. Dennoch hängt die effektive Abgabe eines Therapeuten mit dieser Methode von der Chemie des verwendeten kleinen Moleküls oder biologischen Materials ab.
Protokoll
Alle hier beschriebenen Methoden wurden vom Institutional Animal Care and Use Committee (IACUC) der University of North Carolina at Chapel Hill genehmigt.
1. Präoperative Verfahren
- Sterilisieren Sie chirurgische Instrumente. Autoklaven Sie alle chirurgischen Instrumente vor der Operation. Wenn Sie mehrere Operationen am selben Tag durchführen, sterilisieren Sie Instrumente zwischen Operationen mit einem trockenen Perlensterilisator.
- Bereiten Sie therapeutische in 25% Pluronic-127 Gel (in sterilem destilliertem Wasser verdünnt).
- Richten Sie einen 2F Fogarty Ballonkatheter auf den Insufflator ein und legen Sie das Ballonende des Katheters in eine 1 ml Spritze, die mit einer Salinelösung gefüllt ist.
- Induzieren Sie anästhesie, indem Sie die Ratte in eine Kammer mit 5% Isofluran e.V. setzen.
- Entfernen Sie die Ratte aus der Kammer und notieren Sie das Gewicht der Ratte. Verwenden Sie Haarschneider, um Fell auf dem ventralen Halsbereich zu rasieren.
- Legen Sie die Ratte wieder in die Kammer mit 5% Isofluran, um die Induktion der Anästhesie zu gewährleisten.
- Legen Sie die Rattensupine auf eine chirurgische Plattform und setzen Sie das Gesicht in den Nasenkegel, so dass das Rattengesicht in Richtung des Chirurgen ist.
- Reduzieren Sie die inhalative Anästhesie auf 1,5% Isofluran. Überprüfen Sie die Tiefe der Anästhesie durch einen Zehen-Pinch-Reflex auf allen vier Füßen.
- Band alle vier Beine bis zur chirurgischen Plattform.
- Schalten Sie die Wärmelampe ein.
- Injizieren Sie Atropin (0,01 mg/kg) subkutan, um Atemwegssekrete zu reduzieren.
- Injizieren Sie Carprofen (5 mg/kg) subkutan zur prophylaktischen Schmerztherapie. Wenn entzündungshemmende Medikamente für das Experiment nicht akzeptabel sind, beziehen Sie sich auf die Schritte 3.2.2 und 3.2.3.
- Verwenden Sie Schmiermittel-Augensalbe auf beide Augen mit einem sterilen Wattestäbchen, um das Trocknen von Hornhäuten während der Operation zu verhindern.
- Wischen Sie den Hals dreimal in einer kreisförmigen Bewegung abwechselnd zwischen 70% Ethylalkohol gefolgt von Betadine aus der Mitte der rasierten Region nach außen, um die Einschnittstelle zu sterilisieren.
- Infiltrieren Sie die Einschnittlinie s.c. mit 0,25% Bupivacain.
- Setzen Sie sterile chirurgische Handschuhe auf, bevor Sie sterile chirurgische Instrumente und Zubehör verwenden.
- Legen Sie alle autoklavierten chirurgischen Instrumente auf einem sterilen chirurgischen Blatt aus.
- Schneiden Sie drei unabhängige 1 Zoll Stränge steriler 7-0 Prolene Naht.
- Wattestäbchen und Gaze auf chirurgisches Blatt legen.
- Die Ratte mit einem sterilen Operationsblatt, das nur den sterilisierten Halsbereich freilegt, drapieren.
- Schneiden Sie eine zusätzliche kleine Öffnung in Blatt, die einen Teil des Nasenkegels freisetzt. Dies wird der Ort sein, um den Ballonkatheter während der Verletzung zu kleben.
2. Operative Verfahren
- Während des gesamten chirurgischen Eingriffs die Tiefe der Anästhesie bewerten, indem Sie die Atemfrequenz überwachen (die Rate sollte konsistent und als normal angesehen werden) sowie alle 15 min durch Zehenkneifen. Wenn die Atemfrequenz steigt oder es eine Reaktion auf die Zehenprise gibt, dann unterbrechen Sie die chirurgische Manipulation und erhöhen Sie Isofluran bis zu 2,5%.
- Belichten Sie die gemeinsame Halsschlagader (CCA).
- Machen Sie einen oberflächlichen, geraden, Längsausschnitt Schnitt zwischen den Kieferknochen der Ratte. Der Schnitt wird etwa 1,5-2 cm lang sein.
- Machen Sie einen Schnitt durch das Bindegewebe unter der Haut, bis die Muskelschicht ausgesetzt ist. Verdrängen Sie die Speicheldrüsen unter der Haut, um auf das Muskelgewebe zuzugreifen.
- Trennen Sie das Bindegewebe unverblümt vom Muskel, indem Sie eine geschlossene Schere zwischen Muskelschicht und Bindegewebe einsetzen und die Schere sanft öffnen, während Sie die Haut nach oben ziehen.
- Sezieren Sie die beiden sichtbaren Muskeln (sternohyoid und sternomastoid) längs entlang der linken Seite der Luftröhre, bis ein dritter Muskel (Omohyoid) beobachtet wird, der senkrecht zu den beiden oberflächlichen Muskeln verläuft.
- Verwenden Sie Zangen, um ein Fenster zu erstellen, das diesen senkrechten Muskel (Omohyoid) vom Längsmuskel (Sternohyoid) trennt, der auf der Luftröhre verläuft. Führen Sie diese Trennung vorsichtig durch, um ein stumpfes Trauma der Luftröhre zu verhindern.
- Erreichen Sie Zangen unter dem senkrechten Muskel und schneiden Sie die beiden Längsmuskeln zu trennen und die CCA aussetzen.
- Sezieren Sie die CCA.
- Sezieren Sie die CCA in der Nähe der Bifurkation, bis die interne Halsschlagader (ICA) und die äußere Halsartery (ECA) freigelegt werden.
- Sezieren Sie die überlegene Schilddrüsenarterie (STA), die aus dem ECA verzweigt.
- Mit den vorgeschnittenen Prolene-Nähten ligate die STA und die ECA in der Nähe ihrer jeweiligen Bifurkation. Lassen Sie den Großteil der Naht auf einer Seite des Knotens und greifen Sie jede Naht mit einem gekrümmten Hämostat.
- Beenden Sie die Sezierung um die ICA, erreichen Sie Zangen unter und um die ICA und verwenden Sie eine nicht zerkleinerte Gefäßklemme, um eine distale Kontrolle zu erreichen. Klemmen Sie die Okzipitalarterie zusammen mit der ICA.
- Sezieren Sie das CCA-Proximal zur Bifurkation und stellen Sie sicher, dass der Vagusnerv vom CCA getrennt wird.
- Erreichen Sie Zangen unter und um den CCA und verwenden Sie eine nicht zerkleinerte Gefäßklemme, um eine proximale Kontrolle zu erreichen. Klemme mindestens 5 mm von der Bifurkation entfernt.
- Führen Sie Ballonverletzungen aus.
- Manövrieren Sie die gekrümmten Hämostate, die jeden ligaten Arterienzweig halten, um die Bifurkation zwischen dem ECA und dem überlegenen Zweig aufzudecken.
- Sezieren Sie das Gewebe vorsichtig an der Bifurkation und machen Sie dann einen Arteriotomie-Schnitt zwischen dem ECA und dem überlegenen Zweig mit einer Mikrodissektionsschere.
- Verwenden Sie einen Wattestäbchen, um das gesamte Blut aus dem CCA zu schieben und die Arteriotomie-Website zu säubern.
- Legen Sie den ungeblähen Ballonkatheter durch die Arteriotomie ein und rücken Sie in die CCA vor, bis das proximale Ende des Ballons hinter der Bifurkation liegt.
- Bandkatheter an den Nasenkegel, damit der Ballon während der Inflation nicht aus der Arterie rutscht.
- Aufblasen Sie den Ballon langsam auf 5 Druckatmosphären und lassen Sie ihn 5 Minuten lang im CCA ab, um eine arterielle Verletzung auszulösen. Stellen Sie sicher, dass der Druck während der gesamten 5 min konstant bleibt.
- Nach 5 min, entleeren Ballon und sanft aus dem CCA durch die Arteriotomie zu entfernen.
- Spülen Sie den CCA, indem Sie die Klemme am CCA vorsichtig drücken. Entfernen Sie die Klemme nicht.
- Ligate das ECA-Proximal an die Arteriotomie und entferne dann die Klemmen aus dem CCA und der ICA, um den Blutfluss durch das CCA in die ICA wiederherzustellen. Stellen Sie sicher, dass es keine sichtbaren Blutungen um die Arteriotomie gibt und dass die CCA pulsiert.
- Tragen Sie allein 100 L therapeutisches oder pluronisches Gelfahrzeug periadventitially entlang des verletzten CCA auf. Achten Sie dabei auf die linke Seite des CCA und dann auf die rechte Seite des CCA, um eine gleichmäßige Beschichtung der verletzten Arterie zu gewährleisten.
- Schließen Sie die Wundstelle.
- Überschüssige Prolene-Nähte schneiden.
- Schließen Sie die Wunde mit unterbrochenen 4-0 oder 6-0 Vicryl-Schichten entlang des Bindegewebes.
- Beenden Sie das Schließen der Wunde mit laufender 4-0 Nylon Naht entlang der Haut.
3. Postoperative Verfahren
- Legen Sie die Ratte allein in einen sauberen Käfig mit der Hälfte des Käfigs unter einer Heizlampe und überwachen Sie, bis die Ratte genügend Bewusstsein zurückerlangt, um die Brustruhe aufrechtzuerhalten. Halten Sie die Ratte in einem separaten Käfig, bis das Tier vollständig wachsam und mobil ist, bevor Es in seinen ursprünglichen Käfig zurückversetzt wird.
- Überwachen Sie die Ratte täglich für die nächsten drei Tage und dann dreimal pro Woche bis zur Sterbehilfe. Euthanisieren Sie mit Isofluran-Überdosierung gefolgt von bilateraler Thorakotomie wie unten beschrieben.
- Nutzen Sie das National Centre for the Replacement Refinement & Reduction of Animals in Research (NC3Rs) Grimace Scale, um postoperative Schmerzniveaus zu identifizieren. Wenn ein Tier Schmerzen zu haben scheint oder einen neurologischen Kompromiss entwickelt, opfern Sie sofort.
- Für Tiere, die kein Carprofen erhalten, adienen Acetaminophen 6 mg/ml in ihrem Trinkwasser 24 h vor der Operation durch 48 h nach der Operation. Acetaminophen bietet Analgesie mit minimalen entzündungshemmenden Wirkungen.
- Alternativ können andere Analgesie-Strategien mit minimaler entzündungshemmender Wirkung verwendet werden, wie Buprenorphin oder Buprenorphin erweiterte Freisetzung. Wenden Sie sich an das Veterinärteam Ihrer Einrichtung.
4. Gewebeernte und Bildgebung
- Zwei Wochen nach der Operation, einschläfern Sie die Ratte durch Überdosierung der Anästhesie (5% Isofluran). Alternativ können Ratten zu einem früheren Zeitpunkt eingeschläfert werden, um die verschiedenen Aspekte der arteriellen Verletzungsreaktion zu analysieren.
- Sobald die Atmung stoppt, führen bilaterale Thorakotomie als sekundäre Methode der Euthanasie.
- Machen Sie einen seitlichen Schnitt durch den Bauch, und schneiden Sie dann nach oben, durch das Zwerchfell und die Rippen, die die Brusthöhle freisetzen.
- Durchdringen und fixieren Sie die Arterien.
- Legen Sie eine 18 G Kanüle, die an einem Gravitationsperfusions-Fixationssystem befestigt ist, durch den linken Ventrikel ein. Halten Sie den äquivalenten Druck zwischen Ratten aufrecht, indem Sie die Höhe des Perfusionssystems relativ zur Tischplatte markieren (120 cm Höhe, entsprechend 91 ± 3 mmHg).
- Klemmen Sie die Kanüle zusammen mit dem Ventrikel mit einem gekrümmten Hämostat.
- Machen Sie einen Schnitt im rechten Vorhof, öffnen Sie den Gefäßkreislauf und beginnen Sie die Perfusion mit PBS, gefolgt von 2-4% Paraformaldehyd (jeweils ca. 250 ml).
- Bereiten Sie Paraformaldehyd in PBS am Tag des Opfers verdünnt, oder höchstens in der Nacht vor dem Opfer. Bei der Vorbereitung am Tag des Opfers, stellen Sie sicher, dass Paraformaldehyd auf Raumtemperatur abgekühlt ist, bevor Sie mit der Perfusion beginnen. Paraformaldehyd bei 4 °C lagern.
- Nach der Fixierung die linken und rechten Karotisarterien extrahieren und bei 4 °C für 2 h in 2-4% Paraformaldehyd lagern.
- Arterien auf 30% Saccharose übertragen und über Nacht bei 4 °C lagern.
- Nach 16-24 h die Arterien in eine optimale Schnitttemperatur (OCT) einbetten und OCT-eingebettete Arterienblöcke einfrieren.
- Zustand Arterien in OCT bei Raumtemperatur für 10 min. Platzieren Sie die Arterie parallel zur Ebene des mit OCT gefüllten Kryomolds und markieren Sie die Seite des Kryomolds, auf die die arterielle Bifurkation gerichtet ist. Snap-Freeze in flüssigem Stickstoff.
- Tiefkühlblöcke langfristig bei -80 °C lagern.
- Abschnitt gefrorene Blöcke mit einem Kryostat.
- Sammeln Sie sechs 5 m dicke arterielle Querschnitte pro Rutsche, wobei Rutsche 1 an der Bifurkation beginnt.
- Abschnitt eingefrorene Blöcke, bis Hyperplasie nicht mehr sichtbar ist (ca. 100 Dias).
- Hämatoxylin & Eosin (H&E) Fleckenrutschen18
- Finden Sie den Bereich der Verletzung, indem Sie eine von zehn Dias entlang der gesamten Arterie ab der Bifurkation (z. B. Rutschen 1, 10, 20, 30, 40, 50, 60, 70, 80, 90 und 100) färben.
- Stain zusätzliche Dias um die Stelle der Verletzung, um die Rutsche mit Spitzenverschluss zu finden (z. B. Rutschen 20, 30 und 40 hatten sichtbare Hyperplasie, so Fleckenrutschen 15, 25, 35 und 45).
- Beflecken und quantifizieren Sie die Rutsche mit Spitzenverschluss und äquidistanten Dias vor und nach dem Spitzenverschlussrutsche (z. B. Spitzenverschluss, der bei Folie 35 gefunden wird, dann Flecken und Quantifizierungsgleitet 25, 45 usw.) für insgesamt 3-10 Dias pro Ratte.
- Für die Lichtbogenfluoreszenzmikroskopie-Bildgebung die Arterien über Nacht bei 4 °C nach Fixierung in Schritt 4.4 aufbewahren.
- Probearterie mit 1:500 Verdünnung des Kaninchenanti-CD31 Primärantikörpers in Verdünnungsmittel (pH 7.4) für 3 Tage. Dann Gegenfleck arterien mit 1:500 Verdünnung von Anti-Kaninchen Alexa Fluor 647 Sekundärantikörper für 2 Tage19.
- Löschen Sie die Arterie mit iDISCO+20.
- Bild der Arterie mit einem Lichtbogenfluoreszenzmikroskop21. Rendern von Bildern mit Software (z.B. Imaris)19.
- Quantifizieren Sie neointimale Hyperplasie. Führen Sie die Quantifizierung nach Möglichkeit in geblendeter Weise durch.
- Verwenden Sie die ImageJ-Software, um den Umfang der oben ermittelten 3-10 Dias (Schritt 4.8.3) zu verfolgen.
- Quantifizieren Sie die Fläche jeder verfolgten Region in ImageJ, und exportieren Sie diese Werte. Die Intima-Spur ergibt das Lumengebiet, die IEL-Spur ergibt das IEL-Gebiet und die EEL-Spur ergibt das EEL-Gebiet.
- Durchschnittlich die Werte, die aus den 3-10 Dias erhalten werden, um die durchschnittliche Verletzung (% Okklusion, Intima:Media (I:M) Verhältnis, neointimale Hyperplasie) pro Rattenkarotisarterie zu erhalten.
Neointimalhyperplasie = IEL-Bereich - Lumenbereich
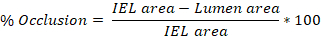
Ergebnisse
Abbildung 1 zeigt alle Materialien und chirurgischen Werkzeuge, die für diese Operation verwendet werden. Die Hematoxylin-&Eosin-Färbung (H&E) von zweiwöchigen verletzten arteriellen Querschnitten ermöglicht eine klare Visualisierung der neointimalen Hyperplasie. Abbildung 2 zeigt repräsentative Bilder von H&E-befleckten arteriellen Querschnitten einer gesunden, verletzten und behandelten Arterie. Abbildung 2 zeigt auch, wie de...
Diskussion
Die Ratten-Carotis-Arterie Ballonverletzung ist eine der am häufigsten verwendeten und untersuchten Restenose-Tiermodelle. Sowohl das ursprüngliche Ballonverletzungsmodell3 als auch die modifizierte druckgesteuerte Segmentverletzungsvariante10 haben viele Aspekte der arteriellen Verletzungsreaktion, die auch beim Menschen auftritt, informiert, wobei die wenigen Einschränkungen darin bestehen, dass sich fibrinreicher Thrombus selten entwickelt und lokale Entzündungen im ...
Offenlegungen
Die Autoren erklären, dass es keine Interessenkonflikte in Bezug auf die Veröffentlichung dieses Manuskripts gibt.
Danksagungen
N.E.B. wurde durch ein Ausbildungsstipendium des National Institute of Environmental Health Sciences (5T32ES007126-35, 2018) und ein Vordoktorandenstipendium der American Heart Association (20PRE35120321) unterstützt. E.S.M.B. war ein KL2-Stipendiat, der teilweise vom UNC Clinical and Translational Science Award-K12 Scholars Program (KL2TR002490, 2018) und dem National Heart, Lung and Blood Institute (K01HL145354) unterstützt wurde. Die Autoren danken Dr. Pablo Ariel vom UNC Microscopy Services Laboratory für die Unterstützung bei LSFM. Die Lichtbogenfluoreszenzmikroskopie wurde im Mikroskopie-Service-Labor durchgeführt. Das Mikroskopie-Services-Labor, Abteilung für Pathologie und Labormedizin, wird zum Teil durch P30 CA016086 Cancer Center Core Support Grant für das UNC Lineberger Comprehensive Cancer Center unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | Fisher | 14955450 | |
| 1 mL Syringe with needle | BD | 309626 | |
| 2 French Fogarty Balloon Embolectomy Catheter | Edwards LifeSciences | 120602F | |
| 4-0 Ethilon (Nylon) Suture | Ethicon Inc | 662H | |
| 4-0 Vicryl Suture | Ethicon Inc | J214H | |
| 7-0 Prolene Suture | Ethicon Inc | 8800H | |
| 70% ethyl alcohol | |||
| Anti-Rabbit Alexa Fluor 647 | Thermo Fisher Scientific | A21245 | |
| Atropine Sulfate | Vedco Inc | for veterinary use | |
| Cotton Swabs | Puritan | 806-WC | |
| Curved Hemostats | Fine Science Tools | 13009-12 | |
| Fine Curved Forceps | Fine Science Tools | 11203-25 | |
| Fine Scissors | Fine Science Tools | 14090-11 | |
| Gauze | Covidien | 2252 | |
| IHC-Tek Diluent (pH 7.4) | IHC World | IW-1000 | |
| Insufflator | Merit Medical | IN4130 | |
| Iodine solution | |||
| Lubricating Eye Ointment | Dechra | for veterinary use | |
| Mayo Scissors | Fine Science Tools | 14010-15 | |
| Micro Serrefines | Fine Science Tools | 18055-05 | |
| Microdissection Scissors | Fine Science Tools | 15004-08 | |
| Micro-Serrefine Clamp Applying Forceps | Fine Science Tools | 18057-14 | |
| Needle Holder | Fine Science Tools | 12003-15 | |
| Pluronic-127 (diluted in sterile water) | Sigma-Aldrich | P2443 | 25% prepared |
| Rabbit Anti-CD31 | Abcam | ab28364 | |
| Retractor | Bent paper clips work well | ||
| Rimadyl (Carprofen) | Zoetis Inc | for veterinary use | |
| Saline solution | |||
| Standard Forceps | Fine Science Tools | 11006-12 | |
| Sterile Drape | Dynarex | 4410 | |
| T-Pins |
Referenzen
- American Heart Association. Cardiovascular Disease: A Costly Burden for America, Projections Through 2035. American Heart Association CVD Burden Report. , (2017).
- Singh, R. B., Mengi, S. A., Xu, Y. J., Arneja, A. S., Dhalla, N. S. Pathogenesis of atherosclerosis: A multifactorial process. Experimental and Clinical Cardiology. 7 (1), 40-53 (2002).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Mechanisms of stenosis after arterial injury. Laboratory Investigation. 49 (2), 208-215 (1983).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Kinetics of cellular proliferation after arterial injury. I. Smooth muscle growth in the absence of endothelium. Laboratory Investigation. 49 (3), 327-333 (1983).
- Sartore, S., et al. Contribution of adventitial fibroblasts to neointima formation and vascular remodeling: from innocent bystander to active participant. Circulation Research. 89 (12), 1111-1121 (2001).
- Tanaka, K., et al. Circulating progenitor cells contribute to neointimal formation in nonirradiated chimeric mice. The FASEB Journal. 22 (2), 428-436 (2008).
- Henry, M., et al. Carotid angioplasty and stenting under protection. Techniques, results and limitations. The Journal of Cardiovascular Surgery. 47 (5), 519-546 (2006).
- Kounis, N. G., et al. Thrombotic responses to coronary stents, bioresorbable scaffolds and the Kounis hypersensitivity-associated acute thrombotic syndrome. Journal of Thoracic Disease. 9 (4), 1155-1164 (2017).
- Jackson, C. L. Animal models of restenosis. Trends in Cardiovascular Medicine. 4 (3), 122-130 (1994).
- Shears, L. L., et al. Efficient inhibition of intimal hyperplasia by adenovirus-mediated inducible nitric oxide synthase gene transfer to rats and pigs in vivo. Journal of the American College of Surgeons. 187 (3), 295-306 (1998).
- Takayama, T., et al. A murine model of arterial restenosis: technical aspects of femoral wire injury. Journal of Visualized Experiments. (97), (2015).
- Zhang, L. N., Parkinson, J. F., Haskell, C., Wang, Y. X. Mechanisms of intimal hyperplasia learned from a murine carotid artery ligation model. Current Vascular Pharmacology. 6 (1), 37-43 (2008).
- Jahnke, T., et al. Characterization of a new double-injury restenosis model in the rat aorta. Journal of Endovascular Therapy. 12 (3), 318-331 (2005).
- Gregory, E. K., et al. Periadventitial atRA citrate-based polyester membranes reduce neointimal hyperplasia and restenosis after carotid injury in rats. American Journal of Physiology-Heart and Circulatory Physiology. 307 (10), 1419-1429 (2014).
- Buglak, N. E., Jiang, W., Bahnson, E. S. M. Cinnamic aldehyde inhibits vascular smooth muscle cell proliferation and neointimal hyperplasia in Zucker Diabetic Fatty rats. Redox Biology. 19, 166-178 (2018).
- Bahnson, E. S., et al. Long-term effect of PROLI/NO on cellular proliferation and phenotype after arterial injury. Free Radical Biology and Medicine. 90, 272-286 (2016).
- Gilbert, J. C. W., Davies, M. C., Hadgraft, J. The behaviour of Pluronic F127 in aqueous solution studied using fluorescent probes. International Journal of Pharmaceutics. 40 (1-2), 93-99 (1987).
- Tulis, D. A. Histological and morphometric analyses for rat carotid balloon injury model. Methods in Molecular Medicine. 139, 31-66 (2007).
- Buglak, N. E., et al. Light Sheet Fluorescence Microscopy as a New Method for Unbiased Three-Dimensional Analysis of Vascular Injury. Cardiovascular Research. , (2020).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Ariel, P. . UltraMicroscope II - A User Guide. , (2018).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Xiangdong, L., et al. Animal models for the atherosclerosis research: a review. Protein Cell. 2 (3), 189-201 (2011).
- Chen, H., Li, D., Liu, M. Novel Rat Models for Atherosclerosis. Journal of Cardiology and Cardiovascular Sceinces. 2 (2), 29-33 (2018).
- Xing, D., Nozell, S., Chen, Y. F., Hage, F., Oparil, S. Estrogen and mechanisms of vascular protection. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (3), 289-295 (2009).
- Tulis, D. A. Rat carotid artery balloon injury model. Methods in Molecular Medicine. 139, 1-30 (2007).
- Pellet-Many, C., et al. Neuropilins 1 and 2 mediate neointimal hyperplasia and re-endothelialization following arterial injury. Cardiovascular Research. 108 (2), 288-298 (2015).
- Wu, B., et al. Perivascular delivery of resolvin D1 inhibits neointimal hyperplasia in a rat model of arterial injury. Journal of Vascular Surgery. 65 (1), 207-217 (2017).
- Tan, J., Yang, L., Liu, C., Yan, Z. MicroRNA-26a targets MAPK6 to inhibit smooth muscle cell proliferation and vein graft neointimal hyperplasia. Scientific Reports. 7, 46602 (2017).
- Pearce, C. G., et al. Beneficial effect of a short-acting NO donor for the prevention of neointimal hyperplasia. Free Radical Biology and Medicine. 44 (1), 73-81 (2008).
- Cao, T., et al. S100B promotes injury-induced vascular remodeling through modulating smooth muscle phenotype. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1863 (11), 2772-2782 (2017).
- Madigan, M., Entabi, F., Zuckerbraun, B., Loughran, P., Tzeng, E. Delayed inhaled carbon monoxide mediates the regression of established neointimal lesions. Journal of Vascular Surgery. 61 (4), 1026-1033 (2015).
- Khurana, R., et al. Angiogenesis-dependent and independent phases of intimal hyperplasia. Circulation. 110 (16), 2436-2443 (2004).
- Tsihlis, N. D., Vavra, A. K., Martinez, J., Lee, V. R., Kibbe, M. R. Nitric oxide is less effective at inhibiting neointimal hyperplasia in spontaneously hypertensive rats. Nitric Oxide. 35, 165-174 (2013).
- Chen, J., et al. Inhibition of neointimal hyperplasia in the rat carotid artery injury model by a HMGB1 inhibitor. Atherosclerosis. 224 (2), 332-339 (2012).
- Mano, T., Luo, Z., Malendowicz, S. L., Evans, T., Walsh, K. Reversal of GATA-6 downregulation promotes smooth muscle differentiation and inhibits intimal hyperplasia in balloon-injured rat carotid artery. Circulation Research. 84 (6), 647-654 (1999).
- Becher, T., et al. Three-Dimensional Imaging Provides Detailed Atherosclerotic Plaque Morphology and Reveals Angiogenesis after Carotid Artery Ligation. Circulation Research. 126 (5), 619-632 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten