Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Крыса сонной артерии Давление контролируемых сегментальных воздушный шар травмы с Периавентициального терапевтического применения
В этой статье
Резюме
Травма воздушного шара сонной артерии крыс имитирует клиническую процедуру ангиопластики, выполняемую для восстановления кровотока в атеросклеротических сосудах. Эта модель индуцирует реакцию артериальной травмы, разбавляя артериальную стенку, и опротестов интимальный слой эндотелиальных клеток, в конечном счете вызывая ремоделирование и интимальный гиперпластический ответ.
Аннотация
Сердечно-сосудистые заболевания остаются основной причиной смерти и инвалидности во всем мире, отчасти из-за атеросклероза. Атеросклеротический налет сужает область светимой поверхности артерий, тем самым уменьшая достаточный приток крови к органам и дистальным тканям. Клинически, процедуры реваскуляризации, такие как ангиопластика воздушного шара с или без размещения стента, направлены на восстановление кровотока. Хотя эти процедуры восстановить кровоток за счет уменьшения бремени бляшек, они повреждают стенку сосуда, который инициирует артериальный ответ исцеления. Длительное заживление ответ вызывает артериальный ререноз, или повторное сужение, в конечном счете, ограничивая долгосрочный успех этих процедур реваскуляризации. Таким образом, доклинические модели животных являются неотъемлемой частью для анализа патофизиологических механизмов вождения ререноза, и дают возможность проверить новые терапевтические стратегии. Модели Murine дешевле и проще в эксплуатации, чем крупные модели животных. Воздушный шар или проволоки травмы являются два общепринятых методов травмы, используемые в моделях murine. Модели травмы воздушного шара, в частности, имитируют клиническую процедуру ангиопластики и наносят адекватный ущерб артерии для развития ререноза. В этом мы описываем хирургические детали для выполнения и гистограммологически анализа модифицированной, контролируемой давлением крысы сонной артерии модели повреждения воздушного шара. Кроме того, этот протокол подчеркивает, как местное периавентиционное применение терапевтических средств может быть использовано для ингибирования неоинтимальной гиперплазии. Наконец, мы представляем флуоресцентную микроскопию светового листа как новый подход к визуализации и визуализации артериальной травмы в трех измерениях.
Введение
Сердечно-сосудистые заболевания (ССЗ) остается основной причиной смерти во всеммире 1. Атеросклероз является основной причиной большинства связанных с ССЗ заболеваемости и смертности. Атеросклероз является накопление бляшек внутри артерий, что приводит к сужению люмена, препятствуя надлежащей перфузии крови к органам и дистальныхтканей 2. Клинические вмешательства для лечения тяжелого атеросклероза включают воздушный шар ангиопластики с или без стентирования размещения. Это вмешательство включает в себя продвижение воздушного шара катетер к месту налета, и надувание воздушного шара для сжатия налета к артериальной стенке, расширение области светимости. Эта процедура повреждает артерию, однако, инициируя реакцию артериальнойтравмы 3. Длительная активация этой реакции травмы приводит к артериальному реренозу, или повторному сужению, вторичной по отношению к неоинтимальной гиперплазии и ремоделирования сосудов. Во время ангиопластики интимальный слой оголается эндотелиальных клеток, что приводит к немедленному набору тромбоцитов и локальному воспалению. Локальная сигнализация вызывает фенотипические изменения в сосудистых гладких мышечных клетках (VSMC) и адвентитиальных фибробластах. Это приводит к миграции и распространению VSMC и фибробластов внутрь люмена, что приводит к неоинтимальнойгиперплазии 4,5. Циркулирующие клетки-предшественники и иммунные клетки также способствуют общему объему ререноза6. Там, где это применимо, лекарственно-элутные стенты (DES) являются действующим стандартом для ингибирования ререноза7. DES ингибировать артериальной ре-эндотелиализации, однако, создавая тем самым про-тромботической среде, что может привести к позднему тромбозустента 8. Таким образом, модели животных являются неотъемлемой частью как для понимания патофизиологии ререноза, так и для разработки более эффективных терапевтических стратегий для продления эффективности процедур реваскуляризации.
Несколько больших и малых животныхмоделей 9 используются для изучения этой патологии. К ним относятсявоздушный шар травмы 3,10 илипроволоки травмы 11 светимой стороне артерии, а такжечастичная перевязка 12 илиманжеты размещения 13 вокруг артерии. Воздушный шар и проволоки травмы как denude эндотелиальный слой артерии, имитируя то, что происходит клинически после ангиопластики. В частности, модели травм воздушных шаров используют те же инструменты, что и в клинических условиях (т.е. воздушный шар катетер). Травма воздушного шара лучше всего выполняется в крысиных моделях, так как крысиные артерии являются подходящим размером для коммерчески доступных катетеров воздушного шара. В этом мы описываем управляемой давлением сегментальной артериальной травмы, устоявшейся, модифицированной версии травмы воздушного шара сонной артерии крысы. Этот подход, контролируемый давлением, тесно имитирует клиническую процедуру ангиопластики и позволяет воспроизвести образование неоинтимальной гиперплазии черездве недели после травмы 14,15. Кроме того, это давление контролируемых артериальных травм приводит к полному восстановлению эндотелиального слоя на 2 недели после операции16. Это прямо контрастирует с оригинальной моделью повреждения воздушного шара, описанной Clowes, где эндотелиальный слой никогда не возвращается к полному охвату3.
После операции, терапии могут быть применены к или направлены на поврежденную артерию через несколько подходов. Метод, описанный в этом, использует периавентитное применение небольшой молекулы, встроенной в раствор плуронического геля. В частности, мы применяем раствор 100 МКм циннамического альдегида в 25% гель Pluronic-F127 к артерии сразу после травмы, чтобы ингибировать образование неоинтимальной гиперплазии15. Pluronic-F127 является нетоксичным, термо-реверсивный гель, способный поставлять наркотики локально контролируемым образом17. Между тем, артериальная травма является локальной, поэтому местная администрация позволяет проверить активный принцип при минимизации внецелегового воздействия. Тем не менее, эффективная доставка терапевтических с помощью этого метода будет зависеть от химии небольшой молекулы или биологических используется.
протокол
Все методы, описанные здесь, были одобрены Институциональным комитетом по уходу за животными и использованию (IACUC) Университета Северной Каролины в Чапел-Хилл.
1. Предоперационные процедуры
- Стерилизовать хирургические инструменты. Автоклав всех хирургических инструментов перед операцией. При выполнении нескольких операций в один и тот же день, стерилизовать инструменты между операциями с помощью сухой стерилизатор бисера.
- Приготовьте терапевтический 25% гель Pluronic-127 (разбавленный в стерильной дистиллированной воде).
- Установите катетер 2F Fogarty воздушный шар к insufflator и поместите воздушный шар конце катетера в 1 мл шприц заполнен солевым раствором.
- Индуцировать анестезию, поместив крысу в камеру с 5% изофлюран.
- Удалите крысу из камеры и замитмить вес крысы. Используйте ножницы для бритья меха в области брюшной шеи.
- Поместите крысу обратно в камеру с 5% изофлюран для обеспечения индукции анестезии.
- Поместите крысиный суп на хирургическую платформу, вставив лицо в конус носа так, чтобы лицо крысы было направлено к хирургу.
- Снижение ингаляционной анестезии до 1,5% изофлюрана. Проявите глубину анестезии с помощью рефлекса на ногах на всех четырех ногах.
- Лента все четыре ноги вниз к хирургической платформе.
- Включите тепловую лампу.
- Инъекция атропина (0,01 мг/кг) подкожно для уменьшения секреции дыхательных путей.
- Инъекция карпрофена (5 мг/кг) подкожно для профилактического ведения боли. Если противовоспалительные препараты не приемлемы для эксперимента, обратитесь к шагам 3.2.2 и 3.2.3.
- Нанесите смазку глазной мази на оба глаза с помощью стерильного ватного тампона, чтобы предотвратить высыхание роговицы во время операции.
- Шваб шеи три раза круговыми движениями чередующихся между 70% этилового спирта следуют бетадин из центра бритой области наружу, чтобы стерилизовать разрез сайта.
- Проникнуть в линию разреза s.c. с 0,25% bupivacaine.
- Натеьте стерильные хирургические перчатки перед обработкой стерильных хирургических инструментов и принадлежностей.
- Выложить все автоматические хирургические инструменты на стерильный хирургический лист.
- Вырезать три независимых 1 дюймовый пряди стерильных 7-0 Prolene шва.
- Поместите ватные тампоны и марлю на хирургический лист.
- Drape крысы с стерильным хирургическим листом, который только подвергает стерилизованной области шеи.
- Вырезать дополнительное небольшое отверстие в листе, который подвергает часть конуса носа. Это будет место для лентой вниз воздушный шар катетер во время травмы.
2. Оперативные процедуры
- В течение всей хирургической процедуры, оценить глубину анестезии путем мониторинга частоты дыхания (скорость должна быть последовательной и считается нормальной), а также на ноте щепотку каждые 15 минут. Если частота дыхания увеличивается или есть реакция на щепотку нося, то приостанавливать хирургические манипуляции и увеличить изофлюран до 2,5%.
- Разоблачить общую сонную артерию (CCA).
- Сделайте поверхностный, прямой, продольный разрез декольте между челюстными костями крысы. Разрез будет примерно 1,5-2 см в длину.
- Сделайте разрез через соединительной ткани под кожей, пока мышечный слой подвергается. Вытесните слюнные железы под кожей, чтобы получить доступ к мышечной ткани.
- Грубо отделить соединительной ткани от мышцы, вставив закрытые ножницы между мышечным слоем и соединительной ткани и осторожно открывая ножницы, потянув кожу вверх.
- Рассеките две видимые мышцы (стернохиоид и стерномастоид) продольно вдоль левой стороны трахеи до тех пор, пока третья мышца (омохиоид), которая проходит перпендикулярно двум поверхностным мышцам наблюдается.
- Используйте типсы для создания окна, отделяющее эту перпендикулярную мышцу (омохиоид) от продольной мышцы (стернохиоид), бегущей на вершине трахеи. Аккуратно выполните это разделение, чтобы предотвратить тупую травму трахеи.
- Достигните типсов под перпендикулярной мышцей и вырежьте, чтобы отделить две продольные мышцы и разоблачить CCA.
- Рассекает CCA.
- Рассекает CCA вблизи бифуркации до внутренней сонной артерии (ICA) и внешней сонной артерии (ECA) подвергаются воздействию.
- Рассекает превосходную щитовидную артерию (STA), которая ветвиется из ЭКА.
- Используя предварительно вырезать Prolene швы, ligate STA и ECA вблизи их соответствующих бифуркации. Оставьте большую часть шва в одну сторону узла и захватить каждый шов с изогнутым гемостата.
- Закончите рассечение вокруг ICA, достичь типсов под и вокруг ICA, и использовать не дробления сосудистого зажима для достижения дистального контроля. Зажим затылочной артерии вместе с ICA.
- Рассекает CCA проксимальной бифуркации, обеспечивая отделить блуждающий нерв от CCA.
- Достичь типсов под и вокруг CCA и использовать не дробления сосудистого зажима для достижения проксимального контроля. Поместите зажим не менее 5 мм от бифуркации.
- Выполните травму воздушного шара.
- Маневр изогнутые гемостаты проведения каждой перевязки ветки артерии подвергать бифуркации между ЭКА и верхней ветви.
- Аккуратно вскрыть ткани при бифуркации, а затем сделать разрез артериотомии между ЭКА и верхней ветви с помощью ножниц микродиссекции.
- Используйте ватный тампон, чтобы вытолкнуть всю кровь из CCA и очистить место артериотомии.
- Вставьте неинфлированный воздушный шар катетер через артериотомию и заранее в CCA до проксимального конца шара мимо бифуркации.
- Лента катетер к носу конуса, чтобы воздушный шар не выскользнуть из артерии во время инфляции.
- Медленно надуть воздушный шар до 5 атмосфер давления и оставить в CCA на 5 минут, чтобы вызвать артериальную травму. Убедитесь, что давление остается постоянным в течение всего 5 минут.
- Через 5 минут сдуть воздушный шар и аккуратно удалить из CCA через артериотомию.
- Промыть CCA, осторожно сжимая на зажим на CCA. Не снимите зажим.
- Ligate ECA проксимальной артериотомии, а затем удалить зажимы из CCA и ICA для восстановления кровотока через CCA в ICA. Убедитесь, что нет видимых кровотечений вокруг артериотомии и что CCA пульсирует.
- Применить 100 йл терапевтических или Pluronic гель транспортного средства только periadventitially вдоль раненых CCA. Сделайте это, применяя 50 КЛ на левой стороне CCA, а затем 50 йл на правой стороне CCA, чтобы обеспечить равномерное покрытие травмированной артерии.
- Закройте место ранения.
- Вырезать избыток prolene швов.
- Закройте рану, используя прерванные 4-0 или 6-0 vicryl слоев вдоль соединительной ткани.
- Закончите закрывать рану с помощью бега 4-0 нейлонового шва вдоль кожи.
3. Послеоперационные процедуры
- Поместите крысу в одиночку в чистую клетку с половиной клетки под лампой для отопления и контролировать, пока крыса не приходит достаточно сознания для поддержания стерни лежа. Держите крысу в отдельной клетке до тех пор, пока животное не будет полностью начеку и мобильным перед передачей обратно в свою первоначальную клетку.
- Мониторинг крысы ежедневно в течение следующих трех дней, а затем три раза в неделю до эвтаназии. Euthanize использованием изофлуран передозировки следуют двусторонние торакотомии, как описано ниже.
- Используйте Национальный центр по доработке и сокращению животных в исследованиях (NC3Rs) гримасы масштаба для выявления послеоперационных уровней боли. Если какое-либо животное, как представляется, испытывают боль или развивать какой-либо неврологический компромисс, жертвовать немедленно.
- Для животных, которые не получают карпрофен, управлять ацетаминофен 6 мг/ мл в питьевой воде 24 ч до операции через 48 ч после операции. Ацетаминофен обеспечивает анальгезию с минимальными противовоспалительными эффектами.
- Кроме того, другие стратегии анальгетики с минимальными противовоспалительными эффектами могут быть использованы, такие как бупренорфин или бупренорфин расширенный релиз. Проконсультируйтесь с ветеринарной командой в вашем учреждении.
4. Урожай тканей и визуализация
- Через две недели после операции усыпляйте крысу при передозировке анестезии (5% изофлюран). Кроме того, усытворять крыс в более ранней точке времени для анализа различных аспектов реакции артериальной травмы.
- После того, как дыхание перестает выполнять двустороннюю торакотомию в качестве вторичного метода эвтаназии.
- Сделайте боковой разрез через брюшную полость, а затем разрежьте вверх, через диафрагму и ребра, обнажая грудную полость.
- Перелить и починить артерии.
- Вставьте канюлю 18 G, прикрепленную к системе гравитационной перфузии-фиксации через левый желудочек. Поддерживайте эквивалентное давление между крысами, отмечая высоту перфузионой системы по отношению к скамейке (высота 120 см, эквивалентная 91 ± 3 мм рт. ст.).
- Зажим канюли вместе с желудочков с помощью изогнутого гемостата.
- Сделайте разрез в правом атриуме, открыв сосудистую цепь, и начните перфузию с PBS с последующим 2-4% параформальдегидом (около 250 мл каждый).
- Подготовка параформальдегида разбавленной в PBS день жертвоприношения, или, по крайней мере, в ночь перед жертвоприношением. При подготовке в день жертвоприношения, обеспечить параформальдегид остыл до комнатной температуры до начала перфузии. Хранить параформальдегид при 4 градусов по Цельсию.
- После фиксации, извлечь левую и правую сонные артерии и хранить при 4 градусов по Цельсию в течение 2 ч в 2-4% параформальдегида.
- Передача артерий до 30% сахарозы и хранить на ночь при 4 градусов по Цельсию.
- После 16-24 ч, вставлять артерии в оптимальной температуре резки (OCT) соединения и заморозить OCT-встроенных блоков артерии.
- Состояние артерий в ОКТ при комнатной температуре в течение 10 мин. Поместите артерию параллельно плоскости криомольда, наполненной ОКТ, обозначая сторону криомольда, к которой обращена артериальная бифуркация. Snap-заморозка в жидком азоте.
- Храните замороженные блоки в долгосрочной перспективе при -80 градусов по Цельсию.
- Раздел замороженных блоков с использованием криостата.
- Соберите шесть 5 мкм толщиной артериальных поперечных сечений на слайд, с слайдом 1, начиная с бифуркации.
- Раздел замороженных блоков до гиперплазии больше не видны (около 100 слайдов).
- Гематоксилин и эозин (Н И Е) пятно слайды18
- Найдите область травмы, окрашивая один из каждых десяти слайдов по всей артерии, начиная с бифуркации (например, слайды 1, 10, 20, 30, 40, 50, 60, 70, 80, 90 и 100).
- Пятно дополнительные слайды вокруг места травмы, чтобы найти слайд с пиком окклюзии (например, слайды 20, 30 и 40 были видны гиперплазии, таким образом пятно слайды 15, 25, 35 и 45).
- Пятно и количественно слайд с пиком окклюзии и равноудающих слайдов до и после пика окклюзии слайд (например, пик окклюзии найти на слайде 35, то пятно и количественно слайды 25, 45 и т.д.) в общей сложности 3-10 слайдов на крысу.
- Для изображения микроскопии листа светлого листа, храните артерии всю ночь при 4 градусах Цельсия после фиксации в шаге 4.4.
- Зонд артерии с 1:500 разбавления кролика анти-CD31 первичного антитела в разбавлении (рН 7,4) в течение 3 дней. Затем counterstain артерии с 1:500 разбавления анти-кролик Alexa Fluor 647 вторичных антител в течение 2дней 19.
- Очисти артерию с помощью iDISCO20.
- Изображение артерии с помощью светового листа флуоресценции микроскоп21. Рендер изображения с помощью программного обеспечения (например, Imaris)19.
- Количественная неоинтимальная гиперплазия. Выполните количественную оценку в ослепленной манере, если это возможно.
- Используйте программное обеспечение ImageJ для отслеживания периметра инима, внутренней эластичной ламины (IEL) и внешней эластичной ламины (EEL) артерии на каждом из 3-10 слайдов, определенных выше (шаг 4.8.3).
- Количественная оценка площади каждого отслеживаемого региона в ImageJ и экспорт этих значений. След intima дает область люмена, след IEL дает область IEL, а след EEL дает область EEL.
- Среднее значение, полученное из 3-10 слайдов, чтобы получить среднюю травму (% окклюзии, intima:media (I:M) соотношение, неоинтимальной гиперплазии) на крысиную сонную артерию.
Неоинтимальная гиперплазия - область IEL - Люменская область
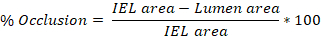
Результаты
На рисунке 1 показаны все материалы и хирургические инструменты, используемые для выполнения этой операции. Гематоксилин и эозин (Н И Е) окрашивание двухнедельных травмированных артериальных поперечных сечений позволяет четко визуализировать неоинтимальную гиперпла?...
Обсуждение
Травма воздушного шара сонной артерии крыс является одним из наиболее широко используемых и изученных моделей ререноза животных. Оба оригинальных модели травмывоздушного шара 3 и модифицированного давления контролируемыхсегментальных травм вариации 10 сообщил...
Раскрытие информации
Авторы заявляют, что в связи с публикацией этой рукописи нет конфликта интересов.
Благодарности
N.E.B. была поддержана грантом на обучение от Национального института наук об охране окружающей среды (5T32ES007126-35, 2018), и допретантной стипендией Американской ассоциации сердца (20PRE35120321). Е.С.M.B. был ученым KL2, частично поддерживаемым Программой ученых-ученых КООН по клинической и трансляционной науке (KL2TR002490, 2018) и Национальным институтом сердца, легких и крови (K01HL145354). Авторы благодарят д-ра Пабло Ариэля из Лаборатории микроскопии КООН за помощь в работе с LSFM. Микроскопия светового листа флуоресценции была проведена в Лаборатории микроскопии. Лаборатория микроскопии, Кафедра патологии и лабораторной медицины, частично поддерживается P30 CA016086 Онкологический центр Основной грант поддержки КООН Lineberger Всеобъемлющий онкологический центр.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | Fisher | 14955450 | |
| 1 mL Syringe with needle | BD | 309626 | |
| 2 French Fogarty Balloon Embolectomy Catheter | Edwards LifeSciences | 120602F | |
| 4-0 Ethilon (Nylon) Suture | Ethicon Inc | 662H | |
| 4-0 Vicryl Suture | Ethicon Inc | J214H | |
| 7-0 Prolene Suture | Ethicon Inc | 8800H | |
| 70% ethyl alcohol | |||
| Anti-Rabbit Alexa Fluor 647 | Thermo Fisher Scientific | A21245 | |
| Atropine Sulfate | Vedco Inc | for veterinary use | |
| Cotton Swabs | Puritan | 806-WC | |
| Curved Hemostats | Fine Science Tools | 13009-12 | |
| Fine Curved Forceps | Fine Science Tools | 11203-25 | |
| Fine Scissors | Fine Science Tools | 14090-11 | |
| Gauze | Covidien | 2252 | |
| IHC-Tek Diluent (pH 7.4) | IHC World | IW-1000 | |
| Insufflator | Merit Medical | IN4130 | |
| Iodine solution | |||
| Lubricating Eye Ointment | Dechra | for veterinary use | |
| Mayo Scissors | Fine Science Tools | 14010-15 | |
| Micro Serrefines | Fine Science Tools | 18055-05 | |
| Microdissection Scissors | Fine Science Tools | 15004-08 | |
| Micro-Serrefine Clamp Applying Forceps | Fine Science Tools | 18057-14 | |
| Needle Holder | Fine Science Tools | 12003-15 | |
| Pluronic-127 (diluted in sterile water) | Sigma-Aldrich | P2443 | 25% prepared |
| Rabbit Anti-CD31 | Abcam | ab28364 | |
| Retractor | Bent paper clips work well | ||
| Rimadyl (Carprofen) | Zoetis Inc | for veterinary use | |
| Saline solution | |||
| Standard Forceps | Fine Science Tools | 11006-12 | |
| Sterile Drape | Dynarex | 4410 | |
| T-Pins |
Ссылки
- American Heart Association. Cardiovascular Disease: A Costly Burden for America, Projections Through 2035. American Heart Association CVD Burden Report. , (2017).
- Singh, R. B., Mengi, S. A., Xu, Y. J., Arneja, A. S., Dhalla, N. S. Pathogenesis of atherosclerosis: A multifactorial process. Experimental and Clinical Cardiology. 7 (1), 40-53 (2002).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Mechanisms of stenosis after arterial injury. Laboratory Investigation. 49 (2), 208-215 (1983).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Kinetics of cellular proliferation after arterial injury. I. Smooth muscle growth in the absence of endothelium. Laboratory Investigation. 49 (3), 327-333 (1983).
- Sartore, S., et al. Contribution of adventitial fibroblasts to neointima formation and vascular remodeling: from innocent bystander to active participant. Circulation Research. 89 (12), 1111-1121 (2001).
- Tanaka, K., et al. Circulating progenitor cells contribute to neointimal formation in nonirradiated chimeric mice. The FASEB Journal. 22 (2), 428-436 (2008).
- Henry, M., et al. Carotid angioplasty and stenting under protection. Techniques, results and limitations. The Journal of Cardiovascular Surgery. 47 (5), 519-546 (2006).
- Kounis, N. G., et al. Thrombotic responses to coronary stents, bioresorbable scaffolds and the Kounis hypersensitivity-associated acute thrombotic syndrome. Journal of Thoracic Disease. 9 (4), 1155-1164 (2017).
- Jackson, C. L. Animal models of restenosis. Trends in Cardiovascular Medicine. 4 (3), 122-130 (1994).
- Shears, L. L., et al. Efficient inhibition of intimal hyperplasia by adenovirus-mediated inducible nitric oxide synthase gene transfer to rats and pigs in vivo. Journal of the American College of Surgeons. 187 (3), 295-306 (1998).
- Takayama, T., et al. A murine model of arterial restenosis: technical aspects of femoral wire injury. Journal of Visualized Experiments. (97), (2015).
- Zhang, L. N., Parkinson, J. F., Haskell, C., Wang, Y. X. Mechanisms of intimal hyperplasia learned from a murine carotid artery ligation model. Current Vascular Pharmacology. 6 (1), 37-43 (2008).
- Jahnke, T., et al. Characterization of a new double-injury restenosis model in the rat aorta. Journal of Endovascular Therapy. 12 (3), 318-331 (2005).
- Gregory, E. K., et al. Periadventitial atRA citrate-based polyester membranes reduce neointimal hyperplasia and restenosis after carotid injury in rats. American Journal of Physiology-Heart and Circulatory Physiology. 307 (10), 1419-1429 (2014).
- Buglak, N. E., Jiang, W., Bahnson, E. S. M. Cinnamic aldehyde inhibits vascular smooth muscle cell proliferation and neointimal hyperplasia in Zucker Diabetic Fatty rats. Redox Biology. 19, 166-178 (2018).
- Bahnson, E. S., et al. Long-term effect of PROLI/NO on cellular proliferation and phenotype after arterial injury. Free Radical Biology and Medicine. 90, 272-286 (2016).
- Gilbert, J. C. W., Davies, M. C., Hadgraft, J. The behaviour of Pluronic F127 in aqueous solution studied using fluorescent probes. International Journal of Pharmaceutics. 40 (1-2), 93-99 (1987).
- Tulis, D. A. Histological and morphometric analyses for rat carotid balloon injury model. Methods in Molecular Medicine. 139, 31-66 (2007).
- Buglak, N. E., et al. Light Sheet Fluorescence Microscopy as a New Method for Unbiased Three-Dimensional Analysis of Vascular Injury. Cardiovascular Research. , (2020).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Ariel, P. . UltraMicroscope II - A User Guide. , (2018).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Xiangdong, L., et al. Animal models for the atherosclerosis research: a review. Protein Cell. 2 (3), 189-201 (2011).
- Chen, H., Li, D., Liu, M. Novel Rat Models for Atherosclerosis. Journal of Cardiology and Cardiovascular Sceinces. 2 (2), 29-33 (2018).
- Xing, D., Nozell, S., Chen, Y. F., Hage, F., Oparil, S. Estrogen and mechanisms of vascular protection. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (3), 289-295 (2009).
- Tulis, D. A. Rat carotid artery balloon injury model. Methods in Molecular Medicine. 139, 1-30 (2007).
- Pellet-Many, C., et al. Neuropilins 1 and 2 mediate neointimal hyperplasia and re-endothelialization following arterial injury. Cardiovascular Research. 108 (2), 288-298 (2015).
- Wu, B., et al. Perivascular delivery of resolvin D1 inhibits neointimal hyperplasia in a rat model of arterial injury. Journal of Vascular Surgery. 65 (1), 207-217 (2017).
- Tan, J., Yang, L., Liu, C., Yan, Z. MicroRNA-26a targets MAPK6 to inhibit smooth muscle cell proliferation and vein graft neointimal hyperplasia. Scientific Reports. 7, 46602 (2017).
- Pearce, C. G., et al. Beneficial effect of a short-acting NO donor for the prevention of neointimal hyperplasia. Free Radical Biology and Medicine. 44 (1), 73-81 (2008).
- Cao, T., et al. S100B promotes injury-induced vascular remodeling through modulating smooth muscle phenotype. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1863 (11), 2772-2782 (2017).
- Madigan, M., Entabi, F., Zuckerbraun, B., Loughran, P., Tzeng, E. Delayed inhaled carbon monoxide mediates the regression of established neointimal lesions. Journal of Vascular Surgery. 61 (4), 1026-1033 (2015).
- Khurana, R., et al. Angiogenesis-dependent and independent phases of intimal hyperplasia. Circulation. 110 (16), 2436-2443 (2004).
- Tsihlis, N. D., Vavra, A. K., Martinez, J., Lee, V. R., Kibbe, M. R. Nitric oxide is less effective at inhibiting neointimal hyperplasia in spontaneously hypertensive rats. Nitric Oxide. 35, 165-174 (2013).
- Chen, J., et al. Inhibition of neointimal hyperplasia in the rat carotid artery injury model by a HMGB1 inhibitor. Atherosclerosis. 224 (2), 332-339 (2012).
- Mano, T., Luo, Z., Malendowicz, S. L., Evans, T., Walsh, K. Reversal of GATA-6 downregulation promotes smooth muscle differentiation and inhibits intimal hyperplasia in balloon-injured rat carotid artery. Circulation Research. 84 (6), 647-654 (1999).
- Becher, T., et al. Three-Dimensional Imaging Provides Detailed Atherosclerotic Plaque Morphology and Reveals Angiogenesis after Carotid Artery Ligation. Circulation Research. 126 (5), 619-632 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены