A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
עכברוש עורק הראש מבוקר לחץ על פגיעה בבלון מגזרי עם יישום טיפולי Periadventitial
In This Article
Summary
הפציעה בבלון עורק התרדמה של החולדה מחקה את הליך האנגיופלסטיקה הקליני המבוצע כדי לשחזר את זרימת הדם בכלי טרשת עורקים. מודל זה גורם לתגובת פגיעה עורקית על ידי התנפצות דופן העורקים, ו denuding את השכבה האינטימית של תאי אנדותל, בסופו של דבר גורם שיפוץ ותגובה היפרפלסטית מולדת.
Abstract
מחלות לב וכלי דם נשאר הגורם המוביל למוות ונכות ברחבי העולם, בין השאר עקב טרשת עורקים. לוחית טרשת עורקים מצמצמת את שטח הפנים הזוהר בעורקים ובכך מפחיתה זרימת דם נאותה לאיברים ולרקמות דיסטליות. קלינית, נהלי revascularization כגון אנגיופלסטיקה בלון עם או בלי מיקום סטנט שואפים לשחזר את זרימת הדם. למרות הליכים אלה מחדש את זרימת הדם על ידי הפחתת נטל פלאק, הם פוגעים בקיר כלי הדם, אשר יוזם את תגובת ריפוי העורקים. תגובת הריפוי הממושכת גורמת לרסטנוזיס עורקי, או להצטמצם מחדש, ובסופו של דבר מגבילה את ההצלחה ארוכת הטווח של הליכי revascularization אלה. לכן, מודלים פרה-קוליניים של בעלי חיים הם חלק בלתי נפרד מניתוח המנגנונים הפתופיזיולוגיים המניעים את restenosis, ומספקים את ההזדמנות לבחון אסטרטגיות טיפוליות חדשניות. דגמי מורין זולים וקלים יותר לתפעול מאשר מודלים גדולים של בעלי חיים. בלון או פגיעה תיל הם שני אופני פציעה מקובלים בשימוש במודלים מורין. מודלים של פגיעת בלון במיוחד מחקים את הליך האנגיופלסטיקה הקלינית וגורמים נזק הולם לעורק להתפתחות restenosis. בזאת אנו מתארים את הפרטים הכירורגיים לביצוע וניתוח היסטולוגי של מודל הפגיעה בבלון עורק הראש של עכברושים שעבר שינוי, הנשלט בלחץ. בנוסף, פרוטוקול זה מדגיש כיצד יישום periadventitial המקומי של טיפולים יכול לשמש כדי לעכב היפרפלזיה ניאוינטימיאלית. לבסוף, אנו מציגים מיקרוסקופיית פלואורסצנטיות של יריעות אור כגישה חדשנית להדמיה ותדמיינות של הפגיעה העורקית בשלושה ממדים.
Introduction
מחלות לב וכלי דם (CVD) נשאר הגורם המוביל למוות ברחבי העולם1. טרשת עורקים היא הגורם הבסיסי לרוב התחלואה והתמותה הקשורות ל- CVD. טרשת עורקים היא הצטברות של פלאק בתוך העורקים שתוצאתו לומן צר, מעכב זלוף דם תקין לאיברים ורקמות דיסטליות2. התערבויות קליניות לטיפול טרשת עורקים חמורה כוללים אנגיופלסטיקה בלון עם או בלי מיקום סטנט. התערבות זו כרוכה בקידום קטטר בלון לאתר של פלאק, וניפוח הבלון כדי לדחוס את השלט לקיר העורקים, הרחבת האזור הזוהר. הליך זה פוגע בעורק, עם זאת, ייזום תגובת פגיעה עורקית3. הפעלה ממושכת של תגובת פציעה זו מובילה לרסטנוזיס עורקי, או להצטמצמות מחדש, משנית להיפרפלזיה ניאו-ינטילית ולשיפוץ כלי שיט. במהלך אנגיופלסטיקה השכבה האינטימית היא denuded של תאי אנדותל המוביל גיוס טסיות מיידית דלקת מקומית. איתות מקומי גורם לשינויים פנוטיפיים בתאי שריר חלקים בכלי הדם (VSMC) ופיברובלסטים הרפתקניים. זה מוביל הגירה והתפשטות של VSMC ו fibroblasts פנימה אל הלומן, המוביל היפרפלזיה ניאוינטימל4,5. במחזור תאים אב ותאי החיסון גם לתרום את הנפח הכולל של restenosis6. במידת הצורך, סטנטים מעוררי סמים (DES) הם התקן הנוכחי לעיכוב restenosis7. DES לעכב אנדותל עורקי מחדש, עם זאת, ובכך ליצור סביבה פרו טרומבוטית שיכולה לגרום פקקת מאוחרת סטנט8. לכן, מודלים של בעלי חיים הם חלק בלתי נפרד הן להבנת הפתופיזיולוגיה של restenosis, והן לפיתוח אסטרטגיות טיפוליות טובות יותר כדי להאריך את היעילות של הליכי revascularization.
מספר מודלים גדולים וקטנים של בעליחיים 9 מנוצלים לחקר פתולוגיה זו. אלה כוללים פגיעה בבלון3,10 או פציעהתיל 11 של הצד הזוהר של העורק, כמו גם קשירה חלקית12 או מיקום חפתים13 סביב העורק. פגיעת הבלון והחוט הן מנודה את שכבת האנדותל של העורק, מחקה את מה שקורה קלינית לאחר אנגיופלסטיקה. בפרט, מודלים של פגיעה בבלונים משתמשים בכלים דומים כמו בסביבה הקלינית (כלומר, קטטר בלון). הפגיעה בבלון מבוצעת בצורה הטובה ביותר בדגמי עכברושים, שכן עורקי חולדה הם בגודל מתאים לקטטרים בלון זמינים מסחרית. בזאת אנו מתארים פגיעה עורקית מגזרית מבוקרת לחץ, גרסה מבוססת ומותנית היטב של פגיעת בלון עורק הראש של החולדה. גישה זו מבוקרת לחץ מחקה מקרוב את הליך האנגיופלסטיקה הקלינית, ומאפשרת היווצרות היפרפלזיה ניאוינטילית הניתנת לשחזור שבועיים לאחר פציעה14,15. בנוסף, זה פגיעה עורקית מבוקרת לחץ תוצאות שיקום שכבת אנדותל מלאה על ידי 2 שבועות לאחר הניתוח16. זה מנוגד ישירות לדגם פגיעת הבלון המקורי, המתואר על ידי Clowes, שבו שכבת האנדותל לעולם לא חוזרת לכיסוי מלא3.
לאחר הניתוח, ניתן להחיל טיפולי או להפנות לכיוון העורק הפצוע באמצעות מספר גישות. השיטה המתוארת בזאת משתמשת ביישום periadventitial של מולקולה קטנה מוטבע בתמיסת ג'ל פלורונית. באופן ספציפי, אנו מיישמים פתרון של 100 μM אלדהיד סיננמי ב 25% פלורוניק-F127 ג'ל לעורק מיד לאחר פציעה כדי לעכב היווצרות היפרפלזיה ניאוינטילית15. Pluronic-F127 הוא ג'ל לא רעיל, תרמו הפיך מסוגל לספק תרופות באופן מקומי באופן מבוקר17. בינתיים, פגיעה עורקית היא מקומית, ולכן הממשל המקומי מאפשר לבדוק עיקרון פעיל תוך מזעור השפעות מחוץ ליעד. עם זאת, אספקה יעילה של טיפול בשיטה זו תהיה תלויה בכימיה של המולקולה הקטנה או הביולוגית המשמשת.
Protocol
כל השיטות המתוארות כאן אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) של אוניברסיטת צפון קרוליינה בצ'אפל היל.
1. הליכים טרום ניתוחיים
- לעקר מכשירים כירורגיים. אוטוקלאב כל המכשירים הכירורגיים לפני הניתוח. אם אתם מבצעים מספר ניתוחים באותו יום, יש לעקר מכשירים בין ניתוחים באמצעות מעקר חרוזים יבש.
- הכן טיפולית 25% פלורוניק-127 ג'ל (מדולל במים מזוקקים סטריליים).
- הגדר קטטר בלון פוגרטי 2F כדי insufflator ומניחים את קצה הבלון של הקטטר במזרק 1 מ"ל מלא תמיסת מלח.
- לגרום להרדמה על ידי הצבת החולדה בתא עם 5% isoflurane.
- תוציא את החולדה מהתא ותקליט את משקל החולדה. השתמש קוצץ שיער כדי לגלח פרווה על אזור הצוואר הגחוני.
- מניחים את החולדה בחזרה לתוך התא עם 5% isoflurane כדי להבטיח אינדוקציה של הרדמה.
- מניחים את הסופרן החולדה על פלטפורמה כירורגית, מכניסים את הפנים לתוך חרוט האף, כך פני החולדה הוא לכיוון המנתח.
- להפחית הרדמה בשאיפה ל 1.5% isoflurane. לאמת את עומק ההרדמה על ידי רפלקס צביטה בוהן על כל ארבעת הרגליים.
- תדביק את כל ארבע הרגליים לפלטפורמה הכירורגית.
- תדליק את מנורת החום.
- להזריק אטרופין (0.01 מ"ג/ק"ג) תת עורית כדי להפחית את הפרשות דרכי הנשימה.
- הזרק Carprofen (5 מ"ג/ק"ג) תת עורית לטיפול בכאב מניעתי. אם תרופות אנטי דלקתיות אינן מקובלות על הניסוי מתייחסים לשלבים 3.2.2 ו 3.2.3.
- החל משחת עיניים סיכה על שתי העיניים באמצעות ספוגית כותנה סטרילית כדי למנוע קרניות ייבוש במהלך הניתוח.
- לנגב את הצוואר שלוש פעמים בתנועה מעגלית לסירוגין בין 70% אלכוהול אתיל ואחריו Betadine ממרכז האזור מגולח כלפי חוץ כדי לעקר את אתר החתך.
- לחדור את קו החתך s.c. עם 0.25% bupivacaine.
- ללבוש כפפות כירורגיות סטריליות לפני טיפול מכשירים כירורגיים סטריליים ואספקה.
- פורסים את כל המכשירים הכירורגיים האוטומטיים על גיליון כירורגי סטרילי.
- חותכים שלושה גדילים עצמאיים 1 אינץ ' של תפר סטרילי 7-0 Prolene.
- מניחים ספוגיות כותנה וגזה על סדין כירורגי.
- לעטוף את החולדה עם סדין כירורגי סטרילי שרק חושף את אזור הצוואר מעוקר.
- חותכים פתח קטן נוסף בסדין החושף חלק מתוך חרוט האף. זה יהיה האתר להדבקת קטטר הבלון במהלך פציעה.
2. נהלים אופרטיביים
- במהלך כל ההליך הכירורגי, להעריך את עומק ההרדמה על ידי ניטור קצב הנשימה (שיעור צריך להיות עקבי ונחשב נורמלי) כמו גם על ידי צביטה בוהן כל 15 דקות. אם קצב הנשימה עולה או שיש תגובה לצביטת בוהן, אז להשהות מניפולציה כירורגית ולהגדיל isoflurane עד 2.5%.
- לחשוף את העורק הראשי המשותף (CCA).
- לעשות חתך שטחי, ישר, צוואר אורך בין עצמות הלסת של החולדה. אורך החתך יהיה כ-1.5-2 ס"מ.
- בצע חתך דרך רקמת החיבור מתחת לעור עד שכבת השריר נחשפת. לעקור את בלוטות הרוק מתחת לעור כדי לגשת לרקמת השריר.
- מפרידים בבוטות את רקמת החיבור מהשריר על ידי החדרת מספריים סגורים בין שכבת השריר לרקמת החיבור ופותחים בעדינות את המספריים תוך משיכת העור כלפי מעלה.
- לנתח את שני השרירים הנראים לעין (עצם החזה ו sternomastoid) לאורך הצד השמאלי של קנה הנשימה עד שריר שלישי (omohyoid) כי פועל בניצב לשני השרירים השטחיים הוא ציין.
- השתמש מלקחיים כדי ליצור חלון המפריד שריר ניצב זה (omohyoid) משריר האורך (עצם החזה) פועל על גבי קנה הנשימה. בצעו בעדינות הפרדה זו כדי למנוע טראומה קהה לקנה הנשימה.
- להגיע מלקחיים מתחת לשריר הניצב לחתוך להפריד את שני שרירי האורך ולחשוף את CCA.
- לנתח את CCA.
- לנתח את CCA ליד bifurcation עד העורק הראשי הפנימי (ICA) ועורק עורק ראשי חיצוני (ECA) נחשפים.
- לנתח את עורק בלוטת התריס מעולה (STA), אשר מסתעף מן ECA.
- באמצעות תפרים Prolene לחתוך מראש, ligate STA ו ECA ליד bifurcation בהתאמה שלהם. השאירו את רוב התפירה לצד אחד של הקשר ותפסו כל תפר עם המוסטט מעוקל.
- לסיים לנתח סביב ICA, להגיע מלקחיים מתחת ומסביב ICA, ולהשתמש מהדק כלי דם שאינו מוחץ כדי להשיג שליטה דיסטלית. מהדקים את העורק העורפי יחד עם ה- ICA.
- לנתח את CCA proximal כדי bifurcation, הבטחת להפריד את עצב הוואגוס מן CCA.
- להגיע מלקחיים מתחת ומסביב CCA ולהשתמש מהדק כלי דם שאינו מוחץ כדי להשיג שליטה פרוקסימלית. מניחים מהדק לפחות 5 מ"מ מהתנורציה.
- בצע פגיעה בבלון.
- לתמרן את hemostats מעוקל מחזיק כל ענף עורק רצועות לחשוף את bifurcation בין ECA לבין ענף מעולה.
- לנתח בעדינות רקמה בביפורציה ולאחר מכן לבצע חתך arteriotomy בין ECA לבין ענף מעולה באמצעות מספריים microdissection.
- השתמש ספוגית כותנה כדי לדחוף את כל הדם מתוך CCA ולנקות את האתר arteriotomy.
- הכנס את קטטר בלון מנופח דרך העורקים ולהתקדם לתוך CCA עד הקצה הפרוקסימלי של הבלון הוא עבר bifurcation.
- קטטר סרט אל חרוט האף כך הבלון לא להחליק מתוך העורק במהלך האינפלציה.
- לאט לנפח את הבלון ל 5 אטמוספרות של לחץ ולהשאיר CCA במשך 5 דקות כדי לגרום לפגיעה בעורקים. ודא כי הלחץ נשאר קבוע במשך כל 5 דקות.
- לאחר 5 דקות, לנפח בלון בעדינות להסיר מן CCA דרך העורקים.
- לשטוף את CCA על ידי בעדינות לסחוט על המהדק ב CCA. אל תסיר את ההידוק.
- Ligate ECA proximal לעורקים ולאחר מכן להסיר את המהדקים מן CCA ו ICA כדי לשחזר את זרימת הדם דרך CCA כדי ICA. ודא שאין דימום גלוי סביב העורקים וכי CCA הוא פועם.
- יש למרוח 100 μL של רכב ג'ל טיפולי או פלוריוני לבדו לאורך CCA הפצוע. עשה זאת על ידי החלת 50 μL בצד שמאל של CCA ולאחר מכן 50 μL בצד ימין של CCA כדי להבטיח אפילו ציפוי של העורק הפצוע.
- סגור את אתר הפצע.
- חותכים תפרים פרולין עודף.
- סגור את הפצע באמצעות מופרע 4-0 או 6-0 שכבות vicryl לאורך רקמת החיבור.
- סיים לסגור את הפצע באמצעות ריצה 4-0 תפר ניילון לאורך העור.
3. הליכים לאחר הניתוח
- מניחים את החולדה לבד בכלוב נקי עם חצי מהכלוב תחת מנורת חימום ומפקחים עד שהחולדה חוזרת להכרה מספקת כדי לשמור על שיקום עצם החזה. שמור את החולדה בכלוב נפרד עד החיה היא ערנית לחלוטין נייד לפני העברה חזרה לכלוב המקורי שלהם.
- לפקח על החולדה מדי יום במשך שלושת הימים הבאים ולאחר מכן שלוש פעמים בשבוע עד המתת חסד. המתת חסד באמצעות מנת יתר isoflurane ואחריו כריתת חזה דו-צדדית כמתואר להלן.
- השתמש במרכז הלאומי לעידון חלופי & הפחתת בעלי חיים במחקר (NC3Rs) סולם עוויתות כדי לזהות רמות כאב לאחר הניתוח. אם נראה כי בעל חיים כלשהו חווה כאב או מפתח פשרה נוירולוגית כלשהי, הקרב מיד.
- עבור בעלי חיים שאינם מקבלים carprofen, לנהל פרצטמול 6 מ"ג / מ"ל במי השתייה שלהם 24 שעות לפני הניתוח דרך 48 שעות לאחר הניתוח. פרצטמול מספק משככי כאבים עם השפעות אנטי דלקתיות מינימליות.
- לחלופין, אסטרטגיות משככי כאבים אחרים עם השפעות אנטי דלקתיות מינימליות ניתן להשתמש, כגון buprenorphine או buprenorphine שחרור מורחב. התייעץ עם הצוות הווטרינרי במוסד שלך.
4. קציר רקמות והדמיה
- שבועיים לאחר הניתוח, המתת לחות החולדה על ידי מנת יתר של הרדמה (5% isoflurane). לחלופין, המתת חסד חולדות בנקודת זמן מוקדמת יותר כדי לנתח את ההיבטים השונים של תגובת הפגיעה בעורקים.
- ברגע שהנשימה מפסיקה לבצע כריתת חזה דו-צדדית כשיטה משנית של המתת חסד.
- בצע חתך לרוחב דרך הבטן, ולאחר מכן לחתוך כלפי מעלה, דרך הסרעפת והצלעות, חושף את חלל בית החזה.
- לעיין ולתקן את העורקים.
- הכנס קנולה 18 G מחובר למערכת קיבוע זלוף כבידתי דרך החדר השמאלי. לשמור על לחץ שווה בין חולדות על ידי סימון הגובה של מערכת זלוף יחסית הספסל (גובה 120 ס"מ, שווה ערך 91 ± 3 מ"מ היג).
- מהדקים את הצינורית יחד עם החדר באמצעות המוסטט מעוקל.
- בצע חתך באטריום הימני, פתיחת מעגל כלי הדם, ולהתחיל זלוף עם PBS ואחריו 2-4% paraformaldehyde (כ 250 מ"ל כל אחד).
- הכן paraformaldehyde מדולל PBS יום ההקרבה, או לפחות בלילה שלפני ההקרבה. אם מתכוננים ביום ההקרבה, ודאו שפרפורמלדהיד התקרר לטמפרטורת החדר לפני תחילת הזלוף. חנות paraformaldehyde ב 4 °C (69 °F).
- לאחר הקיבעון, לחלץ את העורקים הראשיים שמאלה וימינה ולאחסן ב 4 °C (70 °F) עבור 2 שעות ב 2-4% paraformaldehyde.
- מעבירים את העורקים ל-30% סוכרוז ומאחסנים לילה ב-4 מעלות צלזיוס.
- לאחר 16-24 שעות, להטמיע את העורקים בתרכובת טמפרטורת חיתוך אופטימלית (OCT) ולהקפיא בלוקים עורק משובץ OCT.
- תנאי העורקים ב OCT בטמפרטורת החדר במשך 10 דקות. מניחים את העורק במקביל למישור של cryomold מלא OCT, מסמן את הצד של cryomold שאליו bifurcation העורקים פונה. הצמד להקפיא בחנקן נוזלי.
- לאחסן בלוקים קפואים לטווח ארוך ב -80 מעלות צלזיוס.
- סעיף בלוקים קפואים באמצעות cryostat.
- לאסוף שישה חתכי עורקים בעובי 5 מיקרומטר לכל שקופית, עם שקופית 1 החל bifurcation.
- מקטע בלוקים קפואים עד היפרפלזיה כבר לא גלוי (סביב 100 שקופיות).
- שקופיות כתם המטוקסילין ואאוסין (H&E)18
- מצא את אזור הפציעה על-ידי הכתמת אחת מכל עשר שקופיות לאורך כל העורק החל מהביפרציה (למשל, שקופיות 1, 10, 20, 30, 40, 50, 60, 70, 80, 90 ו- 100).
- כתמים שקופיות נוספות סביב האתר של פגיעה כדי למצוא את השקופית עם חסימת שיא (למשל, שקופיות 20, 30, ו 40 היו היפרפלזיה גלויה, ובכך כתמים שקופיות 15, 25, 35, ו 45).
- הכתם וכמת את השקופית עם שיא חסימה ושקופיות שווה ערך לפני ואחרי שקופית חסימת השיא (למשל, חסימת שיא שנמצאה בשקופית 35, ולאחר מכן הכתים וכמת שקופיות 25, 45 וכו ') עבור סך של 3-10 שקופיות לכל חולדה.
- להדמיה מיקרוסקופית פלואורסצנטית גיליון אור, לאחסן את העורקים לילה ב 4 מעלות צלזיוס לאחר קיבעון בשלב 4.4.
- בדיקה עורק עם 1:500 דילול של ארנב אנטי CD31 נוגדן ראשוני ב diluent (pH 7.4) במשך 3 ימים. ואז נגד העורק עם 1:500 דילול של נוגדן אנטי ארנב אלקסה פלואור 647 משני במשך 2 ימים19.
- נקה את העורק באמצעות iDISCO+20.
- תמונה העורק באמצעות מיקרוסקופ פלואורסצנטי גיליון אור21. רינדור תמונות באמצעות תוכנה (למשל, Imaris)19.
- לכמת היפרפלזיה ניאוינטימית. בצע כימות באופן עיוור במידת האפשר.
- השתמש בתוכנת ImageJ כדי לעקוב אחר ההיקף של האינטימה, הלאמינה האלסטית הפנימית (IEL) ולאמינה אלסטית חיצונית (EEL) של עורק בכל אחת מ- 3-10 השקופיות שנקבעו לעיל (שלב 4.8.3).
- כימתו את האזור של כל אזור שעקבו אחריו ב-ImageJ וייצאו ערכים אלה. עקבות האינטימה מניבות את אזור לומן, עקבות IEL מניבות את אזור IEL, ועקבות EEL מניבות את אזור EEL.
- ממוצע הערכים המתקבלים מ 3-10 שקופיות כדי לקבל את הפציעה הממוצעת (% חסימה, intima:media (I:M) יחס, היפרפלזיה ניאוינטילית) לכל עורק התרגז עכברוש.
היפרפלזיה ניאוינטימית = אזור IEL - אזור לומן
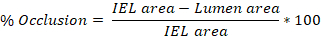
תוצאות
איור 1 מציג את כל החומרים והכלים הכירורגיים המשמשים לביצוע ניתוח זה. המטוקסילין & אאוסין (H&E) הכתמת חתכים עורקיים פצועים של שבועיים מאפשרת הדמיה ברורה של היפרפלזיה ניאוינטילית. איור 2 מציג תמונות מייצגות של חתכי עורקים מוכתמים ב-H&E של עורק בריא, פצוע ומטופל.
Discussion
הפציעה בבלון עורק הראש של החולדה היא אחד המודלים הנפוצים ביותר שנחקרו בבעלי חיים. הן מודל פגיעת הבלון המקורי3 והן וריאציית הפציעה הסגמנטית הנשלטת על ידי לחץשונה 10 הודיעו היבטים רבים של תגובת הפגיעה בעורקים המתרחשת גם בבני אדם, כאשר המגבלות המעטות הן כי פקקת עשירה...
Disclosures
המחברים מצהירים כי אין ניגודי עניינים בנוגע לפרסום כתב יד זה.
Acknowledgements
N.E.B נתמכה על ידי מענק הכשרה מהמכון הלאומי למדעי בריאות הסביבה (5T32ES007126-35, 2018), ומלגת קדם דוקטורט של איגוד הלב האמריקאי (20PRE35120321). E.S.M.B. היה חוקר KL2 נתמך חלקית על ידי UNC קליני ותרגום מדע פרס-K12 חוקרים תוכנית (KL2TR002490, 2018), ואת הלב הלאומי, ריאות, מכון הדם (K01HL145354). המחברים מודים לד"ר פבלו אריאל מהמעבדה לשירותי מיקרוסקופיה של UNC על הסיוע ב-LSFM. מיקרוסקופיית פלואורסצנטיות של יריעות אור בוצעה במעבדה לשירותי מיקרוסקופיה. המעבדה לשירותי מיקרוסקופיה, המחלקה לפתולוגיה ורפואת מעבדה, נתמכת בחלקה על ידי P30 CA016086 מרכז סרטן מרכז הליבה תמיכה מענק למרכז הסרטן מקיף UNC Lineberger.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | Fisher | 14955450 | |
| 1 mL Syringe with needle | BD | 309626 | |
| 2 French Fogarty Balloon Embolectomy Catheter | Edwards LifeSciences | 120602F | |
| 4-0 Ethilon (Nylon) Suture | Ethicon Inc | 662H | |
| 4-0 Vicryl Suture | Ethicon Inc | J214H | |
| 7-0 Prolene Suture | Ethicon Inc | 8800H | |
| 70% ethyl alcohol | |||
| Anti-Rabbit Alexa Fluor 647 | Thermo Fisher Scientific | A21245 | |
| Atropine Sulfate | Vedco Inc | for veterinary use | |
| Cotton Swabs | Puritan | 806-WC | |
| Curved Hemostats | Fine Science Tools | 13009-12 | |
| Fine Curved Forceps | Fine Science Tools | 11203-25 | |
| Fine Scissors | Fine Science Tools | 14090-11 | |
| Gauze | Covidien | 2252 | |
| IHC-Tek Diluent (pH 7.4) | IHC World | IW-1000 | |
| Insufflator | Merit Medical | IN4130 | |
| Iodine solution | |||
| Lubricating Eye Ointment | Dechra | for veterinary use | |
| Mayo Scissors | Fine Science Tools | 14010-15 | |
| Micro Serrefines | Fine Science Tools | 18055-05 | |
| Microdissection Scissors | Fine Science Tools | 15004-08 | |
| Micro-Serrefine Clamp Applying Forceps | Fine Science Tools | 18057-14 | |
| Needle Holder | Fine Science Tools | 12003-15 | |
| Pluronic-127 (diluted in sterile water) | Sigma-Aldrich | P2443 | 25% prepared |
| Rabbit Anti-CD31 | Abcam | ab28364 | |
| Retractor | Bent paper clips work well | ||
| Rimadyl (Carprofen) | Zoetis Inc | for veterinary use | |
| Saline solution | |||
| Standard Forceps | Fine Science Tools | 11006-12 | |
| Sterile Drape | Dynarex | 4410 | |
| T-Pins |
References
- American Heart Association. Cardiovascular Disease: A Costly Burden for America, Projections Through 2035. American Heart Association CVD Burden Report. , (2017).
- Singh, R. B., Mengi, S. A., Xu, Y. J., Arneja, A. S., Dhalla, N. S. Pathogenesis of atherosclerosis: A multifactorial process. Experimental and Clinical Cardiology. 7 (1), 40-53 (2002).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Mechanisms of stenosis after arterial injury. Laboratory Investigation. 49 (2), 208-215 (1983).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Kinetics of cellular proliferation after arterial injury. I. Smooth muscle growth in the absence of endothelium. Laboratory Investigation. 49 (3), 327-333 (1983).
- Sartore, S., et al. Contribution of adventitial fibroblasts to neointima formation and vascular remodeling: from innocent bystander to active participant. Circulation Research. 89 (12), 1111-1121 (2001).
- Tanaka, K., et al. Circulating progenitor cells contribute to neointimal formation in nonirradiated chimeric mice. The FASEB Journal. 22 (2), 428-436 (2008).
- Henry, M., et al. Carotid angioplasty and stenting under protection. Techniques, results and limitations. The Journal of Cardiovascular Surgery. 47 (5), 519-546 (2006).
- Kounis, N. G., et al. Thrombotic responses to coronary stents, bioresorbable scaffolds and the Kounis hypersensitivity-associated acute thrombotic syndrome. Journal of Thoracic Disease. 9 (4), 1155-1164 (2017).
- Jackson, C. L. Animal models of restenosis. Trends in Cardiovascular Medicine. 4 (3), 122-130 (1994).
- Shears, L. L., et al. Efficient inhibition of intimal hyperplasia by adenovirus-mediated inducible nitric oxide synthase gene transfer to rats and pigs in vivo. Journal of the American College of Surgeons. 187 (3), 295-306 (1998).
- Takayama, T., et al. A murine model of arterial restenosis: technical aspects of femoral wire injury. Journal of Visualized Experiments. (97), (2015).
- Zhang, L. N., Parkinson, J. F., Haskell, C., Wang, Y. X. Mechanisms of intimal hyperplasia learned from a murine carotid artery ligation model. Current Vascular Pharmacology. 6 (1), 37-43 (2008).
- Jahnke, T., et al. Characterization of a new double-injury restenosis model in the rat aorta. Journal of Endovascular Therapy. 12 (3), 318-331 (2005).
- Gregory, E. K., et al. Periadventitial atRA citrate-based polyester membranes reduce neointimal hyperplasia and restenosis after carotid injury in rats. American Journal of Physiology-Heart and Circulatory Physiology. 307 (10), 1419-1429 (2014).
- Buglak, N. E., Jiang, W., Bahnson, E. S. M. Cinnamic aldehyde inhibits vascular smooth muscle cell proliferation and neointimal hyperplasia in Zucker Diabetic Fatty rats. Redox Biology. 19, 166-178 (2018).
- Bahnson, E. S., et al. Long-term effect of PROLI/NO on cellular proliferation and phenotype after arterial injury. Free Radical Biology and Medicine. 90, 272-286 (2016).
- Gilbert, J. C. W., Davies, M. C., Hadgraft, J. The behaviour of Pluronic F127 in aqueous solution studied using fluorescent probes. International Journal of Pharmaceutics. 40 (1-2), 93-99 (1987).
- Tulis, D. A. Histological and morphometric analyses for rat carotid balloon injury model. Methods in Molecular Medicine. 139, 31-66 (2007).
- Buglak, N. E., et al. Light Sheet Fluorescence Microscopy as a New Method for Unbiased Three-Dimensional Analysis of Vascular Injury. Cardiovascular Research. , (2020).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Ariel, P. . UltraMicroscope II - A User Guide. , (2018).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Xiangdong, L., et al. Animal models for the atherosclerosis research: a review. Protein Cell. 2 (3), 189-201 (2011).
- Chen, H., Li, D., Liu, M. Novel Rat Models for Atherosclerosis. Journal of Cardiology and Cardiovascular Sceinces. 2 (2), 29-33 (2018).
- Xing, D., Nozell, S., Chen, Y. F., Hage, F., Oparil, S. Estrogen and mechanisms of vascular protection. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (3), 289-295 (2009).
- Tulis, D. A. Rat carotid artery balloon injury model. Methods in Molecular Medicine. 139, 1-30 (2007).
- Pellet-Many, C., et al. Neuropilins 1 and 2 mediate neointimal hyperplasia and re-endothelialization following arterial injury. Cardiovascular Research. 108 (2), 288-298 (2015).
- Wu, B., et al. Perivascular delivery of resolvin D1 inhibits neointimal hyperplasia in a rat model of arterial injury. Journal of Vascular Surgery. 65 (1), 207-217 (2017).
- Tan, J., Yang, L., Liu, C., Yan, Z. MicroRNA-26a targets MAPK6 to inhibit smooth muscle cell proliferation and vein graft neointimal hyperplasia. Scientific Reports. 7, 46602 (2017).
- Pearce, C. G., et al. Beneficial effect of a short-acting NO donor for the prevention of neointimal hyperplasia. Free Radical Biology and Medicine. 44 (1), 73-81 (2008).
- Cao, T., et al. S100B promotes injury-induced vascular remodeling through modulating smooth muscle phenotype. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1863 (11), 2772-2782 (2017).
- Madigan, M., Entabi, F., Zuckerbraun, B., Loughran, P., Tzeng, E. Delayed inhaled carbon monoxide mediates the regression of established neointimal lesions. Journal of Vascular Surgery. 61 (4), 1026-1033 (2015).
- Khurana, R., et al. Angiogenesis-dependent and independent phases of intimal hyperplasia. Circulation. 110 (16), 2436-2443 (2004).
- Tsihlis, N. D., Vavra, A. K., Martinez, J., Lee, V. R., Kibbe, M. R. Nitric oxide is less effective at inhibiting neointimal hyperplasia in spontaneously hypertensive rats. Nitric Oxide. 35, 165-174 (2013).
- Chen, J., et al. Inhibition of neointimal hyperplasia in the rat carotid artery injury model by a HMGB1 inhibitor. Atherosclerosis. 224 (2), 332-339 (2012).
- Mano, T., Luo, Z., Malendowicz, S. L., Evans, T., Walsh, K. Reversal of GATA-6 downregulation promotes smooth muscle differentiation and inhibits intimal hyperplasia in balloon-injured rat carotid artery. Circulation Research. 84 (6), 647-654 (1999).
- Becher, T., et al. Three-Dimensional Imaging Provides Detailed Atherosclerotic Plaque Morphology and Reveals Angiogenesis after Carotid Artery Ligation. Circulation Research. 126 (5), 619-632 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved