Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
In vitro Time-lapse live-cell imaging para explorar la migración celular hacia el órgano de Corti
* Estos autores han contribuido por igual
En este artículo
Resumen
En este estudio, presentamos un método de la proyección de imagen en tiempo real usando microscopia confocal para observar las células que se mueven hacia el tejido dañado por la incubación ex vivo con el epitelio coclear que contiene el órgano de Corti.
Resumen
Para estudiar los efectos de las células madre mesenquimales (MSC) en la regeneración celular y el tratamiento, este método rastrea la migración msc y los cambios morfológicos después de co-cultivo con epitelio coclear. El órgano de Corti fue inmovilizado en una cubierta plástica presionando una porción de la membrana del Reissner generada durante la disección. MsCs confinado por un cilindro de cristal migró hacia el epitelio coclear cuando el cilindro fue quitado. Su localización predominante se observó en el modiolus del órgano de Corti, alineado en una dirección similar a la de las fibras nerviosas. Sin embargo, algunos MSCs fueron localizados en el área del limbus y demostraron una forma horizontalmente alargada. Además, la migración en el área de la célula de pelo fue aumentada, y la morfología del MSCs cambió a las varias formas después del tratamiento del kanamycin. En conclusión, los resultados de este estudio indican que el cocultivo de MSCs con epitelio coclear será útil para el desarrollo de la terapéutica vía el trasplante de la célula y para los estudios de la regeneración de la célula que pueden examinar las varias condiciones y factores.
Introducción
La pérdida de audición puede ocurrir congénitamente o puede ser causada progresivamente por varios factores, incluyendo el envejecimiento, las drogas y el ruido. La pérdida de audición es a menudo difícil de tratar porque es muy difícil restaurar la función deteriorada una vez que las células ciliadas responsables de la audición están dañadas1. Según la Organización Mundial de la Salud, se estima que 461 millones de personas en todo el mundo tienen pérdida auditiva, lo que representa el 6,1% de la población mundial. De las personas con pérdida auditiva, el 93% son adultos y el 7% son niños.
Se han intentado varios enfoques para tratar la pérdida de audición; notablemente, un acercamiento de la regeneración usando MSCs ha emergido como tratamiento prometedor. Cuando el tejido está dañado, los MSCs se liberan naturalmente en el sistema circulatorio y migran al sitio de la lesión donde secretan varias moléculas para formar un microambiente que promueve la regeneración2. Por lo tanto, es importante desarrollar un método para tratar los tejidos dañados a través de la migración de mscs implantados externamente a los órganos diana y su posterior secreción de moléculas que causan una potente regulación inmune, angiogénesis y anti-apoptosis para mejorar la restauración de la función celular dañada3,4,5.
El proceso de búsqueda en el que los MSCs migran a los tejidos dañados puede ser el obstáculo más importante a superar. Las MSCs tienen un mecanismo de localización sistémico con pasos secuenciales de atado/balanceo, activación, detención, transmigración/diapedesis y migración6,7,8. Actualmente, se están realizando esfuerzos para identificar formas de mejorar estas medidas. Se han ensayado diversas estrategias, entre ellas la modificación genética, la ingeniería de la superficie celular, el cebado in vitro y la orientación magnética6,7. Además, varias tentativas se han hecho de promover la protección y la regeneración de células de pelo auditivas homing MSCs al sitio de la cóclea dañada. Sin embargo, el seguimiento de las CSS in vivo requiere mucho tiempo y mano de obra y requiere habilidades altamente especializadas9.
Para resolver este problema, se desarrolló un método para observar el homing de MSCs en la cóclea a través de microscopía confocal time-lapse que fotografía la migración de las células durante varias horas (Figura 1). Fue desarrollado a principios delsiglo 20 y recientemente se ha convertido en una poderosa herramienta para estudiar la migración de células específicas.
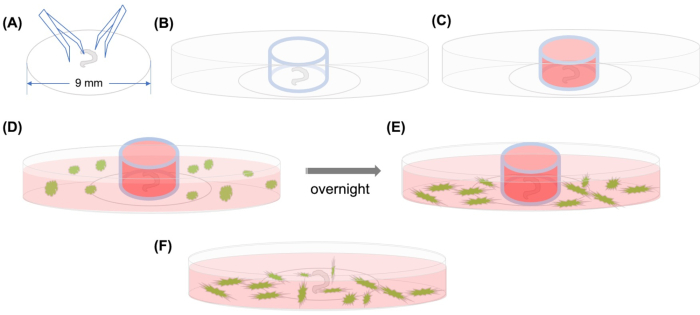
Figura 1:Resumen gráfico. (A) Después de que el órgano diseccionado de Corti se adhiere en una cubierta de plástico usando fórceps, la tapa se coloca en un plato microscópico confocal con fondo de vidrio de 35 mm, y(B) se coloca el cilindro de vidrio. (C) Después de llenar el interior del cilindro de vidrio con medio, (D) los MSC etiquetados con GFP con medio se agregan cuidadosamente fuera del cilindro. (E) Después de la incubación durante la noche, (F) se retira el cilindro de vidrio, y las imágenes se toman con un microscopio confocal. Abreviaturas: GFP = proteína fluorescente verde; MSCs = células madre mesenquimales. Haga clic aquí para ver una versión más amplia de esta figura.
Protocolo
Todos los protocolos de investigación que involucran ratones ICR fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Yonsei en wonju Facultad de Medicina. Los experimentos se realizaron de acuerdo con el Código de Ética de la Asociación Médica Mundial. En este protocolo, los ratones embarazadas de ICR fueron mantenidos en un ciclo claro/oscuro de 12/12 h con el acceso libre al alimento y al agua.
1. Disección de cocleas
- Esterilice la campana de cultivo de tejido de flujo laminar encendiendo la luz ultravioleta durante ~ 30 minutos, y rocíe todas las superficies con etanol al 70% antes de su uso. Deje que las superficies se sequen.
- Coloque los instrumentos de disección en etanol al 70% durante 10 min, y seque antes de usarlo.
- Utilice una cuchilla de operación para decapitar ratones postnatales de 3-4 días de edad (Figura 2A).
- Coloque el cráneo debajo de un estereomicroscopio en la campana de flujo laminar y remoje el tejido en etanol al 70%.
- Remoje rápidamente el tejido en la solución de disección de tejido (1x solución de sal balanceada de Hank, 1 mM HEPES) para eliminar el etanol.
- Cortar la línea central del cráneo con una cuchilla quirúrgica(Figura 2B,C).
- Exponer el cráneo tirando hacia abajo de la piel anterior y cortar el canal auditivo externo de la oreja (Figura 2D).
- Corte de la parte anterior a la posterior del cráneo a través de la línea ocular (Figura 2E).
- Abra el cráneo y retire el cerebro anterior, el cerebelo y el tronco encefálico con fórceps contundentes(Figura 2F,G).
- Usando micro fórceps, separe la cóclea del hueso temporal (Figura 2H).
- Transfiera las cocleas a una placa de Petri que contenga una solución de disección de tejidos.
- Diseccione cuidadosamente toda la cápsula ótica coclear, dejando sólo el tejido blando coclear interno(Figura 2I,J).
- Sostenga el modiolo de las cocleas con fórceps y el conducto coclear con otro par de fórceps, y separe lentamente los dos tejidos (Figura 2K).
- Retire las estrías vasculares y la membrana tectorial desprendiéndose suavemente de ellas(Figura 2L,M).
- Coloque una cubierta de plástico esterilizada en una nueva solución de disección de tejido, y luego coloque el órgano de Corti en una cubierta de 9 mm de diámetro, asegurándose de que la membrana basilar mira hacia abajo (Figura 2N-P).
- Inmovilizar el tejido presionando la membrana de Reissner y el tejido modiolus restante sobre la cubierta con fórceps (Figura 2N-P).
- Transfiera el cubrebocas con el tejido incrustado al centro de un plato confocal de 35 mm de diámetro.
- Colocar el cilindro de clonación de vidrio en el plato, con el explant coclear colocado en el centro del plato, y añadir 100 μL de medio de cultivo explant (DMEM/F12, 10% suero fetal bovino (FBS), 1% suplemento de N2, ampicilina (10 μg/mL))10 dentro del cilindro (Figura 2Q).
- Placa 5 × 103 células de proteína fluorescente verde derivada de la médula ósea de ratón (GFP)-etiquetado MSCs en 2 mL de medio de cultivo (45% DMEM + 45% DMEM/F12, 10% FBS, 1% suplemento de N2, 10 μg/mL de ampicilina) fuera del cilindro de vidrio (Figura 2R).
- Cuando los MSCs son 80-90% confluentes, pasarlos por separarlos con el ácido tetraacético tripsina-etilendiamina.
- Transfiera cuidadosamente el plato confocal a una incubadora humidificada e incube durante la noche a 37 °C en una atmósfera de 5% de CO2.
- Aspirar todo el medio dentro y fuera del cilindro, y luego retire el cilindro de vidrio del plato confocal.
- Añadir 2 mL de medio de cultivo fresco al plato confocal, e incubar el plato de cultivo de tejidos en una incubadora humidificada hasta que esté listo para el análisis.

Figura 2. Disección de una cóclea de ratón y cocultivo del órgano de Corti y MSCs. (A) Decapitación de ratón, (B) y (C) disección sagital de la línea media de la cabeza, (D) y (E) disección coronal del cerebro, (F) y (G) eliminación del cerebro y el hueso temporal, (H) la cóclea, (I) eliminación de la pared coclear ósea, (J) aislamiento de la cóclea, (K) separación del conducto coclear del modiolus, (L) separación de la estría vascular (SV) y ligamento espiral (SL) del órgano de Corti, (M) eliminación de la membrana tectorial, (N-P) fijación de la cóclea en un resbalón de cubierta de plástico, (Q) ubicación de la cubierta y el cilindro de vidrio en el plato confocal, (R) inoculación de MSCs. Barra de escala blanca (A-E) = 1 cm; naranja (F, G, P) y barra de escala amarilla (H,I) = 1 mm; barra de escala verde (J-O) = 0,5 mm. Haga clic aquí para ver una versión más grande de esta figura.
2. Imágenes de lapso de tiempo
- Para los experimentos presentados aquí, utilice un sistema de microscopía confocal con un sistema de incubadora de etapa superior.
- Encienda el microscopio confocal, la luz fluorescente y la computadora.
- Establezca las condiciones de la incubadora de etapa superior colocada en la etapa del microscopio confocal a 37 °C y 5% de CO2 atmósfera.
- Coloque el plato de muestra en el recipiente de fijación del plato, cubra con la tapa de fijación del plato y cierre la cámara con la tapa del calentador superior.
- Ajuste el zoom y el enfoque para localizar el órgano de Corti y MSCs en el campo de visión.
- Abra el software de procesamiento de imágenes. En la opción de localización, seleccione un objetivo Plan-Apochromat de 20x (apertura numérica 0,8) y un área de recorte de 0,5x.
- En Adquisición, haga clic en configuración inteligente y seleccione EGFP.
- Abra la pestaña del canal en Adquisicióny ajuste la potencia del láser a 0,2%, el agujero de alfiler a 44 μm,la ganancia maestra a 750 Vy la ganancia digital a 1,0.
- Haga clic en ESID en configuración de imágenesy establezca la ganancia de ESID en 4 y la ganancia digital en 7.5.
- Haga clic en azulejos y estaca para producir 210 azulejos.
- Abra la estrategia de enfoque y seleccione el modo de enfoque.
- En Serie temporal,establezca la duración en 24 h y el intervalo en 10 min.
- En Adquisición, establezca el tamaño del fotograma en 512 x 512 píxeles, la velocidad de escaneo en 8, la dirección a bidireccional, el promedio a 4xy los bits por píxel a 16.
- Haga clic en iniciar experimento para comenzar el experimento.
3. Modificación del archivo de imagen
- En el procesamiento,haga clic en costurasy establezca la superposición mínima en 5% y el cambio máximo en 10%.
- Haga clic en exportación de película, establecer sin comprimiry establezca la velocidad en 7,5.
4. Inmunosutención
- Aspirar el medio con cuidado y lavar la muestra dos veces con solución salina tamponada con fosfato (PBS) durante 5 min.
- Fijar la muestra con formol al 4% en PBS durante 15 min, y lavar la muestra 3 veces con PBS durante 5 min.
- Permeabilizar la muestra en Tritón X-100 al 0,1% en PBS durante 10 min, y lavar 3 veces con PBS durante 5 min.
- Añadir 250 μL de reactivo faloidina-iFluor 647 (dilución 1:1000 en PBS), e incubar la muestra durante 1 h a temperatura ambiente en la coctelera.
- Lavar la muestra 3 veces con PBS durante 5 min.
- Transfiera el cubrebocas a la corredera de vidrio y agregue 2 gotas de solución de montaje.
- Coloque suavemente un cubrebocas en la corredera.
- Selle el cubrebocas con esmalte de uñas transparente y guárdelo a 4 °C en la oscuridad hasta que se observen las células.
- Imagen de la diapositiva usando un microscopio confocal con un filtro apropiado en la excitación/emisión (Ex/Em)=650/665 nm para la faloidina y en Ex/Em=488/507 nm para EGFP.
Resultados
La migración in vitro de mscs en modo tridimensional ha sido evaluada por un sistema Transwell o por el método tradicional de cicatrización de heridas para observar la migración en modo bidimensional (2D)11. El órgano de Corti es una estructura compleja compuesta por varias células como las células de Boettcher, las células de Claudio, las células de Deiters, las células del pilar, las células de Hensen, las células ciliadas externas, las células cilia...
Discusión
El trasplante de MSCs en sitios dañados para promover la regeneración de células dañadas se ha estudiado extensivamente, y el efecto terapéutico es evidente. El trasplante y la diferenciación subsecuente de MSCs se han divulgado para restaurar la audiencia en ratas con la pérdida de oído inducida por el ácido 3-nitropropionic13. Aunque Lee et al. aplicaron mscs a seres humanos transvenosamente, no lograron ninguna mejora significativa en la audición14. Hasta hace ...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por becas de investigación (NRF-2018-R1D1A1B07050175, HURF-2017-66) de la Fundación Nacional de Investigación (NRF) de Corea y el Fondo de Investigación de la Universidad Hallym.
Materiales
| Name | Company | Catalog Number | Comments |
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
Referencias
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados