Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In vitro Time-lapse Live-Cell Imaging zur Erforschung der Zellmigration zum Organ von Corti
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Studie stellen wir ein Echtzeit-Bildgebungsverfahren unter Verwendung der konfokalen Mikroskopie vor, um Zellen zu beobachten, die sich durch Ex-vivo-Inkubation mit dem Cochlea-Epithel, das das Organ von Corti enthält, in Richtung geschädigtes Gewebe bewegen.
Zusammenfassung
Um die Auswirkungen von mesenchymalen Stammzellen (MSCs) auf die Zellregeneration und -behandlung zu untersuchen, verfolgt diese Methode MSC-Migration und morphologische Veränderungen nach Derkokultur mit Cochlea-Epithel. Das Organ von Corti wurde auf einem Kunststoffdeckel immobilisiert, indem ein Teil der Reissner-Membran gedrückt wurde, der während der Zerlegung erzeugt wurde. MSCs, die durch einen Glaszylinder begrenzt waren, migrierten zum Cochlea-Epithel, als der Zylinder entfernt wurde. Ihre vorherrschende Lokalisation wurde im Modiolus des Organs von Corti beobachtet, ähnlich ausgerichtet in eine Richtung, die der der Nervenfasern ähnelt. Einige MSCs wurden jedoch im Limbusbereich lokalisiert und zeigten eine horizontal längliche Form. Darüber hinaus wurde die Migration in den Haarzellbereich erhöht, und die Morphologie der MSCs änderte sich nach der Kanamycin-Behandlung in verschiedene Formen. Zusammenfassend deuten die Ergebnisse dieser Studie darauf hin, dass die Kokultur von MSCs mit Cochlea-Epithel für die Entwicklung von Therapeutika durch Zelltransplantation und für Studien zur Zellregeneration nützlich sein wird, die verschiedene Bedingungen und Faktoren untersuchen können.
Einleitung
Hörverlust kann angeboren auftreten oder kann schrittweise durch mehrere Faktoren verursacht werden, einschließlich Alterung, Medikamente, und Lärm. Hörverlust ist oft schwierig zu behandeln, weil es sehr schwierig ist, beeinträchtigte Funktion wiederherzustellen, sobald die für das Gehör verantwortlichen Haarzellen geschädigt sind1. Nach Angaben der Weltgesundheitsorganisation leiden weltweit schätzungsweise 461 Millionen Menschen an Hörverlust, was 6,1 % der Weltbevölkerung ausmacht. Von den Menschen mit Hörverlust sind 93 % Erwachsene und 7 % Kinder.
Es wurde versucht, eine Reihe von Ansätzen zur Behandlung von Hörverlust zu finden; insbesondere hat sich ein Regenerationsansatz mit MsC als vielversprechende Behandlung herausgestellt. Wenn Gewebe geschädigt ist, werden MSCs natürlicherweise in das Kreislaufsystem freigesetzt und wandern an die Verletzungsstelle, wo sie verschiedene Moleküle absondern, um eine Mikroumgebung zu bilden, die die Regeneration fördert2. Daher ist es wichtig, eine Methode zur Behandlung von geschädigtem Gewebe durch die Migration von extern implantierten MSCs auf Zielorgane und deren anschließende Sekretion von Molekülen zu entwickeln, die eine starke Immunregulation, Angiogenese und Anti-Apoptose verursachen, um die Wiederherstellung der beschädigten Zellfunktion3,4,5zu verbessern.
Der Homing-Prozess, bei dem MSCs in beschädigte Gewebe migrieren, könnte das wichtigste Hindernis sein, das überwunden werden muss. MSCs verfügen über einen systemischen Homing-Mechanismus mit sequenziellen Schritten des Tethering/Rollings, der Aktivierung, des Arrests, der Transmigration/Diapedese und der Migration6,7,8. Derzeit werden Anstrengungen unternommen, um Wege zur Verbesserung dieser Schritte zu finden. Verschiedene Strategien, einschließlich genetischer Veränderung, Zelloberflächentechnik, In-vitro-Primierung und magnetische Rführung, wurden getestet6,7. Darüber hinaus wurden mehrere Versuche unternommen, den Schutz und die Regeneration von auditiven Haarzellen zu fördern, indem MSCs an die Stelle der beschädigten Cochlea homing. Die Verfolgung von MSCs in vivo ist jedoch zeitaufwändig und arbeitsintensiv und erfordert hochspezialisierte Fähigkeiten9.
Um dieses Problem zu lösen, wurde eine Methode entwickelt, um das Homing von MSCs in der Cochlea durch zeitraffende konfokale Mikroskopie zu beobachten, die die Migration von Zellen über mehrere Stunden fotografiert(Abbildung 1). Es wurde im frühen20. Jahrhundert entwickelt und hat sich vor kurzem zu einem leistungsfähigen Werkzeug für die Untersuchung der Migration von bestimmten Zellen.
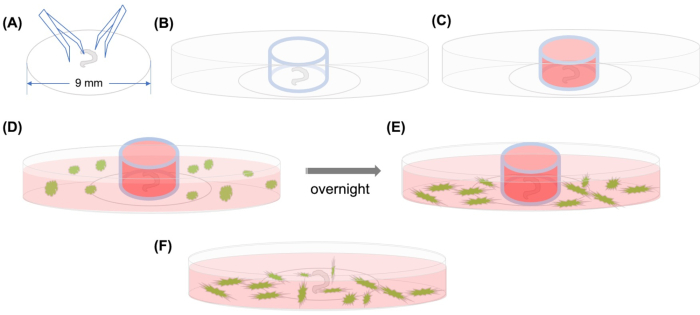
Abbildung 1: Grafische Zusammenfassung. (A) Nachdem das sezierte Organ von Corti mit Zangen auf einem Kunststoffdeckel aufeinem Kunststoffdeckel aufkleben wird, wird der Deckelaufschub auf eine 35 mm Glasboden-Konfokalmikroskopische Schale gelegt, und (B) wird der Glaszylinder positioniert. (C) Nach dem Befüllen der Innenseite des Glaszylinders mit Medium(D) werden GFP-beschriftete MSCs mit Medium sorgfältig außerhalb des Zylinders hinzugefügt. (E) Nach der Inkubation über Nacht (F) wird der Glaszylinder entfernt und Die Bilder werden mit einem konfokalen Mikroskop aufgenommen. Abkürzungen: GFP = grünes fluoreszierendes Protein; MSCs = mesenchymale Stammzellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
Alle Forschungsprotokolle mit ICR-Mäusen wurden vom Institutional Animal Care and Use Committee (IACUC) der Yonsei University am Wonju College of Medicine genehmigt. Die Experimente wurden nach dem Ethikkodex der World Medical Association durchgeführt. In diesem Protokoll wurden schwangere ICR-Mäuse in einem 12/12 h Licht/Dunkel-Zyklus mit freiem Zugang zu Nahrung und Wasser gehalten.
1. Cochlea-Sektion
- Sterilisieren Sie die laminare Strömungsgewebekulturhaube, indem Sie das ultraviolette Licht für 30 min einschalten, und sprühen Sie alle Oberflächen vor der Anwendung mit 70% Ethanol. Lassen Sie die Oberflächen trocknen.
- Sezierinstrumente in 70% Ethanol für 10 min legen und vor der Verwendung trocknen.
- Verwenden Sie eine Operationsklinge, um postnatale 3-4 Tage alte Mäuse zu enthaupten (Abbildung 2A).
- Legen Sie den Schädel unter ein Stereomikroskop in die laminare Strömungshaube und tränken Sie das Gewebe in 70% Ethanol.
- Das Gewebe in einer Gewebesektionslösung (1x Hank es Balanced Salt Solution, 1 mM HEPES) schnell einweichen, um das Ethanol zu entfernen.
- Schneiden Sie die Mittellinie des Schädels mit einer chirurgischen Klinge (Abbildung 2B,C).
- Setzen Sie den Schädel aus, indem Sie die Haut vordergründ herunterziehen und den äußeren Gehörgang des Ohres schneiden (Abbildung 2D).
- Schneiden Sie vom vorderen zum hinteren Teil des Schädels über die Augenlinie (Abbildung 2E).
- Öffnen Sie den Schädel und entfernen Sie vordem, Kleinhirn und Hirnstamm mit stumpfer Zange (Abbildung 2F,G).
- Mit Mikrozangen, trennen Sie die Cochlea vom temporalen Knochen (Abbildung 2H).
- Übertragen Sie die Cochleae in eine Petrischale, die eine Gewebesektionslösung enthält.
- Sezieren Sie sorgfältig die gesamte Cochlea-Otikkapsel, so dass nur das interne Cochlea-Weichgewebe übrig bleibt (Abbildung 2I,J).
- Halten Sie den Modiolus der Cochleae mit Zangen und den Cochlea-Kanal mit einem weiteren Zangenpaar und trennen Sie langsam die beiden Gewebe (Abbildung 2K).
- Entfernen Sie die Stria vascularis und die tektoriale Membran, indem Sie sie vorsichtig abschälen (Abbildung 2L,M).
- Legen Sie einen sterilisierten Kunststoffdeckel in eine neue Gewebedissektionslösung und legen Sie dann das Organ von Corti auf einen Abdeckzettel von 9 mm Durchmesser, um sicherzustellen, dass die Basilarmembran nach unten zeigt (Abbildung 2N-P).
- Immobilisieren Sie das Gewebe, indem Sie die Reissner-Membran und das verbleibende Modiolusgewebe mit Zangen auf den Deckelschlupf drücken (Abbildung 2N-P).
- Übertragen Sie den Deckelrutsch mit dem eingebetteten Gewebe in die Mitte einer konfokalen Schale mit 35 mm Durchmesser.
- Legen Sie den Glasklonzylinder auf die Schale, mit dem Cochlea-Explant in der Mitte der Schale positioniert, und fügen Sie 100 L Explant Culture Medium (DMEM/F12, 10% fetales Rinderserum (FBS), 1% N2-Ergänzung, Ampicillin (10 g/ml))10 in den Zylinder(Abbildung 2Q).
- Platte 5 × 103 Zellen des aus der Maus knochenknochenförmigen grünen Fluoreszenzproteins (GFP) getaggten MSCs in 2 ml Kulturmedium (45% DMEM + 45% DMEM/F12, 10% FBS, 1% N2-Ergänzung, 10 g/ml Ampicillin) außerhalb des Glaszylinders(Abbildung 2R).
- Wenn die MSCs 80-90% konfluent sind, durchtrennen Sie sie, indem Sie sie mit Trypsin-Ethylendiamin-Tetraessigsäure lösen.
- Die konfokale Schale vorsichtig in einen befeuchteten Inkubator geben und bei 37 °C in einer 5%CO2-Atmosphäre über Nacht bebrüten.
- Alle Mittleren innerhalb und außerhalb des Zylinders ansaugen und dann den Glaszylinder aus der konfokalen Schale entfernen.
- Fügen Sie dem konfokalen Gericht 2 ml frisches Kulturmedium hinzu und brüten Sie das Gewebekulturgericht in einem befeuchteten Inkubator, bis es zur Analyse bereit ist.

Abbildung 2. Zerlegung einer Maus-Cochlea und Kokultur des Organs von Corti und MSCs. (A) Enthauptung der Maus, (B) und (C) Mittellinie sagittale Zerlegung des Kopfes, (D) und (E) koronale Zerlegung des Gehirns, (F) und (G) Entfernung des Gehirns und des Temporalknochens, (H) die Cochlea, (I) Entfernung der knöchernen Cochlea-Wand, (J) Isolierung der Cochlea, (K) Trennung des Cochlea-Kanals (L) Trennung von Stria vascularis (SV) und Spiralband (SL) vom Organ von Corti, (M) Entfernung der tektorialen Membran, (N-P) Fixierung der Cochlea auf einem Kunststoffdeckel, (Q) Lage des Deckel- und Glaszylinders in der konfokalen Schale, (R) Inokulation von MSCs. Weiße Skala bar (A-E) = 1 cm; orange (F, G, P) und gelber Skalenbalken (H,I) = 1 mm; Grüne Skala (J-O) = 0,5 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Zeitraffer-Bildgebung
- Verwenden Sie für die hier vorgestellten Experimente ein konfokales Mikroskopiesystem mit einem Bühnen-Inkubator-System.
- Schalten Sie das konfokale Mikroskop, das Fluoreszenzlicht und den Computer ein.
- Stellen Sie die Bedingungen des Bühneninkubators auf der Bühne des konfokalen Mikroskops auf 37 °C und 5%CO2-Atmosphäre.
- Legen Sie die Probenschale auf das Tellerbefestigungsgefäß, decken Sie sie mit dem Tellerbefestigungsdeckel ab und schließen Sie die Kammer mit dem oberen Heizdeckel.
- Passen Sie den Zoom und Fokus an, um das Organ von Corti und MSCs im Sichtfeld zu lokalisieren.
- Öffnen Sie die Bildverarbeitungssoftware. Wählen Sie unter der Option Suchen ein 20-faches Plan-Apochromat-Objektiv (numerische Blende 0,8) und eine 0,5-fache Anbauflächeaus.
- Klicken Sie unter Akquisitionauf Smart Setup und wählen Sie EGFP.
- Öffnen Sie die Kanal-Registerkarte unter Anschaffung, und stellen Sie die Laserleistung auf 0,2%, das Loch auf 44 m, die Master-Verstärkung auf 750 Vund die digitale Verstärkung auf 1,0.
- Klicken Sie auf ESID unter Imaging-Setup, und stellen Sie die ESID-Verstärkung auf 4 und die digitale Verstärkung auf 7.5.
- Klicken Sie auf Fliesen und Pfahl, um 210 Fliesen zu produzieren.
- Öffnen Sie die Focus-Strategie und wählen Sie den Fokusmodusaus.
- Legen Sie unter Zeitreihendie Dauer auf 24 h und das Intervall auf 10 minfest.
- Legen Sie unter Aufnahmedie Framegröße auf 512 x 512 Pixel, die Scangeschwindigkeit auf 8, die Richtung auf bidirektional,die Mittelung auf 4xund die Bits pro Pixel auf 16fest.
- Klicken Sie auf Experiment starten, um das Experiment zu starten.
3. Bilddatei-Änderung
- Klicken Sie unter Verarbeitungauf Heften, und legen Sie die minimale Überlagerung auf 5 % und die maximale Verschiebung auf 10 %fest.
- Klicken Sie auf Filmexport, setzen Sie unkomprimiert, und stellen Sie die Geschwindigkeit auf 7.5.
4. Immunostaining
- Das Medium vorsichtig ansaugen und die Probe zweimal mit phosphatgepufferter Saline (PBS) 5 min waschen.
- Fixieren Sie die Probe mit 4% Formalin in PBS für 15 min, und waschen Sie die Probe 3 mal mit PBS für 5 min.
- Permeabilisieren Sie die Probe in 0,1% Triton X-100 in PBS für 10 min, und waschen Sie 3 mal mit PBS für 5 min.
- Fügen Sie 250 L Phalloidin-iFluor 647 Reagenz (1:1000 Verdünnung in PBS) hinzu und inkubieren Sie die Probe für 1 h bei Raumtemperatur auf dem Shaker.
- Waschen Sie die Probe 3 mal mit PBS für 5 min.
- Übertragen Sie den Deckelrutsch auf den Glasschlitten und fügen Sie 2 Tropfen Montagelösung hinzu.
- Legen Sie einen Deckelzettel vorsichtig auf die Folie.
- Versiegeln Sie den Deckelrutsch mit klarem Nagellack und lagern Sie bei 4 °C im Dunkeln, bis Zellen beobachtet werden.
- Stellen Sie den Dia mit einem konfokalen Mikroskop mit einem geeigneten Filter bei Anregung/Emission (Ex/Em)=650/665 nm für Phalloidin und bei Ex/Em=488/507 nm für EGFP auf.
Ergebnisse
Die In-vitro-Migration von MSCs im dreidimensionalen Modus wurde durch ein Transwell-System oder durch die traditionelle Wundheilungsmethode zur Beobachtung der Migration im zweidimensionalen (2D) Modus11bewertet. Das Organ von Corti ist eine komplexe Struktur, die aus verschiedenen Zellen wie Boettcherzellen, Claudius-Zellen, Deiter-Zellen, Säulenzellen, Hensen-Zellen, äußeren Haarzellen, inneren Haarzellen, Nervenfasern, Basilarmembran und Reikularlamina
Diskussion
Die Transplantation von MSCs an beschädigten Stellen zur Förderung der Regeneration geschädigter Zellen wurde ausgiebig untersucht, und die therapeutische Wirkung ist offensichtlich. Die Transplantation und die anschließende Differenzierung von MSCs wurden berichtet, um das Gehör bei Ratten mit Hörverlust durch 3-Nitropropionsäure13induziert wiederherzustellen. Obwohl Lee et al. MSCs auf Menschen transvenös anwendeten, erreichten sie keine signifikante Verbesserung im Hören
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch Forschungsstipendien (NRF-2018-R1D1A1B07050175, HURF-2017-66) der National Research Foundation (NRF) korea und hallym University Research Fund unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
Referenzen
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten