JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
코르티 의 장기를 향해 세포 마이그레이션을 탐구하는 체외 시간 경과 라이브 세포 이미징
요약
본 연구에서는, 우리는 코르티의 기관을 포함하는 달팽이관 상피와 전 생체 배양에 의해 손상된 조직을 향해 이동하는 세포를 관찰하는 공초점 현미경을 사용하여 실시간 이미징 방법을 제시한다.
초록
세포 재생 및 치료에 대한 중간엽 줄기 세포 (MSC)의 효과를 연구하기 위해이 방법은 달팽이관 상피와 공동 배양 후 MSC 마이그레이션 및 형태 학적 변화를 추적합니다. 코르티의 장기는 해부 중에 생성된 Reissner 막의 일부를 눌러 플라스틱 커버슬립에 고정되었습니다. 실린더를 제거할 때 유리 실린더에 의해 수감된 MSC가 달팽이관 상피로 이동했습니다. 그들의 지배적인 국소화는 코르티의 기관의 modiolus에서 관찰되었다, 신경 섬유의 것과 유사한 방향으로 정렬. 그러나 일부 MsMC는 림푸스 지역에 국한되어 수평으로 길쭉한 모양을 보였습니다. 또한, 모발 세포 영역으로의 이동이 증가되었고, MSC의 형태는 가나마이신 치료 후 다양한 형태로 변경되었다. 결론적으로, 본 연구의 결과는 달팽이관 상피와 MSC의 공존이 세포 이식을 통해 치료의 발달과 다양한 조건과 요인을 검사 할 수있는 세포 재생연구에 유용 할 것임을 나타냅니다.
서문
청력 손실은 선천적으로 발생할 수 있으며 노화, 약물 및 소음을 포함한 여러 가지 요인에 의해 점진적으로 발생할 수 있습니다. 청력을 담당하는 모발 세포가 손상되면 손상된 기능을 복원하기가 매우 어렵기 때문에 청력 손실은 종종 치료하기가어렵습니다. 세계보건기구(WHO)에 따르면 전 세계 4억 6,100만 명이 청력 손실을 입은 것으로 추정되며, 이는 전 세계 인구의 6.1%를 차지합니다. 청력 상실을 가진 사람들 중 93%는 성인이고 7%는 어린이입니다.
청력 손실을 치료하기 위해 여러 가지 접근 법이 시도되었습니다. 특히, MSC를 이용한 재생 접근법은 유망한 치료법으로 부상했습니다. 조직이 손상되면, MSC는 자연적으로 순환 계통으로 방출되고 다양한 분자를 분비하는 상해 부위로 이동하여 재생을 촉진하는 미세 환경을 형성한다2. 따라서, 손상된 세포 기능3, 4, 5의 복원을 향상시키기 위해 강력한 면역 조절, 혈관신생 및 항 세포멸을 유발하는 분자의 장기 및 후속 분비를 표적으로 하는 외부 이식된 MSC의 이동을 통해 손상된 조직을 치료하는 방법을 개발하는 것이 중요하다3,4,5.
MSC가 손상된 조직으로 마이그레이션하는 호밍 프로세스가 극복해야 할 가장 중요한 장애물이 될 수 있습니다. MSC는 테더링 /롤링, 활성화, 체포, 트랜스 마이그레이션 / diapedesis 및 마이그레이션6,7,8의순차적 단계를 갖는 전신 호밍메커니즘을가지고 있습니다. 현재 이러한 단계를 개선할 방법을 파악하기 위한 노력이 진행 중입니다. 유전자 변형, 세포 표면 공학, 체외 프라이밍 및 자기 지도를 포함한 다양한 전략이6,7로테스트되었습니다. 또한 손상된 달팽이관 부위에 MSC를 호밍하여 청각 모발 세포의 보호 및 재생을 촉진하기 위한 여러 시도가 있었습니다. 그러나 생체 내에서 MSC를 추적하는 것은 시간이 많이 걸리고 노동 집약적이며 고도로 전문화된 기술9이필요합니다.
이러한 문제점을 해결하기 위해, 몇 시간 동안 세포의 이주를 촬영한 시간 경과 공초점 현미경검사를 통해 달팽이관내의 MSC의 호밍을 관찰하는 방법이 개발되었다(도1). 그것은 20세기 초에 개발 되었으며 최근 특정 세포의 마이그레이션을 공부 하기 위한 강력한 도구가 되고있다.
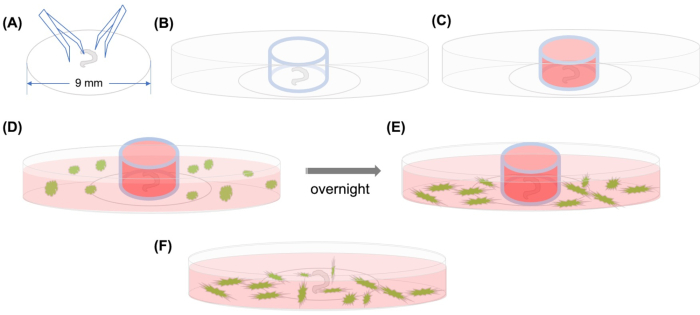
도 1: 그래픽 추상화. (A)코르티의 해부 기관이 집게를 사용하여 플라스틱 커버슬립에 부착된 후, 커버슬립은 35mm 유리 바닥의 공초점 미세한 접시에 배치되고(B)유리 실린더가 배치된다. (C)유리 실린더 내부를 중간으로 채운 후,(D)GFP 라벨이 부착된 MSC를 매체로 기르기 바깥에 신중하게 첨가한다. (E)하룻밤 동안 인큐베이션 후유리실린더가 제거되고, 이미지는 공초점 현미경으로 촬영된다. 약어: GFP = 녹색 형광 단백질; MSC = 중간 엽 줄기 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
ICR 마우스와 관련된 모든 연구 프로토콜은 원주의 의과대학의 연세대학교 기관동물관리및이용위원회(IACUC)의 승인을 받았습니다. 실험은 세계 의학 협회의 윤리 강령에 따라 수행되었다. 이 프로토콜에서 임신 한 ICR 마우스는 음식과 물에 무료로 액세스 할 수있는 12/12 h 빛 / 어두운 주기에 보관되었습니다.
1. 달팽이관 해부
- 30분 동안 자외선을 켜서 라미나르 유동 조직 배양 후드를 살균하고, 사용하기 전에 70% 에탄올로 모든 표면을 분무한다. 표면이 건조하도록 합니다.
- 해부 악기를 70% 에탄올에 10분 동안 놓고 사용하기 전에 건조하십시오.
- 수술 블레이드를 사용하여 산후 3-4 일 된 마우스(그림 2A)를참수하십시오.
- 라미나르 플로우 후드의 스테레오현미경 아래에 두개골을 놓고 70% 에탄올에 티슈를 담그세요.
- 조직을 빠르게 흡수하여 조직 해부 용액(1x 행크의 균형 잡힌 소금 용액, 1mM HEPES)을 사용하여 에탄올을 제거합니다.
- 수술 블레이드(그림 2B,C)로두개골의 중심선을 잘라.
- 피부를 앞쪽으로 당기고 귀의 외부 청각 운하를 절단하여 두개골을 노출시다(도2D).
- 전방에서 눈선을 가로질러 두개골의 후방 부분으로 잘라냅니다(그림2E).
- 두개골을 열고 무딘 집게로 전뇌, 소뇌 및 뇌간을 제거합니다(그림 2F,G).
- 마이크로 포셉을 사용하여 달팽이를 측두골(도2H)에서분리한다.
- 달팽이관을 조직 해부 용액을 함유한 페트리 접시에 옮기다.
- 모든 달팽이관 오틱 캡슐을 신중하게 해부하여 내부 달팽이관 연조직(도2I,J)만남깁니다.
- 다른 한 쌍의 집게로 달팽이관과 달팽이관의 골수를 잡고 두 조직(도 2K)을천천히 분리합니다.
- 그들을 부드럽게 벗겨내어 황반 혈관 및 지각 막을 제거하십시오(그림2L,M).
- 살균 플라스틱 커버슬립을 새로운 조직 해부 용액에 넣고 코르티 의 장기를 직경 9mm의 커버슬립에 놓고 바실라 멤브레인이 아래쪽으로 향하게 합니다(그림2N-P).
- 리스너의 막과 나머지 모골 조직을 집게로 커버슬립에 눌러 조직을 고정시킵니다(도2N-P).
- 임베디드 조직으로 커버슬립을 직경 35mm의 공초점 접시의 중심으로 옮기.
- 유리 클론 실린더를 접시중앙에 달팽이관이 배치하고, 100μL의 축축배 배지(DMEM/F12, 10% 태아소 세럼(FBS), 1% N2 보충제, 암피실린(10 μg/mL))을 접시에 놓는다.
- 플레이트 5 × 103 개의 마우스 골수 유래 녹색 형광 단백질 (GFP)-태그 된 MSC 배양 매체 2 mL (45% DMEM + 45% DMEM/F12, 10% FBS, 1% N2 보충제, 10 μg/mL 의 암피실린) 외부 유리 실린더(그림2R).
- MSC가 80-90 % 컨캔트 일 때 트립신 에틸렌디아민 테트라아세트산으로 분리하여 통과시하십시오.
- 공초점 접시를 가습된 인큐베이터로 조심스럽게 옮기고 5%CO2 분위기에서 37°C에서 하룻밤 동안 배양한다.
- 실린더 내부와 바깥쪽에 있는 모든 매체를 흡인한 다음 공초점 접시에서 유리 실린더를 제거합니다.
- 공초점 접시에 신선한 배양 배지 2mL를 추가하고 분석 준비가 될 때까지 가습 된 인큐베이터에 조직 문화 접시를 배양하십시오.

그림 2. 코르티와 MSC의 기관의 마우스 달팽이관 및 공동 문화의 해부. (A)마우스의 참수,(B)및(C)머리의 중간선 처질 해부,(D)및(E)뇌의 관상 해부,(F)및(G)뇌및 측두골의 제거,(H)달팽이벽의 제거,(J)달팽이관벽의 제거, (J) 달팽이관의 분리,(J)달팽이,(J)달팽이의 분리(L)코르티의 오르간으로부터 의 트리아 혈관(SV) 및 나선형 인대(SL)의 분리,(M)지각막 제거,(N-P)플라스틱 커버 슬립에 달팽이관 고정,(Q)공초점 요리에서 커버슬립 및 유리 실린더의 위치, (R) 공초점 요리에서,(R)현미경의 백색 배율 주황색(F, G, P)및 노란색 스케일 바(H,I)= 1mm; 녹색 스케일 바(J-O) = 0.5mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 타임랩스 이미징
- 여기에 제시 된 실험의 경우 스테이지 탑 인큐베이터 시스템을 갖춘 공초점 현미경 시스템을 사용하십시오.
- 공초점 현미경, 형광등 및 컴퓨터를 켭니다.
- 공초점 현미경의 단계에 배치 된 스테이지 탑 인큐베이터의 조건을 37 °C 및 5 % CO2 대기로 설정합니다.
- 접시 고정 용기에 샘플 접시를 놓고 접시 고정 뚜껑으로 덮고 상단 히터 뚜껑으로 챔버를 닫습니다.
- 줌 및 포커스를 조정하여 시야에서 Corti 및 MSC의 장기를 현지화합니다.
- 이미지 처리 소프트웨어를 엽니다. 찾기 옵션에서 20x 플랜-아포크로마트 목표(숫자 조리개 0.8)와 0.5배 자르기 영역을선택합니다.
- 인수에서 스마트 설정을 클릭하고 EGFP를 선택합니다.
- 획득하에 채널 탭을 열고 레이저 전원을 0.2%로 설정하고 핀홀을 44 μm로설정하고 마스터 게인을 750V로설정하고 디지털 게인을 1.0으로설정합니다.
- 이미징 설정에서 ESID를 클릭하고 ESID 게인을 4로 설정하고 디지털 게인을 7.5로설정합니다.
- 타일과 스테이크를 클릭하여 210개의 타일을 생성합니다.
- 포커스 전략을 열고 포커스 모드를 선택합니다.
- 기간 중, 지속 시간을 24시간으로 설정하고 간격을 10분으로 설정합니다.
- 획득하에프레임 크기를 512 x 512픽셀로 설정하고, 속도를 8로, 양방향 방향, 평균을 4배로, 픽셀당 비트는 16으로설정한다.
- 실험을 시작하려면 실험을 시작합니다.
3. 이미지 파일 수정
- 처리 중, 스티치를클릭하고, 5 %로 최소 오버레이를 설정하고 최대 이동을 10 %로 설정합니다.
- 영화 내보내기를클릭하고 압축되지 않은설정하고 속도를 7.5로설정합니다.
4. 면역 염색
- 배지를 주의 깊게 흡입하고 인산완충식염(PBS)으로 샘플을 5분 간 세척합니다.
- PBS에서 4% 포르말린으로 샘플을 15분 동안 수정하고 PBS로 샘플을 3회 5분 동안 세척합니다.
- PBS에서 0.1% 트리톤 X-100으로 샘플을 10분 동안 세척하고 PBS로 3회 5분 간 세척합니다.
- 250 μL의 phalloidin-iFluor 647 시약 (PBS에서 1:1000 희석)을 추가하고 셰이커의 실온에서 1 시간 동안 샘플을 배양합니다.
- PBS로 샘플을 3회 3회 세척하여 5분 동안 세척합니다.
- 커버슬립을 유리 슬라이드에 옮기고 2방울의 장착 용액을 추가합니다.
- 슬라이드에 커버슬립을 부드럽게 놓습니다.
- 명확한 매니큐어로 커버 슬립을 밀봉하고 세포가 관찰 될 때까지 어둠 속에서 4 °C에 저장합니다.
- 내분/방출(Ex/Em)=650/665 nm에서 적절한 필터를 사용하여 공초점 현미경을 사용하고, EGFP의 경우 Ex/Em=488/507 nm에서 슬라이드를 이미지합니다.
결과
3차원 모드에서 MSC의 체외 이동은 트랜스웰 시스템 또는 전통적인 상처 치유 방법에 의해 2차원(2D)모드(11)에서마이그레이션을 관찰하도록 평가되었다. 코르티의 기관은 보처 세포, 클라우디우스 세포, 디터 세포, 기둥 세포, 헨센의 세포, 외부 헤어 셀, 내부 모발 세포, 신경 섬유, 바실라 막 및 망상 라미나12와같은 다양한 세포로 구성된...
토론
손상된 세포의 재생을 촉진하기 위해 손상된 부위로 MSC를 이식하는 것은 광범위하게 연구되었으며 치료 효과가 분명합니다. MSC의 이식 및 후속 분화는 3-니트로프로피온산(13)에 의해 유도된난청을 가진 쥐의 청력을 회복하는 것으로 보고되었다. Lee et al.은 인간에게 MSC를 적용했지만,14번 청각에서 상당한 개선을 이루지 못했습니다. 최근까지, MSC 이식에 의한 ?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 한국국립연구재단(NRF)과 한림대학교 연구기금(NRF)의 연구보조금(NRF-2018-R1D1A1B07050175, HURF-2017-66)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
참고문헌
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유