É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagens de células vivas in vitro para explorar a migração celular em direção ao órgão de Corti
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Neste estudo, apresentamos um método de imagem em tempo real utilizando microscopia confocal para observar células que se movem em direção ao tecido danificado pela incubação ex vivo com o epitélio coclear contendo o órgão de Corti.
Resumo
Para estudar os efeitos das células-tronco mesenquimais (MSCs) na regeneração e tratamento celular, este método acompanha a migração do MSC e as alterações morfológicas após a cocultura com epitélio coclear. O órgão de Corti foi imobilizado em uma mancha de plástico pressionando uma porção da membrana do Reissner gerada durante a dissecação. MSCs confinados por um cilindro de vidro migraram em direção ao epitélio coclear quando o cilindro foi removido. Sua localização predominante foi observada no modiol do órgão de Corti, alinhado em uma direção semelhante à das fibras nervosas. No entanto, alguns MSCs foram localizados na área do limbus e apresentaram uma forma horizontalmente alongada. Além disso, a migração para a área da célula ciliada foi aumentada, e a morfologia dos MSCs mudou para várias formas após o tratamento da kanamicina. Concluindo, os resultados deste estudo indicam que a cocultura de MSCs com epitélio coclear será útil para o desenvolvimento da terapêutica via transplante celular e para estudos de regeneração celular que possam examinar várias condições e fatores.
Introdução
A perda auditiva pode ocorrer congênitamente ou pode ser causada progressivamente por vários fatores, incluindo envelhecimento, drogas e ruído. A perda auditiva é muitas vezes difícil de tratar porque é muito desafiador restaurar a função prejudicada uma vez que as células ciliadas responsáveis pela audição são danificadas1. De acordo com a Organização Mundial da Saúde, estima-se que 461 milhões de pessoas em todo o mundo tenham perda auditiva, o que representa 6,1% da população mundial. Dos que têm perda auditiva, 93% são adultos e 7% são crianças.
Várias abordagens foram tentadas para tratar a perda auditiva; notavelmente, uma abordagem de regeneração usando MSCs emergiu como um tratamento promissor. Quando o tecido é danificado, os MSCs são naturalmente liberados para o sistema circulatório e migram para o local da lesão onde secretam várias moléculas para formar um microambiente que promove a regeneração2. Por isso, é importante desenvolver um método para tratar tecidos danificados através da migração de MSCs implantados externamente para órgãos alvo e sua subsequente secreção de moléculas que causam regulação imunológica potente, angiogênese e anti-apoptose para melhorar a restauração da função celular danificada3,4,5.
O processo de homing no qual os MSCs migram para tecidos danificados pode ser o obstáculo mais importante a ser superado. Os MSCs possuem um mecanismo de vagem sistêmica com etapas sequenciais de amarração/rolagem, ativação, prisão, transmigração/diápedese e migração6,7,8. Atualmente, estão em andamento esforços para identificar formas de melhorar essas etapas. Várias estratégias, incluindo modificação genética, engenharia de superfície celular, escoramento in vitro e orientação magnética, foram testadas6,7. Além disso, várias tentativas foram feitas para promover a proteção e regeneração de células ciliadas auditivas, lançando MSCs para o local da cóclea danificada. No entanto, o rastreamento de MSCs in vivo é demorado e trabalhoso e requer habilidades altamente especializadas9.
Para resolver esse problema, foi desenvolvido um método para observar o homing de MSCs na cóclea através de microscopia confocal de lapso de tempo que fotografa a migração de células ao longo de várias horas(Figura 1). Foi desenvolvido no início do séculoXX e recentemente tornou-se uma poderosa ferramenta para estudar a migração de células específicas.
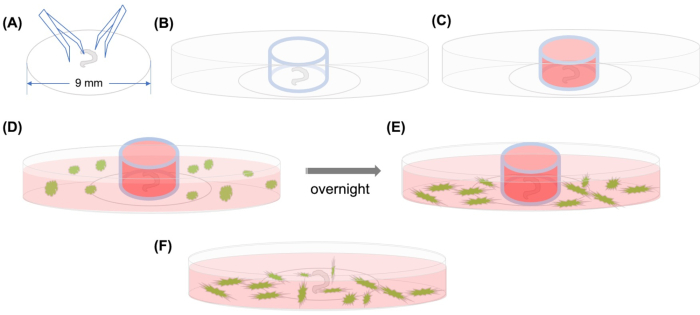
Figura 1: Resumo gráfico. (A) Depois que o órgão dissecado de Corti é aderido a um deslizamento de tampas de plástico usando fórceps, o deslizamento de tampa é colocado em um prato microscópico de 35 mm com fundo de vidro, e(B)o cilindro de vidro é posicionado. (C) Depois de encher o interior do cilindro de vidro com MSCs médios,(D)com etiqueta GFP com meio são adicionados cuidadosamente fora do cilindro. (E) Após a incubação durante a noite,(F) o cilindro de vidro é removido, e as imagens são tiradas com um microscópio confocal. Abreviaturas: GFP = proteína fluorescente verde; MSCs = células-tronco mesenquimais. Clique aqui para ver uma versão maior desta figura.
Protocolo
Todos os protocolos de pesquisa envolvendo camundongos ICR foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Universidade yonsei da Faculdade de Medicina wonju. Os experimentos foram realizados de acordo com o Código de Ética da Associação Médica Mundial. Neste protocolo, os camundongos gestantes de ICR foram mantidos em um ciclo claro/escuro de 12/12 horas com livre acesso a alimentos e água.
1. Dissecção de cochleae
- Esterilize a capa de cultura de tecido de fluxo laminar ligando a luz ultravioleta por ~30 min, e pulverize todas as superfícies com 70% de etanol antes de usar. Deixe as superfícies secarem.
- Coloque instrumentos de dissecção em 70% de etanol por 10 minutos e seque antes de usar.
- Use uma lâmina de operação para decapitar ratos pós-natais de 3 a 4 dias de idade(Figura 2A).
- Coloque o crânio sob um estereótipo na capa de fluxo laminar, e mergulhe o tecido em 70% de etanol.
- Mergulhe rapidamente o tecido na solução de dissecção tecidual (1x Hank's Balanced Salt Solution, 1 mM HEPES) para remover o etanol.
- Corte a linha central do crânio com uma lâmina cirúrgica(Figura 2B,C).
- Exponha o crânio puxando a pele anteriormente e cortando o canal auditivo externo da orelha(Figura 2D).
- Corte da parte anterior para a parte posterior do crânio através da linha ocular(Figura 2E).
- Abra o crânio e remova o cérebro, o cerebelo e o tronco cerebral com fórceps contundentes(Figura 2F,G).
- Utilizando micro fórceps, separe a cóclea do osso temporal(Figura 2H).
- Transfira a cóclea para uma placa de Petri contendo solução de dissecção tecidual.
- Disseca cuidadosamente toda a cápsula ótica coclear, restando apenas o tecido mole coclear interno(Figura 2I,J).
- Segure o modiólus da cóclea com fórceps e o duto coclear com outro par de fórceps, e separe lentamente os dois tecidos(Figura 2K).
- Remova a estria vascularis e a membrana tectorial descascando-as suavemente(Figura 2L,M).
- Coloque uma tampa plástica esterilizada em nova solução de dissecção tecidual e, em seguida, coloque o órgão de Corti em uma tampa de 9 mm de diâmetro,certificando-sede que a membrana basilareada fica para baixo(Figura 2N-P ).
- Imobilize o tecido pressionando a membrana do Reissner e o tecido modiolus restante na tampa com fórceps(Figura 2N-P).
- Transfira a tampa com o tecido incorporado para o centro de uma antena confocal de 35 mm de diâmetro.
- Coloque o cilindro de clonagem de vidro no prato, com a explanta coclear posicionada no centro do prato, e adicione 100 μL de cultura de explanta (DMEM/F12, 10% de soro bovino fetal (FBS), suplemento 1% N2, ampicillina (10 μg/mL))10 dentro do cilindro(Figura 2Q).
- Placa 5 × 103 células de proteína fluorescente verde derivada da medula óssea do rato (GFP) marcadas MSCs em 2 mL de meio de cultura (45% DMEM + 45% DMEM/F12, 10% FBS, suplemento 1% N2, 10 μg/mL de ampicilina) fora do cilindro de vidro(Figura 2R).
- Quando os MSCs são 80-90% confluentes, passá-los desprendendo-os com ácido tetraácático de tripquitina-etilenodiamina.
- Transfira cuidadosamente o prato confocal para uma incubadora umidificada e incubar durante a noite a 37 °C em uma atmosfera de 5% de CO2.
- Aspire todo o meio dentro e fora do cilindro e, em seguida, remova o cilindro de vidro do prato confocal.
- Adicione 2 mL de cultura fresca ao prato confocal, e incubar o prato de cultura tecidual em uma incubadora umidificada até estar pronta para análise.

Figura 2. Dissecção de cóclea de rato e cocultura do órgão de Corti e MSCs. (A) Decapitação do camundongo, (B) e (C) dissecção sagital midline da cabeça, (D) e (E) dissecção coronal do cérebro, (F) e (G) remoção do cérebro e osso temporal, (H) a coclesina, (I) remoção da parede coclear óssea,(J) isolamento da cadeia,(K) separação do duto coclear do transó, (L) separação da estria vascularis (SV) e ligamento espiral (SL) do órgão de Corti, (M) remoção da membrana tectorial, (N-P) fixação da cóclea em um deslizamento de tampa plástica,(Q) localização de deslizamento de tampa e cilindro de vidro na prato confocal, (R) inoculação de MSCs. Barra de escala branca (A-E) = 1 cm; laranja(F, G, P) e barra de escala amarela(H,I) = 1 mm; barra de escala verde (J-O) = 0,5 mm. Clique aqui para ver uma versão maior desta figura.
2. Imagem de lapso de tempo
- Para os experimentos aqui apresentados, use um sistema de microscopia confocal com um sistema de incubadora de topo de estágio.
- Ligue o microscópio confocal, a luz fluorescente e o computador.
- Defina as condições da incubadora de topo de palco colocada no palco do microscópio confocal para 37 °C e 5% de atmosfera de CO2.
- Coloque o prato de amostra no recipiente de fixação do prato, cubra com a tampa de fixação do prato e feche a câmara com a tampa superior do aquecedor.
- Ajuste o zoom e o foco para localização do órgão de Corti e MSCs no campo de visão.
- Abra o software de processamento de imagens. Na opção localizar, selecione um objetivo plan-apochromat de 20x (abertura numérica 0,8) e uma área de cultivo de 0,5x.
- Em Aquisição,clique em configuração inteligente e selecione EGFP.
- Abra a guia do canal em Aquisição, e ajuste a potência laser para 0,2%, o pinhole para 44 μm, o ganho mestre para 750 V, e o ganho digital para 1.0.
- Clique em ESID em configuração de imageme defina o ganho do ESID para 4 e o ganho digital para 7,5.
- Clique em Telhas e estaca para produzir 210 telhas.
- Abra a estratégia do Focus e selecione o modo de foco.
- Em sériestemporência, defina a duração para 24h e o intervalo para 10 min.
- Em Aquisição,defina o tamanho do quadro para 512 x 512 pixels, a velocidade de varredura até 8, a direção para bidirecional,a média para 4x, e os bits por pixel para 16.
- Clique no experimento iniciar para iniciar o experimento.
3. Modificação do arquivo de imagem
- Em processamento,clique na costurae defina a sobreposição mínima para 5% e a mudança máxima para 10%.
- Clique na exportação defilme , definir descompactadoe definir a velocidade para 7.5.
4. Imunostaining
- Aspire o meio com cuidado e lave a amostra duas vezes com soro fisiológico tamponado com fosfato (PBS) por 5 minutos.
- Fixar a amostra com 4% de formalina em PBS por 15 minutos e lavar a amostra 3 vezes com PBS por 5 min.
- Permeabilize a amostra em 0,1% Triton X-100 em PBS por 10 minutos, e lave 3 vezes com PBS por 5 min.
- Adicione 250 μL de reagente de falo-iFluor 647 (diluição de 1:1000 em PBS), e incubar a amostra por 1h à temperatura ambiente no shaker.
- Lave a amostra 3 vezes com PBS por 5 minutos.
- Transfira a tampa para o escorregador de vidro e adicione 2 gotas de solução de montagem.
- Coloque uma mancha de cobertura no slide suavemente.
- Sele a tampa com esmalte claro e guarde a 4 °C no escuro até que as células sejam observadas.
- Imagem do slide usando um microscópio confocal com um filtro apropriado na excitação/emissão (Ex/Em)=650/665 nm para phalloidina e em Ex/Em=488/507 nm para EGFP.
Resultados
A migração in vitro de MSCs no modo tridimensional foi avaliada por um sistema Transwell ou pelo método tradicional de cicatrização de feridas para observar a migração no modo bidimensional (2D)11. O órgão de Corti é uma estrutura complexa composta por várias células como células Boettcher, células de Cláudio, células de Deiters, células pilares, células de Hensen, células ciliar externas, células ciliar internas, fibras nervosas, membrana manje...
Discussão
O transplante de MSCs em locais danificados para promover a regeneração de células danificadas tem sido extensivamente estudado, e o efeito terapêutico é evidente. O transplante e a subsequente diferenciação dos MSCs foram relatados para restaurar a audição em ratos com perda auditiva induzida por ácido 3-nitropropídico13. Embora Lee et al. aplicassem MSCs aos seres humanos transvenosamente, eles não alcançaram qualquer melhora significativa na audição14. At?...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado por bolsas de pesquisa (NRF-2018-R1D1A1B07050175, HURF-2017-66) da National Research Foundation (NRF) da Coreia e do Hallym University Research Fund.
Materiais
| Name | Company | Catalog Number | Comments |
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
Referências
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados