Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imagerie in vitro de cellules vivantes en accéléré pour explorer la migration cellulaire vers l’organe de Corti
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Dans cette étude, nous présentons une méthode d’imagerie en temps réel utilisant la microscopie confocale pour observer les cellules se déplaçant vers le tissu endommagé par incubation ex vivo avec l’épithélium cochléaire contenant l’organe de Corti.
Résumé
Pour étudier les effets des cellules souches mésenchymateuses (CSM) sur la régénération et le traitement cellulaires, cette méthode suit la migration msc et les changements morphologiques après co-culture avec l’épithélium cochléaire. L’organe de Corti a été immobilisé sur une lame de couverture en plastique en appuyant sur une partie du Reissner' membrane de s générée pendant la dissection. Les CSM confinés par un cylindre de verre ont migré vers l’épithélium cochléaire lorsque le cylindre a été retiré. Leur localisation prédominante a été observée dans le modiolus de l’organe de Corti, aligné dans une direction similaire à celle des fibres nerveuses. Cependant, quelques CSM ont été localisés dans le secteur de limbus et ont montré une forme horizontalement allongée. En outre, la migration dans le secteur de cellules ciliées a été augmentée, et la morphologie des CSM a changé à de diverses formes après traitement de kanamycin. En conclusion, les résultats de cette étude indiquent que la coculture des CSM avec l’épithélium cochléaire sera utile pour le développement de la thérapeutique par l’intermédiaire de la transplantation cellulaire et pour des études de régénération cellulaire qui peuvent examiner diverses conditions et facteurs.
Introduction
La perte auditive peut survenir congénitalement ou peut être causée progressivement par plusieurs facteurs, y compris le vieillissement, les médicaments et le bruit. La perte auditive est souvent difficile à traiter car il est très difficile de restaurer une fonction altérée une fois que les cellules ciliées responsables de l’audition sont endommagées1. Selon l’Organisation mondiale de la santé, on estime que 461 millions de personnes dans le monde souffrent de perte auditive, ce qui représente 6,1 % de la population mondiale. Parmi les personnes ayant une perte auditive, 93 % sont des adultes et 7 % sont des enfants.
Un certain nombre d’approches ont été tentées pour traiter la perte auditive; notamment, une approche de régénération utilisant des CSM est apparue comme un traitement prometteur. Lorsque les tissus sont endommagés, les CSM sont naturellement libérés dans le système circulatoire et migrent vers le site de la blessure où ils sécrètent diverses molécules pour former un microenvironnement qui favorise la régénération2. Par conséquent, il est important de développer une méthode pour traiter les tissus endommagés par la migration des CSM implantés de l’extérieur vers les organes cibles et leur sécrétion ultérieure de molécules qui provoquent une régulation immunitaire puissante, l’angiogenèse et l’anti-apoptose pour améliorer la restauration de la fonction cellulaire endommagée3,4,5.
Le processus de homing dans lequel les CSM migrent vers les tissus endommagés peut être l’obstacle le plus important à surmonter. Les CSM ont un mécanisme de homing systémique avec des étapes séquentielles d’attache/roulement, d’activation, d’arrêt, de transmigration/diapédèse et de migration6,7,8. À l’heure actuelle, des efforts sont en cours pour trouver des moyens d’améliorer ces étapes. Diverses stratégies, y compris la modification génétique, l’ingénierie de surface cellulaire, l’amorçage in vitro et le guidage magnétique, ont été testées6,7. En outre, plusieurs tentatives ont été faites pour promouvoir la protection et la régénération des cellules ciliées auditives en homing MSCs au site de la cochlée endommagée. Cependant, le suivi des CSM in vivo prend du temps et exige beaucoup de main-d’œuvre et nécessite des compétences hautement spécialisées9.
Pour résoudre ce problème, une méthode a été développée pour observer le homing des CSM dans la cochlée par microscopie confocale time-lapse qui photographie la migration des cellules sur plusieurs heures(Figure 1). Il a été développé au début du 20 e siècle et est récemment devenu un outil puissant pour étudier la migration de cellules spécifiques.
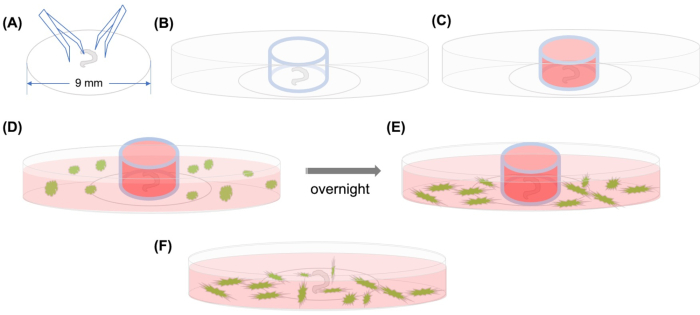
Figure 1: Résumé graphique ( A) Après que l’organe disséqué de Corti est collé sur une lame de couverture en plastique à l’aide d’une pince, la lame de couverture est placée sur une parabole microscopique confocale à fond de verre de 35 mm, et(B)le cylindre de verre est positionné. (C) Après avoir rempli l’intérieur du cylindre de verre avec un milieu, (D) les CSM marqués GFP avec du milieu sont ajoutés soigneusement à l’extérieur du cylindre. (E) Après une nuit d’incubation, (F) le cylindre de verre est retiré et les images sont prises avec un microscope confocal. Abréviations : GFP = protéine fluorescente verte; CSM = cellules souches mésenchymateuses. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Protocole
Tous les protocoles de recherche impliquant des souris de l’IC ont été approuvés par le Comité institutionnel de soins et d’utilisation des animaux (IACUC) de l’Université Yonsei au Wonju College of Medicine. Les expériences ont été réalisées conformément au Code d’éthique de l’Association médicale mondiale. Dans ce protocole, des souris enceintes d’ICR ont été maintenues dans un cycle clair/foncé de 12/12 h avec l’accès libre à la nourriture et à l’eau.
1. Dissection de Cochleae
- Stérilisez la hotte de culture de tissu à flux laminaire en allumant la lumière ultraviolette pendant environ 30 min et vaporisez à toutes les surfaces de l’éthanol à 70% avant utilisation. Laissez les surfaces sécher.
- Placer les instruments de dissection dans de l’éthanol à 70% pendant 10 min et les sécher avant de les utiliser.
- Utilisez une lame d’opération pour décapiter des souris postnatales âgées de 3 à 4 jours(figure 2A).
- Placez le crâne sous un stéréomicroscope dans la hotte à flux laminaire et trempez le tissu dans de l’éthanol à 70%.
- Trempez rapidement le tissu dans une solution de dissection tissulaire (1x solution de sel équilibrée de Hank, HEPES 1 mM) pour éliminer l’éthanol.
- Couper l’axe du crâne à l’aide d’une lame chirurgicale(figure 2B,C).
- Exposer le crâne en tirant vers le bas de la peau vers le bas et en coupant le conduit auditif externe de l’oreille (Figure 2D).
- Couper de la partie antérieure à la partie postérieure du crâne à travers la ligne des yeux(figure 2E).
- Ouvrez le crâne et retirez le cerveau avant, le cervelet et le tronc cérébral à l’l’l’eau émoussée(figure 2F,G).
- À l’aide de micro pinces, séparer la cochlée de l’os temporal (Figure 2H).
- Transférer la cochlée dans une boîte de Petri contenant une solution de dissection tissulaire.
- Disséquer soigneusement toute la capsule otique cochléaire, ne laissant que les tissus mous cochléaires internes(figure 2I,J).
- Maintenez le modiolus de la cochlée avec une pince et le conduit cochléaire avec une autre paire de pinces, et séparez lentement les deux tissus (Figure 2K).
- Enlevez la stria vascularis et la membrane tectoriale en les épluchant doucement (Figure 2L,M).
- Placez une lame de couverture en plastique stérilisée dans une nouvelle solution de dissection tissulaire, puis placez l’organe de Corti sur une lamelle de couverture de 9 mm de diamètre, en vous assurant que la membrane basilaire est orientée vers le bas(Figure 2N-P).
- Immobilisez le tissu en appuyant sur la membrane de Reissner et le tissu modiolus restant sur la lamelle de couverture avec des pinces (Figure 2N-P).
- Transférer la lamelle avec le tissu incorporé au centre d’une capsule confocale de 35 mm de diamètre.
- Placer le cylindre de clonage de verre sur la parabole, avec l’explant cochléaire placé au centre de la parabole, et ajouter 100 μL de milieu de culture explantaire (DMEM/F12, 10 % de sérum fœtal bovin (FBS), supplément de N2 à 1 %, ampicilline (10 μg/mL))10 à l’intérieur du cylindre(figure 2Q).
- La plaque 5 × 103 cellules de CSM marqués par des protéines fluorescentes vertes (GFP) dérivées de la moelle osseuse de souris dans 2 mL de milieu de culture (45 % de DMEM + 45 % de DMEM/F12, 10 % de FBS, 1 % de supplément de N2, 10 μg/mL d’ampicilline) à l’extérieur du cylindre de verre(figure 2R).
- Lorsque les CSM sont confluents à 80-90%, faites-les passer en les détachant avec de l’acide tétraacétique trypsine-éthylènediamine.
- Transférer soigneusement le plat confocal dans un incubateur humidifié et incuber pendant la nuit à 37 °C dans une atmosphère à 5 % deCO2.
- Aspirez tout le milieu à l’intérieur et à l’extérieur du cylindre, puis retirez le cylindre en verre de la parabole confocale.
- Ajouter 2 mL de milieu de culture frais au plat confocal et incuber le plat de culture tissulaire dans un incubateur humidifié jusqu’à ce qu’il soit prêt pour l’analyse.

Figure 2. Dissection d’une cochlée de souris et coculture de l’organe de Corti et mscs. (A) Décapitation de la souris, (B) et (C) dissection sagittale médiane de la tête, (D) et (E) dissection coronale du cerveau, (F) et (G) ablation du cerveau et de l’os temporal, (H) la cochlée, (I) ablation de la paroi cochléaire osseuse, (J) isolement de la cochlée, (K) séparation du canal cochléaire du modiolus, (L) séparation de la stria vascularis (SV) et du ligament spiralé (SL) de l’organe de Corti, (M) ablation de la membrane tectoriale, (N-P) fixation de la cochlée sur un glissement de couverture en plastique, (Q) emplacement de la lame de couverture et du cylindre de verre dans la boîte confocale, (R) inoculation des CSM. Barre à écaille blanche (A-E) = 1 cm; barre d’échelle orange(F, G, P)et jaune(H,I)= 1 mm; barre d’échelle verte (J-O) = 0,5 mm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
2. Imagerie time-lapse
- Pour les expériences présentées ici, utilisez un système de microscopie confocale avec un système d’incubateur à étage supérieur.
- Allumez le microscope confocal, la lumière fluorescente et l’ordinateur.
- Réglez les conditions de l’incubateur de plateau placé sur la scène du microscope confocal à 37 °C et 5 % d’atmosphère deCO2.
- Placez l’échantillon de plat sur le récipient de fixation de la parabole, couvrez avec le couvercle de fixation de la parabole et fermez la chambre avec le couvercle supérieur du chauffage.
- Ajustez le zoom et la mise au point pour localiser l’organe de Corti et mscs dans le champ de vision.
- Ouvrez le logiciel de traitement d’image. Sous l’option localiser, sélectionnez un objectif Plan-Apochromat 20x (ouverture numérique 0,8) et une surface de culture 0,5x.
- Sous Acquisition, cliquez sur smart setup (Configuration intelligente) et sélectionnez EGFP.
- Ouvrez l’onglet du canal sous Acquisitionet réglez la puissance laser à 0,2%, le trou d’épingle à 44 μm,le gain principal à 750 Vet le gain numérique à 1,0.
- Cliquez sur ESID sous configuration d’imagerie, et définissez le gain ESID sur 4 et le gain numérique sur 7.5.
- Cliquez sur Tuiles et jalonner pour produire 210 tuiles.
- Ouvrez la stratégie focus et sélectionnez le mode focus.
- Sous série chronologique, définissez la durée à 24 h et l’intervalle à 10 min.
- Sous Acquisition, définissez la taille de trame sur 512 x 512 pixels, la vitesse de balayage sur 8, la direction à bidirectionnelle, la moyenne à 4xet les bits par pixel à 16.
- Cliquez sur Démarrer l’expérience pour commencer l’expérience.
3. Modification du fichier image
- Sous traitement, cliquez sur couture, et définissez la superposition minimale à 5% et le décalage maximal à 10%.
- Cliquez sur exporter le film, définir non compressé, et réglez la vitesse sur 7.5.
4. Immunomarquage
- Aspirer soigneusement le milieu et laver l’échantillon deux fois avec une solution saline tamponnée au phosphate (PBS) pendant 5 min.
- Fixer l’échantillon avec 4% de forcine dans pbs pendant 15 min, et laver l’échantillon 3 fois avec PBS pendant 5 min.
- Perméabiliser l’échantillon dans 0,1% Triton X-100 dans pbs pendant 10 min, et laver 3 fois avec PBS pendant 5 min.
- Ajouter 250 μL de réactif phalloïdine-iFluor 647 (dilution de 1:1000 dans du PBS) et incuber l’échantillon pendant 1 h à température ambiante sur le shaker.
- Laver l’échantillon 3 fois avec du PBS pendant 5 min.
- Transférer la lame de couverture sur la lame de verre et ajouter 2 gouttes de solution de montage.
- Placez doucement une lame sur la glissière.
- Sceller la lamelle avec du vernis à ongles clair et conserver à 4 °C dans l’obscurité jusqu’à ce que les cellules soient observées.
- Imagez la lame à l’aide d’un microscope confocal avec un filtre approprié à excitation/émission (Ex/Em) = 650/665 nm pour la phalloïde et à Ex/ Em = 488/507 nm pour l’EGFP.
Résultats
La migration in vitro des CSM en mode tridimensionnel a été évaluée par un système Transwell ou par la méthode traditionnelle de cicatrisation des plaies pour observer la migration en mode bidimensionnel (2D)11. L’organe de Corti est une structure complexe composée de diverses cellules telles que les cellules de Boettcher, les cellules de Claudius, les cellules de Deiters, les cellules piliers, les cellules de Hensen, les cellules ciliées externes, les ce...
Discussion
La transplantation de CSM dans des sites endommagés pour favoriser la régénération des cellules endommagées a été intensivement étudiée, et l’effet thérapeutique est évident. On a rapporté que la transplantation et la différenciation subséquente des CSM rétablissent l’audition chez les rats présentant une perte auditive induite par l’acide 3 nitropropionique13. Bien que Lee et coll. aient appliqué des CSM aux êtres humains de façon transcanadienne, ils n’ont pas obtenu d...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par des subventions de recherche (NRF-2018-R1D1A1B07050175, HURF-2017-66) de la National Research Foundation (NRF) de Corée et du Hallym University Research Fund.
matériels
| Name | Company | Catalog Number | Comments |
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
Références
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon