Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
In vitro Time-lapse Live-Cell Imaging для изучения миграции клеток к органу Корти
В этой статье
Резюме
В этом исследовании мы представляем метод визуализации в режиме реального времени с использованием конфокальной микроскопии для наблюдения за клетками, двигамися в направлении поврежденных тканей путем инкубации ex vivo с кохлеарным эпителием, содержащим орган Корти.
Аннотация
Для изучения влияния мезенхимальных стволовых клеток (MSC) на регенерацию клеток и лечение, этот метод отслеживает миграцию MSC и морфологические изменения после совместной культуры с кохлеарной эпителием. Орган Корти был обездвижен на пластиковой крышке, нажав на часть мембраны Рейсснера, генерируемую во время вскрытия. MSCs ограничивается стеклянный цилиндр мигрировали в сторону кохлеарного эпителия, когда цилиндр был удален. Их преобладающая локализация наблюдалась в модиоле органа Корти, выровненном в направлении, аналогичном нервному. Тем не менее, некоторые MSCs были локализованы в области лимбуса и показали горизонтально удлиненной формы. Кроме того, миграция в область волосяных клеток была увеличена, и морфология MSCs изменилась на различные формы после лечения канамицина. В заключение, результаты этого исследования показывают, что кокультура MSCs с кохлеарной эпителия будет полезна для развития терапии через трансплантацию клеток и для исследований регенерации клеток, которые могут изучить различные условия и факторы.
Введение
Потеря слуха может происходить врожденно или может быть вызвана постепенно несколькими факторами, включая старение, наркотики и шум. Потеря слуха часто трудно лечить, потому что это очень сложно восстановить нарушенную функцию, как только волосковых клеток, ответственных за слух повреждены1. По данным Всемирной организации здравоохранения, 461 миллион человек во всем мире, по оценкам, имеют потерю слуха, что составляет 6,1% населения мира. Из тех, кто с потерей слуха, 93% взрослых, и 7% детей.
Был предпринят ряд подходов к лечению потери слуха; в частности, перспективным методом лечения стал подход к регенерации с использованием MSC. Когда ткань повреждена, MSCs естественно выпущены в кровеносную систему и мигрируют к месту ушиба где они выделяет различные молекулы для того чтобы сформировать микроокноронику которая способствуетрегенерации 2. Следовательно, важно разработать метод лечения поврежденных тканей путем миграции внешне имплантированных MSCs к целевым органам и их последующей секрециимолекул,которые вызывают мощную иммунную регуляцию, ангиогенез и анти-апоптоз для повышения восстановления поврежденной функцииклеток 3,4,5.
Процесс самонаведения, в котором MSCs мигрируют в поврежденные ткани может быть наиболее важным препятствием для преодоления. MSCs имеют системный механизм самонаведения с последовательными шагами привязывания / прокатки, активации, ареста, трансмиграции / диапедез, имиграция 6,7,8. В настоящее время предпринимаются усилия по выявлению путей совершенствования этих шагов. Различные стратегии, в том числе генетическая модификация, инженерия поверхности клеток, в пробирке грунтовки, и магнитное руководство,были протестированы 6,7. Кроме того, было предпринято несколько попыток содействовать защите и регенерации слуховых волосковых клеток путем самонаведения MSCs к месту повреждения улитки. Тем не менее, отслеживание MSCs in vivo является трудоемким и трудоемким и требует высокоспециализированныхнавыков 9.
Для решения этой проблемы был разработан метод наблюдения за самонаведением MSC в улитке через промежуточную конфокаловую микроскопию, которая фотографирует миграцию клеток в течениенескольких часов (рисунок 1). Он был разработан в начале 20-говека и в последнее время стал мощным инструментом для изучения миграции конкретных клеток.
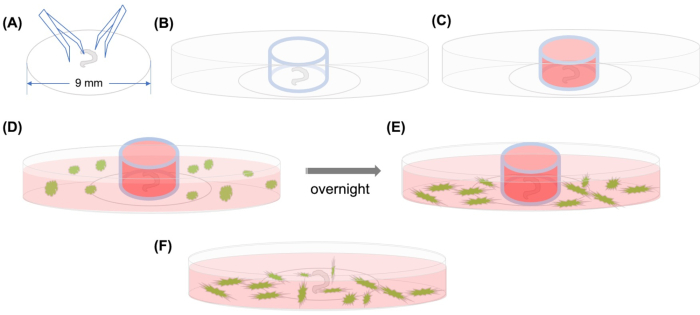
Рисунок 1: Графический абстрактный. (A) После того, как расчлененный орган Корти прилипает на пластиковой крышке с использованием типсов, крышки помещаются на 35-мм стеклянное дно конфокальной микроскопической тарелки, и (B) стеклянный цилиндр расположен. (C) После заполнения внутренней части стеклянного цилиндра со средним, (D) GFP помечены MSCs со средним добавляются тщательно за пределами цилиндра. (E) После инкубации на ночь, (F) стеклянный цилиндр удаляется, и изображения принимаются с конфокального микроскопа. Аббревиатуры: GFP - зеленый флуоресцентный белок; MSCs и мезенхимальные стволовые клетки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
протокол
Все протоколы исследований с участием мышей МЦР были одобрены Институциональным комитетом по уходу за животными и использованию (IACUC) Университета Yonsei в Медицинском колледже Вонджу. Эксперименты проводились в соответствии с Кодексом этики Всемирной медицинской ассоциации. В этом протоколе беременные мыши МЦР содержались в светло-темном цикле 12/12 ч с бесплатным доступом к пище и воде.
1. Вскрытие улитки
- Стерилизовать ламинарный поток ткани культуры капот, включив ультрафиолетовый свет в течение 30 минут, и спрей все поверхности с 70% этанола до использования. Дайте поверхностям высохнуть.
- Поместите инструменты для вскрытия в 70% этанола в течение 10 минут, и высушите перед использованием.
- Используйте операционное лезвие, чтобы обезглавить постнатальных 3-4 дневных мышей(рисунок 2A).
- Поместите череп под стереомикроскоп в капюшоне ламинарного потока и замочите ткань в 70% этанола.
- Быстро замочите ткань в растворе вскрытия тканей (1x Хэнк сбалансированный раствор соли, 1 мМ HEPES) для удаления этанола.
- Вырезать центральную линию черепа хирургическим лезвием(рисунок 2B,C).
- Разоблачить череп, потянув вниз кожу передней и резки внешнего слухового канала уха (Рисунок 2D).
- Вырезать из передней к задней части черепа через линию глаза(рисунок 2E).
- Откройте череп и удалите forebrain, мозжечок, и ствол мозга с тупыми типсами(рисунок 2F,G).
- Используя микро-типсы, отделяйте улитку от височной кости(рисунок 2H).
- Перенесите улитку в чашку Петри, содержащую раствор вскрытия тканей.
- Тщательно вскрыть все кохлеарный otic капсулы, оставив только внутренние кохлеарный мягкихтканей (рисунок 2I,J).
- Держите модиол улитки с типсами и кохлеарный проток с другой парой типсов, и медленно отделить две ткани (Рисунок 2K).
- Удалите стриа васкуляры и текториальной мембраны, осторожно пилинг их прочь(рисунок 2L,M).
- Поместите стерилизованную пластиковую крышку в новый раствор вскрытия тканей, а затем поместите орган Корти на крышку диаметром 9 мм, убедившись, что базилярная мембрана стоит вниз(рисунок 2N-P).
- Обездвижить ткань, нажав мембрану Рейсснера и оставшиеся ткани модиолус на крышку с миппами(рисунок 2N-P).
- Перенесите крышку со встроенной тканью в центр конфокального блюда диаметром 35 мм.
- Поместите стеклянный клонирование цилиндра на блюдо, с кохлеарным эксплантом, расположенным в центре блюда, и добавьте 100 мкл экзафентной культуры среды (DMEM/F12, 10% сыворотки крупного рогатого скота плода (FBS), 1% N2 дополнения, ампициллин (10 мкг/мл))10 внутрицилиндра (рисунок 2).
- Плита 5 ×10 3 клетки мыши костного мозга полученных зеленый флуоресцентный белок (GFP) помечены MSCs в 2 мл культуры среды (45% DMEM и 45% DMEM/F12, 10% FBS, 1% N2 дополнения, 10 мкг / мл ампициллина) за пределамистеклянного цилиндра ( Рисунок 2R).
- Когда MSCs 80-90% стечения, прохождение их путем отсоединения их с трипсином-этилендиаминовой тетраасетной кислоты.
- Тщательно перенесите конфокальные блюда во влажный инкубатор и инкубировать на ночь при 37 градусов по Цельсию в атмосфере 5% CO2.
- Аспирировать все средние внутри и снаружи цилиндра, а затем удалить стеклянный цилиндр из конфокального блюда.
- Добавьте 2 мл свежей культуры среды к конфокальной тарелке, и инкубировать блюдо культуры тканей во влажном инкубаторе до готовности к анализу.

Рисунок 2. Вскрытие улитки мыши и кокультуры органа Корти и MSCs. (A ) Обезглавливание мыши, (B) и (C) средней линии sagittal рассечение головы, (D) и (E) коронального вскрытия мозга,(F) и (G) удаление мозга и височной кости, (H) улитка, (I) удаление костлявой кохлеарный стенки, (J) изоляция улитки, ( (L) отделение стриа васкуляриса (SV) и спиральной связки (SL) от органа Корти, (M) удаление текторной мембраны, (N-P) фиксация улитки на пластиковой крышке скольжения, ( ) расположение крышки и стеклянный цилиндр в конфокальной тарелке, (R) прививка MSCs. Белая шкала бар ( оранжевый(F, G, P)и желтый планкашкалы (H,I)- 1 мм; зеленая шкала бар (J-O) 0,5 мм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
2. Изображение замедленного действия
- Для экспериментов, представленных здесь, используйте систему конфокальные микроскопии с системой инкубатора верхней ступени.
- Включите конфокальный микроскоп, флуоресцентный свет и компьютер.
- Установите условия инкубатора на этапе, помещенного на стадии конфокального микроскопа, до 37 градусов по Цельсию и 5% CO2 атмосферы.
- Поместите образец блюда на сосуд для фиксации блюда, накройте крышкой для фиксации блюда и закройте камеру верхней крышкой нагревателя.
- Отрегулируйте зум и фокус для локализации органа Корти и MSC в поле зрения.
- Откройте программное обеспечение для обработки изображений. В соответствии с опцией поиска выберите цель 20x Plan-Apochromat (численная диафрагма 0,8) и площадь урожая 0,5x.
- В рамках приобретениянажмите на интеллектуальную настройку и выберите EGFP.
- Откройте вкладку канала под Приобретение, и установить мощность лазера до 0,2%, пинхол до 44 мкм, мастер получить до 750 V, и цифровой прирост до 1,0.
- Нажмите на ESID под настройкойизображения, и установите ESID получить до 4 и цифровой прирост до 7,5.
- Нажмите на плитки и кол для производства 210 плитки.
- Откройте стратегию Фокус и выберите режим фокусировки.
- По временным сериямустановите продолжительность до 24 ч и интервал до 10 мин.
- В рамках приобретения,установить размер кадра до 512 х 512 пикселей, скорость сканирования до 8, направление двунаправленный, в среднем до 4x, и биты на пиксель до 16.
- Нажмите на стартовый эксперимент, чтобы начать эксперимент.
3. Модификация файла изображения
- При обработкенажмите на сшиваниеи установите минимальную накладку до 5% и максимальный сдвиг до 10%.
- Нажмите на экспортфильма, установите несжатый,и установите скорость до 7,5.
4. Иммуностимулятор
- Аспирировать среду тщательно, и мыть образец дважды с фосфат-буферной солевой раствор (PBS) в течение 5 мин.
- Исправить образец с 4% формалин в PBS в течение 15 минут, и мыть образец 3 раза с PBS в течение 5 мин.
- Permeabilize образец в 0,1% Тритон X-100 в PBS в течение 10 минут, и мыть 3 раза с PBS в течение 5 мин.
- Добавьте 250 МКЛ фаллоидин-iFluor 647 реагента (1:1000 разбавления в PBS), и инкубировать образец в течение 1 ч при комнатной температуре на шейкере.
- Вымойте образец 3 раза с PBS в течение 5 минут.
- Перенесите крышку на стеклянную горку и добавьте 2 капли монтажного раствора.
- Поместите крышку на слайд осторожно.
- Печать крышки с четким лаком для ногтей и хранить при 4 градусов по Цельсию в темноте, пока клетки не наблюдаются.
- Изображение слайда с помощью конфокального микроскопа с соответствующим фильтром при возбуждении/выбросе (Ex/Em) 650/665 нм для фаллоидин и на Ex/Em'488/507 nm для EGFP.
Результаты
Миграция MSC в трехмерном режиме была оценена системой Transwell или традиционным методом заживления ран для наблюдения за миграцией в двухмерном (2D) режиме11. Орган Корти является сложной структурой, состоящей из различных клеток, таких как клетки Boettcher, клетки ...
Обсуждение
Тщательно изучена трансплантация MSC в поврежденные участки для содействия регенерации поврежденных клеток, и терапевтический эффект очевиден. Трансплантация и последующая дифференциация MSCs, как сообщается, восстановить слух у крыс с потерей слуха, вызванной 3-нитропропионовой
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Эта работа была поддержана научно-исследовательскими грантами (NRF-2018-R1D1A1B07050175, HURF-2017-66) от Национального исследовательского фонда (NRF) Кореи и Исследовательского фонда Халлымского университета.
Материалы
| Name | Company | Catalog Number | Comments |
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
Ссылки
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены