Method Article
Modelo de herida humana ex vivo y enfoque de tinción de montaje completo para evaluar con precisión la reparación de la piel
En este artículo
Resumen
Aquí demostramos una técnica optimizada para evaluar la reparación de heridas utilizando piel humana ex vivo combinada con un enfoque de tinción de montaje completo. Esta metodología proporciona una plataforma preclínica para la evaluación de posibles terapias de heridas.
Resumen
Las heridas crónicas que no cicatrizan, que afectan principalmente a los ancianos y diabéticos, son un área importante de necesidad clínica insatisfecha. Desafortunadamente, los tratamientos actuales para heridas crónicas son inadecuados, mientras que los modelos preclínicos disponibles predicen mal la eficacia clínica de las nuevas terapias. Aquí describimos un modelo preclínico de alto rendimiento para evaluar múltiples aspectos de la respuesta de reparación de la piel humana. Las heridas de espesor parcial se crearon en la piel humana ex vivo y se cultivaron a lo largo de un curso de tiempo de curación. Las biopsias de heridas de piel se recogieron en fijador para el procedimiento de tinción de montaje completo. Las muestras fijas se bloquearon y se incubaron en anticuerpos primarios, con la detección lograda a través de anticuerpos secundarios conjugados fluorescentemente. Las heridas se contrateñeron y se realizaron imágenes mediante microscopía confocal antes de calcular el porcentaje de cierre de la herida (reepilecialización) en cada biopsia. Aplicando este protocolo, revelamos que las heridas por escisión de 2 mm creadas en la piel sana del donante se reepitelizan completamente en el día 4-5 después de la herida. Por el contrario, las tasas de cierre de las heridas de la piel diabética se reducen significativamente, acompañadas de una reforma de barrera perturbada. La combinación de heridas en la piel humana con un novedoso enfoque de tinción de montaje completo permite un método rápido y reproducible para cuantificar la reparación de heridas ex vivo. En conjunto, este protocolo proporciona una valiosa plataforma humana para evaluar la efectividad de las posibles terapias de heridas, transformando las pruebas preclínicas y la validación.
Introducción
Las heridas crónicas que no cicatrizan, que son altamente prevalentes en los ancianos y diabéticos, son un área muy poco apreciada de necesidad clínica insatisfecha. Estas heridas presentan una gran carga física y psicológica para los pacientes y cuestan a los proveedores de atención médica miles de millones cada año para tratar1. A pesar de una mejor comprensión de la biología de las heridas y los avances en la tecnología, hasta el 40% de las heridas crónicas aún no se curan después de la mejor atención estándar2. Así, el 14-26% de los pacientes con úlceras del pie diabético requieren posteriormente la amputación3,mientras que la tasa de mortalidad post-amputación a 5 años se sitúa en aproximadamente el 70%4. Como resultado, existe un requisito urgente para desarrollar nuevas terapias eficaces para mejorar la calidad de vida del paciente al tiempo que se reduce la carga sustancial de atención médica impuesta por la mala cicatrización de las heridas. Los modelos preclínicos mal predictivos siguen siendo un obstáculo importante para el desarrollo de nuevas terapias efectivas.
La reparación de heridas es un proceso dinámico y multifacético que involucra una amplia gama de tipos de células, innumerables niveles de comunicación y un entorno tisular que se remodela temporalmente. La curación de la piel se basa en cuatro etapas reparadoras principales: hemostasia, inflamación, proliferación y remodelación de la matriz. Estas etapas en última instancia actúan para prevenir la pérdida de sangre y la infección, cerrar la superficie de la herida (un proceso denominado reepilecialización) y devolver la piel a un estado no herido5. Las heridas crónicas se asocian con una etiología diversa y una perturbación generalizada de los procesos de curación6,lo que complica aún más la identificación de dianas terapéuticas. Sin embargo, se ha desarrollado una amplia gama de modelos para dilucidar los impulsores moleculares y celulares de la patología de heridas y probar nuevos enfoques terapéuticos7.
El modelo de reparación de heridas más utilizado es la herida aguda en el ratón. Los ratones son altamente tratables para estudios mecanicistas y proporcionan modelos validados de envejecimiento y diabetes8. A pesar de las similitudes generales mostradas entre la curación de ratones y humanos, las diferencias entre especies en la estructura de la piel y la dinámica de curación permanecen. Esto significa que la mayoría de las investigaciones de heridas murinas no se traducen fácilmente a la clínica9. En consecuencia, se ha dado un impulso hacia los sistemas humanos in vitro y ex vivo con alta aplicabilidad y traducibilidad10,11.
Aquí proporcionamos un protocolo en profundidad para la realización de heridas por escisión de espesor parcial en piel humana ex vivo. También describimos nuestro enfoque de tinción de montaje completo como un método altamente reproducible para evaluar la curación ex vivo de la piel humana. Mostramos la trayectoria de la reparación epidérmica (reepilecialización) y la posterior formación de barreras, evaluando la tasa de cierre de heridas en piel humana sana versus diabética. Finalmente, demostramos cómo la tinción de montaje completo se puede adaptar para su uso con una variedad de anticuerpos para evaluar varios aspectos de la respuesta de curación.
Protocolo
La piel humana se obtuvo de pacientes sometidos a cirugía reconstructiva en Castle Hill Hospital y Hull Royal Infirmary (Hull, Reino Unido) bajo el consentimiento del paciente completo y por escrito, las pautas institucionales y la aprobación ética (LREC: 17/SC/0220 y 19/NE/0150). Se recogió piel no diabética de pacientes sometidos a cirugía de rutina (edad media = 68 años). La piel diabética se seleccionó de donantes que habían establecido diabetes tipo II y antecedentes de ulceración (edad media = 81). Las muestras de la cirugía se transportaron en medios de retención y se procesaron inmediatamente después de su llegada al laboratorio. Todos los pasos experimentales utilizando tejido humano no fijado se realizaron en el nivel de bioseguridad 2 (BSL-2) en un gabinete de bioseguridad de flujo laminar de clase II.
1. Preparación de medios de cultivo de la piel y reactivos de tinción
NOTA: Todos los detalles de reactivos y consumibles se proporcionan en la Tabla de Materiales. Asegúrese de que todos los reactivos y equipos utilizados para el procesamiento y cultivo de tejidos humanos sean estériles. Esterilizar los instrumentos antes del uso y descontaminar con desinfectante después del contacto con el tejido. Descontaminar los productos de desecho en desinfectante al 1% antes de su eliminación.
- Medios de retención: Suplementar el Medio Águila Modificada (DMEM) de Dulbecco con 2 mM de L-glutamina y solución antibiótico-antimicótica al 4% (v/v).
- Solución salina equilibrada de Hank (HBSS) con antibióticos: Agregue una solución antibiótica antimicótica al 4% (v/v) a HBSS. Conservar a 4 °C hasta su uso.
- Solución salina tamponada con fosfato (DPBS) de Dulbecco: Prepare DPBS disolviendo 9,6 g de polvo de DPBS por litro de agua destilada (dH2O). Autoclave para esterilizar y conservar a 4 °C hasta su uso.
- Medios de crecimiento de la piel humana: Suplementar DMEM de alta glucosa con 2 mM de L-glutamina, 1% (v/v) solución antibiótica-antimicótica y 10% (v/v) de suero fetal bovino. Conservar a 4 °C hasta su uso.
- Fijador cutánico: A 450 mL de dH2O, añadir 40 mL de solución de formaldehído, 10 mL de ácido acético glacial, 4,5 g de cloruro de sodio y 0,25 g de bromuro de alquiltrimetilamonio. Almacene a temperatura ambiente (RT) y úselo dentro de unos días.
PRECAUCIÓN: El fijador es peligroso (irritante e inflamable). Manejar con cuidado y desechar a través de una ruta apropiada. - Solución salina tamponada con fosfato (PBS): Prepare PBS para la tinción de montaje completo agregando 6 g de cloruro de sodio a 100 ml de solución tampón de fosfato y 900 ml de dH2O.
- Tampón de lavado de manchas: Disuelva 0.5% (v / v) Triton X-100 en PBS.
- Tampón de bloqueo: Agregue 0.2% (p/ v) de azida de sodio y 2% (v / v) de suero animal al tampón de lavado de manchas. Conservar a 4 °C durante un hasta dos semanas.
NOTA: Bloqueo en el suero de la especie huésped de anticuerpos secundarios. La azida de sodio evitará el crecimiento bacteriano durante la incubación. - Solución de trabajo DAPI: Prepare un stock de 5 mg/ml de 4′,6-diamidino-2-fenilindol (DAPI) en dimetilsulfóxido. Diluya el material 1:1.000 en tampón de lavado de tinción para dar una solución de trabajo DAPI de 5 μg/mL.
- Bloque de peroxidasa: Agregue peróxido de hidrógeno al 0.3% (v / v) al tampón de lavado de tinción. Conservar a 4 °C hasta su uso. Mantener en la oscuridad para evitar la descomposición.
- Kit ABC-HRP:
- Anticuerpo secundario conjugado con HRP: 1 gota de IgG anti-cabra de conejo biotinilado en 5 mL de tampón de tinción. Conservar a 4 °C durante un hasta dos semanas.
NOTA: El kit/secundario utilizado dependerá de la especie huésped del anticuerpo primario. - Reactivo del complejo avidina-biotina (ABC): 2 gotas de reactivo A y 2 gotas de reactivo B en 5 ml de tampón de lavado de tinción. El reactivo ABC debe prepararse al menos 30 minutos antes de su uso. Conservar a 4 °C durante un hasta dos semanas.
- Anticuerpo secundario conjugado con HRP: 1 gota de IgG anti-cabra de conejo biotinilado en 5 mL de tampón de tinción. Conservar a 4 °C durante un hasta dos semanas.
- Sustrato de peroxidasa: 3 gotas de reactivo 1, 2 gotas de reactivo 2, 2 gotas de reactivo 3 y 2 gotas de peróxido de hidrógeno en 5 ml de dH2O. El sustrato de peroxidasa debe prepararse inmediatamente antes de su uso y no se puede almacenar.
2. Preparación de la piel para la herida
NOTA: Estos pasos deben realizarse en un gabinete de bioseguridad de flujo laminar de clase II.
- Recoja la piel en los soportes de sujeción y transpórse hasta el gabinete BSL-2.
- Coloque la dermis de la piel de lado hacia abajo dentro de una placa de Petri estéril de 90 mm y retire el tejido adiposo con tijeras estériles.
- Coloque la piel en un tubo de 50 ml que contenga 25 ml de HBSS con antibióticos durante 10 minutos en RT. Agite intermitentemente para eliminar cualquier residuo de sangre y tejido adiposo.
- Repita el paso 2.3 con un nuevo tubo de 50 ml.
- Coloque la piel en un tubo fresco de 50 ml que contenga 25 ml de HBSS, esta vez sin antibióticos durante 10 minutos en RT. Agite como en el paso 2.3.
- Realice un enjuague final de la piel colocando la piel en un tubo nuevo con 25 ml de DPBS. La piel ahora está lista para herir.
3. Creación de heridas ex vivo en la piel humana
NOTA: Estos pasos deben realizarse en un gabinete de bioseguridad de flujo laminar de clase II.
- Prepare los platos de cultivo de la piel antes de la herida. En una placa de Petri de 60 mm, apile dos almohadillas absorbentes estériles y agregue 4 ml de medios de piel humana a través del costado de la placa. Coloque una membrana de filtro de nylon estéril sobre la pila de almohadillas absorbentes.
NOTA: Los medios de la piel pueden ser alterados dependiendo de las condiciones de tratamiento requeridas. Se pueden cultivar hasta tres explantes de heridas en cada pila. - Seque el lado dérmico de la piel con una gasa estéril en una placa de Petri de 90 mm para eliminar el DPBS residual.
NOTA: Esto evita que la piel se deslice al enrollar. - Coloque la dermis de la piel de lado hacia abajo en una tapa limpia de placa de Petri de 90 mm y seque la epidermis con una gasa estéril fresca.
NOTA: Es más fácil enrollar la piel en una tapa de placa de Petri que en la base. El trabajo posterior debe llevarse a cabo rápidamente para evitar que la piel se seque. - Sosteniendo la piel tensa, presione un punzón de biopsia de 2 mm contra la piel y gire suavemente. No golpee completamente a través de la piel.
NOTA: Las heridas de espesor parcial están diseñadas para perforar a través de la epidermis y parcialmente en la dermis. Puede haber variabilidad de donante a donante y de sitio a sitio en la fuerza requerida para crear la herida de espesor parcial. - Use fórceps curvas de tejido dentado para recoger cada lado de la herida de 2 mm y enganche tijeras de iris curvas debajo de la herida de 2 mm para cortarla uniformemente.
- Biopsia alrededor de la herida central de 2 mm utilizando una punción de biopsia de 6 mm para crear un explante de 6 mm con una herida de 2 mm de espesor parcial en el centro.
NOTA: Se puede usar una punción de biopsia de 6 mm para puntuar la piel para marcar dónde debe estar cada herida de 2 mm. Tenga cuidado de no perforar el tejido por completo. Cree explantes de heridas en un patrón de panal para reducir el desperdicio. - Coloque los explantes de la epidermis enrollada de lado hacia arriba en la pila de membrana del filtro de nylon (preparado en el paso 3.1).
NOTA: Al manipular explantes de heridas, tenga cuidado de no dañar la herida central. Use pequeñas alforjas y recoja cada explante en lados opuestos. - Incubar heridas a 32-37 °C y 5% CO2 en atmósfera humidificada (90-95%) durante 1-7 días. Reemplace los medios cada 2-3 días.
4. Tinción de montaje entero de heridas ex vivo
NOTA: Esta sección describe los métodos de tinción de inmunofluorescencia e inmunoperoxidasa. Mezcle bien todos los reactivos antes de usarlos.
- Método de tinción fluorescente
- Recoger los explantes enrollados en tubos de microcentrífuga de 1,5 ml que contengan 500 μL de fijador cutángeo e incubar a 4 °C durante la noche.
NOTA: El fijador utilizado en este protocolo funciona bien para los anticuerpos descritos. Se requerirá optimización para otros anticuerpos. La fijación tisular durante más de 24 h puede conducir a una fijación excesiva. - Al día siguiente retire el fijador y reemplácelo con 1 ml de tampón de lavado de manchas. Las biopsias se pueden almacenar en tampón de lavado de tinción a 4 °C hasta 2 semanas antes de la tinción.
NOTA: Para todos los pasos del tampón de lavado, use una pipeta serológica o una punta de pipeta, teniendo cuidado de no dañar la herida. - Aspire el tampón de lavado de manchas y realice un enjuague más con 1 ml de tampón de lavado de manchas.
- Calcule la cantidad de búfer de bloqueo necesario para los pasos 4.1.5-4.1.6 (número de muestras x 300 μL = cantidad de búfer de bloqueo en μL). Haga un búfer adicional si es necesario.
- Añadir 150 μL de tampón de bloqueo a cada muestra e incubar durante 1 h en RT. Para todos los pasos de tinción, asegúrese de que cada muestra esté suficientemente cubierta y que no haya burbujas que cubran la superficie de la herida de la biopsia.
NOTA: Este paso en adelante se puede realizar en tubos de microcentrífuga de 1,5 ml o en una placa de 48 pozos. Si usa una placa de 48 pozos, incube las heridas boca abajo en cada pozo. - Diluya el anticuerpo primario en el tampón de bloqueo restante.
NOTA: La queratina 14 (K14) diluida 1:1.000 anti-ratón en el búfer de bloqueo funciona bien. Optimice este paso para su uso con otros anticuerpos o múltiples sondas. - Aspire el tampón de bloqueo y agregue 150 μL de anticuerpo primario por tubo de pozo/microcentrífuga. Incubar explantes de heridas en anticuerpos primarios a 4 °C durante la noche.
- Al día siguiente, aspire el anticuerpo primario y enjuague en tampón de lavado de tinción que contenga azida de sodio al 0,2% durante 1 h a RT (500 μL por muestra).
- Realice tres pasos de enjuague más utilizando el tampón de lavado de manchas (30 min por lavado, 500 μL por muestra).
- Diluya el anticuerpo secundario conjugado fluorescentemente en tampón de lavado de tinción (por ejemplo, cabra anti-ratón 488 en dilución 1:400).
- Calcular la cantidad requerida de anticuerpos secundarios (número de muestras x 150 μL = cantidad en μL).
- Añadir 150 μL de anticuerpo secundario a cada tubo de pozo/microcentrífuga. Incubar durante 1 h en RT. Realizar los pasos de incubación 4.1.10 - 4.1.16 en la oscuridad ya que el anticuerpo secundario es sensible a la luz.
NOTA: Este paso se puede realizar a 4 °C durante la noche si es necesario. Optimizar la concentración de anticuerpos secundarios necesarios para una señal adecuada y una tinción de fondo limitada. - Retire el anticuerpo secundario y realice 3 enjuagues de 3 x 30 minutos con tampón de lavado de tinción (500 μL por muestra).
- Deseche el búfer de lavado sobrante y calcule la cantidad de solución de trabajo DAPI requerida (según el paso 4.1.11).
- Contraaltene cada explante con 150 μL de solución de trabajo DAPI durante 10 min a RT.
NOTA: DAPI teñirá los núcleos celulares de azul. El tinte Hoechst se puede utilizar como alternativa a DAPI. - Realice dos lavados finales de 30 minutos con tampón de lavado de tinción (500 μL por muestra). Las biopsias se pueden almacenar en tampón de lavado de tinción a 4 ° C en la oscuridad hasta dos semanas antes de la obtención de imágenes.
- Recoger los explantes enrollados en tubos de microcentrífuga de 1,5 ml que contengan 500 μL de fijador cutángeo e incubar a 4 °C durante la noche.
- Método de tinción Brightfield.
- Realice los pasos 4.1.1 - 4.1.3.
- Resalte la actividad de la peroxidasa endógena con bloqueo de peroxidasa a 4 °C durante la noche.
NOTA: Este paso es importante cuando se utiliza un anticuerpo conjugado con HRP para reducir la tinción de fondo no específica del tejido. El tejido altamente vascularizado contendrá más actividad endógena de la peroxidasa. - Deseche el bloque de peroxidasa y enjuague dos veces durante 30 minutos en tampón de lavado de manchas.
- Realice los pasos 4.1.4 - 4.1.8.
NOTA: Los lavados después del paso 4.1.7 son particularmente importantes para eliminar la azida de sodio de las muestras. Si la azida de sodio no se elimina adecuadamente, inactivará la HRP e interferirá con la detección de manchas. - Añadir 150 μL de anticuerpo secundario conjugado con HRP a cada tubo de pozo/microcentrífuga e incubar durante la noche a 4 °C o 1 h a RT.
- Retire el anticuerpo secundario y realice 3 x 30 min de lavado en tampón de lavado de manchas.
- Agregue 150 μL de reactivo ABC a cada pozo/tubo de microcentrífuga e incube durante la noche a 4 °C o 1 hora a RT.
- Aspirar el reactivo ABC y realizar lavados de 3 x 30 min en tampón de lavado de manchas.
- Agregue un sustrato de peroxidasa de 150 μL a un explante y determine el tiempo necesario para detectar un cambio de color notable.
NOTA: Elija una muestra donde se espere una tinción fuerte. En este caso, un anillo rojo para mostrar la epidermis migratoria (K14). La 3,3'-diaminobencidina-4, o cualquier otro sustrato cromogénico apropiado, puede utilizarse como sustituto de este sustrato de peroxidasa. - Una vez que se observe un cambio de color, retire el sustrato de peroxidasa y reemplácelo con 1 ml de dH2O.
- Repita la detección del sustrato de peroxidasa para los otros explantes, incubando durante el tiempo determinado en el paso 4.2.11.
- Enjuague todos los explantes con 1 ml de dH2O para eliminar el sustrato de peroxidasa residual. Aunque los explantes pueden almacenarse hasta una semana a 4 °C antes de la obtención de imágenes, es mejor obtener imágenes de ellos lo antes posible para evitar la lixiviación del sustrato de peroxidasa en el dH2O con el tiempo.
5. Imagen y cuantificación
- Imágenes fluorescentes
NOTA: Las imágenes fluorescentes se realizan utilizando un microscopio de barrido láser confocal. Sin embargo, un microscopio fluorescente invertido puede ser suficiente para adquirir imágenes 2D para cuantificar las tasas de cierre de heridas. Al seleccionar anticuerpos secundarios, asegúrese de que los fluorocromos elegidos sean compatibles con los espectros de excitación y emisión del equipo de microscopía disponible.- Utilice un microscopio de barrido láser confocal equipado con un objetivo de 2.5x, 10x y 20x, etapa motorizada x-y-z, cámara digital y software de adquisición. Encienda el detector de luz transmitida (TPMT) para permitir una fácil visualización de cada biopsia y para permitir la medición del cierre total de la herida. Alternativamente, mida cada herida a través de microscopía de campo brillante después de imágenes de fluorescencia.
- Coloque una base de placa de Petri de 60 mm en la plataforma de imágenes y agregue una capa delgada (alrededor de 1 ml) de DPBS.
NOTA: Si se usa demasiado DPBS, la biopsia se moverá durante la toma de imágenes. Alternativamente, use una placa de 48 pozos si hay un soporte de placa disponible. - Use pequeñas fórceps de tejido para transferir explantes de heridas de pozos/tubos de microcentrífuga a la placa de Petri que contiene DPBS. Coloque la herida de la biopsia de lado hacia abajo en la placa de Petri.
- Use el ocular y la lámpara fluorescente para localizar y enfocar la herida. Si las burbujas están atrapadas debajo de la muestra en el campo de visión, recoja la herida con forrcepciones de tejido y reposicione.
- Configure el software de imágenes, asegurando el mismo tamaño de agujero de alfiler entre canales para una confocalidad óptima. Para esto, verifique el valor de una unidad aireda para cada canal y seleccione el valor más grande. Seleccione la velocidad de escaneo, la calidad de la imagen y el promedio.
NOTA: Los fluorocromos de los anticuerpos secundarios conjugados y la contratinción elegida (por ejemplo, DAPI) dictarán los canales requeridos. - Encienda el software de adquisición en vivo y ajuste la potencia del láser y la ganancia de cada canal a los niveles necesarios para visualizar la tinción. Reduzca el ruido de fondo aumentando el desplazamiento digital.
- Coloque la herida en el centro del plano de la imagen.
NOTA: Si la herida no llena toda la imagen debido al uso de un objetivo más pequeño o a la creación de una herida más grande, tome un panel de imágenes y coselas (manualmente o con una función de mosaico en el software de imágenes correspondiente). - Adquirir imágenes de las biopsias de la herida. Utilice la misma configuración de imagen entre explantes.
NOTA: Las imágenes de mayor potencia permitirán la evaluación de las estructuras tisulares y la expresión y ubicación de los marcadores celulares. - Recoja las pilas Z en serie a través de la herida, especialmente cuando el tejido no esté completamente plano contra la placa de Petri. Utilice un software de análisis para contraer la pila Z en una sola imagen de proyección de máxima intensidad.
- Imágenes de campo brillante
NOTA: Las imágenes de campo brillante de biopsias teñidas con inmunoperoxidasa se pueden realizar de múltiples maneras.- Imágenes de microscopio invertido: Prepare los explantes de heridas para la obtención de imágenes colocándolos en una placa de Petri / pozo como se describe en los pasos 5.1.2-5.1.3. Adquiera imágenes digitales bajo iluminación de campo brillante en un microscopio invertido equipado con una cámara digital. Unir varias imágenes si es necesario.
- Imágenes de microscopio digital inalámbrico: Use un microscopio digital inalámbrico conectado a un teléfono o computadora portátil para obtener imágenes de alta calidad de una manera rentable. Coloque los explantes enrollados de lado hacia arriba sobre algún tejido y retire cualquier residuo de dH2O (o tampón de lavado de manchas) del almacenamiento de muestras. Coloque el explante de la herida en el centro del campo de visión del microscopio. Adquiera imágenes utilizando la cámara conectada.
- Cuantificación
NOTA: El porcentaje de cierre de heridas se puede cuantificar en cualquier software que permita dibujar y medir formas a mano alzada. ImageJ se puede utilizar para realizar la cuantificación de la siguiente manera:- Abra la imagen que se cuantificará en el software ImageJ.
- Use la herramienta de forma a mano alzada para dibujar alrededor del exterior de la herida reepilecializada donde se encuentra con la piel normal. Presione M (o Analizar | Medida) para adquirir una medición de área "exterior".
NOTA: La textura del tejido de la herida reepilificada difiere de la piel normal. Las imágenes no necesitan ser escaladas antes de este tipo de análisis. - Use la herramienta de forma a mano alzada para dibujar alrededor del área abierta de la herida. Aquí es donde la herida abierta se encuentra con el borde interior del tejido reepiltelizante. Presione M (o Analizar | Medir) para adquirir una medición de área 'interna'.
- Utilice la siguiente ecuación para deducir el porcentaje de reepilecialización/cierre de la herida:
% Cierre = (Área de la herida externa - Área de la herida interna) / (Área de la herida externa) x 100
NOTA: El porcentaje de cobertura de área de anticuerpos se puede deducir de la misma manera (por ejemplo, K14) o como porcentaje del área total de la herida. La intensidad porcentual también puede proporcionar información semicuantitativa sobre la expresión a nivel tisular de los marcadores de interés, mientras que las imágenes de alta potencia presentan datos de expresión a nivel celular.
Resultados
En este informe, presentamos un nuevo enfoque ex vivo de heridas cutáneas y tinción de montaje completo para evaluar los factores que influyen en la respuesta de reparación de la piel humana. La Figura 1A muestra un esquema de la tubería de procedimiento, que se puede realizar en 3-10 días, dependiendo de los tiempos de incubación de la herida. Las heridas de espesor parcial se cultivan en pilas de membrana en el aire: interfaz de membrana y se pueden recolectar para tinción de montaje completo, incrustarse en parafina o medio OCT para histología general, o congelarse en nitrógeno líquido para análisis bioquímico(Figura 1B). Generalmente creamos heridas de espesor parcial de 2 mm dentro del centro de explantes de 6 mm. Sin embargo, el tamaño de la herida y el explante circundante pueden alterarse según los requisitos. El procedimiento de montaje completo se ha adaptado con éxito para los métodos de tinción de inmunoperoxidasa e inmunofluorescencia(Figura 1C).
La inmunofluorescencia permite el sondeo de tejido con múltiples anticuerpos. Para ello, aconsejamos el uso de anticuerpos primarios criados en diferentes especies, y anticuerpos secundarios conjugados fluorescentemente compatibles con especies para limitar la reactividad entre especies. Las concentraciones de anticuerpos y los tiempos de incubación deberán optimizarse. Si se observa tinción de fondo, reduzca las concentraciones de anticuerpos, aumente los pasos de lavado y agregue un tampón de bloqueo al anticuerpo secundario. La viabilidad de los tejidos frescos se puede evaluar directamente con colorantes de viabilidad comercial (ver Tabla de Materiales). También mostramos que el tejido puede fijarse después de la tinción de viabilidad y obtener una imagen exitosa cuando es prácticamente adecuado (Figura 1D).
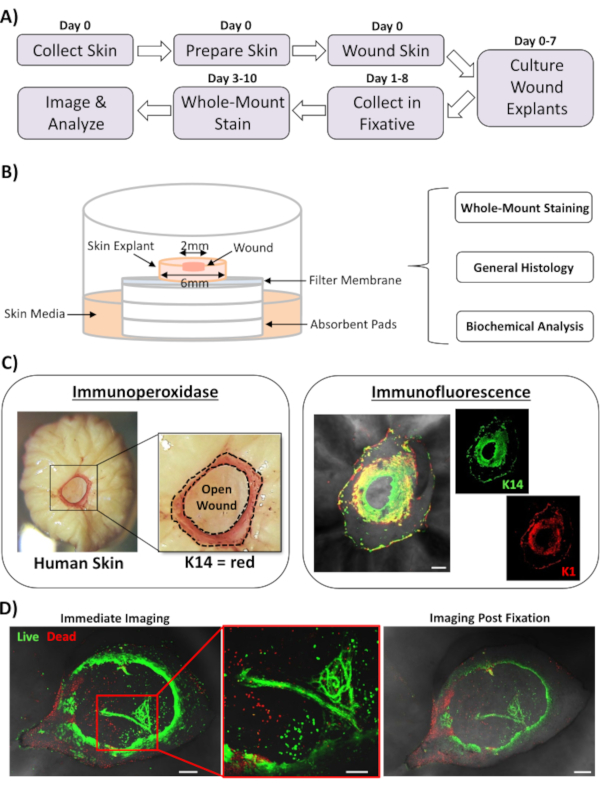
Figura 1: El enfoque de la herida humana ex vivo y la tinción de montaje completo. (A) Pipeline que representa el flujo de trabajo de procedimiento desde la recolección de piel y la realización de heridas ex vivo, hasta la tinción de tejidos y el análisis de datos. (B) Diagrama que demuestra el sistema de cultivo de heridas de piel humana ex vivo con análisis realizados rutinariamente en el tejido. (C) La tinción de montaje completo puede emplearse utilizando técnicas de inmunoperoxidasa e inmunofluorescencia. K14 = queratina 14. (D) El tejido vivo puede teñirse con tintes de viabilidad comercial y obtener imágenes con éxito después de la fijación. Bar = 100 μm. Esta tinción se realizó en pieles no diabéticas. Haga clic aquí para ver una versión más grande de esta figura.
El uso más ampliamente aplicable para la tinción de heridas en todo el montaje es determinar la tasa de cierre de la herida de una manera más reproducible que la que se puede proporcionar a través de la sección histológica. El porcentaje de cierre se cuantificó como porcentaje de reepilecialización de la superficie de la herida, como se demuestra en la Figura 2A. El porcentaje de cobertura de área de marcadores específicos se puede medir a partir del área total de la herida o como un porcentaje de la herida reepilecializada. Caracterizamos la cicatrización en piel sana (no diabética) versus diabética a lo largo de un curso de siete días, recogiendo heridas en cada día después de la herida (imágenes representativas, Figura 2B). Las heridas cutáneas sanas se cerraron con el tiempo como se esperaba, con un cierre total observado en la mayoría de las muestras para el día 4-5. Por el contrario, las heridas de la piel diabética no se cerraron completamente dentro del período de análisis de siete días(Figura 2C). Se observó un retraso significativo en el cierre de la herida entre las heridas cutáneas sanas y diabéticas al comparar las tasas de cicatrización en cada punto de tiempo posterior a la lesión(P < 0,001 al día 6, P < 0,05 al día 6 y P < 0,05 a P < 0,001 al día 7).
Después de la evaluación de las tasas generales de cierre de heridas; medimos el porcentaje de toda el área de la herida (área externa en la Figura 2A)donde se pudieron visualizar las células K14 positivas (tinción verde en la Figura 2B). Curiosamente, observamos que en heridas cutáneas sanas ex vivo, la tinción de K14 alcanzó su punto máximo en el día 2 y luego disminuyó rápidamente (importancia en cada punto de tiempo frente al pico del día 2, Figura 2D). Es probable que esto refleje la re-formación de la barrera epidérmica temprana, excluyendo la penetración de anticuerpos K14 a través de capas epidérmicas diferenciadas (ver Esquema de la Figura 2E). Durante el proceso de reepiltelización, los queratinocitos de la capa basal (K14 + ve) migran hacia adentro sobre la herida abierta de tal manera que la epidermis más cercana al borde externo de la herida se forma antes que la epidermis más cerca del borde interno de la herida (frente migratorio). Mientras que el borde frontal de la epidermis recién formada continúa migrando para cerrar la herida abierta restante, la epidermis del borde externo comienza a diferenciarse para reformar las otras capas epidérmicas. En la curación temprana, esperaríamos ver que la mayor parte del área reepiltelizada consiste en células basales (K14 + ve), mientras que en la reparación posterior se pierde la tinción de K14 a medida que la epidermis se diferencia del exterior hacia adentro (ver imágenes de montura completa en la Figura 2E). Por lo tanto, la disminución en la tinción de K14 que se muestra en la Figura 2D (flechas hacia abajo) se correlaciona con una mayor diferenciación epidérmica. Curiosamente, la tinción visible de K14 alcanzó su punto máximo más temprano en heridas sanas (día 2) versus diabéticas (día 4), lo que demuestra aún más que la reepilecialización y la posterior diferenciación epidérmica se retrasan en las heridas de la piel diabética.
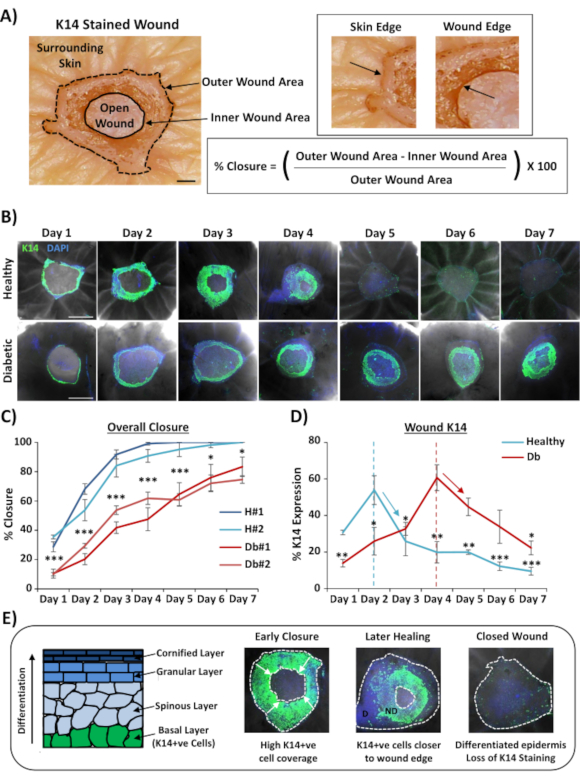
Figura 2:La tinción de montaje completo revela tasas de curación perturbadas en la piel diabética frente a la sana. (A) El método utilizado para cuantificar el cierre de la herida a partir de las mediciones externas e internas de la herida. Las imágenes de Campo Brillante muestran queratina 14 (K14) se tiñe en rojo. Bar = 300 μm. (B) Imágenes representativas de la cicatrización a lo largo del tiempo (día post-herida) en piel sana y diabética. Bar = 500 μm. K14 = verde. DAPI = núcleos azules. (C) Cuantificación de las tasas de cierre de heridas (porcentaje de reepilecialización) que muestra que las heridas ex vivo de piel sana se cierran significativamente más rápido que las heridas ex vivo de piel diabética. H = saludable. Db = diabético. (D) El porcentaje de tinción K14 alcanza su punto máximo antes en la piel sana frente a la diabética y luego disminuye en línea con el aumento de la diferenciación epidérmica (flechas hacia abajo). (E) La tinción K14 (célula epidérmica basal) se pierde a medida que la epidermis se diferencia. D = diferenciado. ND = no diferenciado. Las líneas punteadas blancas representan los bordes internos y externos de la herida. Flechas blancas = dirección de la migración. n = 6 heridas por donante, por punto de tiempo. Media +/- SEM. * = P < 0,05, ** = P < 0,01 y *** = P < 0,001. Sanos y diabéticos comparados en cada punto de tiempo de curación en C (valorde P para la comparación menos significativa). Cambio temporal en la tinción de K14 en comparación con el pico para cada donante en D. Haga clic aquí para ver una versión más grande de esta figura.
A continuación, utilizamos la tinción de montaje completo para explorar la expresión tisular y la localización de otros marcadores relevantes para la herida en pieles no diabéticas(Figura 3). Todos los anticuerpos utilizados y sus concentraciones de trabajo se proporcionan en la Tabla de Materiales. Los vasos sanguíneos en la herida abierta se tiñen positivamente con el anticuerpo de actina del músculo liso alfa (a-SMA), utilizado en combinación con K14 para delinear los bordes epidérmicos en imágenes de menor potencia(Figura 3A). La matriz dérmica se tiñó con anticuerpos contra colágeno tipo I (COL 1) y fibronectina (Fn). Aquí se observó que el colágeno era abundante en fibras gruesas, mientras que las fibras de fibronectina eran escasas, onduladas ydelgadas (Figura 3A). Nuestro enfoque de tinción de montaje completo también es capaz de proporcionar resolución de tinción a nivel celular, como se ha demostrado para los queratinocitos K14 positivos(Figura 3B).
Finalmente, mostramos que las heridas humanas ex vivo poseen células inmunes residentes, con células de Langerhans detectadas alrededor de la epidermis recién formada en el día 3 después de la herida(Figura 3C). De hecho, estos resultados sugieren que la tinción de montaje completo puede usarse para investigar las características clave de la respuesta de curación, incluida la inflamación, la proliferación y la matriz extracelular(Figura 4A). Tomados en conjunto, nuestros datos revelan que el procedimiento combinado de heridas cutáneas ex vivo y tinción de montaje completo es un método válido para evaluar varios aspectos de la reparación de la piel humana sana y diabética (patológica).
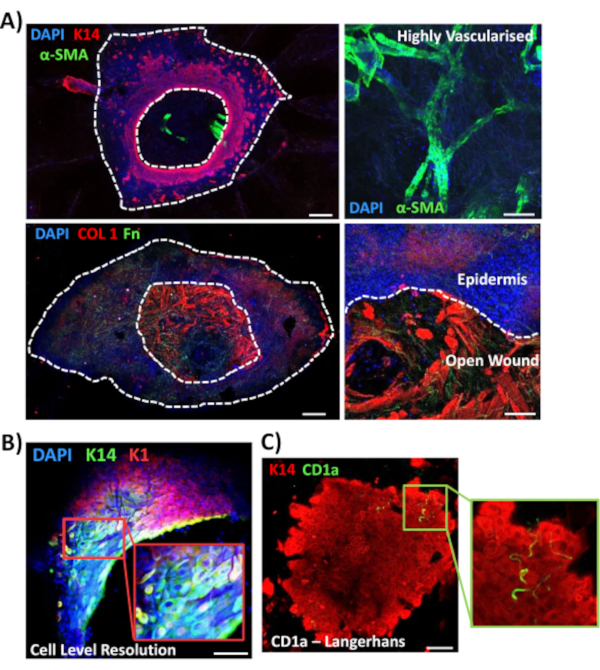
Figura 3: Optimización del enfoque de tinción de montaje completo para su uso con otros anticuerpos. (A) Los vasos sanguíneos se tiñeron con actina alfa del músculo liso (α-SMA, verde) y queratina 14 (K14, rojo), mientras que las fibras de la matriz se tiñeron con colágeno I (COL 1, rojo) y fibronectina (Fn, verde). (B) El procedimiento de montaje completo proporciona una resolución de localización hasta el nivel de celda (K14, verde; K1, rojo). (C) Células de Langerhans CD1a+ve (verdes) observadas en la epidermis recién formada. DAPI = núcleos azules. Bar = 100 μm. Las líneas punteadas blancas muestran los bordes internos y externos de la herida y separan la herida de la epidermis. Esta tinción se realizó en pieles no diabéticas. Haga clic aquí para ver una versión más grande de esta figura.
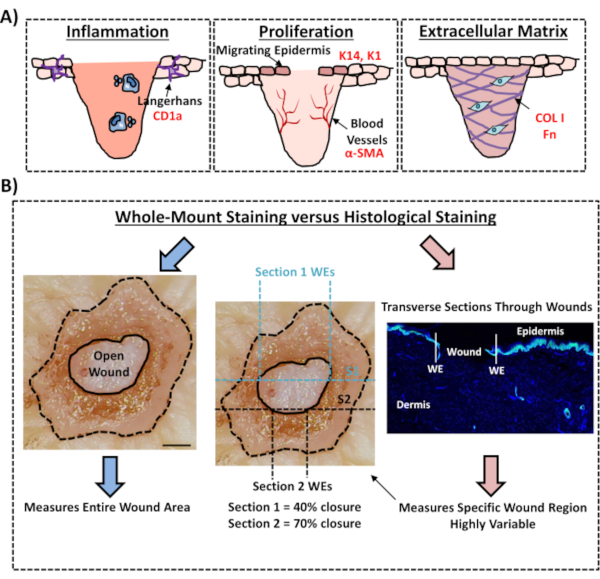
Figura 4: Validez del procedimiento de tinción de montaje completo para evaluar la cicatrización de heridas. (A) Ilustración que representa cómo la técnica de tinción de montaje completo puede evaluar los procesos relevantes para la herida. Anticuerpos utilizados = texto rojo. K14 = queratina 14. COL 1 = colágeno 1. Fn = fibronectina. (B) El procedimiento de tinción de montaje completo (flechas azules) introduce menos variabilidad en las mediciones de cierre de heridas que el análisis histológico estándar (flechas rojas). S1 = sección 1. WE = borde de la herida. Barra = 300 μm. Esta tinción se realizó en pieles no diabéticas. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este protocolo experimental, describimos un método optimizado para evaluar el cierre de heridas en piel humana ex vivo utilizando tinción de tejido de montaje completo. Este es un recurso importante para permitir la evaluación crítica de posibles tratamientos de heridas y para proporcionar una mejor comprensión de la respuesta humana de reparación de heridas. Hemos publicado la evaluación de curación en heridas cutáneas ex vivo anteriormente12,13, sin embargo, en estos informes no se utilizó el enfoque de tinción de montaje completo para medir el cierre de la herida. La tinción de montaje completo es mucho más fácil y requiere menos experiencia técnica que la histología estándar, que implica la incrustación de parafina o OCT y la seccionamiento de muestras. El procedimiento de montaje completo también reduce la variabilidad experimental, lo que permite cuantificar toda la herida y no solo una sola sección transversal en una posición definida dentro del tejido (ver Figura 4B para ilustración comparativa). Apoyamos plenamente la importancia de cuantificar la curación de toda la estructura de la herida no simétrica, como lo describen claramente Rhea y Dunnwald para las heridas agudas murinas14. Estos autores mostraron la importancia de seccionar en serie las heridas por escisión in vivo para mediciones reproducibles y precisas de la morfología de la herida. La seccionamiento en serie podría aplicarse igualmente a las heridas humanas ex vivo; sin embargo, para una cuantificación precisa del cierre de la herida y la reepitelización, la tinción de montaje completo de alto rendimiento debe ser el método preferido. Observamos que este protocolo de tinción de montaje completo también debe ser compatible con el procesamiento posterior (cera u OCT) para el análisis histológico tradicional.
La tinción de montaje completo no está exenta de desventajas. Si bien ofrece una mayor reproducibilidad en experimentos de curación de heridas, requiere el uso de más tejido para el análisis que las técnicas histológicas estándar. Esto puede ser un problema en el que el acceso al tejido es limitado, particularmente cuando se necesitan evaluar múltiples anticuerpos. Un enfoque alternativo sería emplear un método de herida incisional donde el ancho de la herida es relativamente uniforme y la variabilidad se reduce (como se muestra en las heridas de ratón y humanos15,16). Sin embargo, las heridas por escisión siguen siendo más aplicables a la mayoría de los tipos de heridas patológicas17.
En este estudio, se crearon heridas de espesor parcial de 2 mm dentro del centro de los explantes de piel de 6 mm. Este método puede optimizarse para tamaños alternativos de heridas y explantes por escisión a diferentes profundidades de la piel18. Además, la fuerza requerida para generar heridas variará entre los donantes, donde la piel envejecida requerirá menos fuerza para la biopsia. También evitaríamos el uso de pieles que muestren estrías prominentes u otras alteraciones estructurales. Hemos validado una gama de anticuerpos para considerar diferentes aspectos de la respuesta curativa ex vivo. Este protocolo también se puede utilizar con otros anticuerpos relevantes para la piel, donde las concentraciones de anticuerpos y los tiempos de incubación deberán optimizarse. Sin embargo, creemos que nuestro protocolo es el más adecuado para la cuantificación absoluta del cierre total de la herida, seguido de la evaluación espacial de proteínas específicas de interés. Si bien la montura completa proporciona una resolución reducida de la inmunolocalización en comparación con el análisis histológico estándar de las secciones de tejido, proporciona información 3D adicional que falta en la histología 2D estándar.
Una advertencia de la evaluación de la curación en la piel ex vivo versus los modelos in vivo es que carece de una respuesta sistémica. Un aspecto importante de la reparación de heridas es la inflamación y la posterior granulación tisular, que es causada por una afluencia de células inflamatorias y células endoteliales de la vasculatura19. A pesar de esta limitación, la piel ex vivo todavía proporciona una mejor recapitulación de la curación clínica que los ensayos de heridas basados en células. Los experimentos in vitro en general involucran monocapas de tipo unicelular o cocultivos cultivados en plástico de cultivo de tejidos, mientras que la piel ex vivo proporciona un entorno nativo para explorar el comportamiento celular. Más recientemente, han surgido una serie de sistemas equivalentes de piel, donde la piel se cultiva en un entorno de laboratorio a partir de matriz artificial y células aisladas de la piel20,21. Aunque estos modelos imitan la piel humana mejor que la mayoría de los enfoques in vitro, todavía no simulan completamente el entorno del tejido nativo y generalmente son demasiado frágiles para lesionarse de manera reproducible. Además, nosotros (y otros) hemos demostrado que el tejido de la piel humana ex vivo retiene las células inmunes residentes, lo que sin duda contribuirá a la reparación22,23. El trabajo futuro debe centrarse ahora en ampliar la viabilidad y la inmunocompetencia del modelo ex vivo para la evaluación de la curación en etapa tardía24. Una opción es un mayor avance de las prometedoras tecnologías de órganos en un chip capaces de prolongar la viabilidad de los tejidos y mantener la arquitectura nativa de la piel durante un período de hasta dos semanas en cultivo25. Los modelos ex vivo también han comenzado a considerar la importancia de la respuesta inflamatoria de la piel mediante la incorporación exitosa de células inmunes, como los neutrófilos, en el tejido huésped26 o la inyección de anticuerpos al tejido huésped para provocar una reacción inmune27. Esperamos que estos hallazgos allanen el camino para el desarrollo de métodos más refinados y traducibles en el futuro.
Un beneficio importante del uso de piel ex vivo para medir el cierre de la herida es la capacidad de comparar las tasas de curación en tejido sano (por ejemplo, no diabético) versus patológico (por ejemplo, diabético o envejecido). Aquí demostramos que la reepilecialización y la formación de barreras están realmente deterioradas en las heridas diabéticas versus sanas ex vivo. De hecho, esto proporciona una ruta para la evaluación preclínica de la reparación patológica, donde el envejecimiento y la diabetes son los principales factores de riesgo para desarrollar heridas crónicas1. Si bien existen modelos patológicos in vitro, como células aisladas de tejido envejecido y diabético, o células cultivadas en glucosa alta para imitar la hiperglucemia28,29, estas células pueden perder rápidamente su fenotipo una vez eliminadas del microambiente in vivo. Un componente importante del entorno de curación patológica extrínseca es la matriz dérmica, que se altera tanto en el envejecimiento como en la diabetes30. De hecho, esta matriz perturbada afecta el comportamiento de los fibroblastos residentes e ingenuos31,32. Por lo tanto, no se puede subestimar la importancia de estudiar las células en su entorno de tejido huésped.
En resumen, nuestro protocolo proporciona una plataforma importante para cuantificar la reepilefilización de heridas humanas, explorar factores reguladores y probar la validez y eficacia de posibles terapias12,13. Si bien las pruebas preclínicas aún requieren enfoques in vivo, una estrategia combinada que utilice tejido humano ex vivo y heridas murinas in vivo debería refinar la vía preclínica, reduciendo el uso de animales al tiempo que aumenta la traducibilidad entre especies.
Divulgaciones
Los autores declaran que no hay conflictos de intereses.
Agradecimientos
Nos gustaría agradecer al Sr. Paolo Matteuci y al Sr. George Smith por proporcionar tejido al paciente. También estamos agradecidos con la señorita Amber Rose Stafford por ayudar con la recolección de tejidos y el Daisy Appeal por proporcionar instalaciones de laboratorio.
Materiales
| Name | Company | Catalog Number | Comments |
| 50 mL Falcon Tubes | Falcon | 352070 | For skin washing |
| 1.5 ml TubeOne Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | For whole-mount staining |
| 48-Well CytoOne Plate, TC-Treated | Starlab | CC7682-7548 | For whole-mount staining |
| Acetic Acid Glacial | Fisher Chemical | A/0400/PB15 | Part of fixative |
| Alkyltrimethylammonium Bromide | Sigma-Aldrich | M7635 | Part of fixative |
| Anti-Alpha Smooth Muscle Actin Antibody [1A4] | Abcam | ab7817 | Stains blood vessels |
| Anti-Collagen I Antibody | Abcam | ab34710 | Stains collagen |
| Anti-Cytokeratin 14 Antibody [LL002] | Abcam | ab7800 | Stains epidermis |
| CD1A Antibody (CTB6) | Santa Cruz Biotechnology | sc-5265 | Stains Langerhans cells |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Thermo Fisher Scientific | 62247 | Counterstain for cell nuclei |
| Falcon 60mm Petri dishes | Falcon | 353004 | Human ex vivo culture |
| Fibronectin Antibody (EP5) | Santa Cruz Biotechnology | sc-8422 | Stains fibronectin |
| Formaldehyde, Extra Pure, Solution 37-41%, SLR | Fisher Chemical | F/1501/PB17 | Part of fixative |
| Gauze Swabs | Medisave | CS1650 | To clean skin |
| Gibco™ Antibiotic-Antimycotic Solution | Thermo Fisher Scientific | 15240062 | Human ex vivo culture |
| Gibco DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960044 | Human ex vivo culture |
| Gibco Fetal Bovine Serum | Thermo Fisher Scientific | 10500064 | Human ex vivo culture |
| Gibco HBSS, no calcium, no magnesium | Thermo Fisher Scientific | 14170088 | Human ex vivo culture |
| Gibco L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 | Human ex vivo culture |
| Hydrogen Peroxide | Sigma-Aldrich | H1009-100ML | For immunoperoxidase staining |
| ImageJ Software | National Institutes of Health | N/A | For image analysis |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Mouse, Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Rabbit, Alexa Fluor 594 | Thermo Fisher Scientific | A11012 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fisher Scientific | L3224 | For viability assessment of tissue |
| Iris Forceps, 10 cm, Curved, 1x2 teeth | World Precision Instruments | 15917 | To create wounds |
| Iris Scissors, 11 cm, Curved, SuperCut, Tungsten Carbide | World Precision Instruments | 501264 | To create wounds |
| Iris Scissors, 11 cm, Straight, SuperCut, Tungsten Carbide | World Precision Instruments | 501263 | To remove adipose tissue |
| Keratin 1 Polyclonal Antibody, Purified | Biolegend | 905201 | Stains epidermis |
| Keratin 14 Polyclonal Antibody, Purified | Biolegend | 905301 | Stains epidermis |
| LSM 710 Confocal Laser Scanning Microscope | Carl Zeiss | Discontinued | For fluorescent imaging |
| Merck Millipore Absorbent pads | Merck Millipore | AP10045S0 | Human ex vivo culture |
| Merck Millipore Nylon Hydrophilic Membrane Filters | Merck Millipore | HNWP04700 | Human ex vivo culture |
| Normal Goat Serum Solution | Vector Laboratories | S-1000-20 | Animal serum used depends on secondary antibody |
| Phosphate Buffer Solution | Sigma-Aldrich | P3619 | For wash buffer |
| Sodium Azide | Sigma-Aldrich | S2002 | For blocking buffer |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | Part of fixative |
| Sterilisation Pouches | Medisave | SH3710 | To sterilise instruments |
| Stiefel 2mm biopsy punches | Medisave | BI0500 | For partial thickness wound |
| Stiefel 6mm biopsy punches | Medisave | BI2000 | For outer explant |
| Thermo Scientific Sterilin Standard 90mm Petri Dishes | Thermo Fisher Scientific | 101VR20 | To prepare skin |
| Triton X-100 | Fisher Chemical | T/3751/08 | For wash buffer |
| VECTASTAIN Elite ABC-HRP Kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-6101 | For immunoperoxidase staining; HRP kit used depends on primary antibody |
| Vector NovaRED Substrate Kit, Peroxidase (HRP) | Vector Laboratories | SK-4800 | For immunoperoxidase staining |
| Wireless Digital Microscope | Jiusion | N/A | For brightfield imaging |
Referencias
- Lindholm, C., Searle, R. Wound management for the 21st century: combining effectiveness and efficiency. International Wound Journal. 13, 5-15 (2016).
- Guest, J. F., et al. Health economic burden that different wound types impose on the UK's National Health Service. International Wound Journal. 14 (2), 322-330 (2017).
- Guest, J. F., Fuller, G. W., Vowden, P. Diabetic foot ulcer management in clinical practice in the UK: costs and outcomes. International Wound Journal. 15 (1), 43-52 (2018).
- López-Valverde, M. E., et al. Perioperative and long-term all-cause mortality in patients with diabetes who underwent a lower extremity amputation. Diabetes Research and Clinical Practice. 141, 175-180 (2018).
- Wilkinson, H. N., Hardman, M. J. The role of estrogen in cutaneous ageing and repair. Maturitas. 103, 60-64 (2017).
- Frykberg, R. G., Banks, J. Challenges in the treatment of chronic wounds. Advances in Wound Care. 4 (9), 560-582 (2015).
- Wilkinson, H. N., Hardman, M. J. Wound healing: cellular mechanisms and pathological outcomes. Open Biology. 10 (9), 200223 (2020).
- Ansell, D. M., Holden, K. A., Hardman, M. J. Animal models of wound repair: Are they cutting it. Experimental Dermatology. 21 (8), 581-585 (2012).
- Elliot, S., Wikramanayake, T. C., Jozic, I., Tomic-Canic, M. A modeling conundrum: murine models for cutaneous wound healing. Journal of Investigative Dermatology. 138 (4), 736-740 (2018).
- Mazio, C., et al. Pre-vascularized dermis model for fast and functional anastomosis with host vasculature. Biomaterials. 192, 159-170 (2019).
- Wilkinson, H. N., Iveson, S., Catherall, P., Hardman, M. J. A novel silver bioactive glass elicits antimicrobial efficacy against Pseudomonas aeruginosa and Staphylococcus aureus in an ex vivo skin wound biofilm model. Frontiers in Microbiology. 9, 1450 (2018).
- Wilkinson, H. N., et al. Elevated local senescence in diabetic wound healing is linked to pathological repair via CXCR2. Journal of Investigative Dermatology. 139 (5), 1171-1181 (2019).
- Wilkinson, H. N., et al. Tissue iron promotes wound repair via M2 macrophage polarization and the chemokine (CC motif) ligands 17 and 22. The American Journal of Pathology. 189 (11), 2196-2208 (2019).
- Rhea, L., Dunnwald, M. Murine excisional wound healing model and histological morphometric wound analysis. Journal of Visualized Experiments. 162, e61616 (2020).
- Ansell, D. M., Campbell, L., Thomason, H. A., Brass, A., Hardman, M. J. A statistical analysis of murine incisional and excisional acute wound models. Wound Repair and Regeneration. 22 (2), 281-287 (2014).
- Rizzo, A. E., Beckett, L. A., Baier, B. S., Isseroff, R. R. The linear excisional wound: an improved model for human ex vivo wound epithelialization studies. Skin Research and Technology. 18 (1), 125-132 (2012).
- Olsson, M., et al. The humanistic and economic burden of chronic wounds: a systematic review. Wound Repair and Regeneration. 27 (1), 114-125 (2019).
- Mendoza-Garcia, J., Sebastian, A., Alonso-Rasgado, T., Bayat, A. Optimization of an ex vivo wound healing model in the adult human skin: Functional evaluation using photodynamic therapy. Wound Repair and Regeneration. 23 (5), 685-702 (2015).
- Brownhill, V. R., et al. Pre-clinical assessment of single-use negative pressure wound therapy during in vivo porcine wound healing. Advances in Wound Care. , (2020).
- Diekmann, J., et al. A three-dimensional skin equivalent reflecting some aspects of in vivo aged skin. Experimental Dermatology. 25 (1), 56-61 (2016).
- Vidal Yucha, S. E., Tamamoto, K. A., Nguyen, H., Cairns, D. M., Kaplan, D. L. Human skin equivalents demonstrate need for neuro-immuno-cutaneous system. Advanced Biosystems. 3 (1), 1800283 (2019).
- Dijkgraaf, F. E., et al. Tissue patrol by resident memory CD8+ T cells in human skin. Nature Immunology. 20 (6), 756-764 (2019).
- He, X., de Oliveira, V. L., Keijsers, R., Joosten, I., Koenen, H. J. Lymphocyte isolation from human skin for phenotypic analysis and ex vivo cell culture. Journal of Visualized Experiments. (110), e52564 (2016).
- Pupovac, A., et al. Toward immunocompetent 3D skin models. Advanced Healthcare Materials. 7 (12), 1701405 (2018).
- Ataç, B., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Kim, J. J., et al. A microscale, full-thickness, human skin on a chip assay simulating neutrophil responses to skin infection and antibiotic treatments. Lab on a Chip. 19 (18), 3094-3103 (2019).
- Jardet, C., et al. Development and characterization of a human Th17-driven ex vivo skin inflammation model. Experimental Dermatology. 29 (10), 993-1003 (2020).
- Chen, J. L., et al. Metformin attenuates diabetes-induced tau hyperphosphorylation in vitro and in vivo by enhancing autophagic clearance. Experimental Neurology. 311, 44-56 (2019).
- Demirovic, D., Rattan, S. I. Curcumin induces stress response and hormetically modulates wound healing ability of human skin fibroblasts undergoing ageing in vitro. Biogerontology. 12 (5), 437-444 (2011).
- Wilkinson, H. N., Hardman, M. J. Wound senescence: A functional link between diabetes and ageing. Experimental Dermatology. 30 (1), 68-73 (2020).
- Fisher, G. J., et al. Collagen fragmentation promotes oxidative stress and elevates matrix metalloproteinase-1 in fibroblasts in aged human skin. The American Journal of Pathology. 174 (1), 101-114 (2009).
- Quan, T., Little, E., Quan, H., Voorhees, J. J., Fisher, G. J. Elevated matrix metalloproteinases and collagen fragmentation in photodamaged human skin: impact of altered extracellular matrix microenvironment on dermal fibroblast function. Journal of Investigative Dermatology. 133 (5), 1362 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados