Method Article
Modelo de ferida ex vivo humana e abordagem de coloração de montagem inteira para avaliar com precisão o reparo da pele
Neste Artigo
Resumo
Aqui demonstramos uma técnica otimizada para avaliar o reparo da ferida usando a pele humana ex vivo combinada com uma abordagem de coloração de montagem inteira. Essa metodologia fornece uma plataforma pré-clínica para avaliação de potenciais terapias de feridas.
Resumo
As feridas crônicas não curativas, que afetam principalmente idosos e diabéticos, são uma área significativa de necessidade clínica não atendida. Infelizmente, os tratamentos atuais de feridas crônicas são inadequados, enquanto os modelos pré-clínicos disponíveis prevêem mal a eficácia clínica de novas terapias. Aqui descrevemos um modelo pré-clínico de alta produtividade para avaliar múltiplos aspectos da resposta de reparação da pele humana. Feridas de espessura parcial foram criadas na pele ex vivo humana e cultivadas em um curso de tempo de cura. Biópsias de feridas de pele foram coletadas em fixação para o procedimento de coloração de todo o montagem. As amostras fixas foram bloqueadas e incubadas em anticorpos primários, com detecção obtida por anticorpo secundário conjugado fluorescentemente. As feridas foram contra-manchadas e imagens via microscopia confocal antes de calcular o fechamento percentual da ferida (re-epitelialização) em cada biópsia. Aplicando este protocolo, revelamos que 2 mm de feridas excisionais criadas na pele saudável do doador são totalmente re-epitelializadas até o dia 4-5 pós-ferida. Pelo contrário, as taxas de fechamento de feridas de pele diabéticas são significativamente reduzidas, acompanhadas de reforma de barreira perturbada. A combinação do ferimento da pele humana com uma nova abordagem de coloração de montagem total permite um método rápido e reprodutível para quantificar o reparo da ferida ex vivo. Coletivamente, este protocolo fornece uma valiosa plataforma humana para avaliar a eficácia de potenciais terapias de feridas, transformando testes pré-clínicos e validação.
Introdução
As feridas crônicas e não curativas, altamente prevalentes em idosos e diabéticos, são uma área não apreciada de necessidade clínica não atendida. Essas feridas representam uma grande carga física e psicológica para os pacientes e custam bilhões aos prestadores de cuidados de saúde a cada ano para tratar1. Apesar da melhor compreensão da biologia das feridas e dos avanços tecnológicos, até 40% das feridas crônicas ainda não conseguem cicatrizar após o melhor cuidado padrão2. Assim, 14-26% dos pacientes com úlceras diabéticas no pé requerem posteriormente amputação3, enquanto a taxa de mortalidade pós-amputação de 5 anos é de aproximadamente 70%4. Como resultado, há uma exigência urgente de desenvolver novas terapias eficazes para melhorar a qualidade de vida do paciente, reduzindo a carga substancial de saúde imposta por feridas de cura ruins. Modelos pré-clínicos pouco preditivos continuam a ser um obstáculo significativo para o desenvolvimento de novas terapias eficazes.
O reparo de feridas é um processo dinâmico e multifacetado que envolve uma gama diversificada de tipos celulares, inúmeros níveis de comunicação e um ambiente tecidual que é temporariamente remodelado. A cicatrização da pele é sustentada por quatro grandes estágios reparados: hemostasia, inflamação, proliferação e remodelação matricial. Esses estágios, em última análise, atuam para prevenir a perda de sangue e a infecção, fechar a superfície da ferida (um processo chamado de re-epitelialização) e devolver a pele a um estado ileso5. As feridas crônicas estão associadas à etiologia diversificada e à perturbação generalizada aos processos de cura6,complicando ainda mais a identificação de alvos terapêuticos. No entanto, uma ampla gama de modelos foram desenvolvidos para elucidar os condutores moleculares e celulares da patologia da ferida e testar novas abordagens terapêuticas7.
O modelo de reparo de ferida mais usado é o ferimento agudo no rato. Os camundongos são altamente tratáveis para estudos mecanicistas e fornecem modelos validados de envelhecimento e diabetes8. Apesar das semelhanças gerais mostradas entre a cura do camundongo e do ser humano, as diferenças entre as espécies na estrutura da pele e na dinâmica de cura permanecem. Isso significa que a maioria das pesquisas de ferida murina não se traduz facilmente para a clínica9. Consequentemente, houve um impulso para sistemas humanos in vitro e ex vivo com alta aplicabilidade e tradução10,11.
Aqui fornecemos um protocolo aprofundado para a realização de feridas excisionais de espessura parcial na pele humana ex vivo. Também descrevemos nossa abordagem de coloração de montagem inteira como um método altamente reprodutível de avaliação da cicatrização da pele humana ex vivo. Mostramos a trajetória de reparação epidérmica (re-epitelialização) e posterior formação de barreiras, avaliando a taxa de fechamento de feridas em pele humana saudável versus diabética. Finalmente, demonstramos como a coloração de montagem inteira pode ser adaptada para uso com uma gama de anticorpos para avaliar vários aspectos da resposta à cura.
Protocolo
A pele humana foi obtida de pacientes submetidos a cirurgia reconstrutiva no Hospital Castle Hill e na Enfermaria Real de Hull (Hull, Reino Unido) sob total consentimento informado, por escrito do paciente, diretrizes institucionais e aprovação ética (LRECs: 17/SC/0220 e 19/NE/0150). A pele não diabética foi coletada de pacientes submetidos à cirurgia de rotina (idade média = 68). A pele diabética foi selecionada entre doadores que estabeleceram diabetes tipo II e histórico de ulceração (idade média = 81). Amostras da cirurgia foram transportadas em meios de comunicação e processadas imediatamente após a chegada ao laboratório. Todas as etapas experimentais utilizando tecido humano não fixado foram realizadas no Nível 2 (BSL-2) em um gabinete de biossegurança de fluxo laminar classe II.
1. Preparação de mídia de cultura de pele e reagentes de coloração
NOTA: Todos os detalhes reagentes e consumíveis são fornecidos na Tabela de Materiais. Certifique-se de que todos os reagentes e equipamentos utilizados para o processamento e cultura do tecido humano são estéreis. Esterilizar instrumentos antes do uso e descontaminar com desinfetante após contato com o tecido. Descontaminar resíduos em 1% de desinfetante antes do descarte.
- Segurando a mídia: Suplemente alta glicose Dulbecco's Modified Eagle Medium (DMEM) com 2 mM L-glutamina e 4% (v/v) solução antimicomolética antibiótico.
- Solução de sal balanceada da Hank (HBSS) com antibióticos: Adicione 4% (v/v) solução antimicomótica antibiótico ao HBSS. Armazene a 4 °C até o uso.
- Linha salina tamponada de fosfato de Dulbecco (DPBS): Prepare DPBS dissolvendo 9,6 g de pó DPBS por litro de água destilada (dH2O). Autoclave para esterilizar e armazenar a 4 °C até usar.
- Mídia de crescimento da pele humana: Suplementa DMEM de alta glicose com 2 mM L-glutamina, 1% (v/v) solução antimíctica antibiótico e 10% (v/v) soro bovino fetal. Armazene a 4 °C até o uso.
- Fixação da pele: A 450 mL de dH2O, adicione 40 mL de solução de formaldeído, 10 mL de ácido acético glacial, 4,5 g de cloreto de sódio e 0,25 g de brometo de alquilrimtilamônio. Armazene em temperatura ambiente (RT) e use dentro de alguns dias.
ATENÇÃO: Fixação é perigoso (irritante e inflamável). Manuseie com cuidado e descarte através de uma rota apropriada. - Salina tamponada fosfato (PBS): Prepare o PBS para coloração de montagem integral adicionando 6 g de cloreto de sódio a 100 mL de solução tampão fosfato e 900 mL de dH2O.
- Tampão de lavagem de manchas: Dissolver 0,5% (v/v) Triton X-100 em PBS.
- Tampão de bloqueio: Adicione 0,2% (p/v) azida de sódio e 2% (v/v) soro animal ao tampão de lavagem de manchas. Armazene a 4 °C por até duas semanas.
NOTA: Bloqueie o soro da espécie hospedeira de anticorpos secundários. A azida de sódio evitará o crescimento bacteriano durante a incubação. - Solução de trabalho DAPI: Prepare um estoque de 5 mg/mL de 4′,6-diamidino-2-fenilôdole (DAPI) em sulfóxido de dimetil. Diluir o estoque 1:1.000 no buffer de lavagem de manchas para dar uma solução de trabalho DAPI de 5 μg/mL.
- Bloco peroxidase: Adicione peróxido de hidrogênio de 0,3% (v/v) ao tampão de lavagem de manchas. Armazene a 4 °C até o uso. Mantenha-se no escuro para evitar a decomposição.
- Kit ABC-HRP:
- Anticorpo secundário conjugado pelo HRP: 1 gota de coelhinho biotiningado anti-cabra IgG em 5 mL de tampão de coloração. Armazene a 4 °C por até duas semanas.
NOTA: O kit/secundário utilizado dependerá da espécie hospedeira do anticorpo primário. - Reagente do Complexo Avidin-biotina (ABC): 2 gotas de reagente A e 2 gotas de reagente B em 5 mL de tampão de lavagem de manchas. O reagente ABC deve ser preparado pelo menos 30 minutos antes do uso. Armazene a 4 °C por até duas semanas.
- Anticorpo secundário conjugado pelo HRP: 1 gota de coelhinho biotiningado anti-cabra IgG em 5 mL de tampão de coloração. Armazene a 4 °C por até duas semanas.
- Substrato peroxidase: 3 gotas de reagente 1, 2 gotas de reagente 2, 2 gotas de reagente 3 e 2 gotas de peróxido de hidrogênio em 5 mL de dH2O. O substrato peroxidase deve ser preparado imediatamente antes do uso e não pode ser armazenado.
2. Preparação da pele para ferimentos
NOTA: Estas etapas devem ser executadas em um gabinete de biossegurança de fluxo laminar classe II.
- Colete a pele na retenção de mídia e transporte para o gabinete BSL-2.
- Coloque o lado da dermis da pele para baixo dentro de uma placa de Petri estéril de 90 mm e remova tecido adiposo com uma tesoura estéril.
- Coloque a pele em um tubo de 50 mL contendo 25 mL de HBSS com antibióticos por 10 minutos na RT. Agite intermitentemente para remover qualquer sangue residual e tecido adiposo.
- Repita o passo 2.3 usando um novo tubo de 50 mL.
- Coloque a pele em um tubo fresco de 50 mL contendo 25 mL de HBSS, desta vez sem antibióticos por 10 min no RT. Shake como na etapa 2.3.
- Realize uma lavagem final da pele colocando a pele em um novo tubo com 25 mL de DPBS. A pele está pronta para ferir.
3. Criando feridas de pele humana ex vivo
NOTA: Estas etapas devem ser executadas em um gabinete de biossegurança de fluxo laminar classe II.
- Prepare os pratos da cultura da pele antes de ferir. Em uma placa de Petri de 60 mm, empilhe duas almofadas absorventes estéreis e adicione 4 mL de mídia de pele humana através do lado do prato. Coloque uma membrana de filtro de nylon estéril na pilha de almofadas absorventes.
NOTA: A mídia da pele pode ser alterada dependendo das condições de tratamento necessárias. Até três explantas de feridas podem ser cultivadas em cada pilha. - Seque o lado dérmico da pele em gaze estéril em uma placa de Petri de 90 mm para remover DPBS residuais.
NOTA: Isso evita que a pele deslize ao redor ao ferir. - Coloque o lado da derme da pele para baixo em uma tampa de placa de Petri limpa de 90 mm e dab a epiderme seca com gaze fresca estéril.
NOTA: É mais fácil ferir a pele em uma tampa de placa de Petri do que a base. O trabalho subsequente deve ser realizado rapidamente para evitar que a pele seque. - Segurando a pele esticada, pressione um soco de biópsia de 2 mm contra a pele e torça suavemente. Não soque inteiramente pela pele.
NOTA: As feridas parciais de espessura são projetadas para perfurar a epiderme e parcialmente na derme. Pode haver variabilidade de doador para doador e local-a-local na força necessária para criar a ferida de espessura parcial. - Use fórceps de tecido dentulho curvo para pegar cada lado da ferida de 2 mm e enganchar a tesoura de íris curva sob a ferida de 2 mm para cortá-la uniformemente.
- Biópsia ao redor da ferida central de 2 mm usando um soco de biópsia de 6 mm para criar uma explanta de 6 mm com uma ferida parcial de 2 mm de espessura no centro.
NOTA: Um soco de biópsia de 6 mm pode ser usado para marcar a pele para marcar onde cada ferida de 2 mm deve estar. Tome cuidado para não perfurar o tecido completamente. Crie explants de feridas em um padrão de favo de mel para reduzir o desperdício. - Coloque explants de epiderme de ferida lado acima na pilha de membrana do filtro de nylon (preparado na etapa 3.1).
NOTA: Ao manusear explantes de feridas, tenha cuidado para não danificar a ferida central. Use pequenos fórceps e pegue cada explanta em lados opostos. - Incubar feridas a 32-37 °C e 5% de CO2 em uma atmosfera umidificada (90-95%) durante 1-7 dias. Substitua a mídia a cada 2-3 dias.
4. Coloração completa de feridas ex vivo
NOTA: Esta seção descreve os métodos de coloração de imunofluorescência e imunoperoxidase. Misture bem todos os reagentes antes de usar.
- Método de coloração fluorescente
- Coletar explanações de feridas em tubos de microcentrifus de 1,5 mL contendo 500 μL de fixação da pele e incubar a 4 °C durante a noite.
NOTA: O fixador utilizado neste protocolo funciona bem para os anticorpos descritos. A otimização será necessária para outros anticorpos. A fixação do tecido acima de 24 h pode levar à super-fixação. - No dia seguinte, remova o fixador e substitua por 1 mL de tampão de lavagem de manchas. As biópsias podem ser armazenadas em tampão de lavagem de manchas a 4 °C até 2 semanas antes da coloração.
NOTA: Para todas as etapas de tampão de lavagem, use uma pipeta sorológica ou ponta de pipeta, tomando cuidado para não danificar a ferida. - Aspire o tampão de lavagem de manchas e realize mais uma lavagem com 1 mL de tampão de lavagem de manchas.
- Calcule a quantidade de tampão de bloqueio necessária para as etapas 4.1.5-4.1.6 (número de amostras x 300 μL = quantidade de tampão de bloqueio em μL). Faça um buffer extra, se necessário.
- Adicione 150 μL de tampão de bloqueio a cada amostra e incubar por 1 h no RT. Para todas as etapas de coloração, certifique-se de que cada amostra esteja suficientemente coberta e que não haja bolhas cobrindo a superfície da ferida da biópsia.
NOTA: Este passo em diante pode ser realizado em tubos de microcentrifuuge de 1,5 mL ou em uma placa de 48 poços. Se usar uma placa de 48 poços, incubar as feridas de frente para baixo em cada poço. - Diluir o anticorpo primário no buffer de bloqueio restante.
NOTA: A queratina anti-rato 14 (K14) diluída 1:1.000 no buffer de bloqueio funciona bem. Otimize esta etapa para uso com outros anticorpos ou sondas múltiplas. - Aspire o tampão de bloqueio e adicione 150 μL de anticorpo primário por tubo de bem/microcentrifuuge. Incubar explantas de ferida em anticorpo primário a 4 °C durante a noite.
- No dia seguinte, aspire o anticorpo primário e enxágue no tampão de lavagem de manchas contendo 0,2% de azida de sódio por 1 h a RT (500 μL por amostra).
- Realize mais três etapas de lavagem usando tampão de lavagem de manchas (30 minutos por lavagem, 500 μL por amostra).
- Diluir o anticorpo secundário fluorescente conjugado no tampão de lavagem de manchas (por exemplo, anti-rato de cabra 488 às 1:400 diluição).
- Calcule a quantidade necessária de anticorpo secundário (número de amostras x 150 μL = quantidade em μL).
- Adicione 150 μL de anticorpo secundário a cada tubo de bem/microcentrífuga. Incubar por 1h na RT. Realize as etapas de incubação 4.1.10 - 4.1.16 no escuro, pois o anticorpo secundário é sensível à luz.
NOTA: Esta etapa pode ser realizada a 4 °C durante a noite, se necessário. Otimize a concentração de anticorpos secundários necessários para o sinal adequado e a coloração de fundo limitada. - Remova o anticorpo secundário e realize enxaguas de 3 x 30 minutos com tampão de lavagem de manchas (500 μL por amostra).
- Descarte o tampão de lavagem restante e calcule a quantidade de solução de trabalho DAPI necessária (conforme a etapa 4.1.11).
- Contratente cada explant com 150 μL de solução de trabalho DAPI por 10 min no RT.
NOTA: O DAPI manchará os núcleos celulares em azul. O corante hoechst pode ser usado como uma alternativa ao DAPI. - Realize duas lavagens finais de 30 min com tampão de lavagem de manchas (500 μL por amostra). As biópsias podem ser armazenadas no tampão de lavagem de manchas a 4 °C no escuro até duas semanas antes da imagem.
- Coletar explanações de feridas em tubos de microcentrifus de 1,5 mL contendo 500 μL de fixação da pele e incubar a 4 °C durante a noite.
- Método de coloração de Brightfield.
- Realizar etapas 4.1.1 - 4.1.3.
- Saciar atividade peroxidase endógena com bloco peroxidase a 4 °C durante a noite.
NOTA: Esta etapa é importante ao usar um anticorpo conjugado com HRP para reduzir a coloração de fundo não específica do tecido. Tecido altamente vascularizado conterá mais atividade peroxidase endógena. - Descarte o bloco de peroxidase e enxágue duas vezes por 30 minutos no tampão de lavagem de manchas.
- Realizar etapas 4.1.4 - 4.1.8.
NOTA: As lavagens após a etapa 4.1.7 são particularmente importantes para remover a azida de sódio das amostras. Se o azida de sódio não for removido adequadamente, ele inativará o HRP e interferirá na detecção de manchas. - Adicione 150 anticorpos secundários conjugados por HRP a cada tubo de bem/microcentrifuuus e incubar durante a noite a 4 °C ou 1 h no RT.
- Remova o anticorpo secundário e realize lavagens de 3 x 30 min no tampão de lavagem de manchas.
- Adicione 150 reagentes μL ABC a cada tubo de bem/microcentrifus de microcentragem e incubar durante a noite a 4 °C ou 1 hora no RT.
- Aspire o reagente ABC e realize lavagens de 3 x 30 min no tampão de lavagem de manchas.
- Adicione 150 μL de substrato peroxidase a uma explanta e determine o tempo necessário para detectar uma alteração de cor perceptível.
NOTA: Escolha uma amostra onde seja esperada uma coloração forte. Neste caso, um anel vermelho para mostrar a epiderme migratória (K14). 3,3'-diaminobenzidina-4, ou qualquer outro substrato cromogênico apropriado, pode ser usado como substituto para este substrato peroxidase. - Uma vez observada uma mudança de cor, remova o substrato de peroxidase e substitua por 1 mL de dH2O.
- Repita a detecção de substrato de peroxidase para as outras explantas, incubando pelo tempo determinado na etapa 4.2.11.
- Enxágüe todas as explanações com 1 mL de dH2O para remover o substrato residual de peroxidase. Embora as explanações possam ser armazenadas até uma semana a 4 °C antes da imagem, é melhor imagnê-las o mais rápido possível para evitar o lixiviação do substrato peroxidase no dH2O ao longo do tempo.
5. Imagem e quantificação
- Imagem fluorescente
NOTA: A imagem fluorescente é realizada usando um microscópio de varredura a laser confocal. No entanto, um microscópio fluorescente invertido pode ser suficiente para adquirir imagens 2D para quantificar as taxas de fechamento de feridas. Ao selecionar anticorpos secundários, certifique-se de que os fluorochromes escolhidos são compatíveis com os espectros de excitação e emissão do equipamento de microscopia disponível.- Use um microscópio de varredura a laser confocal equipado com um objetivo de 2,5x, 10x e 20x, estágio motorizado x-y-z, câmera digital e software de aquisição. Ligue o detector de luz transmitido (TPMT) para permitir uma visualização fácil de cada biópsia e para permitir a medição do fechamento total da ferida. Alternativamente, meça cada ferida através de microscopia de campo brilhante após a imagem de fluorescência.
- Coloque uma base de placa de Petri de 60 mm na plataforma de imagem e adicione uma camada fina (cerca de 1 mL) de DPBS.
NOTA: Se for usado muito DPBS, a biópsia se moverá durante a imagem. Alternativamente, use uma placa de 48 poços se um suporte de placa estiver disponível. - Use pequenos fórceps de tecido para transferir explanações de feridas de tubos de poços/microcentrifus de microcentragem para a placa de Petri contendo DPBS. Coloque a parte da biópsia no lado da placa de Petri.
- Use a ocular e a lâmpada fluorescente para localizar e focar na ferida. Se as bolhas estiverem presas sob a amostra no campo de visão, pegue a ferida com fórceps teciduais e reposicione.
- Configure o software de imagem, garantindo o tamanho igual do pinhole entre os canais para uma confocalidade ideal. Para isso, verifique o valor de uma unidade arejada para cada canal e selecione o maior valor. Selecione velocidade de varredura, qualidade da imagem e média.
NOTA: Os fluorochromes dos anticorpos secundários conjugados e da contra-mancha escolhida (por exemplo, DAPI) ditarão os canais necessários. - Ligue o software de aquisição ao vivo e ajuste a potência do laser e o ganho de cada canal para os níveis necessários para visualizar a coloração. Reduza o ruído de fundo aumentando o deslocamento digital.
- Posicione a ferida no centro do plano de imagem.
NOTA: Se a ferida não preencher toda a imagem devido ao uso de um objetivo menor ou à criação de uma ferida maior, pegue um painel de imagens e costure-as juntas (manualmente ou com uma função de revestimento no software de imagem relevante). - Adquira imagens das biópsias da ferida. Use as mesmas configurações de imagem entre explantas.
NOTA: Imagens de maior potência permitirão a avaliação das estruturas teciduais e da expressão e localização do marcador celular. - Colete pilhas Z em série através da ferida, especialmente onde o tecido não é completamente plano contra a placa de Petri. Use o software de análise para colapsar a pilha Z em uma única imagem de projeção de intensidade máxima.
- Imagens de Brightfield
NOTA: Imagens brilhantes de biópsias manchadas de imunoperoxidase podem ser realizadas de várias maneiras.- Imagens de microscópio invertido: Prepare explants de ferida para imagens colocando-as em uma placa de Petri/bem como descritas nas etapas 5.1.2-5.1.3. Adquira imagens digitais sob iluminação brightfield em um microscópio invertido equipado com uma câmera digital. A stitche várias imagens, se necessário.
- Imagem de microscópio digital sem fio: Use um microscópio digital sem fio conectado a um telefone ou laptop para obter imagens de alta qualidade de forma econômica. Coloque as explantas laterais para cima em algum tecido e remova qualquer dHresidual 2O (ou tampão de lavagem de manchas) do armazenamento da amostra. Posicione a explanta da ferida no centro do campo de visão do microscópio. Adquira imagens usando a câmera conectada.
- Quantificação
NOTA: O fechamento percentual da ferida pode ser quantificado em qualquer software que permita que formas à mão livre sejam desenhadas e medidas. ImageJ pode ser usado para realizar quantificação da seguinte forma:- Abra a imagem a ser quantificada no software ImageJ.
- Use a ferramenta de forma à mão livre para desenhar ao redor do lado de fora da ferida re-epitelializada onde ela encontra a pele normal. Pressione M (ou Analise | Medida) para adquirir uma medição de área 'externa'.
NOTA: A textura do tecido da ferida re-epitelializada difere da pele normal. As imagens não precisam ser dimensionadas antes desse tipo de análise. - Use a ferramenta de forma à mão livre para desenhar ao redor da área de ferida aberta. É aqui que a ferida aberta encontra a borda interna do tecido re-epitelializado. Pressione M (ou Analise | Medida) para adquirir uma medição de área 'interna'.
- Use a seguinte equação para deduzir a ree epitelialização/fechamento da ferida percentual:
% Fechamento = (Área da Ferida Externa - Área interna da ferida) / (Área externa da ferida) x 100
NOTA: A cobertura percentual da área dos anticorpos pode ser deduzida da mesma forma (por exemplo, K14) ou como uma porcentagem da área total da ferida. A intensidade percentual também pode fornecer informações semi-quantitativas sobre a expressão do nível tecidual de marcadores de interesse, enquanto a imagem de alta potência apresenta dados de expressão no nível celular.
Resultados
Neste relatório, apresentamos uma nova abordagem de feridas de pele ex vivo e coloração de todo o nível para avaliar fatores que influenciam a resposta ao reparo da pele humana. A Figura 1A mostra um esquema do gasoduto processual, que pode ser realizado em 3-10 dias, dependendo dos tempos de incubação da ferida. As feridas de espessura parcial são cultivadas em pilhas de membrana no ar : interface de membrana e podem ser coletadas para coloração de montagem integral, embutidas em parafina ou meio OCT para histologia geral, ou congeladas em nitrogênio líquido para análise bioquímica(Figura 1B). Geralmente criamos feridas de espessura parcial de 2 mm no centro de explants de 6 mm. No entanto, o tamanho da ferida e explanta circundante pode ser alterado dependendo dos requisitos. O procedimento de montagem total foi adaptado com sucesso para os métodos de coloração de imunoperoxidase e imunofluorescência(Figura 1C).
A imunofluorescência permite a sondagem de tecido com múltiplos anticorpos. Para isso, aconselhamos o uso de anticorpos primários criados em diferentes espécies, e anticorpos secundários fluorescentes com correspondência de espécies para limitar a reatividade entre espécies. As concentrações de anticorpos e os tempos de incubação precisarão ser otimizados. Se for observada a coloração de fundo, reduza as concentrações de anticorpos, aumente as etapas de lavagem e adicione o tampão de bloqueio ao anticorpo secundário. A viabilidade do tecido fresco pode ser avaliada diretamente com corantes de viabilidade comercial (ver Tabela de Materiais). Também mostramos que o tecido pode ser corrigido após a coloração de viabilidade e com sucesso quando é praticamente adequado(Figura 1D).
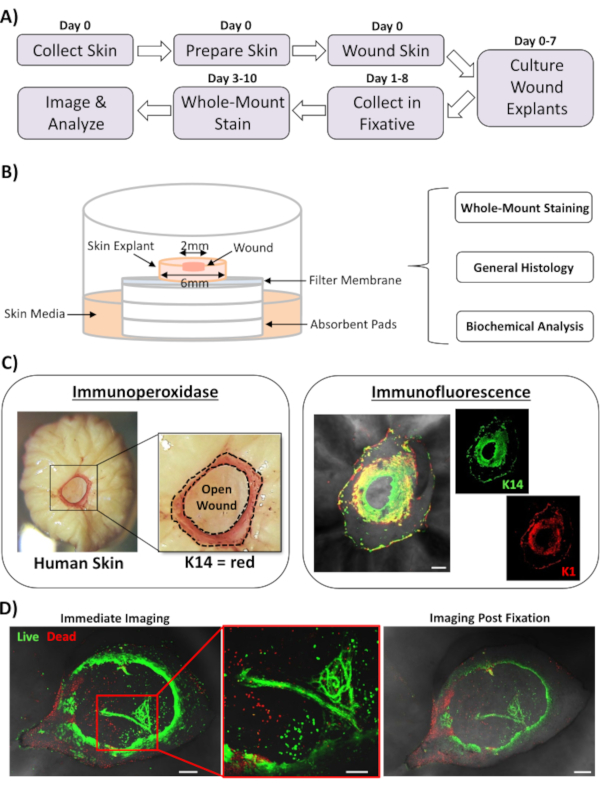
Figura 1: A abordagem de coloração ex vivo humana e a abordagem de coloração de todo o montagem. (A) Pipeline que retrata o fluxo de trabalho processual desde a coleta da pele e a realização de ferimentos ex vivo, até a coloração do tecido e análise de dados. (B) Diagrama demonstrando o sistema de cultura de feridas de pele ex vivo humana com análises realizadas rotineiramente no tecido. (C) A coloração total pode ser empregada utilizando técnicas de imunoperoxidase e imunofluorescência. K14 = queratina 14. (D) O tecido vivo pode ser manchado com corantes de viabilidade comercial e imageado com sucesso pós fixação. Barra = 100 μm. Esta coloração foi realizada em pele não diabética. Clique aqui para ver uma versão maior desta figura.
O uso mais amplamente aplicável para coloração de feridas de montagem total é determinar a taxa de fechamento da ferida de forma mais reprodutível do que pode ser fornecido através de seção histológica. O fechamento percentual foi quantificado como re-epitelialização percentual da superfície da ferida, conforme demonstrado na Figura 2A. A cobertura percentual da área de marcadores específicos pode ser medida a partir da área total da ferida ou como uma porcentagem da ferida re-epitelializada. Caracterizamos a cicatrização em pele saudável (não diabética) versus diabética em um período de sete dias, coletando feridas a cada dia após o ferimento (imagens representativas, Figura 2B). Feridas de pele saudáveis fechadas ao longo do tempo, como esperado, com fechamento total observado na maioria das amostras até o dia 4-5. Pelo contrário, as feridas de pele diabética não conseguiram fechar totalmente dentro do período de análise de sete dias(Figura 2C). Observou-se um atraso significativo no fechamento da ferida entre feridas de pele saudáveis e diabéticas ao comparar as taxas de cicatrização em cada ponto de tempo pós-lesão (P < 0,001 ao dia 6, P < 0,05 no dia 6 e P < 0,05 a P < 0,001 no dia 7).
Após avaliação das taxas globais de fechamento de feridas; medimos a porcentagem de toda a área da ferida (área externa na Figura 2A) onde células positivas de K14 poderiam ser visualizadas (coloração verde na Figura 2B). Curiosamente, observamos que em feridas saudáveis da pele ex vivo, a coloração do K14 atingiu o pico no dia 2 e, em seguida, rapidamente diminuiu (significância em cada ponto de tempo versus o pico do dia 2, Figura 2D). Isso provavelmente reflete a re-formação da barreira epidérmica inicial, excluindo a penetração de anticorpos K14 através de camadas epidérmicas diferenciadas (ver Esquema da Figura 2E). Durante o processo de re-epitelialização, os queratinócitos de camada basal (K14+ve) migram para dentro sobre a ferida aberta de modo que a epiderme se for mais próxima da borda da ferida externa se forma mais cedo do que a epiderme mais próxima da borda interna da ferida (frente migratória). Enquanto a borda frontal da epiderme recém-formada continua a migrar para fechar a ferida aberta restante, a epiderme da borda externa começa a se diferenciar para reformar as outras camadas epidérmicas. Na cura precoce, esperamos, assim, ver que a maior parte da área re-epitelializada consiste em células basais (K14+ve), enquanto em posterior reparo a coloração do K14 é perdida à medida que a epiderme se diferencia do interior externo (ver imagens de montagem total na Figura 2E). Portanto, o declínio das manchas de K14 mostradas na Figura 2D (setas descendentes) correlaciona-se com o aumento da diferenciação epidérmica. Curiosamente, as manchas visíveis de K14 atingiram o pico mais cedo em feridas saudáveis (dia 2) versus diabéticas (dia 4), demonstrando ainda que a ree epitelialização e a subsequente diferenciação epidérmica são em feridas de pele diabéticas.
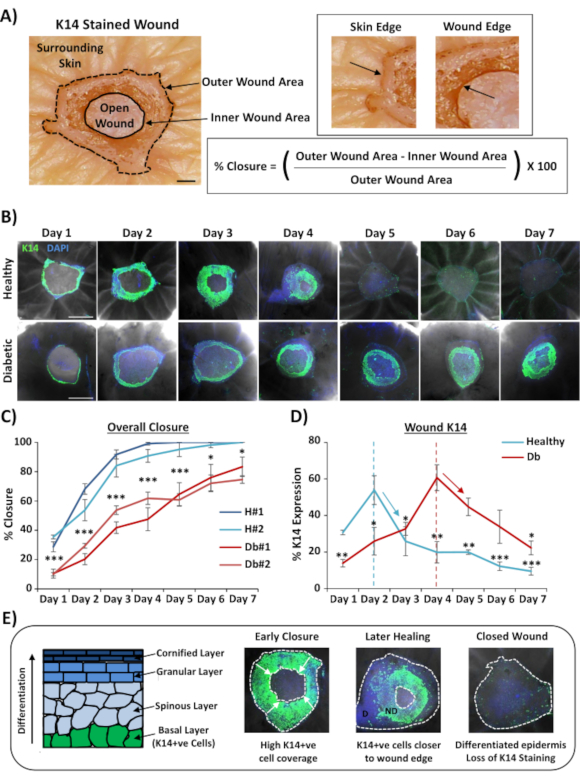
Figura 2: A coloração de montagem total revela taxas de cicatrização perturbadas em pele diabética versus saudável. (A) O método utilizado para quantificar o fechamento da ferida a partir de medidas externas e internas da ferida. Imagens de Brightfield mostram a queratina 14 (K14) manchando em vermelho. Barra = 300 μm. (B) Imagens representativas de cura ao longo do tempo (pós-ferida diária) em pele saudável e diabética. Barra = 500 μm. K14 = verde. DAPI = núcleos azuis. (C) Quantificação das taxas de fechamento de feridas (re-epitelialização percentual) mostrando que feridas ex vivo de pele saudável fecham significativamente mais rápido do que feridas ex vivo de pele diabética. H = saudável. Db = diabético. (D) Percentual K14 manchas picos mais cedo na pele saudável versus diabético e, em seguida, diminui em linha com o aumento da diferenciação epidérmica (setas para baixo). (E) A coloração de K14 (célula epidérmica basal) é perdida à medida que a epiderme se diferencia. D = diferenciado. ND = não diferenciado. Linhas pontilhadas brancas retratam bordas internas e externas das feridas. Setas brancas = direção de migração. n = 6 feridas por doador, por ponto de tempo. Média +/- SEM. * = P < 0,05, ** = P < 0,01 e *** = P < 0,001. Saudável e diabético comparado a cada ponto de tempo de cura em C (Valor P para comparação menos significativa). Mudança temporal na coloração do K14 em comparação com o pico para cada doador em D. Clique aqui para ver uma versão maior desta figura.
Em seguida, usamos manchas de montagem inteira para explorar a expressão tecidual e a localização de outros marcadores relevantes para feridas na pele não diabética(Figura 3). Todos os anticorpos utilizados e suas concentrações de trabalho são fornecidos na Tabela de Materiais. Vasos sanguíneos na ferida aberta manchados positivamente com anticorpo de ato muscular liso alfa (a-SMA), usado em combinação com K14 para delinear as bordas epidérmicas em imagens de menor potência(Figura 3A). A matriz dérmica foi manchada com anticorpos contra colágeno tipo I (COL 1) e fibronectina (Fn). Aqui o colágeno foi observado como fibras grossas abundantes, enquanto as fibras de fibronectina eram esparsas, onduladas e finas(Figura 3A). Nossa abordagem de coloração de montagem completa também é capaz de fornecer resolução de nível celular de coloração, como demonstrado para queratinócitos K14 positivos(Figura 3B).
Finalmente, mostramos que as feridas ex vivo humanas possuem células imunes residentes, com células langerhans detectadas em torno de epiderme recém-formada no dia 3 pós-ferida(Figura 3C). De fato, esses resultados sugerem que a coloração de montagem total pode ser usada para investigar características-chave da resposta de cura, incluindo inflamação, proliferação e a matriz extracelular(Figura 4A). Juntos, nossos dados revelam que o procedimento combinado de woundamento da pele ex vivo e coloração de montagem integral é um método válido para avaliar vários aspectos do reparo da pele humana saudável e diabética (patológica).
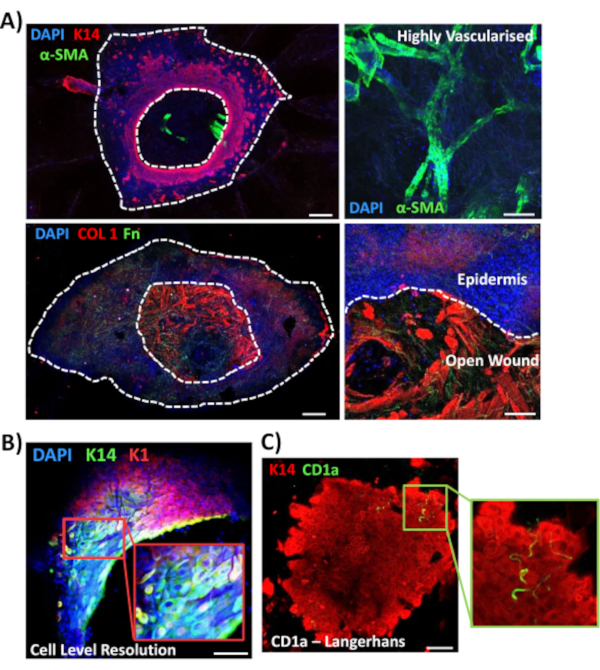
Figura 3: Otimização da abordagem de coloração de todo o montagem para uso com outros anticorpos. (A) Os vasos sanguíneos foram manchados com actina muscular suave alfa (α-SMA, verde) e queratina 14 (K14, vermelho), enquanto as fibras de matriz foram manchadas com colágeno I (COL 1, vermelho) e fibronectina (Fn, verde). (B) O procedimento de montagem integral fornece até a resolução de nível celular de localização (K14, verde; K1, vermelho). (C) Células CD1+ve Langerhans (verde) observadas em epiderme recém-formada. DAPI = núcleos azuis. Barra = 100 μm. Linhas pontilhadas brancas mostram bordas internas e externas das feridas e feridas separadas da epiderme. Esta coloração foi realizada em pele não diabética. Clique aqui para ver uma versão maior desta figura.
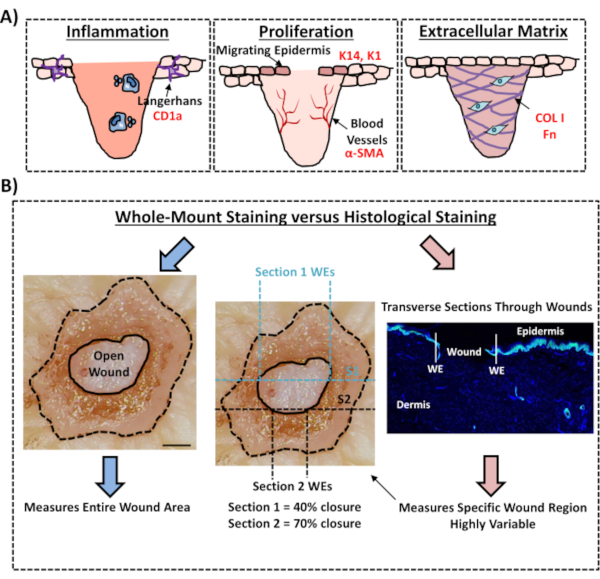
Figura 4: Validade do procedimento de coloração de todo o montagem para avaliação da cicatrização da ferida. (A) Ilustração que descreve como a técnica de coloração de todo o montagem pode avaliar processos relevantes para a ferida. Anticorpos utilizados = texto vermelho. K14 = queratina 14. COL 1 = colágeno 1. Fn = fibronectina. (B) O procedimento de coloração de montagem total (setas azuis) introduz menos variabilidade às medidas de fechamento da ferida do que a análise histológica padrão (setas vermelhas). S1 = seção 1. WE = borda da ferida. Barra = 300 μm. Esta coloração foi realizada em pele não diabética. Clique aqui para ver uma versão maior desta figura.
Discussão
Neste protocolo experimental, descrevemos um método otimizado para avaliar o fechamento de feridas na pele ex vivo humana usando coloração de tecido de montagem inteira. Este é um recurso importante para permitir uma avaliação crítica de possíveis tratamentos de feridas e proporcionar uma melhor compreensão da resposta de reparação de feridas humanas. Publicamos avaliação de cura em feridas de pele ex vivo anteriormente12,13, mas nestes relatos a abordagem de coloração de todo o montagem não foi usada para medir o fechamento da ferida. A coloração de montagem total é muito mais fácil e requer menos experiência técnica do que a histologia padrão, que envolve parafina ou incorporação de OCT e secção de amostras. O procedimento de montagem total também reduz a variabilidade experimental, permitindo a quantificação de toda a ferida e não apenas uma única seção transversa em uma posição definida dentro do tecido (ver Figura 4B para ilustração comparativa). Apoiamos plenamente a importância de quantificar a cicatrização de toda a estrutura de feridas não simétricas, conforme claramente descrito por Rhea e Dunnwald para feridas agudas murinas14. Esses autores mostraram a importância da secção serial de feridas excisionais in vivo para medidas reprodutíveis e precisas da morfologia da ferida. A secção serial pode ser igualmente aplicada a feridas ex vivo humanas; no entanto, para quantificação precisa do fechamento da ferida e re-epitelialização, a coloração de alto rendimento de montagem total deve ser o método preferido. Observamos que este protocolo de coloração de montagem total também deve ser compatível com o processamento subsequente (cera ou OCT) para análise histológica tradicional.
A coloração de montagem total não é sem desvantagens. Embora proporcione maior reprodutibilidade em experimentos de cicatrização de feridas, requer o uso de mais tecido para análise do que técnicas histológicas padrão. Este pode ser um problema onde o acesso ao tecido é limitado, particularmente quando vários anticorpos precisam ser avaliados. Uma abordagem alternativa seria empregar um método de ferida incisional onde a largura da ferida é relativamente uniforme e a variabilidade é reduzida (como mostrado em camundongos e feridas humanas15,16). No entanto, as feridas excisionais permanecem mais aplicáveis à maioria dos tipos de feridas patológicas17.
Neste estudo, foram criadas feridas de espessura parcial de 2 mm no centro de explants de pele de 6 mm. Este método pode ser otimizado para tamanhos alternativos de feridas excisionais e explantar em diferentes profundidades de pele18. Além disso, a força necessária para gerar feridas vai variar entre os doadores, onde a pele envelhecida exigirá menos força para a biópsia. Também evitaríamos usar a pele exibindo estrias proeminentes ou outras alterações estruturais. Validamos uma série de anticorpos para considerar diferentes aspectos da resposta de cura ex vivo. Este protocolo também pode ser usado com outros anticorpos relevantes para a pele, onde concentrações de anticorpos e tempos de incubação precisarão ser otimizados. No entanto, acreditamos que nosso protocolo é mais adequado à quantificação absoluta do fechamento total da ferida, seguido pela avaliação espacial de proteínas específicas de interesse. Embora o montagem integral forneça uma resolução reduzida de imunolocalização versus análise histológica padrão das seções teciduais, fornece informações 3D adicionais que estão faltando da histologia 2D padrão.
Uma ressalva de avaliar a cura nos modelos ex vivo skin versus in vivo é que ela carece de uma resposta sistêmica. Um aspecto importante da reparação da ferida é a inflamação e a subsequente granulação tecidual, que é causada por um influxo de células inflamatórias e células endoteliais da vasculatura19. Apesar dessa limitação, a pele ex vivo ainda proporciona uma melhor recapitulação da cicatrização clínica do que os ensaios de feridas baseadas em células. Experimentos in vitro em geral envolvem monocamadas ou co-culturas do tipo celular único cultivadas no plástico da cultura tecidual, enquanto a pele ex vivo fornece um ambiente nativo para explorar o comportamento celular. Mais recentemente, surgiram vários sistemas equivalentes à pele, onde a pele é cultivada em um ambiente laboratorial a partir de matriz artificial e células isoladas da pele20,21. Embora esses modelos imitem a pele humana melhor do que a maioria das abordagens in vitro, eles ainda não simulam totalmente o ambiente de tecido nativo e geralmente são muito frágeis para ferir reprodutivelmente. Além disso, nós (e outros) demonstramos que o tecido da pele humana ex vivo retém células imunes residentes, o que, sem dúvida, contribuirá para a reparação22,23. O trabalho futuro deve agora focar na ampliação da viabilidade e imunocompetência do modelo ex vivo para avaliação de cura em estágio final24. Uma opção é o avanço de tecnologias promissoras de órgãos em um chip capazes de prolongar a viabilidade tecidual e manter a arquitetura nativa da pele por até duas semanas na cultura25. Os modelos ex vivo também começaram a considerar a importância da resposta inflamatória da pele incorporando com sucesso células imunes, como neutrófilos, no tecido hospedeiro26 ou injetando tecido hospedeiro com anticorpos para provocar uma reação imune27. Esperamos que essas descobertas abram caminho para o desenvolvimento de métodos mais refinados e traduzíveis no futuro.
Um grande benefício do uso da pele ex vivo para medir o fechamento da ferida é a capacidade de comparar as taxas de cicatrização em tecidos saudáveis (por exemplo, não diabéticos) versus patológicos (por exemplo, diabéticos ou idosos). Aqui mostramos que a re-epitelialização e a formação de barreiras são de fato prejudicadas em feridas diabéticas versus saudáveis ex vivo. De fato, isso fornece um caminho para avaliação pré-clínica da reparação patológica, onde o envelhecimento e o diabetes são os principais fatores de risco para o desenvolvimento de feridas crônicas1. Enquanto existem modelos patológicos in vitro, como células isoladas de tecido envelhecido e diabético, ou células cultivadas em alta glicose para imitar hiperglicemia28,29, essas células podem perder rapidamente seu fenótipo uma vez removido do microambiente in vivo. Um componente importante do ambiente de cura patológica extrínseca é a matriz dérmica, que é alterada tanto no envelhecimento quanto no diabetes30. De fato, essa matriz perturbada afeta o comportamento dos fibroblastos residentes e ingênuos31,32. Assim, a importância de estudar células em seu ambiente de tecido hospedeiro não pode ser subestimada.
Em resumo, nosso protocolo fornece uma importante plataforma para quantificar a re-epitelialização de feridas humanas, explorar fatores regulatórios e testar a validade e eficácia de potenciais terapêuticas12,13. Embora os testes pré-clínicos ainda exijam abordagens in vivo, uma estratégia combinada usando tecido humano ex vivo e ferida in vivo murine deve refinar a via pré-clínica, reduzindo o uso de animais enquanto aumenta a tradução de espécies cruzadas.
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
Gostaríamos de agradecer aos senhores deputados Paolo Matteuci e George Smith pelo fornecimento de tecido de pacientes. Também somos gratos à Srta. Amber Rose Stafford por ajudar na coleta de tecidos e no Apelo Daisy por fornecer instalações de laboratório.
Materiais
| Name | Company | Catalog Number | Comments |
| 50 mL Falcon Tubes | Falcon | 352070 | For skin washing |
| 1.5 ml TubeOne Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | For whole-mount staining |
| 48-Well CytoOne Plate, TC-Treated | Starlab | CC7682-7548 | For whole-mount staining |
| Acetic Acid Glacial | Fisher Chemical | A/0400/PB15 | Part of fixative |
| Alkyltrimethylammonium Bromide | Sigma-Aldrich | M7635 | Part of fixative |
| Anti-Alpha Smooth Muscle Actin Antibody [1A4] | Abcam | ab7817 | Stains blood vessels |
| Anti-Collagen I Antibody | Abcam | ab34710 | Stains collagen |
| Anti-Cytokeratin 14 Antibody [LL002] | Abcam | ab7800 | Stains epidermis |
| CD1A Antibody (CTB6) | Santa Cruz Biotechnology | sc-5265 | Stains Langerhans cells |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Thermo Fisher Scientific | 62247 | Counterstain for cell nuclei |
| Falcon 60mm Petri dishes | Falcon | 353004 | Human ex vivo culture |
| Fibronectin Antibody (EP5) | Santa Cruz Biotechnology | sc-8422 | Stains fibronectin |
| Formaldehyde, Extra Pure, Solution 37-41%, SLR | Fisher Chemical | F/1501/PB17 | Part of fixative |
| Gauze Swabs | Medisave | CS1650 | To clean skin |
| Gibco™ Antibiotic-Antimycotic Solution | Thermo Fisher Scientific | 15240062 | Human ex vivo culture |
| Gibco DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960044 | Human ex vivo culture |
| Gibco Fetal Bovine Serum | Thermo Fisher Scientific | 10500064 | Human ex vivo culture |
| Gibco HBSS, no calcium, no magnesium | Thermo Fisher Scientific | 14170088 | Human ex vivo culture |
| Gibco L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 | Human ex vivo culture |
| Hydrogen Peroxide | Sigma-Aldrich | H1009-100ML | For immunoperoxidase staining |
| ImageJ Software | National Institutes of Health | N/A | For image analysis |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Mouse, Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Rabbit, Alexa Fluor 594 | Thermo Fisher Scientific | A11012 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fisher Scientific | L3224 | For viability assessment of tissue |
| Iris Forceps, 10 cm, Curved, 1x2 teeth | World Precision Instruments | 15917 | To create wounds |
| Iris Scissors, 11 cm, Curved, SuperCut, Tungsten Carbide | World Precision Instruments | 501264 | To create wounds |
| Iris Scissors, 11 cm, Straight, SuperCut, Tungsten Carbide | World Precision Instruments | 501263 | To remove adipose tissue |
| Keratin 1 Polyclonal Antibody, Purified | Biolegend | 905201 | Stains epidermis |
| Keratin 14 Polyclonal Antibody, Purified | Biolegend | 905301 | Stains epidermis |
| LSM 710 Confocal Laser Scanning Microscope | Carl Zeiss | Discontinued | For fluorescent imaging |
| Merck Millipore Absorbent pads | Merck Millipore | AP10045S0 | Human ex vivo culture |
| Merck Millipore Nylon Hydrophilic Membrane Filters | Merck Millipore | HNWP04700 | Human ex vivo culture |
| Normal Goat Serum Solution | Vector Laboratories | S-1000-20 | Animal serum used depends on secondary antibody |
| Phosphate Buffer Solution | Sigma-Aldrich | P3619 | For wash buffer |
| Sodium Azide | Sigma-Aldrich | S2002 | For blocking buffer |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | Part of fixative |
| Sterilisation Pouches | Medisave | SH3710 | To sterilise instruments |
| Stiefel 2mm biopsy punches | Medisave | BI0500 | For partial thickness wound |
| Stiefel 6mm biopsy punches | Medisave | BI2000 | For outer explant |
| Thermo Scientific Sterilin Standard 90mm Petri Dishes | Thermo Fisher Scientific | 101VR20 | To prepare skin |
| Triton X-100 | Fisher Chemical | T/3751/08 | For wash buffer |
| VECTASTAIN Elite ABC-HRP Kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-6101 | For immunoperoxidase staining; HRP kit used depends on primary antibody |
| Vector NovaRED Substrate Kit, Peroxidase (HRP) | Vector Laboratories | SK-4800 | For immunoperoxidase staining |
| Wireless Digital Microscope | Jiusion | N/A | For brightfield imaging |
Referências
- Lindholm, C., Searle, R. Wound management for the 21st century: combining effectiveness and efficiency. International Wound Journal. 13, 5-15 (2016).
- Guest, J. F., et al. Health economic burden that different wound types impose on the UK's National Health Service. International Wound Journal. 14 (2), 322-330 (2017).
- Guest, J. F., Fuller, G. W., Vowden, P. Diabetic foot ulcer management in clinical practice in the UK: costs and outcomes. International Wound Journal. 15 (1), 43-52 (2018).
- López-Valverde, M. E., et al. Perioperative and long-term all-cause mortality in patients with diabetes who underwent a lower extremity amputation. Diabetes Research and Clinical Practice. 141, 175-180 (2018).
- Wilkinson, H. N., Hardman, M. J. The role of estrogen in cutaneous ageing and repair. Maturitas. 103, 60-64 (2017).
- Frykberg, R. G., Banks, J. Challenges in the treatment of chronic wounds. Advances in Wound Care. 4 (9), 560-582 (2015).
- Wilkinson, H. N., Hardman, M. J. Wound healing: cellular mechanisms and pathological outcomes. Open Biology. 10 (9), 200223 (2020).
- Ansell, D. M., Holden, K. A., Hardman, M. J. Animal models of wound repair: Are they cutting it. Experimental Dermatology. 21 (8), 581-585 (2012).
- Elliot, S., Wikramanayake, T. C., Jozic, I., Tomic-Canic, M. A modeling conundrum: murine models for cutaneous wound healing. Journal of Investigative Dermatology. 138 (4), 736-740 (2018).
- Mazio, C., et al. Pre-vascularized dermis model for fast and functional anastomosis with host vasculature. Biomaterials. 192, 159-170 (2019).
- Wilkinson, H. N., Iveson, S., Catherall, P., Hardman, M. J. A novel silver bioactive glass elicits antimicrobial efficacy against Pseudomonas aeruginosa and Staphylococcus aureus in an ex vivo skin wound biofilm model. Frontiers in Microbiology. 9, 1450 (2018).
- Wilkinson, H. N., et al. Elevated local senescence in diabetic wound healing is linked to pathological repair via CXCR2. Journal of Investigative Dermatology. 139 (5), 1171-1181 (2019).
- Wilkinson, H. N., et al. Tissue iron promotes wound repair via M2 macrophage polarization and the chemokine (CC motif) ligands 17 and 22. The American Journal of Pathology. 189 (11), 2196-2208 (2019).
- Rhea, L., Dunnwald, M. Murine excisional wound healing model and histological morphometric wound analysis. Journal of Visualized Experiments. 162, e61616 (2020).
- Ansell, D. M., Campbell, L., Thomason, H. A., Brass, A., Hardman, M. J. A statistical analysis of murine incisional and excisional acute wound models. Wound Repair and Regeneration. 22 (2), 281-287 (2014).
- Rizzo, A. E., Beckett, L. A., Baier, B. S., Isseroff, R. R. The linear excisional wound: an improved model for human ex vivo wound epithelialization studies. Skin Research and Technology. 18 (1), 125-132 (2012).
- Olsson, M., et al. The humanistic and economic burden of chronic wounds: a systematic review. Wound Repair and Regeneration. 27 (1), 114-125 (2019).
- Mendoza-Garcia, J., Sebastian, A., Alonso-Rasgado, T., Bayat, A. Optimization of an ex vivo wound healing model in the adult human skin: Functional evaluation using photodynamic therapy. Wound Repair and Regeneration. 23 (5), 685-702 (2015).
- Brownhill, V. R., et al. Pre-clinical assessment of single-use negative pressure wound therapy during in vivo porcine wound healing. Advances in Wound Care. , (2020).
- Diekmann, J., et al. A three-dimensional skin equivalent reflecting some aspects of in vivo aged skin. Experimental Dermatology. 25 (1), 56-61 (2016).
- Vidal Yucha, S. E., Tamamoto, K. A., Nguyen, H., Cairns, D. M., Kaplan, D. L. Human skin equivalents demonstrate need for neuro-immuno-cutaneous system. Advanced Biosystems. 3 (1), 1800283 (2019).
- Dijkgraaf, F. E., et al. Tissue patrol by resident memory CD8+ T cells in human skin. Nature Immunology. 20 (6), 756-764 (2019).
- He, X., de Oliveira, V. L., Keijsers, R., Joosten, I., Koenen, H. J. Lymphocyte isolation from human skin for phenotypic analysis and ex vivo cell culture. Journal of Visualized Experiments. (110), e52564 (2016).
- Pupovac, A., et al. Toward immunocompetent 3D skin models. Advanced Healthcare Materials. 7 (12), 1701405 (2018).
- Ataç, B., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Kim, J. J., et al. A microscale, full-thickness, human skin on a chip assay simulating neutrophil responses to skin infection and antibiotic treatments. Lab on a Chip. 19 (18), 3094-3103 (2019).
- Jardet, C., et al. Development and characterization of a human Th17-driven ex vivo skin inflammation model. Experimental Dermatology. 29 (10), 993-1003 (2020).
- Chen, J. L., et al. Metformin attenuates diabetes-induced tau hyperphosphorylation in vitro and in vivo by enhancing autophagic clearance. Experimental Neurology. 311, 44-56 (2019).
- Demirovic, D., Rattan, S. I. Curcumin induces stress response and hormetically modulates wound healing ability of human skin fibroblasts undergoing ageing in vitro. Biogerontology. 12 (5), 437-444 (2011).
- Wilkinson, H. N., Hardman, M. J. Wound senescence: A functional link between diabetes and ageing. Experimental Dermatology. 30 (1), 68-73 (2020).
- Fisher, G. J., et al. Collagen fragmentation promotes oxidative stress and elevates matrix metalloproteinase-1 in fibroblasts in aged human skin. The American Journal of Pathology. 174 (1), 101-114 (2009).
- Quan, T., Little, E., Quan, H., Voorhees, J. J., Fisher, G. J. Elevated matrix metalloproteinases and collagen fragmentation in photodamaged human skin: impact of altered extracellular matrix microenvironment on dermal fibroblast function. Journal of Investigative Dermatology. 133 (5), 1362 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados