Method Article
인간 Ex 생체 내 상처 모델 및 피부 수리를 정확하게 평가하기 위한 전산 염색 접근법
요약
여기서는 전형염색 접근법과 결합된 전 생체 내 인간의 피부를 사용하여 상처 수리를 평가하기 위한 최적화된 기술을 시연합니다. 이 방법론은 잠재적인 상처 치료의 평가를 위한 전임상 플랫폼을 제공합니다.
초록
주로 노인과 당뇨병에 영향을 미치는 만성 비 치유 상처는 임상 충족되지 않은 필요성의 중요한 영역입니다. 불행히도, 현재 만성 상처 치료는 부적당하지만, 사용 가능한 전 임상 모델은 새로운 치료법의 임상 효능을 제대로 예측하지 못하고 있습니다. 여기에서 우리는 인간 피부 복구 반응의 다중 양상을 평가하기 위하여 높은 처리량, 전임상 모형을 기술합니다. 부분 두께 상처는 인간 전 생체 내 피부에서 생성되고 치유 시간 과정을 통해 배양되었습니다. 피부 상처 생검은 전체 마운트 염색 절차에 대한 고정에서 수집되었다. 고정 된 샘플은 형광으로 접합 된 이차 항체를 통해 검출이 이루어지면서 1 차 항체에서 차단되고 배양되었습니다. 상처는 각 생검에서 백분율 상처 폐쇄 (재상화)를 계산하기 전에 공초점 현미경 검사를 통해 반염색되고 심상화되었습니다. 이 프로토콜을 적용, 우리는 건강한 기증자 피부에 생성 된 2mm 절제 적 상처가 완전히 4-5 후 상처 에 의해 다시 상형화되어 있음을 알 수 있습니다. 반대로, 당뇨병 피부 상처의 폐쇄 비율은 크게 감소, 혼란 장벽 개혁과 함께. 인간의 피부 상처와 새로운 전산 염색 접근법을 결합하면 전 생체 내 상처 수리를 정량화하는 신속하고 재현 가능한 방법이 있습니다. 전체적으로, 이 프로토콜은 잠재적인 상처 치료의 효과를 평가하기 위하여 귀중한 인간 적인 플랫폼을 제공합니다, 전 임상 시험 및 검증을 변환합니다.
서문
노인과 당뇨병 환자에서 매우 널리 퍼진 만성, 비 치유 상처는 임상 충족되지 않은 필요성의 주로 인정받지 못하는 지역입니다. 이러한 상처는 환자에게 큰 신체적, 심리적 부담을 주며 매년1을치료하기 위해 의료 서비스 제공자에게 수십억 달러의 비용을 부담합니다. 상처 생물학과 기술의 발전에 대한 이해가 향상되더라도, 만성 상처의 최대 40%는 여전히 최고의 표준 배려2에따라 치유하는 것을 실패합니다. 따라서, 당뇨병 발 궤양을 가진 환자의 14-26%는 이후에 절단3를요구합니다, 5 년 사후 절단 사망률은 대략 70%4에서 있는 동안. 그 결과, 가난한 치유 상처에 의해 부과되는 실질적인 헬스케어 부담을 감소시키면서 환자의 삶의 질을 향상시키기 위하여 효과적인 새로운 치료를 개발하는 긴급한 요구 사항이 있습니다. 제대로 예측 전 임상 모델은 효과적인 새로운 치료의 개발에 중요한 장애물 남아있다.
상처 복구는 다양한 범위의 세포 유형, 수많은 수준의 통신 및 일시적으로 리모델링되는 조직 환경을 포함하는 동적이고 다각적인 과정입니다. 피부 치유는 4개의 중요한 회복 단계에 의해 뒷받침됩니다: hemostasis, 염증, 증식 및 매트릭스 리모델링. 이러한 단계는 궁극적으로 혈액 손실 및 감염을 방지하고 상처 표면 (재상화이라고 불리는 과정)을 닫고 피부를 부상되지 않은 상태로 되돌리기 위해 작용합니다5. 만성 상처는 다양한 병인학 및 치유 과정에 광범위한 동요와 연관되어6,치료 대상의 식별을 더욱 복잡하게. 그럼에도 불구하고, 상처 병리학의 분자 및 세포 동인을 해명하고 새로운 치료 접근법7을테스트하기 위해 광범위한 모델이 개발되었다.
가장 많이 사용되는 상처 수리 모델은 마우스에 급성 상처입니다. 마우스는 기계학 연구를 위해 높게 관예하고 노화와 당뇨병의 검증된 모형을 제공합니다8. 마우스와 인간의 치유 사이에 나타난 일반적인 유사성에도 불구하고 피부 구조와 치유 역학의 종 간 차이는 남아 있습니다. 이것은 대부분의 뮤린 상처 연구가 쉽게 클리닉9로번역되지 않는다는 것을 의미합니다. 결과적으로, 높은 적용성 및 번역성10,11을가진 체외 및 전 생체 시스템에서 인간을 향한 추진이 있었다.
여기서 우리는 전 생체 내 인간의 피부에 부분 두께 절제적 상처를 수행하기위한 심층 프로토콜을 제공합니다. 또한 전형염색 접근법을 전 생체 인간 피부 치유를 평가하는 매우 재현 가능한 방법으로 설명합니다. 우리는 표피 수리의 궤적을 보여줍니다 (다시 상피화) 및 후속 장벽 형성, 당뇨병 인간의 피부 대 건강한 상처 폐쇄의 비율을 평가. 마지막으로, 전체 탈것이 다양한 항체와 함께 사용하기 위해 어떻게 적응할 수 있는지 를 입증하여 치유 반응의 다양한 측면을 평가합니다.
프로토콜
인간의 피부는 캐슬 힐 병원과 선체 로얄 병원에서 재건 수술을받고 환자에서 얻은 (헐, 영국) 전체 통보에 따라, 서면 환자 동의, 기관 지침, 윤리적 승인 (LRECs: 17/SC/0220 및 19/NE/0150). 비 당뇨병 피부는 일상적인 수술을 받은 환자로부터 수집되었다 (평균 연령 = 68). 당뇨병 피부는 타입 II 당뇨병과 궤양의 역사를 설립한 기증자에게서 선택되었습니다 (평균 연령 = 81). 수술샘플은 미디어를 들고 운반되어 실험실에 도착하자마자 처리되었습니다. 고정되지 않은 인간 조직을 이용한 모든 실험 단계는 클래스 II 라미나르 플로우 생물안전 캐비닛에서 생물안전 수준-2(BSL-2)에서 수행되었다.
1. 피부 배양 매체 및 염색 시약의 준비
참고: 모든 시약 및 소모품 세부 정보는 재료 표에제공됩니다. 인간 조직의 처리 및 문화에 사용되는 모든 시약 및 장비가 멸균되었는지 확인합니다. 사용 전에 기기를 살균하고 조직과의 접촉 후 소독제로 오염제거합니다. 폐기 전에 1% 소독제로 폐기물을 오염 제거합니다.
- 보유 매체: 보충 높은 포도 당 덜벡코의 수정 된 독수리 매체 (DMEM) 와 2 mM L-글루타민 과 4% (v/v) 항생제 항 진 내 용.
- 항생제를 가진 행크의 균형 잡힌 소금 용액 (HBSS): HBSS에 4% (v/v) 항생제 항진균액을 추가합니다. 사용할 때까지 4 °C에 보관하십시오.
- 덜벡코의 인산완충식염(DPBS): 증류수(dH2O)의리터당 9.6g의 DPBS 분말을 용해하여 DPBS를 준비한다. 자동 클락은 사용될 때까지 4°C에서 살균하고 보관합니다.
- 인간 피부 성장 매체: 2 mM L-글루타민, 1% (v/v) 항생제 항진균용액 및 10% (v/v) 태아 소 혈청으로 높은 포도당 DMEM을 보충합니다. 사용할 때까지 4 °C에 보관하십시오.
- 피부 고정: dH2O의 450mL에, 포름알데히드 용액 40mL, 빙하 아세트산 10mL, 염화 나트륨 4.5g, 알킬트리메틸람모늄 브로마이드 0.25 g를 추가합니다. 실온(RT)에 보관하고 며칠 이내에 사용하십시오.
주의: 고정은 위험합니다(자극제 및 인화성). 주의하여 처리하고 적절한 경로를 통해 폐기하십시오. - 인산완충식식(PBS): 염화나트륨 6g을 인산완충액 100mL, dH2O900mL에 첨가하여 전체 마운트 염색을 위한 PBS를 준비한다.
- 염색 세척 버퍼: PBS에서 0.5% (v/v) 트리톤 X-100을 녹입니다.
- 블로킹 버퍼: 0.2% (w/v) 나트륨 아지드와 2% (v/v) 동물 혈청을 염색 세척 버퍼에 추가합니다. 최대 2주 동안 4°C에 보관하십시오.
참고: 이차 항체 숙주 종의 혈청에서 차단한다. 아지드 나트륨은 인큐베이션 중 세균 성장을 방지할 수 있습니다. - DAPI 작업 솔루션: 디메틸 설플옥화물에서 4′,6-diamidino-2-phenylindole (DAPI)의 5 mg / mL 재고를 준비합니다. 5 μg/mL DAPI 작업 용액을 제공하기 위해 스테인딩 워시 버퍼에 1:1,000의 스톡을 희석시.
- 과록시다제 블록: 과산화수소0.3%(v/v)를 첨가하여 세척 버퍼를 염색합니다. 사용할 때까지 4 °C에 보관하십시오. 분해를 방지하기 위해 어둠 속에서 유지합니다.
- ABC-HRP 키트:
- HRP-컨쥬게이드 이차 항체: 염색 버퍼의 5mL에서 바이오티니드 토끼 안티 염소 IgG 1 방울. 최대 2주 동안 4°C에 보관하십시오.
참고: 사용되는 키트/보조는 1차 항체의 숙주 종에 따라 달라집니다. - 아비딘-비오틴 복합체(ABC) 시약: 시약 A 2방울, 시약 B 2방울을 염색 세척 버퍼 5mL로 떨어뜨린다. ABC 시약은 사용하기 최소 30분 전에 준비해야 합니다. 최대 2주 동안 4°C에 보관하십시오.
- HRP-컨쥬게이드 이차 항체: 염색 버퍼의 5mL에서 바이오티니드 토끼 안티 염소 IgG 1 방울. 최대 2주 동안 4°C에 보관하십시오.
- 과산화기: 시약 1개 3방울, 시약 2방울 2방울, 시약 3점 2방울, 과산화수소 2방울 5mL dH2O. Peroxidase 기판은 사용 직전에 신선하게 준비해야 하며 보관할 수 없습니다.
2. 상처에 대한 피부 준비
참고: 이러한 단계는 클래스 II 라미나르 플로우 생물 안전 캐비닛에서 수행되어야 합니다.
- 미디어를 들고 BSL-2 캐비닛으로 이동하여 피부를 수집합니다.
- 피부 진미 측면을 90mm 멸균 페트리 접시 내에 놓고 멸균 가위로 지방 조직을 제거합니다.
- RT에서 10 분 동안 항생제로 25 mL의 HBSS를 포함하는 50 mL 튜브에 피부를 배치합니다.
- 새로운 50mL 튜브를 사용하여 2.3 단계를 반복하십시오.
- HBSS의 25mL를 포함하는 신선한 50 mL 튜브에 피부를 놓고, 이번에는 RT. Shake에서 10 분 동안 항생제없이 2.3 단계에서와 같이 흔들어주세요.
- DPBS의 25mL와 함께 새로운 튜브에 피부를 배치하여 최종 피부 헹구기를 수행합니다. 피부는 이제 상처를 입을 준비가 되었습니다.
3. 전 생체 내 인간의 피부 상처 만들기
참고: 이러한 단계는 클래스 II 라미나르 플로우 생물 안전 캐비닛에서 수행되어야 합니다.
- 상처가 나기 전에 피부 문화 요리를 준비하십시오. 60mm 페트리 접시에 멸균 흡수 패드 2개를 쌓아 요리 측면을 통해 인간 피부 매체 4mL을 추가합니다. 멸균 나일론 필터 멤브레인을 흡수 패드 스택에 놓습니다.
참고: 피부 미디어는 필요한 치료 조건에 따라 변경할 수 있습니다. 각 스택에서 최대 3개의 상처 이해가 배양될 수 있다. - 90mm 페트리 접시에 멸균 거즈에 피부의 진피 면을 건조하여 잔류 DPBS를 제거합니다.
참고: 이것은 상처가 있을 때 피부가 미끄러지는 것을 방지합니다. - 깨끗한 90mm 페트리 접시 뚜껑에 피부 진미 를 내려 놓고 신선한 멸균 거즈로 건조한 표피를 두드려 주세요.
참고 : 베이스보다 페트리 접시 뚜껑에 피부를 감는 것이 더 쉽습니다. 피부가 건조되는 것을 방지하기 위해 후속 작업을 신속하게 수행해야합니다. - 피부를 팽팽하게 잡고 피부에 2mm 생검 펀치를 누르고 부드럽게 비틀어주세요. 피부를 완전히 펀치하지 마십시오.
참고: 부분 두께 상처는 표피를 통해 부분적으로 진피로 펀치하도록 설계되었습니다. 부분 두께 상처를 만드는 데 필요한 힘에 기증자 - 투 - 기증자 및 현장 적 가변성이있을 수 있습니다. - 곡선이 있는 치아 조직 집게를 사용하여 2mm 상처의 각 면을 선택하고 2mm 상처 아래에 곡선홍채 가위를 연결하여 균일하게 잘라냅니다.
- 중앙 2mm 주위의 생검은 중앙에 부분 두께 2mm 상처가있는 6mm 의 엑스처를 만들기 위해 6mm 생검 펀치를 사용하여 상처를 만듭니다.
참고: 6mm 생검 펀치는 각 2mm 상처가 있어야 하는 곳을 표시하기 위해 피부를 채점하는 데 사용될 수 있습니다. 조직을 완전히 관통하지 않도록주의하십시오. 낭비를 줄이기 위해 벌집 패턴으로 상처 를 만듭니다. - 나일론 필터 멤브레인 스택에 상처 표피를 옆으로 놓습니다 (3.1 단계에서 준비).
참고: 상처 를 다룰 때는 중앙 상처를 손상시키지 않도록주의하십시오. 작은 집게를 사용하고 반대쪽에서 각 각 을 선택합니다. - 1-7일 동안 가습대기(90-95%)에서 32-37°C 및5%CO2에서 상처를 배양한다. 2-3일마다 미디어를 교체합니다.
4. 전 생체 내 상처의 전산 염색
참고: 이 단면도는 면역형광및 면역peroxidase 염색 방법을 기술합니다. 사용하기 전에 모든 시약을 잘 섞습니다.
- 형광 염색 방법
- 피부 고정 및 인큐베이션의 500 μL을 포함하는 1.5 mL 마이크로 센심 분리구 튜브에서 상처 박기를 수집하고 하룻밤 사이에 4 ° C에서 배양하십시오.
참고: 이 프로토콜에 사용되는 고정은 기술된 항체에 적합합니다. 최적화는 다른 항체에 필요합니다. 24 시간 보다 더 긴 조직 고정 과도 한 고정으로 이어질 수 있습니다. - 다음 날 고정을 제거하고 염색 세척 버퍼의 1mL로 교체합니다. 생검은 염색 하기 전에 최대 2 주 까지 4 °C에서 염색 세척 버퍼에 저장할 수 있습니다.
참고: 모든 세척 버퍼 단계의 경우, 상처를 손상시키지 않도록 주의하여 세로지 피펫 또는 파이펫 팁을 사용하십시오. - 염색 세척 버퍼를 흡인하고 염색 세척 버퍼 1mL로 한 번 더 헹구세요.
- 4.1.5-4.1.6 단계(샘플 수 x 300 μL = μL의 차단 버퍼 양)에 필요한 차단 버퍼의 양을 계산합니다. 필요한 경우 추가 버퍼를 만듭니다.
- 각 샘플에 150 μL의 블로킹 버퍼를 추가하고 RT에서 1h로 인큐베이션합니다. 모든 염색 단계에 대해 각 샘플이 충분히 덮여 있고 생검 상처 표면을 덮는 거품이 없는지 확인하십시오.
참고: 이 단계는 1.5mL 마이크로센심분리기 튜브 또는 48개의 웰 플레이트에서 수행될 수 있다. 48 웰 플레이트를 사용하는 경우, 상처는 각 우물에서 아래로 아래로 아래로 인큐베이션. - 나머지 차단 버퍼에서 1차 항체를 희석시다.
참고: 안티 마우스 케라틴 14 (K14) 희석 1:1,000 차단 버퍼에 잘 작동 합니다. 다른 항체 또는 다중 프로브와 함께 사용하기 위해이 단계를 최적화합니다. - 차단 버퍼를 흡인하고 웰/미세센심분리기 튜브당 150 μL 1차 항체를 추가합니다. 하룻밤 동안 4°C에서 1차 항체에서 상처 가마를 배양한다.
- 다음 날, 1차 항체를 흡인시키고 T(샘플당 500 μL)에서 1h에 대해 0.2%의 아지드 나트륨을 함유한 염색 세척 버퍼에서 헹구는 다.
- 염색 세척 버퍼(세척당 30분, 시료당 500 μL)를 사용하여 3개의 헹구기 단계를 더 수행합니다.
- 염색 세척 버퍼에서 형광으로 공주된 이차 항체를 희석시(예를 들어, 염소 항마우스 488 에서 1:400 희석).
- 이차 항체의 필요한 양을 계산합니다 (샘플 수 x 150 μL = μL의 양).
- 각 웰/미세 원심 분리튜브에 이차 항체 150 μL을 추가합니다. RT에서 1h에 대한 인큐베이션은 이차 항체가 빛에 민감하기 때문에 어둠 속에서 4.1.10 - 4.1.16 배양 단계를 수행한다.
참고: 필요한 경우 이 단계는 하룻밤 사이에 4°C에서 수행될 수 있습니다. 적절한 신호와 제한된 배경 염색에 필요한 이차 항체의 농도를 최적화합니다. - 이차 항체를 제거하고 염색 세척 버퍼 (샘플 당 500 μL)로 3 x 30 분 헹구는 작업을 수행합니다.
- 남은 세척 버퍼를 폐기하고 필요한 DAPI 작업 솔루션의 양을 계산합니다(단계 4.1.11당).
- 카운터스테인은 각각 RT에서 10분 동안 DAPI 작업 용액 150μL로 절제됩니다.
참고 : DAPI는 세포 핵을 파란색으로 얼룩지게합니다. Hoechst 염료는 DAPI의 대안으로 사용될 수 있습니다. - 염색 세척 버퍼(샘플당 500 μL)로 마지막 30분 세척 2개를 수행합니다. 생검은 이미징 전 최대 2주 전에 어두운 4°C에서 염색 세척 버퍼에 보관할 수 있습니다.
- 피부 고정 및 인큐베이션의 500 μL을 포함하는 1.5 mL 마이크로 센심 분리구 튜브에서 상처 박기를 수집하고 하룻밤 사이에 4 ° C에서 배양하십시오.
- 브라이트필드 염색 방법.
- 4.1.1 - 4.1.3 단계를 수행합니다.
- 하룻밤 사이에 4°C에서 peroxidase 블록으로 내인성 과산화제 활성을 담금질한다.
참고: 이 단계는 조직에서 비특이적 배경 얼룩을 줄이기 위해 HRP-컨쥬게이징 항체를 사용할 때 중요합니다. 고도로 혈관화 된 조직은 더 많은 내인성 과산화증 활동을 포함할 것이다. - 페록시다제 블록을 버리고 염색 세척 버퍼에서 30 분 동안 두 번 헹구십시오.
- 4.1.4 - 4.1.8 단계를 수행합니다.
참고: 4.1.7 단계 후 의 세하는 것은 샘플에서 아지드 나트륨을 제거하는 것이 특히 중요합니다. 아지드 나트륨을 적절히 제거하지 않으면 HRP가 비활성화되고 염색 감지를 방해합니다. - 각 웰/미세센트심분리기 튜브에 150 μL HRP-컨쥬게이드 이차 항체를 추가하고 RT에서 4°C 또는 1h에서 하룻밤 동안 배양합니다.
- 이차 항체를 제거하고 염색 세척 버퍼에서 3 x 30 분 세척을 수행합니다.
- 각 웰/마이크로센트심분리기 튜브에 150 μL ABC 시약을 추가하고 RT에서 4°C 또는 1시간에서 하룻밤 동안 배양합니다.
- ABC 시약을 흡인하고 염색 세척 버퍼에서 3 x 30 분 세척을 수행합니다.
- 150 μL peroxidase 기판을 한 식소에 추가하고 눈에 띄는 색상 변화를 감지하는 데 필요한 시간을 결정합니다.
참고: 강한 염색이 예상되는 샘플을 선택합니다. 이 경우 마이그레이션표(K14)를 표시하는 빨간색 링입니다. 3,3'-디아미노벤지딘-4, 또는 다른 임의의 적절한 염색체 기질은, 이러한 과산화기질을 대체하는 것으로 사용될 수 있다. - 색 변화가 관찰되면, peroxidase 기판을 제거하고 dH2O의 1 mL로 대체하십시오.
- 다른 이종에 대한 과산화제 기판 검출을 반복하고, 4.2.11 단계에서 결정된 시간 동안 배양한다.
- 잔류 과산화증기판을 제거하기 위해 dH2O의 1mL로 모든 이출을 헹구는다. 각질은 이미징 전에 4°C에서 최대 1주일까지 저장될 수 있지만, 시간이 지남에 따라 과산화기의 침출을 방지하기 위해가능한 한 빨리 그들을 이미지화하는 것이 좋습니다.
5. 이미징 및 정량화
- 형광 화상 진찰
참고: 형광 화상 진찰은 공초점 레이저 스캐닝 현미경을 사용하여 수행됩니다. 그러나, 반전형 형광 현미경은 상처 폐쇄율을 정량화하기 위해 2D 심상을 획득하기에 충분할 수 있다. 이차 항체를 선택할 때 선택한 플루오로크롬이 사용 가능한 현미경 장비의 여기 및 방출 스펙트럼과 호환되는지 확인합니다.- 2.5배, 10배 및 20배 목표, x-y-z 전동 단계, 디지털 카메라 및 획득 소프트웨어가 장착된 공초점 레이저 스캐닝 현미경을 사용합니다. 각 생검을 쉽게 시각화할 수 있도록 전송된 광 검출기(TPMT)를 켜서 총 상처 폐쇄를 측정할 수 있도록 합니다. 또는 형광 이미징 다음 밝은 필드 현미경 검사를 통해 각 상처를 측정하십시오.
- 이미징 플랫폼에 60mm 페트리 접시 베이스를 놓고 DPBS의 얇은 층(약 1mL)을 추가합니다.
참고: 너무 많은 DPBS를 사용하는 경우, 생검은 이미징 중에 주위를 이동할 것입니다. 또는 플레이트 홀더를 사용할 수 있는 경우 48 웰 플레이트를 사용하십시오. - 작은 조직 집게를 사용하여 우물/미세 원심분리기 튜브에서 DPBS가 함유된 페트리 접시에 상처 이발기를 전달합니다. 생검 상처쪽을 페트리 접시에 놓습니다.
- 접안렌즈와 형광램프를 사용하여 상처에 초점을 맞춥니다. 거품이 시야의 샘플 아래에 갇혀있는 경우, 조직 집게및 재배치와 상처를 선택합니다.
- 최적의 공초점성을 위해 채널 간에 동일한 핀홀 크기를 보장하여 이미징 소프트웨어를 설정합니다. 이를 위해 각 채널에 대해 하나의 통풍이 좋은 단위의 값을 확인하고 가장 큰 값을 선택합니다. 스캔 속도, 이미지 품질 및 평균을 선택합니다.
참고: 공액된 이차 항체및 선택한 카운터스테인(예를 들어, DAPI)의 불소크롬은 필요한 채널을 지시합니다. - 라이브 획득 소프트웨어를 켜고 각 채널의 레이저 출력과 게인을 염색시각화하는 데 필요한 수준으로 조정합니다. 디지털 오프셋을 늘려 배경 소음을 줄입니다.
- 이미징 평면의 중앙에 상처를 배치합니다.
참고: 작은 목표를 사용하거나 더 큰 상처를 생성하여 상처가 전체 이미지를 채우지 않으면 이미지 패널을 가져 와서 함께 스티치하십시오(수동으로 또는 관련 이미징 소프트웨어의 타일링 기능). - 상처 생검의 이미지를 획득. 내간 사이에 동일한 이미징 설정을 사용합니다.
참고: 높은 전력 이미지는 조직 구조와 세포 마커 발현 및 위치를 평가할 수 있습니다. - 특히 조직이 페트리 접시에 완전히 평평하지 않은 상처를 통해 직렬 Z 스택을 수집합니다. 분석 소프트웨어를 사용하여 Z 스택을 단일 최대 강도 프로젝션 이미지로 축소합니다.
- 브라이트필드 이미징
참고: 면역 페로시다아제 스테인드 생검의 브라이트필드 이미징은 여러 가지 방법으로 수행될 수 있다.- 반전 현미경 이미징: 5.1.2-5.1.3 단계에서 설명된 대로 페트리 접시/에 배치하여 이미징을 위해 상처 이출을 준비합니다. 디지털 카메라가 장착된 반전 된 현미경으로 밝은 시야 조명 아래에서 디지털 이미지를 획득하십시오. 필요한 경우 여러 이미지를 함께 스티치합니다.
- 무선 디지털 현미경 이미징: 휴대폰이나 랩톱에 연결된 무선 디지털 현미경을 사용하여 비용 효율적인 방식으로 고품질 이미지를 얻을 수 있습니다. 상처가 있는 쪽을 일부 조직에 올려 놓고 샘플 저장에서 잔류 dH2O(또는 염색 세척 버퍼)를 제거합니다. 현미경 시야의 중심에 상처가 내포되어 놓습니다. 연결된 카메라를 사용하여 이미지를 획득합니다.
- 부량
참고: 백분율 상처 닫기는 프리핸드 셰이프를 그려서 측정할 수 있는 모든 소프트웨어에서 정량화될 수 있습니다. ImageJ는 다음과 같이 정량화를 수행하는 데 사용할 수 있습니다.- ImageJ 소프트웨어에서 정량화할 이미지를 엽니다.
- 프리핸드 셰이프 도구를 사용하여 정상적인 피부와 만나는 재상화 된 상처의 바깥쪽을 그립니다. M을 누르거나 분석| 측정)'외부' 영역 측정을 획득합니다.
참고: 재형화된 상처 조직 질감은 정상적인 피부와 다릅니다. 이러한 유형의 분석 이전에는 이미지를 확장할 필요가 없습니다. - 프리핸드 셰이프 도구를 사용하여 열린 상처 영역을 그립니다. 이것은 열린 상처가 다시 상형화 조직의 내부 가장자리를 만나는 곳입니다. M을 누르거나 분석| 측정)을측정하여 '내부' 영역 측정을 획득합니다.
- 백분율 상처 재상화/폐쇄를 추론하려면 다음 방정식을 사용합니다.
% 폐쇄 = (외부 상처 영역 - 내부 상처 영역) / (외부 상처 영역) x 100
참고: 항체의 백분율 영역 커버리지는 동일한 방식으로 추론될 수 있다(예를 들어, K14) 또는 전체 상처 영역의 백분율로 추론될 수 있다. 백분율 강도는 또한 관심있는 마커의 조직 수준 발현에 대한 반 정량적 정보를 제공할 수 있으며, 고전력 이미징은 세포 수준에서 발현 데이터를 제시합니다.
결과
이 보고서에서는 인간의 피부 수리 반응에 영향을 미치는 요인을 평가하기 위해 새로운 전 생체 피부 상처 및 전체 마운트 염색 접근법을 제시합니다. 도 1A는 상처 배양 시간에 따라 3-10일 이내에 수행될 수 있는 절차 파이프라인의 회로도를 나타낸다. 부분 두께 상처는 공기 중막 스택에 배양된다 : 멤브레인 인터페이스및 전체 탈산 염색을 위해 수집 될 수있다, 파라핀 또는 OCT 매체에 내장 일반 히스토닉을 위해, 또는 생화학 분석을위한 액체 질소에서 냉동(도 1B). 우리는 일반적으로 6mm 의 항문 내의 2mm 부분 두께 상처를 만듭니다. 그러나, 상처와 주변 의 크기는 요구 사항에 따라 변경될 수 있습니다. 전체 탈산 절차는 면역페로시다제 및 면역형광 염색방법(도 1C)에성공적으로 적응되었다.
면역 형광은 다중 항체를 가진 조직의 탐구를 허용합니다. 이를 위해, 우리는 다른 종에서 제기된 1 차적인 항체를 사용하고, 종 일치하는 형광으로 공주된 이차 항체를 사용하여 종 간 반응성을 제한하는 것이 좋습니다. 항체 농도및 인큐베이션 시간은 최적화되어야 합니다. 배경 염색이 관찰되면 항체 농도를 줄이고 세척 단계를 증가시키고 이차 항체에 블로킹 버퍼를 추가하십시오. 신선한 조직 생존력은 상업적 생존성 염료로 직접 평가할 수 있습니다(재료표참조). 우리는 또한 조직이 실질적으로 적합 할 때 사후 생존 성 염색을 고정하고 성공적으로 이미지 할 수 있음을 보여줍니다(도 1D).
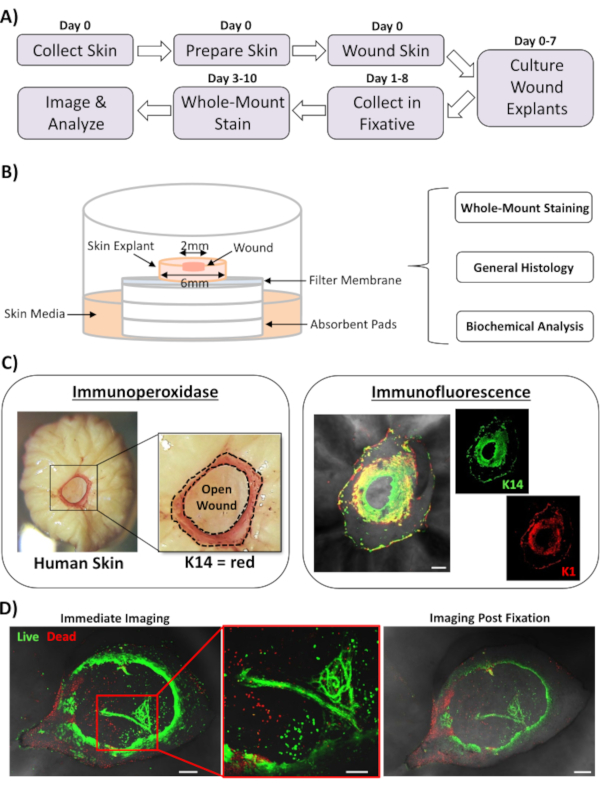
도 1: 인간 전 생체 내 상처 및 전산 염색 접근법. (A)파이프라인은 피부를 수집하고 전 생체 내 상처를 수행하여 조직을 염색하고 데이터를 분석하는 절차적 워크플로우를 묘사합니다. (B)조직에서 일상적으로 수행되는 분석이 있는 인간 전 생체 균진 배양 시스템을 보여주는 다이어그램. (C)전산 염색은 면역페로시다제 및 면역형광 기술을 모두 사용하여 사용될 수 있다. K14 = 케라틴 14. (D)라이브 조직은 상업적 생존성 염료로 염색될 수 있으며 성공적으로 사후 고정을 통해 이미지화될 수 있다. 바 = 100 μm. 이 염색은 비 당뇨병 피부에서 수행되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
상처의 전체 마운트 염색에 가장 널리 적용 가능한 용도는 조직학적 단면을 통해 제공 될 수있는 것보다 더 재현 가능한 방식으로 상처 폐쇄 율을 결정하는 것입니다. 백분율 폐쇄는 도 2A에서설명한 바와 같이 상처 표면의 백분율 상피화로 정량화되었다. 특정 마커의 백분율 영역 범위는 총 상처 부위또는 재상피화 된 상처의 백분율로 측정 될 수 있습니다. 7일 의 시간 동안 건강한(비당뇨병 환자)과 당뇨병 피부의 치유를 특징으로 하며, 상처 후 매일 상처를 수집합니다(대표 이미지, 그림 2B). 건강한 피부 상처는 예상대로 시간이 지남에 따라 닫혔으며, 4-5 일까지 대부분의 샘플에서 전체 폐쇄가 관찰되었습니다. 반대로, 당뇨 피부 상처는 7일 분석기간(도 2C)내에완전히 닫히지 못했다. 부상 후 각 시중(P< 0.001~6일째0.001, P< 0.05, P< 0.05 ~0.05 < ~0.001일0.001로 건강하고 당뇨피부상처 사이에 상처 가루가 크게 지연되는 것을 관찰하였다.
전반적인 상처 폐쇄 비율의 평가 다음; K14 양성전지가 시각화될 수 있는 전체 상처 영역(도 2A의외부 영역)의 백분율을 측정하였다(도 2B의녹색 염색). 흥미롭게도, 우리는 건강한 전 생체 내 피부 상처에서 K14 염색이 2 일째에 정점에 달한 다음 급속히 감소하는 것을 관찰했습니다 (각 시점에 대한 의미는 2 일 피크, 그림 2D). 이는 차별화된 표피 층을 통한 K14 항체 침투를 제외한 초기 표피 장벽의 재형성을 반영할 가능성이 높다(도 2E 회로도 참조). 재상피화 과정에서, 기저층(K14+ve) 각질세포는 외부 상처 에지에 가까운 표피가 내부 상처 가장자리에 가까운 표피보다 일찍 형성하도록 개방된 상처 위로 안쪽으로 이동한다(전면 마이그레이션). 새로 형성된 표피의 전면 가장자리가 남은 열린 상처를 닫기 위해 계속 이동하는 동안, 외부 모서리 표피는 다른 표피 층을 개혁하기 위해 차별화되기 시작합니다. 초기 치유에서, 우리는 따라서 다시 상피 영역의 대부분을 볼 것으로 예상 한다 기초 (K14+ve) 세포, 나중에 복구 K14 얼룩은 표피 안쪽에서 구별으로 손실 되는 동안 (그림 2E에서전체 마운트 이미지 참조). 따라서 도 2D(아래쪽 화살표)에 도시된 K14 염색의 감소는 표피 분화 증가와 상관관계가 있다. 흥미롭게도, 눈에 보이는 K14 염색은 당뇨병 (4 일) 상처대 건강한 (2 일) 에서 일찍 정점을 찍었으며, 당뇨병 피부 상처에서 다시 상피화 및 후속 표피 분화가 지연된다는 것을 더욱 입증합니다.
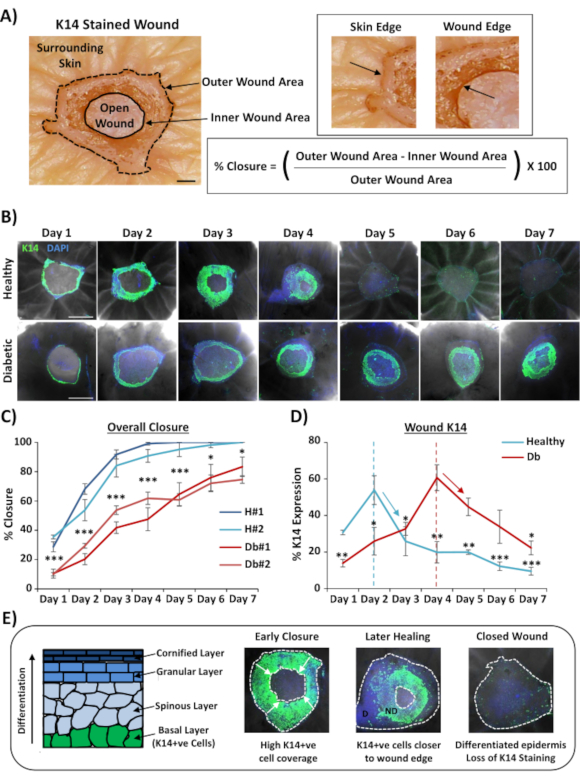
그림 2: 전산 염색은 당뇨병과 건강한 피부의 위터링 률을 드러낸다. (A)외부 및 내부 상처 측정에서 상처 폐쇄를 정량화하는 데 사용되는 방법. 브라이트필드 이미지는 케라틴 14(K14)가 빨간색으로 염색하는 모습을 보여줍니다. Bar = 300 μm.(B)건강하고 당뇨병 피부에서 시간(하루 후 상처)의 대표적인 이미지. 바 = 500 μm. K14 = 녹색. DAPI = 청색 핵. (C)상처 폐쇄율(백분율 상피화)의 정량화는 건강한 피부로부터의 전 생체 내 상처가 당뇨병 피부에서 전생된 생체내 상처보다 훨씬 빠르다는 것을 보여준다. H = 건강. Db = 당뇨병. (D)백분율 K14 염색 피크는 당뇨병 피부 대 건강한 에서 일찍 피크를 염색한 다음 증가된 표피 분화 (아래 화살표)에 따라 감소합니다. (E)K14(기저표피세포) 염색은 표피가 구별됨에 따라 손실된다. D = 차별화. ND = 차별화되지 않습니다. 흰색 점선은 내부 및 외부 상처 가장자리를 묘사합니다. 흰색 화살표 = 마이그레이션 방향입니다. n = 기증자 당 6 상처, 시간 당. 평균 +/- SEM. * = P < 0.05, ** = P < 0.01 및 *** = P < 0.001. C의 각 치유 시점(최소 비교를 위한P값)에서 비교되는 건강하고 당뇨병. K14 염색의 현세적 변화는 D의각 기증자에 대한 피크에 비해. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
다음으로 전산 염색을 사용하여 비당뇨병 피부에서 다른 상처 관련 마커의 조직 발현 및 국소화를 탐구하였다(도3). 사용되는 모든 항체와 그들의 작업 농도는 재료의 표에제공됩니다. 열린 상처내의 혈관은 알파 평활근 액틴(a-SMA) 항체로 긍정적으로 염색되었으며, K14와 함께 하전력이미지(그림 3A)에서표피 가장자리를 묘사하였다. 진피 매트릭스는 콜라겐 타입 I(COL 1) 및 섬유넥틴(Fn)에 대한 항체로 염색하였다. 여기서 콜라겐은 섬유넥틴 섬유가 희소하고 물결모양이고 얇은 반면 풍부한 두꺼운 섬유로 관찰되었다(도3A). 당사의 전체 마운트 염색 접근법은 K14 양성 각질세포(그림 3B)에대해 입증된 바와 같이 염색의 세포 수준 해상도를 제공할 수 있습니다.
마지막으로, 인간 전 생체 내 상처는 상주 면역 세포를 가지고 있음을 보여 주며, 랑거한스 세포는 3일째에 새로 형성된 표피 주변에서 검출된 것으로나타났다(그림 3C). 실제로, 이러한 결과는 전체 탈염얼룩이 염증, 증식 및 세포외 매트릭스(도4A)를포함한 치유 반응의 주요 특징을 조사하는 데 사용될 수 있음을 시사한다. 종합하면, 우리의 데이터는 결합된 전 생체 피부 상처 및 전산 염색 절차가 건강하고 당뇨병 (병리학적인) 인간 피부 수반의 각종 양상을 평가하는 유효한 방법이다는 것을 보여줍니다.
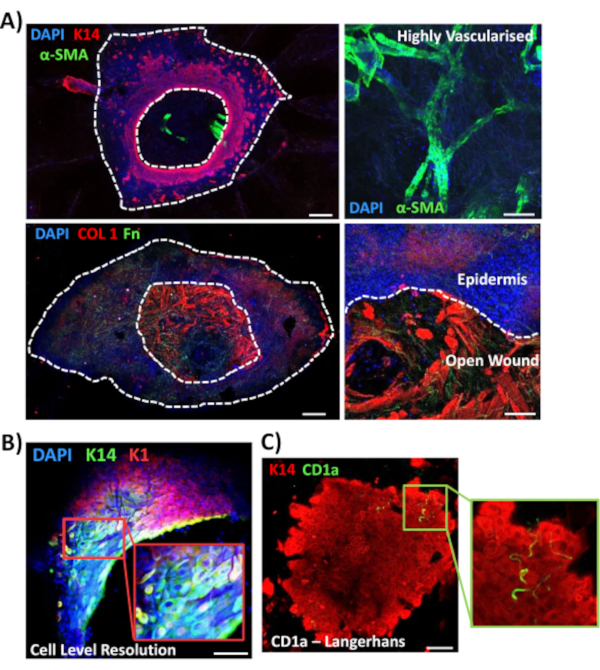
도 3: 다른 항체와 함께 사용하기 위한 전체 마운트 염색 접근법의 최적화. (A)혈관은 알파 부드러운 근육 액틴(α-SMA, 녹색) 및 케라틴 14(K14, 빨간색)로 염색되었으며, 매트릭스 섬유는 콜라겐 I(COL 1, red) 및 섬유네신(Fn, green)으로 염색되었다. (B)전체 마운트 절차는 국소화의 세포 수준 해상도까지 제공 (K14, 녹색; K1, 빨간색). (C)CD1a+ve 랑거한스 세포(녹색)가 새로 형성된 표피에서 관찰된다. DAPI = 청색 핵. 바 = 100 μm. 흰색 점선은 내부 및 외부 상처 가장자리를 표시하고 표피에서 별도의 상처를 보여줍니다. 이 염색은 비 당뇨병 피부에서 수행되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
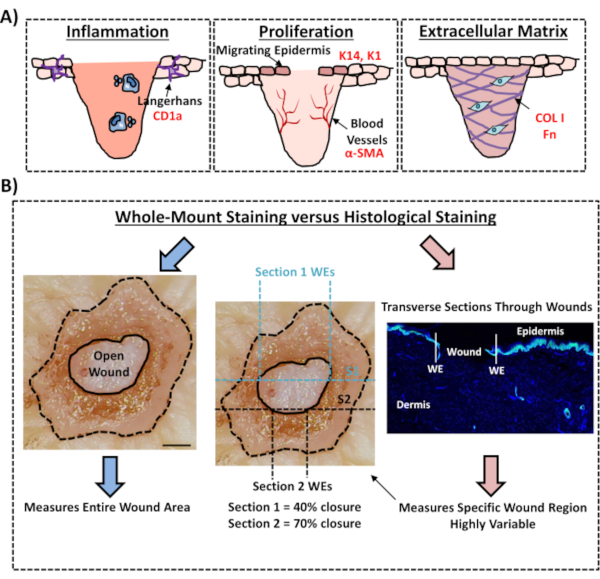
그림 4: 상처 치유를 평가하기 위한 전체 마운트 염색 절차의 타당성. (A)전체 마운트 염색 기술이 상처 관련 공정을 어떻게 평가할 수 있는지를 기술한 예시. 사용되는 항체 = 빨간색 텍스트. K14 = 케라틴 14. COL 1 = 콜라겐 1. Fn = 섬유네틴. (B)전체 탈착 절차(파란색 화살표)는 표준 조직학적 분석(빨간색 화살표)보다 감착 측정에 대한 가변성이 적습니다. S1 = 섹션 1. 우리는 = 상처 가장자리. 바 = 300 μm. 이 염색은 비 당뇨병 피부에서 수행되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 실험 프로토콜에서, 우리는 전체 마운트 조직 염색을 사용하여 인간 전 생체 피부의 상처 폐쇄를 평가하기위한 최적화 된 방법을 설명합니다. 이것은 잠재적인 상처 처리의 중요한 평가를 허용하고, 인간 적인 상처 복구 반응의 더 나은 이해를 제공하기 위하여 중요한 자원입니다. 우리는 이전에 전 생체 피부 상처에 치유 평가를 발표했다12,13,아직 이러한 보고서에서 전체 마운트 염색 접근 방식은 상처 폐쇄를 측정하는 데 사용되지 않았다. 전체 마운트 염색은 훨씬 쉽고 파라핀 또는 OCT 포함 및 샘플의 단면을 포함하는 표준 히스토로지보다 덜 기술적 인 경험이 필요합니다. 또한 전체 마운트 절차는 실험 적 가변성을 감소시켜 조직 내의 정의된 위치에서 단일 횡방향 섹션뿐만 아니라 전체 상처의 정량화를 허용합니다 (비교 그림에 대한 그림 4B 참조). 우리는 완전히 전체 비 대칭 상처 구조의 치유의 중요성을 지원, 명확하게 뮤린 급성 상처에 대한 레아와 던발트에 의해 설명된 대로(14). 이 저자는 상처 형태학의 재현 가능하고 정확한 측정을 위한 생체 내 절제적 상처에서 연속적으로 단면의 중요성을 보여주었습니다. 직렬 단면은 인간 전 생체 내 상처에 동일하게 적용될 수 있습니다. 그러나, 상처 폐쇄 및 재상화의 정확한 정량화를 위해, 높은 처리량 전체 마운트 염색이 바람직한 방법이어야 한다. 이 전체 마운트 염색 프로토콜은 기존의 조직학적 분석을 위해 후속 처리(왁스 또는 OCT)와도 호환되어야 합니다.
전체 마운트 염색은 단점이없는 것은 아닙니다. 상처 치유 실험에서 더 높은 재현성을 제공하지만 표준 조직학적 기술보다 분석을 위해 더 많은 조직을 사용해야 합니다. 이것은 조직 접근이 제한되는 문제점일지도 모릅니다, 특히 다중 항체가 평가될 필요가 있는 곳에. 다른 접근법은 상처 폭이 상대적으로 균일하고 가변성이 감소되는 절개 상처 방법을 사용하는 것입니다 (마우스 및 인간의 상처에 도시된 바와 같이15,16). 그러나, 절제상처는 대부분의 병리학적 상처유형(17)에더 적용가능한 상태로 남아 있다.
이 연구에서는, 2mm 부분 두께 상처는 6mm 피부 이성의 중앙 내에서 만들어졌습니다. 이 방법은 다른 피부깊이(18)에서대체 절제상처 및 절제크기에 최적화될 수 있다. 또한, 상처를 생성하는 데 필요한 힘은 노인 피부가 생검에 적은 힘을 필요로 하는 기증자 마다 다를 것입니다. 우리는 또한 눈에 띄는 스트레치 마크 또는 기타 구조적 변화를 표시하는 피부를 사용하지 않을 것입니다. 우리는 전 생체 치유 반응의 다른 측면을 고려하는 항체의 범위를 검증했다. 이 프로토콜은 또한 항체 농도 및 잠복 시간이 최적화될 필요가 있는 그밖 피부 관련 항체와 함께 이용될 수 있습니다. 그럼에도 불구하고, 우리는 우리의 프로토콜이 관심의 특정 단백질의 공간 평가 뒤에 총 상처 폐쇄의 절대 적인 정량화에 가장 적합하다고 믿습니다. 전체 마운트는 조직 섹션의 표준 조직 분석대 면역 국소화의 감소된 분해능을 제공하지만 표준 2D 조직학에서 누락된 추가 3D 정보를 제공합니다.
생체 모델의 전 생체 피부와 생체 내 피부의 치유를 평가하는 한 가지 주의 사항은 전신 반응이 부족하다는 것입니다. 상처 수리의 중요한 양상은 염증 및 후속 조직 과립이며, 이는 혈관(19)에서염증 세포 및 내피 세포의 유입에 의해 발생합니다. 이러한 제한에도 불구하고, ex vivo 피부는 여전히 세포 기반 상처 분석보다 임상 치유의 더 나은 회수를 제공합니다. 일반적으로 체외 실험은 조직 배양 플라스틱에서 자란 단일 세포 유형 단층 또는 공동 배양을 포함하지만 ex vivo 피부는 세포 행동을 탐구하는 네이티브 환경을 제공합니다. 최근에는 인공 매트릭스와 분리된 피부세포(20,21)로부터실험실 환경에서 피부가 자라는 다수의 피부 등가 시스템이등장하고있다. 이 모형은 대부분의 시험관 내 접근 보다는 더 나은 인간의 피부를 모방하더라도, 그(것)들은 아직도 완전히 네이티브 조직 환경을 시뮬레이션하지 않으며 일반적으로 재보적으로 상해를 입기 위하여 너무 허약합니다. 또한, 우리(및 그 외)는 전 생체 내 인간 피부 조직이 상주 면역 세포를 유지한다는 것을 입증했으며, 이는 의심할 여지 없이22,23을수리하는 데 기여할 것이다. 향후 작업은 이제 후기 단계 치유 평가24에대한 전 생체 모델의 생존력과 면역 역량을 확장하는 데 중점을 두어야 한다. 한 가지 옵션은 조직 생존가능성을 연장하고 문화25에서최대 2주 동안 네이티브 스킨 아키텍처를 유지할 수 있는 유망한 장기 온-어칩 기술의 발전이다. Ex vivo 모델은 또한 호중구와 같은 면역 세포를 숙주조직(26)에 성공적으로 통합하거나 면역 반응을 유도하기 위해 항체로 숙주 조직을 주입함으로써 피부 염증 반응의 중요성을 고려하기시작했다( 27) 우리는 이러한 사실 인정이 미래에 더 세련되고 번역 가능한 방법의 개발을 위한 도로를 포장할 것으로 예상합니다.
상처 폐쇄를 측정하기 위해 전 생체 균 피부를 사용하는 주요 이점은 병리학 (예 : 당뇨병 또는 노인) 조직과 건강한 (예 : 비 당뇨병 환자)에서 치유율을 비교하는 능력입니다. 여기에서 우리는 재상화와 장벽 형성이 실제로 건강한 전 생체 내 상처 대 당뇨병에서 실제로 손상된다는 것을 보여주었습니다. 실제로, 이것은 노화와 당뇨병이 만성 상처 개발을 위한 주요 위험 요소인 병리학 적 수리의 전 임상 평가를 위한 경로를 제공한다1. 체외 병리학 적 모델은 노인 및 당뇨병 조직으로부터 분리 된 세포, 또는 고혈당을 모방하기 위해 높은 포도당에서 배양 된세포(28,29)와같은 존재하지만, 이러한 세포는 생체 내 미세 환경에서 제거된 후 신속하게 표현형을 잃을 수 있습니다. 외외 병리학 적 치유 환경의 중요한 구성 요소는 노화와 당뇨병(30)모두에서 변경되는 진피 매트릭스입니다. 실제로, 이 혼란 매트릭스는 거주자와 순진한 섬유 아세포31,32의행동에 영향을 미친다. 따라서, 그들의 호스트 조직 환경에서 세포를 공부의 중요성을 과소 평가 할 수 없다.
요약하자면, 우리의 프로토콜은 인간의 상처를 다시 상피화하고, 규제 요인을 탐구하고, 잠재적 인 치료법의 타당성과 효능을 테스트하는 중요한 플랫폼을 제공합니다12,13. 전임상 테스트는 여전히 생체 내 접근법이 필요하지만, 전 생체 인간 조직과 생체 내 뮤린 상처를 사용하는 결합 된 전략은 전 임상 경로를 개선하여 동물 사용을 감소시키면서 종 간 번역성을 증가시켜야합니다.
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
우리는 환자 조직을 제공 씨 파올로 Matteuci와 미스터 조지 스미스에게 감사드립니다. 우리는 또한 미스 앰버 로즈 스태퍼드조직 수집 및 실험실 시설을 제공하는 데이지 호소를 지원해 주셔서 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| 50 mL Falcon Tubes | Falcon | 352070 | For skin washing |
| 1.5 ml TubeOne Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | For whole-mount staining |
| 48-Well CytoOne Plate, TC-Treated | Starlab | CC7682-7548 | For whole-mount staining |
| Acetic Acid Glacial | Fisher Chemical | A/0400/PB15 | Part of fixative |
| Alkyltrimethylammonium Bromide | Sigma-Aldrich | M7635 | Part of fixative |
| Anti-Alpha Smooth Muscle Actin Antibody [1A4] | Abcam | ab7817 | Stains blood vessels |
| Anti-Collagen I Antibody | Abcam | ab34710 | Stains collagen |
| Anti-Cytokeratin 14 Antibody [LL002] | Abcam | ab7800 | Stains epidermis |
| CD1A Antibody (CTB6) | Santa Cruz Biotechnology | sc-5265 | Stains Langerhans cells |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Thermo Fisher Scientific | 62247 | Counterstain for cell nuclei |
| Falcon 60mm Petri dishes | Falcon | 353004 | Human ex vivo culture |
| Fibronectin Antibody (EP5) | Santa Cruz Biotechnology | sc-8422 | Stains fibronectin |
| Formaldehyde, Extra Pure, Solution 37-41%, SLR | Fisher Chemical | F/1501/PB17 | Part of fixative |
| Gauze Swabs | Medisave | CS1650 | To clean skin |
| Gibco™ Antibiotic-Antimycotic Solution | Thermo Fisher Scientific | 15240062 | Human ex vivo culture |
| Gibco DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960044 | Human ex vivo culture |
| Gibco Fetal Bovine Serum | Thermo Fisher Scientific | 10500064 | Human ex vivo culture |
| Gibco HBSS, no calcium, no magnesium | Thermo Fisher Scientific | 14170088 | Human ex vivo culture |
| Gibco L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 | Human ex vivo culture |
| Hydrogen Peroxide | Sigma-Aldrich | H1009-100ML | For immunoperoxidase staining |
| ImageJ Software | National Institutes of Health | N/A | For image analysis |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Mouse, Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Rabbit, Alexa Fluor 594 | Thermo Fisher Scientific | A11012 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fisher Scientific | L3224 | For viability assessment of tissue |
| Iris Forceps, 10 cm, Curved, 1x2 teeth | World Precision Instruments | 15917 | To create wounds |
| Iris Scissors, 11 cm, Curved, SuperCut, Tungsten Carbide | World Precision Instruments | 501264 | To create wounds |
| Iris Scissors, 11 cm, Straight, SuperCut, Tungsten Carbide | World Precision Instruments | 501263 | To remove adipose tissue |
| Keratin 1 Polyclonal Antibody, Purified | Biolegend | 905201 | Stains epidermis |
| Keratin 14 Polyclonal Antibody, Purified | Biolegend | 905301 | Stains epidermis |
| LSM 710 Confocal Laser Scanning Microscope | Carl Zeiss | Discontinued | For fluorescent imaging |
| Merck Millipore Absorbent pads | Merck Millipore | AP10045S0 | Human ex vivo culture |
| Merck Millipore Nylon Hydrophilic Membrane Filters | Merck Millipore | HNWP04700 | Human ex vivo culture |
| Normal Goat Serum Solution | Vector Laboratories | S-1000-20 | Animal serum used depends on secondary antibody |
| Phosphate Buffer Solution | Sigma-Aldrich | P3619 | For wash buffer |
| Sodium Azide | Sigma-Aldrich | S2002 | For blocking buffer |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | Part of fixative |
| Sterilisation Pouches | Medisave | SH3710 | To sterilise instruments |
| Stiefel 2mm biopsy punches | Medisave | BI0500 | For partial thickness wound |
| Stiefel 6mm biopsy punches | Medisave | BI2000 | For outer explant |
| Thermo Scientific Sterilin Standard 90mm Petri Dishes | Thermo Fisher Scientific | 101VR20 | To prepare skin |
| Triton X-100 | Fisher Chemical | T/3751/08 | For wash buffer |
| VECTASTAIN Elite ABC-HRP Kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-6101 | For immunoperoxidase staining; HRP kit used depends on primary antibody |
| Vector NovaRED Substrate Kit, Peroxidase (HRP) | Vector Laboratories | SK-4800 | For immunoperoxidase staining |
| Wireless Digital Microscope | Jiusion | N/A | For brightfield imaging |
참고문헌
- Lindholm, C., Searle, R. Wound management for the 21st century: combining effectiveness and efficiency. International Wound Journal. 13, 5-15 (2016).
- Guest, J. F., et al. Health economic burden that different wound types impose on the UK's National Health Service. International Wound Journal. 14 (2), 322-330 (2017).
- Guest, J. F., Fuller, G. W., Vowden, P. Diabetic foot ulcer management in clinical practice in the UK: costs and outcomes. International Wound Journal. 15 (1), 43-52 (2018).
- López-Valverde, M. E., et al. Perioperative and long-term all-cause mortality in patients with diabetes who underwent a lower extremity amputation. Diabetes Research and Clinical Practice. 141, 175-180 (2018).
- Wilkinson, H. N., Hardman, M. J. The role of estrogen in cutaneous ageing and repair. Maturitas. 103, 60-64 (2017).
- Frykberg, R. G., Banks, J. Challenges in the treatment of chronic wounds. Advances in Wound Care. 4 (9), 560-582 (2015).
- Wilkinson, H. N., Hardman, M. J. Wound healing: cellular mechanisms and pathological outcomes. Open Biology. 10 (9), 200223 (2020).
- Ansell, D. M., Holden, K. A., Hardman, M. J. Animal models of wound repair: Are they cutting it. Experimental Dermatology. 21 (8), 581-585 (2012).
- Elliot, S., Wikramanayake, T. C., Jozic, I., Tomic-Canic, M. A modeling conundrum: murine models for cutaneous wound healing. Journal of Investigative Dermatology. 138 (4), 736-740 (2018).
- Mazio, C., et al. Pre-vascularized dermis model for fast and functional anastomosis with host vasculature. Biomaterials. 192, 159-170 (2019).
- Wilkinson, H. N., Iveson, S., Catherall, P., Hardman, M. J. A novel silver bioactive glass elicits antimicrobial efficacy against Pseudomonas aeruginosa and Staphylococcus aureus in an ex vivo skin wound biofilm model. Frontiers in Microbiology. 9, 1450 (2018).
- Wilkinson, H. N., et al. Elevated local senescence in diabetic wound healing is linked to pathological repair via CXCR2. Journal of Investigative Dermatology. 139 (5), 1171-1181 (2019).
- Wilkinson, H. N., et al. Tissue iron promotes wound repair via M2 macrophage polarization and the chemokine (CC motif) ligands 17 and 22. The American Journal of Pathology. 189 (11), 2196-2208 (2019).
- Rhea, L., Dunnwald, M. Murine excisional wound healing model and histological morphometric wound analysis. Journal of Visualized Experiments. 162, e61616 (2020).
- Ansell, D. M., Campbell, L., Thomason, H. A., Brass, A., Hardman, M. J. A statistical analysis of murine incisional and excisional acute wound models. Wound Repair and Regeneration. 22 (2), 281-287 (2014).
- Rizzo, A. E., Beckett, L. A., Baier, B. S., Isseroff, R. R. The linear excisional wound: an improved model for human ex vivo wound epithelialization studies. Skin Research and Technology. 18 (1), 125-132 (2012).
- Olsson, M., et al. The humanistic and economic burden of chronic wounds: a systematic review. Wound Repair and Regeneration. 27 (1), 114-125 (2019).
- Mendoza-Garcia, J., Sebastian, A., Alonso-Rasgado, T., Bayat, A. Optimization of an ex vivo wound healing model in the adult human skin: Functional evaluation using photodynamic therapy. Wound Repair and Regeneration. 23 (5), 685-702 (2015).
- Brownhill, V. R., et al. Pre-clinical assessment of single-use negative pressure wound therapy during in vivo porcine wound healing. Advances in Wound Care. , (2020).
- Diekmann, J., et al. A three-dimensional skin equivalent reflecting some aspects of in vivo aged skin. Experimental Dermatology. 25 (1), 56-61 (2016).
- Vidal Yucha, S. E., Tamamoto, K. A., Nguyen, H., Cairns, D. M., Kaplan, D. L. Human skin equivalents demonstrate need for neuro-immuno-cutaneous system. Advanced Biosystems. 3 (1), 1800283 (2019).
- Dijkgraaf, F. E., et al. Tissue patrol by resident memory CD8+ T cells in human skin. Nature Immunology. 20 (6), 756-764 (2019).
- He, X., de Oliveira, V. L., Keijsers, R., Joosten, I., Koenen, H. J. Lymphocyte isolation from human skin for phenotypic analysis and ex vivo cell culture. Journal of Visualized Experiments. (110), e52564 (2016).
- Pupovac, A., et al. Toward immunocompetent 3D skin models. Advanced Healthcare Materials. 7 (12), 1701405 (2018).
- Ataç, B., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Kim, J. J., et al. A microscale, full-thickness, human skin on a chip assay simulating neutrophil responses to skin infection and antibiotic treatments. Lab on a Chip. 19 (18), 3094-3103 (2019).
- Jardet, C., et al. Development and characterization of a human Th17-driven ex vivo skin inflammation model. Experimental Dermatology. 29 (10), 993-1003 (2020).
- Chen, J. L., et al. Metformin attenuates diabetes-induced tau hyperphosphorylation in vitro and in vivo by enhancing autophagic clearance. Experimental Neurology. 311, 44-56 (2019).
- Demirovic, D., Rattan, S. I. Curcumin induces stress response and hormetically modulates wound healing ability of human skin fibroblasts undergoing ageing in vitro. Biogerontology. 12 (5), 437-444 (2011).
- Wilkinson, H. N., Hardman, M. J. Wound senescence: A functional link between diabetes and ageing. Experimental Dermatology. 30 (1), 68-73 (2020).
- Fisher, G. J., et al. Collagen fragmentation promotes oxidative stress and elevates matrix metalloproteinase-1 in fibroblasts in aged human skin. The American Journal of Pathology. 174 (1), 101-114 (2009).
- Quan, T., Little, E., Quan, H., Voorhees, J. J., Fisher, G. J. Elevated matrix metalloproteinases and collagen fragmentation in photodamaged human skin: impact of altered extracellular matrix microenvironment on dermal fibroblast function. Journal of Investigative Dermatology. 133 (5), 1362 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유