Method Article
Модель раны человека Ex vivo и подход к окрашиванию цельного крепления для точной оценки восстановления кожи
В этой статье
Резюме
Здесь мы демонстрируем оптимизированную технику оценки заживления ран с использованием кожи человека ex vivo в сочетании с подходом окрашивания целиком. Эта методология обеспечивает доклиническую платформу для оценки потенциальных методов лечения ран.
Аннотация
Хронические незаживающие раны, которые в первую очередь поражают пожилых людей и диабетиков, являются значительной областью клинической неудовлетворенной потребности. К сожалению, современные методы лечения хронических ран являются неадекватными, в то время как имеющиеся доклинические модели плохо предсказывают клиническую эффективность новых методов лечения. Здесь мы описываем высокопроизводительную доклиническую модель для оценки нескольких аспектов реакции на восстановление кожи человека. Раны частичной толщины были созданы в коже человека ex vivo и культивированы в течение времени заживления. Биопсия раны кожи была собрана в фиксатор для процедуры окрашивания всего крепления. Фиксированные образцы блокировали и инкубировали в первичном антителе, причем обнаружение достигалось с помощью флуоресцентно конъюгированных вторичных антител. Раны были контрокрашиваемы и визуалированы с помощью конфокальной микроскопии перед расчетом процента закрытия раны (повторной эпителизации) в каждой биопсии. Применяя этот протокол, мы выявляем, что 2 мм эксцизионные раны, созданные в здоровой донорской коже, полностью повторно эпителизуются к 4-5 дню после ранения. Напротив, показатели закрытия диабетических ран кожи значительно снижаются, что сопровождается возмущенной барьерной реформацией. Сочетание ран кожи человека с новым подходом к окрашиванию цельным креплением позволяет быстро и воспроизводимо использовать метод количественной оценки восстановления ран ex vivo. В совокупности этот протокол предоставляет ценную человеческую платформу для оценки эффективности потенциальных методов лечения ран, трансформируя доклинические испытания и валидацию.
Введение
Хронические, незаживающие раны, которые широко распространены у пожилых людей и диабетиков, являются в значительной степени недооцененной областью клинической неудовлетворенной потребности. Эти раны представляют собой серьезное физическое и психологическое бремя для пациентов и обойдётся медицинским работникам в миллиарды долларов каждый год длялечения 1. Несмотря на улучшение понимания биологии ран и достижения в области технологий, до 40% хронических ран все еще не заживают в соответствии с лучшим стандартным уходом2. Так, 14-26% пациентов с диабетической язвой стопы впоследствии нуждаются в ампутации3,в то время как 5-летняя смертность после ампутации составляет примерно 70%4. В результате возникает настоятельная необходимость в разработке новых эффективных методов лечения для улучшения качества жизни пациентов при одновременном снижении существенного бремени здравоохранения, вызванного плохо заживающими ранами. Плохо прогностические доклинические модели остаются значительным препятствием для разработки эффективных новых методов лечения.
Восстановление раны - это динамичный и многогранный процесс, включающий в себя разнообразный спектр типов клеток, бесчисленные уровни коммуникации и тканевую среду, которая временно реконструируется. Заживление кожи подкрепляется четырьмя основными репаративными стадиями: гемостаз, воспаление, пролиферация и ремоделирование матрицы. Эти стадии в конечном итоге действуют, чтобы предотвратить потерю крови и инфекцию, закрыть раневую поверхность (процесс, называемый реэпителизацией) и вернуть кожу в неповреженое состояние5. Хронические раны связаны с различной этиологией и широко распространенным возмущением процессов заживления6,что еще больше усложняет идентификацию терапевтических мишеней. Тем не менее, был разработан широкий спектр моделей для выяснения молекулярных и клеточных факторов патологии ран и тестирования новых терапевтических подходов7.
Наиболее используемой моделью восстановления ран является острое ранение у мыши. Мыши очень хорошо поддаются механистическим исследованиям и предоставляют проверенные модели старения и диабета8. Несмотря на общее сходство, показанное среди мышиного и человеческого исцеления, различия между видами в структуре кожи и динамике заживления сохраняются. Это означает, что большинство исследований мыщерий не так легко перевести в клинику9. Следовательно, произошел толчок к человеческим системам in vitro и ex vivo с высокой применимостью и переводимостью10,11.
Здесь мы предоставляем подробный протокол для выполнения эксцизальных ран частичной толщины в ex vivo коже человека. Мы также описываем наш подход к окрашиванию всего крепления как высоко воспроизводимый метод оценки заживления кожи человека ex vivo. Показана траектория восстановления эпидермия (реэпителизации) и последующего формирования барьера, оценивая скорость закрытия раны у здоровой и диабетической кожи человека. Наконец, мы демонстрируем, как окрашивание цельного крепления может быть адаптировано для использования с целым рядом антител для оценки различных аспектов реакции на заживление.
протокол
Человеческая кожа была получена от пациентов, перенесших реконструктивную хирургию в больнице Касл-Хилл и Королевском лазарете Халла (Халл, Великобритания) при полном информированном письменном согласии пациента, институциональных руководящих принципах и этическом одобрении (LRECs: 17/SC/0220 и 19/NE/0150). Небиабетическая кожа была собрана у пациентов, перенесших обычную операцию (средний возраст = 68 лет). Диабетическая кожа была выбрана из доноров, у которых был диабет II типа и история изъязвления (средний возраст = 81 год). Образцы, полученные в результате операции, транспортировались в носителях и обрабатывались сразу по прибытии в лабораторию. Все экспериментальные этапы с использованием нефиксированной ткани человека выполнялись на уровне биобезопасности-2 (BSL-2) в шкафу биобезопасности с ламинарным потоком класса II.
1. Подготовка среды для культивирования кожи и окрашивающих реагентов
ПРИМЕЧАНИЕ: Все реагенты и расходные материалы приведены в Таблице материалов. Убедитесь, что все реагенты и оборудование, используемые для обработки и культивирование тканей человека, являются стерильными. Стерилизуйте инструменты перед использованием и обеззараживайте дезинфицирующим средством после контакта с тканью. Обеззараживать отходы в 1% дезинфицирующее средство перед утилизацией.
- Удерживающие среды: Дополнить высокоуглековую модифицированную орлиную среду (DMEM) Dulbecco l-глютамином и 4% (v/v) антибиотическим раствором.
- Сбалансированный солевой раствор Хэнка (HBSS) с антибиотиками: Добавьте 4% (v/v) антибиотико-антимикотический раствор к HBSS. Хранить при 4 °C до использования.
- Фосфатный буферизованный физиологический раствор Dulbecco (DPBS): Приготовьте DPBS путем растворения 9,6 г порошка DPBS на литр дистиллированной воды (dH2O). Автоклав для стерилизации и хранения при 4 °C до использования.
- Среда роста кожи человека: Дополняйте высокий уровень глюкозы DMEM 2 мМ L-глутамина, 1% (v/ v) антибиотик-антимикотический раствор и 10% (v / v) фетальную бычную сыворотку. Хранить при 4 °C до использования.
- Фиксатор кожи: До 450 мл dH2O, добавить 40 мл раствора формальдегида, 10 мл ледниковой уксусной кислоты, 4,5 г хлорида натрия и 0,25 г бромида алкилтриметиламмония. Хранить при комнатной температуре (RT) и использовать в течение нескольких дней.
ВНИМАНИЕ: Фиксатор опасен (раздражающий и легковоспламеняющийся). Обращаться с осторожностью и утилизировать по соответствующему маршруту. - Фосфатно-буферный физиологический раствор (PBS): Подготовьте PBS для окрашивания целиком, добавив 6 г хлорида натрия к 100 мл фосфатного буферного раствора и 900 мл dH2O.
- Окрашивание промывного буфера: Растворите 0,5% (v/v) Triton X-100 в PBS.
- Блокирующий буфер: Добавьте 0,2% (мас./об.) азида натрия и 2% (v/v) сыворотки животных в буфер для промывки окрашивания. Хранить при 4 °C до двух недель.
ПРИМЕЧАНИЕ: Блок в сыворотке вторичных антител вида-хозяина. Азид натрия предотвратит рост бактерий во время инкубации. - Рабочий раствор DAPI: Приготовьте запас 5 мг/мл 4',6-диамидино-2-фенилиндола (DAPI) в диметилсульфоксиде. Разбавьте запас 1:1000 в окрашивательном буфере для промывки, чтобы получить рабочий раствор DAPI 5 мкг/мл.
- Блок пероксидазы: Добавьте 0,3% (v/v) перекиси водорода в буфер для окрашивания. Хранить при 4 °C до использования. Хранить в темноте, чтобы предотвратить разложение.
- Комплект ABC-HRP:
- HRP-конъюгированное вторичное антитело: 1 капля биотинилированного кролика против козьего IgG в 5 мл окрашивающего буфера. Хранить при 4 °C до двух недель.
ПРИМЕЧАНИЕ: Используемый набор/вторичный будет зависеть от вида хозяина первичного антитела. - Реагент Авидин-биотинового комплекса (АВС): 2 капли реагента А и 2 капли реагента В в 5 мл окрашивающего промывного буфера. Реагент ABC следует приготовить не менее чем за 30 мин до начала использования. Хранить при 4 °C до двух недель.
- HRP-конъюгированное вторичное антитело: 1 капля биотинилированного кролика против козьего IgG в 5 мл окрашивающего буфера. Хранить при 4 °C до двух недель.
- Пероксидазный субстрат: 3 капли реагента 1, 2 капли реагента 2, 2 капли реагента 3 и 2 капли перекиси водорода в 5 мл dH 2 O. Субстрат пероксидазы долженбытьсвежеприготовлен непосредственно перед применением и не может храниться.
2. Подготовка кожи к ранам
ПРИМЕЧАНИЕ: Эти этапы должны выполняться в шкафу биобезопасности ламинарного потока класса II.
- Соберите кожу в носитель и транспортируете в шкаф BSL-2.
- Поместите дерму кожи стороной вниз в стерильную чашку Петри 90 мм и удалите жировую ткань стерильными ножницами.
- Поместите кожу в пробирку 50 мл, содержащую 25 мл HBSS с антибиотиками, в течение 10 мин при RT. Периодически встряхивайте, чтобы удалить остаточную кровь и жировую ткань.
- Повторите шаг 2.3, используя новую трубку 50 мл.
- Поместите кожу в свежую пробирку объемом 50 мл, содержащую 25 мл HBSS, на этот раз без антибиотиков в течение 10 минут при RT. Встряхните, как на шаге 2.3.
- Выполните окончательное ополаскивательное ополаскивательное ополаскиватель, поместив кожу в новую трубку с 25 мл DPBS. Теперь кожа готова к ране.
3. Создание ран кожи человека ex vivo
ПРИМЕЧАНИЕ: Эти этапы должны выполняться в шкафу биобезопасности ламинарного потока класса II.
- Подготовьте блюда для культивирования кожи перед нанесением ран. В чашку Петри 60 мм сложить две стерильные абсорбирующие прокладки и добавить 4 мл среды кожи человека через боковую часть чашки. Поместите стерильную нейлоновую фильтрующей мембрану на стопку абсорбирующих прокладок.
ПРИМЕЧАНИЕ: Кожные среды могут быть изменены в зависимости от требуемых условий лечения. На каждой стопке можно культивировать до трех раневых эксплантов. - Высушите кожную сторону кожи на стерильной марле в чашке Петри 90 мм, чтобы удалить остаточные DPBS.
ПРИМЕЧАНИЕ: Это предотвращает скольжение кожи при ранении. - Поместите дерму кожи стороной вниз на чистую крышку чашки Петри 90 мм и смажь эпидермис насухо свежей стерильной марлей.
ПРИМЕЧАНИЕ: Легче намотать кожу в крышку чашки Петри, чем в основание. Последующие работы следует проводить быстро, чтобы предотвратить пересыхание кожи. - Удерживая кожу подтянутой, прижмите 2 мм биопсийный перфоратор к коже и аккуратно закрутите. Не пробивайте кожу целиком.
ПРИМЕЧАНИЕ: Раны частичной толщины предназначены для пробивки эпидермиса и частично в дерму. Может наблюдаться вариабельность от донора к донору и от места к участку в силе, необходимой для создания раны частичной толщины. - Используйте изогнутые зубчатые тканевые щипцы, чтобы поднять каждую сторону раны 2 мм и зацепить изогнутые ножницы радужной оболочки под раной 2 мм, чтобы вырезать ее равномерно.
- Биопсия вокруг центральной раны 2 мм с использованием 6 мм биопсийного пунша для создания 6 мм экспланта с частичной толщиной 2 мм раны в центре.
ПРИМЕЧАНИЕ: 6 мм биопсийный удар может быть использован для оценки кожи, чтобы отметить, где должна быть каждая рана 2 мм. Позаботьтесь о том, чтобы не проткнуть ткань целиком. Создайте раневые экспланты в сотовом рисунке, чтобы уменьшить потери. - Поместите намотаные экспланты эпидермиса стороной вверх на нейлоновый фильтр мембранный стек (подготовленный на этапе 3.1).
ПРИМЕЧАНИЕ: При обращении с раневыми эксплантами будьте осторожны, чтобы не повредить центральную рану. Используйте небольшие щипцы и подберите каждый эксплант с противоположных сторон. - Инкубировать раны при 32-37 °C и 5% CO2 в увлажненной атмосфере (90-95%) в течение 1-7 дней. Заменяйте носители каждые 2-3 дня.
4. Полное окрашивание ран ex vivo
ПРИМЕЧАНИЕ: В этом разделе описываются методы иммунофлуоресценции и окрашивания иммунопероксидазой. Хорошо перемешайте все реагенты перед использованием.
- Метод флуоресцентного окрашивания
- Соберите раневые экспланты в микроцентрифужные трубки по 1,5 мл, содержащие 500 мкл фиксатора кожи, и инкубируйте при 4 °C на ночь.
ПРИМЕЧАНИЕ: Фиксатор, используемый в этом протоколе, хорошо работает для описанных антител. Оптимизация потребуется для других антител. Фиксация тканей более 24 ч может привести к чрезмерной фиксации. - На следующий день снимите фиксатор и замените 1 мл окрашивания промывного буфера. Биопсия может храниться в буфере для окрашивания при 4 °C до 2 недель до окрашивания.
ПРИМЕЧАНИЕ: Для всех этапов промывки буфера используйте серологическую пипетку или наконечник пипетки, заботясь о том, чтобы не повредить рану. - Аспирировать буфер для стирки окрашивания и выполнить еще одно ополаскивание 1 мл буфера для стирки окрашивания.
- Рассчитайте объем блокирующего буфера, необходимый для шагов 4.1.5-4.1.6 (количество выборок x 300 мкл = количество блокирующего буфера в мкл). При необходимости сделайте дополнительный буфер.
- Добавьте 150 мкл блокирующего буфера к каждому образцу и инкубируем в течение 1 ч при РТ. На всех этапах окрашивания убедитесь, что каждый образец достаточно покрыт и что нет пузырьков, покрывающих раневую поверхность биопсии.
ПРИМЕЧАНИЕ: Этот шаг вперед может быть выполнен в микроцентрифужных трубках 1,5 мл или в пластине из 48 скважин. Если вы используете пластину из 48 скважин, высиживая раны лицевой стороной вниз в каждой скважине. - Разбавляют первичное антитело в оставшемся блокирующем буфере.
ПРИМЕЧАНИЕ: Антимышиный кератин 14 (K14), разбавленный 1:1000 в блокирующем буфере, работает хорошо. Оптимизируйте этот шаг для использования с другими антителами или несколькими зондами. - Аспирировать блокирующий буфер и добавить 150 мкл первичного антитела на скважину/микроцентрифугу. Инкубировать раневые экспланты в первичном антителе при 4 °C в течение ночи.
- На следующий день аспирируют первичное антитело и смывают в окрашивающий промывочный буфер, содержащий 0,2% азида натрия в течение 1 ч при РТ (500 мкл на образец).
- Выполните еще три шага промывки с использованием буфера для окрашивания (30 минут на стирку, 500 мкл на образец).
- Разбавляют флуоресцентно конъюгированное вторичное антитело в окрашивании промывного буфера (например, козий антимыший антимыший 488 в разведении 1:400).
- Рассчитать необходимое количество вторичных антител (количество образцов х 150 мкл = количество в мкл).
- Добавьте 150 мкл вторичного антитела в каждую трубку скважины/микроцентрифуги. Инкубировать в течение 1 ч при RT. Выполнять инкубационные этапы 4.1.10 - 4.1.16 в темноте, так как вторичное антитело светочувствительно.
ПРИМЕЧАНИЕ: Этот шаг может быть выполнен при 4 °C в течение ночи, если это необходимо. Оптимизировать концентрацию вторичных антител, необходимую для адекватного сигнала и ограниченного фонового окрашивания. - Удалите вторичное антитело и выполните 3 х 30 мин полосканий с окрашивающим буфером для стирки (500 мкл на образец).
- Отбросьте оставшийся буфер промывки и рассчитайте необходимое количество рабочего раствора DAPI (в соответствии с шагом 4.1.11).
- Обрежет каждое эксплант 150 мкл рабочего раствора DAPI в течение 10 мин при RT.
ПРИМЕЧАНИЕ: DAPI окрашивает ядра клеток в синий цвет. Краситель Hoechst может быть использован в качестве альтернативы DAPI. - Выполните две заключительные 30-минутные промывки с буфером для окрашивания (500 мкл на образец). Биопсия может храниться в буфере окрашивания при 4 °C в темноте за две недели до визуализации.
- Соберите раневые экспланты в микроцентрифужные трубки по 1,5 мл, содержащие 500 мкл фиксатора кожи, и инкубируйте при 4 °C на ночь.
- Метод окрашивания Brightfield.
- Выполните шаги 4.1.1 - 4.1.3.
- Закалка эндогенной пероксидазной активности блоком пероксидазы при 4 °C в течение ночи.
ПРИМЕЧАНИЕ: Этот шаг важен при использовании HRP-конъюгированного антитела для уменьшения неспецифического фонового окрашивания из ткани. Высоковаскуляризированная ткань будет содержать больше эндогенной пероксидазной активности. - Отбросьте пероксидазный блок и дважды промойте в течение 30 минут в окрашивающей буфере для стирки.
- Выполните шаги 4.1.4 - 4.1.8.
ПРИМЕЧАНИЕ: Промывки после этапа 4.1.7 особенно важны для удаления азида натрия из образцов. Если азид натрия не удаляется должным образом, он инактивирует HRP и препятствует обнаружению окрашивания. - Добавляют 150 мкл HRP-конъюгированного вторичного антитела к каждой трубке скважины/микроцентрифуги и инкубируют в течение ночи при 4 °C или 1 ч при RT.
- Удалите вторичное антитело и выполните промывку 3 x 30 мин в окрашивающий буфер для стирки.
- Добавьте 150 мкл реагента ABC в каждую трубку скважины/микроцентрифуги и инкубируйте в течение ночи при 4 °C или 1 час при RT.
- Аспирируйте реагент ABC и выполняйте промывки 3 х 30 мин в буфере для окрашивания.
- Добавьте 150 мкл пероксидазного субстрата к одному экспланту и определите время, необходимое для обнаружения заметного изменения цвета.
ПРИМЕЧАНИЕ: Выберите образец, в котором ожидается сильное окрашивание. В этом случае красное кольцо показывает мигрирующие эпидермисы (К14). 3,3'-диаминобензидин-4 или любой другой соответствующий хромогенный субстрат может быть использован в качестве замены этого пероксидазного субстрата. - Как только наблюдается изменение цвета, удалите субстрат пероксидазы и замените 1 мл dH2O.
- Повторите обнаружение пероксидазного субстрата для других эксплантов, инкубирующих в течение времени, определенного на этапе 4.2.11.
- Промыть все экспланты 1 мл dH2O для удаления остаточного пероксидазного субстрата. Хотя экспланты могут храниться до одной недели при 4 °C до получения изображения, лучше визуализировать их как можно скорее, чтобы предотвратить выщелачивание пероксидазной подложки в dH2O с течением времени.
5. Визуализация и количественная оценка
- Флуоресцентная визуализация
ПРИМЕЧАНИЕ: Флуоресцентная визуализация выполняется с использованием конфокального лазерно-сканирующего микроскопа. Тем не менее, перевернутого флуоресцентного микроскопа может быть достаточно для получения 2D-изображений для количественной оценки скорости закрытия раны. При выборе вторичных антител убедитесь, что выбранные фторхромы совместимы с спектрами возбуждения и излучения имеющегося оборудования для микроскопии.- Используйте конфокальный лазерно-сканирующий микроскоп, оснащенный объективом 2,5x, 10x и 20x, моторизованной сценой x-y-z, цифровой камерой и программным обеспечением для сбора. Включите детектор пропускаемого света (TPMT), чтобы упростить визуализацию каждой биопсии и измерить общее закрытие раны. В качестве альтернативы, измерьте каждую рану с помощью микроскопии Brightfield после флуоресцентной визуализации.
- Поместите 60-миллиметровую основу чашки Петри на платформу визуализации и добавьте тонкий слой (около 1 мл) DPBS.
ПРИМЕЧАНИЕ: Если используется слишком много DPBS, биопсия будет перемещаться во время визуализации. В качестве альтернативы используйте пластину на 48 скважин, если имеется держатель пластины. - Используйте небольшие тканевые щипцы для переноса раневых эксплантов из трубок скважин/микроцентрифуг в чашку Петри, содержащую DPBS. Поместите намотаную биопсию стороной вниз в чашку Петри.
- Используйте окуляр и люминесцентную лампу, чтобы найти и сфокусироваться на ране. Если пузырьки застряли под образцом в поле зрения, подберите рану тканевыми щипцами и перепозиционируемой.
- Настройте программное обеспечение для визуализации, обеспечив равный размер точечного отверстия между каналами для оптимальной конфокальности. Для этого проверьте значение одной воздушной единицы для каждого канала и выберите наибольшее значение. Выберите скорость сканирования, качество изображения и усреднение.
ПРИМЕЧАНИЕ: Фторхромы конъюгированных вторичных антител и выбранное контрокрастина (например, DAPI) будут диктовать необходимые каналы. - Включите программное обеспечение для сбора данных в реальном времени и отрегулируйте мощность лазера и коэффициент усиления каждого канала до уровней, необходимых для визуализации окрашивания. Уменьшите фоновый шум за счет увеличения цифрового смещения.
- Расположите рану в центре плоскости визуализации.
ПРИМЕЧАНИЕ: Если рана не заполняет все изображение из-за использования меньшего объектива или создания более крупной раны, возьмите панель изображений и сшивайте их вместе (вручную или с функцией укладки плитки в соответствующем программном обеспечении для визуализации). - Получить изображения раневой биопсии. Используйте одни и те же параметры изображения между эксплантами.
ПРИМЕЧАНИЕ: Изображения с более высокой мощностью позволят оценить структуры тканей и экспрессию и местоположение клеточных маркеров. - Собирайте серийные Z-стопки через рану, особенно там, где ткань не совсем плоская против чашки Петри. Используйте аналитическое программное обеспечение, чтобы свернуть стек Z в одно проекционное изображение максимальной интенсивности.
- Визуализация Брайтфилда
ПРИМЕЧАНИЕ: Визуализация Brightfield окрашенных иммунопероксидазой биопсий может быть выполнена несколькими способами.- Визуализация в инвертированном микроскопе: Подготовка раневых эксплантов к визуализации путем помещения их в чашку Петри/колодец, как описано в шагах 5.1.2-5.1.3. Получайте цифровые изображения при ярком освещении поля на перевернутом микроскопе, оснащенном цифровой камерой. При необходимости сшите несколько изображений.
- Беспроводная цифровая микроскопическая визуализация: используйте беспроводной цифровой микроскоп, подключенный к телефону или ноутбуку, для получения высококачественных изображений экономически эффективным способом. Поместите экспланты, намотанные стороной вверх, на некоторую ткань и удалите остаточный dH2O (или буфер для промывки окрашивания) из хранилища образцов. Расположите раневую эксплант в центре поля зрения микроскопа. Получайте изображения с помощью подключенной камеры.
- Квантификация
ПРИМЕЧАНИЕ: Процент закрытия раны может быть количественно определен в любом программном обеспечении, которое позволяет рисовать и измерять формы от руки. ImageJ можно использовать для выполнения количественной оценки следующим образом:- Откройте изображение для количественной оценки в программном обеспечении ImageJ.
- Используйте инструмент «Форма от руки», чтобы нарисовать вокруг внешней стороны повторно эпителиализованной раны, где она встречается с нормальной кожей. Нажмите клавишу M (или Анализ | Измерение), чтобы получить измерение «внешней» площади.
ПРИМЕЧАНИЕ: Текстура реэпителизированной раневой ткани отличается от нормальной кожи. Изображения не нужно масштабировать перед этим типом анализа. - Используйте инструмент «Форма от руки», чтобы рисовать вокруг открытой области раны. Именно здесь открытая рана встречается с внутренним краем реэпителиализирующей ткани. Нажмите клавишу M (или Анализ | Измерение), чтобы получить измерение «внутренней» площади.
- Используйте следующее уравнение для получения процентной доли повторного эпителизации/закрытия раны:
% закрытия = (Наружная область раны - Внутренняя область раны) / (Внешняя область раны) x 100
ПРИМЕЧАНИЕ: Процентная площадь покрытия антител может быть выведена таким же образом (например, K14) или в процентах от общей площади раны. Процентная интенсивность также может предоставлять полукомитную информацию о экспрессии маркеров, представляющих интерес на уровне тканей, в то время как высокопроизводительная визуализация представляет данные экспрессии на клеточном уровне.
Результаты
В этом отчете мы представляем новый подход к ранам кожи ex vivo и окрашиванию всего крепления для оценки факторов, влияющих на реакцию восстановления кожи человека. На фиг.1А показана схема процедурного трубопровода, который может быть выполнен за 3-10 дней, в зависимости от времени инкубации раны. Раны частичной толщины культивируются на мембранных стеках на воздухе: мембранной границе раздела и могут быть собраны для окрашивания цельным креплением, встроены в парафиновую или ОКТ-среду для общей гистологии или заморожены в жидком азоте для биохимического анализа(рисунок 1В). Обычно мы создаем раны частичной толщины 2 мм в центре 6 мм эксплантов. Однако размер раны и окружающего экспланта может быть изменен в зависимости от требований. Процедура whole-mount была успешно адаптирована как для иммунопероксидазных, так и для иммунофлуоресцентных методов окрашивания(рисунок 1C).
Иммунофлуоресценция позволяет прощупвать ткани с несколькими антителами. Для этого мы советуем использовать первичные антитела, выращенные у разных видов, и флуоресцентно конъюгированные вторичные антитела, чтобы ограничить межвидовую реактивность. Концентрации антител и время инкубации должны быть оптимизированы. Если наблюдается фоновое окрашивание, уменьшите концентрацию антител, увеличьте шаги промывки и добавьте блокирующий буфер к вторичному антителу. Жизнеспособность свежих тканей может быть непосредственно оценена с помощью красителей коммерческой жизнеспособности (см. Таблицу материалов). Мы также показываем, что ткань может быть зафиксирована после окрашивания жизнеспособности и успешно изображена, когда она практически подходит(рисунок 1D).
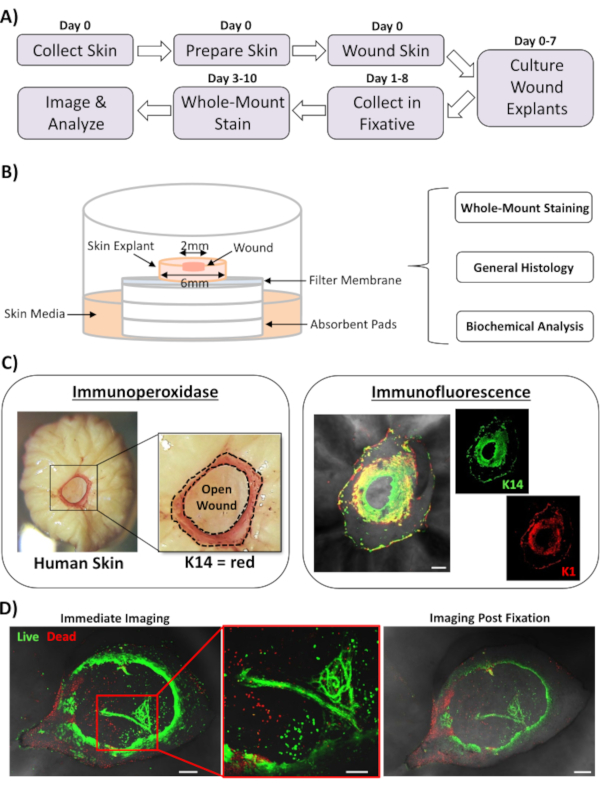
Рисунок 1:Подход к ранированию человека ex vivo и окрашиванию целиком. (A) Конвейер, изображающий процедурный рабочий процесс от сбора кожи и выполнения ранения ex vivo до окрашивания тканей и анализа данных. (B)Диаграмма, демонстрирующая систему посева ран кожи человека ex vivo с анализами, обычно выполняемыми на ткани. (C) Окрашивание цельным креплением может быть использовано с использованием как иммунопероксидазы, так и методов иммунофлуоресценции. K14 = кератин 14. (D) Живая ткань может быть окрашена красителями коммерческой жизнеспособности и успешно изображена после фиксации. Бар = 100 мкм. Это окрашивание проводилось на коже без диабета. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Наиболее широко применимым применением для окрашивания ран целиком является определение скорости закрытия раны более воспроизводимым способом, чем это может быть обеспечено с помощью гистологического сечения. Процент закрытия был количественно определен как процент повторного эпителизации раневой поверхности, как показано на рисунке 2А. Процентное покрытие площади конкретных маркеров может быть измерено от общей площади раны или в процентах от повторно эпителизированной раны. Мы характеризовали заживление в здоровой (не диабетической) и диабетической коже в течение семи дней, собирая раны в каждый день после ранения (репрезентативные изображения, рисунок 2B). Здоровые кожные раны закрывались со временем, как и ожидалось, при этом полное закрытие наблюдалось в большинстве образцов к 4-5 дню. Напротив, диабетические раны кожи не смогли полностью закрыться в течение семидневного периода анализа(рисунок 2C). Значительная задержка закрытия ран наблюдалась между здоровыми и диабетическими ранами кожи при сравнении показателей заживления в каждый момент времени после травмы(P < 0,001 до 6-го дня, P < 0,05 на 6-й день и P < 0,05 до P < 0,001 на 7-й день).
После оценки общих показателей закрытия ран; мы измерили процент всей раневой области (внешняя область на рисунке 2A),где можно было визуализировать положительные клетки K14 (зеленое окрашивание на рисунке 2B). Интересно, что мы наблюдали, что при здоровых ранах кожи ex vivo окрашивание K14 достигало пика на 2-й день, а затем быстро снижалось (значение в каждой точке времени по сравнению с пиком дня 2, рисунок 2D). Это, вероятно, отражает перерайновление раннего эпидермального барьера, исключая проникновение антитела К14 через дифференцированные эпидермальные слои (см. схему на рисунке 2Е). Во время процесса реэпителизации базальный слой (K14+ve) кератиноциты мигрируют внутрь по открытой ране таким образом, что эпидермис ближе к внешнему краю раны образуется раньше, чем эпидермис ближе к внутреннему краю раны (мигрируя спереди). В то время как передний край вновь образованного эпидермиса продолжает мигрировать, чтобы закрыть оставшуюся открытую рану, наружный край эпидермиса начинает дифференцироваться, чтобы реформировать другие эпидермальные слои. Таким образом, при раннем заживлении мы ожидаем увидеть большую часть повторно эпителиализованной области, состоящую из базальных (K14 + ve) клеток, в то время как при более позднем восстановлении окрашивание K14 теряется, поскольку эпидермис дифференцируется от внешней внутрь (см. изображения цельного крепления на рисунке 2E). Таким образом, снижение окрашивания K14, показанное на рисунке 2D (стрелки вниз), коррелирует с повышенной эпидермальной дифференцировкой. Интересно, что видимое окрашивание K14 достигло пика ранее в здоровых (день 2) по сравнению с диабетическими (день 4) ранами, что еще раз демонстрирует, что реэпителизация и последующая эпидермальная дифференцировка задерживаются в диабетических ранах кожи.
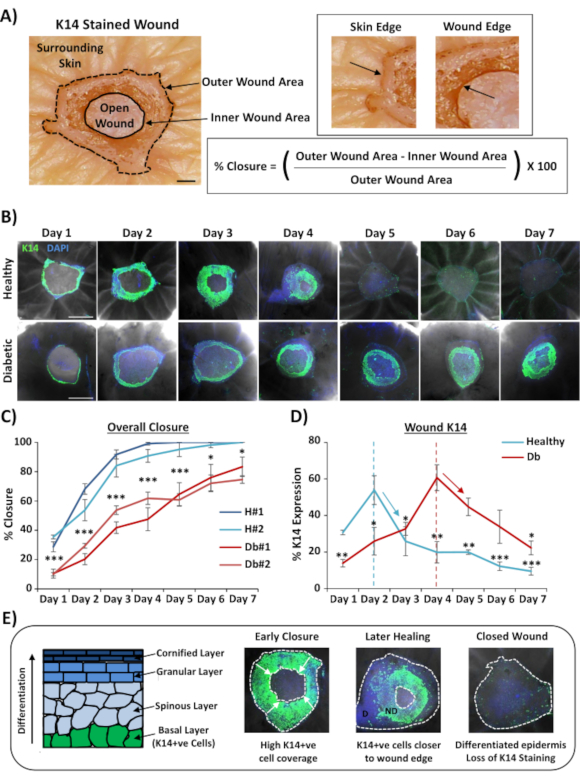
Рисунок 2:Окрашивание цельным креплением показывает возмущенные темпы заживления у диабетической и здоровой кожи. (A) Метод, используемый для количественной оценки закрытия раны из внешних и внутренних измерений раны. На снимках Brightfield видно окрашивание кератина 14 (K14) в красный цвет. Bar = 300 мкм. (B) Репрезентативные изображения заживления с течением времени (день после ранения) в здоровой и диабетической коже. Бар = 500 мкм. K14 = зеленый. DAPI = синие ядра. (C)Количественная оценка частоты закрытия ран (процентная реэпителизация), показывающая, что раны ex vivo со здоровой кожей закрываются значительно быстрее, чем раны ex vivo с диабетической кожи. H = здоровый. Db = диабетический. (D) Процент окрашивания K14 достигает пика ранее в здоровой и диабетической коже, а затем снижается в соответствии с увеличением эпидермальной дифференцировки (стрелки вниз). (E)K14 (базальная эпидермальная клетка) окрашивание теряется по мере дифференцировки эпидермиса. D = дифференцированный. ND = не дифференцировано. Белые пунктирные линии изображают внутренние и внешние края раны. Белые стрелки = направление миграции. n = 6 ран на одного донора, на момент времени. Среднее значение +/- SEM. * = P < 0,05, ** = P < 0,01 и *** = P < 0,001. Здоровые и диабетические сравниваются в каждый момент времени заживления в C (значениеP для наименее значимого сравнения). Временное изменение окрашивания K14 по сравнению с пиком для каждого донора в D. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Затем мы использовали окрашивание цельным креплением для изучения экспрессии тканей и локализации других раневых маркеров в несайбетической коже(рисунок 3). Все используемые антитела и их рабочие концентрации приведены в Таблице материалов. Кровеносные сосуды в открытой ране положительно окрашены альфа-гладкомышечные актиновые (a-SMA) антитела, используемые в комбинации с K14 для очерчивания краев эпидермиса на изображениях с более низкой мощностью(рисунок 3A). Дермальный матрикс окрашивали антителами против коллагена I типа (COL 1) и фибронектина (Fn). Здесь коллаген наблюдался в виде обильных толстых волокон, в то время как волокна фибронектина были редкими, волнистыми и тонкими(рисунок 3А). Наш подход к окрашиванию всего крепления также способен обеспечить разрешение окрашивания на клеточном уровне, как показано для K14-положительных кератиноцитов(рисунок 3B).
Наконец, мы показываем, что человеческие раны ex vivo обладают резидентными иммунными клетками, причем клетки Лангерганса обнаруживаются вокруг вновь образованного эпидермиса на 3-й день после ранения(рисунок 3C). Действительно, эти результаты свидетельствуют о том, что окрашивание целиком может быть использовано для исследования ключевых особенностей реакции заживления, включая воспаление, пролиферацию и внеклеточный матрикс(рисунок 4A). Взятые вместе, наши данные показывают, что комбинированная процедура ранирования кожи ex vivo и окрашивания всего крепления является действительным методом оценки различных аспектов здорового и диабетического (патологического) восстановления кожи человека.
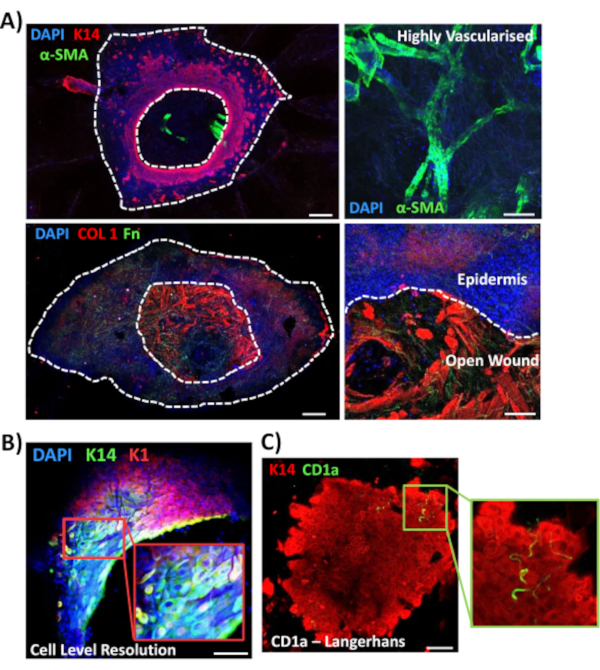
Рисунок 3:Оптимизация подхода окрашивания всего крепления для использования с другими антителами. (A) Кровеносные сосуды окрашивали альфа-актином гладких мышц (α-SMA, зеленый) и кератином 14 (K14, красный), в то время как матричные волокна окрашивали коллагеном I (COL 1, красный) и фибронектином (Fn, зеленый). (B)Процедура полного монтажа обеспечивает разрешение локализации до уровня ячейки (K14, зеленый; К1, красный). (C)CD1a+ve клетки Лангерганса (зеленые), наблюдаемые во вновь образованном эпидермисе. DAPI = синие ядра. Бар = 100 мкм. Белые пунктирные линии показывают внутренние и внешние края раны и отделяют рану от эпидермиса. Это окрашивание проводилось на коже без диабета. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
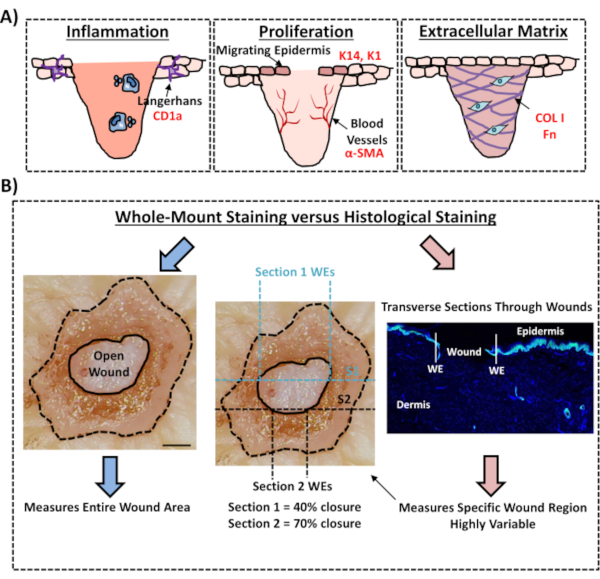
Рисунок 4:Валидность процедуры окрашивания всего крепления для оценки заживления ран. (A) Иллюстрация, изображающая, как метод окрашивания всего крепления может оценивать процессы, относящиеся к ране. Используемые антитела = красный текст. K14 = кератин 14. COL 1 = коллаген 1. Fn = фибронектин. (B) Процедура окрашивания всего крепления (синие стрелки) вносит меньшую изменчивость в измерения закрытия раны, чем стандартный гистологический анализ (красные стрелки). S1 = раздел 1. WE = замотанные края. Бар = 300 мкм. Это окрашивание проводилось на коже без диабета. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В этом экспериментальном протоколе мы описываем оптимизированный метод оценки закрытия раны в коже человека ex vivo с использованием окрашивания тканей цельного крепления. Это важный ресурс, позволяющий критически оценить потенциальные методы лечения ран и обеспечить лучшее понимание реакции человека на восстановление ран. Мы опубликовали оценку заживления ран кожи ex vivoранее 12,13,но в этих отчетах подход к окрашиванию всего крепления не использовался для измерения закрытия раны. Окрашивание цельным креплением намного проще и требует меньшего технического опыта, чем стандартная гистология, которая включает в себя встраивание парафина или ОКТ и секционирование образцов. Процедура полного крепления также снижает экспериментальную изменчивость, позволяя количественно оценить всю рану, а не только один поперечный участок в определенном положении в ткани (см. Рисунок 4B для сравнительной иллюстрации). Мы полностью поддерживаем важность количественного заживления всей несимметричной структуры раны, как это четко изложено Реей и Даннвальдом для мышиных острых ран14. Эти авторы показали важность последовательного секционирования in vivo эксцизионных ран для воспроизводимых и точных измерений морфологии раны. Серийное сечение может в равной степени применяться к ранам человека ex vivo; однако для точной количественной оценки закрытия раны и повторной эпителизации предпочтительным методом должно быть высокопроизводительное окрашивание всего крепления. Отметим, что этот протокол окрашивания всего крепления также должен быть совместим с последующей обработкой (воск или ОКТ) для традиционного гистологического анализа.
Окрашивание цельным креплением не лишено недостатков. Хотя он обеспечивает более высокую воспроизводимость в экспериментах по заживлению ран, он требует использования большего количества тканей для анализа, чем стандартные гистологические методы. Это может быть проблемой, когда доступ к тканям ограничен, особенно там, где необходимо оценить несколько антител. Альтернативным подходом было бы использование метода разрезанного ранирования, при котором ширина раны относительно равномерна, а изменчивость снижается (как показано в ранах мышей и человека15,16). Однако эксцизные раны остаются более применимыми к большинству патологических ран типов17.
В этом исследовании раны частичной толщины 2 мм были созданы в центре 6 мм эксплантов кожи. Этот метод может быть оптимизирован для альтернативных размеров эксцизионных ран и эксплантов на разных глубинах кожи18. Кроме того, сила, необходимая для создания ран, будет варьироваться между донорами, где стареющая кожа будет требовать меньше силы для биопсии. Мы также избегаем использования кожи, отображающей заметные растяжки или другие структурные изменения. Мы проверили ряд антител для рассмотрения различных аспектов реакции заживления ex vivo. Этот протокол также может быть использован с другими антителами, относящимися к коже, где концентрации антител и время инкубации должны быть оптимизированы. Тем не менее, мы считаем, что наш протокол наиболее подходит для абсолютной количественной оценки общего закрытия раны с последующей пространственной оценкой конкретных белков, представляющих интерес. В то время как цельное крепление обеспечивает снижение разрешения иммунолокализации по сравнению со стандартным гистологическим анализом участков тканей, оно предоставляет дополнительную 3D-информацию, отсутствующую в стандартной 2D-гистологии.
Одно из предостережений при оценке заживления кожи ex vivo по сравнению с моделями in vivo заключается в том, что ему не хватает системного ответа. Важным аспектом заживления ран является воспаление и последующая грануляция тканей, которая вызвана притоком воспалительных клеток и эндотелиальных клеток из сосудистой клетки19. Несмотря на это ограничение, кожа ex vivo по-прежнему обеспечивает лучшее повторение клинического заживления, чем анализы ран на основе клеток. Эксперименты in vitro в целом включают монослои одноклеточного типа или совместные культуры, выращенные на пластике тканевой культуры, тогда как кожа ex vivo обеспечивает нативную среду для изучения поведения клеток. Совсем недавно появился ряд кожных эквивалентных систем, где кожа выращивается в лабораторных условиях из искусственного матрикса и изолированных клеток кожи20,21. Хотя эти модели имитируют кожу человека лучше, чем большинство подходов in vitro, они все еще не полностью имитируют среду нативной ткани и, как правило, слишком хрупкие, чтобы воспроизводимо травмировать. Кроме того, мы (и другие) продемонстрировали, что ткань кожи человека ex vivo сохраняет резидентные иммунные клетки, которые, несомненно, будут способствовать восстановлению22,23. Будущая работа теперь должна быть сосредоточена на расширении жизнеспособности и иммунокомпетентности модели ex vivo для оценки заживления на поздней стадии24. Одним из вариантов является дальнейшее продвижение перспективных технологий «орган на чипе», способных продлить жизнеспособность тканей и поддерживать нативную архитектуру кожи на срок до двух недель в культуре25. Модели ex vivo также начали учитывать важность воспалительной реакции кожи путем успешного включения иммунных клеток, таких как нейтрофилы, в ткань хозяина26 или введения в ткань хозяина антител для вызова иммунной реакции27. Мы ожидаем, что эти результаты проложат путь к разработке более совершенных и переводимых методов в будущем.
Основным преимуществом использования кожи ex vivo для измерения закрытия раны является возможность сравнивать показатели заживления в здоровой (например, недиабетической) и патологической (например, диабетической или пожилой) ткани. Здесь мы показали, что реэпителизация и формирование барьера действительно нарушаются при диабетических и здоровых ранах ex vivo. Действительно, это обеспечивает путь для доклинической оценки патологического восстановления, где старение и диабет являются основными факторами риска развития хроническихран1. В то время как существуют патологические модели in vitro, такие как клетки, выделенные из пожилой и диабетической ткани, или клетки, культивируемые в высоком уровне глюкозы для имитации гипергликемии28,29,эти клетки могут быстро потерять свой фенотип после удаления из микросреды in vivo. Важным компонентом внешней патологической заживляющей среды является дермальный матрикс, который изменяется как при старении, так и при диабете30. Действительно, эта возмущенная матрица влияет на поведение резидентных и наивных фибробластов31,32. Таким образом, важность изучения клеток в среде тканей хозяина нельзя недооценивать.
Таким образом, наш протокол предоставляет важную платформу для количественной оценки реэпителизации ран человека, изучения регуляторных факторов и проверки достоверности и эффективности потенциальных терапевтических средств12,13. В то время как доклинические испытания по-прежнему требуют подходов in vivo, комбинированная стратегия с использованием ex vivo человеческих тканей и in vivo мышиных ран должна усовершенствовать доклинический путь, уменьшая использование животных при одновременном повышении межвидовой переводимости.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Мы хотели бы поблагодарить г-на Паоло Маттеучи и г-на Джорджа Смита за предоставление тканей пациента. Мы также благодарны мисс Эмбер Роуз Стаффорд за помощь в сборе тканей и Призыву Дейзи за предоставление лабораторных помещений.
Материалы
| Name | Company | Catalog Number | Comments |
| 50 mL Falcon Tubes | Falcon | 352070 | For skin washing |
| 1.5 ml TubeOne Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | For whole-mount staining |
| 48-Well CytoOne Plate, TC-Treated | Starlab | CC7682-7548 | For whole-mount staining |
| Acetic Acid Glacial | Fisher Chemical | A/0400/PB15 | Part of fixative |
| Alkyltrimethylammonium Bromide | Sigma-Aldrich | M7635 | Part of fixative |
| Anti-Alpha Smooth Muscle Actin Antibody [1A4] | Abcam | ab7817 | Stains blood vessels |
| Anti-Collagen I Antibody | Abcam | ab34710 | Stains collagen |
| Anti-Cytokeratin 14 Antibody [LL002] | Abcam | ab7800 | Stains epidermis |
| CD1A Antibody (CTB6) | Santa Cruz Biotechnology | sc-5265 | Stains Langerhans cells |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Thermo Fisher Scientific | 62247 | Counterstain for cell nuclei |
| Falcon 60mm Petri dishes | Falcon | 353004 | Human ex vivo culture |
| Fibronectin Antibody (EP5) | Santa Cruz Biotechnology | sc-8422 | Stains fibronectin |
| Formaldehyde, Extra Pure, Solution 37-41%, SLR | Fisher Chemical | F/1501/PB17 | Part of fixative |
| Gauze Swabs | Medisave | CS1650 | To clean skin |
| Gibco™ Antibiotic-Antimycotic Solution | Thermo Fisher Scientific | 15240062 | Human ex vivo culture |
| Gibco DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960044 | Human ex vivo culture |
| Gibco Fetal Bovine Serum | Thermo Fisher Scientific | 10500064 | Human ex vivo culture |
| Gibco HBSS, no calcium, no magnesium | Thermo Fisher Scientific | 14170088 | Human ex vivo culture |
| Gibco L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 | Human ex vivo culture |
| Hydrogen Peroxide | Sigma-Aldrich | H1009-100ML | For immunoperoxidase staining |
| ImageJ Software | National Institutes of Health | N/A | For image analysis |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Mouse, Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Rabbit, Alexa Fluor 594 | Thermo Fisher Scientific | A11012 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fisher Scientific | L3224 | For viability assessment of tissue |
| Iris Forceps, 10 cm, Curved, 1x2 teeth | World Precision Instruments | 15917 | To create wounds |
| Iris Scissors, 11 cm, Curved, SuperCut, Tungsten Carbide | World Precision Instruments | 501264 | To create wounds |
| Iris Scissors, 11 cm, Straight, SuperCut, Tungsten Carbide | World Precision Instruments | 501263 | To remove adipose tissue |
| Keratin 1 Polyclonal Antibody, Purified | Biolegend | 905201 | Stains epidermis |
| Keratin 14 Polyclonal Antibody, Purified | Biolegend | 905301 | Stains epidermis |
| LSM 710 Confocal Laser Scanning Microscope | Carl Zeiss | Discontinued | For fluorescent imaging |
| Merck Millipore Absorbent pads | Merck Millipore | AP10045S0 | Human ex vivo culture |
| Merck Millipore Nylon Hydrophilic Membrane Filters | Merck Millipore | HNWP04700 | Human ex vivo culture |
| Normal Goat Serum Solution | Vector Laboratories | S-1000-20 | Animal serum used depends on secondary antibody |
| Phosphate Buffer Solution | Sigma-Aldrich | P3619 | For wash buffer |
| Sodium Azide | Sigma-Aldrich | S2002 | For blocking buffer |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | Part of fixative |
| Sterilisation Pouches | Medisave | SH3710 | To sterilise instruments |
| Stiefel 2mm biopsy punches | Medisave | BI0500 | For partial thickness wound |
| Stiefel 6mm biopsy punches | Medisave | BI2000 | For outer explant |
| Thermo Scientific Sterilin Standard 90mm Petri Dishes | Thermo Fisher Scientific | 101VR20 | To prepare skin |
| Triton X-100 | Fisher Chemical | T/3751/08 | For wash buffer |
| VECTASTAIN Elite ABC-HRP Kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-6101 | For immunoperoxidase staining; HRP kit used depends on primary antibody |
| Vector NovaRED Substrate Kit, Peroxidase (HRP) | Vector Laboratories | SK-4800 | For immunoperoxidase staining |
| Wireless Digital Microscope | Jiusion | N/A | For brightfield imaging |
Ссылки
- Lindholm, C., Searle, R. Wound management for the 21st century: combining effectiveness and efficiency. International Wound Journal. 13, 5-15 (2016).
- Guest, J. F., et al. Health economic burden that different wound types impose on the UK's National Health Service. International Wound Journal. 14 (2), 322-330 (2017).
- Guest, J. F., Fuller, G. W., Vowden, P. Diabetic foot ulcer management in clinical practice in the UK: costs and outcomes. International Wound Journal. 15 (1), 43-52 (2018).
- López-Valverde, M. E., et al. Perioperative and long-term all-cause mortality in patients with diabetes who underwent a lower extremity amputation. Diabetes Research and Clinical Practice. 141, 175-180 (2018).
- Wilkinson, H. N., Hardman, M. J. The role of estrogen in cutaneous ageing and repair. Maturitas. 103, 60-64 (2017).
- Frykberg, R. G., Banks, J. Challenges in the treatment of chronic wounds. Advances in Wound Care. 4 (9), 560-582 (2015).
- Wilkinson, H. N., Hardman, M. J. Wound healing: cellular mechanisms and pathological outcomes. Open Biology. 10 (9), 200223 (2020).
- Ansell, D. M., Holden, K. A., Hardman, M. J. Animal models of wound repair: Are they cutting it. Experimental Dermatology. 21 (8), 581-585 (2012).
- Elliot, S., Wikramanayake, T. C., Jozic, I., Tomic-Canic, M. A modeling conundrum: murine models for cutaneous wound healing. Journal of Investigative Dermatology. 138 (4), 736-740 (2018).
- Mazio, C., et al. Pre-vascularized dermis model for fast and functional anastomosis with host vasculature. Biomaterials. 192, 159-170 (2019).
- Wilkinson, H. N., Iveson, S., Catherall, P., Hardman, M. J. A novel silver bioactive glass elicits antimicrobial efficacy against Pseudomonas aeruginosa and Staphylococcus aureus in an ex vivo skin wound biofilm model. Frontiers in Microbiology. 9, 1450 (2018).
- Wilkinson, H. N., et al. Elevated local senescence in diabetic wound healing is linked to pathological repair via CXCR2. Journal of Investigative Dermatology. 139 (5), 1171-1181 (2019).
- Wilkinson, H. N., et al. Tissue iron promotes wound repair via M2 macrophage polarization and the chemokine (CC motif) ligands 17 and 22. The American Journal of Pathology. 189 (11), 2196-2208 (2019).
- Rhea, L., Dunnwald, M. Murine excisional wound healing model and histological morphometric wound analysis. Journal of Visualized Experiments. 162, e61616 (2020).
- Ansell, D. M., Campbell, L., Thomason, H. A., Brass, A., Hardman, M. J. A statistical analysis of murine incisional and excisional acute wound models. Wound Repair and Regeneration. 22 (2), 281-287 (2014).
- Rizzo, A. E., Beckett, L. A., Baier, B. S., Isseroff, R. R. The linear excisional wound: an improved model for human ex vivo wound epithelialization studies. Skin Research and Technology. 18 (1), 125-132 (2012).
- Olsson, M., et al. The humanistic and economic burden of chronic wounds: a systematic review. Wound Repair and Regeneration. 27 (1), 114-125 (2019).
- Mendoza-Garcia, J., Sebastian, A., Alonso-Rasgado, T., Bayat, A. Optimization of an ex vivo wound healing model in the adult human skin: Functional evaluation using photodynamic therapy. Wound Repair and Regeneration. 23 (5), 685-702 (2015).
- Brownhill, V. R., et al. Pre-clinical assessment of single-use negative pressure wound therapy during in vivo porcine wound healing. Advances in Wound Care. , (2020).
- Diekmann, J., et al. A three-dimensional skin equivalent reflecting some aspects of in vivo aged skin. Experimental Dermatology. 25 (1), 56-61 (2016).
- Vidal Yucha, S. E., Tamamoto, K. A., Nguyen, H., Cairns, D. M., Kaplan, D. L. Human skin equivalents demonstrate need for neuro-immuno-cutaneous system. Advanced Biosystems. 3 (1), 1800283 (2019).
- Dijkgraaf, F. E., et al. Tissue patrol by resident memory CD8+ T cells in human skin. Nature Immunology. 20 (6), 756-764 (2019).
- He, X., de Oliveira, V. L., Keijsers, R., Joosten, I., Koenen, H. J. Lymphocyte isolation from human skin for phenotypic analysis and ex vivo cell culture. Journal of Visualized Experiments. (110), e52564 (2016).
- Pupovac, A., et al. Toward immunocompetent 3D skin models. Advanced Healthcare Materials. 7 (12), 1701405 (2018).
- Ataç, B., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Kim, J. J., et al. A microscale, full-thickness, human skin on a chip assay simulating neutrophil responses to skin infection and antibiotic treatments. Lab on a Chip. 19 (18), 3094-3103 (2019).
- Jardet, C., et al. Development and characterization of a human Th17-driven ex vivo skin inflammation model. Experimental Dermatology. 29 (10), 993-1003 (2020).
- Chen, J. L., et al. Metformin attenuates diabetes-induced tau hyperphosphorylation in vitro and in vivo by enhancing autophagic clearance. Experimental Neurology. 311, 44-56 (2019).
- Demirovic, D., Rattan, S. I. Curcumin induces stress response and hormetically modulates wound healing ability of human skin fibroblasts undergoing ageing in vitro. Biogerontology. 12 (5), 437-444 (2011).
- Wilkinson, H. N., Hardman, M. J. Wound senescence: A functional link between diabetes and ageing. Experimental Dermatology. 30 (1), 68-73 (2020).
- Fisher, G. J., et al. Collagen fragmentation promotes oxidative stress and elevates matrix metalloproteinase-1 in fibroblasts in aged human skin. The American Journal of Pathology. 174 (1), 101-114 (2009).
- Quan, T., Little, E., Quan, H., Voorhees, J. J., Fisher, G. J. Elevated matrix metalloproteinases and collagen fragmentation in photodamaged human skin: impact of altered extracellular matrix microenvironment on dermal fibroblast function. Journal of Investigative Dermatology. 133 (5), 1362 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены