Method Article
Modello di ferita umana ex vivo e approccio di colorazione a montaggio intero per valutare con precisione la riparazione della pelle
In questo articolo
Riepilogo
Qui dimostriamo una tecnica ottimizzata per valutare la riparazione delle ferite utilizzando la pelle umana ex vivo combinata con un approccio di colorazione a montaggio intero. Questa metodologia fornisce una piattaforma pre-clinica per la valutazione di potenziali terapie delle ferite.
Abstract
Le ferite croniche non cicatrizzanti, che colpiscono principalmente gli anziani e i diabetici, sono un'area significativa di bisogni clinici insoddisfatti. Sfortunatamente, gli attuali trattamenti delle ferite croniche sono inadeguati, mentre i modelli pre-clinici disponibili predicono male l'efficacia clinica delle nuove terapie. Qui descriviamo un modello pre-clinico ad alto rendimento per valutare molteplici aspetti della risposta alla riparazione della pelle umana. Le ferite a spessore parziale sono state create nella pelle umana ex vivo e coltivate attraverso un corso di tempo di guarigione. Le biopsie delle ferite cutanee sono state raccolte in fissativo per la procedura di colorazione a tutto monte. I campioni fissi sono stati bloccati e incubati nell'anticorpo primario, con rilevamento ottenuto tramite anticorpo secondario coniugato fluorescentemente. Le ferite sono state controbattete e riprese tramite microscopia confocale prima di calcolare la percentuale di chiusura della ferita (riepitelizzazione) in ogni biopsia. Applicando questo protocollo, riveliamo che le ferite escissionali di 2 mm create nella pelle sana del donatore sono completamente riepitelizzate entro il giorno 4-5 post-ferimento. Al contrario, i tassi di chiusura delle ferite cutanee diabetiche sono significativamente ridotti, accompagnati da una riforma della barriera perturbata. La combinazione di ferite cutanee umane con un nuovo approccio di colorazione a montaggio intero consente un metodo rapido e riproducibile per quantificare ex vivo la riparazione della ferita. Collettivamente, questo protocollo fornisce una preziosa piattaforma umana per valutare l'efficacia di potenziali terapie delle ferite, trasformando i test e la convalida pre-clinici.
Introduzione
Le ferite croniche e non cicatrizzanti, che sono molto diffuse negli anziani e nei diabetici, sono un'area molto poco apprezzata del bisogno clinico insoddisfatto. Queste ferite rappresentano un importante onere fisico e psicologico per i pazienti e costano miliardi agli operatori sanitari ogni anno per il trattamentodi 1. Nonostante una migliore comprensione della biologia delle ferite e dei progressi tecnologici, fino al 40% delle ferite croniche non riesce ancora a guarire seguendo le migliori cure standard2. Pertanto, il 14-26% dei pazienti con ulcere del piede diabetico richiede successivamente l'amputazione3, mentre il tasso di mortalità post-amputazione a 5 anni si attesta a circa il 70%4. Di conseguenza, vi è l'urgente necessità di sviluppare nuove terapie efficaci per migliorare la qualità della vita dei pazienti, riducendo al contempo il notevole onere sanitario imposto dalle ferite di scarsa guarigione. Modelli pre-clinici scarsamente predittivi rimangono un ostacolo significativo allo sviluppo di nuove terapie efficaci.
La riparazione delle ferite è un processo dinamico e sfaccettato che coinvolge una vasta gamma di tipi di cellule, innumerevoli livelli di comunicazione e un ambiente tissutale che viene temporaneamente rimodellato. La guarigione della pelle è sostenuta da quattro principali fasi riparative: emostasi, infiammazione, proliferazione e rimodellamento della matrice. Queste fasi agiscono in definitiva per prevenire la perdita di sangue e l'infezione, chiudere la superficie della ferita (un processo chiamato riepitelizzazione) e riportare la pelle a uno stato illeso5. Le ferite croniche sono associate a diverse eziologia e diffusa perturbazione dei processi di guarigione6, complicando ulteriormente l'identificazione di bersagli terapeutici. Tuttavia, è stata sviluppata un'ampia gamma di modelli per chiarire i driver molecolari e cellulari della patologia della ferita e testare nuovi approcci terapeutici7.
Il modello di riparazione della ferita più utilizzato è la ferita acuta nel topo. I topi sono altamente trattabili per studi meccanicistici e forniscono modelli convalidati di invecchiamento e diabete8. Nonostante le somiglianze generali mostrate tra la guarigione del topo e dell'uomo, le differenze tra le specie nella struttura della pelle e nelle dinamiche di guarigione rimangono. Ciò significa che la maggior parte della ricerca sulle ferite murine non si traduce facilmente nella clinica9. Di conseguenza, c'è stata una spinta verso sistemi umani in vitro ed ex vivo con elevata applicabilità e traducibilità10,11.
Qui forniamo un protocollo approfondito per l'esecuzione di ferite escissionali a spessore parziale in pelle umana ex vivo. Descriviamo anche il nostro approccio di colorazione a tutto monte come un metodo altamente riproducibile per valutare ex vivo la guarigione della pelle umana. Mostriamo la traiettoria della riparazione epidermica (riepitelizzazione) e la successiva formazione della barriera, valutando il tasso di chiusura della ferita nella pelle umana sana rispetto a quella diabetica. Infine, dimostriamo come la colorazione a tutto monte può essere adattata per l'uso con una gamma di anticorpi per valutare vari aspetti della risposta di guarigione.
Protocollo
La pelle umana è stata ottenuta da pazienti sottoposti a chirurgia ricostruttiva presso il Castle Hill Hospital e l'Hull Royal Infirmary (Hull, Regno Unito) con il consenso scritto del paziente, le linee guida istituzionali e l'approvazione etica (LREC: 17 / SC / 0220 e 19 / NE / 0150). La pelle non diabetica è stata raccolta da pazienti sottoposti a chirurgia di routine (età media = 68). La pelle diabetica è stata selezionata tra donatori che avevano stabilito il diabete di tipo II e una storia di ulcerazione (età media = 81). I campioni provenienti dalla chirurgia sono stati trasportati in mezzi di detenzione ed elaborati immediatamente dopo l'arrivo in laboratorio. Tutte le fasi sperimentali utilizzando tessuto umano non fissato sono state eseguite al livello di biosicurezza 2 (BSL-2) in un armadio di biosicurezza a flusso laminare di classe II.
1. Preparazione dei mezzi di coltura cutanei e dei reagenti coloranti
NOTA: Tutti i dettagli del reagente e del materiale di consumo sono forniti nella Tabella dei materiali. Assicurarsi che tutti i reagenti e le attrezzature utilizzate per la lavorazione e la coltura del tessuto umano siano sterili. Sterilizzare gli strumenti prima dell'uso e decontaminare con disinfettante a contatto con il tessuto. Decontaminare i prodotti di scarto in disinfettante all'1% prima dello smaltimento.
- Mezzi di tenuta: Integrare il Modified Eagle Medium (DMEM) di Dulbecco ad alto contenuto di glucosio con 2 mM di L-glutammina e soluzione antibiotico-antimicotica al 4% (v/v).
- Soluzione salina bilanciata di Hank (HBSS) con antibiotici: aggiungere una soluzione antibiotico-antimicotica al 4% (v/v) all'HBSS. Conservare a 4 °C fino all'uso.
- Soluzione salina tamponata con fosfato di Dulbecco (DPBS): Preparare DPBS sciogliendo 9,6 g di polvere di DPBS per litro di acqua distillata (dH2O). Autoclave per sterilizzare e conservare a 4 °C fino all'uso.
- Mezzi di crescita della pelle umana: Integrare DMEM ad alto contenuto di glucosio con 2 mM di L-glutammina, soluzione antibiotico-antimicotica all'1% (v/v) e siero bovino fetale al 10% (v/v). Conservare a 4 °C fino all'uso.
- Fissativo cutaneo: a 450 mL di dH2O, aggiungere 40 mL di soluzione di formaldeide, 10 mL di acido acetico glaciale, 4,5 g di cloruro di sodio e 0,25 g di bromuro di alchiltrimetilammonio. Conservare a temperatura ambiente (RT) e utilizzare entro pochi giorni.
ATTENZIONE: il fissativo è pericoloso (irritante e infiammabile). Maneggiare con cura e smaltire attraverso un percorso appropriato. - Soluzione salina tamponata con fosfato (PBS): preparare PBS per la colorazione a montaggio intero aggiungendo 6 g di cloruro di sodio a 100 mL di soluzione tampone fosfato e 900 mL di dH2O.
- Tampone di lavaggio colorante: Sciogliere lo 0,5% (v/v) di Triton X-100 in PBS.
- Tampone bloccante: aggiungere lo 0,2% (p/v) di azide di sodio e il 2% (v/v) di siero animale al tampone di lavaggio colorante. Conservare a 4 °C per un massimo di due settimane.
NOTA: Blocco nel siero della specie ospite anticorpale secondaria. L'azide di sodio previene la crescita batterica durante l'incubazione. - Soluzione di lavoro DAPI: Preparare una scorta di 5 mg/mL di 4′,6-diamidino-2-fenilindolo (DAPI) in dimetilsolfossido. Diluire lo stock 1:1.000 in un tampone di lavaggio colorante per dare una soluzione di lavoro DAPI da 5 μg/mL.
- Blocco di perossidasi: aggiungere lo 0,3% (v/v) di perossido di idrogeno al tampone di lavaggio colorante. Conservare a 4 °C fino all'uso. Tenere al buio per evitare la decomposizione.
- Kit ABC-HRP:
- Anticorpo secondario coniugato HRP: 1 goccia di IgG anti-capra di coniglio biotinilato in 5 ml di tampone colorante. Conservare a 4 °C per un massimo di due settimane.
NOTA: il kit/secondario utilizzato dipenderà dalla specie ospite dell'anticorpo primario. - Reagente del complesso avidina-biotina (ABC): 2 gocce di reagente A e 2 gocce di reagente B in 5 mL di tampone di lavaggio colorante. Il reagente ABC deve essere preparato almeno 30 minuti prima dell'uso. Conservare a 4 °C per un massimo di due settimane.
- Anticorpo secondario coniugato HRP: 1 goccia di IgG anti-capra di coniglio biotinilato in 5 ml di tampone colorante. Conservare a 4 °C per un massimo di due settimane.
- Substrato della perossidasi: 3 gocce di reagente 1, 2 gocce di reagente 2, 2 gocce di reagente 3 e 2 gocce di perossido di idrogeno in 5 mL di dH2O. Il substrato della perossidasi deve essere preparato immediatamente prima dell'uso e non può essere conservato.
2. Preparazione della pelle per il ferimento
NOTA: questi passaggi devono essere eseguiti in un armadio di biosicurezza a flusso laminare di classe II.
- Raccogliere la pelle nei supporti di tenuta e trasportarla all'armadio BSL-2.
- Posizionare il derma cutaneo con il lato verso il basso all'interno di una capsula di Petri sterile da 90 mm e rimuovere il tessuto adiposo con forbici sterili.
- Posizionare la pelle in un tubo da 50 ml contenente 25 mL di HBSS con antibiotici per 10 minuti a RT. Agitare a intermittenza per rimuovere eventuali residui di sangue e tessuto adiposo.
- Ripetere il passaggio 2.3 utilizzando un nuovo tubo da 50 ml.
- Mettere la pelle in un tubo fresco da 50 ml contenente 25 mL di HBSS, questa volta senza antibiotici per 10 minuti a RT. Agitare come nel passaggio 2.3.
- Eseguire un risciacquo finale della pelle posizionando la pelle in un nuovo tubo con 25 ml di DPBS. La pelle è ora pronta per ferire.
3. Creazione di ferite cutanee umane ex vivo
NOTA: questi passaggi devono essere eseguiti in un armadio di biosicurezza a flusso laminare di classe II.
- Preparare i piatti della cultura della pelle prima della ferita. In una capsula di Petri da 60 mm, impilare due cuscinetti assorbenti sterili e aggiungere 4 ml di mezzi della pelle umana attraverso il lato del piatto. Posizionare una membrana filtrante in nylon sterile sulla pila assorbente.
NOTA: i supporti cutanei possono essere modificati a seconda delle condizioni di trattamento richieste. Fino a tre espianti di ferite possono essere coltivati su ogni pila. - Asciugare il lato dermico della pelle su una garza sterile in una capsula di Petri da 90 mm per rimuovere il DPBS residuo.
NOTA: Questo impedisce alla pelle di scivolare durante la ferita. - Posizionare il derma della pelle con il lato verso il basso su un coperchio pulito della capsula di Petri da 90 mm e tamponare l'epidermide asciutta con una garza sterile fresca.
NOTA: È più facile avvolgere la pelle in un coperchio della capsula di Petri rispetto alla base. Il lavoro successivo deve essere eseguito rapidamente per evitare che la pelle si secchi. - Tenendo la pelle tesa, premere un pugno biopsia di 2 mm contro la pelle e ruotare delicatamente. Non perforare interamente la pelle.
NOTA: le ferite a spessore parziale sono progettate per perforare l'epidermide e parzialmente nel derma. Ci può essere variabilità da donatore a donatore e da sito a sito nella forza necessaria per creare la ferita a spessore parziale. - Utilizzare una pinza di tessuto dentato curvo per raccogliere ciascun lato della ferita da 2 mm e agganciare le forbici dell'iride curve sotto la ferita da 2 mm per ritagliarla uniformemente.
- Biopsia intorno alla ferita centrale da 2 mm utilizzando un punzone per biopsia da 6 mm per creare un espianto da 6 mm con una ferita di spessore parziale di 2 mm al centro.
NOTA: un punzone per biopsia da 6 mm può essere usato per segnare la pelle per segnare dove dovrebbe essere ogni ferita di 2 mm. Fare attenzione a non perforare completamente il tessuto. Crea espianti di ferite in un modello a nido d'ape per ridurre gli sprechi. - Posizionare l'epidermide degli espianti avvolti lateralmente verso l'alto sulla pila di membrane del filtro in nylon (preparata nel passaggio 3.1).
NOTA: Quando si maneggiano gli espianti della ferita, fare attenzione a non danneggiare la ferita centrale. Usa una piccola pinna e raccogli ogni espianto ai lati opposti. - Incubare le ferite a 32-37 °C e 5% CO2 in atmosfera umidificata (90-95%) per 1-7 giorni. Sostituire il supporto ogni 2-3 giorni.
4. Colorazione integrale delle ferite ex vivo
NOTA: Questa sezione descrive i metodi di immunofluorescenza e colorazione dell'immunoperossidasi. Mescolare bene tutti i reagenti prima dell'uso.
- Metodo di colorazione fluorescente
- Raccogliere gli espianti della ferita in tubi microcentrifuga da 1,5 mL contenenti 500 μL di fissativo cutaneo e incubare a 4 °C durante la notte.
NOTA: il fissativo utilizzato in questo protocollo funziona bene per gli anticorpi descritti. L'ottimizzazione sarà necessaria per altri anticorpi. La fissazione dei tessuti più lunga di 24 ore può portare a una fissazione eccessiva. - Il giorno seguente rimuovere il fissativo e sostituirlo con 1 mL di tampone di lavaggio colorante. Le biopsie possono essere conservate in un tampone di lavaggio colorante a 4 °C fino a 2 settimane prima della colorazione.
NOTA: Per tutte le fasi del tampone di lavaggio, utilizzare una pipetta sierologica o una punta della pipetta, facendo attenzione a non danneggiare la ferita. - Aspirare il tampone di lavaggio di colorazione ed eseguire un altro risciacquo con 1 mL di tampone di lavaggio colorante.
- Calcolare la quantità di buffer di blocco richiesta per i passaggi 4.1.5-4.1.6 (numero di campioni x 300 μL = quantità di buffer di blocco in μL). Crea un buffer aggiuntivo, se necessario.
- Aggiungere 150 μL di tampone bloccante a ciascun campione e incubare per 1 ora a RT. Per tutte le fasi di colorazione, assicurarsi che ogni campione sia sufficientemente coperto e che non vi siano bolle che coprono la superficie della ferita da biopsia.
NOTA: Questo passaggio in avanti può essere eseguito in tubi microcentrifuga da 1,5 ml o in una piastra da 48 pozzetti. Se si utilizza una piastra da 48 pozzetti, incubare le ferite a faccia in giù in ciascun pozzetti. - Diluire l'anticorpo primario nel restante tampone di blocco.
NOTA: la cheratina anti-topo 14 (K14) diluita 1:1.000 nel buffer di blocco funziona bene. Ottimizzare questo passaggio per l'uso con altri anticorpi o sonde multiple. - Aspirare il tampone bloccante e aggiungere 150 μL di anticorpo primario per tubo pozzo/microcentrifuga. Incubare gli espianti della ferita in anticorpi primari a 4 °C durante la notte.
- Il giorno successivo, aspirare l'anticorpo primario e risciacquare nel tampone di lavaggio contenente 0,2% di azide di sodio per 1 ora a RT (500 μL per campione).
- Eseguire altre tre fasi di risciacquo utilizzando il tampone di lavaggio di colorazione (30 minuti per lavaggio, 500 μL per campione).
- Diluire l'anticorpo secondario coniugato fluorescentemente nel tampone di lavaggio colorante (ad esempio, anti-topo di capra 488 alla diluizione 1:400).
- Calcolare la quantità richiesta di anticorpi secondari (numero di campioni x 150 μL = quantità in μL).
- Aggiungere 150 μL di anticorpo secondario a ciascun tubo di pozzo/microcentrifuga. Incubare per 1 ora a RT. Eseguire le fasi di incubazione 4.1.10 - 4.1.16 al buio poiché l'anticorpo secondario è sensibile alla luce.
NOTA: questo passaggio può essere eseguito a 4 °C durante la notte, se necessario. Ottimizzare la concentrazione di anticorpi secondari necessari per un segnale adeguato e una colorazione di fondo limitata. - Rimuovere l'anticorpo secondario ed eseguire 3 risciacqui di 30 minuti con tampone di lavaggio colorante (500 μL per campione).
- Scartare il tampone di lavaggio rimanente e calcolare la quantità di soluzione di lavoro DAPI richiesta (come da passaggio 4.1.11).
- Controbattere ogni espianto con 150 μL di soluzione di lavoro DAPI per 10 minuti a RT.
NOTA: DAPI macchierà i nuclei cellulari di blu. Il colorante Hoechst può essere utilizzato come alternativa al DAPI. - Eseguire due lavaggi finali di 30 minuti con tampone di lavaggio colorante (500 μL per campione). Le biopsie possono essere conservate in un tampone di lavaggio colorante a 4 °C al buio fino a due settimane prima dell'imaging.
- Raccogliere gli espianti della ferita in tubi microcentrifuga da 1,5 mL contenenti 500 μL di fissativo cutaneo e incubare a 4 °C durante la notte.
- Metodo di colorazione Brightfield.
- Eseguire i passaggi 4.1.1 - 4.1.3.
- Spegnere l'attività della perossidasi endogena con blocco di perossidasi a 4 °C durante la notte.
NOTA: Questo passaggio è importante quando si utilizza un anticorpo coniugato HRP per ridurre la colorazione di fondo non specifica dal tessuto. Il tessuto altamente vascolarizzato conterrà più attività endogena della perossidasi. - Scartare il blocco di perossidasi e risciacquare due volte per 30 minuti nel tampone di lavaggio colorante.
- Eseguire i passaggi 4.1.4 - 4.1.8.
NOTA: I lavaggi dopo il passaggio 4.1.7 sono particolarmente importanti per rimuovere l'azide di sodio dai campioni. Se l'azide di sodio non viene adeguatamente rimosso, inattiverà l'HRP e interferirà con il rilevamento della colorazione. - Aggiungere 150 μL di anticorpo secondario coniugato HRP a ciascun tubo di pozzo/microcentrifuga e incubare durante la notte a 4 °C o 1 ora a RT.
- Rimuovere l'anticorpo secondario ed eseguire 3 lavaggi di 30 minuti nel tampone di lavaggio della colorazione.
- Aggiungere 150 μL di reagente ABC a ciascun tubo di pozzo/microcentrifuga e incubare durante la notte a 4 °C o 1 ora a RT.
- Aspirare il reagente ABC ed eseguire 3 lavaggi di 3 minuti nel tampone di lavaggio di colorazione.
- Aggiungere 150 μL di substrato di perossidasi a un espianto e determinare il tempo necessario per rilevare un cambiamento di colore evidente.
NOTA: scegliere un campione in cui è prevista una forte colorazione. In questo caso, un anello rosso per mostrare l'epidermide migrante (K14). La 3,3'-diaminobenzidina-4, o qualsiasi altro substrato cromogenico appropriato, può essere usato in sostituzione di questo substrato della perossidasi. - Una volta osservato un cambiamento di colore, rimuovere il substrato della perossidasi e sostituire con 1 mL di dH2O.
- Ripetere il rilevamento del substrato della perossidasi per gli altri espianti, incubando per il tempo determinato nel passaggio 4.2.11.
- Risciacquare tutti gli espianti con 1 mL di dH2O per rimuovere il substrato residuo della perossidasi. Sebbene gli espianti possano essere conservati fino a una settimana a 4 °C prima dell'imaging, è meglio immaginarli il prima possibile per evitare la lisciviazione del substrato della perossidasi nel dH2O nel tempo.
5. Imaging e quantificazione
- Imaging fluorescente
NOTA: l'imaging fluorescente viene eseguito utilizzando un microscopio a scansione laser confocale. Tuttavia, un microscopio fluorescente invertito può essere sufficiente per acquisire immagini 2D per quantificare i tassi di chiusura della ferita. Quando si selezionano gli anticorpi secondari, assicurarsi che i fluorocromi scelti siano compatibili con gli spettri di eccitazione ed emissione delle apparecchiature di microscopia disponibili.- Utilizzare un microscopio a scansione laser confocale dotato di un obiettivo 2,5x, 10x e 20x, stadio motorizzato x-y-z, fotocamera digitale e software di acquisizione. Accendere il rilevatore di luce trasmessa (TPMT) per consentire una facile visualizzazione di ogni biopsia e per consentire la misurazione della chiusura totale della ferita. In alternativa, misurare ogni ferita tramite microscopia a campo luminoso dopo l'imaging a fluorescenza.
- Posizionare una base di piastra di Petri da 60 mm sulla piattaforma di imaging e aggiungere uno strato sottile (circa 1 mL) di DPBS.
NOTA: se viene utilizzato troppo DPBS, la biopsia si muoverà durante l'imaging. In alternativa utilizzare una piastra da 48 pozzetti se è disponibile un portapiatti. - Utilizzare piccole pinna di tessuto per trasferire gli espianti della ferita da pozzi / tubi microcentrifuga alla capsula di Petri contenente DPBS. Posizionare la ferita da biopsia verso il basso nella capsula di Petri.
- Utilizzare l'oculare e la lampada fluorescente per individuare e mettere a fuoco la ferita. Se le bolle sono intrappolate sotto il campione nel campo visivo, raccogliere la ferita con una pina di tessuto e riposizionarsi.
- Impostare il software di imaging, garantendo la stessa dimensione del foro stenopeico tra i canali per una confocalità ottimale. Per questo, controlla il valore di un'unità ariosa per ciascun canale e seleziona il valore più grande. Seleziona la velocità di scansione, la qualità dell'immagine e la media.
NOTA: I fluorocromi degli anticorpi secondari coniugati e la controstena scelta (ad esempio, DAPI) determineranno i canali richiesti. - Accendere il software di acquisizione live e regolare la potenza e il guadagno laser di ciascun canale ai livelli necessari per visualizzare la colorazione. Ridurre il rumore di fondo aumentando l'offset digitale.
- Posizionare la ferita al centro del piano di imaging.
NOTA: se la ferita non riempie l'intera immagine a causa dell'utilizzo di un obiettivo più piccolo o della creazione di una ferita più grande, prendere un pannello di immagini e cucirle insieme (manualmente o con una funzione di piastrellatura nel software di imaging pertinente). - Acquisire immagini delle biopsie della ferita. Utilizzare le stesse impostazioni di imaging tra gli espianti.
NOTA: immagini a più alta potenza consentiranno la valutazione delle strutture tissutali e dell'espressione e della posizione dei marcatori cellulari. - Raccogliere pile Z seriali attraverso la ferita, specialmente dove il tessuto non è completamente piatto contro la capsula di Petri. Utilizzare un software di analisi per comprimere lo stack Z in un'unica immagine di proiezione a intensità massima.
- Imaging a campo luminoso
NOTA: l'imaging a campo luminoso delle biopsie colorate con immunoperossidasi può essere eseguito in diversi modi.- Imaging al microscopio invertito: preparare gli espianti delle ferite per l'imaging posizionandoli in una capsula di Petri/come descritto nei passaggi 5.1.2-5.1.3. Acquisire immagini digitali sotto illuminazione a campo luminoso su un microscopio invertito dotato di una fotocamera digitale. Cuci insieme più immagini, se necessario.
- Imaging digitale wireless al microscopio: utilizzare un microscopio digitale wireless collegato a un telefono o laptop per ottenere immagini di alta qualità in modo economico. Posizionare gli espianti avvolti lateralmente su un tessuto e rimuovere qualsiasi residuo di dH2O (o tampone di lavaggio colorante) dalla conservazione del campione. Posizionare l'espianto della ferita al centro del campo visivo del microscopio. Acquisire immagini utilizzando la fotocamera collegata.
- Quantificazione
NOTA: la chiusura percentuale della ferita può essere quantificata in qualsiasi software che consenta di disegnare e misurare forme a mano libera. ImageJ può essere utilizzato per eseguire la quantificazione come segue:- Aprire l'immagine da quantificare nel software ImageJ.
- Usa lo strumento a forma di mano libera per disegnare intorno all'esterno della ferita riepitelizzata dove incontra la pelle normale. Premere M (o Analizza | Misura) per acquisire una misurazione dell'area "esterna".
NOTA: La texture del tessuto della ferita riepitelizzata differisce dalla pelle normale. Le immagini non devono essere ridimensionate prima di questo tipo di analisi. - Utilizzare lo strumento a forma di mano libera per disegnare intorno all'area aperta della ferita. È qui che la ferita aperta incontra il bordo interno del tessuto riepitelizzante. Premere M (o Analizza | Misura) per acquisire una misurazione dell'area "interna".
- Utilizzare la seguente equazione per dedurre la percentuale di riepitelizzazione/chiusura della ferita:
% Chiusura = (Area esterna della ferita - Area interna della ferita) / (Area esterna della ferita) x 100
NOTA: la percentuale di copertura dell'area degli anticorpi può essere dedotta allo stesso modo (ad esempio, K14) o come percentuale dell'area totale della ferita. L'intensità percentuale può anche fornire informazioni semi-quantitative sull'espressione a livello tissutale dei marcatori di interesse, mentre l'imaging ad alta potenza presenta dati di espressione a livello cellulare.
Risultati
In questo rapporto, presentiamo un nuovo approccio ex vivo per le ferite cutanee e la colorazione a tutto monte per valutare i fattori che influenzano la risposta alla riparazione della pelle umana. La Figura 1A mostra uno schema della pipeline procedurale, che può essere eseguito in 3-10 giorni, a seconda dei tempi di incubazione della ferita. Le ferite a spessore parziale vengono coltivate su pile di membrana all'aria: interfaccia a membrana e possono essere raccolte per la colorazione a montaggio intero, incorporate in paraffina o mezzo OCT per l'istologia generale o congelate in azoto liquido per analisi biochimiche (Figura 1B). Generalmente creiamo ferite a spessore parziale di 2 mm all'interno del centro di espianti da 6 mm. Tuttavia, la dimensione della ferita e dell'espianto circostante può essere modificata a seconda delle esigenze. La procedura a montaggio intero è stata adattata con successo sia per l'immunoperossidasi che per i metodi di colorazione a immunofluorescenza (Figura 1C).
L'immunofluorescenza consente il sondaggio del tessuto con anticorpi multipli. Per questo, consigliamo di utilizzare anticorpi primari allevati in specie diverse e anticorpi secondari coniugati fluorescenti abbinati a specie per limitare la reattività tra specie. Le concentrazioni di anticorpi e i tempi di incubazione dovranno essere ottimizzati. Se si osserva una colorazione di fondo, ridurre le concentrazioni di anticorpi, aumentare le fasi di lavaggio e aggiungere tampone bloccante all'anticorpo secondario. La vitalità dei tessuti freschi può essere valutata direttamente con coloranti di redditività commerciale (vedi Tabella dei materiali). Mostriamo anche che il tessuto può essere riparato dopo la colorazione di vitalità e ripreso con successo quando è praticamente adatto (Figura 1D).
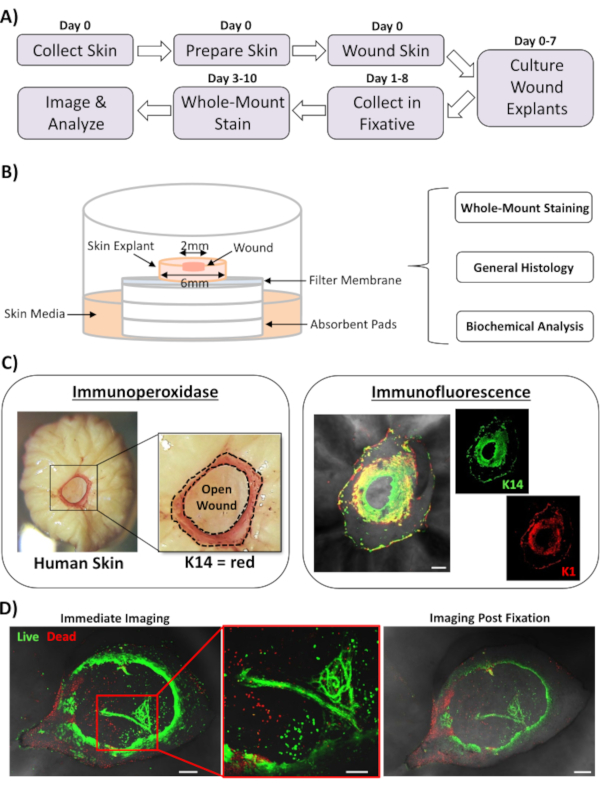
Figura 1: L'approccio umano ex vivo per la ferita e la colorazione a montaggio intero. (A) Pipeline che illustra il flusso di lavoro procedurale dalla raccolta della pelle e dall'esecuzione di ferite ex vivo, alla colorazione dei tessuti e all'analisi dei dati. (B) Diagramma che illustra il sistema di coltura delle ferite cutanee umane ex vivo con analisi eseguite di routine sul tessuto. (C) La colorazione integrale può essere impiegata utilizzando sia l'immunoperossidasi che l'immunofluorescenza. K14 = cheratina 14. (D) Il tessuto vivo può essere colorato con coloranti di vitalità commerciale e ripreso con successo dopo la fissazione. Barra = 100 μm. Questa colorazione è stata eseguita nella pelle non diabetica. Fare clic qui per visualizzare una versione più grande di questa figura.
L'uso più ampiamente applicabile per la colorazione a montaggio intero delle ferite è quello di determinare il tasso di chiusura della ferita in un modo più riproducibile di quello che può essere fornito tramite il sezionamento istologico. La percentuale di chiusura è stata quantificata come riepitelizzazione percentuale della superficie della ferita, come dimostrato nella Figura 2A. La copertura percentuale dell'area di marcatori specifici può essere misurata dall'area totale della ferita o come percentuale della ferita riepitelizzata. Abbiamo caratterizzato la guarigione in pelle sana (non diabetica) rispetto a quella diabetica per un periodo di tempo di sette giorni, raccogliendo ferite ogni giorno dopo la ferita (immagini rappresentative, Figura 2B). Le ferite cutanee sane si sono chiuse nel tempo come previsto, con chiusura completa osservata nella maggior parte dei campioni entro il giorno 4-5. Al contrario, le ferite cutanee diabetiche non sono riuscite a chiudersi completamente entro il periodo di analisi di sette giorni (Figura 2C). Un ritardo significativo nella chiusura della ferita è stato osservato tra ferite cutanee sane e diabetiche quando si confrontano i tassi di guarigione a ciascun punto temporale post-lesione(P < 0,001 al giorno 6, P < 0,05 al giorno 6 e P < 0,05 a P < 0,001 al giorno 7).
A seguito della valutazione dei tassi complessivi di chiusura della ferita; abbiamo misurato la percentuale dell'intera area della ferita (area esterna in Figura 2A)in cui è possibile visualizzare le cellule K14 positive (colorazione verde in Figura 2B). È interessante notare che abbiamo osservato che nelle ferite cutanee ex vivo sane, la colorazione K14 ha raggiunto il picco al giorno 2 e poi è diminuita rapidamente (significato in ogni punto temporale rispetto al picco del giorno 2, Figura 2D). Ciò riflette probabilmente la ri-formazione della barriera epidermica precoce, escludendo la penetrazione dell'anticorpo K14 attraverso strati epidermici differenziati (vedere schema Figura 2E). Durante il processo di riepitelizzazione, i cheratinociti dello strato basale (K14 + ve) migrano verso l'interno sopra la ferita aperta in modo tale che l'epidermide più vicina al bordo esterno della ferita si formi prima dell'epidermide più vicina al bordo interno della ferita (fronte migrante). Mentre il bordo anteriore dell'epidermide appena formata continua a migrare per chiudere la ferita aperta rimanente, l'epidermide del bordo esterno inizia a differenziarsi per riformare gli altri strati epidermici. Nella guarigione precoce, ci aspetteremmo quindi di vedere la maggior parte dell'area riepitelizzata costituita da cellule basali (K14 + ve), mentre nella riparazione successiva la colorazione K14 viene persa poiché l'epidermide si differenzia dall'esterno verso l'interno (vedi immagini a montaggio intero in Figura 2E). Pertanto, il declino della colorazione K14 mostrato nella Figura 2D (frecce verso il basso) è correlato con un aumento della differenziazione epidermica. È interessante notare che la colorazione K14 visibile ha raggiunto il picco prima nelle ferite sane (giorno 2) rispetto a quelle diabetiche (giorno 4), dimostrando ulteriormente che la riepitelizzazione e la successiva differenziazione epidermica sono ritardate nelle ferite cutanee diabetiche.
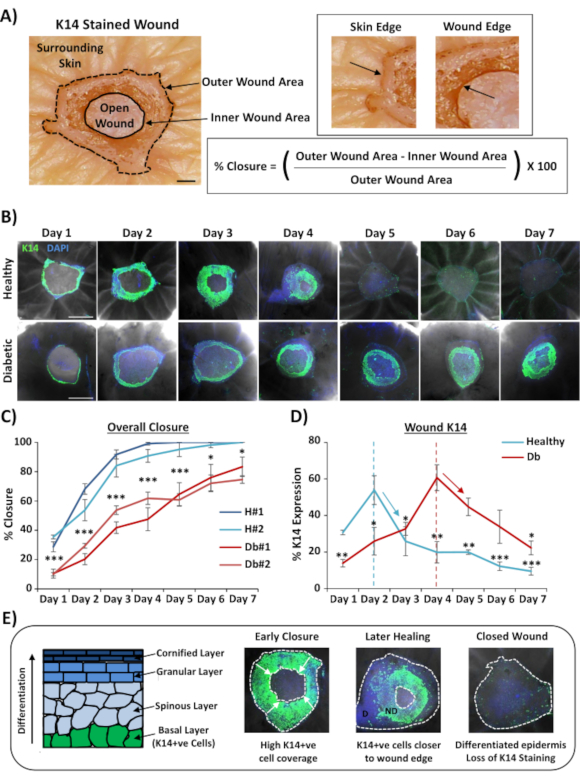
Figura 2: La colorazione a tutto monte rivela tassi di guarigione perturbati nella pelle diabetica rispetto a quella sana. (A) Il metodo utilizzato per quantificare la chiusura della ferita dalle misurazioni della ferita esterna ed interna. Le immagini Di Brightfield mostrano cheratina 14 (K14) si colora di rosso. Bar = 300 μm. (B) Immagini rappresentative della guarigione nel tempo (giorno post-ferimento) in pelle sana e diabetica. Barra = 500 μm. K14 = verde. DAPI = nuclei blu. (C) Quantificazione dei tassi di chiusura della ferita (percentuale di riepitelizzazione) che mostra che le ferite ex vivo da pelle sana si chiudono significativamente più velocemente delle ferite ex vivo da pelle diabetica. H = sano. Db = diabetico. (D) Percentuale di colorazione K14 raggiunge il picco prima nella pelle sana rispetto a quella diabetica e poi diminuisce in linea con l'aumento della differenziazione epidermica (frecce verso il basso). (E) K14 (cellule epidermiche basali) la colorazione viene persa man mano che l'epidermide si differenzia. D = differenziato. ND = non differenziato. Le linee tratteggiate bianche raffigurano i bordi interni ed esterni della ferita. Frecce bianche = direzione della migrazione. n = 6 ferite per donatore, per punto temporale. Media +/- SEM. * = P < 0,05, ** = P < 0,01 e *** = P < 0,001. Sano e diabetico confrontati in ogni punto del tempo di guarigione in C (valoreP per il confronto meno significativo). Variazione temporale della colorazione K14 rispetto al picco per ciascun donatore in D. Fare clic qui per visualizzare una versione più grande di questa figura.
Successivamente abbiamo utilizzato la colorazione a montaggio intero per esplorare l'espressione tissutale e la localizzazione di altri marcatori rilevanti per la ferita nella pelle non diabetica (Figura 3). Tutti gli anticorpi utilizzati e le loro concentrazioni di lavoro sono forniti nella Tabella dei materiali. I vasi sanguigni nella ferita aperta sono stati colorati positivamente con l'anticorpo alfa dell'actina della muscolatura liscia (a-SMA), utilizzato in combinazione con K14 per delineare i bordi epidermici in immagini a bassa potenza (Figura 3A). La matrice dermica è stata colorata con anticorpi contro il collagene di tipo I (COL 1) e la fibronectina (Fn). Qui il collagene è stato osservato come abbondanti fibre spesse mentre le fibre di fibronectina erano sparse, ondulate e sottili (Figura 3A). Il nostro approccio di colorazione a montaggio intero è anche in grado di fornire la risoluzione della colorazione a livello cellulare, come dimostrato per i cheratinociti K14-positivi (Figura 3B).
Infine, mostriamo che le ferite umane ex vivo possiedono cellule immunitarie residenti, con cellule di Langerhans rilevate intorno all'epidermide appena formata al giorno 3 post-ferimento (Figura 3C). In effetti, questi risultati suggeriscono che la colorazione a tutto monte può essere utilizzata per studiare le caratteristiche chiave della risposta di guarigione tra cui l'infiammazione, la proliferazione e la matrice extracellulare(Figura 4A). Nel loro insieme, i nostri dati rivelano che la procedura combinata ex vivo di ferite cutanee e colorazione a montaggio intero è un metodo valido per valutare vari aspetti della riparazione della pelle umana sana e diabetica (patologica).
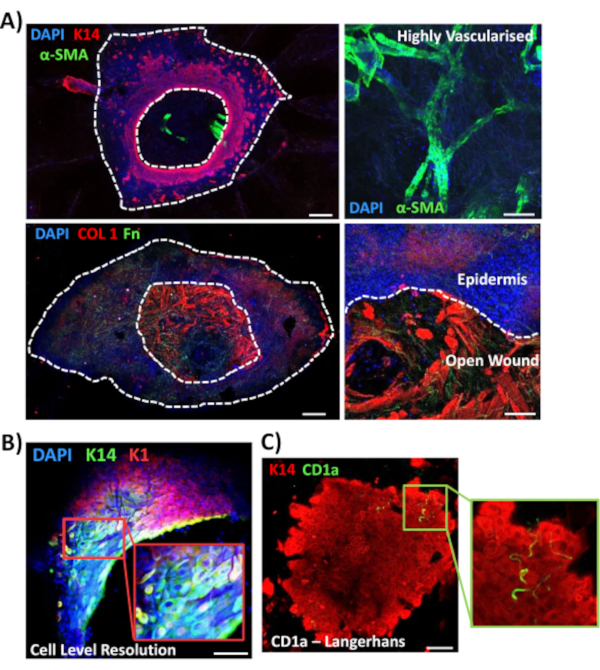
Figura 3: Ottimizzazione dell'approccio di colorazione a tutto monte per l'uso con altri anticorpi. (A) I vasi sanguigni sono stati colorati con alfa actina muscolare liscia (α-SMA, verde) e cheratina 14 (K14, rosso), mentre le fibre della matrice sono state colorate con collagene I (COL 1, rosso) e fibronectina (Fn, verde). (B) La procedura a montaggio intero fornisce una risoluzione di localizzazione fino al livello cellulare (K14, verde; K1, rosso). (C) Cellule di Langerhans CD1a+ve (verdi) osservate nell'epidermide di nuova formazione. DAPI = nuclei blu. Barra = 100 μm. Le linee tratteggiate bianche mostrano i bordi interni ed esterni della ferita e separano la ferita dall'epidermide. Questa colorazione è stata eseguita nella pelle non diabetica. Fare clic qui per visualizzare una versione più grande di questa figura.
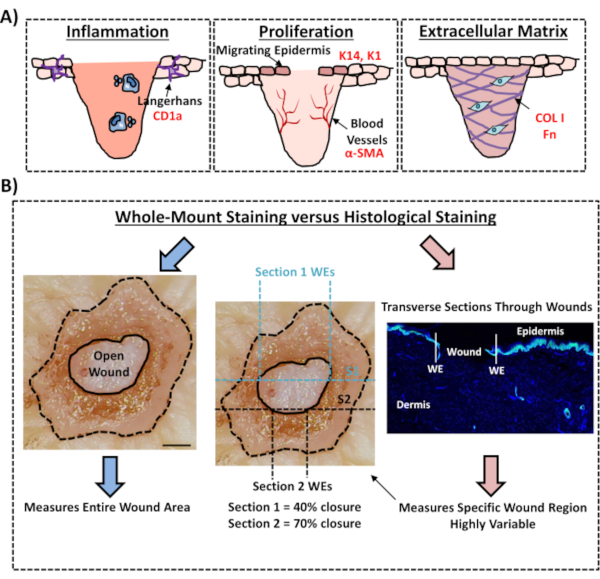
Figura 4: Validità della procedura di colorazione a montaggio intero per valutare la guarigione delle ferite. (A) Illustrazione che illustra come la tecnica di colorazione a montaggio intero può valutare i processi rilevanti per la ferita. Anticorpi usati = testo rosso. K14 = cheratina 14. COL 1 = collagene 1. Fn = fibronectina. (B) La procedura di colorazione a montaggio intero (frecce blu) introduce una minore variabilità nelle misurazioni di chiusura della ferita rispetto all'analisi istologica standard (frecce rosse). S1 = sezione 1. WE = bordo della ferita. Barra = 300 μm. Questa colorazione è stata eseguita nella pelle non diabetica. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
In questo protocollo sperimentale, descriviamo un metodo ottimizzato per valutare la chiusura della ferita nella pelle umana ex vivo utilizzando la colorazione del tessuto a montaggio intero. Questa è una risorsa importante per consentire la valutazione critica dei potenziali trattamenti delle ferite e per fornire una migliore comprensione della risposta alla riparazione della ferita umana. Abbiamo pubblicato la valutazione di guarigione nelle ferite cutanee ex vivo in precedenza12,13, ma in questi rapporti l'approccio di colorazione a monte intero non è stato utilizzato per misurare la chiusura della ferita. La colorazione a montaggio intero è molto più semplice e richiede meno esperienza tecnica rispetto all'istologia standard, che comporta l'incorporamento di paraffina o OCT e il sezionamento dei campioni. La procedura a montaggio intero riduce anche la variabilità sperimentale, consentendo la quantificazione dell'intera ferita e non solo di una singola sezione trasversale in una posizione definita all'interno del tessuto (vedere la Figura 4B per l'illustrazione comparativa). Sosteniamo pienamente l'importanza di quantificare la guarigione dell'intera struttura della ferita non simmetrica, come chiaramente delineato da Rhea e Dunnwald per le ferite acute murine14. Questi autori hanno mostrato l'importanza del sezionamento seriale di ferite escissionali in vivo per misurazioni riproducibili e precise della morfologia della ferita. Il sezionamento seriale potrebbe essere applicato anche alle ferite umane ex vivo; tuttavia, per una quantificazione accurata della chiusura della ferita e della riepitelizzazione, la colorazione a montaggio intero ad alta produttività dovrebbe essere il metodo preferito. Notiamo che questo protocollo di colorazione a montaggio intero dovrebbe essere compatibile anche con la successiva lavorazione (cera o OCT) per l'analisi istologica tradizionale.
La colorazione a montaggio intero non è priva di svantaggi. Mentre offre una maggiore riproducibilità negli esperimenti di guarigione delle ferite, richiede l'uso di più tessuto per l'analisi rispetto alle tecniche istologiche standard. Questo può essere un problema in cui l'accesso ai tessuti è limitato, in particolare quando è necessario valutare più anticorpi. Un approccio alternativo sarebbe quello di impiegare un metodo di avsizione incisionale in cui la larghezza della ferita è relativamente uniforme e la variabilità è ridotta (come mostrato nelle ferite di topo e umane15,16). Tuttavia, le ferite escissionali rimangono più applicabili alla maggior parte dei tipi di ferite patologiche17.
In questo studio, sono state create ferite di spessore parziale di 2 mm all'interno del centro di espianti cutanei da 6 mm. Questo metodo può essere ottimizzato per ferite escissionali alternative e dimensioni di espianto a diverse profondità cutanee18. Inoltre, la forza necessaria per generare ferite varierà tra i donatori, dove la pelle invecchiata richiederà meno forza per la biopsia. Eviteremmo anche di usare la pelle che mostra smagliature prominenti o altre alterazioni strutturali. Abbiamo convalidato una serie di anticorpi per considerare diversi aspetti della risposta di guarigione ex vivo. Questo protocollo può anche essere utilizzato con altri anticorpi rilevanti per la pelle, in cui le concentrazioni di anticorpi e i tempi di incubazione dovranno essere ottimizzati. Tuttavia, riteniamo che il nostro protocollo sia più adatto alla quantificazione assoluta della chiusura totale della ferita, seguita dalla valutazione spaziale di specifiche proteine di interesse. Mentre l'intero montaggio fornisce una risoluzione ridotta dell'immunolocalizzazione rispetto all'analisi istologica standard delle sezioni tissutali, fornisce ulteriori informazioni 3D che mancano nell'istologia 2D standard.
Un avvertimento per valutare la guarigione nella pelle ex vivo rispetto ai modelli in vivo è che manca una risposta sistemica. Un aspetto importante della riparazione della ferita è l'infiammazione e la successiva granulazione dei tessuti, che è causata da un afflusso di cellule infiammatorie e cellule endoteliali dallavascolarizzazione 19. Nonostante questa limitazione, la pelle ex vivo fornisce ancora una migliore ricapitolazione della guarigione clinica rispetto ai saggi delle ferite basati sulle cellule. Gli esperimenti in vitro in generale coinvolgono monostrati o co-colture di tipo cellulare singolo coltivate su coltura tissutale plastica, mentre la pelle ex vivo fornisce un ambiente nativo per esplorare il comportamento cellulare. Più recentemente, sono emersi un certo numero di sistemi equivalenti della pelle, in cui la pelle viene coltivata in un ambiente di laboratorio da matrice artificiale e cellule cutanee isolate20,21. Sebbene questi modelli imitino la pelle umana meglio della maggior parte degli approcci in vitro, non simulano ancora completamente l'ambiente tissutale nativo e sono generalmente troppo fragili per ferire in modo riproducibile. Inoltre, noi (e altri) abbiamo dimostrato che il tessuto cutaneo umano ex vivo conserva le cellule immunitarie residenti, che senza dubbio contribuiranno alla riparazione22,23. Il lavoro futuro dovrebbe ora concentrarsi sull'estensione della vitalità e dell'immunocompetenza del modello ex vivo per la valutazione della guarigione in fase avanzata24. Un'opzione è l'ulteriore avanzamento delle promettenti tecnologie organ-on-a-chip in grado di prolungare la vitalità dei tessuti e mantenere l'architettura cutanea nativa per un massimo di due settimane incoltura 25. I modelli ex vivo hanno anche iniziato a considerare l'importanza della risposta infiammatoria cutanea incorporando con successo cellule immunitarie, come i neutrofili, nel tessuto ospite26 o iniettando tessuto ospite con anticorpi per suscitare una reazione immunitaria27. Ci aspettiamo che questi risultati apriranno la strada allo sviluppo di metodi più raffinati e traducibili in futuro.
Uno dei principali vantaggi dell'utilizzo della pelle ex vivo per misurare la chiusura della ferita è la capacità di confrontare i tassi di guarigione in tessuto sano (ad esempio, non diabetico) rispetto a quello patologico (ad esempio, diabetico o invecchiato). Qui abbiamo dimostrato che la riepitelizzazione e la formazione di barriere sono effettivamente compromesse nelle ferite diabetiche rispetto a quelle sane ex vivo. In effetti, questo fornisce un percorso per la valutazione pre-clinica della riparazione patologica, in cui l'invecchiamento e il diabete sono i principali fattori di rischio per lo sviluppo di ferite croniche1. Mentre esistono modelli patologici in vitro, come cellule isolate da tessuto invecchiato e diabetico, o cellule coltivate in glucosio alto per imitare l'iperglicemia28,29, queste cellule possono rapidamente perdere il loro fenotipo una volta rimosse dal microambiente in vivo. Una componente importante dell'ambiente di guarigione patologica estrinseca è la matrice dermica, che viene alterata sia nell'invecchiamento che nel diabete30. Infatti, questa matrice perturbata influenza il comportamento dei fibroblasti residenti e ingenui31,32. Pertanto, l'importanza di studiare le cellule nel loro ambiente di tessuto ospite non può essere sottovalutata.
In sintesi, il nostro protocollo fornisce un'importante piattaforma per quantificare la riepitelizzazione della ferita umana, esplorare i fattori regolatori e testare la validità e l'efficacia delle potenziali terapie12,13. Mentre i test pre-clinici richiedono ancora approcci in vivo, una strategia combinata che utilizza tessuto umano ex vivo e ferite murine in vivo dovrebbe perfezionare il percorso pre-clinico, riducendo l'uso di animali e aumentando la traducibilità tra specie.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Ringraziamo paolo Matteuci e George Smith per aver fornito il tessuto dei pazienti. Siamo anche grati a Miss Amber Rose Stafford per l'assistenza nella raccolta dei tessuti e al Daisy Appeal per la fornitura di strutture di laboratorio.
Materiali
| Name | Company | Catalog Number | Comments |
| 50 mL Falcon Tubes | Falcon | 352070 | For skin washing |
| 1.5 ml TubeOne Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | For whole-mount staining |
| 48-Well CytoOne Plate, TC-Treated | Starlab | CC7682-7548 | For whole-mount staining |
| Acetic Acid Glacial | Fisher Chemical | A/0400/PB15 | Part of fixative |
| Alkyltrimethylammonium Bromide | Sigma-Aldrich | M7635 | Part of fixative |
| Anti-Alpha Smooth Muscle Actin Antibody [1A4] | Abcam | ab7817 | Stains blood vessels |
| Anti-Collagen I Antibody | Abcam | ab34710 | Stains collagen |
| Anti-Cytokeratin 14 Antibody [LL002] | Abcam | ab7800 | Stains epidermis |
| CD1A Antibody (CTB6) | Santa Cruz Biotechnology | sc-5265 | Stains Langerhans cells |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Thermo Fisher Scientific | 62247 | Counterstain for cell nuclei |
| Falcon 60mm Petri dishes | Falcon | 353004 | Human ex vivo culture |
| Fibronectin Antibody (EP5) | Santa Cruz Biotechnology | sc-8422 | Stains fibronectin |
| Formaldehyde, Extra Pure, Solution 37-41%, SLR | Fisher Chemical | F/1501/PB17 | Part of fixative |
| Gauze Swabs | Medisave | CS1650 | To clean skin |
| Gibco™ Antibiotic-Antimycotic Solution | Thermo Fisher Scientific | 15240062 | Human ex vivo culture |
| Gibco DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960044 | Human ex vivo culture |
| Gibco Fetal Bovine Serum | Thermo Fisher Scientific | 10500064 | Human ex vivo culture |
| Gibco HBSS, no calcium, no magnesium | Thermo Fisher Scientific | 14170088 | Human ex vivo culture |
| Gibco L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 | Human ex vivo culture |
| Hydrogen Peroxide | Sigma-Aldrich | H1009-100ML | For immunoperoxidase staining |
| ImageJ Software | National Institutes of Health | N/A | For image analysis |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Mouse, Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Rabbit, Alexa Fluor 594 | Thermo Fisher Scientific | A11012 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fisher Scientific | L3224 | For viability assessment of tissue |
| Iris Forceps, 10 cm, Curved, 1x2 teeth | World Precision Instruments | 15917 | To create wounds |
| Iris Scissors, 11 cm, Curved, SuperCut, Tungsten Carbide | World Precision Instruments | 501264 | To create wounds |
| Iris Scissors, 11 cm, Straight, SuperCut, Tungsten Carbide | World Precision Instruments | 501263 | To remove adipose tissue |
| Keratin 1 Polyclonal Antibody, Purified | Biolegend | 905201 | Stains epidermis |
| Keratin 14 Polyclonal Antibody, Purified | Biolegend | 905301 | Stains epidermis |
| LSM 710 Confocal Laser Scanning Microscope | Carl Zeiss | Discontinued | For fluorescent imaging |
| Merck Millipore Absorbent pads | Merck Millipore | AP10045S0 | Human ex vivo culture |
| Merck Millipore Nylon Hydrophilic Membrane Filters | Merck Millipore | HNWP04700 | Human ex vivo culture |
| Normal Goat Serum Solution | Vector Laboratories | S-1000-20 | Animal serum used depends on secondary antibody |
| Phosphate Buffer Solution | Sigma-Aldrich | P3619 | For wash buffer |
| Sodium Azide | Sigma-Aldrich | S2002 | For blocking buffer |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | Part of fixative |
| Sterilisation Pouches | Medisave | SH3710 | To sterilise instruments |
| Stiefel 2mm biopsy punches | Medisave | BI0500 | For partial thickness wound |
| Stiefel 6mm biopsy punches | Medisave | BI2000 | For outer explant |
| Thermo Scientific Sterilin Standard 90mm Petri Dishes | Thermo Fisher Scientific | 101VR20 | To prepare skin |
| Triton X-100 | Fisher Chemical | T/3751/08 | For wash buffer |
| VECTASTAIN Elite ABC-HRP Kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-6101 | For immunoperoxidase staining; HRP kit used depends on primary antibody |
| Vector NovaRED Substrate Kit, Peroxidase (HRP) | Vector Laboratories | SK-4800 | For immunoperoxidase staining |
| Wireless Digital Microscope | Jiusion | N/A | For brightfield imaging |
Riferimenti
- Lindholm, C., Searle, R. Wound management for the 21st century: combining effectiveness and efficiency. International Wound Journal. 13, 5-15 (2016).
- Guest, J. F., et al. Health economic burden that different wound types impose on the UK's National Health Service. International Wound Journal. 14 (2), 322-330 (2017).
- Guest, J. F., Fuller, G. W., Vowden, P. Diabetic foot ulcer management in clinical practice in the UK: costs and outcomes. International Wound Journal. 15 (1), 43-52 (2018).
- López-Valverde, M. E., et al. Perioperative and long-term all-cause mortality in patients with diabetes who underwent a lower extremity amputation. Diabetes Research and Clinical Practice. 141, 175-180 (2018).
- Wilkinson, H. N., Hardman, M. J. The role of estrogen in cutaneous ageing and repair. Maturitas. 103, 60-64 (2017).
- Frykberg, R. G., Banks, J. Challenges in the treatment of chronic wounds. Advances in Wound Care. 4 (9), 560-582 (2015).
- Wilkinson, H. N., Hardman, M. J. Wound healing: cellular mechanisms and pathological outcomes. Open Biology. 10 (9), 200223 (2020).
- Ansell, D. M., Holden, K. A., Hardman, M. J. Animal models of wound repair: Are they cutting it. Experimental Dermatology. 21 (8), 581-585 (2012).
- Elliot, S., Wikramanayake, T. C., Jozic, I., Tomic-Canic, M. A modeling conundrum: murine models for cutaneous wound healing. Journal of Investigative Dermatology. 138 (4), 736-740 (2018).
- Mazio, C., et al. Pre-vascularized dermis model for fast and functional anastomosis with host vasculature. Biomaterials. 192, 159-170 (2019).
- Wilkinson, H. N., Iveson, S., Catherall, P., Hardman, M. J. A novel silver bioactive glass elicits antimicrobial efficacy against Pseudomonas aeruginosa and Staphylococcus aureus in an ex vivo skin wound biofilm model. Frontiers in Microbiology. 9, 1450 (2018).
- Wilkinson, H. N., et al. Elevated local senescence in diabetic wound healing is linked to pathological repair via CXCR2. Journal of Investigative Dermatology. 139 (5), 1171-1181 (2019).
- Wilkinson, H. N., et al. Tissue iron promotes wound repair via M2 macrophage polarization and the chemokine (CC motif) ligands 17 and 22. The American Journal of Pathology. 189 (11), 2196-2208 (2019).
- Rhea, L., Dunnwald, M. Murine excisional wound healing model and histological morphometric wound analysis. Journal of Visualized Experiments. 162, e61616 (2020).
- Ansell, D. M., Campbell, L., Thomason, H. A., Brass, A., Hardman, M. J. A statistical analysis of murine incisional and excisional acute wound models. Wound Repair and Regeneration. 22 (2), 281-287 (2014).
- Rizzo, A. E., Beckett, L. A., Baier, B. S., Isseroff, R. R. The linear excisional wound: an improved model for human ex vivo wound epithelialization studies. Skin Research and Technology. 18 (1), 125-132 (2012).
- Olsson, M., et al. The humanistic and economic burden of chronic wounds: a systematic review. Wound Repair and Regeneration. 27 (1), 114-125 (2019).
- Mendoza-Garcia, J., Sebastian, A., Alonso-Rasgado, T., Bayat, A. Optimization of an ex vivo wound healing model in the adult human skin: Functional evaluation using photodynamic therapy. Wound Repair and Regeneration. 23 (5), 685-702 (2015).
- Brownhill, V. R., et al. Pre-clinical assessment of single-use negative pressure wound therapy during in vivo porcine wound healing. Advances in Wound Care. , (2020).
- Diekmann, J., et al. A three-dimensional skin equivalent reflecting some aspects of in vivo aged skin. Experimental Dermatology. 25 (1), 56-61 (2016).
- Vidal Yucha, S. E., Tamamoto, K. A., Nguyen, H., Cairns, D. M., Kaplan, D. L. Human skin equivalents demonstrate need for neuro-immuno-cutaneous system. Advanced Biosystems. 3 (1), 1800283 (2019).
- Dijkgraaf, F. E., et al. Tissue patrol by resident memory CD8+ T cells in human skin. Nature Immunology. 20 (6), 756-764 (2019).
- He, X., de Oliveira, V. L., Keijsers, R., Joosten, I., Koenen, H. J. Lymphocyte isolation from human skin for phenotypic analysis and ex vivo cell culture. Journal of Visualized Experiments. (110), e52564 (2016).
- Pupovac, A., et al. Toward immunocompetent 3D skin models. Advanced Healthcare Materials. 7 (12), 1701405 (2018).
- Ataç, B., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Kim, J. J., et al. A microscale, full-thickness, human skin on a chip assay simulating neutrophil responses to skin infection and antibiotic treatments. Lab on a Chip. 19 (18), 3094-3103 (2019).
- Jardet, C., et al. Development and characterization of a human Th17-driven ex vivo skin inflammation model. Experimental Dermatology. 29 (10), 993-1003 (2020).
- Chen, J. L., et al. Metformin attenuates diabetes-induced tau hyperphosphorylation in vitro and in vivo by enhancing autophagic clearance. Experimental Neurology. 311, 44-56 (2019).
- Demirovic, D., Rattan, S. I. Curcumin induces stress response and hormetically modulates wound healing ability of human skin fibroblasts undergoing ageing in vitro. Biogerontology. 12 (5), 437-444 (2011).
- Wilkinson, H. N., Hardman, M. J. Wound senescence: A functional link between diabetes and ageing. Experimental Dermatology. 30 (1), 68-73 (2020).
- Fisher, G. J., et al. Collagen fragmentation promotes oxidative stress and elevates matrix metalloproteinase-1 in fibroblasts in aged human skin. The American Journal of Pathology. 174 (1), 101-114 (2009).
- Quan, T., Little, E., Quan, H., Voorhees, J. J., Fisher, G. J. Elevated matrix metalloproteinases and collagen fragmentation in photodamaged human skin: impact of altered extracellular matrix microenvironment on dermal fibroblast function. Journal of Investigative Dermatology. 133 (5), 1362 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon