Method Article
Humanes Ex-vivo-Wundmodell und Whole-Mount-Färbeansatz zur genauen Bewertung der Hautreparatur
In diesem Artikel
Zusammenfassung
Hier demonstrieren wir eine optimierte Technik zur Beurteilung der Wundreparatur mit ex vivo menschlicher Haut in Kombination mit einem Whole-Mount-Färbeansatz. Diese Methodik bietet eine präklinische Plattform für die Bewertung potenzieller Wundtherapien.
Zusammenfassung
Chronische nicht heilende Wunden, die vor allem ältere Menschen und Diabetiker betreffen, sind ein bedeutender Bereich des klinisch ungedeckten Bedarfs. Leider sind die derzeitigen chronischen Wundbehandlungen unzureichend, während die verfügbaren präklinischen Modelle die klinische Wirksamkeit neuer Therapien schlecht vorhersagen. Hier beschreiben wir ein präklines Modell mit hohem Durchsatz, um mehrere Aspekte der menschlichen Hautreparaturreaktion zu bewerten. Wunden mit partieller Dicke wurden in der menschlichen Ex-vivo-Haut erzeugt und über einen Heilungszeitverlauf kultiviert. Hautwundbiopsien wurden als Fixiermittel für das Ganzfärbeverfahren gesammelt. Fixierte Proben wurden blockiert und in primären Antikörpern inkubiert, wobei der Nachweis über fluoreszierend konjugierte sekundäre Antikörper erfolgen sollte. Die Wunden wurden gegengefärbt und mittels konfokaler Mikroskopie abgebildet, bevor der prozentuale Wundverschluss (Reepithelisierung) in jeder Biopsie berechnet wurde. Unter Anwendung dieses Protokolls zeigen wir, dass 2 mm Exzisionswunden, die in gesunder Spenderhaut entstehen, bis zum Tag 4-5 nach der Verwundung vollständig reepithelialisiert werden. Im Gegenteil, die Verschlussraten von diabetischen Hautwunden sind signifikant reduziert, begleitet von einer gestörten Barrierereformation. Die Kombination von menschlichen Hautwunden mit einem neuartigen Whole-Mount-Färbeansatz ermöglicht eine schnelle und reproduzierbare Methode zur Quantifizierung der Ex-vivo-Wundreparatur. Insgesamt bietet dieses Protokoll eine wertvolle menschliche Plattform, um die Wirksamkeit potenzieller Wundtherapien zu bewerten und präklinische Tests und Validierungen zu transformieren.
Einleitung
Chronische, nicht heilende Wunden, die bei älteren Menschen und Diabetikern weit verbreitet sind, sind ein stark ungeschätzter Bereich des klinischen ungedeckten Bedarfs. Diese Wunden stellen eine große physische und psychische Belastung für die Patienten dar und kosten Gesundheitsdienstleister jedes Jahr Milliarden, um1zu behandeln. Trotz eines verbesserten Verständnisses der Wundbiologie und Fortschritten in der Technologie können bis zu 40% der chronischen Wunden nach bester Standardversorgung immer noch nicht heilen2. So benötigen 14-26% der Patienten mit diabetischen Fußgeschwüren anschließend eine Amputation3,während die 5-Jahres-Sterblichkeitsrate nach der Amputation bei etwa 70%liegt 4. Infolgedessen besteht ein dringender Bedarf an der Entwicklung wirksamer neuer Therapien, um die Lebensqualität der Patienten zu verbessern und gleichzeitig die erhebliche Gesundheitsbelastung durch schlecht heilende Wunden zu reduzieren. Schlecht prädiktive präklinische Modelle bleiben eine erhebliche Hürde für die Entwicklung wirksamer neuer Therapien.
Die Wundreparatur ist ein dynamischer und facettenreicher Prozess, der eine Vielzahl von Zelltypen, unzählige Kommunikationsebenen und eine Gewebeumgebung umfasst, die zeitlich umgestaltet wird. Die Hautheilung wird durch vier haupt reparative Stadien untermauert: Hämostase, Entzündung, Proliferation und Matrixumbau. Diese Stadien wirken letztendlich, um Blutverlust und Infektionen zu verhindern, die Wundoberfläche zu schließen (ein Prozess, der als Reepithelisierung bezeichnet wird) und die Haut in einen unverletzten Zustandzurückvergeben 5. Chronische Wunden sind mit einer vielfältigen Ätiologie und einer weit verbreiteten Störung der Heilungsprozesse verbunden6, was die Identifizierung therapeutischer Ziele weiter erschwert. Dennoch wurde eine breite Palette von Modellen entwickelt, um sowohl die molekularen und zellulären Treiber der Wundpathologie aufzuklären als auch neue therapeutische Ansätze zu testen7.
Das am häufigsten verwendete Wundreparaturmodell ist die akute Wunde in der Maus. Mäuse sind für mechanistische Studien in hohem Maße beherrschbar und liefern validierte Modelle des Alterns und Diabetes8. Trotz der allgemeinen Ähnlichkeiten zwischen der Heilung von Maus und Mensch bleiben Unterschiede zwischen den Arten in der Hautstruktur und der Heilungsdynamik bestehen. Dies bedeutet, dass die meisten murinen Wunduntersuchungen nicht leicht auf die Klinik übertragen werdenkönnen 9. Folglich gab es einen Schub in Richtung menschlicher in vitro und ex vivo Systeme mit hoher Anwendbarkeit und Übersetzbarkeit10,11.
Hier bieten wir ein detailliertes Protokoll für die Durchführung von Exzisionswunden mit teildicker Dicke in ex vivo menschlicher Haut. Wir skizzieren auch unseren Whole-Mount-Färbeansatz als eine hochgradig reproduzierbare Methode zur Bewertung der Ex-vivo-Heilung menschlicher Haut. Wir zeigen den Verlauf der epidermalen Reparatur (Re-Epithelisierung) und der anschließenden Barrierebildung und bewerten die Rate des Wundverschlusses bei gesunder und diabetischer menschlicher Haut. Schließlich zeigen wir, wie die Ganzkörperfärbung für die Verwendung mit einer Reihe von Antikörpern angepasst werden kann, um verschiedene Aspekte der Heilungsreaktion zu beurteilen.
Protokoll
Menschliche Haut wurde von Patienten erhalten, die sich einer rekonstruktiven Operation im Castle Hill Hospital und im Hull Royal Infirmary (Hull, UK) unterzogen, die vollständig informierte, schriftliche Patienteneinwilligung, institutionelle Richtlinien und ethische Genehmigungen (LRECs: 17/SC/0220 und 19/NE/0150) vorsaßen. Nicht-diabetische Haut wurde von Patienten gesammelt, die sich einer Routineoperation unterzogen (Durchschnittsalter = 68 Jahre). Diabetische Haut wurde aus Spendern ausgewählt, die Typ-II-Diabetes und eine Anamnese von Ulzerationen (Durchschnittsalter = 81 Jahre) festgestellt hatten. Proben aus der Operation wurden in Haltemedien transportiert und sofort nach Ankunft im Labor verarbeitet. Alle experimentellen Schritte mit nicht fixiertem menschlichem Gewebe wurden bei Biosafety Level-2 (BSL-2) in einer Laminar-Flow-Biosicherheitswerkbank der Klasse II durchgeführt.
1. Herstellung von Hautkulturmedien und Färbereagenzien
HINWEIS: Alle Details zu Reagenzien und Verbrauchsmaterialien finden Sie in der Materialtabelle. Stellen Sie sicher, dass alle Reagenzien und Geräte, die für die Verarbeitung und Kultur von menschlichem Gewebe verwendet werden, steril sind. Sterilisieren Sie Instrumente vor der Verwendung und dekontaminieren Sie mit Desinfektionsmittel nach Kontakt mit dem Gewebe. Dekontamination von Abfallprodukten in 1% Desinfektionsmittel vor der Entsorgung.
- Haltemedien: Ergänzen Sie Dulbeccos Modified Eagle Medium (DMEM) mit hoher Glukose mit 2 mM L-Glutamin und 4% (v / v) Antibiotikum-Antimykotika-Lösung.
- Hanks ausgewogene Salzlösung (HBSS) mit Antibiotika: Fügen Sie HBSS 4% (v / v) antibiotische antimykotische Lösung hinzu. Bis zum Gebrauch bei 4 °C lagern.
- Dulbeccos phosphatgepufferte Kochsalzlösung (DPBS): Zubereiten von DPBS durch Lösen von 9,6 g DPBS-Pulver pro Liter destilliertem Wasser (dH2O). Autoklav zum Sterilisieren und Lagern bei 4 °C bis zum Gebrauch.
- Menschliche Hautwachstumsmedien: Ergänzen Sie DMEM mit hohem Glukosegehalt mit 2 mM L-Glutamin, 1% (v / v) antibiotisch-antimykotische Lösung und 10% (v / v) fetalem Rinderserum. Bis zum Gebrauch bei 4 °C lagern.
- Hautfixiermittel: Zu 450 mldH2Owerden 40 ml Formaldehydlösung, 10 ml Eisessig, 4,5 g Natriumchlorid und 0,25 g Alkyltrimethylammoniumbromid hinzugefügt. Bei Raumtemperatur (RT) lagern und innerhalb weniger Tage verwenden.
ACHTUNG: Fixiermittel ist gefährlich (reizend und brennbar). Vorsichtig handhaben und über einen geeigneten Weg entsorgen. - Phosphatgepufferte Kochsalzlösung (PBS): Bereiten Sie PBS für die Färbung auf ganzer Montage vor, indem Sie 6 g Natriumchlorid zu 100 ml Phosphatpufferlösung und 900 mldH2O hinzufügen.
- Färbewaschpuffer: 0,5% (v/v) Triton X-100 in PBS auflösen.
- Blockierpuffer: Fügen Sie 0,2% (w / v) Natriumazid und 2% (v / v) Tierserum zum Färbewaschpuffer hinzu. Bei 4 °C bis zu zwei Wochen lagern.
HINWEIS: Block im Serum der sekundären Antikörper-Wirtsart. Natriumazid verhindert das Bakterienwachstum während der Inkubation. - DAPI-Arbeitslösung: Bereiten Sie einen 5 mg/ml-Vorrat von 4′,6-Diamidino-2-phenylindol (DAPI) in Dimethylsulfoxid vor. Verdünnen Sie den Schaft 1:1.000 in Färbewaschpuffer, um eine 5 μg/ ml DAPI-Arbeitslösung zu erhalten.
- Peroxidaseblock: Fügen Sie 0,3% (v / v) Wasserstoffperoxid zum Färbewaschpuffer hinzu. Bis zum Gebrauch bei 4 °C lagern. Im Dunkeln aufbewahren, um Zersetzung zu verhindern.
- ABC-HRP Bausatz:
- HRP-konjugierter sekundärer Antikörper: 1 Tropfen biotinyliertes Kaninchen-Antiziegen-IgG in 5 ml Färbepuffer. Bei 4 °C bis zu zwei Wochen lagern.
HINWEIS: Das verwendete Kit/sekundär hängt von der Wirtsart des primären Antikörpers ab. - Avidin-Biotin-Komplex (ABC) Reagenz: 2 Tropfen Reagenz A und 2 Tropfen Reagenz B in 5 ml Färbewaschpuffer. ABC-Reagenz sollte mindestens 30 Minuten vor der Verwendung zubereitet werden. Bei 4 °C bis zu zwei Wochen lagern.
- HRP-konjugierter sekundärer Antikörper: 1 Tropfen biotinyliertes Kaninchen-Antiziegen-IgG in 5 ml Färbepuffer. Bei 4 °C bis zu zwei Wochen lagern.
- Peroxidase-Substrat: 3 Tropfen Reagenz 1, 2 Tropfen Reagenz 2, 2 Tropfen Reagenz 3 und 2 Tropfen Wasserstoffperoxid in 5 ml dH2O. Peroxidase-Substrat sollte unmittelbar vor der Verwendung frisch zubereitet werden und kann nicht gelagert werden.
2. Vorbereitung der Haut auf die Verwundung
HINWEIS: Diese Schritte sollten in einer Biosicherheitswerkbank mit laminarer Strömung der Klasse II durchgeführt werden.
- Sammeln Sie die Haut in haltemedien und transportieren Sie sie zum BSL-2-Schrank.
- Legen Sie die Hautdermis mit der Seite nach unten in eine 90 mm sterile Petrischale und entfernen Sie das Fettgewebe mit einer sterilen Schere.
- Legen Sie die Haut für 10 min bei RT in einen 50-ml-Röhrchen mit 25 ml HBSS mit Antibiotika. Schütteln Sie intermittierend, um Restblut und Fettgewebe zu entfernen.
- Wiederholen Sie Schritt 2.3 mit einem neuen 50-ml-Röhrchen.
- Legen Sie die Haut in ein frisches 50-ml-Röhrchen mit 25 ml HBSS, diesmal ohne Antibiotika für 10 min bei RT. Schütteln Sie wie in Schritt 2.3.
- Führen Sie eine abschließende Hautspülung durch, indem Sie die Haut in einen neuen Schlauch mit 25 ml DPBS legen. Die Haut ist jetzt bereit zum Aufwickeln.
3. Ex-vivo-Wunden menschlicher Haut erzeugen
HINWEIS: Diese Schritte sollten in einer Biosicherheitswerkbank mit laminarer Strömung der Klasse II durchgeführt werden.
- Bereiten Sie die Hautkulturschalen vor der Verwundung zu. In einer 60 mm Petrischale zwei sterile absorbierende Pads stapeln und 4 ml menschliche Hautmedien über die Seite der Schüssel hinzufügen. Legen Sie eine sterile Nylonfiltermembran auf den saugfähigen Pad-Stapel.
HINWEIS: Hautmedien können je nach den erforderlichen Behandlungsbedingungen verändert werden. Auf jedem Stapel können bis zu drei Wundausscheidungen kultiviert werden. - Trocknen Sie die Hauthaut auf steriler Gaze in einer 90 mm Petrischale, um verbleibende DPBS zu entfernen.
HINWEIS: Dies verhindert, dass die Haut bei Wunden herumrutscht. - Legen Sie die Hautdermis mit der Seite nach unten auf einen sauberen 90 mm Petrischalendeckel und tupfen Sie die Epidermis trocken mit frischer steriler Gaze.
HINWEIS: Es ist einfacher, die Haut in einem Petrischalendeckel zu wickeln als die Basis. Nachfolgende Arbeiten sollten schnell durchgeführt werden, um ein Austrocknen der Haut zu verhindern. - Halten Sie die Haut straff, drücken Sie einen 2 mm Biopsiestempel gegen die Haut und drehen Sie sich sanft. Nicht vollständig durch die Haut schlagen.
HINWEIS: Wunden mit teildicker Dicke sind so konzipiert, dass sie durch die Epidermis und teilweise in die Dermis schlagen. Es kann eine Variabilität zwischen Spender und von Ort zu Stelle in der Kraft geben, die erforderlich ist, um die teilweise Dicke der Wunde zu erzeugen. - Verwenden Sie eine gebogene Zahngewebezette, um jede Seite der 2-mm-Wunde aufzunehmen, und haken Sie eine gebogene Irisschere unter der 2-mm-Wunde ein, um sie gleichmäßig auszuschneiden.
- Biopsie um die zentrale 2 mm Wunde mit einem 6 mm Biopsiestempel, um eine 6 mm Explant mit einer teildicken 2 mm Wunde in der Mitte zu erzeugen.
HINWEIS: Ein 6-mm-Biopsiestempel kann verwendet werden, um die Haut zu punkten, um zu markieren, wo sich jede 2-mm-Wunde befrüden sollte. Achten Sie darauf, das Gewebe nicht vollständig zu durchbohren. Erstellen Sie Wundausscheidungen in einem Wabenmuster, um Verschwendung zu reduzieren. - Legen Sie die Wundentplants epidermis mit der Seite nach oben auf den Nylonfiltermembranstapel (vorbereitet in Schritt 3.1).
HINWEIS: Achten Sie beim Umgang mit Wundexplanten darauf, die zentrale Wunde nicht zu beschädigen. Verwenden Sie eine kleine Zette und nehmen Sie jede Explant an gegenüberliegenden Seiten auf. - Inkubieren Sie Wunden bei 32-37 °C und 5% CO2 in einer befeuchteten Atmosphäre (90-95%) für 1-7 Tage. Ersetzen Sie das Medium alle 2-3 Tage.
4. Ganzfärben von Ex-vivo-Wunden
HINWEIS: In diesem Abschnitt werden Immunfluoreszenz- und Immunperoxidase-Färbemethoden beschrieben. Mischen Sie alle Reagenzien vor Gebrauch gut.
- Fluoreszierende färbeende Methode
- Wundausscheidungen in 1,5-ml-Mikrozentrifugenröhrchen mit 500 μL Hautfixiermittel sammeln und über Nacht bei 4 °C inkubieren.
HINWEIS: Das in diesem Protokoll verwendete Fixiermittel funktioniert gut für die beschriebenen Antikörper. Für andere Antikörper ist eine Optimierung erforderlich. Eine Gewebefixierung von mehr als 24 Stunden kann zu einer Überfixierung führen. - Am nächsten Tag das Fixiermittel entfernen und durch 1 ml Fleckenwaschpuffer ersetzen. Biopsien können bis zu 2 Wochen vor der Färbung in Färbewaschpuffern bei 4 °C gelagert werden.
HINWEIS: Verwenden Sie für alle Waschpufferschritte eine serologische Pipette oder Pipettenspitze, wobei Sie darauf achten, die Wunde nicht zu beschädigen. - Saugen Sie den Fleckenwaschpuffer an und spülen Sie ihn noch einmal mit 1 ml Färbewaschpuffer durch.
- Berechnen Sie die Menge des Sperrpuffers, die für die Schritte 4.1.5-4.1.6 erforderlich ist (Anzahl der Proben x 300 μL = Menge des Sperrpuffers in μL). Machen Sie bei Bedarf zusätzlichen Puffer.
- Fügen Sie jeder Probe 150 μL Blockierpuffer hinzu und inkubieren Sie sie für 1 h bei RT. Stellen Sie bei allen Färbeschritten sicher, dass jede Probe ausreichend bedeckt ist und dass keine Blasen die Oberfläche der Biopsiewunde bedecken.
HINWEIS: Dieser Schritt kann in 1,5-ml-Mikrozentrifugenröhrchen oder in einer 48-Well-Platte durchgeführt werden. Wenn Sie eine 48-Well-Platte verwenden, inkubieren Sie die Wunden mit dem Gesicht nach unten in jedem Brunnen. - Verdünnen Sie den primären Antikörper im verbleibenden Blockierungspuffer.
HINWEIS: Anti-Maus-Keratin 14 (K14) verdünnt 1:1.000 im Blockierpuffer funktioniert gut. Optimieren Sie diesen Schritt für die Verwendung mit anderen Antikörpern oder mehreren Sonden. - Saugen Sie den Blockierpuffer an und fügen Sie 150 μL primären Antikörper pro Vertiefungs-/Mikrozentrifugenröhrchen hinzu. Inkubieren Sie Wundarplanten in primären Antikörpern bei 4 °C über Nacht.
- Am nächsten Tag den primären Antikörper absaugen und in einem Färbewaschpuffer mit 0,2% Natriumazid für 1 h bei RT (500 μL pro Probe) abspülen.
- Führen Sie drei weitere Spülschritte mit einem Färbewaschpuffer durch (30 min pro Waschgang, 500 μL pro Probe).
- Verdünnen Sie den fluoreszierend konjugierten sekundären Antikörper in Färbewaschpuffer (z. B. Ziegen-Antimaus 488 bei 1:400 Verdünnung).
- Berechnen Sie die erforderliche Menge an sekundären Antikörpern (Anzahl der Proben x 150 μL = Menge in μL).
- 150 μL sekundärer Antikörper in jede Vertiefung/Mikrozentrifugenröhre geben. Inkubieren Sie 1 h bei RT. Führen Sie die Inkubationsschritte 4.1.10 - 4.1.16 im Dunkeln durch, da der sekundäre Antikörper lichtempfindlich ist.
HINWEIS: Dieser Schritt kann bei Bedarf bei 4 °C über Nacht durchgeführt werden. Optimieren Sie die Konzentration sekundärer Antikörper, die für ein angemessenes Signal und eine begrenzte Hintergrundfärbung erforderlich ist. - Entfernen Sie den sekundären Antikörper und führen Sie 3 x 30 min Spülungen mit Färbewaschpuffer (500 μL pro Probe) durch.
- Entsorgen Sie den übrig gebliebenen Waschpuffer und berechnen Sie die Menge der erforderlichen DAPI-Arbeitslösung (gemäß Schritt 4.1.11).
- Gegenbeflecken Sie jede Explant mit 150 μL DAPI-Arbeitslösung für 10 min bei RT.
HINWEIS: DAPI färbt Zellkerne blau. Hoechst Farbstoff kann als Alternative zu DAPI verwendet werden. - Führen Sie zwei abschließende 30-minütige Wäschen mit Färbepuffer durch (500 μL pro Probe). Biopsien können bis zu zwei Wochen vor der Bildgebung im Färbewaschpuffer bei 4 °C im Dunkeln gelagert werden.
- Wundausscheidungen in 1,5-ml-Mikrozentrifugenröhrchen mit 500 μL Hautfixiermittel sammeln und über Nacht bei 4 °C inkubieren.
- Hellfeld-Färbemethode.
- Führen Sie die Schritte 4.1.1 - 4.1.3 aus.
- Löschen Sie die endogene Peroxidaseaktivität mit Peroxidaseblock bei 4 °C über Nacht.
HINWEIS: Dieser Schritt ist wichtig, wenn ein HRP-konjugierter Antikörper verwendet wird, um unspezifische Hintergrundfärbungen aus dem Gewebe zu reduzieren. Stark vaskularisiertes Gewebe enthält mehr endogene Peroxidase-Aktivität. - Entsorgen Sie den Peroxidaseblock und spülen Sie ihn zweimal für 30 minuten im Färbewaschpuffer ab.
- Führen Sie die Schritte 4.1.4 - 4.1.8 aus.
HINWEIS: Waschungen nach Schritt 4.1.7 sind besonders wichtig, um Natriumazid aus den Proben zu entfernen. Wenn Natriumazid nicht ausreichend entfernt wird, inaktiviert es die HRP und stört die Fleckenerkennung. - 150 μL HRP-konjugierter sekundärer Antikörper in jedes Well/Mikrozentrifugenröhrchen geben und über Nacht bei 4 °C oder 1 h bei RT inkubieren.
- Entfernen Sie den sekundären Antikörper und führen Sie 3 x 30 min Wäschen im Färbewaschpuffer durch.
- 150 μL ABC-Reagenz in jede Vertiefung/Mikrozentrifugenröhrchen geben und über Nacht bei 4 °C oder 1 Stunde bei RT inkubieren.
- Saugen Sie das ABC-Reagenz an und führen Sie 3 x 30 min Wäschen im Fleckenwaschpuffer durch.
- Fügen Sie 150 μL Peroxidase-Substrat zu einer Explant hinzu und bestimmen Sie die Zeit, die benötigt wird, um eine spürbare Farbänderung zu erkennen.
HINWEIS: Wählen Sie eine Probe, bei der starke Flecken erwartet werden. In diesem Fall ein roter Ring, um die wandernde Epidermis (K14) anzuzeigen. 3,3'-Diaminobenzidin-4 oder jedes andere geeignete chromogene Substrat kann als Ersatz für dieses Peroxidasesubstrat verwendet werden. - Sobald eine Farbänderung beobachtet wurde, entfernen Sie das Peroxidasesubstrat und ersetzen Sie es durch 1 ml dH2O.
- Wiederholen Sie die Peroxidasesubstratdetektion für die anderen Explanten und inkubieren Sie sie für die in Schritt 4.2.11 festgelegte Zeit.
- Spülen Sie alle Explants mit 1 mldH2Oab, um das verbleibende Peroxidasesubstrat zu entfernen. Obwohl Explants bis zu einer Woche bei 4 °C vor der Bildgebung gelagert werden können, ist es besser, sie so schnell wie möglich abbilden zu können, um ein Auslaugen des Peroxidasesubstrats in das dH2O im Laufe der Zeit zu verhindern.
5. Bildgebung und Quantifizierung
- Fluoreszierende Bildgebung
HINWEIS: Die fluoreszierende Bildgebung wird mit einem konfokalen Laser-Scanning-Mikroskop durchgeführt. Ein invertiertes Fluoreszenzmikroskop kann jedoch ausreichen, um 2D-Bilder zu erhalten, um die Wundverschlussraten zu quantifizieren. Achten Sie bei der Auswahl sekundärer Antikörper darauf, dass die gewählten Fluorochrome mit den Anregungs- und Emissionsspektren der verfügbaren Mikroskopiegeräte kompatibel sind.- Verwenden Sie ein konfokales Laserscanning-Mikroskop, das mit einem 2,5-fachen, 10-fachen und 20-fachen Objektiv, einer motorisierten x-y-z-Bühne, einer Digitalkamera und einer Erfassungssoftware ausgestattet ist. Schalten Sie den Durchlichtdetektor (TPMT) ein, um eine einfache Visualisierung jeder Biopsie zu ermöglichen und die Messung des gesamten Wundverschlusses zu ermöglichen. Alternativ können Sie jede Wunde mittels Hellfeldmikroskopie nach der Fluoreszenzbildgebung messen.
- Legen Sie eine 60-mm-Petrischalenbasis auf die Bildgebungsplattform und fügen Sie eine dünne Schicht (ca. 1 ml) DPBS hinzu.
HINWEIS: Wenn zu viel DPBS verwendet wird, bewegt sich die Biopsie während der Bildgebung. Alternativ können Sie eine 48-Well-Platte verwenden, wenn ein Plattenhalter verfügbar ist. - Verwenden Sie eine kleine Gewebezette, um Wundexplants aus Vertiefungen / Mikrozentrifugenröhrchen in die Petrischale zu übertragen, die DPBS enthält. Legen Sie die Biopsiewunde mit der Seite nach unten in die Petrischale.
- Verwenden Sie das Okular und die Leuchtstofflampe, um die Wunde zu lokalisieren und zu fokussieren. Wenn Blasen unter der Probe im Sichtfeld eingeschlossen sind, nehmen Sie die Wunde mit einer Gewebezette auf und positionieren Sie sie neu.
- Richten Sie die Bildgebungssoftware ein und stellen Sie sicher, dass die Lochgröße zwischen den Kanälen für eine optimale Konfoalität gewährleistet ist. Überprüfen Sie dazu den Wert einer luftigen Einheit für jeden Kanal und wählen Sie den größten Wert aus. Wählen Sie Scangeschwindigkeit, Bildqualität und Mittelwertbildung.
HINWEIS: Die Fluorochrome der konjugierten sekundären Antikörper und der gewählte Gegenfleck (z. B. DAPI) bestimmen die erforderlichen Kanäle. - Schalten Sie die Live-Erfassungssoftware ein und passen Sie die Laserleistung und -verstärkung jedes Kanals auf die Werte an, die zur Visualisierung von Flecken erforderlich sind. Reduzieren Sie Hintergrundgeräusche, indem Sie den digitalen Offset erhöhen.
- Positionieren Sie die Wunde in der Mitte der Abbildungsebene.
HINWEIS: Wenn die Wunde nicht das gesamte Bild ausfüllt, weil ein kleineres Objektiv verwendet wird oder eine größere Wunde entsteht, nehmen Sie eine Bildplatte und fügen Sie sie zusammen (manuell oder mit einer Kachelfunktion in der entsprechenden Bildgebungssoftware). - Erfassen Sie Bilder der Wundbiopsien. Verwenden Sie die gleichen Bildeinstellungen zwischen Explants.
HINWEIS: Bilder mit höherer Leistung ermöglichen die Beurteilung von Gewebestrukturen und zellulärer Markerexpression und -ortung. - Sammeln Sie serielle Z-Stapel durch die Wunde, insbesondere wenn das Gewebe nicht vollständig flach gegen die Petrischale ist. Verwenden Sie Analysesoftware, um den Z-Stapel in ein einziges Projektionsbild mit maximaler Intensität zu reduzieren.
- Hellfeld-Bildgebung
HINWEIS: Die Hellfeldbildgebung von immunperoxidasegefärbten Biopsien kann auf verschiedene Arten durchgeführt werden.- Invertierte mikroskopische Bildgebung: Bereiten Sie Wundausscheidungen für die Bildgebung vor, indem Sie sie in eine Petrischale/Vertiefung legen, wie in den Schritten 5.1.2-5.1.3 beschrieben. Erfassen Sie digitale Bilder unter Hellfeldbeleuchtung auf einem invertierten Mikroskop, das mit einer Digitalkamera ausgestattet ist. Fügen Sie bei Bedarf mehrere Bilder zusammen.
- Drahtlose digitale Mikroskopbildgebung: Verwenden Sie ein drahtloses Digitalmikroskop, das an ein Telefon oder einen Laptop angeschlossen ist, um qualitativ hochwertige Bilder auf kostengünstige Weise zu erhalten. Legen Sie die mit der Seite nach oben aufgewickelten Explanten auf etwas Gewebe und entfernen Sie alle restlichen dH2O (oder Fleckenwaschpuffer) aus der Probenlagerung. Positionieren Sie die Wundausscheidung in der Mitte des Mikroskop-Sichtfeldes. Erfassen Sie Bilder mit der angeschlossenen Kamera.
- Quantifizierung
HINWEIS: Der prozentuale Wundverschluss kann in jeder Software quantifiziert werden, mit der Freihandformen gezeichnet und gemessen werden können. ImageJ kann verwendet werden, um die Quantifizierung wie folgt durchzuführen:- Öffnen Sie das zu quantifizierende Bild in der ImageJ-Software.
- Verwenden Sie das Freihandformwerkzeug, um die Außenseite der reepithelialisierten Wunde zu zeichnen, wo sie auf die normale Haut trifft. Drücken Sie M (oder analyze | Measure), um eine "äußere" Flächenmessung zu erhalten.
HINWEIS: Die reepithelialisierte Wundgewebetextur unterscheidet sich von normaler Haut. Die Bilder müssen vor dieser Art der Analyse nicht skaliert werden. - Verwenden Sie das Freihandformwerkzeug, um den offenen Wundbereich zu zeichnen. Hier trifft die offene Wunde auf den Innenrand des reepithelialisierenden Gewebes. Drücken Sie M (oder analyze | Measure), um eine "innere" Flächenmessung zu erhalten.
- Verwenden Sie die folgende Gleichung, um eine prozentuale Wund-Reepithelisierung/ -schließung abzuleiten:
% Verschluss = (Äußerer Wundbereich - Innerer Wundbereich) / (Äußerer Wundbereich) x 100
HINWEIS: Die prozentuale Flächenabdeckung von Antikörpern kann auf die gleiche Weise (z. B. K14) oder als Prozentsatz der gesamten Wundfläche abgeleitet werden. Die prozentuale Intensität kann auch semi-quantitative Informationen über die Expression von Markern auf Gewebeebene liefern, während die High-Power-Bildgebung Expressionsdaten auf zellulärer Ebene präsentiert.
Ergebnisse
In diesem Bericht stellen wir einen neuartigen Ex-vivo-Ansatz zur Hautverwundung und ganzer Färbung vor, um Faktoren zu bewerten, die die menschliche Hautreparaturreaktion beeinflussen. Abbildung 1A zeigt ein Schema der Prozedurleitung, die je nach Wundinkubationszeiten in 3-10 Tagen durchgeführt werden kann. Die teildicken Wunden werden auf Membranstapeln an der Luft: Membranschnittstelle kultiviert und können für die Färbung auf ganzer Montage gesammelt, in Paraffin oder OCT-Medium für die allgemeine Histologie eingebettet oder für die biochemische Analyse in flüssigem Stickstoff eingefroren werden (Abbildung 1B). Wir erzeugen in der Regel 2 mm teildicke Wunden in der Mitte von 6 mm Explantierungen. Die Größe der Wunde und der umgebenden Explant kann jedoch je nach Anforderung verändert werden. Das Whole-Mount-Verfahren wurde sowohl für immunperoxidase- als auch für Immunfluoreszenz-Färbemethoden erfolgreich angepasst (Abbildung 1C).
Die Immunfluoreszenz ermöglicht die Untersuchung von Gewebe mit mehreren Antikörpern. Dazu empfehlen wir, primäre Antikörper zu verwenden, die in verschiedenen Spezies gezüchtet wurden, und spezies-abgestimmte fluoreszierende fluoreszierende sekundäre Antikörper, um die reaktivität über verschiedene Spezies zu begrenzen. Antikörperkonzentrationen und Inkubationszeiten müssen optimiert werden. Wenn eine Hintergrundfärbung beobachtet wird, reduzieren Sie die Antikörperkonzentrationen, erhöhen Sie die Waschschritte und fügen Sie dem sekundären Antikörper einen Blockierungspuffer hinzu. Die Lebensfähigkeit von Frischem Gewebe kann direkt mit handelsüblichen Lebensfähigkeitsfarbstoffen beurteilt werden (siehe Materialtabelle). Wir zeigen auch, dass Gewebe nach der Lebensfähigkeitsfärbung fixiert und erfolgreich abgebildet werden kann, wenn es praktisch geeignet ist (Abbildung 1D).
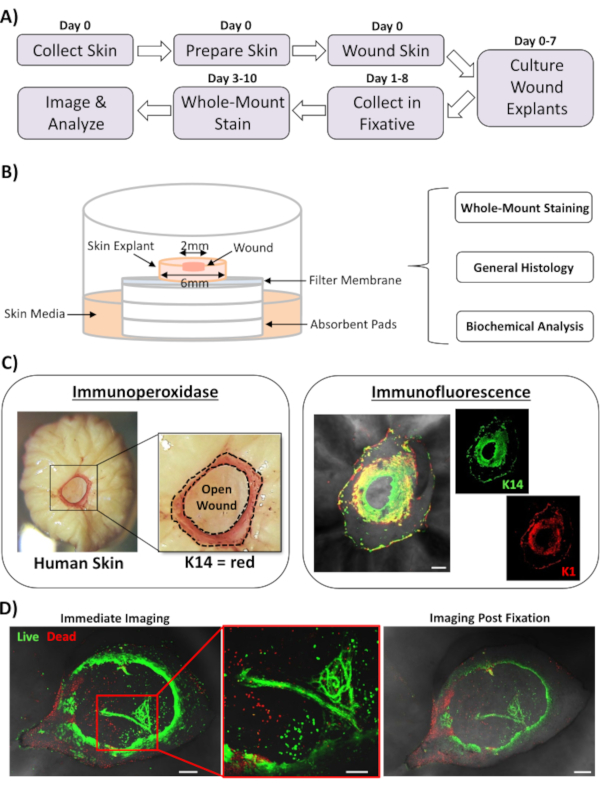
Abbildung 1: Der Ansatz der menschlichen Ex-vivo-Verwundung und der Färbung auf ganzer Montierung. (A) Pipeline, die den verfahrenstechnischen Arbeitsablauf von der Hauterfassung und der Durchführung von Ex-vivo-Wunden bis hin zur Färbung von Gewebe und der Analyse von Daten darstellt. (B) Diagramm zur Demonstration des menschlichen Ex-vivo-Hautwundkultursystems mit routinemäßig durchgeführten Analysen am Gewebe. (C) Die Ganzmontagefärbung kann sowohl mit Immunperoxidase- als auch mit Immunfluoreszenztechniken eingesetzt werden. K14 = Keratin 14. (D) Lebendes Gewebe kann mit handelsüblichen Lebensfähigkeitsfarbstoffen gefärbt und nach der Fixierung erfolgreich abgebildet werden. Bar = 100 μm. Diese Färbung wurde bei nicht-diabetischer Haut durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die am weitesten verbreitete Anwendung für die Ganzfärbung von Wunden besteht darin, die Wundverschlussrate reproduzierbarer zu bestimmen, als dies durch histologische Schnitte möglich ist. Der prozentuale Verschluss wurde als prozentuale Reepithelisierung der Wundoberfläche quantifiziert, wie in Abbildung 2Agezeigt. Die prozentuale Flächenabdeckung bestimmter Marker kann aus der gesamten Wundfläche oder als Prozentsatz der reepithelialisierten Wunde gemessen werden. Wir charakterisierten die Heilung bei gesunder (nicht diabetischer) versus diabetischer Haut über einen Zeitraum von sieben Tagen und sammelten Wunden an jedem Tag nach der Verwundung (repräsentative Bilder, Abbildung 2B). Gesunde Hautwunden schlossen sich im Laufe der Zeit wie erwartet, wobei in den meisten Proben bis zum Tag 4-5 ein vollständiger Verschluss beobachtet wurde. Im Gegenteil, diabetische Hautwunden konnten sich innerhalb des siebentägigen Analysezeitraums nicht vollständig schließen (Abbildung 2C). Eine signifikante Verzögerung des Wundverschlusses wurde zwischen gesunden und diabetischen Hautwunden beobachtet, wenn die Heilungsraten zu jedem Zeitpunkt nach der Verletzung verglichen wurden(P < 0,001 bis Tag 6, P < 0,05 an Tag 6 und P < 0,05 bis P < 0,001 an Tag 7).
Nach Bewertung der Gesamtverschlussraten der Wunde; Wir haben den Prozentsatz der gesamten Wundfläche (äußerer Bereich in Abbildung 2A)gemessen, in dem K14-positive Zellen sichtbar gemacht werden konnten (grüne Färbung in Abbildung 2B). Interessanterweise beobachteten wir, dass bei gesunden Ex-vivo-Hautwunden die K14-Färbung am Tag 2 ihren Höhepunkt erreichte und dann schnell abnahm (Signifikanz zu jedem Zeitpunkt im Vergleich zum Tag 2-Peak, Abbildung 2D). Dies spiegelt wahrscheinlich eine Neubildung der frühen epidermalen Barriere wider, mit Ausnahme der K14-Antikörperpenetration durch differenzierte epidermale Schichten (siehe Abbildung 2E schematisch). Während des Re-Epithelisierungsprozesses wandern Basalschicht-Keratinozyten (K14+ve) über die offene Wunde nach innen, so dass sich die Epidermis näher am äußeren Wundrand früher bildet als die Epidermis näher am inneren Wundrand (wandernde Vorderseite). Während die Vorderkante der neu gebildeten Epidermis weiter wandert, um die verbleibende offene Wunde zu schließen, beginnt sich die äußere Randepidermis zu differenzieren, um die anderen epidermalen Schichten zu reformieren. In der frühen Heilung würden wir daher erwarten, dass der größte Teil des reepithelialisierten Bereichs aus Basalzellen (K14 + ve) besteht, während bei späterer Reparatur die K14-Färbung verloren geht, da sich die Epidermis von außen nach innen unterscheidet (siehe Ganzbildbilder in Abbildung 2E). Daher korreliert der in Abbildung 2D gezeigte Rückgang der K14-Färbung (Abwärtspfeile) mit einer erhöhten epidermalen Differenzierung. Interessanterweise erreichte die sichtbare K14-Färbung früher ihren Höhepunkt bei gesunden (Tag 2) im Vergleich zu diabetischen (Tag 4) Wunden, was weiter zeigt, dass die Reepithelisierung und die anschließende epidermale Differenzierung bei diabetischen Hautwunden verzögert sind.
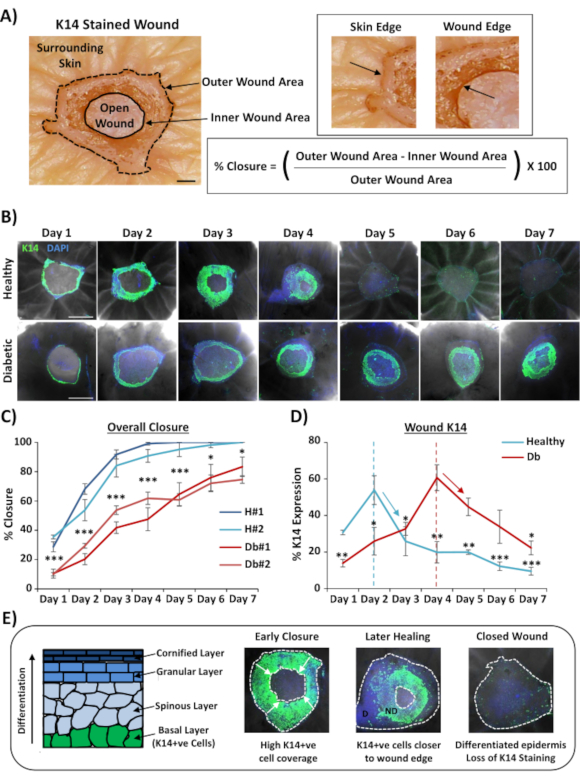
Abbildung 2: Die Färbung auf ganzer Montierung zeigt gestörte Heilungsraten bei diabetischer und gesunder Haut. (A) Die Methode zur Quantifizierung des Wundverschlusses aus äußeren und inneren Wundmessungen. Hellfeldbilder zeigen Keratin 14 (K14) Färbung in Rot. Balken = 300 μm. (B) Repräsentative Bilder der Heilung im Laufe der Zeit (Tag nach der Verwundung) in gesunder und diabetischer Haut. Bar = 500 μm. K14 = grün. DAPI = blaue Kerne. (C) Quantifizierung der Wundverschlussraten (prozentuale Reepithelisierung), die zeigt, dass ex vivo Wunden von gesunder Haut signifikant schneller schließen als ex vivo Wunden von diabetischer Haut. H = gesund. Db = Diabetiker. (D) Die prozentuale K14-Färbung erreicht bei gesunder und diabetischer Haut früher ihren Höhepunkt und nimmt dann im Einklang mit einer erhöhten epidermalen Differenzierung ab (Pfeile nach unten). (E) K14 (basale epidermale Zelle) Färbung geht verloren, wenn sich die Epidermis differenziert. D = differenziert. ND = nicht differenziert. Weiß gepunktete Linien zeigen innere und äußere Wundränder. Weiße Pfeile = Richtung der Migration. n = 6 Wunden pro Spender, pro Zeitpunkt. Mittelwert +/- SEM. * = P < 0,05, ** = P < 0,01 und *** = P < 0,001. Gesund und diabetisch im Vergleich zu jedem Heilungszeitpunkt in C (P-Wert für den geringsten signifikanten Vergleich). Zeitliche Veränderung der K14-Färbung im Vergleich zum Peak für jeden Spender in D. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Als nächstes verwendeten wir die Ganzkörperfärbung, um die Gewebeexpression und Lokalisation anderer wundrelevanter Marker in nicht-diabetischer Haut zu untersuchen (Abbildung 3). Alle verwendeten Antikörper und ihre Arbeitskonzentrationen sind in der Materialtabelle aufgeführt. Blutgefäße in der offenen Wunde waren positiv mit einem Alpha-Glattmuskel-Aktin -Antikörper (a-SMA) gefärbt, der in Kombination mit K14 zur Abgrenzung der epidermalen Ränder in Bildern mit geringerer Leistung verwendet wurde (Abbildung 3A). Die dermale Matrix wurde mit Antikörpern gegen Kollagen Typ I (COL 1) und Fibronektin (Fn) gefärbt. Hier wurde Kollagen als reichlich dicke Fasern beobachtet, während Fibronektinfasern spärlich, wellig und dünn waren (Abbildung 3A). Unser Whole-Mount-Färbeansatz ist auch in der Lage, eine Auflösung der Färbung auf Zellebene zu erreichen, wie für K14-positive Keratinozyten gezeigt wurde (Abbildung 3B).
Schließlich zeigen wir, dass menschliche Ex-vivo-Wunden residente Immunzellen besitzen, wobei Langerhans-Zellen am Tag 3 nach der Verwundung um die neu gebildete Epidermis herum nachgewiesen wurden (Abbildung 3C). Tatsächlich deuten diese Ergebnisse darauf hin, dass die Färbung des ganzen Mounts verwendet werden kann, um Schlüsselmerkmale der Heilungsreaktion einschließlich Entzündung, Proliferation und der extrazellulären Matrix zu untersuchen (Abbildung 4A). Zusammengenommen zeigen unsere Daten, dass das kombinierte Ex-vivo-Verfahren zur Hautverwundung und zur Färbung ganzer Montierung eine gültige Methode zur Beurteilung verschiedener Aspekte der gesunden und diabetischen (pathologischen) menschlichen Hautreparatur ist.
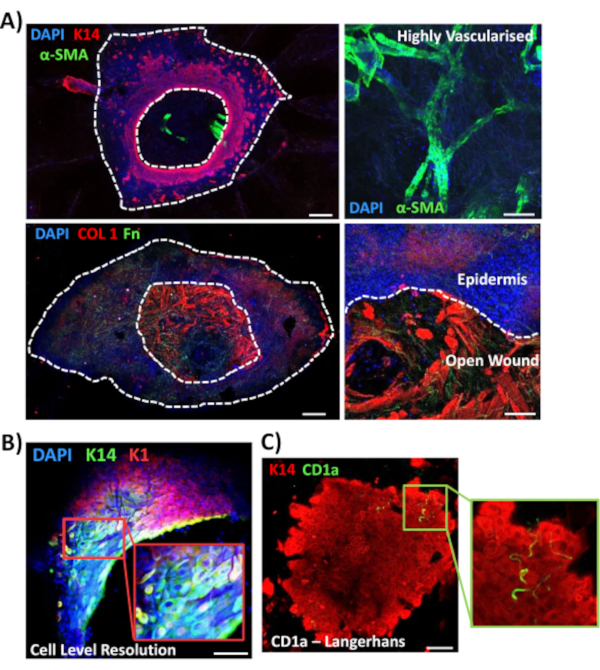
Abbildung 3: Optimierung des Whole-Mount-Färbeansatzes für die Verwendung mit anderen Antikörpern. (A) Blutgefäße wurden mit Alpha-Glattmuskel-Aktin (α-SMA, grün) und Keratin 14 (K14, rot) gefärbt, während Matrixfasern mit Kollagen I (COL 1, rot) und Fibronektin (Fn, grün) gefärbt wurden. (B) Das Whole-Mount-Verfahren bietet eine Auflösung der Lokalisierung auf Zellebene (K14, grün; K1, rot). (C) CD1a+ve Langerhans-Zellen (grün) beobachtet in neu gebildeter Epidermis. DAPI = blaue Kerne. Bar = 100 μm. Weiße gepunktete Linien zeigen innere und äußere Wundränder und trennen die Wunde von der Epidermis. Diese Färbung wurde bei nicht-diabetischer Haut durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
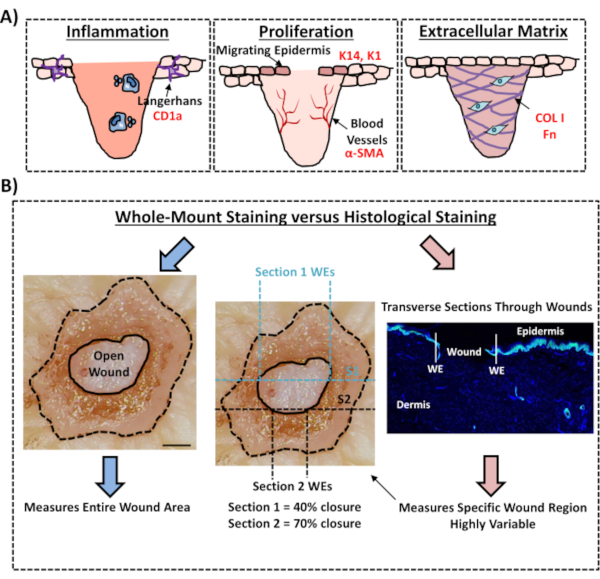
Abbildung 4: Validität des Whole-Mount-Färbeverfahrens zur Beurteilung der Wundheilung. (A) Illustration, wie die Whole-Mount-Färbetechnik wundrelevante Prozesse bewerten kann. Verwendete Antikörper = roter Text. K14 = Keratin 14. COL 1 = Kollagen 1. Fn = Fibronektin. (B) Das Färbungsverfahren auf ganzer Montierung (blaue Pfeile) führt zu einer geringeren Variabilität der Wundverschlussmessungen als die histologische Standardanalyse (rote Pfeile). S1 = Abschnitt 1. WE = Wundkante. Bar = 300 μm. Diese Färbung wurde bei nicht-diabetischer Haut durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In diesem experimentellen Protokoll beschreiben wir eine optimierte Methode zur Bewertung des Wundverschlusses in menschlicher Ex-vivo-Haut mittels Ganzkörpergewebefärbung. Dies ist eine wichtige Ressource, um eine kritische Bewertung potenzieller Wundbehandlungen zu ermöglichen und ein besseres Verständnis der menschlichen Wundreparaturreaktion zu ermöglichen. Wir haben eine Heilungsbewertung bei Ex-vivo-Hautwunden veröffentlicht, die zuvor12,13, aber in diesen Berichten wurde der Whole-Mount-Färbeansatz nicht zur Messung des Wundverschlusses verwendet. Die Färbung auf ganzer Montage ist viel einfacher und erfordert weniger technische Erfahrung als die Standardhistologie, bei der Paraffin oder OCT eingebettet und Proben zerschnitten werden. Das Whole-Mount-Verfahren reduziert auch die experimentelle Variabilität und ermöglicht die Quantifizierung der gesamten Wunde und nicht nur eines einzelnen Querabschnitts an einer definierten Position innerhalb des Gewebes (siehe Abbildung 4B zur vergleichenden Veranschaulichung). Wir unterstützen voll und ganz die Bedeutung der Quantifizierung der Heilung der gesamten nicht-symmetrischen Wundstruktur, wie von Rhea und Dunnwald für akutemurine Wundenklar umrissen 14 . Diese Autoren zeigten, wie wichtig die serielle Schnittung von In-vivo-Exzisionswunden für reproduzierbare und präzise Messungen der Wundmorphologie ist. Serielle Schnitte könnten auch auf menschliche Ex-vivo-Wunden angewendet werden; Für eine genaue Quantifizierung des Wundverschlusses und der Reepithelisierung sollte jedoch die Hochdurchsatz-Ganzmontagefärbung die bevorzugte Methode sein. Wir weisen darauf hin, dass dieses Whole-Mount-Färbeprotokoll auch mit der anschließenden Verarbeitung (Wachs oder OCT) für die traditionelle histologische Analyse kompatibel sein sollte.
Ganzmontage ist nicht ohne Nachteile. Während es eine höhere Reproduzierbarkeit in Wundheilungsexperimenten bietet, erfordert es die Verwendung von mehr Gewebe für die Analyse als Standard-histologische Techniken. Dies kann ein Problem sein, wenn der Zugang zu Gewebe eingeschränkt ist, insbesondere wenn mehrere Antikörper bewertet werden müssen. Ein alternativer Ansatz wäre die Anwendung einer Schnittwundenmethode, bei der die Wundbreite relativ gleichmäßig ist und die Variabilität reduziert ist (wie in Maus- und menschliche Wunden15,16gezeigt). Exzisionswunden bleiben jedoch für die meisten pathologischen Wundtypen anwendbar17.
In dieser Studie wurden 2 mm teildicke Wunden in der Mitte von 6 mm Hauterregungen erzeugt. Diese Methode kann für alternative Exzisionswunde und Explantionsgrößen in verschiedenen Hauttiefen optimiert werden18. Darüber hinaus variiert die Kraft, die erforderlich ist, um Wunden zu erzeugen, zwischen den Spendern, wobei gealterte Haut weniger Kraft zur Biopsie benötigt. Wir würden auch vermeiden, Haut zu verwenden, die auffällige Dehnungsstreifen oder andere strukturelle Veränderungen aufweist. Wir haben eine Reihe von Antikörpern validiert, um verschiedene Aspekte der Ex-vivo-Heilungsreaktion zu berücksichtigen. Dieses Protokoll kann auch mit anderen hautrelevanten Antikörpern verwendet werden, bei denen Antikörperkonzentrationen und Inkubationszeiten optimiert werden müssen. Dennoch glauben wir, dass unser Protokoll am besten für die absolute Quantifizierung des gesamten Wundverschlusses geeignet ist, gefolgt von einer räumlichen Bewertung spezifischer Proteine von Interesse. Während Whole-Mount eine reduzierte Auflösung der Immunlokalisierung im Vergleich zur histologischen Standardanalyse von Gewebeschnitten bietet, liefert es zusätzliche 3D-Informationen, die in der Standard-2D-Histologie fehlen.
Ein Vorbehalt bei der Beurteilung der Heilung in Ex-vivo-Haut im Vergleich zu In-vivo-Modellen ist, dass es keine systemische Reaktion gibt. Ein wichtiger Aspekt der Wundreparatur ist die Entzündung und anschließende Gewebegranulation, die durch einen Zustrom von Entzündungszellen und Endothelzellen aus dem Gefäß verursacht wird19. Trotz dieser Einschränkung bietet ex vivo Haut immer noch eine bessere Rekapitulation der klinischen Heilung als zellbasierte Wundtests. In-vitro-Experimente beinhalten im Allgemeinen Einzelzell-Monoschichten oder Co-Kulturen, die auf Gewebekulturkunststoff gezüchtet wurden, während ex vivo Haut eine native Umgebung bietet, um das Zellverhalten zu erforschen. In jüngerer Zeit sind eine Reihe von hautäquivalenten Systemen entstanden, bei denen die Haut in einer Laborumgebung aus künstlicher Matrix und isolierten Hautzellen gezüchtet wird20,21. Obwohl diese Modelle die menschliche Haut besser nachahmen als die meisten In-vitro-Ansätze, simulieren sie immer noch nicht vollständig die native Gewebeumgebung und sind im Allgemeinen zu zerbrechlich, um reproduzierbar zu verletzen. Darüber hinaus haben wir (und andere) gezeigt, dass ex vivo menschliches Hautgewebe ansässige Immunzellen behält, was zweifellos zur Reparatur beitragen wird22,23. Zukünftige Arbeiten sollten sich nun darauf konzentrieren, die Lebensfähigkeit und Immunkompetenz des Ex-vivo-Modells für die Heilungsbewertung im Spätstadium zu erweitern24. Eine Option ist die Weiterentwicklung vielversprechender Organ-on-a-Chip-Technologien, die in der Lage sind, die Lebensfähigkeit des Gewebes zu verlängern und die native Hautarchitektur für bis zu zwei Wochen in Kulturaufrechtzuerhalten 25. Ex-vivo-Modelle haben auch begonnen, die Bedeutung der Entzündungsreaktion der Haut zu berücksichtigen, indem sie erfolgreich Immunzellen wie Neutrophile in das Wirtsgewebeeinbauen 26 oder Wirtsgewebe mit Antikörpern injizieren, um eine Immunreaktionauszulösen 27. Wir gehen davon aus, dass diese Erkenntnisse den Weg für die Entwicklung verfeinerter und übersetzbarer Methoden in der Zukunft ebnen werden.
Ein großer Vorteil der Verwendung von Ex-vivo-Haut zur Messung des Wundverschlusses ist die Fähigkeit, Heilungsraten in gesundem (z. B. nicht-diabetischem) und pathologischem (z. B. diabetischem oder gealtertem) Gewebe zu vergleichen. Hier haben wir gezeigt, dass Re-Epithelisierung und Barrierebildung bei diabetischen versus gesunden Ex-vivo-Wunden tatsächlich beeinträchtigt sind. In der Tat bietet dies einen Weg für die präklinische Bewertung der pathologischen Reparatur, wo Alterung und Diabetes Hauptrisikofaktoren für die Entwicklung chronischer Wunden sind1. Während in vitro pathologische Modelle existieren, wie Zellen, die aus gealtertem und diabetischem Gewebe isoliert wurden, oder Zellen, die in hoher Glukose kultiviertwurden,um Hyperglykämie nachzuahmen28,29, können diese Zellen schnell ihren Phänotyp verlieren, sobald sie aus der In-vivo-Mikroumgebung entfernt wurden. Ein wichtiger Bestandteil der extrinsischen pathologischen Heilungsumgebung ist die dermale Matrix, die sowohl beim Altern als auch bei Diabetes30verändert wird. Tatsächlich beeinflusst diese gestörte Matrix das Verhalten der ansässigen und naiven Fibroblasten31,32. Daher ist die Bedeutung der Untersuchung von Zellen in ihrer Wirtsgewebeumgebung nicht zu unterschätzen.
Zusammenfassend bietet unser Protokoll eine wichtige Plattform, um die Reepithelisierung menschlicher Wunden zu quantifizieren, regulatorische Faktoren zu erforschen und die Validität und Wirksamkeit potenzieller Therapeutika zu testen12,13. Während präklinische Tests immer noch In-vivo-Ansätze erfordern, sollte eine kombinierte Strategie, bei der ex vivo menschliches Gewebe und in vivo murine Verwundungen verwendet werden, den präklinischen Weg verfeinern, den Tiereinsatz reduzieren und gleichzeitig die artübergreifende Übersetzbarkeit erhöhen.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Wir danken Herrn Paolo Matteuci und Herrn George Smith für die Bereitstellung von Patientengewebe. Wir danken auch Miss Amber Rose Stafford für die Unterstützung bei der Gewebeentnahme und dem Daisy Appeal für die Bereitstellung von Laboreinrichtungen.
Materialien
| Name | Company | Catalog Number | Comments |
| 50 mL Falcon Tubes | Falcon | 352070 | For skin washing |
| 1.5 ml TubeOne Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | For whole-mount staining |
| 48-Well CytoOne Plate, TC-Treated | Starlab | CC7682-7548 | For whole-mount staining |
| Acetic Acid Glacial | Fisher Chemical | A/0400/PB15 | Part of fixative |
| Alkyltrimethylammonium Bromide | Sigma-Aldrich | M7635 | Part of fixative |
| Anti-Alpha Smooth Muscle Actin Antibody [1A4] | Abcam | ab7817 | Stains blood vessels |
| Anti-Collagen I Antibody | Abcam | ab34710 | Stains collagen |
| Anti-Cytokeratin 14 Antibody [LL002] | Abcam | ab7800 | Stains epidermis |
| CD1A Antibody (CTB6) | Santa Cruz Biotechnology | sc-5265 | Stains Langerhans cells |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Thermo Fisher Scientific | 62247 | Counterstain for cell nuclei |
| Falcon 60mm Petri dishes | Falcon | 353004 | Human ex vivo culture |
| Fibronectin Antibody (EP5) | Santa Cruz Biotechnology | sc-8422 | Stains fibronectin |
| Formaldehyde, Extra Pure, Solution 37-41%, SLR | Fisher Chemical | F/1501/PB17 | Part of fixative |
| Gauze Swabs | Medisave | CS1650 | To clean skin |
| Gibco™ Antibiotic-Antimycotic Solution | Thermo Fisher Scientific | 15240062 | Human ex vivo culture |
| Gibco DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960044 | Human ex vivo culture |
| Gibco Fetal Bovine Serum | Thermo Fisher Scientific | 10500064 | Human ex vivo culture |
| Gibco HBSS, no calcium, no magnesium | Thermo Fisher Scientific | 14170088 | Human ex vivo culture |
| Gibco L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 | Human ex vivo culture |
| Hydrogen Peroxide | Sigma-Aldrich | H1009-100ML | For immunoperoxidase staining |
| ImageJ Software | National Institutes of Health | N/A | For image analysis |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Mouse, Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Rabbit, Alexa Fluor 594 | Thermo Fisher Scientific | A11012 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fisher Scientific | L3224 | For viability assessment of tissue |
| Iris Forceps, 10 cm, Curved, 1x2 teeth | World Precision Instruments | 15917 | To create wounds |
| Iris Scissors, 11 cm, Curved, SuperCut, Tungsten Carbide | World Precision Instruments | 501264 | To create wounds |
| Iris Scissors, 11 cm, Straight, SuperCut, Tungsten Carbide | World Precision Instruments | 501263 | To remove adipose tissue |
| Keratin 1 Polyclonal Antibody, Purified | Biolegend | 905201 | Stains epidermis |
| Keratin 14 Polyclonal Antibody, Purified | Biolegend | 905301 | Stains epidermis |
| LSM 710 Confocal Laser Scanning Microscope | Carl Zeiss | Discontinued | For fluorescent imaging |
| Merck Millipore Absorbent pads | Merck Millipore | AP10045S0 | Human ex vivo culture |
| Merck Millipore Nylon Hydrophilic Membrane Filters | Merck Millipore | HNWP04700 | Human ex vivo culture |
| Normal Goat Serum Solution | Vector Laboratories | S-1000-20 | Animal serum used depends on secondary antibody |
| Phosphate Buffer Solution | Sigma-Aldrich | P3619 | For wash buffer |
| Sodium Azide | Sigma-Aldrich | S2002 | For blocking buffer |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | Part of fixative |
| Sterilisation Pouches | Medisave | SH3710 | To sterilise instruments |
| Stiefel 2mm biopsy punches | Medisave | BI0500 | For partial thickness wound |
| Stiefel 6mm biopsy punches | Medisave | BI2000 | For outer explant |
| Thermo Scientific Sterilin Standard 90mm Petri Dishes | Thermo Fisher Scientific | 101VR20 | To prepare skin |
| Triton X-100 | Fisher Chemical | T/3751/08 | For wash buffer |
| VECTASTAIN Elite ABC-HRP Kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-6101 | For immunoperoxidase staining; HRP kit used depends on primary antibody |
| Vector NovaRED Substrate Kit, Peroxidase (HRP) | Vector Laboratories | SK-4800 | For immunoperoxidase staining |
| Wireless Digital Microscope | Jiusion | N/A | For brightfield imaging |
Referenzen
- Lindholm, C., Searle, R. Wound management for the 21st century: combining effectiveness and efficiency. International Wound Journal. 13, 5-15 (2016).
- Guest, J. F., et al. Health economic burden that different wound types impose on the UK's National Health Service. International Wound Journal. 14 (2), 322-330 (2017).
- Guest, J. F., Fuller, G. W., Vowden, P. Diabetic foot ulcer management in clinical practice in the UK: costs and outcomes. International Wound Journal. 15 (1), 43-52 (2018).
- López-Valverde, M. E., et al. Perioperative and long-term all-cause mortality in patients with diabetes who underwent a lower extremity amputation. Diabetes Research and Clinical Practice. 141, 175-180 (2018).
- Wilkinson, H. N., Hardman, M. J. The role of estrogen in cutaneous ageing and repair. Maturitas. 103, 60-64 (2017).
- Frykberg, R. G., Banks, J. Challenges in the treatment of chronic wounds. Advances in Wound Care. 4 (9), 560-582 (2015).
- Wilkinson, H. N., Hardman, M. J. Wound healing: cellular mechanisms and pathological outcomes. Open Biology. 10 (9), 200223 (2020).
- Ansell, D. M., Holden, K. A., Hardman, M. J. Animal models of wound repair: Are they cutting it. Experimental Dermatology. 21 (8), 581-585 (2012).
- Elliot, S., Wikramanayake, T. C., Jozic, I., Tomic-Canic, M. A modeling conundrum: murine models for cutaneous wound healing. Journal of Investigative Dermatology. 138 (4), 736-740 (2018).
- Mazio, C., et al. Pre-vascularized dermis model for fast and functional anastomosis with host vasculature. Biomaterials. 192, 159-170 (2019).
- Wilkinson, H. N., Iveson, S., Catherall, P., Hardman, M. J. A novel silver bioactive glass elicits antimicrobial efficacy against Pseudomonas aeruginosa and Staphylococcus aureus in an ex vivo skin wound biofilm model. Frontiers in Microbiology. 9, 1450 (2018).
- Wilkinson, H. N., et al. Elevated local senescence in diabetic wound healing is linked to pathological repair via CXCR2. Journal of Investigative Dermatology. 139 (5), 1171-1181 (2019).
- Wilkinson, H. N., et al. Tissue iron promotes wound repair via M2 macrophage polarization and the chemokine (CC motif) ligands 17 and 22. The American Journal of Pathology. 189 (11), 2196-2208 (2019).
- Rhea, L., Dunnwald, M. Murine excisional wound healing model and histological morphometric wound analysis. Journal of Visualized Experiments. 162, e61616 (2020).
- Ansell, D. M., Campbell, L., Thomason, H. A., Brass, A., Hardman, M. J. A statistical analysis of murine incisional and excisional acute wound models. Wound Repair and Regeneration. 22 (2), 281-287 (2014).
- Rizzo, A. E., Beckett, L. A., Baier, B. S., Isseroff, R. R. The linear excisional wound: an improved model for human ex vivo wound epithelialization studies. Skin Research and Technology. 18 (1), 125-132 (2012).
- Olsson, M., et al. The humanistic and economic burden of chronic wounds: a systematic review. Wound Repair and Regeneration. 27 (1), 114-125 (2019).
- Mendoza-Garcia, J., Sebastian, A., Alonso-Rasgado, T., Bayat, A. Optimization of an ex vivo wound healing model in the adult human skin: Functional evaluation using photodynamic therapy. Wound Repair and Regeneration. 23 (5), 685-702 (2015).
- Brownhill, V. R., et al. Pre-clinical assessment of single-use negative pressure wound therapy during in vivo porcine wound healing. Advances in Wound Care. , (2020).
- Diekmann, J., et al. A three-dimensional skin equivalent reflecting some aspects of in vivo aged skin. Experimental Dermatology. 25 (1), 56-61 (2016).
- Vidal Yucha, S. E., Tamamoto, K. A., Nguyen, H., Cairns, D. M., Kaplan, D. L. Human skin equivalents demonstrate need for neuro-immuno-cutaneous system. Advanced Biosystems. 3 (1), 1800283 (2019).
- Dijkgraaf, F. E., et al. Tissue patrol by resident memory CD8+ T cells in human skin. Nature Immunology. 20 (6), 756-764 (2019).
- He, X., de Oliveira, V. L., Keijsers, R., Joosten, I., Koenen, H. J. Lymphocyte isolation from human skin for phenotypic analysis and ex vivo cell culture. Journal of Visualized Experiments. (110), e52564 (2016).
- Pupovac, A., et al. Toward immunocompetent 3D skin models. Advanced Healthcare Materials. 7 (12), 1701405 (2018).
- Ataç, B., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Kim, J. J., et al. A microscale, full-thickness, human skin on a chip assay simulating neutrophil responses to skin infection and antibiotic treatments. Lab on a Chip. 19 (18), 3094-3103 (2019).
- Jardet, C., et al. Development and characterization of a human Th17-driven ex vivo skin inflammation model. Experimental Dermatology. 29 (10), 993-1003 (2020).
- Chen, J. L., et al. Metformin attenuates diabetes-induced tau hyperphosphorylation in vitro and in vivo by enhancing autophagic clearance. Experimental Neurology. 311, 44-56 (2019).
- Demirovic, D., Rattan, S. I. Curcumin induces stress response and hormetically modulates wound healing ability of human skin fibroblasts undergoing ageing in vitro. Biogerontology. 12 (5), 437-444 (2011).
- Wilkinson, H. N., Hardman, M. J. Wound senescence: A functional link between diabetes and ageing. Experimental Dermatology. 30 (1), 68-73 (2020).
- Fisher, G. J., et al. Collagen fragmentation promotes oxidative stress and elevates matrix metalloproteinase-1 in fibroblasts in aged human skin. The American Journal of Pathology. 174 (1), 101-114 (2009).
- Quan, T., Little, E., Quan, H., Voorhees, J. J., Fisher, G. J. Elevated matrix metalloproteinases and collagen fragmentation in photodamaged human skin: impact of altered extracellular matrix microenvironment on dermal fibroblast function. Journal of Investigative Dermatology. 133 (5), 1362 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten