Method Article
Cilt Onarımını Doğru Değerlendirmek için İnsan Ex vivo Yara Modeli ve Tam Montajlı Boyama Yaklaşımı
Bu Makalede
Özet
Burada, ex vivo insan derisini kullanarak yara onarımını değerlendirmek için optimize edilmiş bir teknik ve tam montajlı bir boyama yaklaşımı sergiliyoruz. Bu metodoloji, potansiyel yara tedavilerinin değerlendirilmesi için klinik öncesi bir platform sağlar.
Özet
Öncelikle yaşlıları ve diyabetikleri etkileyen kronik iyileşmeyen yaralar, klinik karşılanmamış ihtiyacın önemli bir alanıdır. Ne yazık ki, mevcut kronik yara tedavileri yetersizken, mevcut klinik öncesi modeller yeni tedavilerin klinik etkinliğini kötü tahmin ediyor. Burada, insan cildi onarım yanıtının birden fazla yönünü değerlendirmek için yüksek verimli, klinik öncesi bir modeli açıklıyoruz. kısmi kalınlık yaraları insan ex vivo derisinde yaratıldı ve iyileşme süresi boyunca kültürlendi. Cilt yarası biyopsileri tüm montajlı boyama prosedürü için fiksatif olarak toplanarak toplandırıldı. Sabit numuneler primer antikorda bloke edildi ve kuluçkaya yatırıldı, floresan konjuge sekonder antikor ile tespit edildi. Her biyopside yüzde yara kapatma (yeniden epitelizasyon) hesaplanmadan önce konfokal mikroskopi ile yaralar karşı konuldu ve görüntülendi. Bu protokolü uygulayarak sağlıklı donör deride oluşturulan 2 mm eksizyonel yaraların 4-5. gün yaralama sonrası tamamen yeniden epitelleştiğini ortaya koyuyoruz. Aksine, diyabetik cilt yaralarının kapanma oranları, pertürbed bariyer reformu eşliğinde önemli ölçüde azalır. İnsan derisi yarasını yeni bir tam montajlı boyama yaklaşımıyla birleştirmek, ex vivo yara onarımını ölçmek için hızlı ve tekrarlanabilir bir yöntem sağlar. Toplu olarak, bu protokol potansiyel yara tedavilerinin etkinliğini değerlendirmek, klinik öncesi test ve doğrulamayı dönüştürmek için değerli bir insan platformu sağlar.
Giriş
Yaşlılarda ve diyabetiklerde oldukça yaygın olan kronik, iyileşmeyen yaralar, klinik karşılanmayan ihtiyacın büyük ölçüde takdir edilmeyen bir alanıdır. Bu yaralar hastalara büyük bir fiziksel ve psikolojik yük teşkil eder ve sağlık hizmeti sağlayıcılarına her yıl1tedavi için milyarlara mal eder. Yara biyolojisinin iyi anlaşılmasına ve teknolojideki gelişmelere rağmen, kronik yaraların% 40'ına kadarı hala en iyi standart bakımın ardından iyileşmemektedir2. Bu nedenle, diyabetik ayak ülseri olan hastaların% 14-26'sı daha sonra amputasyongerektirir 3, 5 yıllık amputasyon sonrası ölüm oranı ise yaklaşık% 704'tür. Sonuç olarak, kötü iyileşen yaraların getirdiği önemli sağlık yükünü azaltırken, hasta yaşam kalitesini artırmak için etkili yeni tedaviler geliştirmek için acil bir gereklilik vardır. Kötü tahmine dayalı klinik öncesi modeller, etkili yeni tedavilerin geliştirilmesinde önemli bir engel olmaya devam etmektedir.
Yara onarımı, çok çeşitli hücre tiplerini, sayısız iletişim seviyesini ve zamansal olarak yeniden şekillendirilen bir doku ortamını içeren dinamik ve çok yönlü bir süreçtir. Cilt iyileşmesi dört ana telafi aşaması ile desteklenmektedir: hemostaz, iltihaplanma, çoğalma ve matris remodeling. Bu aşamalar sonuçta kan kaybını ve enfeksiyonu önlemek, yara yüzeyini kapatmak (yeniden epitelizasyon olarak adlandırılan bir süreç) ve cildi yaralanmamış bir duruma döndürmek için hareket eder5. Kronik yaralar, çeşitli etiyoloji ve iyileşme süreçlerine yaygın pertürbasyon ile ilişkilidir6Terapötik hedeflerin tanımlanmasını daha da karmaşık hale getiren. Bununla birlikte, hem yara patolojisinin moleküler ve hücresel sürücülerini aydınlatacak hem de yeni terapötik yaklaşımları test etmek için çok çeşitli modeller geliştirilmiştir7.
En çok kullanılan yara onarım modeli farede akut yaralamadır. Fareler mekanistik çalışmalar için oldukça çekişli ve doğrulanmış yaşlanma ve diyabet modelleri sağlar8. Fare ve insan iyileşmesi arasında gösterilen genel benzerliklere rağmen, cilt yapısındaki türler arası farklılıklar ve iyileşme dinamikleri devam etmektedir. Bu, çoğu murine yara araştırmasının kliniğe kolayca çevrilmediği anlamına gelir9. Sonuç olarak, yüksek uygulanabilirlik ve çevrililebilirliğe sahip insan in vitro ve ex vivo sistemlerine doğru bir itme olmuştur10,11.
Burada ex vivo insan derisinde kısmi kalınlık eksizyonal yaraların gerçekleştirilmesi için derinlemesine bir protokol sunuyoruz. Ayrıca, ex vivo insan cilt iyileşmesini değerlendirmek için son derece tekrarlanabilir bir yöntem olarak tüm montajlı boyama yaklaşımımızı özetliyoruz. Sağlıklı ve diyabetik insan derisinde yara kapanma oranını değerlendiren epidermal onarım (yeniden epitelizasyon) ve sonraki bariyer oluşumunun yörüngesini gösteriyoruz. Son olarak, iyileşme yanıtının çeşitli yönlerini değerlendirmek için bir dizi antikorla tüm montajlı lekelemenin kullanıma nasıl uyarlanabildiğini gösteriyoruz.
Protokol
Castle Hill Hastanesi ve Hull Royal Infirmary'de (Hull, UK) rekonstrüktif cerrahi uygulanan hastalardan tam bilgili, yazılı hasta onayı, kurumsal yönergeler ve etik onay (LREC' ler: 17/SC/0220 ve 19/NE/0150) altında insan derisi elde edildi. Rutin ameliyat yapılan hastalardan diyabetik olmayan deri toplandı (yaş ortalaması = 68). Diyabetik deri tip II diyabet ve ülserasyon öyküsü (yaş ortalaması = 81) olan donörlerden seçilmişti. Ameliyattan alınan örnekler bekleme ortamlarında nakledildi ve laboratuvara vardıklarında hemen işlendi. Düzeltilmemiş insan dokusu kullanılarak yapılan tüm deneysel adımlar Biyogüvenlik Seviye-2'de (BSL-2) sınıf II laminer akış biyogüvenlik kabininde gerçekleştirildi.
1. Cilt kültürü medyasının hazırlanması ve reaktiflerin boyanma
NOT: Tüm reaktif ve sarf malzemeleri ayrıntıları Malzeme Tablosunda verilmiştir. İnsan dokusunun işlenmesi ve kültürü için kullanılan tüm reaktiflerin ve ekipmanların steril olduğundan emin olun. Aletleri kullanımdan önce sterilize edin ve doku ile temas etti sonra dezenfektan ile arındırın. Atık ürünleri bertaraf etmeden önce % 1 dezenfektanda dekontamine edin.
- Tutma ortamı: Yüksek glikoz Dulbecco'nun Modifiye Kartal Orta (DMEM) 2 mM L-glutamin ve% 4 (v /v) antibiyotik-antimycotic çözelti ile takviye.
- Hank'in antibiyotikli dengeli tuz çözeltisi (HBSS) : HBSS'ye% 4 (v / v) antibiyotik-antimykotik çözelti ekleyin. Kullanıma kadar 4 °C'de saklayın.
- Dulbecco'nun fosfat tamponlu salin (DPBS): Damıtılmış suyun litresi başına 9,6 g DPBS tozunun (dH2O) çözünmesiyle DPBS hazırlayın. Kullanıma kadar sterilize etmek ve 4 °C'de saklamak için otoklav.
- İnsan cildi büyüme ortamı: 2 mM L-glutamin, % 1 (v / v) antibiyotik-antimykotik çözelti ve% 10 (v / v) fetal sığır serumu ile yüksek glikoz DMEM takviyesi. Kullanıma kadar 4 °C'de saklayın.
- Cilt düzeltici: 450 mL dH2O'ya, 40 mL formaldehit çözeltisi, 10 mL buzul asetik asit, 4,5 g sodyum klorür ve 0,25 g alkiltrimetilammonium bromür ekleyin. Oda sıcaklığında (RT) saklayın ve birkaç gün içinde kullanın.
DİkKAT: Fiksatif tehlikelidir (tahriş edici ve yanıcı). Dikkatli bir şekilde idare edin ve uygun bir rota üzerinden atın. - Fosfat tamponlu salin (PBS): 100 mL fosfat tampon çözeltisine 6 g sodyum klorür ve 900 mL dH2O ekleyerek PBS'yi tam montajlı boyama için hazırlayın.
- Boyama yıkama tamponu: PBS'de %0,5 (v/v) Triton X-100 çözün.
- Engelleme tamponu: Boyama yıkama tamponu için % 0.2 (w/ v) sodyum azit ve% 2 (v / v) hayvan serumu ekleyin. 4 °C'de iki haftaya kadar saklayın.
NOT: İkincil antikor konak türlerinin serumunda blok. Sodyum azit inkübasyon sırasında bakteri üremesini önleyecektir. - DAPI çalışma çözümü: Dimetil sülfit içinde 4′, 6-diamidino-2-fenylindole (DAPI) 5 mg / mL stok hazırlayın. 5 μg/mL DAPI çalışma çözümü vermek için stoku 1:1.000 boyama yıkama tamponunda seyreltin.
- Peroksidaz bloğu: Boyama yıkama tamponu için% 0,3 (v/v) hidrojen peroksit ekleyin. Kullanıma kadar 4 °C'de saklayın. Ayrışmayı önlemek için karanlıkta tutun.
- ABC-HRP Kiti:
- HRP-konjuge sekonder antikor: 5 mL boyama tamponunda 1 damla biyotinillenmiş tavşan anti-keçi IgG. 4 °C'de iki haftaya kadar saklayın.
NOT: Kullanılan kit/ikincil, birincil antikorun konak türlere bağlı olacaktır. - Avidin-biotin kompleksi (ABC) reaktifi: 5 mL boyama yıkama tamponunda 2 damla reaktif A ve 2 damla reaktif B. ABC reaktifi kullanılmadan en az 30 dakika önce hazırlanmalıdır. 4 °C'de iki haftaya kadar saklayın.
- HRP-konjuge sekonder antikor: 5 mL boyama tamponunda 1 damla biyotinillenmiş tavşan anti-keçi IgG. 4 °C'de iki haftaya kadar saklayın.
- Peroksidaz substratı: 3 damla reaktif 1, 2 damla reaktif 2, 2 damla reaktif 3 ve 2 damla hidrojen peroksit 5 mL dH2O. Peroksidaz substratı kullanımdan hemen önce taze olarak hazırlanmalıdır ve saklanamaz.
2. Cildin yaralama için hazırlanması
NOT: Bu adımlar sınıf II laminer akış biyogüvenlik kabininde yapılmalıdır.
- Cildi tutma ortamında toplayın ve BSL-2 kabinine taşıyın.
- Cilt dermis tarafını 90 mm steril petri kabının içine yerleştirin ve yağ dokusunu steril makasla çıkarın.
- Cildi RT'de 10 dakika antibiyotikli 25 mL HBSS içeren 50 mL'lik bir tüpe yerleştirin.
- Yeni bir 50 mL tüp kullanarak 2.3 adımlarını tekrarlayın.
- Cildi 25 mL HBSS içeren taze bir 50 mL tüpe yerleştirin, bu sefer RT'de 10 dakika antibiyotiksiz.
- Cildi 25 mL DPBS'li yeni bir tüpe yerleştirerek son bir cilt durulama gerçekleştirin. Deri artık yara almaya hazır.
3. Ex vivo insan derisi yaraları oluşturma
NOT: Bu adımlar sınıf II laminer akış biyogüvenlik kabininde yapılmalıdır.
- Yara alamadan önce cilt kültürü yemeklerini hazırlayın. 60 mm Petri kabında, iki steril emici ped istifleyin ve kabın yan tarafından 4 mL insan derisi ortamı ekleyin. Emici ped yığınına steril bir naylon filtre zarı yerleştirin.
NOT: Cilt ortamı gerekli tedavi koşullarına bağlı olarak değiştirilebilir. Her yığında en fazla üç yara eksplantı kültürlenebilir. - Kalıntı DPBS'yi çıkarmak için cildin dermal tarafını steril gazlı bez üzerinde 90 mm Petri kabında kurutun.
NOT: Bu, yara alırken cildin etrafta kaymasını önler. - Cilt dermis tarafını temiz bir 90 mm Petri kabı kapağına yerleştirin ve epidermisi taze steril gazlı bezle kurulayın.
NOT: Petri kabı kapağında cildi yaralamak tabandan daha kolaydır. Cildin kurumasını önlemek için sonraki çalışmalar hızlı bir şekilde yapılmalıdır. - Cildi gergin tutarak, cilde 2 mm biyopsi yumruğu bastırın ve hafifçe bükün. Tamamen deriye yumruk atmayın.
NOT: Kısmi kalınlık yaraları epidermisin içinden ve kısmen dermisin içine delmek için tasarlanmıştır. Kısmi kalınlık yarasını oluşturmak için gerekli kuvvette donörden donöre ve bölgeden bölgeye değişkenlik olabilir. - 2 mm yaranın her iki tarafını almak için kavisli dişli doku forsepsleri kullanın ve düzgün bir şekilde kesmek için 2 mm yaranın altındaki kavisli iris makasını bağlayın.
- Merkezde kısmi kalınlıkta 2 mm yaraya sahip 6 mm'lik bir eksplant oluşturmak için 6 mm'lik bir biyopsi zımbası kullanılarak merkezi 2 mm yaranın etrafında biyopsi.
NOT: Her 2 mm'lik yaranın nerede olması gerektiğini işaretlemek için cildi puanlamak için 6 mm'lik bir biyopsi zımbası kullanılabilir. Dokuyu tamamen delmemeye dikkat edin. Wastage azaltmak için petek deseninde yara eksplantları oluşturun. - Yara eksplantları epidermis tarafını naylon filtre membran yığınına yerleştirin (adım 3.1'de hazırlanır).
NOT: Yara eksplantlarını kullanırken, merkezi yaraya zarar vermemeye dikkat edin. Küçük tokparlamalar kullanın ve her bir dışlayıcıyı karşı taraflarda alın. - 1-7 gün boyunca nemli bir atmosferde (%90-95) 32-37 °C ve %5 CO2'de yaraları kuluçkaya yatır. Medyayı her 2-3 günde bir değiştirin.
4. Ex vivo yaralarının tamamen montajlı boyanma
NOT: Bu bölümde immünoresans ve immünperoksidaz boyama yöntemleri açıklanmaktadır. Kullanmadan önce tüm reaktifleri iyice karıştırın.
- Floresan boyama yöntemi
- 500 μL cilt fiksatifi içeren 1,5 mL mikrosantrifüj tüplerinde yara eksplantlarını toplayın ve bir gecede 4 °C'de kuluçkaya yatırın.
NOT: Bu protokolde kullanılan fiksatif, açıklanan antikorlar için iyi çalışır. Diğer antikorlar için optimizasyon gerekecektir. 24 saatten uzun doku fiksasyonu aşırı fiksasyona yol açabilir. - Ertesi gün fiksatifi çıkarın ve 1 mL boyama yıkama tamponu ile değiştirin. Biyopsiler lekelemeden 2 hafta öncesine kadar 4 °C'de boyama yıkama tamponunda saklanabilir.
NOT: Tüm yıkama tampon adımları için, yaraya zarar vermemeye dikkat ederek serolojik bir pipet veya pipet ucu kullanın. - Boyama yıkama tamponu aspire ve 1 mL boyama yıkama tamponu ile bir durulama daha gerçekleştirin.
- 4.1.5-4.1.6 adımları için gereken engelleme arabelleği miktarını hesaplayın (numune sayısı x 300 μL = μL'deki engelleme arabelleği miktarı). Gerekirse ekstra arabellek yapın.
- Her örneğe 150 μL engelleme tamponu ekleyin ve RT'de 1 saat kuluçkaya yatırın. Tüm boyama adımları için, her numunenin yeterince kaplanın ve biyopsi yara yüzeyini kaplayan kabarcıklar olmadığından emin olun.
NOT: Bu adım 1,5 mL mikrosantrifüj tüplerde veya 48 kuyu plakasında gerçekleştirilebilir. 48 kuyu plakası kullanıyorsanız, yaraları her kuyuda yüzüstü inkübize edin. - Kalan blokaj tamponunda birincil antikoru seyreltin.
NOT: Anti-fare keratin 14 (K14) seyreltilmiş 1:1,000 engelleme tampon iyi çalışır. Bu adımı diğer antikorlarla veya birden fazla probla kullanmak için optimize edin. - Blokaj tamponu aspire edin ve kuyu/mikrosantrifüj tüpü başına 150 μL birincil antikor ekleyin. Kuluçka yarası primer antikorda bir gecede 4 °C'de eksplantlar.
- Ertesi gün, birincil antikoru epire edin ve RT'de 1 saat boyunca % 0,2 sodyum azit içeren boyama yıkama tamponunda durulayın (örnek başına 500 μL).
- Boyama yıkama tamponu kullanarak üç durulama adımı daha gerçekleştirin (yıkama başına 30 dk, numune başına 500 μL).
- Floresan konjuge ikincil antikoru boyama yıkama tamponunda seyreltin (örneğin, keçi anti-fare 488 saat 1:400 seyreltme).
- Gerekli ikincil antikor miktarını hesaplayın (numune sayısı x 150 μL = μL miktarı).
- Her kuyu/mikrosantrifüj tüpüne 150 μL ikincil antikor ekleyin. RT'de 1 saat kuluçkaya yatın.
NOT: Bu adım gerekirse gece boyunca 4 °C'de gerçekleştirilebilir. Yeterli sinyal ve sınırlı arka plan boyama için gereken ikincil antikor konsantrasyonunun optimize edilmesini optimize edin. - İkincil antikoru çıkarın ve boyama yıkama tamponu (numune başına 500 μL) ile 3 x 30 dk durulama gerçekleştirin.
- Kalan yıkama tamponu atın ve gereken DAPI çalışma çözümü miktarını hesaplayın (adım 4.1.11'e göre).
- RT'de 10 dakika boyunca 150 μL DAPI çalışma çözümü ile her bir eksplant'a karşı saldırın.
NOT: DAPI hücre çekirdeğini maviye boyar. Hoechst boyası DAPI'ya alternatif olarak kullanılabilir. - Boyama yıkama tamponu (numune başına 500 μL) ile iki son 30 dakika yıkama gerçekleştirin. Biyopsiler, görüntülemeden iki hafta öncesine kadar karanlıkta 4 °C'de boyama yıkama tamponunda saklanabilir.
- 500 μL cilt fiksatifi içeren 1,5 mL mikrosantrifüj tüplerinde yara eksplantlarını toplayın ve bir gecede 4 °C'de kuluçkaya yatırın.
- Brightfield boyama yöntemi.
- 4.1.1 - 4.1.3 adımlarını gerçekleştirin.
- Endojen peroksidaz aktivitesini peroksidaz bloğu ile bir gecede 4 °C'de söndürün.
NOT: Bu adım, dokudan spesifik olmayan arka plan lekelerini azaltmak için HRP konjuge antikor kullanırken önemlidir. Yüksek oranda damarlı doku daha endojen peroksidaz aktivitesi içerecektir. - Peroksidaz bloğunu atın ve boyama yıkama tamponunda 30 dakika boyunca iki kez durulayın.
- 4.1.4 - 4.1.8 adımlarını gerçekleştirin.
NOT: 4.1.7 adımından sonraki yıkamalar, sodyum azidini numunelerden çıkarmak için özellikle önemlidir. Sodyum azit yeterince çıkarılmazsa, HRP'yi devre dışı bırakır ve leke tespitini zorlar. - Her bir kuyu/mikrosantrifüj tüpüne 150 μL HRP konjuge ikincil antikor ekleyin ve RT'de 4 °C veya 1 saatte bir gecede kuluçkaya yatırın.
- İkincil antikoru çıkarın ve boyama yıkama tamponunda 3 x 30 dk yıkama gerçekleştirin.
- Her kuyu/mikrosantrifüj tüpüne 150 μL ABC reaktif ekleyin ve rt'de 4 °C veya 1 saatte bir gecede kuluçkaya yatırın.
- ABC reaktifini epire edin ve boyama yıkama tamponunda 3 x 30 dk yıkama gerçekleştirin.
- Bir eksplanteye 150 μL peroksidaz substratı ekleyin ve gözle görülür bir renk değişimini tespit etmek için gereken süreyi belirleyin.
NOT: Güçlü boyamanın beklendiği bir örnek seçin. Bu durumda, göç eden epidermisi (K14) göstermek için kırmızı bir halka. 3,3'-diaminobenzidine-4 veya diğer uygun kromojenik substrat, bu peroksidaz substratı yerine kullanılabilir. - Bir renk değişikliği gözlendikten sonra, peroksidaz substratını çıkarın ve 1 mL dH2O ile değiştirin.
- Diğer eksplantlar için peroksidaz substrat algılamasını tekrarlayın ve adım 4.2.11'de belirlenen süre boyunca inkübasyon yaparak.
- Kalan peroksidaz substratını çıkarmak için tüm eksplantları 1 mL dH2O ile durulayın. Eksplantlar görüntülemeden önce 4 °C'de bir haftaya kadar saklansa da, peroksidaz substratının zamanla dH2O'ya sızmasını önlemek için mümkün olan en kısa sürede görüntülemek daha iyidir.
5. Görüntüleme ve nicelik
- Floresan görüntüleme
NOT: Floresan görüntüleme, konfokal lazer tarama mikroskobu kullanılarak gerçekleştirilir. Bununla birlikte, ters bir floresan mikroskop, yara kapatma oranlarını ölçmek için 2D görüntüler elde etmek için yeterli olabilir. İkincil antikorları seçerken, seçilen florokromların mevcut mikroskopi ekipmanının ekscitasyon ve emisyon spektrumu ile uyumlu olduğundan emin olun.- 2,5x, 10x ve 20x hedef, x-y-z motorlu sahne, dijital kamera ve edinme yazılımı ile donatılmış bir konfokal lazer tarama mikroskobu kullanın. Her biyopsinin kolay görselleştirilmesini sağlamak ve toplam yara kapatmanın ölçülmesini sağlamak için iletilen ışık dedektörünü (TPMT) kapatın. Alternatif olarak, floresan görüntülemeden sonra her yarayı brightfield mikroskopisi ile ölçün.
- Görüntüleme platformuna 60 mm Petri çanak tabanı yerleştirin ve ince bir dpbs tabakası (yaklaşık 1 mL) ekleyin.
NOT: Çok fazla DPBS kullanılırsa, biyopsi görüntüleme sırasında hareket eder. Alternatif olarak, bir plaka tutucu varsa 48 kuyu plakası kullanın. - Yara eksplantlarını kuyulardan/mikrosantrifüj tüplerinden DPBS içeren Petri kabına aktarmak için küçük doku tokaları kullanın. Biyopsi yarasını Petri kabına koyun.
- Yarayı bulmak ve odaklanmak için göz merceği ve floresan lambayı kullanın. Kabarcıklar görüş alanındaki numunenin altına sıkışmışsa, yarayı doku tokaları ile alın ve yeniden konumlandırın.
- Optimum konfokalite için kanallar arasında eşit iğne deliği boyutu sağlayarak görüntüleme yazılımını kurun. Bunun için, her kanal için bir havadar birimin değerini kontrol edin ve en büyük değeri seçin. Tarama hızını, görüntü kalitesini ve ortalamayı seçin.
NOT: Konjuge sekonder antikorların florokromları ve seçilen karşıtlıklar (örneğin, DAPI) gerekli kanalları dikte edecektir. - Canlı alım yazılımını aç ve her kanalın lazer gücünü ve kazancını boyamayı görselleştirmek için gereken seviyelere ayarlayın. Dijital uzaklığı artırarak arka plan gürültüsünü azaltın.
- Yarayı görüntüleme düzleminin ortasına yerleştirin.
NOT: Daha küçük bir amaç kullanmak veya daha büyük bir yara oluşturmak nedeniyle yara görüntünün tamamını doldurmuyorsa, bir görüntü paneli alın ve bunları birbirine dikin (manuel olarak veya ilgili görüntüleme yazılımında bir döşeme işleviyle). - Yara biyopsilerinin görüntülerini alın. Eksplantlar arasında aynı görüntüleme ayarlarını kullanın.
NOT: Daha yüksek güçlü görüntüler doku yapılarının ve hücresel işaretleyici ifadesinin ve konumunun değerlendirilmesine izin verecektir. - Özellikle doku Petri kabına karşı tamamen düz değilken, yaradan seri Z yığınlarını toplayın. Z yığınını tek bir maksimum yoğunluk projeksiyon görüntüsüne daraltmak için analiz yazılımını kullanın.
- Brightfield görüntüleme
NOT: İmmünperoksidaz lekeli biyopsilerin brightfield görüntülemesi birçok şekilde yapılabilir.- Ters mikroskop görüntüleme: Yara eksplantlarını 5.1.2-5.1.3 adımlarında açıklandığı gibi bir Petri kabına/kuyusuna yerleştirerek görüntüleme için hazırlayın. Dijital kamera ile donatılmış ters mikroskopta brightfield aydınlatma altında dijital görüntüler elde edin. Gerekirse birden fazla görüntüyi birleştirin.
- Kablosuz dijital mikroskop görüntüleme: Yüksek kaliteli görüntüleri uygun maliyetli bir şekilde elde etmek için telefona veya dizüstü bilgisayara bağlı kablosuz dijital mikroskop kullanın. Yarayı bir miktar dokuya yerleştirin ve kalan dH2O'yu (veya boyama yıkama tamponu) numune depolamasından çıkarın. Yarayı mikroskop görüş alanının ortasına yerleştirin. Bağlı kamerayı kullanarak görüntü alın.
- Miktar
NOT: Yüzde yara kapatma, serbest şekillerin çizilmesine ve ölçülmesine izin veren herhangi bir yazılımda ölçülebilir. ImageJ aşağıdaki gibi nicelik gerçekleştirmek için kullanılabilir:- ImageJ yazılımında ölçülecek görüntüyü açın.
- Normal ciltle buluştuğu yeniden epitelize yaranın dışını çizmek için serbest şekil aracını kullanın. M tuşuna basın (veya | Çözümle Ölçü) 'dış' alan ölçümü elde etmek için.
NOT: Yeniden epitelize yara dokusu dokusu normal ciltten farklıdır. Görüntülerin bu tür analizlerden önce ölçeklendirilmesi gerekmez. - Açık yara alanının etrafını çizmek için serbest şekil aracını kullanın. Burası açık yaranın yeniden epitelleşen dokunun iç kenarı ile buluştuğu yerdir. M tuşuna basın (veya | Çözümle Ölçü) 'iç' alan ölçümü elde etmek için.
- Yüzde yarası yeniden epitelizasyonu/kapanmasını çıkarmak için aşağıdaki denklemi kullanın:
Kapanma Yüzdesi = (Dış Yara Bölgesi - İç Yara Bölgesi) / (Dış Yara Alanı) x 100
NOT: Antikorların yüzde alan kapsamı aynı şekilde (örneğin, K14) veya toplam yara alanının yüzdesi olarak ortaya çıkabilir. Yüzde yoğunluğu ayrıca ilgi çekici belirteçlerin doku seviyesi ifadesi hakkında yarı nicel bilgi sağlayabilirken, yüksek güçlü görüntüleme hücresel düzeyde ifade verilerini sunar.
Sonuçlar
Bu raporda, insan cilt onarım yanıtını etkileyen faktörleri değerlendirmek için yeni bir ex vivo cilt yaralama ve tam montajlı boyama yaklaşımı sunuyoruz. Şekil 1A, yara inkübasyon sürelerine bağlı olarak 3-10 gün içinde gerçekleştirilebilen prosedürel işlem hattının şemasını göstermektedir. Kısmi kalınlık yaraları havadaki membran yığınları üzerinde kültürlenir : membran arayüzü ve genel histoloji için parafin veya OCT ortamına gömülü veya biyokimyasal analiz için sıvı nitrojende dondurularak tam montajlı boyama için toplanabilir (Şekil 1B). Genellikle 6 mm eksplantların merkezinde 2 mm kısmi kalınlık yaraları oluştururuz. Bununla birlikte, yaranın ve çevresindeki eksplantın boyutu gereksinimlere bağlı olarak değiştirilebilir. Tüm montaj prosedürü hem immünoperoksidaz hem de immünofluoresans boyama yöntemleri için başarıyla uyarlanmıştır (Şekil 1C).
İmmünofluoresans, birden fazla antikor ile dokunun yoklasını sağlar. Bunun için, farklı türlerde yetiştirilen birincil antikorların ve türler arası reaktiviteyi sınırlamak için türlerle eşleşen floresan konjuge ikincil antikorların kullanılmasını tavsiye ediyoruz. Antikor konsantrasyonlarının ve kuluçka sürelerinin optimize edilmesi gerekecektir. Arka plan boyama gözlenirse, antikor konsantrasyonlarını azaltın, yıkama adımlarını artırın ve ikincil antikora bloke tampon ekleyin. Taze doku canlılığı doğrudan ticari canlılık boyaları ile değerlendirilebilir (bkz. Malzeme Tablosu). Ayrıca dokunun canlılık sonrası lekelemenin sabit olabileceğini ve pratik olarak uygun olduğunda başarıyla görüntülenebileceğini gösteriyoruz (Şekil 1D).
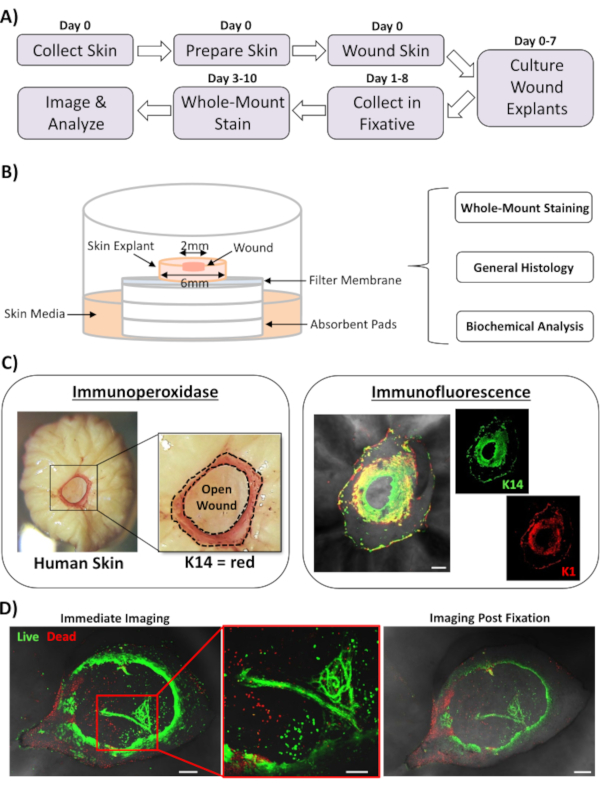
Şekil 1: İnsan ex vivo yaralama ve tam montajlı boyama yaklaşımı. (A) Cilt toplama ve ex vivo yaralama gerçekleştirme, doku boyama ve verileri analiz prosedürel iş akışını gösteren boru hattı. (B) Doku üzerinde rutin olarak yapılan analizlerle insan ex vivo cilt yarası kültür sistemini gösteren şema. (C) Tüm montajlı boyama hem immünperoksidaz hem de immünofluoresans teknikleri kullanılarak kullanılabilir. K14 = keratin 14. (D) Canlı doku ticari canlılık boyaları ile lekelenebilir ve fiksasyon sonrası başarıyla görüntülenebilir. Çubuk = 100 μm. Bu lekeleme diyabetik olmayan ciltlerde yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Yaraların tam montajlı boyanmalarında en yaygın kullanım, yara kapatma oranını histolojik kesitleme ile sağlanabilecekten daha tekrarlanabilir bir şekilde belirlemektir. Yüzde kapanışı, Şekil 2A'dagösterildiği gibi yara yüzeyinin yüzde olarak yeniden epitelizasyonu olarak ölçüldü. Belirli belirteçlerin yüzde alan kapsamı, toplam yara bölgesinden veya yeniden epitelize yaranın yüzdesi olarak ölçülebilir. Sağlıklı (diyabetik olmayan) ve diyabetik ciltlerde iyileşmeyi yedi günlük bir zaman diliminde karakterize ettik, her gün yaralama sonrası yaralar topladık (temsili görüntüler, Şekil 2B). Sağlıklı cilt yaraları beklendiği gibi zamanla kapanır, çoğu örnekte 4-5 gün boyunca tam kapanma gözlenir. Aksine, diyabetik cilt yaraları yedi günlük analiz süresi içinde tam olarak kapanamadı(Şekil 2C). Yaralanma sonrası her zaman noktasında iyileşme oranları karşılaştırılırken sağlıklı ve diyabetik cilt yaraları arasında yara kapanmasında önemli bir gecikme gözlenmiştir(P < 0.001 ile 6. gün, P < 6. günde 0.05 ve P < 0.05 ile P < 0.001 7. gün).
Genel yara kapatma oranlarının değerlendirilmesinin ardından; K14 pozitif hücrelerinin görselleştirilebildiği tüm yara bölgesinin (Şekil 2A'dakidış alan) yüzdesini ölçtük (Şekil 2B'deyeşil boyama). İlginçtir ki, sağlıklı ex vivo cilt yaralarında, K14 lekelemenin 2. günde zirve yaptığını ve daha sonra hızla düştüğünü gözlemledik (her zaman noktasında 2. güne göre önem, Şekil 2D). Bu muhtemelen, farklılaştırılmış epidermal katmanlar aracılığıyla K14 antikor penetrasyonu hariç erken epidermal bariyerin yeniden oluşumunu yansıtmaktadır (bkz. Şekil 2E şeması). Yeniden epitelizasyon işlemi sırasında bazal tabaka (K14+ve) keratinositler açık yaranın üzerine doğru göç eder, böylece epidermisin dış yara kenarına daha yakın olması, epidermisin iç yara kenarına (ön geçiş) daha erken oluşur. Yeni oluşan epidermisin ön kenarı kalan açık yarayı kapatmak için göç etmeye devam ederken, dış kenar epidermisi diğer epidermal tabakaları reforme etmek için farklılaşmaya başlar. Erken iyileşmede, böylece yeniden epitelize edilen alanın çoğunun bazal (K14 +ve) hücrelerden oluştuğunu görmeyi beklerken, daha sonra epidermisin dışarıdan içe doğru farklılaşmasıyla K14 lekelenmeleri kaybolur (Şekil 2E'dekitam montajlı görüntülere bakın). Bu nedenle Şekil 2D'de (aşağı doğru oklar) gösterilen K14 lekelemedeki düşüş, artan epidermal farklılaşma ile ilişkilidir. İlginçtir ki, görünür K14 lekelenme sağlıklı (2. gün) ve diyabetik (4. gün) yaralarda daha erken zirve yaptı ve diyabetik cilt yaralarında yeniden epitelizasyon ve daha sonra epidermal farklılaşmanın geciktiğini gösterdi.
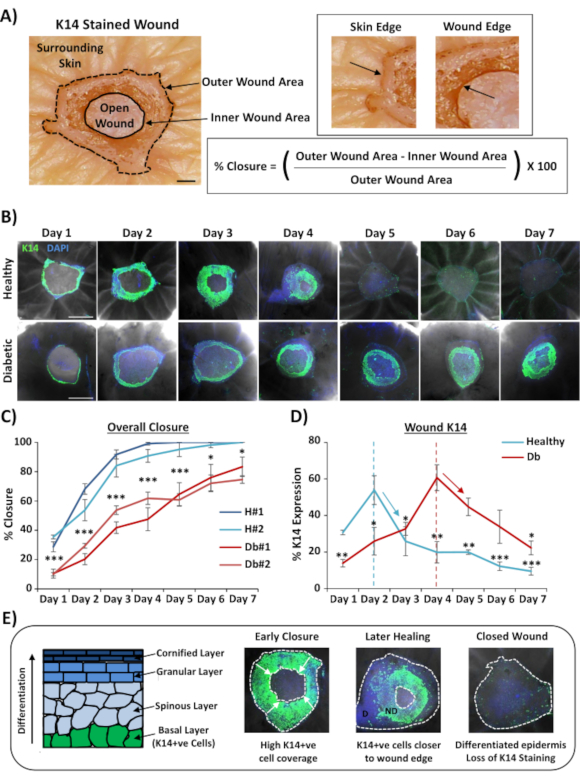
Şekil 2: Tüm montajlı lekeleme, diyabetik ve sağlıklı ciltlerde pertürbed iyileşme oranlarını ortaya koymaktadır. (A) Dış ve iç yara ölçümlerinden yara kapatmayı ölçmek için kullanılan yöntem. Brightfield görüntüleri keratin 14 (K14) kırmızı leke gösteriyor. Bar = 300 μm. (B) Sağlıklı ve diyabetik ciltlerde zaman içinde iyileşmenin temsili görüntüleri (yara sonrası gün). Çubuk = 500 μm. K14 = yeşil. DAPI = mavi çekirdek. (C) Sağlıklı ciltten gelen ex vivo yaraların diyabetik deriden gelen ex vivo yaralarından önemli ölçüde daha hızlı kapandığını gösteren yara kapatma oranlarının nicelleştirilmesi (yüzde yeniden epitelizasyon). H = sağlıklı. Db = diyabetik. (D) Yüzde K14 lekelenme sağlıklı ve diyabetik ciltlerde daha erken zirveler ve daha sonra artan epidermal farklılaşma (aşağı oklar) doğrultusunda azalır. (E) Epidermisin farklılaşmasıyla K14 (bazal epidermal hücre) lekelenme kaybolur. D = farklılaştırılmış. ND = farklılaşmamış. Beyaz noktalı çizgiler iç ve dış yara kenarlarını tasvir eder. Beyaz oklar = geçiş yönü. n = Donör başına, zaman noktası başına 6 yara. Ortalama +/- SEM. * = P < 0.05, ** = P < 0.01 ve *** = P < 0.001. C'deki her iyileşme zaman noktasında sağlıklı ve diyabetik (en az anlamlı karşılaştırma içinP değeri). K14 boyamada zamansal değişim, D'dekiher donör için zirveye kıyasla. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Daha sonra diyabetik olmayan ciltlerde doku ekspresyonunu ve yara ile ilgili diğer belirteçlerin lokalizasyonunu araştırmak için tam montajlı boyama kullandık(Şekil 3). Kullanılan tüm antikorlar ve çalışma konsantrasyonları Malzeme Tablosunda verilmiştir. Açık yaradaki kan damarları, alt güç görüntülerindeki epidermal kenarları tanımlamak için K14 ile birlikte kullanılan alfa düz kas aktinin (a-SMA) antikoru ile pozitif olarak boyanmıştır (Şekil 3A). Dermal matris kollajen tip I (COL 1) ve fibronektin (Fn) karşı antikorlarla lekelendi. Burada kolajen bol kalın lifler olarak gözlenirken fibronektin lifleri seyrek, dalgalı ve inceydi(Şekil 3A). Tüm montajlı boyama yaklaşımımız, K14 pozitif keratinositler için gösterildiği gibi, lekelemenin hücre düzeyinde çözünürlüğünü de sağlayabilir (Şekil 3B).
Son olarak, insan ex vivo yaralarının yerleşik bağışıklık hücrelerine sahip olduğunu gösteriyoruz, Langerhans hücreleri 3. Gerçekten de, bu sonuçlar, iltihaplanma, çoğalma ve hücre dışı matris de dahil olmak üzere iyileşme yanıtının temel özelliklerini araştırmak için tüm montajlı boyamanın kullanılabileceğini göstermektedir (Şekil 4A). Birlikte ele alındığında, verilerimiz kombine ex vivo cilt yaralama ve tam montajlı boyama prosedürünün sağlıklı ve diyabetik (patolojik) insan cilt onarımının çeşitli yönlerini değerlendirmek için geçerli bir yöntem olduğunu ortaya koymaktadır.
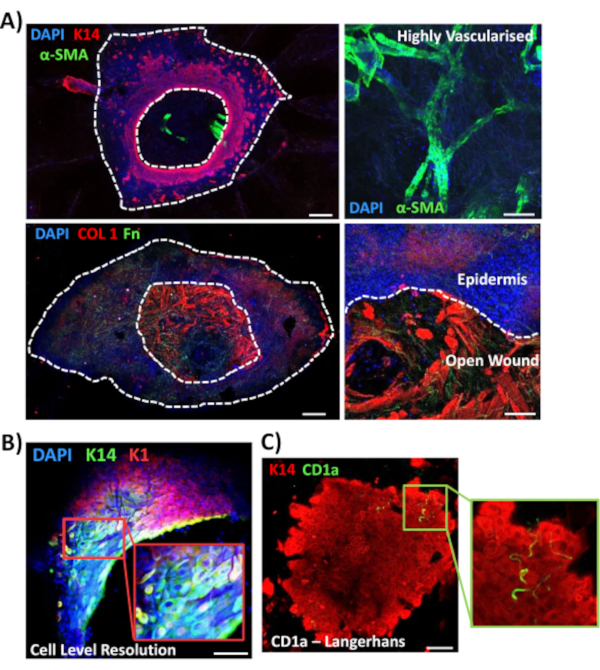
Şekil 3: Diğer antikorlarla kullanılmak üzere tüm montajlı boyama yaklaşımının optimizasyonu. (A) Kan damarları alfa düz kas aktin (α-SMA, yeşil) ve keratin 14 (K14, kırmızı) ile lekelenirken, matris lifleri kollajen I (COL 1, kırmızı) ve fiektin (Fn, yeşil) ile boyanmıştır. (B) Tüm montaj prosedürü, lokalizasyonun hücre düzeyinde çözünürlüğünü sağlar (K14, yeşil; K1, kırmızı). (C) CD1a+ve Langerhans hücreleri (yeşil) yeni oluşan epidermiste gözlendi. DAPI = mavi çekirdek. Çubuk = 100 μm. Beyaz noktalı çizgiler iç ve dış yara kenarlarını ve yarayı epidermisten ayırır. Bu lekeleme diyabetik olmayan ciltlerde yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
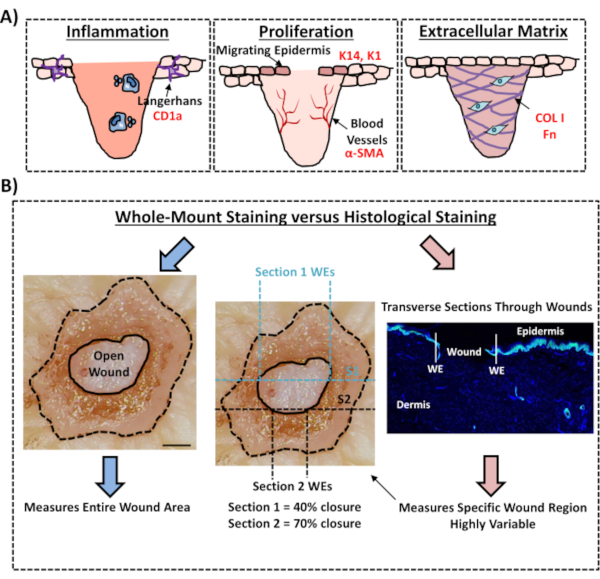
Şekil 4: Yara iyileşmesini değerlendirmek için tüm montajlı boyama prosedürünün geçerliliği. (A) Tüm montajlı boyama tekniğinin yara ile ilgili süreçleri nasıl değerlendirebileceğini gösteren illüstrasyon. Kullanılan antikorlar = kırmızı metin. K14 = keratin 14. COL 1 = kollajen 1. Fn = fibronektin. (B) Tüm montajlı boyama prosedürü (mavi oklar), yara kapatma ölçümlerine standart histolojik analizlere (kırmızı oklar) göre daha az değişkenlik gösterir. S1 = bölüm 1. WE = yara kenarı. Çubuk = 300 μm. Bu lekeleme diyabetik olmayan ciltlerde yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu deneysel protokolde, insan ex vivo derisinde yara kapatmayı tüm montajlı doku boyama kullanarak değerlendirmek için optimize edilmiş bir yöntem açıklıyoruz. Bu, potansiyel yara tedavilerinin eleştirel değerlendirilmesine izin vermek ve insan yarası onarım yanıtının daha iyi anlaşılmasını sağlamak için önemli bir kaynaktır. Daha önce12,13exvivo cilt yaralarında iyileşme değerlendirmesi yayınladık, ancak bu raporlarda yara kapatmayı ölçmek için tüm montaj lekeleme yaklaşımı kullanılmadı. Bütün montajlı boyama çok daha kolaydır ve numunelerin parafin veya OCT gömülmesini ve bölümlenilmesini içeren standart histolojiden daha az teknik deneyim gerektirir. Tüm montaj prosedürü ayrıca deneysel değişkenliği azaltarak, doku içinde tanımlanmış bir konumda sadece tek bir enine bölümün değil, tüm yaranın ölçülmesini sağlar (karşılaştırmalı illüstrasyon için Şekil 4B'ye bakın). Rhea ve Dunnwald tarafından murine akut yaralar için açıkça belirtildiği gibi, simetrik olmayan tüm yara yapısının iyileşmesinin ölçülmesinin önemini tam olarak destekliyoruz14. Bu yazarlar, yara morfolojisinin tekrarlanabilir ve hassas ölçümleri için in vivo eksizyonal yaraların seri olarak bölümlemenin önemini göstermiştir. Seri kesitler insan ex vivo yaralarına eşit olarak uygulanabilir; ancak yara kapatma ve yeniden epitelizasyonun doğru ölçülmesi için yüksek verimli tam montajlı boyama tercih edilen yöntem olmalıdır. Bu tüm montajlı boyama protokolün geleneksel histolojik analiz için sonraki işleme (balmumu veya OCT) ile de uyumlu olması gerektiğini not ediyoruz.
Tüm montajlı boyama dezavantajları olmadan değildir. Yara iyileştirme deneylerinde daha yüksek tekrarlanabilirlik sağlarken, analiz için standart histolojik tekniklerden daha fazla doku kullanılmasını gerektirir. Bu, doku erişiminin sınırlı olduğu, özellikle birden fazla antikorin değerlendirilmesi gereken bir sorun olabilir. Alternatif bir yaklaşım, yara genişliğinin nispeten düzgün olduğu ve değişkenliğin azaldığı bir kesi yaralanması yöntemi sağlamak olacaktır (fare ve insan yaralarında gösterildiği gibi15,16). Bununla birlikte, eksizyonal yaralar çoğu patolojik yara tipi17için daha uygulanabilir olmaya devam eder.
Bu çalışmada 6 mm deri eksplantlarının merkezinde 2 mm kısmi kalınlıkta yaralar oluşturulmuştur. Bu yöntem, farklı cilt derinliklerinde alternatif eksizyonal yara ve eksplant boyutları için optimize edilebilir18. Ek olarak, yara oluşturmak için gereken kuvvet, yaşlı cildin biyopsi için daha az güç gerektireceği donörler arasında değişecektir. Ayrıca cilt belirgin çatlaklar veya diğer yapısal değişiklikler gösteren kullanmaktan kaçınırız. Ex vivo iyileşme yanıtının farklı yönlerini göz önünde bulundurmak için bir dizi antikor doğruladık. Bu protokol, antikor konsantrasyonlarının ve kuluçka sürelerinin optimize edilmesi gereken diğer ciltle ilgili antikorlarla da kullanılabilir. Bununla birlikte, protokolümüzün en çok toplam yara kapanmasının mutlak nicelemesine ve ardından belirli ilgi proteinlerinin mekansal değerlendirmesine uygun olduğuna inanıyoruz. Tüm montaj, doku bölümlerinin standart histolojik analizine karşı immünolokalizasyonun daha az çözümlenmesini sağlarken, standart 2D histolojide eksik olan ek 3D bilgiler sağlar.
Ex vivo ciltte iyileşmeyi in vivo modellere göre değerlendirmenin bir uyarısı, sistemik bir tepkiden yoksun olmasıdır. Yara onarımının önemli bir yönü, enflamatuar hücrelerin ve endotel hücrelerinin vaskülatörden akınından kaynaklanan iltihaplanma ve sonraki doku granülasyonudur19. Bu sınırlamaya rağmen, ex vivo cilt hala hücre bazlı yara testlerinden daha iyi bir klinik iyileşme rekapitülasyonu sağlar. Genel olarak in vitro deneyler tek hücre tipi monolayerleri veya doku kültürü plastiği üzerinde yetiştirilen ortak kültürleri içerirken, ex vivo cilt hücre davranışını keşfetmek için yerel bir ortam sağlar. Daha yakın zamanda, yapay matris ve izole cilt hücrelerinden laboratuvar ortamında cildin yetiştirildiği bir dizi cilde eşdeğer sistem ortaya çıkmıştır20,21. Bu modeller insan cildini çoğu in vitro yaklaşımdan daha iyi taklit etse de, yine de doğal doku ortamını tam olarak simüle etmezler ve genellikle tekrarlanabilir şekilde yaralanmak için çok kırılgandırlar. Ek olarak, biz (ve diğerleri) ex vivo insan cilt dokusunun yerleşik bağışıklık hücrelerini koruduğunu gösterdik, bu da şüphesiz onarıma katkıda bulunacak22,23. Gelecekteki çalışmalar artık ex vivo modelinin geç aşama iyileştirme değerlendirmesi için canlılığını ve immünocompetency'sini genişletmeye odaklanmalıdır24. Bir seçenek, doku canlılığını uzatabilen ve kültürde iki haftaya kadar yerel cilt mimarisini koruyabilen gelecek vaat eden çip üzerinde organ teknolojilerinin daha dailerlemesidir 25. Ex vivo modelleri ayrıca nötrofiller gibi bağışıklık hücrelerini konak doku26'ya başarıyla dahil ederek veya bağışıklık reaksiyonuna neden olacak antikorlarla konak doku enjekte ederek cilt enflamatuar yanıtının önemini düşünmeye başlamıştır27. Bu bulguların gelecekte daha rafine ve çevrilebilir yöntemlerin geliştirilmesinin önünü açmasını bekliyoruz.
Yara kapatmayı ölçmek için ex vivo deri kullanmanın en büyük yararı, sağlıklı (örneğin diyabetik olmayan) dokudaki iyileşme oranlarını patolojik (örneğin diyabetik veya yaşlı) doku ile karşılaştırma yeteneğidir. Burada diyabetik ve sağlıklı ex vivo yaralarında yeniden epitelizasyon ve bariyer oluşumunun gerçekten bozulmuş olduğunu gösterdik. Gerçekten de, bu, yaşlanma ve diyabetin kronik yaralar geliştirmek için önemli risk faktörleri olduğu patolojik onarımın klinik öncesi değerlendirmesi için bir yol sağlar1. Yaşlı ve diyabetik dokudan izole edilmiş hücreler veya hiperglisemi28,29'utaklit etmek için yüksek glikozda kültürlenmiş hücreler gibi in vitro patolojik modeller mevcut olsa da, bu hücreler in vivo mikroçevrinden çıkarıldıktan sonra fenotiplerini hızla kaybedebilirler. Dış patolojik iyileşme ortamının önemli bir bileşeni, hem yaşlanma hem de diyabet30'dadeğiştirilen dermal matristir. Gerçekten de, bu pertürbed matris yerleşik ve naif fibroblastların davranışını etkiler31,32. Bu nedenle, hücrelerin konak doku ortamlarında incelenmesinin önemi küçümsenemez.
Özetle, protokolümüz insan yarasının yeniden epitelizasyonunu ölçmek, düzenleyici faktörleri araştırmak ve potansiyel terapötiklerin geçerliliğini ve etkinliğini test etmek için önemli bir platform sağlar12,13. Klinik öncesi testler hala in vivo yaklaşımlar gerektirmekle birlikte, ex vivo insan dokusu ve in vivo murine yaralanması kullanan birleşik bir strateji, klinik öncesi yolu iyileştirmeli ve türler arası çevrilebilirliği artırırken hayvan kullanımını azaltmalıdır.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan eder.
Teşekkürler
Hasta dokusunu sağladıkları için Bay Paolo Matteuci ve Bay George Smith'e teşekkür ederiz. Ayrıca doku toplanmasına yardımcı olduğu için Bayan Amber Rose Stafford'a ve laboratuvar olanakları sağladığı için Daisy Appeal'a minnettarız.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 50 mL Falcon Tubes | Falcon | 352070 | For skin washing |
| 1.5 ml TubeOne Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | For whole-mount staining |
| 48-Well CytoOne Plate, TC-Treated | Starlab | CC7682-7548 | For whole-mount staining |
| Acetic Acid Glacial | Fisher Chemical | A/0400/PB15 | Part of fixative |
| Alkyltrimethylammonium Bromide | Sigma-Aldrich | M7635 | Part of fixative |
| Anti-Alpha Smooth Muscle Actin Antibody [1A4] | Abcam | ab7817 | Stains blood vessels |
| Anti-Collagen I Antibody | Abcam | ab34710 | Stains collagen |
| Anti-Cytokeratin 14 Antibody [LL002] | Abcam | ab7800 | Stains epidermis |
| CD1A Antibody (CTB6) | Santa Cruz Biotechnology | sc-5265 | Stains Langerhans cells |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Thermo Fisher Scientific | 62247 | Counterstain for cell nuclei |
| Falcon 60mm Petri dishes | Falcon | 353004 | Human ex vivo culture |
| Fibronectin Antibody (EP5) | Santa Cruz Biotechnology | sc-8422 | Stains fibronectin |
| Formaldehyde, Extra Pure, Solution 37-41%, SLR | Fisher Chemical | F/1501/PB17 | Part of fixative |
| Gauze Swabs | Medisave | CS1650 | To clean skin |
| Gibco™ Antibiotic-Antimycotic Solution | Thermo Fisher Scientific | 15240062 | Human ex vivo culture |
| Gibco DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960044 | Human ex vivo culture |
| Gibco Fetal Bovine Serum | Thermo Fisher Scientific | 10500064 | Human ex vivo culture |
| Gibco HBSS, no calcium, no magnesium | Thermo Fisher Scientific | 14170088 | Human ex vivo culture |
| Gibco L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 | Human ex vivo culture |
| Hydrogen Peroxide | Sigma-Aldrich | H1009-100ML | For immunoperoxidase staining |
| ImageJ Software | National Institutes of Health | N/A | For image analysis |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Mouse, Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Rabbit, Alexa Fluor 594 | Thermo Fisher Scientific | A11012 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fisher Scientific | L3224 | For viability assessment of tissue |
| Iris Forceps, 10 cm, Curved, 1x2 teeth | World Precision Instruments | 15917 | To create wounds |
| Iris Scissors, 11 cm, Curved, SuperCut, Tungsten Carbide | World Precision Instruments | 501264 | To create wounds |
| Iris Scissors, 11 cm, Straight, SuperCut, Tungsten Carbide | World Precision Instruments | 501263 | To remove adipose tissue |
| Keratin 1 Polyclonal Antibody, Purified | Biolegend | 905201 | Stains epidermis |
| Keratin 14 Polyclonal Antibody, Purified | Biolegend | 905301 | Stains epidermis |
| LSM 710 Confocal Laser Scanning Microscope | Carl Zeiss | Discontinued | For fluorescent imaging |
| Merck Millipore Absorbent pads | Merck Millipore | AP10045S0 | Human ex vivo culture |
| Merck Millipore Nylon Hydrophilic Membrane Filters | Merck Millipore | HNWP04700 | Human ex vivo culture |
| Normal Goat Serum Solution | Vector Laboratories | S-1000-20 | Animal serum used depends on secondary antibody |
| Phosphate Buffer Solution | Sigma-Aldrich | P3619 | For wash buffer |
| Sodium Azide | Sigma-Aldrich | S2002 | For blocking buffer |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | Part of fixative |
| Sterilisation Pouches | Medisave | SH3710 | To sterilise instruments |
| Stiefel 2mm biopsy punches | Medisave | BI0500 | For partial thickness wound |
| Stiefel 6mm biopsy punches | Medisave | BI2000 | For outer explant |
| Thermo Scientific Sterilin Standard 90mm Petri Dishes | Thermo Fisher Scientific | 101VR20 | To prepare skin |
| Triton X-100 | Fisher Chemical | T/3751/08 | For wash buffer |
| VECTASTAIN Elite ABC-HRP Kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-6101 | For immunoperoxidase staining; HRP kit used depends on primary antibody |
| Vector NovaRED Substrate Kit, Peroxidase (HRP) | Vector Laboratories | SK-4800 | For immunoperoxidase staining |
| Wireless Digital Microscope | Jiusion | N/A | For brightfield imaging |
Referanslar
- Lindholm, C., Searle, R. Wound management for the 21st century: combining effectiveness and efficiency. International Wound Journal. 13, 5-15 (2016).
- Guest, J. F., et al. Health economic burden that different wound types impose on the UK's National Health Service. International Wound Journal. 14 (2), 322-330 (2017).
- Guest, J. F., Fuller, G. W., Vowden, P. Diabetic foot ulcer management in clinical practice in the UK: costs and outcomes. International Wound Journal. 15 (1), 43-52 (2018).
- López-Valverde, M. E., et al. Perioperative and long-term all-cause mortality in patients with diabetes who underwent a lower extremity amputation. Diabetes Research and Clinical Practice. 141, 175-180 (2018).
- Wilkinson, H. N., Hardman, M. J. The role of estrogen in cutaneous ageing and repair. Maturitas. 103, 60-64 (2017).
- Frykberg, R. G., Banks, J. Challenges in the treatment of chronic wounds. Advances in Wound Care. 4 (9), 560-582 (2015).
- Wilkinson, H. N., Hardman, M. J. Wound healing: cellular mechanisms and pathological outcomes. Open Biology. 10 (9), 200223 (2020).
- Ansell, D. M., Holden, K. A., Hardman, M. J. Animal models of wound repair: Are they cutting it. Experimental Dermatology. 21 (8), 581-585 (2012).
- Elliot, S., Wikramanayake, T. C., Jozic, I., Tomic-Canic, M. A modeling conundrum: murine models for cutaneous wound healing. Journal of Investigative Dermatology. 138 (4), 736-740 (2018).
- Mazio, C., et al. Pre-vascularized dermis model for fast and functional anastomosis with host vasculature. Biomaterials. 192, 159-170 (2019).
- Wilkinson, H. N., Iveson, S., Catherall, P., Hardman, M. J. A novel silver bioactive glass elicits antimicrobial efficacy against Pseudomonas aeruginosa and Staphylococcus aureus in an ex vivo skin wound biofilm model. Frontiers in Microbiology. 9, 1450 (2018).
- Wilkinson, H. N., et al. Elevated local senescence in diabetic wound healing is linked to pathological repair via CXCR2. Journal of Investigative Dermatology. 139 (5), 1171-1181 (2019).
- Wilkinson, H. N., et al. Tissue iron promotes wound repair via M2 macrophage polarization and the chemokine (CC motif) ligands 17 and 22. The American Journal of Pathology. 189 (11), 2196-2208 (2019).
- Rhea, L., Dunnwald, M. Murine excisional wound healing model and histological morphometric wound analysis. Journal of Visualized Experiments. 162, e61616 (2020).
- Ansell, D. M., Campbell, L., Thomason, H. A., Brass, A., Hardman, M. J. A statistical analysis of murine incisional and excisional acute wound models. Wound Repair and Regeneration. 22 (2), 281-287 (2014).
- Rizzo, A. E., Beckett, L. A., Baier, B. S., Isseroff, R. R. The linear excisional wound: an improved model for human ex vivo wound epithelialization studies. Skin Research and Technology. 18 (1), 125-132 (2012).
- Olsson, M., et al. The humanistic and economic burden of chronic wounds: a systematic review. Wound Repair and Regeneration. 27 (1), 114-125 (2019).
- Mendoza-Garcia, J., Sebastian, A., Alonso-Rasgado, T., Bayat, A. Optimization of an ex vivo wound healing model in the adult human skin: Functional evaluation using photodynamic therapy. Wound Repair and Regeneration. 23 (5), 685-702 (2015).
- Brownhill, V. R., et al. Pre-clinical assessment of single-use negative pressure wound therapy during in vivo porcine wound healing. Advances in Wound Care. , (2020).
- Diekmann, J., et al. A three-dimensional skin equivalent reflecting some aspects of in vivo aged skin. Experimental Dermatology. 25 (1), 56-61 (2016).
- Vidal Yucha, S. E., Tamamoto, K. A., Nguyen, H., Cairns, D. M., Kaplan, D. L. Human skin equivalents demonstrate need for neuro-immuno-cutaneous system. Advanced Biosystems. 3 (1), 1800283 (2019).
- Dijkgraaf, F. E., et al. Tissue patrol by resident memory CD8+ T cells in human skin. Nature Immunology. 20 (6), 756-764 (2019).
- He, X., de Oliveira, V. L., Keijsers, R., Joosten, I., Koenen, H. J. Lymphocyte isolation from human skin for phenotypic analysis and ex vivo cell culture. Journal of Visualized Experiments. (110), e52564 (2016).
- Pupovac, A., et al. Toward immunocompetent 3D skin models. Advanced Healthcare Materials. 7 (12), 1701405 (2018).
- Ataç, B., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Kim, J. J., et al. A microscale, full-thickness, human skin on a chip assay simulating neutrophil responses to skin infection and antibiotic treatments. Lab on a Chip. 19 (18), 3094-3103 (2019).
- Jardet, C., et al. Development and characterization of a human Th17-driven ex vivo skin inflammation model. Experimental Dermatology. 29 (10), 993-1003 (2020).
- Chen, J. L., et al. Metformin attenuates diabetes-induced tau hyperphosphorylation in vitro and in vivo by enhancing autophagic clearance. Experimental Neurology. 311, 44-56 (2019).
- Demirovic, D., Rattan, S. I. Curcumin induces stress response and hormetically modulates wound healing ability of human skin fibroblasts undergoing ageing in vitro. Biogerontology. 12 (5), 437-444 (2011).
- Wilkinson, H. N., Hardman, M. J. Wound senescence: A functional link between diabetes and ageing. Experimental Dermatology. 30 (1), 68-73 (2020).
- Fisher, G. J., et al. Collagen fragmentation promotes oxidative stress and elevates matrix metalloproteinase-1 in fibroblasts in aged human skin. The American Journal of Pathology. 174 (1), 101-114 (2009).
- Quan, T., Little, E., Quan, H., Voorhees, J. J., Fisher, G. J. Elevated matrix metalloproteinases and collagen fragmentation in photodamaged human skin: impact of altered extracellular matrix microenvironment on dermal fibroblast function. Journal of Investigative Dermatology. 133 (5), 1362 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır