Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aprovechamiento de la micro-tomografía computarizada para analizar las interacciones parásitas planta-huésped
En este artículo
Resumen
Micro-CT es una herramienta no destructiva que puede analizar estructuras de plantas en tres dimensiones. El presente protocolo describe la preparación de la muestra para aprovechar la micro-TC para analizar la estructura y función de las plantas parásitas. Se utilizan diferentes especies para resaltar las ventajas de este método cuando se combina con preparaciones específicas.
Resumen
La micro-tomografía computarizada se ha convertido en una herramienta establecida en la investigación de la estructura y función de la planta. Su naturaleza no destructiva, combinada con la posibilidad de visualización tridimensional y seccionamiento virtual, ha permitido un análisis novedoso y cada vez más detallado de órganos vegetales complejos. También se pueden explorar las interacciones entre las plantas, incluso entre las plantas parásitas y sus huéspedes. Sin embargo, la preparación de la muestra antes del escaneo se vuelve crucial debido a la interacción entre estas plantas, que a menudo difieren en la organización y composición del tejido. Además, la amplia diversidad de plantas con flores parásitas, que van desde cuerpos vegetativos altamente reducidos hasta árboles, hierbas y arbustos, debe considerarse durante el muestreo, tratamiento y preparación del material parásito-huésped. Aquí se describen dos enfoques diferentes para introducir soluciones de contraste en el parásito y / o plantas huésped, centrándose en el análisis del haustorio. Este órgano promueve la conexión y la comunicación entre las dos plantas. Siguiendo un enfoque simple, los detalles de la organización del tejido del haustorio se pueden explorar tridimensionalmente, como se muestra aquí para las especies parásitas eufitoides, vid y muérdago. La selección de agentes contrastantes específicos y los enfoques de aplicación también permiten la observación detallada de la propagación del endoparásito dentro del cuerpo del huésped y la detección de la conexión directa de vaso a vaso entre el parásito y el huésped, como se muestra aquí para un parásito de raíz obligado. Por lo tanto, el protocolo discutido aquí se puede aplicar a la amplia diversidad de plantas con flores parásitas para avanzar en la comprensión de su desarrollo, estructura y funcionamiento.
Introducción
La tomografía microcomputarizada de rayos X de alta resolución (micro-TC) es un método de imagen en el que se registran múltiples radiografías (proyecciones) de una muestra desde diferentes ángulos de visión y luego se utilizan para proporcionar una reconstrucción virtual de la muestra1. Este objeto virtual puede ser analizado, manipulado y segmentado, permitiendo la exploración no destructiva en tres dimensiones2. Inicialmente diseñado para análisis médicos y más tarde para aplicaciones industriales, el micro-CT también ofrece la ventaja de visualizar órganos y tejidos internos sin necesidad de procedimientos invasivos3. Al igual que otras formas de imagen, la micro-TC funciona con una compensación entre el campo de visión y el tamaño de píxel, lo que significa que las imágenes de alta resolución de muestras grandes son casi inalcanzables4. Constantemente se están realizando avances en el uso de fuentes de rayos X de alta energía (es decir, sincrotrón) y aumento óptico secundario, lo que permite que la resolución más pequeña alcance menos de 100 nm 5,6. Sin embargo, se necesitan tiempos de escaneo más largos para muestras grandes, lo que aumenta la posibilidad de artefactos debido al movimiento de la muestra o la deformación dentro del escáner. Además, la micro-TC generalmente está limitada por las variaciones naturales de densidad dentro de la muestra y cómo la muestra interactúa con los rayos X. Si bien una dosis de rayos X más alta es mejor para penetrar muestras más densas, es menos eficiente para capturar variaciones en la densidad dentro y entre la muestra y su medio circundante7. Por otro lado, una dosis de rayos X más baja ofrece menos poder de penetración y a menudo requiere tiempos de escaneo más largos pero más sensibilidad en la detección de densidad7.
Estas restricciones han obstaculizado durante mucho tiempo el uso de la microtomografía para las ciencias de las plantas, dado que la mayoría de los tejidos vegetales están compuestos de tejido ligero (no denso) con baja absorción de rayos X8. Las primeras aplicaciones de micro-CT se centraron en el mapeo de redes radiculares dentro de la matriz del suelo 9,10. Más tarde, las estructuras vegetales con diferencias más significativas en la densidad del tejido, como la madera, comenzaron a explorarse. Esto ha permitido investigar la funcionalidad del xilema 11,12, el desarrollo de organizaciones tisulares complejas13,14 y las interacciones entre plantas15,16,17. El análisis de tejido blando y homogéneo se está generalizando debido a los agentes de contraste, que ahora son un procedimiento estándar en las preparaciones para la micro-tomografía computarizada de muestras de plantas. Sin embargo, los protocolos para la introducción de contraste pueden tener resultados diferentes dependiendo del volumen de la muestra, las propiedades estructurales y el tipo de solución utilizada8. Idealmente, el agente de contraste debe mejorar la distinción entre diferentes tejidos, permitir la evaluación de la funcionalidad del tejido/órgano y/o proporcionar información bioquímica sobre un tejido18. Por lo tanto, el tratamiento adecuado de la muestra, la preparación y el montaje antes de la exploración se vuelven cruciales para cualquier análisis de micro-TC.
Micro-CT de la planta parásita haustorium
Las plantas con flores parásitas representan un grupo funcional distinto de angiospermas caracterizadas por un órgano conocido como haustorio19. Este órgano multicelular, un híbrido de desarrollo entre un tallo modificado y una raíz, actúa sobre la unión, penetración y contacto del huésped por un parásito20. Por esta razón, se considera que el haustorio "encarna la idea misma del parasitismo entre las plantas"21. Una comprensión detallada del desarrollo, la estructura y el funcionamiento de este órgano es crucial para la ecología, evolución y manejo de plantas parásitas. Sin embargo, la complejidad general de las plantas parásitas y la estructura y los haustorios altamente modificados a menudo dificultan el análisis detallado y la comparación. Las conexiones del haustorio también suelen ser extensas y no homogéneas en la distribución de tejidos y células (Figura 1). En este contexto, si bien trabajar con pequeños fragmentos de tejido permite una manipulación más fácil y una mayor resolución, puede llevar a conclusiones erróneas sobre la arquitectura tridimensional de estructuras complejas, como el haustorio de plantas parásitas.
Aunque existe una vasta literatura sobre anatomía y ultraestructura haustorium para la mayoría de las especies de plantas parásitas, la organización tridimensional y la relación espacial entre los tejidos del parásito y del huésped sigue siendo poco explorada17. En un trabajo reciente de Masumoto et al.22, más de 300 secciones seriales de microtomos semifinos fueron fotografiadas y reconstruidas en un objeto virtual tridimensional que representa el haustorio de dos especies de parásitos. El excelente nivel de detalle de este método proporciona información sin precedentes sobre la estructura 3D celular y anatómica del haustorio. Sin embargo, una técnica tan lenta prohibiría un análisis similar en parásitos con conexiones haustorias más extensas. El uso de micro-CT surge como una excelente herramienta para el análisis tridimensional de haustorios complejos y a menudo voluminosos de plantas parásitas. Aunque no es un sustituto de la sección anatómica detallada y otras formas complementarias de análisis microscópicos17,23, los resultados obtenidos a través de la micro-TC, especialmente para muestras grandes, también pueden servir como guía para dirigir el submuestreo de segmentos más pequeños, que luego pueden ser analizados utilizando otras herramientas, como microscopía confocal y electrónica, o re-analizados con sistemas de micro-TC de alta resolución.

Figura 1: Plantas parásitas de diferentes grupos funcionales utilizadas en este protocolo. Parásito eufitoide Pyrularia pubera (A), endoparásito Viscum minimum (B) con frutos verdes (círculo negro discontinuo), vid parásita Cuscuta americana (C), muérdago Struthanthus martianus (D), parásito de raíz obligada Scybalium fungiforme (E). Los segmentos de la raíz del huésped (Hr) o tallo (Hs) facilitan la aplicación de contraste en el haustorio parásito (P). La presencia de raíz madre del parásito (flechas) en la muestra permite el análisis de la organización del vaso haustorio. Los rectángulos indican segmentos de la muestra utilizados para el análisis. Barras de escala = 2 cm. Haga clic aquí para ver una versión más grande de esta figura.
A medida que la micro-TC se convierte en una técnica cada vez más popular en las ciencias de las plantas, existen guías, protocolos y literatura que tratan sobre el escaneo de muestras, la reconstrucción tridimensional, la segmentación y el análisis 3,10,24. Por lo tanto, estos pasos no se discutirán aquí. Al igual que con cualquier técnica de imaginación, el tratamiento adecuado y el montaje de muestras son fundamentales, aunque a menudo se pasa por alto. Por esta razón, este protocolo se centra en la preparación de muestras de haustorio para micro-TC. Más específicamente, este protocolo describe dos enfoques para introducir agentes de contraste en muestras de haustorio para mejorar la visualización de diferentes tejidos y tipos de células en el haustorio, para facilitar la detección de tejido parásito dentro de la raíz / tallo del huésped y para analizar las conexiones vasculares parásito-huésped en tres dimensiones. Las preparaciones descritas aquí también se pueden adaptar al análisis de otras estructuras vegetales.
Se utilizaron cinco especies para ilustrar mejor la conveniencia del protocolo descrito aquí. Cada especie representa uno de los cinco grupos funcionales de plantas con flores parásitas, abordando así puntos específicos relacionados con la funcionalidad de cada grupo. Pyrularia pubera (Santalaceae) fue elegida para representar parásitos eufitoides, que germinan en el suelo y forman múltiples haustorios que conectan el parásito con las raíces de sus huéspedes25. Los haustorios creados por estas plantas son a menudo tenues y fácilmente desgarrados del huésped26 (Figura 1A), lo que requiere un proceso de manipulación más delicado. Los endoparásitos están representados aquí por Viscum minimum (Viscaceae). Las especies de este grupo funcional sólo son visibles fuera del cuerpo de sus huéspedes durante períodos cortos (Figura 1B) y viven la mayor parte de sus ciclos de vida como hebras significativamente reducidas y miceliales de células incrustadas dentro de los tejidos del huésped25. Un tercer grupo funcional comprende enredaderas parásitas, que germinan en el suelo pero forman solo raíces rudimentarias, confiando en múltiples haustorios que se adhieren a los tallos de las plantas hospedadoras25 (Figura 1C). Aquí, este grupo funcional está representado por Cuscuta americana (Convolvulaceae). Contrariamente a las vides parásitas, el muérdago germina directamente sobre las ramas de sus plantas hospederas y se desarrolla en haustorios múltiples o solitarios25. La especie elegida para ilustrar este grupo funcional es Struthanthus martianus (Loranthaceae), que forma varias conexiones con la rama huésped (Figura 1D). El análisis de haustorios de muérdago solitario utilizando una combinación de micro-TC y microscopía óptica se puede encontrar en Teixeira-Costa & Ceccantini17. Finalmente, los parásitos de raíces obligadas comprenden especies que germinan en el suelo y penetran en las raíces de las plantas huésped, de las cuales son totalmente dependientes desde las primeras etapas de crecimiento25. Estas plantas están representadas aquí por Scybalium fungiforme (Balanophoraceae), que producen grandes haustorios similares a tubérculos (Figura 1E).
Todas las muestras de plantas utilizadas en este protocolo se fijaron en un alcohol de ácido acético formalina al 70% (FAA 70). La fijación en el muestreo es crucial para preservar los tejidos vegetales, especialmente si se necesitan análisis anatómicos posteriores. En el caso del haustorio vegetal parásito, la fijación también es esencial, ya que este órgano a menudo está compuesto principalmente por células del parénquima no lignificadas20. Los protocolos detallados para la fijación de tejidos vegetales, incluida la preparación de soluciones fijadoras, se pueden encontrar en otra parte27. Por otro lado, en mayor o menor grado, los fijadores pueden causar alteraciones de las propiedades físicas y químicas de una muestra, haciéndola inadecuada para análisis biomecánicos e histoquímicos específicos. Por lo tanto, las muestras frescas, es decir, el material no fijado recogido inmediatamente antes de la preparación, también se pueden utilizar con este protocolo. Los detalles sobre cómo manejar muestras frescas y sugerencias de solución de problemas para material fijo se proporcionan en la sección de discusión.
Protocolo
1. Selección de muestras de plantas parásitas
- Recolectar todo el haustorio de la planta parásita, incluido el tallo / raíz del huésped adjunto y los segmentos de los extremos proximal y distal del órgano huésped parasitado; La longitud ideal de cada segmento equivale al doble del diámetro del haustorio.
NOTA: Para los haustorios laterales, incluya parte del tallo/raíz madre del parásito a partir del cual se formó el haustorio (Figura 1A, B, D). Para los endoparásitos, recolecte un segmento del tallo/raíz del huésped en el que los signos del parásito sean visibles (Figura 1B). En el caso de las conexiones terminales, se debe recoger toda la planta (Figura 1E). - Sumergir toda la muestra en solución fijadora (por ejemplo, FAA) en una proporción volumétrica de 1:10 (muestra: fijador). Dejar las muestras en fijador durante al menos 1 día, dependiendo del tamaño de la muestra27.
NOTA: Las muestras pueden almacenarse en fijador antes de escanear o transferirse a una solución conservante (por ejemplo, etanol al 70%). También se pueden utilizar muestras frescas si no se justifica el análisis anatómico posterior (consulte la sección Discusión). Si trabaja con material nuevo, configure el aparato para la perfusión de la solución de contraste y luego recoja la muestra. No se debe dejar secar la muestra.
2. Aplicación de soluciones contrastantes
- Elija el método de aplicación que se utilizará. Utilice el método de vacío (paso 2.3) para muestras pequeñas (Figura 1A) o no leñosas (Figura 1B). Utilice el método de perfusión para muestras más grandes, siempre que incluya un segmento del tallo/raíz del huésped (Figura 1A, C-E).
- Use guantes de goma y otro equipo de protección personal apropiado (por ejemplo, bata de laboratorio) cuando manipule la muestra, independientemente del enfoque elegido en los siguientes pasos.
PRECAUCIÓN: Todas las soluciones de contraste incluyen sales de metales pesados en su composición y, por lo tanto, no deben manipularse sin el equipo de protección personal adecuado y debajo de una campana extractora. - Para el método de vacío, siga los pasos mencionados a continuación.
- Elija un vial apropiado y etiquételo. El vial debe ser lo suficientemente grande como para acomodar la muestra y la solución de contraste, generalmente en una proporción de 1:10. Verifique las instrucciones del fabricante para asegurarse de que el vial puede soportar un vacío bajo a moderado.
NOTA: No llene el vial hasta el borde, ya que la presión negativa (vacío) puede hacer que el líquido se derrame. - Coloque la muestra en el vial con la solución de contraste (yodo al 1% o fosfotungestado al 3%, ver Tabla de materiales). A continuación, coloque el vial en una cámara de vacío o desecador conectado a una bomba de vacío. Retire la tapa del vial y, a continuación, cierre la cámara de vacío o el desecador.
- Compruebe que no haya grietas en la cámara de vacío/desecador y que la bomba de vacío tenga suficiente aceite.
- Cierre la válvula de escape de la bomba para evitar que el aire se filtre y abra la válvula de escape de la cámara/desecador para forzar la salida del aire.
- Encienda la bomba y espere hasta que la presión alcance aproximadamente 20" Hg.
PRECAUCIÓN: Este proceso suele ser rápido, así que no deje el sistema de vacío desatendido.
NOTA: Si bien la unidad del sistema métrico para la presión es Pascal (Pa), los manómetros en la mayoría de las bombas de vacío de laboratorio muestran presión en pulgadas de mercurio ("Hg), libra por pulgada cuadrada (psi) o bares. 20" Hg equivale a aproximadamente 67.7 Pa, 10 psi o 0.7 bar. - Cierre la válvula de escape de la cámara/desecador para evitar que el aire vuelva a entrar y, a continuación, apague rápidamente la bomba.
- Dejar la muestra al vacío durante al menos 2 h; Las muestras más grandes requieren más tiempo para que la solución de contraste penetre.
- Después del período deseado, retire la muestra de la solución de contraste para prepararla para el escaneo.
- Abra lentamente la válvula de agotamiento de la cámara/desecador para permitir que entre aire.
- Espere a que la presión en la cámara/desecador se agote por completo (es decir, que el manómetro alcance cerca de 0), luego ábralo con cuidado para recuperar la muestra.
- Deseche la solución de contraste adecuadamente y mantenga la muestra en preparación para el escaneo.
- Elija un vial apropiado y etiquételo. El vial debe ser lo suficientemente grande como para acomodar la muestra y la solución de contraste, generalmente en una proporción de 1:10. Verifique las instrucciones del fabricante para asegurarse de que el vial puede soportar un vacío bajo a moderado.
- Para el método de perfusión, siga los pasos mencionados a continuación.
- Seleccione un tanque de suministro para la solución de contraste de acuerdo con el tamaño de la muestra. Use una jeringa de 50 ml (sin aguja ni émbolo) para muestras pequeñas (Figura 2A) o un botiquín intravenoso de 1 L para muestras grandes (Figura 2B).
- Conecte un extremo de un tubo de plástico transparente (consulte la Tabla de materiales) al tanque de suministro, luego conecte el otro extremo a una válvula de dos o tres vías. Conecte un segundo tubo a una salida diferente en la válvula (Figura 2A, B).
- Asegure el tanque de suministro en una posición elevada sin desmontar el aparato configurado en el paso anterior.
NOTA: La distancia vertical entre el tanque y la muestra dictará la presión de perfusión de la solución (Figura 2B). Una distancia de 20-50 cm es suficiente para muestras pequeñas. Para muestras grandes, una distancia de 1 m es más adecuada. - Cierre la válvula de tres vías (Figura 2C) o bidireccional (Figura 2D) para evitar que el líquido salga del sistema de tuberías, luego vierta la solución de contraste en el tanque de suministro. Si usa un botiquín médico intravenoso, llene la bolsa con la solución y cierre la válvula antes de asegurar el aparato en una posición elevada.
- Asegúrese de que no se formen burbujas de aire grandes a lo largo del sistema de tubos (Figura 2E). Si es necesario, permita que la solución de contraste fluya fuera del tubo hasta que se retire la burbuja. Cierre la válvula de nuevo y deje el aparato en su lugar.
- Para preparar la muestra para la perfusión de la solución de contraste, manténgala sumergida en líquido (agua, etanol o fijador) y corte la punta del extremo proximal del tallo/raíz huésped en la muestra (Figura 2F).
- Retire la muestra del líquido en el que se almacenó y envuélvala en una película de parafina para evitar la desecación. Mantenga la muestra cerca y lista para conectarla al aparato.
- Abra cuidadosamente la válvula para permitir que la solución de contraste fluya lentamente y llene el tubo de plástico conectado al tanque mientras mantiene el extremo abierto del sistema en una posición ligeramente elevada para evitar que la solución contrastante se derrame. Una vez más, asegúrese de que no se formen burbujas de aire grandes a lo largo del tubo.
- Conecte el extremo proximal del tallo/raíz huésped en la muestra al extremo abierto del sistema de tubos (Figura 2B, región ampliada). Evite introducir burbujas de aire en el sistema durante este paso. Si es necesario, desconecte la muestra del aparato y elimine las burbujas de aire del sistema permitiendo que la solución fluya.
- Mientras mantiene la muestra conectada al aparato, colóquela dentro de un recipiente para evitar fugas de la solución de contraste en el área donde se instaló el experimento. Utilice tubos de diferentes diámetros, bridas de plástico y adaptadores de válvula (Figura 2G) para garantizar que todas las conexiones del aparato estén bien ajustadas, que se adapten a las ramas huésped de varios tamaños y que la solución no se escape del sistema de tuberías (Figura 2B, región ampliada).
- Deje que la solución perfunda la muestra durante al menos 2 h, o hasta que la solución se acumule dentro del recipiente.
- Cierre la válvula y desconecte cuidadosamente la muestra del aparato. Drene el resto de la solución en el recipiente y deséchelo adecuadamente.
- Retire la película de parafina de la muestra en preparación para el escaneo.
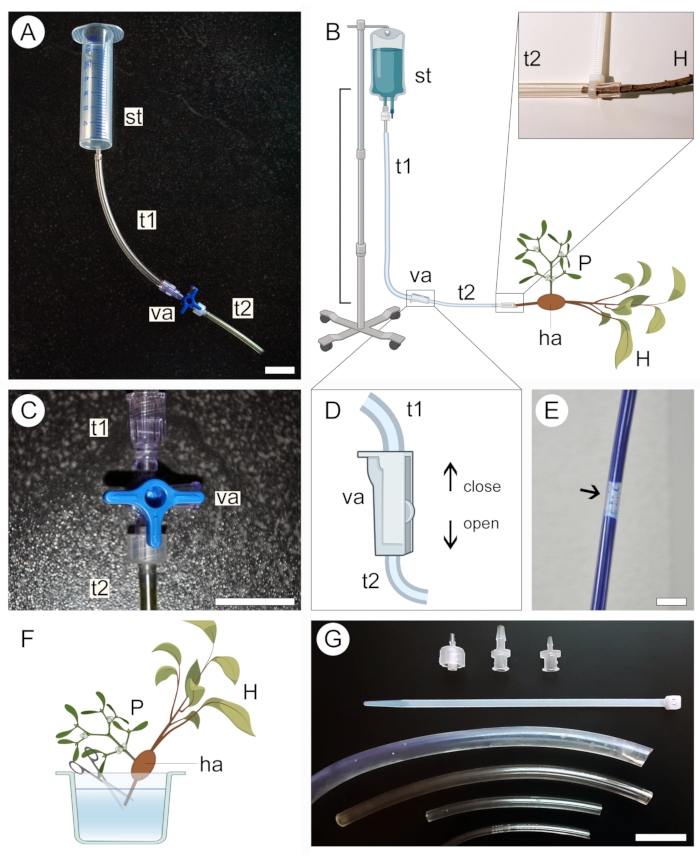
Figura 2: Enfoque de perfusión para aplicación de contraste. Las versiones pequeñas (A) y grandes (B) del aparato de perfusión incluyen un tanque de suministro (st) y dos tubos de plástico (t1 y t2) conectados por una válvula (va). El extremo proximal del tallo huésped (H) que lleva un parásito (P) unido a él a través del haustorio (ha) está conectado al extremo abierto del sistema (B, expandido). Se utiliza una válvula de tres vías (C) o una de dos vías (D) para ayudar a prevenir la formación de burbujas de aire dentro del sistema de tubos, que bloquean el paso de la solución contrastante (E). La punta del extremo proximal del vástago huésped (H) se corta bajo el agua para permitir el paso de la solución de contraste (F). Las bridas, los adaptadores de válvula y los tubos de diferentes diámetros ayudan a asegurar conexiones más estrechas y evitan fugas en el sistema (G). Las figuras 2B, D y F fueron creadas con BioRender. Barras de escala = 2 cm. Haga clic aquí para ver una versión más grande de esta figura.
3. Preparación y montaje de la muestra
- Lave la muestra sumergiéndola en agua durante 2 minutos.
PRECAUCIÓN: No lave las muestras en el fregadero, ya que todas las soluciones de contraste incluyen sales de metales pesados en su composición. Considere el agua utilizada para lavar como una solución de contraste diluida y deséchela adecuadamente. - Coloque la muestra en una toalla de papel a temperatura ambiente para permitir que el exceso de agua se evapore durante 2-5 minutos, dependiendo del tamaño de la muestra. Alternativamente, seque la muestra ligeramente con la ayuda de una toalla de papel. No permita que la muestra se seque completamente.
- Envuelva la muestra en una película de parafina estirándola hasta obtener una capa delgada. Evite doblar la película de parafina sobre la muestra.
- Monte la muestra envuelta en un soporte para muestras, manteniéndola estable y en posición mientras gira durante el escaneo. Use cinta adhesiva, espuma de baja densidad, puntas de pipeta y/o recipientes de plástico transparente para asegurar la muestra en su lugar.
- Escanear la muestra y analizar las imágenes siguiendo protocolos y pautas específicas establecidas para el sistema de micro-TC disponible.
Resultados
El haustorio de plantas parásitas es un órgano complejo que comprende diferentes tejidos y tipos celulares que se entrelazan y conectan con los tejidos de otra planta, utilizada como huésped20. La micro-tomografía computarizada se puede aprovechar para comprender mejor esta compleja estructura de una manera no destructiva y tridimensional cuando se analizan haustorios pequeños (Figura 1A-C) y grandes (Figura 1D, E
Discusión
El uso de soluciones de metales pesados para mejorar el contraste del tejido vegetal se ha convertido en un paso crucial en la preparación de muestras para el análisis de micro-TC. Varios compuestos comúnmente disponibles en los laboratorios de micromorfología vegetal han sido probados por Staedler et al., quienes recomiendan el uso de fosfotungato como el agente más efectivo para penetrar muestras y aumentar el índice de contraste8. Los resultados obtenidos aquí en el análisis del haustor...
Divulgaciones
El autor no tiene nada que revelar.
Agradecimientos
Me gustaría agradecer al Dr. Simone Gomes Ferreira (Laboratorio de Microtomografía, Universidad de Sao Paulo, Brasil) y al Dr. Greg Lin (Centro de Sistemas a Nanoescala, Universidad de Harvard, EE.UU.) por su ayuda primordial y la capacitación indispensable del usuario para diferentes sistemas de microtomografía y software de análisis de datos. También agradezco al personal del Invernadero EEB de la Universidad de Connecticut (EE.UU.), especialmente a Clinton Morse y Matthew Opel por proporcionar los ejemplares de Viscum mínimo. El Dr. John Wenzel brindó la oportunidad y una gran ayuda para el muestreo de Pyrularia pubera. Carolina Bastos, Yasmin Hirao y Talitha Motta ayudaron enormemente con el muestreo de Scybalium fungiforme. Ariadne Furtado, y las doctoras Fernanda Oliveira y Maria Aline Neves proporcionaron la referencia para el uso de la floxina B para el análisis de hongos endófitos. La grabación de video en la Vrije Universiteit Brussel fue posible gracias a la ayuda del Dr. Philippe Claeys, el Dr. Christophe Snoeck, el MSc. Jake Griffith, el Dr. Barabara Veselka y el Dr. Harry Olde Venterink. El financiamiento fue proporcionado por la Coordinación para el Perfeccionamiento del Personal de Educación Superior (CAPES, Brasil) y la Universidad de Harvard Herbaria (EE.UU.).
Materiales
| Name | Company | Catalog Number | Comments |
| 3D X-ray microscope (XRM) system | Zeiss Versa 620 | used to scan Pyrularia pubera | |
| 3D X-ray microscope + A2:D22 | Zeiss | Versa 620 | Used for scanning the species P. pubera |
| CT-Pro 3D software | Nikon | version XT 3.1.11 | Used for three-dimensional reconstruction of scans |
| CT-Vox software | Bruker | version 3.3.1 | Used for analyses and acquisition of images and videos |
| Dragonfly software | Object Research Systems - ORS | version | Used for analyses and acquisition of images and videos |
| Glass vials | Glass Vials Inc. SE | V2708C-FM-SP | Sold by VWR - USA; make sure that vials are able to withstand vacuum at ca. 10 psi |
| Inspect-X | Zeiss | version XT 3.1.11 | Used for controlling the Nikon X-Tek HMXST225 system |
| Iodine solution 0.0282 N | WR Chemicals BDH | BDH7422-1 | Sold by VWR - USA |
| Lead Nitrate II PA 500 g | Vetec | 361.08 | Sold by SPLab |
| Microtomography scanner | Bruker | Skyscan1176 | Used for scanning the species C. americana, S. martianus, and S. fungiforme |
| Microtomography scanner | Nikon | X-Tek HMXST225 | Used for scanning the species V. minimum |
| NRecon software | Bruker | version 1.0.0 | Used for three-dimensional reconstruction |
| Phosphotungstic acid hydrate 3% in aqueous solution | Electron Microscopy Sciences | 101410-756 | Sold by VWR - USA |
| Plastic film (Parafilm) | Heathrow Scientific | PM996 | Sold by VWR - USA |
| Plastic IV bag 500 mL | Taylor | 3478 | Sold by Fibra Cirurgica Produtos para Saude |
| PVC tubing 3/4'' | Nalge Nunc International | SC63013-164 | Sold by VWR - USA |
| Scanning system | Nikon X-Tek HMXST225 | used to scan Viscum minimum | |
| Scanning system | Bruker Skyscan 1176 | used to scan C. americana | |
| Scout-and-ScanTM software | Zeiss | version 16 | Used for controlling the Zeiss Versa 620 system and for three-dimensional reconstruction of scans |
| Three-way valve | ToToT | DMTWVS-5 | Sold by Amazon USA |
| Two-part syringe | HSW Henke-Ject | 4850001000 | Used without the plunger |
| Vacuum chamber | Binder | 80080-434 | Sold by VWR - USA; includes pump and connecting tubes |
| VG Studio Max software | Volume Graphics | version 3.0 | Used for analyses and acquisition of images and videos |
Referencias
- Stock, S. R. . Microcomputed tomography: Methodology and applications. , (2020).
- Hounsfield, G. N. Computerized transverse axial scanning (tomography): I. Description of system. British Journal of Radiology. 46 (552), 1016-1022 (1973).
- Dutilleul, P., Lafond, J. A. Editorial: Branching and rooting out with a CT Scanner: The why, the how, and the outcomes, present and possibly future pierre. Frontiers in Plant Science. 7 (41), 5-6 (2016).
- Metscher, B. D. Biological applications of X-ray microtomography: Imaging micro- anatomy, molecular expression and organismal diversity. Microscopy and Analysis. 27 (2), 13-16 (2013).
- Sakdinawat, A., Attwood, D. Nanoscale X-ray imaging. Nature Photonics. 4 (12), 840-848 (2010).
- Walton, L. A., et al. Morphological characterisation of unstained and intact tissue micro-architecture by X-ray computed micro- and nano-tomography. Scientific Reports. 5, 1-14 (2015).
- Lafond, J. A., Han, L., Dutilleul, P. Concepts and analyses in the ct scanning of root systems and leaf canopies: A timely summary. Frontiers in Plant Science. 6 (1111), 85-91 (2015).
- Staedler, Y. M., Masson, D., Schönenberger, J. Plant tissues in 3D via X-Ray Tomography: Simple contrasting methods allow high resolution imaging. PLoS ONE. 8 (9), 75295 (2013).
- Heeraman, D. A., Hopmans, J. W., Clausnitzer, V. Three dimensional imaging of plant roots in situ with X-ray Computed Tomography. Plant and Soil. 189, 167-179 (1997).
- Dhondt, S., Vanhaeren, H., Van Loo, D., Cnudde, V., Inzé, D. Plant structure visualization by high-resolution X-ray computed tomography. Trends in Plant Science. 15 (8), 419-422 (2010).
- McElrone, A. J., Choat, B., Parkinson, D. Y., MacDowell, A. A., Brodersen, C. R. Using high resolution computed tomography to visualize the three dimensional structure and function of plant vasculature. Journal of Visualized Experiments. (74), e50162 (2013).
- Cochard, H., Delzon, S., Badel, E. X-ray microtomography (micro-CT): A reference technology for high-resolution quantification of xylem embolism in trees. Plant, Cell and Environment. 38 (1), 201-206 (2015).
- Bastos, C. L., Tamaio, N., Angyalossy, V. Unravelling roots of lianas: A case study in Sapindaceae. Annals of Botany. 118 (4), 733-746 (2016).
- da Cunha Neto, I. L., et al. Diversity, distribution, development, and evolution of medullary bundles in Nyctaginaceae. American Journal of Botany. 107 (5), 707-725 (2020).
- Milien, M., Renault-Spilmont, A. S., Cookson, S. J., Sarrazin, A., Verdeil, J. L. Visualization of the 3D structure of the graft union of grapevine using X-ray tomography. Scientia Horticulturae. 144, 130-140 (2012).
- Paya, A. M., Silverberg, J. L., Padgett, J., Bauerle, T. L. X-ray computed tomography uncovers root-root interactions: Quantifying spatial relationships between interacting root systems in three dimensions. Frontiers in Plant Science. 6 (274), 54-65 (2015).
- Teixeira-Costa, L., Ceccantini, G. C. T. Aligning microtomography analysis with traditional anatomy for a 3D understanding of the host-parasite interface - Phoradendron spp. Case study. Frontiers in Plant Science. 7, 1340 (2016).
- Lusic, H., Grinstaff, M. W. X-ray-computed tomography contrast agents. Chemical Reviews. 113 (3), 1641-1666 (2013).
- Těšitel, J. Functional biology of parasitic plants: a review. Plant Ecology and Evolution. 149 (1), 5-20 (2016).
- Teixeira-Costa, L. A living bridge between two enemies: Haustorium structure and evolution across parasitic flowering plants. Revista Brasileira de Botanica. 44 (1), 165-178 (2021).
- Kuijt, J. . The Biology of Parasitic Flowering Plants. , (1969).
- Masumoto, N., et al. Three-dimensional reconstructions of haustoria in two parasitic plant species in the Orobanchaceae. Plant Physiology. 185 (4), 1429-1442 (2021).
- Calo, C. M., et al. A correlation analysis of Light Microscopy and X-ray MicroCT imaging methods applied to archaeological plant remains' morphological attributes visualization. Scientific Reports. 10 (1), 1-15 (2020).
- Brodersen, C. R., Roddy, A. B. New frontiers in the three-dimensional visualization of plant structure and function. American Journal of Botany. 103 (2), 184-188 (2016).
- Teixeira-Costa, L., Davis, C. C. Life history, diversity, and distribution in parasitic flowering plants. Plant Physiology. 187 (1), 32-51 (2021).
- Simpson, B. B. Krameriaceae. Flora Neotropica Monograph. 49, (1989).
- Ruzin, S. E. . Plant microtechnique and microscopy. , (1999).
- Nikolov, L. A., Tomlinson, P. B., Manickam, S., Endress, P. K., Kramer, E. M., Davis, C. C. Holoparasitic Rafflesiaceae possess the most reduced endophytes and yet give rise to the world's largest flowers. Annals of Botany. 114, 233-242 (2014).
- Thorogood, C. J., Teixeira-Costa, L., Ceccantini, G., Davis, C., Hiscock, S. J. Endoparasitic plants and fungi show evolutionary convergence across phylogenetic divisions. New Phytologist. 232 (3), 1159-1167 (2021).
- Largent, D., Johnson, D., Watling, R. . How to Identify Mushrooms to Genus III: Microscopic Features. , (1977).
- Busse, M., et al. Three-dimensional virtual histology enabled through cytoplasm-specific X-ray stain for microscopic and nanoscopic computed tomography. Proceedings of the National Academy of Sciences of the United States of America. 115 (10), 2293-2298 (2018).
- Sperry, J. S., Donnelly, J. R., Tyree, M. T. A method for measuring hydraulic conductivity and embolism in xylem. Plant, Cell and Environment. 11, 35-40 (1988).
- Calvin, C. L. Host-formed tyloses in vessels of the mistletoe Phoradendron (Viscaceae). IAWA Journal. 18 (2), 117-126 (1997).
- Teixeira-Costa, L., Ceccantini, G. Embolism increase and anatomical modifications caused by a parasitic plant. IAWA Journal. 36 (2), 138-151 (2015).
- Ellmore, G. S., Ewers, F. W. Fluid flow in the outermost xylem increment of a ring-porous tree, Ulmus americana. American Journal of Botany. 73 (12), 1771-1774 (1986).
- Ellis, E. A. Staining sectioned biological specimens for transmission electron microscopy: Conventional and En bloc stains. Electron Microscopy: Methods and Protocols. 1117, 57-72 (2014).
- Brodersen, C. R., McElrone, A. J., Choat, B., Matthews, M. A., Shackel, K. A. The dynamics of embolism repair in xylem: In vivo visualizations using high-resolution computed tomography. Plant Physiology. 154 (3), 1088-1095 (2010).
- Brodersen, C. R., et al. Automated analysis of three-dimensional xylem networks using high-resolution computed tomography. New Phytologist. 191 (4), 1168-1179 (2011).
- Lee, K., et al. Visualizing plant development and gene expression in three dimensions using optical projection tomography. Plant Cell. 18 (9), 2145-2156 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados