JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Micro-CT 스캐닝을 활용하여 기생 식물-숙주 상호작용 분석
요약
Micro-CT는 식물 구조를 3차원으로 분석할 수 있는 비파괴 도구입니다. 현재 프로토콜은 기생 식물 구조 및 기능을 분석하기 위해 마이크로 CT를 활용하기 위한 샘플 준비를 설명합니다. 특정 제제와 결합 될 때이 방법의 장점을 강조하기 위해 다른 종이 사용됩니다.
초록
마이크로 CT 스캐닝은 식물의 구조와 기능을 조사하는 데 확립된 도구가 되었습니다. 3차원 시각화 및 가상 절편의 가능성과 결합된 비파괴적 특성으로 인해 복잡한 식물 기관에 대한 새롭고 점점 더 상세한 분석이 가능해졌습니다. 기생 식물과 숙주 사이를 포함하여 식물 간의 상호 작용도 탐구할 수 있습니다. 그러나 스캐닝 전 샘플 준비는 종종 조직 조직과 구성이 다른 이들 식물 간의 상호 작용으로 인해 중요합니다. 또한, 기생충 숙주 물질의 샘플링, 처리 및 준비 중에 고도로 감소된 식물체에서 나무, 허브 및 관목에 이르기까지 기생 꽃 식물의 광범위한 다양성을 고려해야 합니다. 여기에서는 haustorium 분석에 초점을 맞춰 기생충 및/또는 숙주 식물에 대조 용액을 도입하기 위한 두 가지 다른 접근 방식을 설명합니다. 이 기관은 두 식물 사이의 연결과 의사 소통을 촉진합니다. 간단한 접근 방식에 따라 euphytoid, 포도 나무 및 겨우살이 기생 종에 대해 여기에 표시된 것처럼 haustorium 조직 조직의 세부 사항을 3차원으로 탐색할 수 있습니다. 특정 조영제 및 적용 접근법을 선택하면 숙주 체내 기생충 확산을 자세히 관찰하고 여기에 표시된 것처럼 기생충과 숙주 사이의 직접적인 혈관 간 연결을 감지할 수 있습니다. 따라서 여기에서 논의된 프로토콜은 기생 꽃 식물의 광범위한 다양성에 적용하여 발달, 구조 및 기능에 대한 이해를 높일 수 있습니다.
서문
고해상도 X선 마이크로컴퓨터 단층촬영(micro-CT)은 샘플의 여러 방사선 사진(투영)을 서로 다른 시야각에서 기록하고나중에 샘플의 가상 재구성을 제공하는 데 사용하는 이미징 방법입니다1. 그런 다음 이 가상 개체를 분석, 조작 및 분할하여 3차원에서 비파괴 탐색이 가능합니다2. 처음에는 의료 분석용으로 설계되었다가 나중에는 산업 응용 분야를 위해 설계된 micro-CT는 침습적 절차 없이 내부 장기와 조직을 시각화할 수 있는 이점도 제공합니다3. 다른 형태의 이미징과 마찬가지로 마이크로 CT는 시야와 픽셀 크기 사이의 균형을 유지하므로 큰 샘플의 고해상도 이미징은 거의 달성할 수 없습니다4. 고 에너지 X 선 소스 (즉, 싱크로트론) 및 2 차 광학 배율 사용의 발전이 지속적으로 이루어지고 있으며, 가장 작은 해상도가 100 nm 5,6 미만에 도달 할 수 있습니다. 그럼에도 불구하고 큰 샘플의 경우 더 긴 스캔 시간이 필요하므로 스캐너 내부의 샘플 이동 또는 변형으로 인한 아티팩트 가능성이 높아집니다. 또한 마이크로 CT는 일반적으로 시료 내의 자연 밀도 변화와 시료가 X선과 상호 작용하는 방식에 의해 제한됩니다. 밀도가 높은 시료를 투과하는 데는 X선 선량이 더 많을수록 가장 좋지만, 시료와 주변 매질7 내부 및 그 사이의 밀도 변화를 포착하는 데는 덜 효율적이다. 반면, X선 선량이 낮을수록 투과력이 떨어지고 스캔 시간이 길어지지만 밀도 검출 감도가 더 높아진다7.
이러한 제한은 대부분의 식물 조직이 X선 흡수율이 낮은 빛(비조밀) 조직으로 구성되어 있다는 점을 감안할 때 식물 과학에서 현미경 촬영을 사용하는 데 오랫동안 방해가 되어 왔다8. micro-CT의 첫 번째 응용 프로그램은 토양 매트릭스 9,10 내의 뿌리 네트워크를 매핑하는 데 중점을 두었습니다. 나중에 나무와 같이 조직 밀도에 더 큰 차이가 있는 식물 구조가 탐구되기 시작했습니다. 이를 통해 목부 기능성11,12, 복잡한 조직 조직의 발달 13,14 및 식물 간의 상호 작용15,16,17에 대한 조사가 가능해졌습니다. 연질 및 균질 조직의 분석은 조영제로 인해 널리 보급되고 있으며, 이는 현재 식물 샘플의 마이크로 CT 스캐닝 준비의 표준 절차입니다. 그러나, 조영제 도입을 위한 프로토콜은 시료의 부피, 구조적 특성, 사용된 용액의 종류에 따라 다른 결과를 가질 수 있다8. 이상적으로는, 조영제는 상이한 조직들 사이의 구별을 강화하고, 조직/기관 기능 평가를 가능하게 하고, 및/또는 조직(18)에 대한 생화학적 정보를 제공해야 한다. 따라서 스캔 전 적절한 샘플 처리, 준비 및 장착은 모든 마이크로 CT 분석에 매우 중요합니다.
기생 식물 haustorium의 Micro-CT
기생 꽃 피는 식물은 haustorium으로 알려진 기관을 특징으로 하는 속씨식물의 뚜렷한 작용기를 나타냅니다 19. 변형된 줄기와 뿌리 사이의 발달 잡종인 이 다세포 기관은 숙주의 부착, 침투 및 기생충에 의한 접촉에 작용한다(20). 이러한 이유로 haustorium은 "식물들 사이의 기생에 대한 바로 그 아이디어를 구현"하는 것으로 간주됩니다.21. 이 기관의 발달, 구조 및 기능에 대한 자세한 이해는 기생 식물 생태학, 진화 및 관리 연구에 매우 중요합니다. 그럼에도 불구하고 기생 식물의 전반적인 복잡성과 고도로 변형된 구조 및 하우스토리아는 종종 상세한 분석과 비교를 방해합니다. Haustorium 연결은 또한 일반적으로 광범위하고 조직 및 세포 분포에서 균질하지 않습니다(그림 1). 이러한 맥락에서 작은 조직 조각으로 작업하면 조작이 더 쉽고 해상도가 높아질 수 있지만 기생 식물 haustorium과 같은 복잡한 구조의 3 차원 구조에 대한 잘못된 결론을 이끌어 낼 수 있습니다.
대부분의 기생 식물 종에 대한 하우스 토리움 해부학 및 미세 구조에 대한 방대한 문헌이 있지만, 기생충과 숙주 조직 사이의 3차원 조직과 공간적 관계는 아직 잘 연구되지 않고 있다17. Masumoto et al.22의 최근 연구에서 300개 이상의 직렬 반박형 마이크로톰 섹션이 이미지화되어 두 기생충 종의 하우스토리엄을 나타내는 3차원 가상 개체로 재구성되었습니다. 이 방법의 뛰어난 수준의 디테일은 하우스토리움의 세포 및 해부학적 3D 구조에 대한 전례 없는 통찰력을 제공합니다. 그러나 이러한 시간 소모적 인 기술은보다 광범위한 haustorium 연결을 가진 기생충에서 유사한 분석을 금지합니다. micro-CT의 사용은 기생 식물의 복잡하고 종종 부피가 큰 하우스토리아의 3차원 분석을 위한 훌륭한 도구로 부상합니다. 상세한 해부학적 절편 및 기타 보완적인 형태의 현미경 분석을 대체할 수는 없지만17,23, 특히 큰 샘플에 대한 마이크로 CT 스캐닝을 통해 얻은 결과는 더 작은 세그먼트의 하위 샘플링을 지시하는 가이드 역할을 할 수 있으며, 이는 컨포칼 및 전자 현미경과 같은 다른 도구를 사용하여 분석하거나 고해상도 마이크로 CT 시스템으로 재분석할 수 있습니다.

그림 1: 이 프로토콜에 사용된 다양한 작용기의 기생 식물. Euphytoid 기생충 Pyrularia pubera (A), 녹색 과일 (점선 검은 색 원), 기생 덩굴 Cuscuta americana (C), 겨우살이 Struthanthus martianus (D), 절대 뿌리 기생충 Scybalium fungiforme (E). 숙주 뿌리 (Hr) 또는 줄기 (Hs)의 세그먼트는 기생충 하우스 토륨 (P)에 대비를 적용하는 것을 용이하게합니다. 샘플에 기생충 모근/줄기(화살표)가 있으면 하우스 토리움 혈관 조직을 분석할 수 있습니다. 직사각형은 분석에 사용된 샘플의 세그먼트를 나타냅니다. 스케일 바 = 2cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
micro-CT가 식물 과학에서 점점 더 대중적인 기술이 됨에 따라 샘플 스캐닝, 3차원 재구성, 분할 및 분석을 다루는 가이드, 프로토콜 및 문헌이 있습니다 3,10,24. 따라서 이러한 단계는 여기에서 설명하지 않습니다. 모든 상상 기법과 마찬가지로 샘플의 적절한 처리 및 장착은 종종 간과되는 절차이기는 하지만 기본입니다. 이러한 이유로 이 프로토콜은 마이크로 CT 스캐닝을 위한 하우스 토리움 샘플 준비에 중점을 둡니다. 보다 구체적으로, 이 프로토콜은 호스토리움 샘플에 조영제를 도입하여 호스토리움의 다양한 조직 및 세포 유형의 시각화를 개선하고, 숙주 뿌리/줄기 내의 기생 조직의 검출을 용이하게 하고, 기생충-숙주 혈관 연결을 3차원으로 분석하는 두 가지 접근 방식을 설명합니다. 여기에 설명 된 제제는 다른 식물 구조의 분석에도 적용될 수 있습니다.
여기에 기술된 프로토콜의 편의성을 더 잘 설명하기 위해 5종이 사용되었다. 각 종은 기생 꽃 식물의 5 가지 기능 그룹 중 하나를 나타내므로 각 그룹의 기능과 관련된 특정 사항을 다룹니다. Pyrularia pubera (Santalaceae)는 땅에서 발아하여 기생충을 숙주의 뿌리에 연결하는 여러 haustoria를 형성하는 euphytoid 기생충을 나타 내기 위해 선택되었습니다25. 이러한 식물에 의해 생성된 하우스토리아는 종종 미약하고 숙주(26)(그림 1A)로부터 쉽게 찢어지므로, 보다 섬세한 취급 과정이 필요하다. 내부 기생충은 Viscum minimum (Viscaceae)로 표시됩니다. 이 작용기에 속하는 종들은 짧은 기간 동안 숙주의 몸 밖에서만 볼 수 있으며(그림 1B), 숙주 조직 내에 박혀 있는 현저히 감소된 균사체와 같은 세포 가닥으로 수명 주기의 대부분을 산다25. 세 번째 작용기는 기생 덩굴로 구성되며, 이 덩굴은 땅에서 발아하지만 숙주 식물의 줄기에 부착되는 여러 하우스토리아에 의존하여 기초적인 뿌리만 형성합니다25(그림 1C). 여기서, 이 작용기는 Convolvulaceae(Convolvulaceae)로 대표된다. 기생 덩굴과는 달리, 겨우살이는 숙주 식물의 가지에서 직접 발아하여 여러 개 또는 고독한 하우스토리아를 발달시킨다25. 이 작용기를 설명하기 위해 선택된 종은 Struthanthus martianus (Loranthaceae)로, 숙주 가지와 다양한 연결을 형성합니다 (그림 1D). micro-CT와 광학 현미경의 조합을 이용한 고독한 겨우살이 하우스토리아의 분석은 Teixeira-Costa & Ceccantini17에서 찾을 수 있습니다. 마지막으로, 절대 뿌리 기생충은 땅에서 발아하여 숙주 식물의 뿌리에 침투하는 종으로 구성되며, 초기 성장 단계부터 전적으로 의존한다25. 이 식물은 여기에서 Scybalium fungiforme (Balanophoraceae)으로 대표되며, 이는 큰 괴경과 같은 haustoria를 생산합니다 (그림 1E).
이 프로토콜에 사용된 모든 식물 샘플을 70% 포르말린 아세트산 알코올(FAA 70)에 고정했습니다. 샘플링 시 고정은 특히 후속 해부학적 분석이 필요한 경우 식물 조직을 보존하는 데 중요합니다. 기생 식물 haustorium의 경우, 이 기관은 종종 주로 목질화되지 않은 실질 세포로 구성되기 때문에 고정도 필수적이다20. 고정액의 제조를 포함하여, 식물 조직 고정을 위한 상세한 프로토콜은 다른 곳에서 찾을 수 있다27. 반면에, 어느 정도 고정제는 샘플의 물리적 및 화학적 특성을 변화시켜 특정 생체역학적 및 조직화학적 분석에 적합하지 않게 만들 수 있습니다. 따라서, 신선한 샘플, 즉 준비 직전에 수집된 고정되지 않은 물질도 이 프로토콜과 함께 사용할 수 있습니다. 새로운 샘플을 처리하는 방법과 고정된 재료에 대한 문제 해결 제안에 대한 자세한 내용은 토론 섹션에 제공됩니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 기생 식물 샘플 선택
- 부착된 숙주 줄기/뿌리 및 기생된 숙주 기관의 근위 및 원위 말단의 세그먼트를 포함하여 전체 기생 식물 haustorium을 수집합니다. 각 세그먼트의 이상적인 길이는 하우스 토리움 직경의 두 배에 해당합니다.
참고: 외측 haustoria의 경우 haustorium이 형성된 기생충 모체 줄기/뿌리의 일부를 포함합니다(그림 1A,B,D). 내부 기생충의 경우 기생충의 징후가 보이는 숙주 줄기/뿌리의 세그먼트를 수집합니다(그림 1B). 단자 연결의 경우 전체 플랜트를 수집해야 합니다(그림 1E). - 전체 샘플을 고정 용액(예: FAA)에 1:10의 부피 비율로 담그십시오(샘플: 고정액). 샘플의 크기에 따라 최소 1일 동안 샘플을 고정액에 두십시오27.
참고: 샘플은 스캔하기 전에 고정액에 보관하거나 보존 용액(예: 에탄올 70%)으로 옮길 수 있습니다. 후속 해부학적 분석이 보증되지 않는 경우에도 신선한 샘플을 사용할 수 있습니다(토론 섹션 참조). 신선한 재료로 작업하는 경우 조영제를 관류하는 장치를 설정 한 다음 샘플을 수집하십시오. 샘플이 마르지 않도록해야합니다.
2. 대조 용액의 적용
- 사용할 신청 방법을 선택했습니다. 소형(그림 2.3A) 또는 비목재(그림 1B) 샘플에 대해 진공 방법(1단계)을 사용합니다. 숙주 줄기/뿌리의 세그먼트를 포함하는 경우 더 큰 샘플에 관류 방법을 사용합니다(그림 1A,C-E).
- 다음 단계에서 선택한 접근 방식에 관계없이 샘플을 조작할 때 고무 장갑 및 기타 적절한 개인 보호 장비(예: 실험실 코트)를 착용하십시오.
주의 : 모든 대조 용액에는 중금속 염이 포함되어 있으므로 적절한 개인 보호 장비 없이 흄 후드 아래에서 취급해서는 안 됩니다. - 진공 방법의 경우 아래에 언급된 단계를 따르십시오.
- 적절한 바이알을 선택하고 라벨을 붙입니다. 바이알은 샘플과 대조 용액을 수용할 수 있을 만큼 충분히 커야 하며 일반적으로 1:10의 비율로 있어야 합니다. 바이알이 낮거나 중간 정도의 진공을 견딜 수 있는지 제조업체의 지침을 확인하십시오.
알림: 음압(진공)으로 인해 액체가 쏟아질 수 있으므로 바이알을 가장자리까지 채우지 마십시오. - 대조 용액 (1 % 요오드 또는 3 % 포스 포 텅스텐 산염, 재료 표 참조)과 함께 바이알에 샘플을 놓습니다. 그런 다음 바이알을 진공 챔버 또는 진공 펌프에 연결된 데시케이터에 놓습니다. 바이알에서 뚜껑을 제거한 다음 진공 챔버 또는 건조기를 닫습니다.
- 진공 챔버/데시케이터에 균열이 없는지, 진공 펌프에 오일이 충분한지 확인하십시오.
- 펌프의 탈진 밸브를 닫아 공기가 빠져나가는 것을 방지하고 챔버/데시케이터의 탈진 밸브를 열어 공기를 강제로 배출합니다.
- 펌프를 켜고 압력이 약 20"Hg에 도달할 때까지 기다립니다.
주의 : 이 프로세스는 일반적으로 빠르므로 진공 시스템을 방치하지 마십시오.
알림: 압력의 미터법 단위는 파스칼(Pa)이지만 대부분의 실험실 진공 펌프의 압력 게이지는 압력을 수은 인치("Hg), 제곱인치당 파운드(psi) 또는 막대로 표시합니다. 20" Hg는 약 67.7Pa, 10psi 또는 0.7bar와 같습니다. - 챔버/데시케이터 배기 밸브를 닫아 공기가 다시 들어가지 않도록 한 다음 펌프를 빠르게 끕니다.
- 샘플을 최소 2시간 동안 진공 상태로 두십시오. 더 큰 샘플은 대조 용액이 침투하는 데 더 오래 걸립니다.
- 원하는 기간이 지나면 대조 용액에서 샘플을 제거하여 스캔을 준비합니다.
- 챔버/데시케이터 배출 밸브를 천천히 열어 공기가 들어갈 수 있도록 합니다.
- 챔버/데시케이터의 압력이 완전히 소진될 때까지 기다린 다음(즉, 압력 게이지가 0에 가까워질 때까지) 조심스럽게 열어 s를 회수합니다.amp르.
- 대조 용액을 적절하게 버리고 샘플을 스캔할 준비를 하십시오.
- 적절한 바이알을 선택하고 라벨을 붙입니다. 바이알은 샘플과 대조 용액을 수용할 수 있을 만큼 충분히 커야 하며 일반적으로 1:10의 비율로 있어야 합니다. 바이알이 낮거나 중간 정도의 진공을 견딜 수 있는지 제조업체의 지침을 확인하십시오.
- 관류 방법의 경우 아래에 언급된 단계를 따르십시오.
- 샘플의 크기에 따라 대조 용액의 공급 탱크를 선택하십시오. 작은 샘플의 경우 50mL 주사기(바늘 또는 플런저 없음)(그림 2A) 또는 큰 샘플의 경우 1L 정맥 의료 키트(그림 2B)를 사용합니다.
- 투명 플라스틱 튜브(재료 표 참조)의 한쪽 끝을 공급 탱크에 연결한 다음 다른 쪽 끝을 양방향 또는 3방향 밸브에 연결합니다. 두 번째 튜브를 밸브의 다른 배출구에 연결합니다(그림 2A,B).
- 이전 단계에서 설정한 장치를 분해하지 않고 높은 위치에 공급 탱크를 고정하십시오.
알림: 탱크와 샘플 사이의 수직 거리는 용액 관류 압력을 결정합니다(그림 2B). 작은 샘플의 경우 20-50cm의 거리로 충분합니다. 큰 샘플의 경우 1m의 거리가 더 적합합니다. - 3방향(그림 2C) 또는 2방향(그림 2D) 밸브를 닫아 액체가 튜빙 시스템에서 빠져나가는 것을 방지한 다음 대조 용액을 공급 탱크에 붓습니다. 정맥 주사 의료 키트를 사용하는 경우 장치를 높은 위치에 고정하기 전에 백에 용액을 채우고 밸브를 닫으십시오.
- 튜빙 시스템을 따라 큰 기포가 형성되지 않도록 합니다(그림 2E). 필요한 경우 기포가 제거될 때까지 조영제가 튜브 밖으로 흘러나오도록 합니다. 밸브를 다시 닫고 장치를 제자리에 두십시오.
- 조영제의 관류를 위해 샘플을 준비하려면 액체(물, 에탄올 또는 고정제)에 담그고 샘플에서 숙주 줄기/뿌리의 근위 끝 끝을 잘라냅니다(그림 2F).
- 저장된 액체에서 샘플을 제거하고 건조를 피하기 위해 파라핀 필름으로 싸십시오. 샘플을 가까이에 두고 장치에 연결할 준비를 하십시오.
- 대조 용액이 천천히 흐르도록 밸브를 조심스럽게 열고 대조 용액이 쏟아지는 것을 방지하기 위해 시스템의 열린 끝을 약간 높은 위치로 유지하면서 탱크에 연결된 플라스틱 튜브를 채웁니다. 다시 말하지만, 튜브를 따라 큰 기포가 형성되지 않는지 확인하십시오.
- 샘플에서 호스트 스템/루트의 근위 끝을 튜빙 시스템의 열린 끝에 연결합니다(그림 2B, 확대 영역). 이 단계에서 시스템에 기포가 유입되지 않도록 하십시오. 필요한 경우 장치에서 샘플을 분리하고 용액이 흐르도록 하여 시스템에서 기포를 제거합니다.
- 샘플을 장치에 연결한 상태로 유지하면서 대조 용액이 실험이 설정된 영역으로 누출되는 것을 방지하기 위해 용기 안에 넣습니다. 직경이 다른 튜브, 플라스틱 집타이 및 밸브 어댑터(그림 2G)를 사용하여 장치의 모든 연결이 잘 맞는지, 다양한 크기의 호스트 분기를 수용하는지, 용액이 튜브 시스템에서 누출되지 않는지 확인합니다(그림 2B, 확대 영역).
- 용액이 샘플을 최소 2시간 동안 또는 용액이 용기 내부에 축적될 때까지 관류하도록 합니다.
- 밸브를 닫고 장치에서 샘플을 조심스럽게 분리하십시오. 나머지 용액을 용기에 배출하고 적절하게 폐기하십시오.
- 스캔을 준비하기 위해 샘플에서 파라핀 필름을 제거합니다.
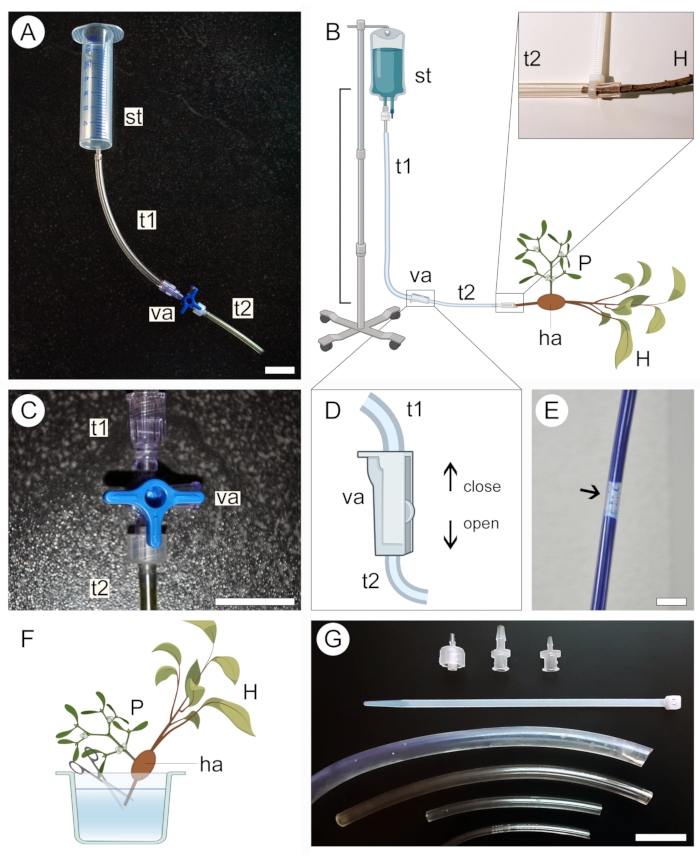
그림 2: 조영제 적용을 위한 관류 방식. 관류 장치의 소형(A) 및 대형(B) 버전은 공급 탱크(st)와 밸브(va)로 연결된 두 개의 플라스틱 튜브(t1 및 t2)를 포함합니다. 하우스토리엄(ha)을 통해 부착된 기생충(P)을 품고 있는 숙주 줄기(H)의 근위 말단은 시스템의 개방된 말단(B, 확장)에 연결됩니다. 3방향(C) 또는 2방향(D) 밸브는 튜빙 시스템 내부에 기포가 형성되어 대조 용액(E)의 통과를 차단하는 것을 방지하는 데 사용됩니다. 숙주 줄기(H)의 근위 단부의 끝은 대조 용액(F)의 통과를 허용하기 위해 수중에서 절단된다. 다양한 직경의 지퍼 타이, 밸브 어댑터 및 튜브는 더 단단한 연결을 고정하고 시스템(G)의 누출을 방지하는 데 도움이 됩니다. 그림 2B, D 및 F는 BioRender로 생성되었습니다. 스케일 바 = 2cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 시료 준비 및 장착
- 샘플을 물에 2분 동안 담가 세척합니다.
주의 : 세척하지 마십시오amp모든 대조 용액에는 중금속 염이 포함되어 있으므로 싱크대에서. 세척에 사용되는 물을 희석된 대조 용액으로 간주하고 적절하게 폐기하십시오. - 샘플의 크기에 따라 과도한 물이 2-5분 동안 증발할 수 있도록 실온에서 종이 타월에 샘플을 놓습니다. 또는 종이 타월을 사용하여 샘플을 약간 건조시킵니다. 샘플이 완전히 건조되지 않도록 하십시오.
- 샘플을 얇은 층으로 늘려서 파라핀 필름으로 감싼다. 샘플 위에 파라핀 필름을 접지 마십시오.
- 포장된 샘플을 샘플 홀더에 장착하여 스캔하는 동안 회전하는 동안 안정적으로 제자리에 유지합니다. 접착 테이프, 저밀도 폼, 피펫 팁 및/또는 투명 플라스틱 용기를 사용하여 샘플을 제자리에 고정합니다.
- 샘플을 스캔하고 사용 가능한 마이크로 CT 시스템에 대해 설정된 특정 프로토콜 및 지침에 따라 이미지를 분석합니다.
Access restricted. Please log in or start a trial to view this content.
결과
기생 식물의 하우스토리엄(haustorium)은 숙주(host20)로 사용되는 다른 식물의 조직과 서로 얽히고 연결되는 상이한 조직 및 세포 유형을 포함하는 복잡한 기관이다. Micro-CT 스캐닝은 소형(그림 1A-C)과 대형(그림 1D,E)을 모두 분석할 때 비파괴적이고 3차원적인 방식으로 이 복잡한 구조를 더 잘 이해하는 데
Access restricted. Please log in or start a trial to view this content.
토론
식물 조직 대비를 개선하기 위해 중금속 용액을 사용하는 것은 마이크로 CT 분석을 위한 샘플 준비에서 중요한 단계가 되었습니다. Staedler et al.은 식물 미세 형태학 실험실에서 일반적으로 사용할 수있는 몇 가지 화합물을 테스트했으며, 샘플을 관통하고 대비 지수를 높이는 데 가장 효과적인 약제로 포스 포 텅스텐 산염을 사용할 것을 권장합니다8. P. pubera 의 하우스 토리...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
다양한 현미경 촬영 시스템 및 데이터 분석 소프트웨어에 대한 최고의 도움과 필수 사용자 교육을 제공한 Simone Gomes Ferreira 박사(브라질 상파울루 대학교 현미경 촬영 실험실)와 Greg Lin 박사(미국 하버드 대학교 나노스케일 시스템 센터)에게 감사드립니다. 또한 미국 코네티컷 대학의 EEB 온실 직원, 특히 최소 비스쿰 표본을 제공한 클린턴 모스와 매튜 오펠에게도 감사드립니다. John Wenzel 박사는 Pyrularia pubera의 샘플링에 대한 기회와 큰 도움을 제공했습니다. 석사 Carolina Bastos, 석사 Yasmin Hirao 및 Talitha Motta는 Scybalium fungiforme의 샘플링에 큰 도움을 주었습니다. 석사 Ariadne Furtado, Drs. Fernanda Oliveira와 Maria Aline Neves는 내생 균류 분석을 위한 플록신 B의 사용에 대한 참고 자료를 제공했습니다. Vrije Universiteit Brussel의 비디오 녹화는 Philippe Claeys 박사, Christophe Snoeck 박사, Jake Griffith 박사, Barabara Veselka 박사 및 Harry Olde Venterink 박사의 도움으로 가능했습니다. 자금은 고등 교육 인력 개선을 위한 조정(CAPES, 브라질)과 Harvard University Herbaria(미국)에서 제공했습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 3D X-ray microscope (XRM) system | Zeiss Versa 620 | used to scan Pyrularia pubera | |
| 3D X-ray microscope + A2:D22 | Zeiss | Versa 620 | Used for scanning the species P. pubera |
| CT-Pro 3D software | Nikon | version XT 3.1.11 | Used for three-dimensional reconstruction of scans |
| CT-Vox software | Bruker | version 3.3.1 | Used for analyses and acquisition of images and videos |
| Dragonfly software | Object Research Systems - ORS | version | Used for analyses and acquisition of images and videos |
| Glass vials | Glass Vials Inc. SE | V2708C-FM-SP | Sold by VWR - USA; make sure that vials are able to withstand vacuum at ca. 10 psi |
| Inspect-X | Zeiss | version XT 3.1.11 | Used for controlling the Nikon X-Tek HMXST225 system |
| Iodine solution 0.0282 N | WR Chemicals BDH | BDH7422-1 | Sold by VWR - USA |
| Lead Nitrate II PA 500 g | Vetec | 361.08 | Sold by SPLab |
| Microtomography scanner | Bruker | Skyscan1176 | Used for scanning the species C. americana, S. martianus, and S. fungiforme |
| Microtomography scanner | Nikon | X-Tek HMXST225 | Used for scanning the species V. minimum |
| NRecon software | Bruker | version 1.0.0 | Used for three-dimensional reconstruction |
| Phosphotungstic acid hydrate 3% in aqueous solution | Electron Microscopy Sciences | 101410-756 | Sold by VWR - USA |
| Plastic film (Parafilm) | Heathrow Scientific | PM996 | Sold by VWR - USA |
| Plastic IV bag 500 mL | Taylor | 3478 | Sold by Fibra Cirurgica Produtos para Saude |
| PVC tubing 3/4'' | Nalge Nunc International | SC63013-164 | Sold by VWR - USA |
| Scanning system | Nikon X-Tek HMXST225 | used to scan Viscum minimum | |
| Scanning system | Bruker Skyscan 1176 | used to scan C. americana | |
| Scout-and-ScanTM software | Zeiss | version 16 | Used for controlling the Zeiss Versa 620 system and for three-dimensional reconstruction of scans |
| Three-way valve | ToToT | DMTWVS-5 | Sold by Amazon USA |
| Two-part syringe | HSW Henke-Ject | 4850001000 | Used without the plunger |
| Vacuum chamber | Binder | 80080-434 | Sold by VWR - USA; includes pump and connecting tubes |
| VG Studio Max software | Volume Graphics | version 3.0 | Used for analyses and acquisition of images and videos |
참고문헌
- Stock, S. R. Microcomputed tomography: Methodology and applications. , CRC Press/Taylor and Francis. Boca Raton, FL. (2020).
- Hounsfield, G. N. Computerized transverse axial scanning (tomography): I. Description of system. British Journal of Radiology. 46 (552), 1016-1022 (1973).
- Dutilleul, P., Lafond, J. A. Editorial: Branching and rooting out with a CT Scanner: The why, the how, and the outcomes, present and possibly future pierre. Frontiers in Plant Science. 7 (41), 5-6 (2016).
- Metscher, B. D. Biological applications of X-ray microtomography: Imaging micro- anatomy, molecular expression and organismal diversity. Microscopy and Analysis. 27 (2), 13-16 (2013).
- Sakdinawat, A., Attwood, D. Nanoscale X-ray imaging. Nature Photonics. 4 (12), 840-848 (2010).
- Walton, L. A., et al. Morphological characterisation of unstained and intact tissue micro-architecture by X-ray computed micro- and nano-tomography. Scientific Reports. 5, 1-14 (2015).
- Lafond, J. A., Han, L., Dutilleul, P. Concepts and analyses in the ct scanning of root systems and leaf canopies: A timely summary. Frontiers in Plant Science. 6 (1111), 85-91 (2015).
- Staedler, Y. M., Masson, D., Schönenberger, J. Plant tissues in 3D via X-Ray Tomography: Simple contrasting methods allow high resolution imaging. PLoS ONE. 8 (9), 75295(2013).
- Heeraman, D. A., Hopmans, J. W., Clausnitzer, V. Three dimensional imaging of plant roots in situ with X-ray Computed Tomography. Plant and Soil. 189, 167-179 (1997).
- Dhondt, S., Vanhaeren, H., Van Loo, D., Cnudde, V., Inzé, D. Plant structure visualization by high-resolution X-ray computed tomography. Trends in Plant Science. 15 (8), 419-422 (2010).
- McElrone, A. J., Choat, B., Parkinson, D. Y., MacDowell, A. A., Brodersen, C. R. Using high resolution computed tomography to visualize the three dimensional structure and function of plant vasculature. Journal of Visualized Experiments. (74), e50162(2013).
- Cochard, H., Delzon, S., Badel, E. X-ray microtomography (micro-CT): A reference technology for high-resolution quantification of xylem embolism in trees. Plant, Cell and Environment. 38 (1), 201-206 (2015).
- Bastos, C. L., Tamaio, N., Angyalossy, V. Unravelling roots of lianas: A case study in Sapindaceae. Annals of Botany. 118 (4), 733-746 (2016).
- da Cunha Neto, I. L., et al. Diversity, distribution, development, and evolution of medullary bundles in Nyctaginaceae. American Journal of Botany. 107 (5), 707-725 (2020).
- Milien, M., Renault-Spilmont, A. S., Cookson, S. J., Sarrazin, A., Verdeil, J. L. Visualization of the 3D structure of the graft union of grapevine using X-ray tomography. Scientia Horticulturae. 144, 130-140 (2012).
- Paya, A. M., Silverberg, J. L., Padgett, J., Bauerle, T. L. X-ray computed tomography uncovers root-root interactions: Quantifying spatial relationships between interacting root systems in three dimensions. Frontiers in Plant Science. 6 (274), 54-65 (2015).
- Teixeira-Costa, L., Ceccantini, G. C. T. Aligning microtomography analysis with traditional anatomy for a 3D understanding of the host-parasite interface - Phoradendron spp. Case study. Frontiers in Plant Science. 7, 1340(2016).
- Lusic, H., Grinstaff, M. W. X-ray-computed tomography contrast agents. Chemical Reviews. 113 (3), 1641-1666 (2013).
- Těšitel, J. Functional biology of parasitic plants: a review. Plant Ecology and Evolution. 149 (1), 5-20 (2016).
- Teixeira-Costa, L. A living bridge between two enemies: Haustorium structure and evolution across parasitic flowering plants. Revista Brasileira de Botanica. 44 (1), 165-178 (2021).
- Kuijt, J. The Biology of Parasitic Flowering Plants. , University of California Press. Berkeley, USA. (1969).
- Masumoto, N., et al. Three-dimensional reconstructions of haustoria in two parasitic plant species in the Orobanchaceae. Plant Physiology. 185 (4), 1429-1442 (2021).
- Calo, C. M., et al. A correlation analysis of Light Microscopy and X-ray MicroCT imaging methods applied to archaeological plant remains' morphological attributes visualization. Scientific Reports. 10 (1), 1-15 (2020).
- Brodersen, C. R., Roddy, A. B. New frontiers in the three-dimensional visualization of plant structure and function. American Journal of Botany. 103 (2), 184-188 (2016).
- Teixeira-Costa, L., Davis, C. C. Life history, diversity, and distribution in parasitic flowering plants. Plant Physiology. 187 (1), 32-51 (2021).
- Simpson, B. B. Krameriaceae. Flora Neotropica Monograph. 49, (1989).
- Ruzin, S. E. Plant microtechnique and microscopy. , Oxford University Press. Oxford, UK. (1999).
- Nikolov, L. A., Tomlinson, P. B., Manickam, S., Endress, P. K., Kramer, E. M., Davis, C. C. Holoparasitic Rafflesiaceae possess the most reduced endophytes and yet give rise to the world's largest flowers. Annals of Botany. 114, 233-242 (2014).
- Thorogood, C. J., Teixeira-Costa, L., Ceccantini, G., Davis, C., Hiscock, S. J. Endoparasitic plants and fungi show evolutionary convergence across phylogenetic divisions. New Phytologist. 232 (3), 1159-1167 (2021).
- Largent, D., Johnson, D., Watling, R. How to Identify Mushrooms to Genus III: Microscopic Features. , Mad River Press Inc. Eureka, CA. USA. (1977).
- Busse, M., et al. Three-dimensional virtual histology enabled through cytoplasm-specific X-ray stain for microscopic and nanoscopic computed tomography. Proceedings of the National Academy of Sciences of the United States of America. 115 (10), 2293-2298 (2018).
- Sperry, J. S., Donnelly, J. R., Tyree, M. T. A method for measuring hydraulic conductivity and embolism in xylem. Plant, Cell and Environment. 11, 35-40 (1988).
- Calvin, C. L. Host-formed tyloses in vessels of the mistletoe Phoradendron (Viscaceae). IAWA Journal. 18 (2), 117-126 (1997).
- Teixeira-Costa, L., Ceccantini, G. Embolism increase and anatomical modifications caused by a parasitic plant. IAWA Journal. 36 (2), 138-151 (2015).
- Ellmore, G. S., Ewers, F. W. Fluid flow in the outermost xylem increment of a ring-porous tree, Ulmus americana. American Journal of Botany. 73 (12), 1771-1774 (1986).
- Ellis, E. A. Staining sectioned biological specimens for transmission electron microscopy: Conventional and En bloc stains. Electron Microscopy: Methods and Protocols. 1117, 57-72 (2014).
- Brodersen, C. R., McElrone, A. J., Choat, B., Matthews, M. A., Shackel, K. A. The dynamics of embolism repair in xylem: In vivo visualizations using high-resolution computed tomography. Plant Physiology. 154 (3), 1088-1095 (2010).
- Brodersen, C. R., et al. Automated analysis of three-dimensional xylem networks using high-resolution computed tomography. New Phytologist. 191 (4), 1168-1179 (2011).
- Lee, K., et al. Visualizing plant development and gene expression in three dimensions using optical projection tomography. Plant Cell. 18 (9), 2145-2156 (2006).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유