É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Aproveitando a microtomografia computadorizada para analisar interações parasitas planta-hospedeiro
Neste Artigo
Resumo
A micro-TC é uma ferramenta não destrutiva capaz de analisar as estruturas das plantas em três dimensões. O presente protocolo descreve o preparo da amostra para alavancar micro-CT para analisar a estrutura e função de plantas parasitas. Diferentes espécies são utilizadas para destacar as vantagens deste método quando associado a preparações específicas.
Resumo
A micro-TC tornou-se uma ferramenta estabelecida na investigação da estrutura e função da planta. Sua natureza não destrutiva, combinada com a possibilidade de visualização tridimensional e seccionamento virtual, tem permitido novas e cada vez mais detalhadas análises de órgãos vegetais complexos. Interações entre plantas, inclusive entre plantas parasitas e seus hospedeiros, também podem ser exploradas. No entanto, o preparo da amostra antes da digitalização torna-se crucial devido à interação entre essas plantas, que muitas vezes diferem na organização e composição dos tecidos. Além disso, a ampla diversidade de plantas com flores parasitas, desde corpos vegetativos altamente reduzidos até árvores, ervas e arbustos, deve ser considerada durante a amostragem, tratamento e preparação do material parasita-hospedeiro. Aqui duas abordagens diferentes são descritas para a introdução de soluções de contraste no parasita e/ou plantas hospedeiras, com foco na análise do haustório. Este órgão promove a conexão e comunicação entre as duas plantas. Seguindo uma abordagem simples, detalhes da organização do tecido haustório podem ser explorados tridimensionalmente, como mostrado aqui para espécies parasitas eufitóides, videiras e visco. A seleção de agentes contrastantes específicos e as abordagens de aplicação também permitem a observação detalhada da disseminação do endoparasita dentro do corpo do hospedeiro e a detecção da conexão direta vaso-vaso entre o parasita e o hospedeiro, como mostrado aqui para um parasita radicular obrigatório. Assim, o protocolo aqui discutido pode ser aplicado à ampla diversidade de plantas com flores parasitas para avançar na compreensão de seu desenvolvimento, estrutura e funcionamento.
Introdução
A microtomografia computadorizada de alta resolução (micro-TC) é um método de imagem no qual múltiplas radiografias (projeções) de uma amostra são registradas a partir de diferentes ângulos de visão e, posteriormente, utilizadas para proporcionar uma reconstrução virtual da amostra1. Esse objeto virtual pode então ser analisado, manipulado e segmentado, permitindo uma exploração não destrutiva em três dimensões2. Inicialmente projetada para análises médicas e posteriormente para aplicações industriais, a micro-TC também oferece a vantagem de visualizar órgãos e tecidos internos sem a necessidade de procedimentos invasivos3. Como outras formas de imagem, a micro-TC trabalha com um trade-off entre o campo de visão e o tamanho do pixel, o que significa que imagens de alta resolução de grandes amostras são quase inatingíveis4. Avanços no uso de fontes de raios X de alta energia (síncrotron) e ampliação óptica secundária estão sendo constantes, permitindo que a menor resolução chegue abaixo de 100 nm 5,6. No entanto, tempos de varredura mais longos são necessários para amostras grandes, aumentando a chance de artefatos devido à movimentação ou deformação da amostra dentro do scanner. Além disso, a micro-TC é geralmente limitada por variações de densidade natural dentro da amostra e como a amostra interage com os raios-X. Embora uma dose maior de raios X seja melhor para penetrar amostras mais densas, ela é menos eficiente em capturar variações de densidade dentro e entre a amostra e seu meio circundante7. Por outro lado, uma menor dose de raios X oferece menor poder de penetração e, muitas vezes, requer tempos de varredura mais longos, mas maior sensibilidade na detecção de densidade7.
Essas restrições há muito dificultam o uso da microtomografia para as ciências vegetais, uma vez que a maioria dos tecidos vegetais é composta por tecido leve (não denso) com baixa absorção de raios X8. As primeiras aplicações do micro-CT foram focadas no mapeamento de redes radiculares dentro da matriz do solo 9,10. Posteriormente, estruturas vegetais com diferenças mais significativas na densidade de tecidos, como a madeira, começaram a ser exploradas. Isso tem permitido investigações da funcionalidade do xilema 11,12, desenvolvimento de organizações teciduais complexas13,14 e interações entre plantas15,16,17. A análise de tecidos moles e homogêneos está se tornando difundida devido aos agentes de contraste, que agora são procedimento padrão em preparações para micro-TC de amostras de plantas. No entanto, protocolos para introdução de contraste podem ter resultados diferentes dependendo do volume da amostra, das propriedades estruturais e do tipo de solução utilizada8. Idealmente, o contraste deve aumentar a distinção entre diferentes tecidos, permitir a avaliação da funcionalidade do tecido/órgão e/ou fornecer informações bioquímicas sobre um tecido18. Portanto, o tratamento, o preparo e a montagem adequados da amostra antes do exame tornam-se cruciais para qualquer análise de micro-TC.
Micro-CT do haustório da planta parasita
As plantas com flores parasitas representam um grupo funcional distinto de angiospermas caracterizadas por um órgão conhecido como haustório19. Esse órgão multicelular, um híbrido de desenvolvimento entre um caule modificado e uma raiz, atua na fixação, penetração e contato do hospedeiro por um parasita20. Por essa razão, considera-se que o haustório "incorpora a própria ideia de parasitismo entre plantas"21. Uma compreensão detalhada do desenvolvimento, estrutura e funcionamento deste órgão é crucial para estudos de ecologia, evolução e manejo de plantas parasitas. No entanto, a complexidade geral das plantas parasitas e a estrutura e haustórios altamente modificados muitas vezes dificultam análises e comparações detalhadas. As conexões do Haustorium também costumam ser extensas e não homogêneas na distribuição tecidual e celular (Figura 1). Nesse contexto, embora o trabalho com pequenos fragmentos de tecido permita maior manipulação e maior resolução, pode levar a conclusões errôneas sobre a arquitetura tridimensional de estruturas complexas, como o haustório de plantas parasitas.
Embora exista uma vasta literatura sobre anatomia e ultraestrutura do haustório para a maioria das espécies de plantas parasitas, a organização tridimensional e a relação espacial entre os tecidos do parasita e do hospedeiro permanecem pouco exploradas17. Em um trabalho recente de Masumoto et al.22, mais de 300 cortes seriados de micrótomos semifinos foram fotografados e reconstruídos em um objeto virtual tridimensional representando o haustório de duas espécies de parasitas. O excelente nível de detalhe deste método fornece informações sem precedentes sobre a estrutura 3D celular e anatômica do haustório. No entanto, tal técnica demorada proibiria uma análise semelhante em parasitas com conexões de haustório mais extensas. O uso da micro-TC surge como uma excelente ferramenta para análise tridimensional de haustórios complexos e muitas vezes volumosos de plantas parasitas. Embora não substituam o corte anatômico detalhado e outras formas complementares de análise microscópica17,23, os resultados obtidos por micro-TC, especialmente para amostras grandes, também podem servir como um guia para direcionar a subamostragem de segmentos menores, que podem ser analisados com outras ferramentas, como microscopia confocal e eletrônica, ou reanalisados com sistemas de micro-TC de alta resolução.

Figura 1: Plantas parasitas de diferentes grupos funcionais utilizadas neste protocolo. Eufitóide parasita Pyrularia pubera (A), endoparasita Viscum minimum (B) com frutos verdes (círculo preto tracejado), cipó parasita Cuscuta americana (C), visco Struthanthus martianus (D), parasita radicular obrigatório Scybalium fungiforme (E). Segmentos da raiz do hospedeiro (Hr) ou caule (Hs) facilitam a aplicação do contraste no haustório do parasita (P). A presença de raiz/caule mãe do parasito (setas) na amostra permite a análise da organização dos vasos do haustório. Os retângulos indicam segmentos da amostra utilizada para análise. Barras de escala = 2 cm. Clique aqui para ver uma versão maior desta figura.
À medida que a micro-TC se torna uma técnica cada vez mais popular nas ciências vegetais, existem guias, protocolos e literatura que tratam de escaneamento de amostras, reconstrução tridimensional, segmentação e análise 3,10,24. Assim, essas etapas não serão discutidas aqui. Como em qualquer técnica de imaginação, o tratamento adequado e a montagem de amostras são fundamentais, embora muitas vezes seja um procedimento negligenciado. Por esta razão, este protocolo concentra-se na preparação de amostras de haustório para micro-TC. Mais especificamente, este protocolo descreve duas abordagens para a introdução de agentes de contraste em amostras de haustório para melhorar a visualização de diferentes tecidos e tipos celulares no haustório, para facilitar a detecção de tecido parasitário dentro da raiz/caule do hospedeiro e para analisar as conexões vasculares parasita-hospedeiro em três dimensões. As preparações aqui descritas também podem ser adaptadas para a análise de outras estruturas vegetais.
Cinco espécies foram utilizadas para melhor ilustrar a conveniência do protocolo aqui descrito. Cada espécie representa um dos cinco grupos funcionais de plantas com flores parasitas, abordando assim pontos específicos relacionados à funcionalidade de cada grupo. Pyrularia pubera (Santalaceae) foi escolhida para representar os parasitas eufitóides, que germinam no solo e formam múltiplos haustórios que conectam o parasita às raízes de seus hospedeiros25. Os haustórios criados por essas plantas são muitas vezes tênues e facilmente rasgados do hospedeiro26 (Figura 1A), exigindo um processo de manuseio mais delicado. Os endoparasitas estão aqui representados por Viscum minimum (Viscaceae ). As espécies desse grupo funcional só são visíveis fora do corpo de seus hospedeiros por curtos períodos (Figura 1B) e vivem a maior parte de seus ciclos de vida como fitas de células significativamente reduzidas e semelhantes a micélios embutidas nos tecidos do hospedeiro25. Um terceiro grupo funcional compreende as videiras parasitas, que germinam no solo, mas formam apenas raízes rudimentares, apoiando-se em múltiplos haustórios que se fixam aos caules das plantas hospedeiras25 (Figura 1C). Aqui, este grupo funcional é representado por Cuscuta americana (Convolvulaceae). Ao contrário das videiras parasitas, os viscos germinam diretamente sobre os ramos de suas plantas hospedeiras e desenvolvem haustórios múltiplos ou solitários25. A espécie escolhida para ilustrar este grupo funcional é Struthanthus martianus (Loranthaceae), que forma várias conexões com o ramo hospedeiro (Figura 1D). A análise do visco solitário haustório utilizando uma combinação de micro-TC e microscopia óptica pode ser encontrada em Teixeira-Costa e Ceccantini17. Finalmente, os parasitas radiculares obrigatórios compreendem espécies que germinam no solo e penetram nas raízes das plantas hospedeiras, das quais são inteiramente dependentes desde os estágios iniciais de crescimento25. Essas plantas são representadas aqui por Scybalium fungiforme (Balanophoraceae), que produzem grandes haustórios semelhantes a tubérculos (Figura 1E).
Todas as amostras de plantas utilizadas neste protocolo foram fixadas em álcool de ácido acético formalina 70% (FAA 70). A fixação no momento da amostragem é crucial para a preservação dos tecidos vegetais, especialmente se análises anatômicas subsequentes forem necessárias. No caso do haustório de plantas parasitas, a fixação também é essencial, pois esse órgão é frequentemente composto primariamente por células parenquimáticas não lignificadas20. Protocolos detalhados para fixação de tecidos vegetais, incluindo a preparação de soluções fixadoras, podem ser encontrados em outros periódicos27. Por outro lado, em maior ou menor grau, os fixadores podem causar alterações nas propriedades físicas e químicas de uma amostra, tornando-a inadequada para análises biomecânicas e histoquímicas específicas. Assim, amostras frescas, ou seja, material não fixado, coletado imediatamente antes do preparo, também podem ser utilizadas com esse protocolo. Detalhes sobre como lidar com amostras novas e sugestões de solução de problemas para material fixado são fornecidos na seção de discussão.
Protocolo
1. Seleção de amostras de plantas parasitas
- Coletar todo o haustório da planta parasita, incluindo o caule/raiz do hospedeiro aderido e segmentos das extremidades proximal e distal do órgão hospedeiro parasitado; O comprimento ideal de cada segmento equivale ao dobro do diâmetro do haustório.
NOTA: Para haustórios laterais, incluir parte do caule/raiz mãe do parasita a partir do qual o haustório foi formado (Figura 1A,B,D). Para endoparasitas, coletar um segmento do caule/raiz do hospedeiro no qual os sinais do parasita são visíveis (Figura 1B). No caso de conexões terminais, toda a planta deve ser coletada (Figura 1E). - Submergir toda a amostra em solução fixadora (por exemplo, FAA) em uma proporção volumétrica de 1:10 (amostra: fixador). Deixar as amostras em fixador por pelo menos 1 dia, dependendo do tamanho da amostra27.
NOTA: As amostras podem ser armazenadas em fixador antes da digitalização ou ser transferidas para uma solução preservadora (por exemplo, etanol 70%). Amostras frescas também podem ser usadas se a análise anatômica subsequente não for justificada (consulte a seção Discussão). Se estiver trabalhando com material fresco, configure o aparelho para perfusão da solução de contraste e, em seguida, colete a amostra. A amostra não deve ser deixada secar.
2. Aplicação de soluções contrastantes
- Escolha o método de aplicação a ser utilizado. Utilizar o método do vácuo (passo 2.3) para amostras pequenas (Figura 1A) ou não lenhosas (Figura 1B). Utilizar o método de perfusão para amostras maiores, desde que inclua um segmento do caule/raiz do hospedeiro (Figura 1A,C-E).
- Use luvas de borracha e outros equipamentos de proteção individual apropriados (por exemplo, jaleco de laboratório) ao manipular a amostra, independentemente da abordagem escolhida nas etapas a seguir.
CUIDADO: Todas as soluções contrastantes incluem sais de metais pesados em sua composição e, portanto, não devem ser manuseadas sem equipamentos de proteção individual adequados e sob uma capela de fumaça. - Para o método de vácuo, siga as etapas mencionadas abaixo.
- Escolha um frasco para injetáveis apropriado e rotule-o. O frasco para injetáveis deve ser suficientemente grande para acomodar a amostra e a solução contrastante, geralmente numa proporção de 1:10. Verifique as instruções do fabricante para garantir que o frasco para injetáveis suporta vácuo baixo a moderado.
NOTA: Não encha o frasco para injetáveis até à borda, pois a pressão negativa (vácuo) pode provocar o derrame do líquido. - Colocar a amostra no frasco para injetáveis com a solução contrastante (iodo a 1% ou fosfotungstato a 3%, ver Tabela de Materiais). Em seguida, coloque o frasco para injetáveis numa câmara de vácuo ou exsicador ligado a uma bomba de vácuo. Retire a tampa do frasco para injetáveis e, em seguida, feche a câmara de vácuo ou o dessecador.
- Verifique se não há rachaduras na câmara de vácuo/exsicador e se a bomba de vácuo tem óleo suficiente.
- Feche a válvula de exaustão da bomba para evitar que o ar se espalhe e abra a válvula de exaustão da câmara/exsicador para forçar a saída do ar.
- Ligue a bomba e aguarde até que a pressão atinja aproximadamente 20" Hg.
CUIDADO: Este processo geralmente é rápido, portanto, não deixe o sistema de vácuo desacompanhado.
NOTA: Enquanto a unidade do sistema métrico para pressão é Pascal (Pa), os manômetros na maioria das bombas de vácuo de laboratório exibem pressão em polegadas de mercúrio ("Hg), libra por polegada quadrada (psi) ou barras. 20" Hg é igual a cerca de 67,7 Pa, 10 psi ou 0,7 bar. - Feche a válvula de escape da câmara/exsicador para evitar a reentrada de ar e, em seguida, desligue rapidamente a bomba.
- Deixar a amostra sob vácuo por pelo menos 2 h; amostras maiores requerem mais tempo para que a solução contrastante penetre.
- Após o período desejado, remova a amostra da solução contrastante para prepará-la para digitalização.
- Abra lentamente a válvula de exaustão da câmara/exsicador para permitir a entrada de ar.
- Aguarde até que a pressão na câmara/exsicador esteja totalmente esgotada (ou seja, o manômetro atinja perto de 0) e, em seguida, abra-a cuidadosamente para recuperar a amostra.
- Descarte a solução contrastante adequadamente e mantenha a amostra em preparação para digitalização.
- Escolha um frasco para injetáveis apropriado e rotule-o. O frasco para injetáveis deve ser suficientemente grande para acomodar a amostra e a solução contrastante, geralmente numa proporção de 1:10. Verifique as instruções do fabricante para garantir que o frasco para injetáveis suporta vácuo baixo a moderado.
- Para o método de perfusão, siga os passos mencionados abaixo.
- Seleccione um tanque de alimentação para a solução contrastante de acordo com o tamanho da amostra. Utilizar uma seringa de 50 mL (sem agulha ou êmbolo) para amostras pequenas (Figura 2A) ou um kit médico intravenoso de 1 L para amostras grandes (Figura 2B).
- Conecte uma extremidade de uma tubulação de plástico transparente (consulte a Tabela de Materiais) ao tanque de alimentação e, em seguida, conecte a outra extremidade a uma válvula bidirecional ou tridirecional. Conecte uma segunda tubulação a uma saída diferente na válvula (Figura 2A,B).
- Fixe o tanque de alimentação em uma posição elevada sem desmontar o aparelho configurado na etapa anterior.
NOTA: A distância vertical entre o tanque e a amostra ditará a pressão de perfusão da solução (Figura 2B). Uma distância de 20-50 cm é suficiente para amostras pequenas. Para amostras grandes, uma distância de 1 m é mais adequada. - Feche a válvula de três vias (Figura 2C) ou bidirecional (Figura 2D) para evitar que o líquido saia do sistema de tubulação e, em seguida, despeje a solução contrastante no tanque de alimentação. Se estiver usando um kit médico intravenoso, encha o saco com a solução e feche a válvula antes de fixar o aparelho em uma posição elevada.
- Certifique-se de que não se formem grandes bolhas de ar ao longo do sistema de tubulação (Figura 2E). Se necessário, deixe a solução de contraste fluir para fora da tubulação até que a bolha seja removida. Feche a válvula novamente e deixe o aparelho no lugar.
- Para preparar a amostra para a perfusão da solução de contraste, mantê-la submersa em líquido (água, etanol ou fixador) e cortar a ponta da extremidade proximal do caule/raiz hospedeira na amostra (Figura 2F).
- Retire a amostra do líquido em que foi armazenada e envolva-a em um filme de parafina para evitar a dessecação. Mantenha a amostra próxima e pronta para ser conectada ao aparelho.
- Abra cuidadosamente a válvula para permitir que a solução contrastante flua lentamente e encha a tubulação plástica conectada ao tanque, mantendo a extremidade aberta do sistema em uma posição ligeiramente elevada para evitar que a solução contrastante vaze. Novamente, certifique-se de que não se formem grandes bolhas de ar ao longo do tubo.
- Conectar a extremidade proximal do caule/raiz hospedeira na amostra à extremidade aberta do sistema de tubulação (Figura 2B, região ampliada). Evite introduzir bolhas de ar no sistema durante esta etapa. Se necessário, desconecte a amostra do aparelho e remova as bolhas de ar do sistema, permitindo que a solução flua.
- Ao manter a amostra conectada ao aparelho, coloque-a dentro de um recipiente para evitar vazamento da solução contrastante para a área onde o experimento foi montado. Use tubos de diferentes diâmetros, zíperes plásticos e adaptadores de válvula (Figura 2G) para garantir que todas as conexões no aparelho estejam bem ajustadas, acomodem ramos hospedeiros de vários tamanhos e que a solução não esteja vazando para fora do sistema de tubulação (Figura 2B, região ampliada).
- Deixe a solução perfundir a amostra durante pelo menos 2 h ou até que a solução se acumule no interior do recipiente.
- Feche a válvula e desconecte cuidadosamente a amostra do aparelho. Escorra o restante da solução para o recipiente e elimine-a adequadamente.
- Retire a película de parafina da amostra em preparação para digitalização.
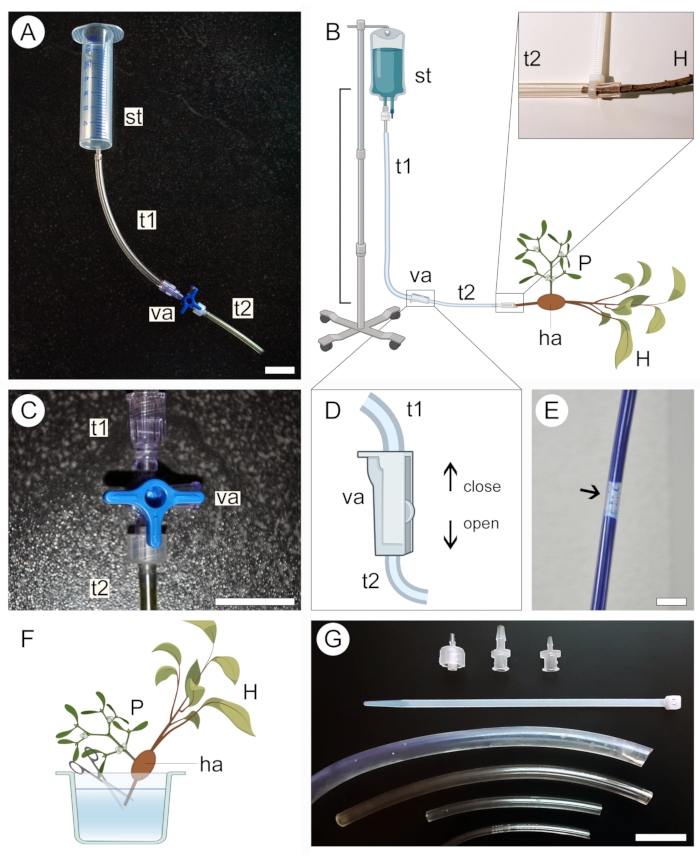
Figura 2: Abordagem de perfusão para aplicação de contraste. As versões pequena (A) e grande (B) do aparelho de perfusão incluem um tanque de alimentação (st) e dois tubos plásticos (t1 e t2) conectados por uma válvula (va). A extremidade proximal do caule do hospedeiro (H) com um parasita (P) ligado a ele através do haustório (ha) está conectada à extremidade aberta do sistema (B, expandida). Uma válvula de três vias (C) ou uma válvula bidirecional (D) é usada para ajudar a evitar a formação de bolhas de ar dentro do sistema de tubulação, que bloqueiam a passagem da solução contrastante (E). A ponta da extremidade proximal do caule hospedeiro (H) é cortada debaixo d'água para permitir a passagem da solução de contraste (F). Zip-ties, adaptadores de válvula e tubulações de diferentes diâmetros ajudam a proteger conexões mais estreitas e evitam vazamentos no sistema (G). As figuras 2B, D e F foram criadas com o BioRender. Barras de escala = 2 cm. Clique aqui para ver uma versão maior desta figura.
3. Preparação e montagem da amostra
- Lave a amostra submergindo-a em água durante 2 minutos.
CUIDADO: Não lave amostras na pia, pois todas as soluções contrastantes incluem sais de metais pesados em sua composição. Considere a água utilizada para lavagem como uma solução contrastante diluída e elimine-a adequadamente. - Coloque a amostra em um papel toalha à temperatura ambiente para permitir que o excesso de água evapore por 2-5 min, dependendo do tamanho da amostra. Alternativamente, seque ligeiramente a amostra com o auxílio de um papel toalha. Não deixe a amostra secar completamente.
- Embrulhe a amostra em uma película de parafina, esticando-a até uma camada fina. Evite dobrar a película de parafina em cima da amostra.
- Monte a amostra embrulhada em um porta-amostras, mantendo-a estável e na posição enquanto gira durante a digitalização. Use fita adesiva, espuma de baixa densidade, pontas de pipeta e/ou recipientes de plástico transparente para fixar a amostra no lugar.
- Digitalizar a amostra e analisar as imagens seguindo protocolos específicos e diretrizes estabelecidas para o sistema de micro-TC disponível.
Resultados
O haustório de plantas parasitas é um órgão complexo composto por diferentes tecidos e tipos celulares que se entrelaçam e se conectam com os tecidos de outra planta, utilizada como hospedeira20. A microtomografia computadorizada pode ser aproveitada para melhor entender essa complexa estrutura de forma não destrutiva e tridimensional ao analisar haustórios pequenos (Figura 1A-C) e grandes (Figura 1D,E).
Discussão
O uso de soluções de metais pesados para melhorar o contraste do tecido vegetal tornou-se uma etapa crucial na preparação de amostras para análise de micro-TC. Vários compostos comumente disponíveis em laboratórios de micromorfologia vegetal foram testados por Staedler et al., que recomendam o uso do fosfotungstato como o agente mais eficaz em penetrar amostras e aumentar o índice decontraste8. Os resultados aqui obtidos na análise do haustório de P. pubera corroboram essa reco...
Divulgações
O autor não tem nada a revelar.
Agradecimentos
Gostaria de agradecer à Dra. Simone Gomes Ferreira (Laboratório de Microtomografia, Universidade de São Paulo, Brasil) e ao Dr. Greg Lin (Center for Nanoscale Systems, Harvard University, EUA) pela ajuda primordial e indispensável treinamento de usuários para diferentes sistemas de microtomografia e softwares de análise de dados. Agradeço também ao pessoal da EEB Greenhouse da Universidade de Connecticut (EUA), especialmente a Clinton Morse e Matthew Opel por fornecerem os espécimes de Viscum minimum. Dr. John Wenzel proporcionou a oportunidade e grande ajuda para a amostragem de Pyrularia pubera. Carolina Bastos, Yasmin Hirao e Talitha Motta ajudaram muito na amostragem de Scybalium fungiforme. A MSc. Ariadne Furtado, e as Dras. Fernanda Oliveira e Maria Aline Neves forneceram a referência para o uso da floroxina B para a análise de fungos endofíticos. A gravação de vídeo na Vrije Universiteit Brussel foi possível graças à ajuda do Dr. Philippe Claeys, Dr. Christophe Snoeck, MSc. Jake Griffith, Dr. Barabara Veselka e Dr. Harry Olde Venterink. O financiamento foi fornecido pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES, Brasil) e pelo Harvard University Herbaria (EUA).
Materiais
| Name | Company | Catalog Number | Comments |
| 3D X-ray microscope (XRM) system | Zeiss Versa 620 | used to scan Pyrularia pubera | |
| 3D X-ray microscope + A2:D22 | Zeiss | Versa 620 | Used for scanning the species P. pubera |
| CT-Pro 3D software | Nikon | version XT 3.1.11 | Used for three-dimensional reconstruction of scans |
| CT-Vox software | Bruker | version 3.3.1 | Used for analyses and acquisition of images and videos |
| Dragonfly software | Object Research Systems - ORS | version | Used for analyses and acquisition of images and videos |
| Glass vials | Glass Vials Inc. SE | V2708C-FM-SP | Sold by VWR - USA; make sure that vials are able to withstand vacuum at ca. 10 psi |
| Inspect-X | Zeiss | version XT 3.1.11 | Used for controlling the Nikon X-Tek HMXST225 system |
| Iodine solution 0.0282 N | WR Chemicals BDH | BDH7422-1 | Sold by VWR - USA |
| Lead Nitrate II PA 500 g | Vetec | 361.08 | Sold by SPLab |
| Microtomography scanner | Bruker | Skyscan1176 | Used for scanning the species C. americana, S. martianus, and S. fungiforme |
| Microtomography scanner | Nikon | X-Tek HMXST225 | Used for scanning the species V. minimum |
| NRecon software | Bruker | version 1.0.0 | Used for three-dimensional reconstruction |
| Phosphotungstic acid hydrate 3% in aqueous solution | Electron Microscopy Sciences | 101410-756 | Sold by VWR - USA |
| Plastic film (Parafilm) | Heathrow Scientific | PM996 | Sold by VWR - USA |
| Plastic IV bag 500 mL | Taylor | 3478 | Sold by Fibra Cirurgica Produtos para Saude |
| PVC tubing 3/4'' | Nalge Nunc International | SC63013-164 | Sold by VWR - USA |
| Scanning system | Nikon X-Tek HMXST225 | used to scan Viscum minimum | |
| Scanning system | Bruker Skyscan 1176 | used to scan C. americana | |
| Scout-and-ScanTM software | Zeiss | version 16 | Used for controlling the Zeiss Versa 620 system and for three-dimensional reconstruction of scans |
| Three-way valve | ToToT | DMTWVS-5 | Sold by Amazon USA |
| Two-part syringe | HSW Henke-Ject | 4850001000 | Used without the plunger |
| Vacuum chamber | Binder | 80080-434 | Sold by VWR - USA; includes pump and connecting tubes |
| VG Studio Max software | Volume Graphics | version 3.0 | Used for analyses and acquisition of images and videos |
Referências
- Stock, S. R. . Microcomputed tomography: Methodology and applications. , (2020).
- Hounsfield, G. N. Computerized transverse axial scanning (tomography): I. Description of system. British Journal of Radiology. 46 (552), 1016-1022 (1973).
- Dutilleul, P., Lafond, J. A. Editorial: Branching and rooting out with a CT Scanner: The why, the how, and the outcomes, present and possibly future pierre. Frontiers in Plant Science. 7 (41), 5-6 (2016).
- Metscher, B. D. Biological applications of X-ray microtomography: Imaging micro- anatomy, molecular expression and organismal diversity. Microscopy and Analysis. 27 (2), 13-16 (2013).
- Sakdinawat, A., Attwood, D. Nanoscale X-ray imaging. Nature Photonics. 4 (12), 840-848 (2010).
- Walton, L. A., et al. Morphological characterisation of unstained and intact tissue micro-architecture by X-ray computed micro- and nano-tomography. Scientific Reports. 5, 1-14 (2015).
- Lafond, J. A., Han, L., Dutilleul, P. Concepts and analyses in the ct scanning of root systems and leaf canopies: A timely summary. Frontiers in Plant Science. 6 (1111), 85-91 (2015).
- Staedler, Y. M., Masson, D., Schönenberger, J. Plant tissues in 3D via X-Ray Tomography: Simple contrasting methods allow high resolution imaging. PLoS ONE. 8 (9), 75295 (2013).
- Heeraman, D. A., Hopmans, J. W., Clausnitzer, V. Three dimensional imaging of plant roots in situ with X-ray Computed Tomography. Plant and Soil. 189, 167-179 (1997).
- Dhondt, S., Vanhaeren, H., Van Loo, D., Cnudde, V., Inzé, D. Plant structure visualization by high-resolution X-ray computed tomography. Trends in Plant Science. 15 (8), 419-422 (2010).
- McElrone, A. J., Choat, B., Parkinson, D. Y., MacDowell, A. A., Brodersen, C. R. Using high resolution computed tomography to visualize the three dimensional structure and function of plant vasculature. Journal of Visualized Experiments. (74), e50162 (2013).
- Cochard, H., Delzon, S., Badel, E. X-ray microtomography (micro-CT): A reference technology for high-resolution quantification of xylem embolism in trees. Plant, Cell and Environment. 38 (1), 201-206 (2015).
- Bastos, C. L., Tamaio, N., Angyalossy, V. Unravelling roots of lianas: A case study in Sapindaceae. Annals of Botany. 118 (4), 733-746 (2016).
- da Cunha Neto, I. L., et al. Diversity, distribution, development, and evolution of medullary bundles in Nyctaginaceae. American Journal of Botany. 107 (5), 707-725 (2020).
- Milien, M., Renault-Spilmont, A. S., Cookson, S. J., Sarrazin, A., Verdeil, J. L. Visualization of the 3D structure of the graft union of grapevine using X-ray tomography. Scientia Horticulturae. 144, 130-140 (2012).
- Paya, A. M., Silverberg, J. L., Padgett, J., Bauerle, T. L. X-ray computed tomography uncovers root-root interactions: Quantifying spatial relationships between interacting root systems in three dimensions. Frontiers in Plant Science. 6 (274), 54-65 (2015).
- Teixeira-Costa, L., Ceccantini, G. C. T. Aligning microtomography analysis with traditional anatomy for a 3D understanding of the host-parasite interface - Phoradendron spp. Case study. Frontiers in Plant Science. 7, 1340 (2016).
- Lusic, H., Grinstaff, M. W. X-ray-computed tomography contrast agents. Chemical Reviews. 113 (3), 1641-1666 (2013).
- Těšitel, J. Functional biology of parasitic plants: a review. Plant Ecology and Evolution. 149 (1), 5-20 (2016).
- Teixeira-Costa, L. A living bridge between two enemies: Haustorium structure and evolution across parasitic flowering plants. Revista Brasileira de Botanica. 44 (1), 165-178 (2021).
- Kuijt, J. . The Biology of Parasitic Flowering Plants. , (1969).
- Masumoto, N., et al. Three-dimensional reconstructions of haustoria in two parasitic plant species in the Orobanchaceae. Plant Physiology. 185 (4), 1429-1442 (2021).
- Calo, C. M., et al. A correlation analysis of Light Microscopy and X-ray MicroCT imaging methods applied to archaeological plant remains' morphological attributes visualization. Scientific Reports. 10 (1), 1-15 (2020).
- Brodersen, C. R., Roddy, A. B. New frontiers in the three-dimensional visualization of plant structure and function. American Journal of Botany. 103 (2), 184-188 (2016).
- Teixeira-Costa, L., Davis, C. C. Life history, diversity, and distribution in parasitic flowering plants. Plant Physiology. 187 (1), 32-51 (2021).
- Simpson, B. B. Krameriaceae. Flora Neotropica Monograph. 49, (1989).
- Ruzin, S. E. . Plant microtechnique and microscopy. , (1999).
- Nikolov, L. A., Tomlinson, P. B., Manickam, S., Endress, P. K., Kramer, E. M., Davis, C. C. Holoparasitic Rafflesiaceae possess the most reduced endophytes and yet give rise to the world's largest flowers. Annals of Botany. 114, 233-242 (2014).
- Thorogood, C. J., Teixeira-Costa, L., Ceccantini, G., Davis, C., Hiscock, S. J. Endoparasitic plants and fungi show evolutionary convergence across phylogenetic divisions. New Phytologist. 232 (3), 1159-1167 (2021).
- Largent, D., Johnson, D., Watling, R. . How to Identify Mushrooms to Genus III: Microscopic Features. , (1977).
- Busse, M., et al. Three-dimensional virtual histology enabled through cytoplasm-specific X-ray stain for microscopic and nanoscopic computed tomography. Proceedings of the National Academy of Sciences of the United States of America. 115 (10), 2293-2298 (2018).
- Sperry, J. S., Donnelly, J. R., Tyree, M. T. A method for measuring hydraulic conductivity and embolism in xylem. Plant, Cell and Environment. 11, 35-40 (1988).
- Calvin, C. L. Host-formed tyloses in vessels of the mistletoe Phoradendron (Viscaceae). IAWA Journal. 18 (2), 117-126 (1997).
- Teixeira-Costa, L., Ceccantini, G. Embolism increase and anatomical modifications caused by a parasitic plant. IAWA Journal. 36 (2), 138-151 (2015).
- Ellmore, G. S., Ewers, F. W. Fluid flow in the outermost xylem increment of a ring-porous tree, Ulmus americana. American Journal of Botany. 73 (12), 1771-1774 (1986).
- Ellis, E. A. Staining sectioned biological specimens for transmission electron microscopy: Conventional and En bloc stains. Electron Microscopy: Methods and Protocols. 1117, 57-72 (2014).
- Brodersen, C. R., McElrone, A. J., Choat, B., Matthews, M. A., Shackel, K. A. The dynamics of embolism repair in xylem: In vivo visualizations using high-resolution computed tomography. Plant Physiology. 154 (3), 1088-1095 (2010).
- Brodersen, C. R., et al. Automated analysis of three-dimensional xylem networks using high-resolution computed tomography. New Phytologist. 191 (4), 1168-1179 (2011).
- Lee, K., et al. Visualizing plant development and gene expression in three dimensions using optical projection tomography. Plant Cell. 18 (9), 2145-2156 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados