Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Tirer parti de la micro-tomodensitométrie pour analyser les interactions parasites-plantes et hôtes
Dans cet article
Résumé
La micro-tomodensitométrie est un outil non destructif qui permet d’analyser les structures végétales en trois dimensions. Le présent protocole décrit la préparation de l’échantillon pour tirer parti de la micro-CT afin d’analyser la structure et la fonction parasitaires des plantes. Différentes espèces sont utilisées pour mettre en évidence les avantages de cette méthode lorsqu’elle est associée à des préparations spécifiques.
Résumé
La micro-tomodensitométrie est devenue un outil établi dans l’étude de la structure et de la fonction des plantes. Sa nature non destructive, combinée à la possibilité d’une visualisation tridimensionnelle et d’une section virtuelle, a permis une analyse nouvelle et de plus en plus détaillée d’organes végétaux complexes. Les interactions entre les plantes, y compris entre les plantes parasites et leurs hôtes, peuvent également être explorées. Cependant, la préparation des échantillons avant le balayage devient cruciale en raison de l’interaction entre ces plantes, qui diffèrent souvent par l’organisation et la composition des tissus. De plus, la grande diversité des plantes à fleurs parasites, allant des corps végétatifs fortement réduits aux arbres, aux herbes et aux arbustes, doit être prise en compte lors de l’échantillonnage, du traitement et de la préparation du matériel hôte-parasite. Ici, deux approches différentes sont décrites pour introduire des solutions de contraste dans le parasite et / ou les plantes hôtes, en se concentrant sur l’analyse de l’haustorium. Cet organe favorise la connexion et la communication entre les deux plantes. En suivant une approche simple, les détails de l’organisation des tissus d’haustorium peuvent être explorés en trois dimensions, comme indiqué ici pour les espèces parasites euphytoïdes, vignes et gui. La sélection d’agents contrastés spécifiques et d’approches d’application permet également une observation détaillée de la propagation de l’endoparasite dans le corps de l’hôte et la détection d’une connexion directe de vaisseau à vaisseau entre le parasite et l’hôte, comme illustré ici pour un parasite racinaire obligatoire. Ainsi, le protocole discuté ici peut être appliqué à la grande diversité des plantes à fleurs parasites pour faire progresser la compréhension de leur développement, de leur structure et de leur fonctionnement.
Introduction
La microtomodensitométrie à rayons X à haute résolution (micro-TDM) est une méthode d’imagerie dans laquelle plusieurs radiographies (projections) d’un échantillon sont enregistrées sous différents angles de vue et utilisées plus tard pour fournir une reconstruction virtuelle de l’échantillon1. Cet objet virtuel peut ensuite être analysé, manipulé et segmenté, permettant une exploration non destructive en trois dimensions2. Initialement conçu pour les analyses médicales et plus tard pour les applications industrielles, le micro-CT offre également l’avantage de visualiser les organes et tissus internes sans nécessiter de procédures invasives3. Comme d’autres formes d’imagerie, la micro-tomodensitométrie fonctionne avec un compromis entre le champ de vision et la taille des pixels, ce qui signifie que l’imagerie haute résolution de grands échantillons est presque inaccessible4. Des progrès dans l’utilisation de sources de rayons X à haute énergie (c.-à-d. synchrotron) et d’un grossissement optique secondaire sont constamment réalisés, permettant à la plus petite résolution d’atteindre moins de 100 nm 5,6. Néanmoins, des temps de numérisation plus longs sont nécessaires pour les échantillons volumineux, ce qui augmente le risque d’artefacts en raison du mouvement ou de la déformation de l’échantillon à l’intérieur du scanner. De plus, la micro-TDM est généralement limitée par les variations naturelles de densité au sein de l’échantillon et par la façon dont l’échantillon interagit avec les rayons X. Bien qu’une dose de rayons X plus élevée soit préférable pour pénétrer dans des échantillons plus denses, elle est moins efficace pour capturer les variations de densité à l’intérieur et entre l’échantillon et son milieu environnant7. D’autre part, une dose de rayons X plus faible offre moins de puissance de pénétration et nécessite souvent des temps de balayage plus longs mais plus de sensibilité dans la détection de la densité7.
Ces restrictions ont longtemps entravé l’utilisation de la microtomographie pour les sciences végétales, étant donné que la plupart des tissus végétaux sont composés de tissus légers (non denses) à faible absorption des rayons X8. Les premières applications de la micro-CT ont été axées sur la cartographie des réseaux racinaires dans la matrice du sol 9,10. Plus tard, des structures végétales présentant des différences plus significatives dans la densité des tissus, telles que le bois, ont commencé à être explorées. Cela a permis d’étudier la fonctionnalité du xylème 11,12, le développement d’organisations tissulaires complexes13,14 et les interactions entre les plantes15,16,17. L’analyse des tissus mous et homogènes se généralise en raison des agents de contraste, qui sont maintenant une procédure standard dans les préparations pour le micro-balayage CT d’échantillons de plantes. Cependant, les protocoles d’introduction du contraste peuvent avoir des résultats différents selon le volume de l’échantillon, les propriétés structurelles et le type de solution utilisée8. Idéalement, l’agent de contraste devrait améliorer la distinction entre les différents tissus, permettre l’évaluation de la fonctionnalité des tissus et des organes et/ou fournir des informations biochimiques sur un tissu18. Par conséquent, un traitement, une préparation et un montage adéquats de l’échantillon avant la numérisation deviennent cruciaux pour toute analyse micro-CT.
Micro-CT de la plante parasite haustorium
Les plantes parasites à fleurs représentent un groupe fonctionnel distinct d’angiospermes caractérisés par un organe connu sous le nom de haustorium19. Cet organe multicellulaire, hybride développemental entre une tige modifiée et une racine, agit sur l’attachement, la pénétration et le contact de l’hôte par un parasite20. Pour cette raison, l’haustorium est considéré comme « incarnant l’idée même de parasitisme chez les plantes »21. Une compréhension détaillée du développement, de la structure et du fonctionnement de cet organe est cruciale pour les études sur l’écologie des plantes parasites, l’évolution et la gestion. Néanmoins, la complexité globale des plantes parasites et leur structure et haustoria fortement modifiées entravent souvent l’analyse détaillée et la comparaison. Les connexions haustorium sont également généralement étendues et non homogènes dans la distribution des tissus et des cellules (Figure 1). Dans ce contexte, bien que le travail avec de petits fragments de tissu permette une manipulation plus facile et une résolution plus élevée, il peut conduire à des conclusions erronées sur l’architecture tridimensionnelle de structures complexes, telles que la plante parasite haustorium.
Bien qu’il existe une vaste littérature sur l’anatomie et l’ultrastructure de l’haustorium pour la plupart des espèces végétales parasites, l’organisation tridimensionnelle et la relation spatiale entre le parasite et les tissus hôtes restent peu explorées17. Dans un travail récent de Masumoto et al.22, plus de 300 sections de microtomes semi-minces en série ont été imagées et reconstruites en un objet virtuel tridimensionnel représentant l’haustorium de deux espèces de parasites. L’excellent niveau de détail de cette méthode fournit des informations sans précédent sur la structure 3D cellulaire et anatomique de l’haustorium. Cependant, une technique aussi longue interdirait une analyse similaire chez les parasites ayant des connexions haustorium plus étendues. L’utilisation de la micro-CT apparaît comme un excellent outil pour l’analyse tridimensionnelle de haustoria complexes et souvent volumineuses de plantes parasites. Bien qu’ils ne remplacent pas le sectionnement anatomique détaillé et d’autres formes complémentaires d’analyses microscopiques17,23, les résultats obtenus par micro-tomodensitométrie, en particulier pour les grands échantillons, peuvent également servir de guide pour diriger le sous-échantillonnage de segments plus petits, qui peuvent ensuite être analysés à l’aide d’autres outils, tels que la microscopie confocale et électronique, ou réanalysés avec des systèmes de micro-tomodensitométrie à haute résolution.

Figure 1 : Plantes parasites de différents groupes fonctionnels utilisés dans ce protocole. Pyrularia pubera (A), endoparasite Viscum minimum (B) avec fruits verts (cercle noir pointillé), vigne parasite Cuscuta americana (C), gui Struthanthus martianus (D), parasite racinaire obligatoire Scybalium fungiforme (E). Les segments de la racine hôte (Hr) ou de la tige (Hs) facilitent l’application du contraste dans le parasite haustorium (P). La présence de racine/tige mère du parasite (flèches) dans l’échantillon permet d’analyser l’organisation des vaisseaux de l’haursorium. Les rectangles indiquent les segments de l’échantillon utilisé pour l’analyse. Barres d’échelle = 2 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Alors que la micro-TDM devient une technique de plus en plus populaire en sciences végétales, il existe des guides, des protocoles et de la littérature traitant de la numérisation d’échantillons, de la reconstruction tridimensionnelle, de la segmentation et de l’analyse 3,10,24. Ainsi, ces étapes ne seront pas discutées ici. Comme pour toute technique d’imagination, le traitement et le montage appropriés des échantillons sont fondamentaux, bien qu’il s’agisse souvent d’une procédure négligée. Pour cette raison, ce protocole se concentre sur la préparation d’échantillons d’haustorium pour la micro-tomodensitométrie. Plus précisément, ce protocole décrit deux approches pour introduire des agents de contraste dans les échantillons d’haustorium afin d’améliorer la visualisation de différents tissus et types de cellules dans l’haustorium, de faciliter la détection de tissu parasite dans la racine / tige hôte et d’analyser les connexions vasculaires parasite-hôte en trois dimensions. Les préparations décrites ici peuvent également être adaptées à l’analyse d’autres structures végétales.
Cinq espèces ont été utilisées pour mieux illustrer la commodité du protocole décrit ici. Chaque espèce représente l’un des cinq groupes fonctionnels de plantes à fleurs parasites, abordant ainsi des points spécifiques liés à la fonctionnalité de chaque groupe. Pyrularia pubera (Santalaceae) a été choisi pour représenter les parasites euphytoïdes, qui germent dans le sol et forment de multiples haustoria qui relient le parasite aux racines de ses hôtes25. Les haustoria créées par ces plantes sont souvent ténues et facilement arrachées de l’hôte26 (Figure 1A), nécessitant ainsi un processus de manipulation plus délicat. Les endoparasites sont représentés ici par Viscum minimum (Viscaceae). Les espèces de ce groupe fonctionnel ne sont visibles à l’extérieur du corps de leurs hôtes que pendant de courtes périodes (Figure 1B) et vivent la plupart de leurs cycles de vie sous forme de brins de cellules significativement réduits et de type mycélial incorporés dans les tissus hôtes25. Un troisième groupe fonctionnel comprend les vignes parasites, qui germent au sol mais ne forment que des racines rudimentaires, s’appuyant sur de multiples haustoria qui s’attachent aux tiges des plantes hôtes25 (Figure 1C). Ici, ce groupe fonctionnel est représenté par Cuscuta americana (Convolvulaceae). Contrairement aux vignes parasites, les guis germent directement sur les branches de leurs plantes hôtes et développent des haustoria multiples ou solitaires25. L’espèce choisie pour illustrer ce groupe fonctionnel est Struthanthus martianus (Loranthaceae), qui forme diverses connexions avec la branche hôte (Figure 1D). L’analyse de la haustoria de gui solitaire à l’aide d’une combinaison de micro-tomodensitométrie et de microscopie optique peut être trouvée dans Teixeira-Costa & Ceccantini17. Enfin, les parasites racinaires obligatoires comprennent les espèces qui germent sur le sol et pénètrent dans les racines des plantes hôtes, dont elles dépendent entièrement dès les premiers stades de croissance25. Ces plantes sont représentées ici par Scybalium fungiforme (Balanophoraceae), qui produit de grandes haustoria ressemblant à des tubercules (Figure 1E).
Tous les échantillons végétaux utilisés dans ce protocole ont été fixés dans un alcool d’acide acétique au formol à 70 % (FAA 70). La fixation lors de l’échantillonnage est cruciale pour la préservation des tissus végétaux, en particulier si des analyses anatomiques ultérieures sont nécessaires. Dans le cas de la plante parasite haustorium, la fixation est également essentielle, car cet organe est souvent principalement composé de cellules de parenchyme non lignifiées20. Des protocoles détaillés pour la fixation des tissus végétaux, y compris la préparation de solutions fixatrices, peuvent être trouvés ailleurs27. D’autre part, à un degré plus ou moins grand, les fixateurs peuvent provoquer des altérations des propriétés physiques et chimiques d’un échantillon, le rendant impropre à des analyses biomécaniques et histochimiques spécifiques. Ainsi, des échantillons frais, c’est-à-dire du matériel non fixé prélevé immédiatement avant la préparation, peuvent également être utilisés avec ce protocole. Des détails sur la façon de manipuler de nouveaux échantillons et des suggestions de dépannage pour le matériel fixe sont fournis dans la section de discussion.
Protocole
1. Sélection d’échantillons de plantes parasites
- Recueillir tout l’haustorium de la plante parasite, y compris la tige/racine de l’hôte attaché et les segments des extrémités proximales et distales de l’organe hôte parasité; La longueur idéale de chaque segment équivaut au double du diamètre de l’Haustorium.
REMARQUE : Pour les haustoria latérales, inclure une partie de la tige/racine mère du parasite à partir de laquelle l’haustorium a été formé (figure 1A, B, D). Pour les endoparasites, prélever un segment de la tige/racine de l’hôte dans lequel des signes du parasite sont visibles (figure 1B). Dans le cas des connexions terminales, l’ensemble de la plante doit être collecté (figure 1E). - Immerger l’échantillon entier dans une solution fixatrice (p. ex., FAA) dans une proportion volumétrique de 1:10 (échantillon : fixateur). Laisser les échantillons dans le fixateur pendant au moins 1 jour, selon la taille de l’échantillon27.
REMARQUE : Les échantillons peuvent être conservés dans un fixateur avant le balayage ou transférés dans une solution de conservation (p. ex. éthanol à 70 %). De nouveaux échantillons peuvent également être utilisés si l’analyse anatomique ultérieure n’est pas justifiée (voir la section Discussion). Si vous travaillez avec un matériau frais, configurez l’appareil de perfusion de la solution de contraste, puis prélevez l’échantillon. L’échantillon ne doit pas sécher.
2. Application de solutions contrastées
- Choisissez la méthode d’application à utiliser. Utiliser la méthode du vide (étape 2.3) pour les petits échantillons (figure 1A) ou non ligneux (figure 1B). Utiliser la méthode de perfusion pour les échantillons plus grands, à condition qu’elle comprenne un segment de la tige/racine hôte (Figure 1A,C-E).
- Porter des gants de caoutchouc et tout autre équipement de protection individuelle approprié (p. ex. sarrau de laboratoire) lors de la manipulation de l’échantillon, quelle que soit l’approche choisie aux étapes suivantes.
ATTENTION: Toutes les solutions contrastées contiennent des sels de métaux lourds dans leur composition et ne doivent donc pas être manipulées sans un équipement de protection individuelle adéquat et sous une hotte. - Pour la méthode du vide, suivez les étapes mentionnées ci-dessous.
- Choisissez un flacon approprié et étiquetez-le. Le flacon doit être suffisamment grand pour accueillir l’échantillon et la solution contrastante, généralement dans une proportion de 1:10. Vérifiez les instructions du fabricant pour vous assurer que le flacon peut résister à un vide faible à modéré.
REMARQUE: Ne remplissez pas le flacon à ras bord, car la pression négative (vide) peut provoquer le déversement du liquide. - Placer l’échantillon dans le flacon avec la solution contrastante (1 % d’iode ou 3 % de phosphotungstate, voir le tableau des matières). Placez ensuite le flacon dans une chambre à vide ou un dessiccateur relié à une pompe à vide. Retirez le couvercle du flacon, puis fermez la chambre à vide ou le dessiccateur.
- Vérifiez qu’il n’y a pas de fissures sur la chambre à vide/dessiccateur et que la pompe à vide contient suffisamment d’huile.
- Fermez la soupape d’échappement de la pompe pour empêcher l’air de s’accumuler et ouvrez la soupape d’échappement de la chambre/dessiccateur pour forcer l’air à sortir.
- Allumez la pompe et attendez que la pression atteigne environ 20 pouces Hg.
ATTENTION: Ce processus est généralement rapide, alors ne laissez pas le système de vide sans surveillance.
REMARQUE: Alors que l’unité du système métrique pour la pression est Pascal (Pa), les manomètres de la plupart des pompes à vide de laboratoire affichent la pression en pouces de mercure (« Hg), livre par pouce carré (psi) ou bars. 20 » Hg équivaut à environ 67,7 Pa, 10 psi ou 0,7 bar. - Fermez la soupape d’échappement de la chambre ou du dessiccateur pour empêcher l’air de rentrer, puis éteignez rapidement la pompe.
- Laisser l’échantillon sous vide pendant au moins 2 h; Les échantillons plus grands nécessitent plus de temps pour que la solution contrastante puisse y pénétrer.
- Après la période souhaitée, retirez l’échantillon de la solution contrastante pour le préparer à la numérisation.
- Ouvrez lentement la soupape d’évacuation de la chambre ou du dessiccateur pour permettre à l’air d’y pénétrer.
- Attendez que la pression dans la chambre/le dessiccateur soit complètement épuisée (c.-à-d. que le manomètre atteint près de 0), puis ouvrez-le soigneusement pour récupérer l’échantillon.
- Jeter la solution contrastante de manière appropriée et conserver l’échantillon en vue de la numérisation.
- Choisissez un flacon approprié et étiquetez-le. Le flacon doit être suffisamment grand pour accueillir l’échantillon et la solution contrastante, généralement dans une proportion de 1:10. Vérifiez les instructions du fabricant pour vous assurer que le flacon peut résister à un vide faible à modéré.
- Pour la méthode de perfusion, suivez les étapes mentionnées ci-dessous.
- Sélectionnez un réservoir d’alimentation pour la solution contrastante en fonction de la taille de l’échantillon. Utiliser une seringue de 50 ml (sans aiguille ni piston) pour les petits échantillons (figure 2A) ou une trousse médicale intraveineuse de 1 l pour les gros échantillons (figure 2B).
- Connectez une extrémité d’un tube en plastique transparent (voir le tableau des matériaux) au réservoir d’alimentation, puis connectez l’autre extrémité à une vanne bidirectionnelle ou tridirectionnelle. Raccordez un deuxième tuyau à une autre sortie de la vanne (Figure 2A,B).
- Fixez le réservoir d’alimentation en position élevée sans démonter l’appareil installé à l’étape précédente.
NOTE: La distance verticale entre le réservoir et l’échantillon dictera la pression de perfusion de la solution (Figure 2B). Une distance de 20 à 50 cm est suffisante pour les petits échantillons. Pour les grands échantillons, une distance de 1 m est plus adéquate. - Fermez la vanne à trois voies (figure 2C) ou bidirectionnelle (figure 2D) pour empêcher le liquide de sortir du système de tuyauterie, puis versez la solution contrastante dans le réservoir d’alimentation. Si vous utilisez une trousse médicale intraveineuse, remplissez le sac avec la solution et fermez la valve avant de fixer l’appareil à une position élevée.
- S’assurer qu’aucune grosse bulle d’air ne se forme le long du système de tubes (figure 2E). Si nécessaire, laissez la solution de contraste s’écouler hors du tube jusqu’à ce que la bulle soit retirée. Fermez à nouveau la vanne et laissez l’appareil en place.
- Pour préparer l’échantillon à la perfusion de la solution de contraste, maintenez-le immergé dans un liquide (eau, éthanol ou fixateur) et coupez l’extrémité de l’extrémité proximale de la tige/racine de l’hôte dans l’échantillon (Figure 2F).
- Retirez l’échantillon du liquide dans lequel il a été stocké et enveloppez-le dans un film de paraffine pour éviter la dessiccation. Gardez l’échantillon à proximité et prêt à être connecté à l’appareil.
- Ouvrez soigneusement la vanne pour permettre à la solution contrastante de s’écouler lentement et remplissez le tube en plastique connecté au réservoir tout en maintenant l’extrémité ouverte du système dans une position légèrement surélevée pour empêcher la solution contrastante de se renverser. Encore une fois, assurez-vous qu’aucune grosse bulle d’air ne se forme le long du tube.
- Relier l’extrémité proximale de la tige/racine hôte de l’échantillon à l’extrémité ouverte du système de tubes (figure 2B, région agrandie). Évitez d’introduire des bulles d’air dans le système au cours de cette étape. Si nécessaire, débranchez l’échantillon de l’appareil et éliminez les bulles d’air du système en laissant la solution s’écouler.
- Tout en gardant l’échantillon connecté à l’appareil, placez-le à l’intérieur d’un récipient pour éviter les fuites de la solution contrastante dans la zone où l’expérience a été mise en place. Utiliser des tubes de différents diamètres, des attaches à glissière en plastique et des adaptateurs de vannes (figure 2G) pour s’assurer que tous les raccords de l’appareil sont bien ajustés, qu’ils s’adaptent aux branches hôtes de différentes tailles et que la solution ne fuit pas du système de tubes (figure 2B, région agrandie).
- Laisser la solution perfuser l’échantillon pendant au moins 2 h ou jusqu’à ce que la solution s’accumule à l’intérieur du récipient.
- Fermez la vanne et débranchez délicatement l’échantillon de l’appareil. Égoutter le reste de la solution dans le récipient et l’éliminer de manière appropriée.
- Retirez le film de paraffine de l’échantillon en vue de la numérisation.
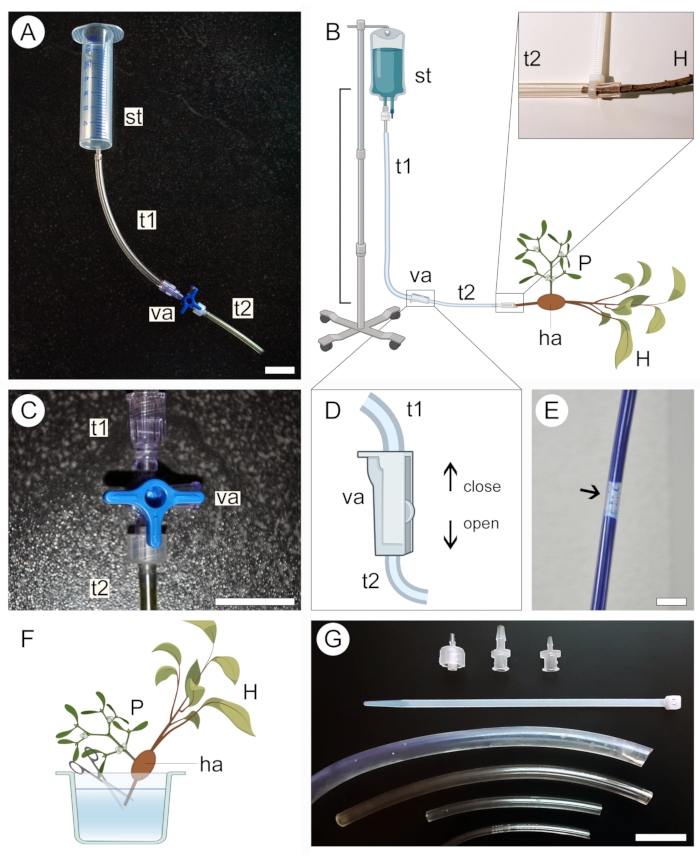
Figure 2 : Approche de perfusion pour l’application de contraste. Les versions petites (A) et grandes (B) de l’appareil de perfusion comprennent un réservoir d’alimentation (st) et deux tubes en plastique (t1 et t2) reliés par une vanne (va). L’extrémité proximale de la tige hôte (H) portant un parasite (P) qui lui est attaché via l’haustorium (ha) est reliée à l’extrémité ouverte du système (B, élargie). Une vanne à trois voies (C) ou bidirectionnelle (D) est utilisée pour aider à prévenir la formation de bulles d’air à l’intérieur du système de tuyauterie, qui bloquent le passage de la solution contrastante (E). L’extrémité de l’extrémité proximale de la tige hôte (H) est coupée sous l’eau pour permettre le passage de la solution de contraste (F). Les attaches à glissière, les adaptateurs de vannes et les tubes de différents diamètres aident à sécuriser les connexions plus serrées et à éviter les fuites dans le système (G). Les figures 2B, D et F ont été créées avec BioRender. Barres d’échelle = 2 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Préparation et montage des échantillons
- Lavez l’échantillon en le plongeant dans l’eau pendant 2 min.
ATTENTION : Ne pas laver les échantillons dans l’évier, car toutes les solutions contrastantes contiennent des sels de métaux lourds dans leur composition. Considérez l’eau utilisée pour le lavage comme une solution contrastante diluée et éliminez-la de manière appropriée. - Placez l’échantillon dans une serviette en papier à température ambiante pour permettre à l’excès d’eau de s’évaporer pendant 2 à 5 minutes selon la taille de l’échantillon. Sinon, séchez légèrement l’échantillon à l’aide d’une serviette en papier. Ne laissez pas l’échantillon sécher complètement.
- Enveloppez l’échantillon dans un film de paraffine en l’étirant en une fine couche. Évitez de plier le film de paraffine sur l’échantillon.
- Montez l’échantillon enveloppé sur un porte-échantillon, en le maintenant stable et en position pendant qu’il tourne pendant la numérisation. Utilisez du ruban adhésif, de la mousse basse densité, des embouts de pipette et/ou des contenants en plastique transparent pour fixer l’échantillon en place.
- Numériser l’échantillon et analyser les images en suivant les protocoles et directives spécifiques établis pour le système micro-CT disponible.
Résultats
L’haustorium des plantes parasites est un organe complexe comprenant différents tissus et types de cellules qui s’entrelacent et se connectent avec les tissus d’une autre plante, utilisée comme hôte20. Le micro-scanner peut être utilisé pour mieux comprendre cette structure complexe de manière non destructive et tridimensionnelle lors de l’analyse à la fois de petites (Figure 1A-C) et de grandes (Figure 1D,E
Discussion
L’utilisation de solutions de métaux lourds pour améliorer le contraste des tissus végétaux est devenue une étape cruciale dans la préparation des échantillons pour l’analyse micro-CT. Plusieurs composés couramment disponibles dans les laboratoires de micromorphologie végétale ont été testés par Staedler et al., qui recommandent d’utiliser le phosphotungstate comme agent le plus efficace pour pénétrer les échantillons et augmenter l’indicede contraste 8. Les résultats obte...
Déclarations de divulgation
L’auteur n’a rien à divulguer.
Remerciements
Je tiens à remercier le Dr Simone Gomes Ferreira (Laboratoire de microtomographie, Université de Sao Paulo, Brésil) et le Dr Greg Lin (Center for Nanoscale Systems, Université Harvard, États-Unis) pour leur aide primordiale et leur formation indispensable aux différents systèmes de microtomographie et logiciels d’analyse de données. Je remercie également le personnel de la serre EEB de l’Université du Connecticut (États-Unis), en particulier Clinton Morse et Matthew Opel pour avoir fourni les spécimens de Viscum minimum. Le Dr John Wenzel a fourni l’opportunité et une grande aide pour l’échantillonnage de Pyrularia pubera. MSc. Carolina Bastos, MSc. Yasmin Hirao et Talitha Motta ont grandement aidé à l’échantillonnage de Scybalium fungiforme. Mme Ariadne Furtado et les Dres Fernanda Oliveira et Maria Aline Neves ont fourni la référence pour l’utilisation de la phloxine B pour l’analyse des champignons endophytes. L’enregistrement vidéo à la Vrije Universiteit Brussel a été rendu possible grâce à l’aide du Dr Philippe Claeys, du Dr Christophe Snoeck, du MSc. Jake Griffith, du Dr Barabara Veselka et du Dr Harry Olde Venterink. Le financement a été fourni par la Coordination pour l’amélioration du personnel de l’enseignement supérieur (CAPES, Brésil) et les herbiers de l’Université Harvard (États-Unis).
matériels
| Name | Company | Catalog Number | Comments |
| 3D X-ray microscope (XRM) system | Zeiss Versa 620 | used to scan Pyrularia pubera | |
| 3D X-ray microscope + A2:D22 | Zeiss | Versa 620 | Used for scanning the species P. pubera |
| CT-Pro 3D software | Nikon | version XT 3.1.11 | Used for three-dimensional reconstruction of scans |
| CT-Vox software | Bruker | version 3.3.1 | Used for analyses and acquisition of images and videos |
| Dragonfly software | Object Research Systems - ORS | version | Used for analyses and acquisition of images and videos |
| Glass vials | Glass Vials Inc. SE | V2708C-FM-SP | Sold by VWR - USA; make sure that vials are able to withstand vacuum at ca. 10 psi |
| Inspect-X | Zeiss | version XT 3.1.11 | Used for controlling the Nikon X-Tek HMXST225 system |
| Iodine solution 0.0282 N | WR Chemicals BDH | BDH7422-1 | Sold by VWR - USA |
| Lead Nitrate II PA 500 g | Vetec | 361.08 | Sold by SPLab |
| Microtomography scanner | Bruker | Skyscan1176 | Used for scanning the species C. americana, S. martianus, and S. fungiforme |
| Microtomography scanner | Nikon | X-Tek HMXST225 | Used for scanning the species V. minimum |
| NRecon software | Bruker | version 1.0.0 | Used for three-dimensional reconstruction |
| Phosphotungstic acid hydrate 3% in aqueous solution | Electron Microscopy Sciences | 101410-756 | Sold by VWR - USA |
| Plastic film (Parafilm) | Heathrow Scientific | PM996 | Sold by VWR - USA |
| Plastic IV bag 500 mL | Taylor | 3478 | Sold by Fibra Cirurgica Produtos para Saude |
| PVC tubing 3/4'' | Nalge Nunc International | SC63013-164 | Sold by VWR - USA |
| Scanning system | Nikon X-Tek HMXST225 | used to scan Viscum minimum | |
| Scanning system | Bruker Skyscan 1176 | used to scan C. americana | |
| Scout-and-ScanTM software | Zeiss | version 16 | Used for controlling the Zeiss Versa 620 system and for three-dimensional reconstruction of scans |
| Three-way valve | ToToT | DMTWVS-5 | Sold by Amazon USA |
| Two-part syringe | HSW Henke-Ject | 4850001000 | Used without the plunger |
| Vacuum chamber | Binder | 80080-434 | Sold by VWR - USA; includes pump and connecting tubes |
| VG Studio Max software | Volume Graphics | version 3.0 | Used for analyses and acquisition of images and videos |
Références
- Stock, S. R. . Microcomputed tomography: Methodology and applications. , (2020).
- Hounsfield, G. N. Computerized transverse axial scanning (tomography): I. Description of system. British Journal of Radiology. 46 (552), 1016-1022 (1973).
- Dutilleul, P., Lafond, J. A. Editorial: Branching and rooting out with a CT Scanner: The why, the how, and the outcomes, present and possibly future pierre. Frontiers in Plant Science. 7 (41), 5-6 (2016).
- Metscher, B. D. Biological applications of X-ray microtomography: Imaging micro- anatomy, molecular expression and organismal diversity. Microscopy and Analysis. 27 (2), 13-16 (2013).
- Sakdinawat, A., Attwood, D. Nanoscale X-ray imaging. Nature Photonics. 4 (12), 840-848 (2010).
- Walton, L. A., et al. Morphological characterisation of unstained and intact tissue micro-architecture by X-ray computed micro- and nano-tomography. Scientific Reports. 5, 1-14 (2015).
- Lafond, J. A., Han, L., Dutilleul, P. Concepts and analyses in the ct scanning of root systems and leaf canopies: A timely summary. Frontiers in Plant Science. 6 (1111), 85-91 (2015).
- Staedler, Y. M., Masson, D., Schönenberger, J. Plant tissues in 3D via X-Ray Tomography: Simple contrasting methods allow high resolution imaging. PLoS ONE. 8 (9), 75295 (2013).
- Heeraman, D. A., Hopmans, J. W., Clausnitzer, V. Three dimensional imaging of plant roots in situ with X-ray Computed Tomography. Plant and Soil. 189, 167-179 (1997).
- Dhondt, S., Vanhaeren, H., Van Loo, D., Cnudde, V., Inzé, D. Plant structure visualization by high-resolution X-ray computed tomography. Trends in Plant Science. 15 (8), 419-422 (2010).
- McElrone, A. J., Choat, B., Parkinson, D. Y., MacDowell, A. A., Brodersen, C. R. Using high resolution computed tomography to visualize the three dimensional structure and function of plant vasculature. Journal of Visualized Experiments. (74), e50162 (2013).
- Cochard, H., Delzon, S., Badel, E. X-ray microtomography (micro-CT): A reference technology for high-resolution quantification of xylem embolism in trees. Plant, Cell and Environment. 38 (1), 201-206 (2015).
- Bastos, C. L., Tamaio, N., Angyalossy, V. Unravelling roots of lianas: A case study in Sapindaceae. Annals of Botany. 118 (4), 733-746 (2016).
- da Cunha Neto, I. L., et al. Diversity, distribution, development, and evolution of medullary bundles in Nyctaginaceae. American Journal of Botany. 107 (5), 707-725 (2020).
- Milien, M., Renault-Spilmont, A. S., Cookson, S. J., Sarrazin, A., Verdeil, J. L. Visualization of the 3D structure of the graft union of grapevine using X-ray tomography. Scientia Horticulturae. 144, 130-140 (2012).
- Paya, A. M., Silverberg, J. L., Padgett, J., Bauerle, T. L. X-ray computed tomography uncovers root-root interactions: Quantifying spatial relationships between interacting root systems in three dimensions. Frontiers in Plant Science. 6 (274), 54-65 (2015).
- Teixeira-Costa, L., Ceccantini, G. C. T. Aligning microtomography analysis with traditional anatomy for a 3D understanding of the host-parasite interface - Phoradendron spp. Case study. Frontiers in Plant Science. 7, 1340 (2016).
- Lusic, H., Grinstaff, M. W. X-ray-computed tomography contrast agents. Chemical Reviews. 113 (3), 1641-1666 (2013).
- Těšitel, J. Functional biology of parasitic plants: a review. Plant Ecology and Evolution. 149 (1), 5-20 (2016).
- Teixeira-Costa, L. A living bridge between two enemies: Haustorium structure and evolution across parasitic flowering plants. Revista Brasileira de Botanica. 44 (1), 165-178 (2021).
- Kuijt, J. . The Biology of Parasitic Flowering Plants. , (1969).
- Masumoto, N., et al. Three-dimensional reconstructions of haustoria in two parasitic plant species in the Orobanchaceae. Plant Physiology. 185 (4), 1429-1442 (2021).
- Calo, C. M., et al. A correlation analysis of Light Microscopy and X-ray MicroCT imaging methods applied to archaeological plant remains' morphological attributes visualization. Scientific Reports. 10 (1), 1-15 (2020).
- Brodersen, C. R., Roddy, A. B. New frontiers in the three-dimensional visualization of plant structure and function. American Journal of Botany. 103 (2), 184-188 (2016).
- Teixeira-Costa, L., Davis, C. C. Life history, diversity, and distribution in parasitic flowering plants. Plant Physiology. 187 (1), 32-51 (2021).
- Simpson, B. B. Krameriaceae. Flora Neotropica Monograph. 49, (1989).
- Ruzin, S. E. . Plant microtechnique and microscopy. , (1999).
- Nikolov, L. A., Tomlinson, P. B., Manickam, S., Endress, P. K., Kramer, E. M., Davis, C. C. Holoparasitic Rafflesiaceae possess the most reduced endophytes and yet give rise to the world's largest flowers. Annals of Botany. 114, 233-242 (2014).
- Thorogood, C. J., Teixeira-Costa, L., Ceccantini, G., Davis, C., Hiscock, S. J. Endoparasitic plants and fungi show evolutionary convergence across phylogenetic divisions. New Phytologist. 232 (3), 1159-1167 (2021).
- Largent, D., Johnson, D., Watling, R. . How to Identify Mushrooms to Genus III: Microscopic Features. , (1977).
- Busse, M., et al. Three-dimensional virtual histology enabled through cytoplasm-specific X-ray stain for microscopic and nanoscopic computed tomography. Proceedings of the National Academy of Sciences of the United States of America. 115 (10), 2293-2298 (2018).
- Sperry, J. S., Donnelly, J. R., Tyree, M. T. A method for measuring hydraulic conductivity and embolism in xylem. Plant, Cell and Environment. 11, 35-40 (1988).
- Calvin, C. L. Host-formed tyloses in vessels of the mistletoe Phoradendron (Viscaceae). IAWA Journal. 18 (2), 117-126 (1997).
- Teixeira-Costa, L., Ceccantini, G. Embolism increase and anatomical modifications caused by a parasitic plant. IAWA Journal. 36 (2), 138-151 (2015).
- Ellmore, G. S., Ewers, F. W. Fluid flow in the outermost xylem increment of a ring-porous tree, Ulmus americana. American Journal of Botany. 73 (12), 1771-1774 (1986).
- Ellis, E. A. Staining sectioned biological specimens for transmission electron microscopy: Conventional and En bloc stains. Electron Microscopy: Methods and Protocols. 1117, 57-72 (2014).
- Brodersen, C. R., McElrone, A. J., Choat, B., Matthews, M. A., Shackel, K. A. The dynamics of embolism repair in xylem: In vivo visualizations using high-resolution computed tomography. Plant Physiology. 154 (3), 1088-1095 (2010).
- Brodersen, C. R., et al. Automated analysis of three-dimensional xylem networks using high-resolution computed tomography. New Phytologist. 191 (4), 1168-1179 (2011).
- Lee, K., et al. Visualizing plant development and gene expression in three dimensions using optical projection tomography. Plant Cell. 18 (9), 2145-2156 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon