A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מינוף סריקת מיקרו-CT לניתוח אינטראקציות טפיליות בין צמח למארח
In This Article
Summary
Micro-CT הוא כלי לא הרסני שיכול לנתח מבנים צמחיים בתלת מימד. הפרוטוקול הנוכחי מתאר את הכנת הדגימה כדי למנף מיקרו-CT לניתוח מבנה ותפקוד צמחים טפיליים. מינים שונים משמשים כדי להדגיש את היתרונות של שיטה זו בשילוב עם תכשירים ספציפיים.
Abstract
סריקת מיקרו-CT הפכה לכלי מבוסס בחקירת מבנה ותפקוד הצמח. טבעו הלא הרסני, בשילוב עם האפשרות של הדמיה תלת מימדית וחתך וירטואלי, איפשר ניתוח חדשני ומפורט יותר ויותר של איברי צמח מורכבים. ניתן לחקור גם אינטראקציות בין צמחים, כולל בין צמחים טפיליים לפונדקאים שלהם. עם זאת, הכנת הדגימה לפני הסריקה הופכת להיות קריטית בשל האינטראקציה בין צמחים אלה, אשר לעתים קרובות שונים בארגון הרקמה ובהרכבה. יתר על כן, יש לקחת בחשבון את המגוון הרחב של צמחים פורחים טפיליים, החל מגופי צומח מצומצמים מאוד ועד עצים, עשבי תיבול ושיחים, במהלך הדגימה, הטיפול וההכנה של חומר פונדקאי טפיל. כאן מתוארות שתי גישות שונות להחדרת תמיסות ניגוד לטפיל ו/או לצמחים פונדקאים, תוך התמקדות בניתוח האוסטוריום. איבר זה מקדם חיבור ותקשורת בין שני הצמחים. בעקבות גישה פשוטה, ניתן לחקור פרטים על ארגון רקמת האוסטוריום באופן תלת-ממדי, כפי שמוצג כאן עבור מינים טפיליים של אופיטואידים, גפנים ודבקונים. בחירת חומרי ניגוד ספציפיים וגישות יישום מאפשרות גם תצפית מפורטת על התפשטות אנדופרזיט בגוף הפונדקאי ואיתור קשר ישיר בין כלי דם לכלי דם בין טפיל לפונדקאי, כפי שמוצג כאן עבור טפיל שורש מחייב. לפיכך, ניתן ליישם את הפרוטוקול הנדון כאן על המגוון הרחב של צמחים פורחים טפיליים כדי לקדם את הבנת התפתחותם, מבנהם ותפקודם.
Introduction
טומוגרפיה מיקרו-ממוחשבת של קרני רנטגן ברזולוציה גבוהה (micro-CT) היא שיטת הדמיה שבה צילומי רנטגן מרובים (הקרנות) של דגימה נרשמים מזוויות צפייה שונות ומשמשים מאוחר יותר כדי לספק שחזור וירטואלי של המדגם1. לאחר מכן ניתן לנתח, לתפעל ולפלח אובייקט וירטואלי זה, המאפשר חקירה לא הרסנית בשלושה ממדים2. מיקרו-CT, שתוכנן בתחילה עבור ניתוחים רפואיים ומאוחר יותר עבור יישומים תעשייתיים, מציע גם את היתרון של הדמיה של איברים פנימיים ורקמות ללא צורך בהליכים פולשניים3. כמו צורות אחרות של הדמיה, מיקרו-CT עובד עם פשרה בין שדה הראייה לגודל הפיקסל, מה שאומר שהדמיה ברזולוציה גבוהה של דגימות גדולות היא כמעט בלתי מושגת4. התקדמות בשימוש במקורות רנטגן עתירי אנרגיה (כלומר, סינכרוטרון) והגדלה אופטית משנית נעשים כל הזמן, ומאפשרים לרזולוציה הקטנה ביותר להגיע מתחת ל -100 ננומטר 5,6. עם זאת, זמני סריקה ארוכים יותר נחוצים עבור דגימות גדולות, מה שמגדיל את הסיכוי לממצאים עקב תנועת הדגימה או עיוות בתוך הסורק. יתר על כן, מיקרו-CT מוגבל בדרך כלל על ידי שינויים בצפיפות הטבעית בתוך הדגימה וכיצד הדגימה מתקשרת עם קרני רנטגן. בעוד שמינון גבוה יותר של קרני רנטגן הוא הטוב ביותר לחדירה לדגימות צפופות יותר, הוא פחות יעיל בלכידת שינויים בצפיפות בתוך ובין הדגימה לבין המדיום הסובב אותה7. מצד שני, מינון רנטגן נמוך יותר מציע פחות כוח חדירה ולעתים קרובות דורש זמני סריקה ארוכים יותר אך רגישות רבה יותר בזיהוי צפיפות7.
הגבלות אלה הקשו זה מכבר על השימוש במיקרוטומוגרפיה למדעי הצמח, בהתחשב בכך שרוב רקמות הצמח מורכבות מרקמה קלה (לא צפופה) עם ספיגת רנטגן נמוכה8. היישומים הראשונים של מיקרו-CT התמקדו במיפוי רשתות שורשים בתוך מטריצת הקרקע 9,10. מאוחר יותר, מבנים צמחיים עם הבדלים משמעותיים יותר בצפיפות הרקמות, כגון עץ, החלו להיחקר. זה איפשר חקירות של פונקציונליות xylem11,12, פיתוח של ארגוני רקמות מורכבים 13,14, ואינטראקציות בין צמחים15,16,17. ניתוח רקמות רכות והומוגניות הופך נפוץ בשל חומרי ניגוד, שהם כיום הליך סטנדרטי בהכנות לסריקת מיקרו-CT של דגימות צמחים. עם זאת, פרוטוקולים להצגת ניגודיות יכולים לקבל תוצאות שונות בהתאם לנפח הדגימה, המאפיינים המבניים וסוג התמיסה שבה נעשה שימוש8. באופן אידיאלי, חומר הניגוד צריך לשפר את ההבחנה בין רקמות שונות, לאפשר הערכת פונקציונליות רקמות/איברים, ו / או לספק מידע ביוכימי על רקמה18. לכן, טיפול מדגימה נאות, הכנה והרכבה לפני הסריקה הופכים קריטיים לכל ניתוח מיקרו-CT.
מיקרו-CT של הצמח הטפילי haustorium
צמחים פורחים טפיליים מייצגים קבוצה פונקציונלית מובחנת של אנגיוספרמים המאופיינת על ידי איבר המכונה haustorium19. איבר רב-תאי זה, הכלאה התפתחותית בין גבעול שעבר שינוי לבין שורש, פועל על התקשרות, חדירה ומגע של הפונדקאי על ידי טפיל20. מסיבה זו, האוסטוריום נחשב כ"מגלם את עצם הרעיון של טפילות בקרב צמחים"21. הבנה מפורטת של התפתחותו, מבנהו ותפקודו של איבר זה חיונית לאקולוגיה של צמחים טפיליים, אבולוציה ומחקרי ניהול. אף על פי כן, המורכבות הכוללת של צמחים טפיליים והמבנה והאוסטוריה המשופרים מעכבים לעתים קרובות ניתוח מפורט והשוואה. קשרי האוסטוריום הם גם בדרך כלל נרחבים ואינם הומוגניים בהתפלגות הרקמות והתאים (איור 1). בהקשר זה, בעוד שעבודה עם שברי רקמות קטנות מאפשרת מניפולציה קלה יותר ורזולוציה גבוהה יותר, היא עלולה להוביל למסקנות שגויות לגבי הארכיטקטורה התלת-ממדית של מבנים מורכבים, כגון האוסטוריום הצמחי הטפילי.
אף על פי שקיימת ספרות ענפה על אנטומיה של האוסטרויום ומבנה העל עבור רוב מיני הצמחים הטפיליים, הארגון התלת-ממדי והקשר המרחבי בין טפיל לרקמות פונדקאי עדיין נחקרים בצורה גרועה17. בעבודה שנערכה לאחרונה על ידי Masumoto et al.22, יותר מ-300 קטעי מיקרוטום סדרתיים דקים למחצה צולמו ושוחזרו לאובייקט וירטואלי תלת-ממדי המייצג את האוסטוריום של שני מיני טפילים. רמת הפירוט המצוינת של שיטה זו מספקת תובנות חסרות תקדים על המבנה התלת-ממדי התאי והאנטומי של האוסטויום. עם זאת, טכניקה כזו הגוזלת זמן רב תאסור ניתוח דומה בטפילים עם קשרים נרחבים יותר של האוסטוריום. השימוש במיקרו-CT מתגלה ככלי מצוין לניתוח תלת-ממדי של צמחים טפיליים מורכבים ולעתים קרובות מגושמים. למרות שאינו מהווה תחליף לחתכים אנטומיים מפורטים וצורות משלימות אחרות של ניתוח מיקרוסקופיה17,23, תוצאות המתקבלות באמצעות סריקת מיקרו-CT, במיוחד עבור דגימות גדולות, יכולות לשמש גם כמדריך לכוון את תת-הדגימה של מקטעים קטנים יותר, אשר לאחר מכן ניתן לנתח באמצעות כלים אחרים, כגון מיקרוסקופ קונפוקלי ואלקטרונים, או לנתח מחדש עם מערכות מיקרו-CT ברזולוציה גבוהה.

איור 1: צמחים טפיליים מקבוצות פונקציונליות שונות שמשתמשים בהם בפרוטוקול הזה. טפיל Euphytoid Pyrularia pubera (A), endoparasite Viscum minimum (B) עם פירות ירוקים (עיגול שחור מקווקו), גפן טפילית Cuscuta americana (C), דבקון Struthanthus martianus (D), טפיל שורש מחייב Scybalium fungiforme (E). מקטעים של שורש הפונדקאי (Hr) או הגבעול (Hs) מאפשרים את יישום הניגוד לתוך הטפיל haustorium (P). הימצאות שורש אם/גבעול הטפיל (חיצים) בדגימה מאפשרת ניתוח של ארגון כלי האוסטוריום. מלבנים מציינים מקטעים של המדגם המשמשים לניתוח. פסי קנה מידה = 2 ס"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
ככל שמיקרו-CT הופך לטכניקה פופולרית יותר ויותר במדעי הצמח, ישנם מדריכים, פרוטוקולים וספרות העוסקים בסריקת דגימות, שחזור תלת מימדי, סגמנטציה וניתוח 3,10,24. לפיכך, צעדים אלה לא יידונו כאן. כמו בכל טכניקת דמיון, טיפול מתאים והרכבה של דגימות הם בסיסיים, אם כי לעתים קרובות להיות הליך התעלמות. מסיבה זו, פרוטוקול זה מתמקד בהכנת דגימות haustorium עבור סריקת micro-CT. באופן ספציפי יותר, פרוטוקול זה מתאר שתי גישות להחדרת חומרי ניגוד לדגימות האוסטוריום כדי לשפר את ההדמיה של רקמות וסוגי תאים שונים בהאוסטוריום, להקל על זיהוי רקמות טפיליות בתוך השורש/גזע הפונדקאי, ולנתח קשרי כלי דם בין טפיל למארח בשלושה ממדים. ההכנות המתוארות כאן יכולות להיות מותאמות גם לניתוח של מבני צמחים אחרים.
חמישה מינים שימשו כדי להמחיש טוב יותר את הנוחות של הפרוטוקול המתואר כאן. כל מין מייצג אחת מחמש הקבוצות הפונקציונליות של צמחים פורחים טפיליים, ובכך מתייחס לנקודות ספציפיות הקשורות לפונקציונליות של כל קבוצה. Pyrularia pubera (Santalaceae) נבחר לייצג טפילים אופיטואידים, הנובטים באדמה ויוצרים מספר אוסטוריה המחברים את הטפיל לשורשי פונדקאיו25 . האוסטוריה שנוצרת על-ידי הצמחים האלה היא לעתים קרובות רופפת ונקרעת בקלות מהפונדקאי26 (איור 1A), ולכן דורשת תהליך טיפול עדין יותר. אנדופרזיטים מיוצגים כאן על ידי Viscum minimum (Viscaceae). מינים בקבוצה הפונקציונלית הזו נראים רק מחוץ לגוף המארחים שלהם לפרקי זמן קצרים (איור 1B), וחיים את רוב מחזורי החיים שלהם כגדילי תאים מופחתים ודמויי תפטיר שמוטבעים בתוך רקמות מארחות25. קבוצה פונקציונלית שלישית כוללת גפנים טפיליות, שנובטות על הקרקע אך יוצרות שורשים בסיסיים בלבד, תוך הסתמכות על הוסטוריה מרובה שמתחברת לגבעולים של צמחים פונדקאים25 (איור 1C). כאן, קבוצה פונקציונלית זו מיוצגת על ידי Cuscuta americana (Convolvulaceae). בניגוד לגפנים טפיליות, דבקונים נובטים ישירות על ענפי הצמחים המארחים שלהם ומפתחים אוסטוריה מרובה או בודדת25. המין שנבחר כדי להמחיש את הקבוצה הפונקציונלית הזו הוא Struthanthus martianus (Loranthaceae), אשר יוצר קשרים שונים עם הענף המארח (איור 1D). ניתוח של דבקון בודד באמצעות שילוב של מיקרו-CT ומיקרוסקופ אור ניתן למצוא ב Teixeira-Costa & Ceccantini17. לבסוף, טפילי שורש חייבים הם מינים הנובטים על הקרקע וחודרים לשורשי הצמחים המארחים, שבהם הם תלויים לחלוטין משלבי הצמיחה המוקדמים ביותר25 . הצמחים האלה מיוצגים כאן על-ידי פטריות סקיבליום (Balanophoraceae), שמייצרות אוסטוריה גדולה דמוית פקעת (איור 1E).
כל דגימות הצמחים ששימשו בפרוטוקול זה תוקנו באלכוהול של 70% חומצה אצטית פורמלית (FAA 70). הקיבוע בעת הדגימה חיוני לשימור רקמות הצמח, במיוחד אם יש צורך בניתוחים אנטומיים עוקבים. במקרה של האוסטורימה צמחית טפילית, קיבוע הוא גם חיוני, כמו איבר זה מורכב לעתים קרובות בעיקר של תאי parenchyma non-lignified20. פרוטוקולים מפורטים לקיבוע רקמות צמחים, כולל הכנת תמיסות קיבוע, ניתן למצוא במקום אחר27. מצד שני, במידה רבה יותר או פחות, קיבועים יכולים לגרום לשינויים בתכונות הפיזיקליות והכימיות של הדגימה, מה שהופך אותה ללא מתאימה לניתוחים ביומכניים והיסטוכימיים ספציפיים. לכן, דגימות טריות, כלומר, חומר לא קבוע שנאסף מיד לפני ההכנה, יכול לשמש גם עם פרוטוקול זה. פרטים על אופן הטיפול בדוגמאות טריות והצעות לפתרון בעיות עבור חומר מקובע מופיעים בסעיף הדיון.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. בחירת דגימת צמחים טפיליים
- אספו את כל האוסטוריום של הצמח הטפילי, כולל הגבעול/שורש הפונדקאי המצורף ומקטעים של שני הקצוות הפרוקסימליים והדיסטליים של האיבר המארח הטפילי; האורך האידיאלי של כל קטע שווה להכפיל את קוטר האוסטוריום.
הערה: עבור האוסטוריה לטרלית, כלול חלק מגבעול/שורש האם של הטפיל שממנו נוצר ההאוסטוריום (איור 1A,B,D). עבור אנדופרזיטים, אספו מקטע של הגבעול/שורש הפונדקאי שבו נראים סימנים של הטפיל (איור 1B). במקרה של חיבורי טרמינל, יש לאסוף את כל הצמח (איור 1E). - השקיעו את כל הדגימה בתמיסה מקבעת (לדוגמה, FAA) ביחס נפחי של 1:10 (מדגם: קיבוע). השאירו דגימות בקיבוע לפחות יום אחד, בהתאם לגודל המדגם27.
הערה: ניתן לאחסן דגימות בקיבוע לפני הסריקה או להעביר אותן לתמיסה משמרת (למשל, אתנול 70%). ניתן להשתמש בדגימות טריות גם אם הניתוח האנטומי הבא אינו מוצדק (ראה סעיף דיון). אם עובדים עם חומר טרי, להגדיר את המנגנון עבור זילוח של פתרון ניגודיות, ולאחר מכן לאסוף את המדגם. אין לתת לדגימה להתייבש.
2. יישום פתרונות מנוגדים
- בחר את שיטת היישום שבה יש להשתמש. השתמשו בשיטת ואקום (שלב 2.3) עבור דגימות קטנות (איור 1A) או לא עציות (איור 1B). השתמשו בשיטת הזילוח עבור דגימות גדולות יותר, בתנאי שהיא כוללת קטע של הגבעול/שורש המארח (איור 1A,C-E).
- יש ללבוש כפפות גומי וציוד הגנה אישי מתאים אחר (לדוגמה, מעיל מעבדה) בעת טיפול הדגימה, ללא קשר לגישה שנבחרה בשלבים הבאים.
זהירות: כל הפתרונות המנוגדים כוללים מלחי מתכת כבדים בהרכבם, ולכן אין לטפל בהם ללא ציוד הגנה אישי מתאים ומתחת למכסה מנוע. - עבור שיטת ואקום, בצע את השלבים המוזכרים להלן.
- בחרו בקבוקון מתאים ותייגו אותו. הבקבוקון חייב להיות גדול מספיק כדי להכיל את הדגימה ואת הפתרון הניגוד, בדרך כלל ביחס של 1:10. בדוק את הוראות היצרן כדי לוודא שהבקבוקון יכול לעמוד בוואקום נמוך עד בינוני.
הערה: אין למלא את הבקבוקון עד אפס מקום, מכיוון שהלחץ השלילי (ואקום) עלול לגרום לנוזל להישפך. - הניחו את הדגימה בבקבוקון עם התמיסה המנוגדת (1% יוד או 3% פוספוטונגסטט, ראו טבלת חומרים). לאחר מכן הניחו את הבקבוקון בתא ואקום או מייבש המחובר למשאבת ואקום. הסירו את המכסה מהבקבוקון וסגרו את תא הוואקום או את מייבש הכביסה.
- בדקו שאין סדקים בתא הוואקום/מייבש ושמשאבת הוואקום מכילה מספיק שמן.
- סגור את שסתום התשישות של המשאבה כדי למנוע הצטברות אוויר ופתח את שסתום התשישות של החדר/מייבש כדי לדחוף את האוויר החוצה.
- הפעל את המשאבה והמתן עד שהלחץ יגיע לכ-20 אינץ' כספית.
זהירות: תהליך זה הוא בדרך כלל מהיר, לכן אל תשאירו את מערכת הוואקום ללא השגחה.
הערה: בעוד שיחידת המערכת המטרית ללחץ היא פסקל (Pa), מדי לחץ ברוב משאבות ואקום המעבדה מציגים לחץ בסנטימטרים של כספית ("כספית"), פאונד לאינץ' מרובע (psi) או ברים. 20 אינץ' כספית שווה לערך 67.7 Pa, 10 psi או 0.7 bar. - סגור את שסתום הפליטה של התא/מייבש כדי למנוע כניסת אוויר מחדש, ולאחר מכן כבה במהירות את המשאבה.
- השאר את הדגימה תחת ואקום לפחות 2 שעות; דגימות גדולות יותר דורשות זמן רב יותר כדי שהפתרון המנוגד יחדור אליו.
- לאחר התקופה הרצויה, הסר את הדגימה מהפתרון המנוגד כדי להכין אותה לסריקה.
- פתחו באיטיות את שסתום התשישות של החדר/מייבש כדי לאפשר כניסת אוויר לתוכו.
- המתן עד שהלחץ בתא/מייבש ימוצה במלואו (כלומר, מד הלחץ מגיע קרוב ל-0), ואז פתח אותו בזהירות כדי לאחזר את הדגימה.
- השליכו את הפתרון המנוגד כראוי ושמרו את הדגימה לקראת הסריקה.
- בחרו בקבוקון מתאים ותייגו אותו. הבקבוקון חייב להיות גדול מספיק כדי להכיל את הדגימה ואת הפתרון הניגוד, בדרך כלל ביחס של 1:10. בדוק את הוראות היצרן כדי לוודא שהבקבוקון יכול לעמוד בוואקום נמוך עד בינוני.
- עבור שיטת הזלוף, בצע את השלבים המוזכרים להלן.
- בחר מיכל אספקה לפתרון הניגוד בהתאם לגודל המדגם. השתמשו במזרק של 50 מ"ל (ללא מחט או בוכנה) עבור דגימות קטנות (איור 2A) או בערכה רפואית תוך ורידית של 1 ליטר עבור דגימות גדולות (איור 2B).
- חברו קצה אחד של צינור פלסטיק שקוף (ראו טבלת חומרים) למיכל האספקה, ולאחר מכן חברו את הקצה השני לשסתום דו-כיווני או תלת-כיווני. חברו צינור שני לשקע אחר בשסתום (איור 2A,B).
- אבטח את מיכל האספקה במיקום מוגבה מבלי לפרק את המנגנון שהוקם בשלב הקודם.
הערה: המרחק האנכי בין המיכל לדגימה יכתיב את לחץ הזלוף של התמיסה (איור 2B). מרחק של 20-50 ס"מ מספיק עבור דגימות קטנות. עבור דגימות גדולות, מרחק של 1 מ 'הוא מספיק יותר. - סגרו את השסתום התלת-כיווני (איור 2C) או הדו-כיווני (איור 2D) כדי למנוע יציאת נוזלים ממערכת הצינורות, ואז שפכו את התמיסה המנוגדת למיכל האספקה. אם אתה משתמש בערכה רפואית תוך ורידית, מלא את השקית בתמיסה וסגור את השסתום לפני אבטחת המכשיר במיקום מוגבה.
- ודאו שלא נוצרות בועות אוויר גדולות לאורך מערכת הצינורות (איור 2E). במידת הצורך, אפשרו לתמיסת הניגוד לזרום החוצה מהצינור עד להסרת הבועה. סגור שוב את השסתום והשאר את המנגנון במקומו.
- כדי להכין את הדגימה לזילוח של תמיסת הניגוד, השאירו אותה שקועה בנוזל (מים, אתנול או קיבוע) וחתכו את קצה הקצה הפרוקסימלי של הגבעול/שורש המאכסן בדגימה (איור 2F).
- הסר את הדגימה מהנוזל שבו היא אוחסנה ועטוף אותה בסרט פרפין כדי למנוע התייבשות. שמור את הדגימה בקרבת מקום ומוכנה לחיבור למנגנון.
- פתח בזהירות את השסתום כדי לאפשר לתמיסת הניגוד לזרום לאט ומלא את צינורות הפלסטיק המחוברים למיכל תוך החזקת הקצה הפתוח של המערכת במיקום מוגבה מעט כדי למנוע את שפיכת התמיסה המנוגדת. שוב, ודא שלא נוצרות בועות אוויר גדולות לאורך הצינור.
- חברו את הקצה הפרוקסימלי של הגבעול/שורש המארח בדגימה לקצה הפתוח של מערכת הצינורות (איור 2B, אזור מוגדל). הימנע מהחדרת בועות אוויר למערכת במהלך שלב זה. במידת הצורך, נתק את הדגימה מהמנגנון והסר בועות אוויר מהמערכת על ידי מתן אפשרות לתמיסה לזרום.
- תוך שמירה על הדגימה מחוברת למנגנון, הניחו אותה בתוך מיכל כדי למנוע דליפה של התמיסה המנוגדת לאזור שבו נערך הניסוי. השתמשו בצינורות בקטרים שונים, באזיקונים מפלסטיק ובמתאמי שסתומים (איור 2G) כדי לוודא שכל החיבורים במכשיר מתאימים היטב, מתאימים לענפים מארחים בגדלים שונים, ושהפתרון אינו דולף החוצה ממערכת הצינורות (איור 2B, אזור מוגדל).
- תן לתמיסה לחורר את הדגימה במשך שעתיים לפחות, או עד שהתמיסה מצטברת בתוך המיכל.
- סגור את השסתום ונתק בזהירות את הדגימה מהמנגנון. מסננים את שארית התמיסה למיכל ומשליכים אותה בהתאם.
- הסר את סרט הפרפין מהדגימה כהכנה לסריקה.
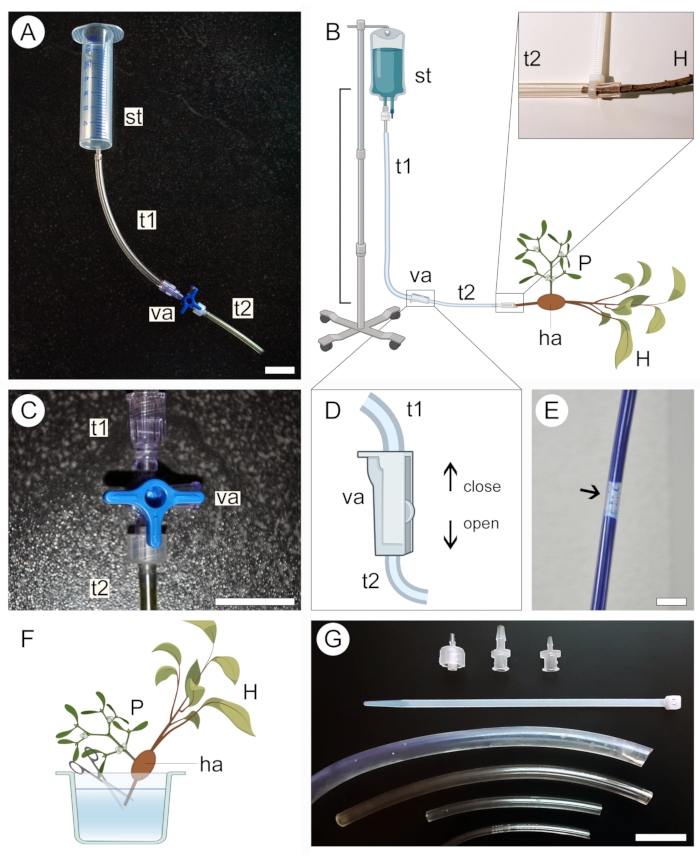
איור 2: גישת זילוח ליישום ניגודיות. גרסאות קטנות (A) וגדולות (B) של מנגנון הזילוח כוללות מיכל אספקה (st) ושני צינורות פלסטיק (t1 ו-t2) המחוברים באמצעות שסתום (va). הקצה הפרוקסימלי של גבעול הפונדקאי (H) הנושא טפיל (P) המחובר אליו דרך האוסטוריום (ha) מחובר לקצה הפתוח של המערכת (B, מורחב). שסתום תלת-כיווני (C) או דו-כיווני (D) משמש למניעת היווצרות בועות אוויר בתוך מערכת הצינורות, אשר חוסמות את המעבר של תמיסה מנוגדת (E). קצה הקצה הפרוקסימלי של גזע הפונדקאי (H) נחתך מתחת למים כדי לאפשר מעבר של תמיסת הניגוד (F). אזיקונים, מתאמי שסתומים וצינורות בקטרים שונים מסייעים לאבטח חיבורים הדוקים יותר ולמנוע דליפה במערכת (G). איורים 2B, D ו-F נוצרו באמצעות BioRender. פסי קנה מידה = 2 ס"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. הכנת מדגם והרכבה
- שטפו את הדגימה על ידי טבילתה במים למשך 2 דקות.
אזהרה: אין לשטוף דגימות בכיור, מכיוון שכל התמיסות המנוגדות כוללות מלחי מתכת כבדים בהרכבן. חשבו על המים המשמשים לשטיפה כתמיסת ניגוד מדוללת והשליכו אותם בהתאם. - הניחו את הדגימה במגבת נייר בטמפרטורת החדר כדי לאפשר לעודפי המים להתאדות למשך 2-5 דקות, בהתאם לגודל הדגימה. לחלופין, יבשו מעט את הדגימה בעזרת מגבת נייר. אין לאפשר לדגימה להתייבש לחלוטין.
- עטפו את הדגימה בסרט פרפין על ידי מתיחתו לשכבה דקה. הימנעו מקיפול סרט הפרפין על גבי הדגימה.
- הרכיבו את הדגימה העטופה על מחזיק דגימה, ושמרו עליה יציבה ובמקומה בזמן שהיא מסתובבת במהלך הסריקה. השתמש בסרט הדבקה, קצף בצפיפות נמוכה, קצוות פיפטה ו / או מיכלי פלסטיק שקופים כדי לאבטח את הדגימה במקומה.
- סרוק את הדגימה ונתח את התמונות בהתאם לפרוטוקולים והנחיות ספציפיים שנקבעו עבור מערכת המיקרו-CT הזמינה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
האוסטוריום של צמחים טפיליים הוא איבר מורכב המורכב מרקמות וסוגי תאים שונים המשתלבים ומתחברים לרקמות של צמח אחר, המשמש כפונדקאי20. ניתן למנף סריקת מיקרו-CT כדי להבין טוב יותר את המבנה המורכב הזה בדרך לא הרסנית ותלת ממדית בעת ניתוח האוסטוריה קטנה (איור 1A-C) וגד?...
Access restricted. Please log in or start a trial to view this content.
Discussion
השימוש בתמיסות מתכות כבדות לשיפור הניגודיות של רקמות הצמח הפך לשלב מכריע בהכנת הדגימות לניתוח מיקרו-CT. מספר תרכובות הזמינות בדרך כלל במעבדות מיקרומורפולוגיה של צמחים נבדקו על ידי Staedler et al., אשר ממליצים להשתמש phosphotungstate כסוכן היעיל ביותר בחדירה דגימות והגדלת מדד הניגוד8. תוצאו?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחבר אין מה לחשוף.
Acknowledgements
ברצוני להודות לד"ר סימון גומז פריירה (מעבדה למיקרוטומוגרפיה, אוניברסיטת סאו פאולו, ברזיל) ולד"ר גרג לין (המרכז למערכות ננומטריות, אוניברסיטת הרווארד, ארה"ב) על עזרתם החשובה ביותר והדרכת המשתמשים החיונית שלהם עבור מערכות מיקרוטומוגרפיה שונות ותוכנות ניתוח נתונים. אני מודה גם לצוות בחממת EEB באוניברסיטת קונטיקט (ארה"ב), במיוחד לקלינטון מורס ומתיו אופל על שסיפקו את הדגימות של Viscum minimum. ד"ר ג'ון ונצל סיפק את ההזדמנות ועזרה רבה לדגימה של Pyrularia pubera. MSC. קרולינה בסטוס, MSc. יסמין היראו וטליתה מוטה עזרו מאוד בדגימה של פטריות סקיבליום. אריאדנה פורטדו, וד"ר פרננדה אוליביירה וד"ר מריה אלין נבס סיפקו את ההתייחסות לשימוש בפלוקסין B לניתוח פטריות אנדופיטיות. הקלטת וידאו באוניברסיטת Vrije Universiteit Brussel התאפשרה הודות לעזרתם של ד"ר פיליפ קלייס, ד"ר כריסטוף סנוק, MSc. ג'ייק גריפית, ד"ר ברברה וסלקה וד"ר הארי אולדה ונטרינק. המימון ניתן על ידי התיאום לשיפור כוח האדם להשכלה גבוהה (CAPES, ברזיל) ואוניברסיטת הרווארד הרבריה (ארה"ב).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 3D X-ray microscope (XRM) system | Zeiss Versa 620 | used to scan Pyrularia pubera | |
| 3D X-ray microscope + A2:D22 | Zeiss | Versa 620 | Used for scanning the species P. pubera |
| CT-Pro 3D software | Nikon | version XT 3.1.11 | Used for three-dimensional reconstruction of scans |
| CT-Vox software | Bruker | version 3.3.1 | Used for analyses and acquisition of images and videos |
| Dragonfly software | Object Research Systems - ORS | version | Used for analyses and acquisition of images and videos |
| Glass vials | Glass Vials Inc. SE | V2708C-FM-SP | Sold by VWR - USA; make sure that vials are able to withstand vacuum at ca. 10 psi |
| Inspect-X | Zeiss | version XT 3.1.11 | Used for controlling the Nikon X-Tek HMXST225 system |
| Iodine solution 0.0282 N | WR Chemicals BDH | BDH7422-1 | Sold by VWR - USA |
| Lead Nitrate II PA 500 g | Vetec | 361.08 | Sold by SPLab |
| Microtomography scanner | Bruker | Skyscan1176 | Used for scanning the species C. americana, S. martianus, and S. fungiforme |
| Microtomography scanner | Nikon | X-Tek HMXST225 | Used for scanning the species V. minimum |
| NRecon software | Bruker | version 1.0.0 | Used for three-dimensional reconstruction |
| Phosphotungstic acid hydrate 3% in aqueous solution | Electron Microscopy Sciences | 101410-756 | Sold by VWR - USA |
| Plastic film (Parafilm) | Heathrow Scientific | PM996 | Sold by VWR - USA |
| Plastic IV bag 500 mL | Taylor | 3478 | Sold by Fibra Cirurgica Produtos para Saude |
| PVC tubing 3/4'' | Nalge Nunc International | SC63013-164 | Sold by VWR - USA |
| Scanning system | Nikon X-Tek HMXST225 | used to scan Viscum minimum | |
| Scanning system | Bruker Skyscan 1176 | used to scan C. americana | |
| Scout-and-ScanTM software | Zeiss | version 16 | Used for controlling the Zeiss Versa 620 system and for three-dimensional reconstruction of scans |
| Three-way valve | ToToT | DMTWVS-5 | Sold by Amazon USA |
| Two-part syringe | HSW Henke-Ject | 4850001000 | Used without the plunger |
| Vacuum chamber | Binder | 80080-434 | Sold by VWR - USA; includes pump and connecting tubes |
| VG Studio Max software | Volume Graphics | version 3.0 | Used for analyses and acquisition of images and videos |
References
- Stock, S. R. Microcomputed tomography: Methodology and applications. , CRC Press/Taylor and Francis. Boca Raton, FL. (2020).
- Hounsfield, G. N. Computerized transverse axial scanning (tomography): I. Description of system. British Journal of Radiology. 46 (552), 1016-1022 (1973).
- Dutilleul, P., Lafond, J. A. Editorial: Branching and rooting out with a CT Scanner: The why, the how, and the outcomes, present and possibly future pierre. Frontiers in Plant Science. 7 (41), 5-6 (2016).
- Metscher, B. D. Biological applications of X-ray microtomography: Imaging micro- anatomy, molecular expression and organismal diversity. Microscopy and Analysis. 27 (2), 13-16 (2013).
- Sakdinawat, A., Attwood, D. Nanoscale X-ray imaging. Nature Photonics. 4 (12), 840-848 (2010).
- Walton, L. A., et al. Morphological characterisation of unstained and intact tissue micro-architecture by X-ray computed micro- and nano-tomography. Scientific Reports. 5, 1-14 (2015).
- Lafond, J. A., Han, L., Dutilleul, P. Concepts and analyses in the ct scanning of root systems and leaf canopies: A timely summary. Frontiers in Plant Science. 6 (1111), 85-91 (2015).
- Staedler, Y. M., Masson, D., Schönenberger, J. Plant tissues in 3D via X-Ray Tomography: Simple contrasting methods allow high resolution imaging. PLoS ONE. 8 (9), 75295(2013).
- Heeraman, D. A., Hopmans, J. W., Clausnitzer, V. Three dimensional imaging of plant roots in situ with X-ray Computed Tomography. Plant and Soil. 189, 167-179 (1997).
- Dhondt, S., Vanhaeren, H., Van Loo, D., Cnudde, V., Inzé, D. Plant structure visualization by high-resolution X-ray computed tomography. Trends in Plant Science. 15 (8), 419-422 (2010).
- McElrone, A. J., Choat, B., Parkinson, D. Y., MacDowell, A. A., Brodersen, C. R. Using high resolution computed tomography to visualize the three dimensional structure and function of plant vasculature. Journal of Visualized Experiments. (74), e50162(2013).
- Cochard, H., Delzon, S., Badel, E. X-ray microtomography (micro-CT): A reference technology for high-resolution quantification of xylem embolism in trees. Plant, Cell and Environment. 38 (1), 201-206 (2015).
- Bastos, C. L., Tamaio, N., Angyalossy, V. Unravelling roots of lianas: A case study in Sapindaceae. Annals of Botany. 118 (4), 733-746 (2016).
- da Cunha Neto, I. L., et al. Diversity, distribution, development, and evolution of medullary bundles in Nyctaginaceae. American Journal of Botany. 107 (5), 707-725 (2020).
- Milien, M., Renault-Spilmont, A. S., Cookson, S. J., Sarrazin, A., Verdeil, J. L. Visualization of the 3D structure of the graft union of grapevine using X-ray tomography. Scientia Horticulturae. 144, 130-140 (2012).
- Paya, A. M., Silverberg, J. L., Padgett, J., Bauerle, T. L. X-ray computed tomography uncovers root-root interactions: Quantifying spatial relationships between interacting root systems in three dimensions. Frontiers in Plant Science. 6 (274), 54-65 (2015).
- Teixeira-Costa, L., Ceccantini, G. C. T. Aligning microtomography analysis with traditional anatomy for a 3D understanding of the host-parasite interface - Phoradendron spp. Case study. Frontiers in Plant Science. 7, 1340(2016).
- Lusic, H., Grinstaff, M. W. X-ray-computed tomography contrast agents. Chemical Reviews. 113 (3), 1641-1666 (2013).
- Těšitel, J. Functional biology of parasitic plants: a review. Plant Ecology and Evolution. 149 (1), 5-20 (2016).
- Teixeira-Costa, L. A living bridge between two enemies: Haustorium structure and evolution across parasitic flowering plants. Revista Brasileira de Botanica. 44 (1), 165-178 (2021).
- Kuijt, J. The Biology of Parasitic Flowering Plants. , University of California Press. Berkeley, USA. (1969).
- Masumoto, N., et al. Three-dimensional reconstructions of haustoria in two parasitic plant species in the Orobanchaceae. Plant Physiology. 185 (4), 1429-1442 (2021).
- Calo, C. M., et al. A correlation analysis of Light Microscopy and X-ray MicroCT imaging methods applied to archaeological plant remains' morphological attributes visualization. Scientific Reports. 10 (1), 1-15 (2020).
- Brodersen, C. R., Roddy, A. B. New frontiers in the three-dimensional visualization of plant structure and function. American Journal of Botany. 103 (2), 184-188 (2016).
- Teixeira-Costa, L., Davis, C. C. Life history, diversity, and distribution in parasitic flowering plants. Plant Physiology. 187 (1), 32-51 (2021).
- Simpson, B. B. Krameriaceae. Flora Neotropica Monograph. 49, (1989).
- Ruzin, S. E. Plant microtechnique and microscopy. , Oxford University Press. Oxford, UK. (1999).
- Nikolov, L. A., Tomlinson, P. B., Manickam, S., Endress, P. K., Kramer, E. M., Davis, C. C. Holoparasitic Rafflesiaceae possess the most reduced endophytes and yet give rise to the world's largest flowers. Annals of Botany. 114, 233-242 (2014).
- Thorogood, C. J., Teixeira-Costa, L., Ceccantini, G., Davis, C., Hiscock, S. J. Endoparasitic plants and fungi show evolutionary convergence across phylogenetic divisions. New Phytologist. 232 (3), 1159-1167 (2021).
- Largent, D., Johnson, D., Watling, R. How to Identify Mushrooms to Genus III: Microscopic Features. , Mad River Press Inc. Eureka, CA. USA. (1977).
- Busse, M., et al. Three-dimensional virtual histology enabled through cytoplasm-specific X-ray stain for microscopic and nanoscopic computed tomography. Proceedings of the National Academy of Sciences of the United States of America. 115 (10), 2293-2298 (2018).
- Sperry, J. S., Donnelly, J. R., Tyree, M. T. A method for measuring hydraulic conductivity and embolism in xylem. Plant, Cell and Environment. 11, 35-40 (1988).
- Calvin, C. L. Host-formed tyloses in vessels of the mistletoe Phoradendron (Viscaceae). IAWA Journal. 18 (2), 117-126 (1997).
- Teixeira-Costa, L., Ceccantini, G. Embolism increase and anatomical modifications caused by a parasitic plant. IAWA Journal. 36 (2), 138-151 (2015).
- Ellmore, G. S., Ewers, F. W. Fluid flow in the outermost xylem increment of a ring-porous tree, Ulmus americana. American Journal of Botany. 73 (12), 1771-1774 (1986).
- Ellis, E. A. Staining sectioned biological specimens for transmission electron microscopy: Conventional and En bloc stains. Electron Microscopy: Methods and Protocols. 1117, 57-72 (2014).
- Brodersen, C. R., McElrone, A. J., Choat, B., Matthews, M. A., Shackel, K. A. The dynamics of embolism repair in xylem: In vivo visualizations using high-resolution computed tomography. Plant Physiology. 154 (3), 1088-1095 (2010).
- Brodersen, C. R., et al. Automated analysis of three-dimensional xylem networks using high-resolution computed tomography. New Phytologist. 191 (4), 1168-1179 (2011).
- Lee, K., et al. Visualizing plant development and gene expression in three dimensions using optical projection tomography. Plant Cell. 18 (9), 2145-2156 (2006).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved