È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sfruttare la scansione micro-CT per analizzare le interazioni parassitarie pianta-ospite
In questo articolo
Riepilogo
Micro-CT è uno strumento non distruttivo in grado di analizzare le strutture delle piante in tre dimensioni. Il presente protocollo descrive la preparazione del campione per sfruttare la micro-CT per analizzare la struttura e la funzione delle piante parassite. Diverse specie sono utilizzate per evidenziare i vantaggi di questo metodo se accoppiato con preparazioni specifiche.
Abstract
La scansione micro-CT è diventata uno strumento consolidato nello studio della struttura e della funzione dell'impianto. La sua natura non distruttiva, unita alla possibilità di visualizzazione tridimensionale e sezionamento virtuale, ha permesso analisi nuove e sempre più dettagliate di organi vegetali complessi. Possono anche essere esplorate le interazioni tra le piante, comprese quelle tra le piante parassite e i loro ospiti. Tuttavia, la preparazione del campione prima della scansione diventa cruciale a causa dell'interazione tra queste piante, che spesso differiscono nell'organizzazione e nella composizione dei tessuti. Inoltre, l'ampia diversità delle piante da fiore parassite, che vanno dai corpi vegetativi altamente ridotti agli alberi, alle erbe e agli arbusti, deve essere considerata durante il campionamento, il trattamento e la preparazione del materiale ospite del parassita. Qui vengono descritti due diversi approcci per introdurre soluzioni di contrasto nel parassita e/o nelle piante ospiti, concentrandosi sull'analisi dell'haustorium. Questo organo promuove la connessione e la comunicazione tra le due piante. Seguendo un approccio semplice, i dettagli dell'organizzazione del tessuto haustorium possono essere esplorati tridimensionalmente, come mostrato qui per le specie parassite eufitoidi, vite e vischio. La selezione di specifici agenti di contrasto e approcci applicativi consente anche un'osservazione dettagliata della diffusione dell'endoparassita all'interno del corpo ospite e il rilevamento della connessione diretta vaso-vaso tra parassita e ospite, come mostrato qui per un parassita radice obbligato. Pertanto, il protocollo discusso qui può essere applicato all'ampia diversità delle piante da fiore parassite per far progredire la comprensione del loro sviluppo, struttura e funzionamento.
Introduzione
La tomografia microcomputerizzata a raggi X ad alta risoluzione (micro-CT) è un metodo di imaging in cui più radiografie (proiezioni) di un campione vengono registrate da diversi angoli di visione e successivamente utilizzate per fornire una ricostruzione virtuale del campione1. Questo oggetto virtuale può quindi essere analizzato, manipolato e segmentato, consentendo l'esplorazione non distruttiva in tre dimensioni2. Inizialmente progettata per analisi mediche e successivamente per applicazioni industriali, la micro-CT offre anche il vantaggio di visualizzare organi interni e tessuti senza la necessità di procedure invasive3. Come altre forme di imaging, la micro-CT funziona con un compromesso tra il campo visivo e la dimensione dei pixel, il che significa che l'imaging ad alta risoluzione di campioni di grandi dimensioni è quasi irraggiungibile4. I progressi nell'uso di sorgenti di raggi X ad alta energia (cioè sincrotrone) e ingrandimento ottico secondario sono costantemente fatti, consentendo alla risoluzione più piccola di raggiungere meno di 100 nm 5,6. Tuttavia, sono necessari tempi di scansione più lunghi per campioni di grandi dimensioni, aumentando la possibilità di artefatti dovuti al movimento o alla deformazione del campione all'interno dello scanner. Inoltre, la micro-CT è generalmente limitata dalle variazioni di densità naturale all'interno del campione e dal modo in cui il campione interagisce con i raggi X. Mentre una dose di raggi X più elevata è la migliore per penetrare campioni più densi, è meno efficiente nel catturare le variazioni di densità all'interno e tra il campione e il suo mezzo circostante7. D'altra parte, una dose di raggi X inferiore offre meno potere di penetrazione e spesso richiede tempi di scansione più lunghi ma una maggiore sensibilità nel rilevamento della densità7.
Queste restrizioni hanno a lungo ostacolato l'uso della microtomografia per le scienze vegetali, dato che la maggior parte dei tessuti vegetali sono composti da tessuto leggero (non denso) con basso assorbimento di raggi X8. Le prime applicazioni della micro-CT si sono concentrate sulla mappatura delle reti radicali all'interno della matrice del suolo 9,10. Successivamente, le strutture vegetali con differenze più significative nella densità dei tessuti, come il legno, iniziarono a essere esplorate. Ciò ha permesso indagini sulla funzionalità xilematica 11,12, lo sviluppo di organizzazioni tissutali complesse13,14 e le interazioni tra piante15,16,17. L'analisi dei tessuti molli e omogenei si sta diffondendo grazie ai mezzi di contrasto, che sono ormai una procedura standard nelle preparazioni per la scansione micro-TC di campioni vegetali. Tuttavia, i protocolli per l'introduzione del contrasto possono avere risultati diversi a seconda del volume del campione, delle proprietà strutturali e del tipo di soluzione utilizzata8. Idealmente, l'agente di contrasto dovrebbe migliorare la distinzione tra i diversi tessuti, consentire la valutazione della funzionalità del tessuto / organo e / o fornire informazioni biochimiche su un tessuto18. Pertanto, un adeguato trattamento, preparazione e montaggio del campione prima della scansione diventano cruciali per qualsiasi analisi micro-CT.
Micro-CT della pianta parassita haustorium
Le piante da fiore parassitarie rappresentano un gruppo funzionale distinto di angiosperme caratterizzate da un organo noto come haustorium19. Questo organo multicellulare, un ibrido evolutivo tra uno stelo modificato e una radice, agisce sull'attaccamento, la penetrazione e il contatto dell'ospite da parte di un parassita20. Per questo motivo, l'haustorium è considerato "incarnare l'idea stessa di parassitismo tra le piante"21. Una comprensione dettagliata dello sviluppo, della struttura e del funzionamento di questo organo è fondamentale per l'ecologia delle piante parassite, l'evoluzione e gli studi di gestione. Tuttavia, la complessità complessiva delle piante parassite e la struttura e l'haustoria altamente modificate spesso ostacolano l'analisi e il confronto dettagliati. Anche le connessioni di Haustorium sono di solito estese e non omogenee nella distribuzione tissutale e cellulare (Figura 1). In questo contesto, mentre lavorare con piccoli frammenti di tessuto consente una manipolazione più facile e una risoluzione più elevata, può portare a conclusioni errate sull'architettura tridimensionale di strutture complesse, come l'haustorio della pianta parassita.
Sebbene esista una vasta letteratura sull'anatomia e l'ultrastruttura dell'haustorio per la maggior parte delle specie di piante parassite, l'organizzazione tridimensionale e la relazione spaziale tra parassiti e tessuti ospiti rimane poco esplorata17. In un recente lavoro di Masumoto et al.22, oltre 300 sezioni seriali di microtomo semisottili sono state visualizzate e ricostruite in un oggetto virtuale tridimensionale che rappresenta l'haustorio di due specie di parassiti. L'eccellente livello di dettaglio di questo metodo fornisce informazioni senza precedenti sulla struttura 3D cellulare e anatomica dell'haustorium. Tuttavia, una tecnica così dispendiosa in termini di tempo impedirebbe un'analisi simile nei parassiti con connessioni haustorium più estese. L'utilizzo della micro-CT emerge come un ottimo strumento per l'analisi tridimensionale di complessi e spesso ingombranti haustoria di piante parassite. Sebbene non sostituiscano il sezionamento anatomico dettagliato e altre forme complementari di analisi microscopiche17,23, i risultati ottenuti tramite scansione micro-CT, in particolare per campioni di grandi dimensioni, possono anche servire come guida per dirigere il sottocampionamento di segmenti più piccoli, che possono quindi essere analizzati utilizzando altri strumenti, come la microscopia confocale ed elettronica, o rianalizzati con sistemi micro-CT ad alta risoluzione.

Figura 1: Piante parassite di diversi gruppi funzionali utilizzati in questo protocollo. Parassita eufitoide Pyrularia pubera (A), endoparassita Viscum minimo (B) con frutti verdi (cerchio nero tratteggiato), vite parassita Cuscuta americana (C), vischio Struthanthus martianus (D), parassita radice obbligata Scybalium fungiforme (E). Segmenti della radice ospite (Hr) o del fusto (Hs) facilitano l'applicazione del contrasto nell'haustorio parassita (P). La presenza di radice/stelo madre del parassita (frecce) nel campione consente l'analisi dell'organizzazione dei vasi di haustorio. I rettangoli indicano i segmenti del campione utilizzato per l'analisi. Barre della scala = 2 cm. Fare clic qui per visualizzare una versione più grande di questa figura.
Poiché la micro-CT diventa una tecnica sempre più popolare nelle scienze vegetali, ci sono guide, protocolli e letteratura che si occupano di scansione dei campioni, ricostruzione tridimensionale, segmentazione e analisi 3,10,24. Pertanto, questi passaggi non saranno discussi qui. Come per qualsiasi tecnica di imagining, il trattamento e il montaggio appropriati dei campioni sono fondamentali, anche se spesso sono una procedura trascurata. Per questo motivo, questo protocollo si concentra sulla preparazione di campioni di haustorium per la scansione micro-CT. Più specificamente, questo protocollo descrive due approcci per introdurre agenti di contrasto nei campioni di haustorio per migliorare la visualizzazione di diversi tessuti e tipi di cellule nell'haustorium, per facilitare la rilevazione di tessuto parassita all'interno della radice / stelo ospite e per analizzare le connessioni vascolari parassita-ospite in tre dimensioni. I preparati qui descritti possono anche essere adattati all'analisi di altre strutture vegetali.
Cinque specie sono state utilizzate per illustrare meglio la convenienza del protocollo qui descritto. Ogni specie rappresenta uno dei cinque gruppi funzionali di piante da fiore parassite, affrontando così punti specifici relativi alla funzionalità di ciascun gruppo. Pyrularia pubera (Santalaceae) è stata scelta per rappresentare i parassiti eufitoidi, che germinano nel terreno e formano molteplici haustoria che collegano il parassita alle radici dei suoi ospiti25. Le haustoria create da queste piante sono spesso tenui e facilmente strappate dall'ospite26 (Figura 1A), richiedendo quindi un processo di manipolazione più delicato. Gli endoparassiti sono rappresentati qui da Viscum minimum (Viscaceae). Le specie di questo gruppo funzionale sono visibili solo al di fuori del corpo dei loro ospiti per brevi periodi (Figura 1B) e vivono la maggior parte dei loro cicli vitali come filamenti di cellule significativamente ridotti e simili a miceli incorporati nei tessuti ospiti25. Un terzo gruppo funzionale comprende viti parassite, che germinano sul terreno ma formano solo radici rudimentali, basandosi su più haustoria che si attaccano ai fusti delle piante ospiti25 (Figura 1C). Qui, questo gruppo funzionale è rappresentato da Cuscuta americana (Convolvulaceae). Contrariamente alle viti parassite, i vischi germinano direttamente sui rami delle piante ospiti e sviluppano haustoria multiple o solitarie25. La specie scelta per illustrare questo gruppo funzionale è Struthanthus martianus (Loranthaceae), che forma varie connessioni con il ramo ospite (Figura 1D). L'analisi del vischio solitario haustoria utilizzando una combinazione di micro-TC e microscopia ottica può essere trovata in Teixeira-Costa & Ceccantini17. Infine, i parassiti delle radici obbligate comprendono le specie che germinano sul terreno e penetrano nelle radici delle piante ospiti, da cui dipendono interamente fin dalle prime fasi di crescita25. Queste piante sono qui rappresentate da Scybalium fungiforme (Balanophoraceae), che producono grandi haustoria simili a tuberi (Figura 1E).
Tutti i campioni di piante utilizzati in questo protocollo sono stati fissati in un alcol di acido acetico formalina al 70% (FAA 70). La fissazione al campionamento è fondamentale per preservare i tessuti vegetali, soprattutto se sono necessarie successive analisi anatomiche. Nel caso dell'haustorio delle piante parassite, anche la fissazione è essenziale, poiché questo organo è spesso composto principalmente da cellule di parenchima non lignificate20. Protocolli dettagliati per la fissazione del tessuto vegetale, compresa la preparazione di soluzioni fissative, possono essere trovati altrove27. D'altra parte, in misura maggiore o minore, i fissativi possono causare alterazioni delle proprietà fisiche e chimiche di un campione, rendendolo inadatto per specifiche analisi biomeccaniche e istochimiche. Pertanto, anche i campioni freschi, cioè il materiale non fissato raccolto immediatamente prima della preparazione, possono essere utilizzati con questo protocollo. I dettagli su come gestire nuovi campioni e i suggerimenti per la risoluzione dei problemi relativi al materiale fissato sono forniti nella sezione di discussione.
Protocollo
1. Selezione del campione di piante parassite
- Raccogliere l'intero haustorio della pianta parassita, compreso il fusto / radice dell'ospite attaccato e segmenti di entrambe le estremità prossimali e distali dell'organo ospite parassitato; La lunghezza ideale di ogni segmento equivale al doppio del diametro dell'haustorium.
NOTA: Per l'haustoria laterale, includere parte del fusto/radice madre del parassita da cui si è formato l'haustorio (Figura 1A,B,D). Per gli endoparassiti, raccogliere un segmento dello stelo/radice ospite in cui sono visibili i segni del parassita (Figura 1B). Nel caso di collegamenti terminali, l'intero impianto deve essere raccolto (figura 1E). - Immergere l'intero campione in soluzione fissativa (ad esempio, FAA) in una proporzione volumetrica di 1:10 (campione: fissativo). Lasciare i campioni in fissativo per almeno 1 giorno, a seconda delle dimensioni del campione27.
NOTA: I campioni possono essere conservati in fissativo prima della scansione o essere trasferiti in una soluzione conservante (ad esempio, etanolo 70%). I campioni freschi possono essere utilizzati anche se la successiva analisi anatomica non è giustificata (vedi sezione Discussione). Se si lavora con materiale fresco, impostare l'apparecchio per la perfusione della soluzione di contrasto, quindi raccogliere il campione. Il campione non deve essere lasciato asciugare.
2. Applicazione di soluzioni contrastanti
- Scegliere il metodo di applicazione da utilizzare. Utilizzare il metodo del vuoto (fase 2.3) per campioni piccoli (Figura 1A) o non legnosi (Figura 1B). Utilizzare il metodo di perfusione per campioni più grandi, a condizione che includa un segmento dello stelo/radice ospite (Figura 1A,C-E).
- Indossare guanti di gomma e altri dispositivi di protezione individuale appropriati (ad esempio, camice da laboratorio) quando si manipola il campione, indipendentemente dall'approccio scelto nelle fasi seguenti.
ATTENZIONE: Tutte le soluzioni contrastanti includono sali di metalli pesanti nella loro composizione, e quindi non devono essere maneggiate senza adeguati dispositivi di protezione individuale e sotto una cappa aspirante. - Per il metodo del vuoto, seguire i passaggi indicati di seguito.
- Scegliere un flaconcino appropriato ed etichettarlo. Il flaconcino deve essere sufficientemente grande da contenere il campione e la soluzione contrastante, di solito in proporzione 1:10. Controllare le istruzioni del produttore per assicurarsi che il flaconcino possa resistere a un vuoto da basso a moderato.
NOTA: Non riempire il flaconcino fino all'orlo, poiché la pressione negativa (vuoto) può causare la fuoriuscita del liquido. - Introdurre il campione nel flaconcino con la soluzione contrastante (iodio all'1% o fosfotungstato al 3%, vedere la tabella dei materiali). Quindi posizionare il flaconcino in una camera a vuoto o essiccatore collegato a una pompa per vuoto. Rimuovere il coperchio dal flaconcino, quindi chiudere la camera a vuoto o l'essiccatore.
- Verificare che non vi siano crepe nella camera a vuoto/essiccatore e che la pompa per vuoto abbia abbastanza olio.
- Chiudere la valvola di scarico della pompa per evitare che l'aria si scateni e aprire la valvola di scarico della camera/essiccatore per forzare l'uscita dell'aria.
- Accendere la pompa e attendere che la pressione raggiunga circa 20" Hg.
ATTENZIONE: Questo processo è solitamente veloce, quindi non lasciare il sistema di aspirazione incustodito.
NOTA: Mentre l'unità del sistema metrico per la pressione è Pascal (Pa), i manometri nella maggior parte delle pompe per vuoto da laboratorio mostrano la pressione in pollici di mercurio ("Hg), libbra per pollice quadrato (psi) o barre. 20" Hg equivale a circa 67,7 Pa, 10 psi, o 0,7 bar. - Chiudere la valvola di scarico della camera/essiccatore per evitare che l'aria rientri in entrata, quindi spegnere rapidamente la pompa.
- Lasciare il campione sotto vuoto per almeno 2 ore; I campioni più grandi richiedono più tempo perché la soluzione contrastante penetri in esso.
- Dopo il periodo desiderato, rimuovere il campione dalla soluzione di contrasto per prepararlo alla scansione.
- Aprire lentamente la valvola di scarico della camera/essiccatore per consentire all'aria di entrare.
- Attendere che la pressione nella camera/essiccatore sia completamente esaurita (cioè il manometro raggiunge quasi 0), quindi aprirlo con attenzione per recuperare il campione.
- Eliminare la soluzione di contrasto in modo appropriato e conservare il campione in preparazione per la scansione.
- Scegliere un flaconcino appropriato ed etichettarlo. Il flaconcino deve essere sufficientemente grande da contenere il campione e la soluzione contrastante, di solito in proporzione 1:10. Controllare le istruzioni del produttore per assicurarsi che il flaconcino possa resistere a un vuoto da basso a moderato.
- Per il metodo di perfusione, seguire i passaggi indicati di seguito.
- Selezionare un serbatoio di alimentazione per la soluzione a contrasto in base alle dimensioni del campione. Utilizzare una siringa da 50 ml (senza ago o stantuffo) per piccoli campioni (Figura 2A) o un kit medico endovenoso da 1 L per campioni di grandi dimensioni (Figura 2B).
- Collegare un'estremità di un tubo di plastica trasparente (vedere la tabella dei materiali) al serbatoio di alimentazione, quindi collegare l'altra estremità a una valvola a due o tre vie. Collegare un secondo tubo a un'uscita diversa nella valvola (Figura 2A,B).
- Fissare il serbatoio di alimentazione in una posizione elevata senza smontare l'apparecchio impostato nella fase precedente.
NOTA: La distanza verticale tra il serbatoio e il campione determinerà la pressione di perfusione della soluzione (Figura 2B). Una distanza di 20-50 cm è sufficiente per piccoli campioni. Per campioni di grandi dimensioni, una distanza di 1 m è più adeguata. - Chiudere la valvola a tre vie (Figura 2C) o a due vie (Figura 2D) per impedire al liquido di uscire dal sistema di tubi, quindi versare la soluzione di contrasto nel serbatoio di alimentazione. Se si utilizza un kit medico per via endovenosa, riempire la sacca con la soluzione e chiudere la valvola prima di fissare l'apparecchio in una posizione elevata.
- Assicurarsi che non si formino grandi bolle d'aria lungo il sistema di tubi (Figura 2E). Se necessario, lasciare che la soluzione di contrasto fuoriesca dal tubo fino a quando la bolla non viene rimossa. Chiudere nuovamente la valvola e lasciare l'apparecchio in posizione.
- Per preparare il campione alla perfusione della soluzione di contrasto, tenerlo immerso in liquido (acqua, etanolo o fissativo) e tagliare la punta dell'estremità prossimale del fusto/radice ospite nel campione (Figura 2F).
- Prelevare il campione dal liquido in cui è stato conservato e avvolgerlo in una pellicola di paraffina per evitare l'essiccazione. Tenere il campione vicino e pronto per essere collegato all'apparecchio.
- Aprire con attenzione la valvola per consentire alla soluzione di contrasto di fluire lentamente e riempire il tubo di plastica collegato al serbatoio mantenendo l'estremità aperta del sistema in una posizione leggermente elevata per evitare che la soluzione di contrasto si rovesci. Ancora una volta, assicurarsi che non si formino grandi bolle d'aria lungo il tubo.
- Collegare l'estremità prossimale dello stelo/radice ospite nel campione all'estremità aperta del sistema di tubi (Figura 2B, regione ingrandita). Evitare di introdurre bolle d'aria nel sistema durante questa fase. Se necessario, scollegare il campione dall'apparecchio e rimuovere le bolle d'aria dal sistema consentendo alla soluzione di fluire.
- Mantenendo il campione collegato all'apparecchiatura, posizionarlo all'interno di un contenitore per evitare perdite della soluzione contrastante nell'area in cui è stato installato l'esperimento. Utilizzare tubi di diversi diametri, fascette in plastica e adattatori per valvole (Figura 2G) per garantire che tutte le connessioni nell'apparecchio siano ben adattate, accolgano rami ospiti di varie dimensioni e che la soluzione non fuoriesca dal sistema di tubi (Figura 2B, regione ingrandita).
- Lasciare che la soluzione perfonda il campione per almeno 2 ore o fino a quando la soluzione si accumula all'interno del contenitore.
- Chiudere la valvola e scollegare con attenzione il campione dall'apparecchio. Scolare il resto della soluzione nel contenitore e smaltirlo in modo appropriato.
- Rimuovere la pellicola di paraffina dal campione in preparazione per la scansione.
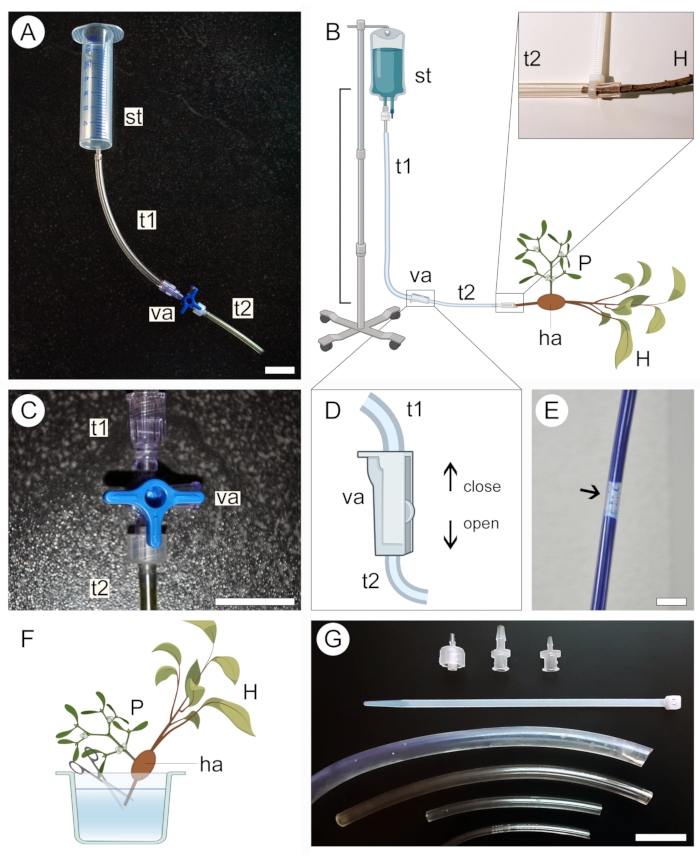
Figura 2: Approccio di perfusione per l'applicazione del contrasto. Le versioni piccole (A) e grandi (B) dell'apparato di perfusione comprendono un serbatoio di alimentazione (st) e due tubi di plastica (t1 e t2) collegati da una valvola (va). L'estremità prossimale dello stelo ospite (H) che porta un parassita (P) attaccato ad esso tramite l'haustorio (ha) è collegata all'estremità aperta del sistema (B, espanso). Una valvola a tre vie (C) o a due vie (D) viene utilizzata per aiutare a prevenire la formazione di bolle d'aria all'interno del sistema di tubi, che bloccano il passaggio della soluzione di contrasto (E). La punta dell'estremità prossimale dello stelo ospite (H) viene tagliata sott'acqua per consentire il passaggio della soluzione di contrasto (F). Fascette lampo, adattatori per valvole e tubi di diversi diametri aiutano a garantire connessioni più strette ed evitare perdite nel sistema (G). Le figure 2B, D e F sono state create con BioRender. Barre della scala = 2 cm. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Preparazione e montaggio del campione
- Lavare il campione immergendolo in acqua per 2 minuti.
ATTENZIONE: Non lavare i campioni nel lavandino, poiché tutte le soluzioni contrastanti includono sali di metalli pesanti nella loro composizione. Considerare l'acqua utilizzata per il lavaggio come una soluzione diluita a contrasto e smaltirla in modo appropriato. - Mettere il campione in un tovagliolo di carta a temperatura ambiente per consentire all'acqua in eccesso di evaporare per 2-5 minuti a seconda delle dimensioni del campione. In alternativa, asciugare leggermente il campione con l'aiuto di un tovagliolo di carta. Non lasciare asciugare completamente il campione.
- Avvolgere il campione in un film di paraffina allungandolo fino a uno strato sottile. Evitare di piegare la pellicola di paraffina sopra il campione.
- Montare il campione avvolto su un supporto per campioni, mantenendolo stabile e in posizione mentre ruota durante la scansione. Utilizzare nastro adesivo, schiuma a bassa densità, punte per pipette e/o contenitori di plastica trasparente per fissare il campione in posizione.
- Scansiona il campione e analizza le immagini seguendo protocolli e linee guida specifici stabiliti per il sistema micro-CT disponibile.
Risultati
L'haustorio delle piante parassite è un organo complesso che comprende diversi tessuti e tipi di cellule che si intrecciano e si collegano con i tessuti di un'altra pianta, utilizzata come ospite20. La scansione micro-CT può essere sfruttata per comprendere meglio questa complessa struttura in modo non distruttivo e tridimensionale quando si analizzano sia piccole (Figura 1A-C) che grandi (Figura 1D,E) haustori...
Discussione
L'uso di soluzioni di metalli pesanti per migliorare il contrasto dei tessuti vegetali è diventato un passo cruciale nella preparazione del campione per l'analisi micro-CT. Diversi composti comunemente disponibili nei laboratori di micromorfologia vegetale sono stati testati da Staedler et al., che raccomandano l'uso del fosfotungstato come agente più efficace nel penetrare i campioni e aumentare l'indice di contrasto8. I risultati ottenuti qui nell'analisi dell'haustorium di P. pubera ...
Divulgazioni
L'autore non ha nulla da rivelare.
Riconoscimenti
Vorrei ringraziare il Dr. Simone Gomes Ferreira (Microtomography Laboratory, Università di San Paolo, Brasile) e il Dr. Greg Lin (Center for Nanoscale Systems, Harvard University, USA) per il loro fondamentale aiuto e indispensabile formazione degli utenti per diversi sistemi di microtomografia e software di analisi dei dati. Ringrazio anche il personale della serra EEB dell'Università del Connecticut (USA), in particolare Clinton Morse e Matthew Opel per aver fornito gli esemplari di Viscum minimo. Il Dr. John Wenzel ha fornito l'opportunità e un grande aiuto per il campionamento di Pyrularia pubera. Carolina Bastos, Yasmin Hirao e Talitha Motta hanno aiutato notevolmente con il campionamento di Scybalium fungiforme. La dott.ssa Ariadne Furtado e le dottoresse Fernanda Oliveira e Maria Aline Neves hanno fornito il riferimento per l'uso della phloxine B per l'analisi dei funghi endofitici. La registrazione video presso la Vrije Universiteit Brussel è stata resa possibile grazie all'aiuto del Dr. Philippe Claeys, Dr. Christophe Snoeck, MSc. Jake Griffith, Dr. Barabara Veselka e Dr. Harry Olde Venterink. Il finanziamento è stato fornito dal Coordinamento per il miglioramento del personale dell'istruzione superiore (CAPES, Brasile) e dall'Università di Harvard Herbaria (USA).
Materiali
| Name | Company | Catalog Number | Comments |
| 3D X-ray microscope (XRM) system | Zeiss Versa 620 | used to scan Pyrularia pubera | |
| 3D X-ray microscope + A2:D22 | Zeiss | Versa 620 | Used for scanning the species P. pubera |
| CT-Pro 3D software | Nikon | version XT 3.1.11 | Used for three-dimensional reconstruction of scans |
| CT-Vox software | Bruker | version 3.3.1 | Used for analyses and acquisition of images and videos |
| Dragonfly software | Object Research Systems - ORS | version | Used for analyses and acquisition of images and videos |
| Glass vials | Glass Vials Inc. SE | V2708C-FM-SP | Sold by VWR - USA; make sure that vials are able to withstand vacuum at ca. 10 psi |
| Inspect-X | Zeiss | version XT 3.1.11 | Used for controlling the Nikon X-Tek HMXST225 system |
| Iodine solution 0.0282 N | WR Chemicals BDH | BDH7422-1 | Sold by VWR - USA |
| Lead Nitrate II PA 500 g | Vetec | 361.08 | Sold by SPLab |
| Microtomography scanner | Bruker | Skyscan1176 | Used for scanning the species C. americana, S. martianus, and S. fungiforme |
| Microtomography scanner | Nikon | X-Tek HMXST225 | Used for scanning the species V. minimum |
| NRecon software | Bruker | version 1.0.0 | Used for three-dimensional reconstruction |
| Phosphotungstic acid hydrate 3% in aqueous solution | Electron Microscopy Sciences | 101410-756 | Sold by VWR - USA |
| Plastic film (Parafilm) | Heathrow Scientific | PM996 | Sold by VWR - USA |
| Plastic IV bag 500 mL | Taylor | 3478 | Sold by Fibra Cirurgica Produtos para Saude |
| PVC tubing 3/4'' | Nalge Nunc International | SC63013-164 | Sold by VWR - USA |
| Scanning system | Nikon X-Tek HMXST225 | used to scan Viscum minimum | |
| Scanning system | Bruker Skyscan 1176 | used to scan C. americana | |
| Scout-and-ScanTM software | Zeiss | version 16 | Used for controlling the Zeiss Versa 620 system and for three-dimensional reconstruction of scans |
| Three-way valve | ToToT | DMTWVS-5 | Sold by Amazon USA |
| Two-part syringe | HSW Henke-Ject | 4850001000 | Used without the plunger |
| Vacuum chamber | Binder | 80080-434 | Sold by VWR - USA; includes pump and connecting tubes |
| VG Studio Max software | Volume Graphics | version 3.0 | Used for analyses and acquisition of images and videos |
Riferimenti
- Stock, S. R. . Microcomputed tomography: Methodology and applications. , (2020).
- Hounsfield, G. N. Computerized transverse axial scanning (tomography): I. Description of system. British Journal of Radiology. 46 (552), 1016-1022 (1973).
- Dutilleul, P., Lafond, J. A. Editorial: Branching and rooting out with a CT Scanner: The why, the how, and the outcomes, present and possibly future pierre. Frontiers in Plant Science. 7 (41), 5-6 (2016).
- Metscher, B. D. Biological applications of X-ray microtomography: Imaging micro- anatomy, molecular expression and organismal diversity. Microscopy and Analysis. 27 (2), 13-16 (2013).
- Sakdinawat, A., Attwood, D. Nanoscale X-ray imaging. Nature Photonics. 4 (12), 840-848 (2010).
- Walton, L. A., et al. Morphological characterisation of unstained and intact tissue micro-architecture by X-ray computed micro- and nano-tomography. Scientific Reports. 5, 1-14 (2015).
- Lafond, J. A., Han, L., Dutilleul, P. Concepts and analyses in the ct scanning of root systems and leaf canopies: A timely summary. Frontiers in Plant Science. 6 (1111), 85-91 (2015).
- Staedler, Y. M., Masson, D., Schönenberger, J. Plant tissues in 3D via X-Ray Tomography: Simple contrasting methods allow high resolution imaging. PLoS ONE. 8 (9), 75295 (2013).
- Heeraman, D. A., Hopmans, J. W., Clausnitzer, V. Three dimensional imaging of plant roots in situ with X-ray Computed Tomography. Plant and Soil. 189, 167-179 (1997).
- Dhondt, S., Vanhaeren, H., Van Loo, D., Cnudde, V., Inzé, D. Plant structure visualization by high-resolution X-ray computed tomography. Trends in Plant Science. 15 (8), 419-422 (2010).
- McElrone, A. J., Choat, B., Parkinson, D. Y., MacDowell, A. A., Brodersen, C. R. Using high resolution computed tomography to visualize the three dimensional structure and function of plant vasculature. Journal of Visualized Experiments. (74), e50162 (2013).
- Cochard, H., Delzon, S., Badel, E. X-ray microtomography (micro-CT): A reference technology for high-resolution quantification of xylem embolism in trees. Plant, Cell and Environment. 38 (1), 201-206 (2015).
- Bastos, C. L., Tamaio, N., Angyalossy, V. Unravelling roots of lianas: A case study in Sapindaceae. Annals of Botany. 118 (4), 733-746 (2016).
- da Cunha Neto, I. L., et al. Diversity, distribution, development, and evolution of medullary bundles in Nyctaginaceae. American Journal of Botany. 107 (5), 707-725 (2020).
- Milien, M., Renault-Spilmont, A. S., Cookson, S. J., Sarrazin, A., Verdeil, J. L. Visualization of the 3D structure of the graft union of grapevine using X-ray tomography. Scientia Horticulturae. 144, 130-140 (2012).
- Paya, A. M., Silverberg, J. L., Padgett, J., Bauerle, T. L. X-ray computed tomography uncovers root-root interactions: Quantifying spatial relationships between interacting root systems in three dimensions. Frontiers in Plant Science. 6 (274), 54-65 (2015).
- Teixeira-Costa, L., Ceccantini, G. C. T. Aligning microtomography analysis with traditional anatomy for a 3D understanding of the host-parasite interface - Phoradendron spp. Case study. Frontiers in Plant Science. 7, 1340 (2016).
- Lusic, H., Grinstaff, M. W. X-ray-computed tomography contrast agents. Chemical Reviews. 113 (3), 1641-1666 (2013).
- Těšitel, J. Functional biology of parasitic plants: a review. Plant Ecology and Evolution. 149 (1), 5-20 (2016).
- Teixeira-Costa, L. A living bridge between two enemies: Haustorium structure and evolution across parasitic flowering plants. Revista Brasileira de Botanica. 44 (1), 165-178 (2021).
- Kuijt, J. . The Biology of Parasitic Flowering Plants. , (1969).
- Masumoto, N., et al. Three-dimensional reconstructions of haustoria in two parasitic plant species in the Orobanchaceae. Plant Physiology. 185 (4), 1429-1442 (2021).
- Calo, C. M., et al. A correlation analysis of Light Microscopy and X-ray MicroCT imaging methods applied to archaeological plant remains' morphological attributes visualization. Scientific Reports. 10 (1), 1-15 (2020).
- Brodersen, C. R., Roddy, A. B. New frontiers in the three-dimensional visualization of plant structure and function. American Journal of Botany. 103 (2), 184-188 (2016).
- Teixeira-Costa, L., Davis, C. C. Life history, diversity, and distribution in parasitic flowering plants. Plant Physiology. 187 (1), 32-51 (2021).
- Simpson, B. B. Krameriaceae. Flora Neotropica Monograph. 49, (1989).
- Ruzin, S. E. . Plant microtechnique and microscopy. , (1999).
- Nikolov, L. A., Tomlinson, P. B., Manickam, S., Endress, P. K., Kramer, E. M., Davis, C. C. Holoparasitic Rafflesiaceae possess the most reduced endophytes and yet give rise to the world's largest flowers. Annals of Botany. 114, 233-242 (2014).
- Thorogood, C. J., Teixeira-Costa, L., Ceccantini, G., Davis, C., Hiscock, S. J. Endoparasitic plants and fungi show evolutionary convergence across phylogenetic divisions. New Phytologist. 232 (3), 1159-1167 (2021).
- Largent, D., Johnson, D., Watling, R. . How to Identify Mushrooms to Genus III: Microscopic Features. , (1977).
- Busse, M., et al. Three-dimensional virtual histology enabled through cytoplasm-specific X-ray stain for microscopic and nanoscopic computed tomography. Proceedings of the National Academy of Sciences of the United States of America. 115 (10), 2293-2298 (2018).
- Sperry, J. S., Donnelly, J. R., Tyree, M. T. A method for measuring hydraulic conductivity and embolism in xylem. Plant, Cell and Environment. 11, 35-40 (1988).
- Calvin, C. L. Host-formed tyloses in vessels of the mistletoe Phoradendron (Viscaceae). IAWA Journal. 18 (2), 117-126 (1997).
- Teixeira-Costa, L., Ceccantini, G. Embolism increase and anatomical modifications caused by a parasitic plant. IAWA Journal. 36 (2), 138-151 (2015).
- Ellmore, G. S., Ewers, F. W. Fluid flow in the outermost xylem increment of a ring-porous tree, Ulmus americana. American Journal of Botany. 73 (12), 1771-1774 (1986).
- Ellis, E. A. Staining sectioned biological specimens for transmission electron microscopy: Conventional and En bloc stains. Electron Microscopy: Methods and Protocols. 1117, 57-72 (2014).
- Brodersen, C. R., McElrone, A. J., Choat, B., Matthews, M. A., Shackel, K. A. The dynamics of embolism repair in xylem: In vivo visualizations using high-resolution computed tomography. Plant Physiology. 154 (3), 1088-1095 (2010).
- Brodersen, C. R., et al. Automated analysis of three-dimensional xylem networks using high-resolution computed tomography. New Phytologist. 191 (4), 1168-1179 (2011).
- Lee, K., et al. Visualizing plant development and gene expression in three dimensions using optical projection tomography. Plant Cell. 18 (9), 2145-2156 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon