Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un modelo confiable de colgajo fascio-cutáneo porcino para estudios de bioingeniería de aloinjertos compuestos vascularizados
En este artículo
Resumen
El presente protocolo describe el modelo de colgajo fascio-cutáneo porcino y su uso potencial en la investigación de tejidos compuestos vascularizados.
Resumen
Los aloinjertos compuestos vascularizados (VCA), como el trasplante de mano, cara o pene, representan el tratamiento de vanguardia para defectos cutáneos devastadores, fallidos por los primeros pasos de la escalera reconstructiva. A pesar de los prometedores resultados estéticos y funcionales, el principal factor limitante sigue siendo la necesidad de una inmunosupresión de por vida aplicada drásticamente y sus riesgos médicos bien conocidos, evitando indicaciones más amplias. Por lo tanto, levantar la barrera inmune en VCA es esencial para inclinar la balanza ética y mejorar la calidad de vida de los pacientes utilizando las técnicas quirúrgicas más avanzadas. La creación de novo de un injerto específico para el paciente es el próximo avance en el trasplante reconstructivo. Utilizando técnicas de ingeniería tisular, los VCA pueden liberarse de células donantes y personalizarse para el receptor a través de la perfusión-descelularización-recelularización. Para desarrollar estas nuevas tecnologías, es necesario un modelo de VCA animal a gran escala. Por lo tanto, los colgajos fascio-cutáneos porcinos, compuestos de piel, grasa, fascia y vasos, representan un modelo ideal para estudios preliminares en VCA. Sin embargo, la mayoría de los modelos VCA descritos en la literatura incluyen músculo y hueso. Este trabajo reporta una técnica confiable y reproducible para la cosecha de colgajo fascio-cutáneo safeno en cerdos, una herramienta práctica para diversos campos de investigación, especialmente la ingeniería de tejidos compuestos vascularizados.
Introducción
Los aloinjertos compuestos vascularizados (VCA) han revolucionado el tratamiento de las pérdidas de partes del cuerpo difíciles de reparar, como las manos, la cara y el pene 1,2,3. Desafortunadamente, los primeros resultados a largo plazo4 han demostrado que la administración a lo largo de toda la vida de agentes inmunosupresores en dosis altas puede conducir a afecciones médicas colaterales graves, como diabetes, infecciones, neoplasia y disfunción renovascular5. Últimamente, los equipos expertos de VCA han tenido que gestionar el riesgo de rechazo crónico que conduce a la pérdida del injerto y realizar los primeros casos de retrasplante de cara 6,7. Se han descrito diferentes estrategias para superar las limitaciones de la inmunosupresión en VCA. El primero se basa en establecer tolerancia al injerto a largo plazo mediante la inducción de un estado de quimerismo mixto inmune en el receptor del aloinjerto 8,9. El segundo implica la creación de novo de un injerto específico para el paciente a través de la ingeniería de tejidos.
Recientemente, la descelularización por perfusión de tejidos biológicos ha generado andamios nativos de matriz extracelular (MEC), permitiendo la preservación de la red vascular y la arquitectura tisular de órganos enteros10. Por lo tanto, la recelularización de estas ECM con células específicas del receptor crearía un injerto personalizado libre de restricciones inmunes. En la investigación sobre bioingeniería VCA, múltiples equipos han descelularizado y obtenido dicha ECM preservando toda la arquitectura11,12,13. Sin embargo, el proceso de recelularización sigue siendo desafiante y no ha tenido éxito en modelos animales grandes14,15. El desarrollo de estas tecnologías innovadoras crea la necesidad de modelos de tejido compuesto de animales grandes fiables y reproducibles. Los modelos porcinos representan la mejor opción en la línea de desarrollo de la bioingeniería, ya que la piel porcina presenta las características anatómicas y fisiológicas más cercanas a la piel humana16. El uso de colgajos fasciocutáneos (FCF) es ideal durante los primeros pasos hacia la creación de injertos de tejido compuesto vascularizados "a medida". De hecho, FCF es un modelo elemental de VCA que contiene piel, grasa, fascia y células endoteliales. Una descripción de los colgajos miocutáneos porcinos17 y los colgajos osteomiocutáneos18 se puede encontrar en la literatura. Sin embargo, hay una falta de enfoque en las técnicas de recolección de colgajos fascio-cutáneos.
Por lo tanto, este estudio tiene como objetivo proporcionar a los investigadores una descripción detallada de una técnica de obtención de FCF safena porcina y representar todas las características del colgajo para su uso en muchos campos de investigación, especialmente en ingeniería de tejidos compuestos vascularizados.
Protocolo
Todos los animales recibieron atención humana siguiendo la Guía del Instituto Nacional de Salud para el Cuidado y Uso de Animales de Laboratorio. El Comité Institucional de Cuidado y Uso de Animales aprobó el protocolo experimental (IACUC- protocolo #2020N000015). Se utilizaron siete cerdos hembras de Yorkshire (20-25 kg) para todos los experimentos.
1. Cuidados preoperatorios
- Ayune al animal para obtener alimentos sólidos 12 h antes de la cirugía.
- Sedar al animal con 4,4 mg/kg de telazol, 2,2 mg/kg de xilazina y 0,04 mg/kg (IM) de sulfato de atropina (ver Tabla de materiales).
- Coloque un catéter intravenoso periférico de 18 G en una vena del oído.
- Intubar a los cerdos con un tubo endotraqueal apropiado (se pueden usar 6-15 mm para cerdos de 10-200 kg) y conectar el tubo a un ventilador. Administrar analgesia preoperatoria con buprenorfina (0,05 mg/kg, IM) (ver Tabla de Materiales).
2. Monitorización intraoperatoria
- Mantener la anestesia con una mezcla de inhalación de isoflurano al 1,5%-3% con flujo de oxígeno de 1,5 L/min.
- Controle continuamente la frecuencia cardíaca, la oximetría de pulso y elCO2 espiratorio final. Evalúe la presión arterial y la temperatura corporal cada 5 minutos.
NOTA: El rango objetivo para la frecuencia cardíaca está entre 90-100 latidos / min, la saturación de oxígeno debe ser superior al 93% y el rango deCO2 al final de la espiración está entre 5% -6% de CO2. - Administrar 5-10 mL/kg por hora de solución salina al 0,9% durante todo el procedimiento para regular la presión arterial media entre 60 mmHg y 90 mmHg.
3. Contratación bilateral de FCF safena
- Coloque al animal en posición supina. Afeite y frote tanto las ingles como las extremidades posteriores, incluya todas las extremidades posteriores en el sitio quirúrgico y cubra de manera estéril.
- Palpar el pulso de la arteria safena ~ 3 dedos de ancho medial desde la rótula y etiquetarlo.
- Identifica y dibuja los límites de la solapa.
NOTA: El límite superior es un eje paralelo al pliegue inguinal 3 cm por debajo de él. El límite lateral es un eje desde la columna ilíaca superior anterior hasta la parte medial de la rótula. - Dibujar un colgajo ovalado de 10 cm de diámetro centrado en el pedículo safeno y contenido en los límites del colgajo descritos anteriormente (paso 3.3).
- Haga una incisión cutánea de 1,5 cm con respecto a la porción distal del pedículo en el punto de referencia del colgajo.
- Abrir la fascia y disección roma para exponer la arteria safena y sus dos venas comitantes. Realizar una ligadura doble y separar en un solo paquete.
- Incise la piel restante del colgajo con una cuchilla.
- Use cauterio para abrir el tejido subcutáneo y la fascia circundante. Realice una hemostasia completa con fórceps bipolares (consulte la Tabla de materiales).
- Fije el componente de la piel del colgajo a la fascia subyacente con suturas 3-0 no absorbibles para evitar la tracción inadvertida y la interrupción de los vasos perforantes.
- Libere el colgajo de la gracilis diseccionando la fascia lejos del músculo.
NOTA: La parte distal del pedículo safeno corre en un plano entre el músculo gracilis y la fascia. La tensión adecuada y la hemostasia bipolar cautelosa de las ramas laterales son elementos cruciales para facilitar la disección pedicular. - Use un bisturí para hacer una incisión de 12 cm en el pliegue inguinal. Realizar una incisión perpendicular uniendo el pliegue inguinal a la parte proximal del colgajo. Levante la piel de conexión y abra la capa subcutánea con cauterio.
- Continúe la disección pedicular siguiendo los vasos safenos hacia abajo hacia los vasos femorales.
NOTA: La porción proximal del pedículo safeno puede correr a través del tabique intermuscular o sumergirse en el músculo gracilis. - Esqueletizar los vasos femorales y ligarlos distalmente a la rama safena en dos haces separados. Continuar la disección de los vasos femorales de distal a proximal hasta alcanzar el nivel del ligamento inguinal. Use fórceps bipolares para cauterizar o clips vasculares y lazos de seda 2-0 para ligar los vasos femorales profundos, luego corte.
NOTA: Los clips vasculares también se pueden usar antes de cortar los vasos. - Repita los pasos 3.2-3.13 en la extremidad posterior contralateral para cosechar el segundo colgajo safeno.
- Heparinizar al animal con una inyección intravenosa (IV) de heparina (100 UI/kg) 5 min antes del paso 3.16.
- Ligate el pedículo femoral (arteria y vena) lo más proximal posible al ligamento inguinal y separa el colgajo del cerdo donante.
- Dilatar los extremos del vaso femoral e insertar un angiocatéter de 20 G tanto en la arteria como en la vena. Use lazos de seda 3-0 para asegurar el catéter a los vasos.
- Enjuague lentamente la arteria fascio-cutánea con 10 ml de solución salina de heparina (100 UI/ml) hasta que se observe una salida venosa clara (Figura 1).
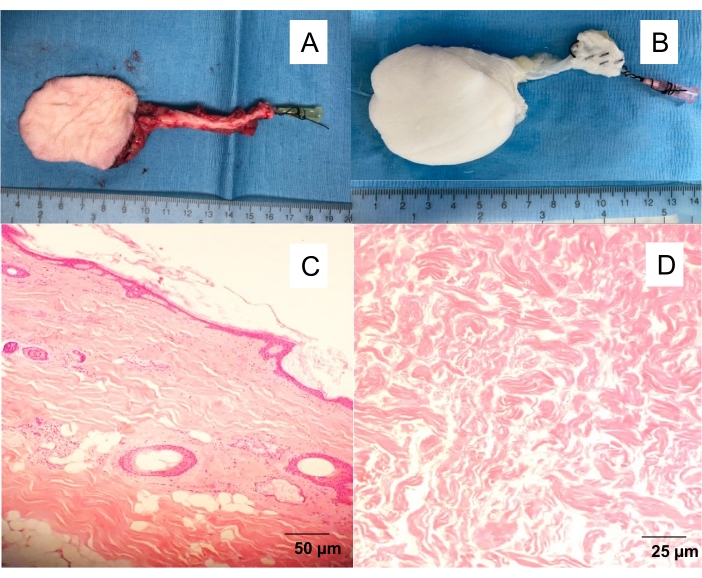
Figura 1: Colgajo fasciocutáneo safeno nativo y descelularizado. (A) Colgajo cutáneo aislado con un angiocatéter de 20 G insertado en la arteria femoral, que permite lavar el colgajo de la sangre y proceder a diferentes experimentos (angiografía, descelularización por perfusión). (B) Colgajo de piel descelularizado. Descelularización de perfusión que produce andamios blancos acelulares después de 10 días de perfusión detergente. Secciones transversales de espesor total teñidas con H&E de (C) colgajo de piel nativa y (D) colgajo de piel descelularizado. Haga clic aquí para ver una versión más grande de esta figura.
- Eutanasia al animal con una inyección intravenosa de fenobarbital sódico (100 mg/kg). Confirmar la muerte por la ausencia de latidos cardíacos y movimientos respiratorios.
Resultados
Este trabajo en animales vivos fue precedido por la determinación del perforasoma safeno en tres especímenes cadavéricos (Figura 2). Se inyectó una solución de relleno coloreada en la arteria safena para opacificar la red vascular específica proveniente de la arteria. La solución está compuesta de 10 ml de agente de glicerina de color azul mezclado con 10 ml del agente diluyente (ver Tabla de materiales). Esto generó un mapa coloreado de la piel vascularizada por la...
Discusión
Este artículo describe un colgajo fasciocutáneo confiable y reproducible cosechado en extremidades posteriores porcinas. Seguir este protocolo quirúrgico paso a paso permitirá la obtención de dos colgajos en un solo animal en menos de 2 h. El paso más crítico de la cirugía es la esqueletización del pedículo vascular dentro de las fibras musculares de gracilis, que requiere una disección completa por parte de un cirujano experto. Asegurar la piel a la fascia con suturas cutáneas es un consejo crucial para evit...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por las subvenciones #85127 (BEU y CLC) y #84702 (AA) de los Hospitales Shriners para Niños. Los autores desean agradecer a la fundación "Gueules Cassées" por el apoyo salarial a los becarios involucrados en ese proyecto.
Materiales
| Name | Company | Catalog Number | Comments |
| 18 G angiocatheter | BD Insyte Autoguard | 381409 | |
| 20 G angiocatheter | BD Insyte Autoguard | 381411 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Atropine Sulfate | AdvaCare | 212-868 | |
| Bipolar cords | ASSI | 228000C | |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Endotrachel tube | Jorgensen Labs | JO615X | size from 6 to 15mm depending on the pig weight |
| Ethilon 3-0 16 mm 3/8 | Ethicon | MPVCP683H | |
| Euthasol | Virbac AH | 200-071 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Metzenbaum scissors 180 mm | B Braun | BC606R | |
| Microfil blue | Flow tech | LMV-120 | |
| Microfil dilution | Flow tech | LMV-112 | colored filing solution |
| Monopolar knife | ASSI | 221230C | |
| N°15 scalpel blade | Swann Morton | NS11 | |
| Omnipaque | General Electric | 4080358 | contrast product |
| Perma-Hand Silk 3-0 | Ethicon | A184H | |
| Small Ligaclip | Ethicon | MCM20 | |
| Stevens scissors 115 mm | B Braun | BC008R | |
| Telazol | Zoetis | 106-111 | |
| Xylamed (xylazine) | Bimeda | 200-529 |
Referencias
- Dubernard, J. M., et al. Human hand allograft: Report on first 6 months. The Lancet. 353 (9161), 1315-1320 (1999).
- Meningaud, J. P., et al. Procurement of total human face graft for allotransplantation: A preclinical study and the first clinical case. Plastic and Reconstructive Surgery. 126 (4), 1181-1190 (2010).
- Cetrulo, C. L., et al. Penis transplantation: First US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Lantieri, L., et al. Face transplant: Long-term follow-up and results of a prospective open study. Lancet. 388 (10052), 1398-1407 (2016).
- Derek, E., Dhanireddy, K. Immunosuppression. Current Opinion in Organ Transplantation. 17 (6), 616-618 (2012).
- Lantieri, L., et al. First human facial retransplantation: 30-month follow-up. Lancet. 396 (10264), 1758-1765 (2020).
- Kauke, M., et al. Full facial retransplantation in a female patient-Technical, immunologic, and clinical considerations. American Journal of Transplantation. 21 (10), 3472-3480 (2021).
- Leonard, D. A., et al. Vascularized composite allograft tolerance across MHC barriers in a large animal model. American Journal of Transplantation. 14 (2), 343-355 (2014).
- Kawai, T., et al. HLA-mismatched renal transplantation without maintenance immunosuppression. The New England Journal of Medicine. 368 (19), 1850-1852 (2013).
- Badylak, S. F., Taylor, D., Uygun, K. Whole-organ tissue engineering: Decellularization and recellularization of three-dimensional matrix scaffolds. Annual Review of Biomedical Engineering. 13, 27-53 (2011).
- Jank, B. J., et al. Creation of a bioengineered skin flap scaffold with a perfusable vascular pedicle. Tissue Engineering Part A. 23 (13-14), 696-707 (2017).
- Jank, B. J., et al. Engineered composite tissue as a bioartificial limb graft. Biomaterials. 61, 246-256 (2015).
- Duisit, J., et al. Decellularization of the porcine ear generates a biocompatible, nonimmunogenic extracellular matrix platform for face subunit bioengineering. Annals of Surgery. 267 (6), 1191-1201 (2018).
- Lupon, E., et al. Engineering Vascularized composite allografts using natural scaffolds: A systematic review. Tissue Engineering Part B: Reviews. , (2021).
- Duisit, J., Maistriaux, L., Bertheuil, N., Lellouch, A. G. Engineering vascularized composite tissues by perfusion decellularization/recellularization: Review. Current Transplantation Reports. 8, 44-56 (2021).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration: Official Publication of the Wound Healing Society [and] the European Tissue Repair Society. 9 (2), 66-76 (2001).
- Haughey, B. H., Panje, W. R. A porcine model for multiple musculocutaneous flaps. The Laryngoscope. 99 (2), 204-212 (1989).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. Journal of Visualized Experiments. (80), e50475 (2013).
- Rosh, E. H., Vistnes, L. M., Ksander, G. A. The panniculus carnosus in the domestic pic. Plastic and Reconstructive Surgery. 59 (1), 94-97 (1977).
- Alessa, M. A., et al. Porcine as a training module for head and neck microvascular reconstruction. Journal of Visualized Experiments. (139), e58104 (2018).
- Minqiang, X., Jie, L., Dali, M., Lanhua, M. Transmidline abdominal skin flap model in pig: Refinements and advancements. Journal of Reconstructive Microsurgery. 28 (02), 111-118 (2012).
- Bodin, F., et al. Porcine model for free-flap breast reconstruction training. Journal of Plastic, Reconstructive & Aesthetic Surgery. 68 (10), 1402-1409 (2015).
- Kadono, K., Gruszynski, M., Azari, K., Kupiec-Weglinski, J. W. Vascularized composite allotransplantation versus solid organ transplantation: Innate-adaptive immune interphase. Current Opinion in Organ Transplantation. 24 (6), 714-720 (2019).
- Kruit, A. S., et al. Rectus Abdominis flap replantation after 18 h hypothermic extracorporeal perfusion-A Porcine Model. Journal of Clinical Medicine. 10 (17), 3858 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados