É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um modelo confiável de retalho fasciocutâneo suíno para estudos de bioengenharia de aloenxertos compostos vascularizados
Neste Artigo
Resumo
O presente protocolo descreve o modelo de retalho fascio-cutâneo suíno e seu potencial uso na pesquisa de tecidos compostos vascularizados.
Resumo
Os aloenxertos compostos vascularizados (VCA), como o transplante de mão, face ou pênis, representam o tratamento de ponta para defeitos devastadores da pele, falhados pelos primeiros passos da escada reconstrutiva. Apesar dos resultados estéticos e funcionais promissores, o principal fator limitante continua sendo a necessidade de uma imunossupressão ao longo da vida drasticamente aplicada e seus riscos médicos bem conhecidos, impedindo indicações mais amplas. Portanto, levantar a barreira imunológica na VCA é essencial para inclinar a escala ética e melhorar a qualidade de vida dos pacientes usando as técnicas cirúrgicas mais avançadas. A criação de novo de um enxerto específico do paciente é o próximo avanço no transplante reconstrutivo. Usando técnicas de engenharia de tecidos, os VCAs podem ser liberados de células doadoras e personalizados para o receptor através de perfusão-descelularização-recelularização. Para desenvolver essas novas tecnologias, é necessário um modelo de VCA animal em larga escala. Assim, os retalhos fasciocutâneos suínos, compostos por pele, gordura, fáscia e vasos, representam um modelo ideal para estudos preliminares em VCA. No entanto, a maioria dos modelos de VCA descritos na literatura inclui músculo e osso. Este trabalho relata uma técnica confiável e reprodutível para a colheita de retalho fasciocutâneo de safena em suínos, uma ferramenta prática para diversos campos de pesquisa, especialmente a engenharia de tecidos compostos vascularizados.
Introdução
Os aloenxertos compostos vascularizados (VCA) revolucionaram o tratamento de perdas de partes do corpo de difícil reparo, como mãos, face e pênis 1,2,3. Infelizmente, os primeiros resultados a longo prazo4 mostraram que a administração ao longo da vida de agentes imunossupressores de altas doses pode levar a condições médicas colaterais graves, incluindo diabetes, infecções, neoplasias e disfunção reno-vascular5. Ultimamente, equipes especializadas de VCA têm tido que gerenciar o risco de rejeição crônica que leva à perda do enxerto e realizar os primeiros casos de retransplante de face 6,7. Diferentes estratégias têm sido descritas para superar as limitações da imunossupressão na VCA. A primeira baseia-se no estabelecimento de tolerância do enxerto a longo prazo, induzindo um estado de quimerismo misto imune no receptor do aloenxerto 8,9. O segundo envolve a criação de novo de um enxerto específico do paciente através da engenharia de tecidos.
Recentemente, a descelularização perfusional de tecidos biológicos tem gerado andaimes de matriz extracelular nativa (MEC), permitindo a preservação da rede vascular e da arquitetura tecidual de órgãos inteiros10. Assim, a recelularização dessas ECM com células específicas do receptor criaria um enxerto personalizado livre de restrições imunológicas. Em pesquisas sobre bioengenharia de VCA, múltiplas equipes descelularizaram e obtiveram tal ECM preservando toda a arquitetura11,12,13. No entanto, o processo de recelularização continua desafiador e não tem sido bem-sucedido em modelos animais de grandeporte 14,15. O desenvolvimento dessas tecnologias inovadoras cria a necessidade de modelos confiáveis e reprodutíveis de tecidos compostos de grandes animais. Os modelos suínos representam a maior escolha no pipeline de desenvolvimento da bioengenharia, pois a pele suína apresenta as características anatômicas e fisiológicas mais próximas da pele humana16. O uso de retalhos fasciocutâneos (FCF) é ideal durante os primeiros passos para a criação de enxertos de tecido composto vascularizado 'sob medida'. De fato, o FCF é um modelo elementar de VCA contendo pele, gordura, fáscia e células endoteliais. A descrição de retalhos miocutâneos suínos17 e retalhos osteomiocutâneos18 pode ser encontrada na literatura. No entanto, há uma falta de foco nas técnicas de colheita de retalhos fáscio-cutâneos.
Assim, este estudo tem como objetivo fornecer aos pesquisadores uma descrição detalhada de uma técnica de aquisição de FCF safena suína e descrever todas as características do retalho para sua utilização em muitos campos de pesquisa, especialmente na engenharia de tecidos compostos vascularizados.
Protocolo
Todos os animais receberam cuidados humanos seguindo o Guia do Instituto Nacional de Saúde para o Cuidado e Uso de Animais de Laboratório. O Comitê Institucional de Cuidado e Uso de Animais aprovou o protocolo experimental (IACUC- protocolo #2020N000015). Sete fêmeas de porcos Yorkshire (20-25 kg) foram utilizadas para todos os experimentos.
1. Cuidados pré-operatórios
- Jejue o animal para alimentos sólidos 12 h antes da cirurgia.
- Sedadar o animal com 4,4 mg/kg de Telazol, 2,2 mg/kg de Xilazina e 0,04 mg/kg (IM) de sulfato de atropina (ver Tabela de Materiais).
- Coloque um cateter intravenoso periférico de 18 G em uma veia da orelha.
- Intubar os suínos com um tubo endotraqueal apropriado (6-15 mm pode ser usado para porcos de 10-200 kg) e conecte o tubo a um ventilador. Administrar analgesia pré-operatória com buprenorfina (0,05 mg/kg, IM) (ver Tabela de Materiais).
2. Monitorização intraoperatória
- Manter a anestesia com uma mistura inalatória de isoflurano a 1,5%-3% com fluxo de oxigênio de 1,5 L/min.
- Monitore continuamente a frequência cardíaca, a oximetria de pulso e o CO2 final da maré. Avalie a pressão arterial e a temperatura corporal a cada 5 min.
NOTA: O intervalo alvo para a frequência cardíaca está entre 90-100 batimentos / min, a saturação de oxigênio deve ser superior a 93% e a faixa de CO 2 da maré final está entre 5% e 6% do CO2. - Administrar 5-10 mL/kg por hora de solução salina a 0,9% durante todo o procedimento para regular a pressão arterial média entre 60 mmHg e 90 mmHg.
3. Aquisição bilateral de FCF safeno
- Coloque o animal em decúbito dorsal. Raspe e esfregue as virilhas e os membros posteriores, inclua todos os membros posteriores no local da cirurgia e cubra de forma estéril.
- Apalpar o pulso da artéria safena ~ 3 larguras dos dedos medial da patela e marcá-lo.
- Identifique e desenhe os limites do retalho.
NOTA: O limite superior é um eixo paralelo ao vinco inguinal 3 cm abaixo dele. O limite lateral é um eixo da espinha ilíaca anterossuperior até a parte medial da patela. - Desenhar um retalho oval de 10 cm de diâmetro centrado no pedículo safeno e contido nos limites do retalho descritos anteriormente (passo 3.3).
- Faça uma incisão cutânea de 1,5 cm em relação à porção distal do pedículo no marco do retalho.
- Abra a fáscia e disseque contundente para expor a artéria safena e suas duas veias comitantes. Execute uma ligadura dupla e separe em um pacote.
- Incise a pele restante do retalho com uma lâmina.
- Use cauterização para abrir o tecido subcutâneo e a fáscia circundante. Realize hemostasia completa usando pinça bipolar (ver Tabela de Materiais).
- Anexe o componente cutâneo do retalho à fáscia subjacente com suturas não absorvíveis 3-0 para evitar a tração inadvertida e a ruptura dos vasos perfurantes.
- Liberte o retalho da grácil dissecando a fáscia para longe do músculo.
NOTA: A parte distal do pedículo da safena corre em um plano entre o músculo grácil e a fáscia. A tensão apropriada e a hemostasia bipolar cautelosa dos ramos laterais são elementos cruciais para facilitar a dissecção do pedículo. - Use um bisturi para fazer uma incisão de 12 cm no vinco inguinal. Realize uma incisão perpendicular unindo o vinco inguinal à parte proximal do retalho. Levante a pele conectada e abra a camada subcutânea usando cauterização.
- Continue a dissecção do pedículo seguindo os vasos safenos para baixo em direção aos vasos femorais.
NOTA: A porção proximal do pedículo da safena pode percorrer o septo intermuscular ou mergulhar no músculo grácil. - Esqueletizar os vasos femorais e ligá-los distalmente ao ramo safeno em dois feixes separados. Continue a dissecção dos vasos femorais do distal para o proximal até atingir o nível do ligamento inguinal. Use pinça bipolar para cauterizar ou clipes vasculares e 2-0 laços de seda para ligar os vasos femorais profundos, em seguida, corte.
NOTA: Os clipes vasculares também podem ser usados antes de cortar os vasos. - Repita os passos 3.2-3.13 no membro posterior contralateral para colher o segundo retalho safeno.
- Heparinizar o animal com uma injeção intravenosa (IV) de heparina (100 UI/kg) 5 min antes do passo 3.16.
- Ligate o pedículo femoral (artéria e veia) o mais proximal possível do ligamento inguinal e separe o retalho do porco doador.
- Dilate as extremidades do vaso femoral e insira um angiocateter 20 G na artéria e na veia. Use laços de seda 3-0 para prender o cateter aos vasos.
- Lavar lentamente a artéria do retalho fasciocutâneo com 10 mL de solução salina de heparina (100 UI/mL) até que se observe um fluxo venoso claro (Figura 1).
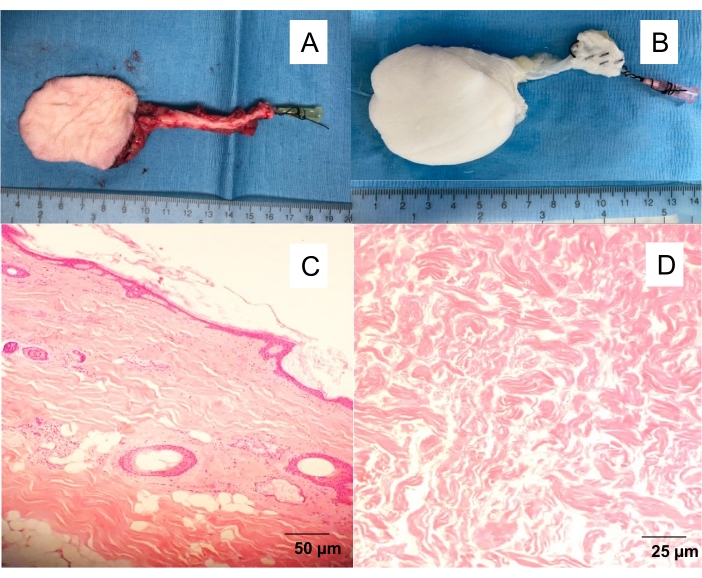
Figura 1: Retalho fasciocutâneo safeno nativo e descelularizado. (A) Retalho cutâneo isolado com angiocateter 20 G inserido na artéria femoral, permitindo lavar o retalho do sangue e prosseguir com diferentes experimentos (angiografia, descelularização por perfusão). (B) Retalho cutâneo descelularizado. Descelularização da perfusão produzindo andaimes brancos e acelulares após 10 dias de perfusão em detergente. Seções transversais de espessura total coradas por H&E do (C) retalho cutâneo nativo e (D) retalho cutâneo descelularizado. Por favor, clique aqui para ver uma versão maior desta figura.
- Eutanasiar o animal com uma injeção IV de fenobarbital sódico (100 mg/kg). Confirmar a morte pela ausência de batimentos cardíacos e movimentos respiratórios.
Resultados
Este trabalho em animais vivos foi precedido pela determinação do perforassomo safeno em três espécimes cadavéricos (Figura 2). Uma solução de enchimento colorida foi injetada na artéria safena para opacificar a rede vascular específica proveniente da artéria. A solução é composta por 10 ml de agente glicerina de cor azul misturado com 10 ml do agente diluente (ver Tabela de Materiais). Isso gerou um mapa colorido da pele vascularizada pela artéria safena e per...
Discussão
Este artigo descreve um retalho fasciocutâneo confiável e reprodutível colhido em membros posteriores de suínos. Seguir este protocolo cirúrgico passo-a-passo permitirá a obtenção de dois retalhos em apenas um animal em menos de 2 h. A etapa mais crítica da cirurgia é a esqueletização do pedículo vascular dentro das fibras musculares do grácil, o que requer uma dissecção completa por um cirurgião qualificado. Fixar a pele à fáscia usando suturas cutâneas é uma dica crucial para evitar um efeito de ci...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi financiado pelos subsídios Shriners Hospitals for Children #85127 (BEU e CLC) e #84702 (AA). Os autores gostariam de agradecer à fundação "Gueules Cassées" pelo apoio salarial aos bolsistas envolvidos nesse projeto.
Materiais
| Name | Company | Catalog Number | Comments |
| 18 G angiocatheter | BD Insyte Autoguard | 381409 | |
| 20 G angiocatheter | BD Insyte Autoguard | 381411 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Atropine Sulfate | AdvaCare | 212-868 | |
| Bipolar cords | ASSI | 228000C | |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Endotrachel tube | Jorgensen Labs | JO615X | size from 6 to 15mm depending on the pig weight |
| Ethilon 3-0 16 mm 3/8 | Ethicon | MPVCP683H | |
| Euthasol | Virbac AH | 200-071 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Metzenbaum scissors 180 mm | B Braun | BC606R | |
| Microfil blue | Flow tech | LMV-120 | |
| Microfil dilution | Flow tech | LMV-112 | colored filing solution |
| Monopolar knife | ASSI | 221230C | |
| N°15 scalpel blade | Swann Morton | NS11 | |
| Omnipaque | General Electric | 4080358 | contrast product |
| Perma-Hand Silk 3-0 | Ethicon | A184H | |
| Small Ligaclip | Ethicon | MCM20 | |
| Stevens scissors 115 mm | B Braun | BC008R | |
| Telazol | Zoetis | 106-111 | |
| Xylamed (xylazine) | Bimeda | 200-529 |
Referências
- Dubernard, J. M., et al. Human hand allograft: Report on first 6 months. The Lancet. 353 (9161), 1315-1320 (1999).
- Meningaud, J. P., et al. Procurement of total human face graft for allotransplantation: A preclinical study and the first clinical case. Plastic and Reconstructive Surgery. 126 (4), 1181-1190 (2010).
- Cetrulo, C. L., et al. Penis transplantation: First US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Lantieri, L., et al. Face transplant: Long-term follow-up and results of a prospective open study. Lancet. 388 (10052), 1398-1407 (2016).
- Derek, E., Dhanireddy, K. Immunosuppression. Current Opinion in Organ Transplantation. 17 (6), 616-618 (2012).
- Lantieri, L., et al. First human facial retransplantation: 30-month follow-up. Lancet. 396 (10264), 1758-1765 (2020).
- Kauke, M., et al. Full facial retransplantation in a female patient-Technical, immunologic, and clinical considerations. American Journal of Transplantation. 21 (10), 3472-3480 (2021).
- Leonard, D. A., et al. Vascularized composite allograft tolerance across MHC barriers in a large animal model. American Journal of Transplantation. 14 (2), 343-355 (2014).
- Kawai, T., et al. HLA-mismatched renal transplantation without maintenance immunosuppression. The New England Journal of Medicine. 368 (19), 1850-1852 (2013).
- Badylak, S. F., Taylor, D., Uygun, K. Whole-organ tissue engineering: Decellularization and recellularization of three-dimensional matrix scaffolds. Annual Review of Biomedical Engineering. 13, 27-53 (2011).
- Jank, B. J., et al. Creation of a bioengineered skin flap scaffold with a perfusable vascular pedicle. Tissue Engineering Part A. 23 (13-14), 696-707 (2017).
- Jank, B. J., et al. Engineered composite tissue as a bioartificial limb graft. Biomaterials. 61, 246-256 (2015).
- Duisit, J., et al. Decellularization of the porcine ear generates a biocompatible, nonimmunogenic extracellular matrix platform for face subunit bioengineering. Annals of Surgery. 267 (6), 1191-1201 (2018).
- Lupon, E., et al. Engineering Vascularized composite allografts using natural scaffolds: A systematic review. Tissue Engineering Part B: Reviews. , (2021).
- Duisit, J., Maistriaux, L., Bertheuil, N., Lellouch, A. G. Engineering vascularized composite tissues by perfusion decellularization/recellularization: Review. Current Transplantation Reports. 8, 44-56 (2021).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration: Official Publication of the Wound Healing Society [and] the European Tissue Repair Society. 9 (2), 66-76 (2001).
- Haughey, B. H., Panje, W. R. A porcine model for multiple musculocutaneous flaps. The Laryngoscope. 99 (2), 204-212 (1989).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. Journal of Visualized Experiments. (80), e50475 (2013).
- Rosh, E. H., Vistnes, L. M., Ksander, G. A. The panniculus carnosus in the domestic pic. Plastic and Reconstructive Surgery. 59 (1), 94-97 (1977).
- Alessa, M. A., et al. Porcine as a training module for head and neck microvascular reconstruction. Journal of Visualized Experiments. (139), e58104 (2018).
- Minqiang, X., Jie, L., Dali, M., Lanhua, M. Transmidline abdominal skin flap model in pig: Refinements and advancements. Journal of Reconstructive Microsurgery. 28 (02), 111-118 (2012).
- Bodin, F., et al. Porcine model for free-flap breast reconstruction training. Journal of Plastic, Reconstructive & Aesthetic Surgery. 68 (10), 1402-1409 (2015).
- Kadono, K., Gruszynski, M., Azari, K., Kupiec-Weglinski, J. W. Vascularized composite allotransplantation versus solid organ transplantation: Innate-adaptive immune interphase. Current Opinion in Organ Transplantation. 24 (6), 714-720 (2019).
- Kruit, A. S., et al. Rectus Abdominis flap replantation after 18 h hypothermic extracorporeal perfusion-A Porcine Model. Journal of Clinical Medicine. 10 (17), 3858 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados