このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
血管化複合同種移植片バイオエンジニアリング研究のための信頼性の高いブタ筋膜皮膚フラップモデル
要約
本プロトコルは、ブタ筋膜皮膚皮弁モデルおよび血管新生複合組織研究におけるその潜在的な使用について説明しています。
要約
手、顔、陰茎移植などの血管化複合同種移植片(VCA)は、再建のはしごの最初のステップで失敗した壊滅的な皮膚の欠陥の最先端の治療法を表しています。有望な審美的および機能的転帰にもかかわらず、主な制限要因は、生涯にわたる免疫抑制とそのよく知られた医学的リスクの必要性であり、より広範な適応症を妨げています。したがって、VCAの免疫バリアを解除することは、倫理的尺度を傾け、最先端の外科的技術を使用して患者の生活の質を向上させるために不可欠です。患者特異的移植片の de novo の作成は、再建移植における今後のブレークスルーです。組織工学技術を使用して、VCAをドナー細胞から解放し、灌流-脱細胞化-再細胞化を通じてレシピエントに合わせてカスタマイズすることができます。これらの新技術を開発するためには、大規模な動物VCAモデルが必要です。したがって、皮膚、脂肪、筋膜、および血管で構成されるブタ筋膜皮膚フラップは、VCAでの予備研究の理想的なモデルを表しています。それにもかかわらず、文献に記載されているほとんどのVCAモデルには、筋肉と骨が含まれています。この研究は、豚の伏在筋膜皮膚皮弁採取のための信頼性が高く再現性のある技術であり、さまざまな研究分野、特に血管新生複合組織工学の実用的なツールであると報告しています。
概要
血管化複合同種移植片(VCA)は、手、顔、陰茎などの修復が困難な身体部分の損失の治療に革命をもたらしました1,2,3。残念ながら、最初の長期アウトカム4は、高用量免疫抑制剤の生涯投与が、糖尿病、感染症、新生物、腎血管機能障害などの重篤な側副病状につながる可能性があることを示しています5。最近、専門家のVCAチームは、移植片の喪失につながる慢性的な拒絶反応のリスクを管理し、最初の顔の再移植症例を実行しなければなりませんでした6,7。VCAにおける免疫抑制の限界を克服するために、さまざまな戦略が説明されています。第1は、同種移植レシピエントにおいて免疫混合キメラ状態を誘導することによって長期移植片耐性を確立することに依存する8、9。2つ目は、組織工学による患者特異的移植片のde novo作成です。
最近、生物学的組織の灌流脱細胞化は、天然の細胞外マトリックス(ECM)足場を生成し、器官全体の血管網および組織構造の保存を可能にしている10。したがって、レシピエント特異的細胞によるこれらのECMの再細胞化は、免疫制約のないカスタマイズされた移植片を作成します。VCAバイオエンジニアリングの研究では、複数のチームが脱細胞化し、アーキテクチャ全体を保存するそのようなECMを取得しました11、12、13。しかしながら、再細胞化プロセスは依然として困難であり、大型動物モデルでは成功していない14、15。これらの画期的な技術を開発することで、信頼性が高く再現性のある大型動物複合組織モデルの必要性が生まれます。ブタの皮膚はヒトの皮膚に最も近い解剖学的および生理学的特徴を示すため、ブタモデルはバイオエンジニアリング発生パイプラインにおける最良の選択を表しています16。筋膜皮膚フラップ(FCF)の使用は、「調整された」血管新生複合組織移植片の作成に向けた最初のステップで理想的です。実際、FCFは、皮膚、脂肪、筋膜、および内皮細胞を含む基本的なVCAモデルです。ブタ筋皮膚フラップ17 および骨筋皮膚フラップ18 の説明は、文献に見出すことができる。それにもかかわらず、筋膜皮膚フラップ収穫技術への焦点が不足しています。
したがって、この研究は、研究者に豚伏在FCF調達技術の詳細な説明を提供し、多くの研究分野、特に血管新生複合組織工学で使用するためのフラップのすべての特性を示すことを目的としています。
プロトコル
すべての動物は、実験動物の世話と使用のための国立衛生研究所のガイドに従って人間の世話を受けました。施設動物管理および使用委員会は、実験プロトコル(IACUC-プロトコル#2020N000015)を承認しました。7匹の雌ヨークシャーブタ(20〜25kg)を全ての実験に使用した。
1.術前ケア
- 手術の12時間前に固形食のために動物を絶食させる。
- 4.4 mg / kgのテラゾール、2.2 mg / kgのキシラジン、および0.04 mg / kg(IM)の硫酸アトロピンで動物を鎮静させます( 材料の表を参照)。.
- 18Gの末梢静脈内カテーテルを耳静脈に配置します。
- 適切な気管内チューブ(10〜200 kgの豚には6〜15 mmを使用できます)で豚を挿管し、チューブを人工呼吸器に接続します。ブプレノルフィン(0.05 mg / kg、IM)による術前鎮痛を投与します( 材料の表を参照)。.
2.術中モニタリング
- 1.5 L / minの酸素流を含む1.5%〜3%イソフルランの吸入混合物で麻酔を維持します。.
- 心拍数、パルスオキシメトリ、潮汐終末CO2を継続的に監視します。5分ごとに血圧と体温を評価します。
注意: 心拍数の目標範囲は90〜100ビート/分で、酸素飽和度は93%より高くなければならず、潮汐終末CO 2範囲はCO2の5%〜6%です。 - 手順全体を通して毎時5〜10 mL / kgの0.9%生理食塩水を投与して、平均動脈圧を60 mmHgから90 mmHgに調節します。.
3. 二国間FCF調達
- 動物を仰臥位に置きます。鼠径部と後肢の両方を剃ってこすり洗いし、後肢全体を手術部位に含め、滅菌方法でドレープします。
- 膝蓋骨の内側にある伏在動脈~3本の指幅の脈拍を触診し、タグを付けます。
- フラップの限界を特定して描画します。
注:上限は、その3cm下の鼠径部のしわに平行な軸です。外側の限界は、上腸骨前棘から膝蓋骨の内側部分までの軸です。 - 伏在茎を中心とし、前述のフラップ制限に含まれる直径10cmの楕円形状のフラップを描きます(ステップ3.3)。
- フラップランドマークの茎の遠位部分に関して1.5cmの皮膚切開を行います。
- 筋膜を開き、鈍い解剖をして伏在動脈とその2つの大静脈を露出させます。二重合字を実行し、1つのバンドルに分けます。
- フラップの残りの皮膚を刃で切開します。
- 焼灼を使用して皮下組織と周囲の筋膜を開きます。双極鉗子を使用して徹底的な止血を行います( 材料の表を参照)。
- フラップの皮膚成分を下にある筋膜に3-0の非吸収性縫合糸で取り付けて、不注意による牽引や穿孔血管の破壊を防ぎます。
- 筋膜を筋肉から離して解剖することにより、フラシリスからフラップを解放します。
注:伏在茎の遠位部分は、グラシリス筋と筋膜の間の平面を走っています。側枝の適切な緊張と慎重な双極性止血は、茎の解剖を容易にするための重要な要素です。 - メスを使用して、鼠径部のしわを12cm切開します。鼠径部のしわをフラップの近位部に接合する垂直切開を行います。接続している皮膚を持ち上げ、焼灼を使用して皮下層を開きます。
- 伏在血管を大腿骨血管に向かってたどって椎弓根解剖を続けます。
注:伏在茎の近位部分は、筋肉間中隔を通過するか、グラシリス筋に飛び込むことができます。 - 大腿骨血管を骨格化し、2つの別々の束で伏在枝に遠位に結紮します。鼠径靭帯のレベルに達するまで、大腿骨血管の遠位から近位まで解剖を続ける。双極鉗子を使用して血管クリップを焼灼するか、2-0シルクタイを使用して大腿骨深部血管を結紮してから切断します。
注意: 血管を切断する前に血管クリップを使用することもできます。 - 反対側の後肢で手順3.2〜3.13を繰り返して、2番目の伏在皮弁を収穫します。
- ステップ3.16の5分前に静脈内(IV)ヘパリン注射(100IU / kg)で動物をヘパリン化します。.
- 大腿骨茎(動脈と静脈)を鼠径靭帯のできるだけ近位に結睭を付け、フラップをドナーブタから分離します。
- 大腿血管の端を拡張し、動脈と静脈の両方に20Gの血管カテーテルを挿入します。3-0シルクタイを使用してカテーテルを血管に固定します。
- 明確な静脈流出が観察されるまで、筋膜皮膚皮弁動脈を10 mLのヘパリン生理食塩水(100 IU / mL)でゆっくりと洗い流します(図1)。
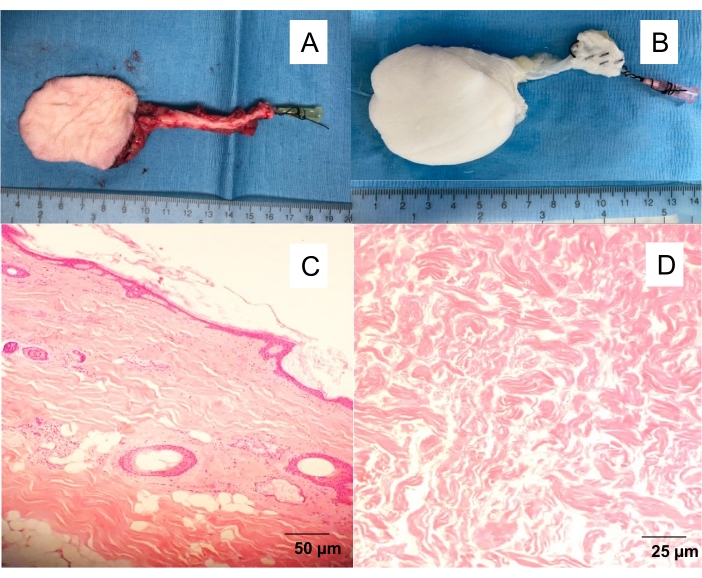
図1:ネイティブおよび脱細胞化された伏在筋膜皮膚フラップ 。 (A)大腿動脈に挿入された20G血管カテーテルを備えた孤立した皮膚フラップにより、血液からフラップを洗い流し、さまざまな実験(血管造影、灌流脱細胞化)を進めることができます。(B)脱細胞化皮膚フラップ。灌流脱細胞化により、10日間の界面活性剤灌流後に白色の無細胞足場が得られます。H&E染色された(C)天然皮膚皮弁および(D)脱細胞化皮膚皮弁の全層断面。 この図の拡大版を表示するには、ここをクリックしてください。
- フェノバルビタールナトリウム(100 mg / kg)のIV注射で動物を安楽死させます。.心拍や呼吸運動がないことで死亡を確認します。
結果
生きている動物に関するこの研究は、3つの死体標本上の伏在性穿孔を決定することによって先行されました(図2)。着色された充填溶液を伏在動脈に注入して、動脈から来る特定の血管網を不透明にしました。この溶液は、10 mLの青色グリセリン剤と10 mLの希釈剤を混合して構成されています( 材料の表を参照)。これにより、伏在動脈によって血管新生された...
ディスカッション
この記事では、豚の後肢で収穫された信頼性が高く再現可能な筋膜皮膚皮弁について説明します。この段階的な手術プロトコルに従うことで、2時間以内に1匹の動物に2つのフラップを調達することができます。手術の最も重要なステップは、グラシリス筋線維内の血管茎の骨格化であり、熟練した外科医による徹底的な解剖が必要です。皮膚縫合糸を使用して皮膚を筋膜に固定することは、?...
開示事項
著者は開示するものは何もありません。
謝辞
この作業は、シュラインズ小児病院助成金#85127(BEUおよびCLC)および#84702(AA)によって資金提供されました。著者は、そのプロジェクトに関与するフェローへの給与支援について、「グールカセ」財団に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 18 G angiocatheter | BD Insyte Autoguard | 381409 | |
| 20 G angiocatheter | BD Insyte Autoguard | 381411 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Atropine Sulfate | AdvaCare | 212-868 | |
| Bipolar cords | ASSI | 228000C | |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Endotrachel tube | Jorgensen Labs | JO615X | size from 6 to 15mm depending on the pig weight |
| Ethilon 3-0 16 mm 3/8 | Ethicon | MPVCP683H | |
| Euthasol | Virbac AH | 200-071 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Metzenbaum scissors 180 mm | B Braun | BC606R | |
| Microfil blue | Flow tech | LMV-120 | |
| Microfil dilution | Flow tech | LMV-112 | colored filing solution |
| Monopolar knife | ASSI | 221230C | |
| N°15 scalpel blade | Swann Morton | NS11 | |
| Omnipaque | General Electric | 4080358 | contrast product |
| Perma-Hand Silk 3-0 | Ethicon | A184H | |
| Small Ligaclip | Ethicon | MCM20 | |
| Stevens scissors 115 mm | B Braun | BC008R | |
| Telazol | Zoetis | 106-111 | |
| Xylamed (xylazine) | Bimeda | 200-529 |
参考文献
- Dubernard, J. M., et al. Human hand allograft: Report on first 6 months. The Lancet. 353 (9161), 1315-1320 (1999).
- Meningaud, J. P., et al. Procurement of total human face graft for allotransplantation: A preclinical study and the first clinical case. Plastic and Reconstructive Surgery. 126 (4), 1181-1190 (2010).
- Cetrulo, C. L., et al. Penis transplantation: First US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Lantieri, L., et al. Face transplant: Long-term follow-up and results of a prospective open study. Lancet. 388 (10052), 1398-1407 (2016).
- Derek, E., Dhanireddy, K. Immunosuppression. Current Opinion in Organ Transplantation. 17 (6), 616-618 (2012).
- Lantieri, L., et al. First human facial retransplantation: 30-month follow-up. Lancet. 396 (10264), 1758-1765 (2020).
- Kauke, M., et al. Full facial retransplantation in a female patient-Technical, immunologic, and clinical considerations. American Journal of Transplantation. 21 (10), 3472-3480 (2021).
- Leonard, D. A., et al. Vascularized composite allograft tolerance across MHC barriers in a large animal model. American Journal of Transplantation. 14 (2), 343-355 (2014).
- Kawai, T., et al. HLA-mismatched renal transplantation without maintenance immunosuppression. The New England Journal of Medicine. 368 (19), 1850-1852 (2013).
- Badylak, S. F., Taylor, D., Uygun, K. Whole-organ tissue engineering: Decellularization and recellularization of three-dimensional matrix scaffolds. Annual Review of Biomedical Engineering. 13, 27-53 (2011).
- Jank, B. J., et al. Creation of a bioengineered skin flap scaffold with a perfusable vascular pedicle. Tissue Engineering Part A. 23 (13-14), 696-707 (2017).
- Jank, B. J., et al. Engineered composite tissue as a bioartificial limb graft. Biomaterials. 61, 246-256 (2015).
- Duisit, J., et al. Decellularization of the porcine ear generates a biocompatible, nonimmunogenic extracellular matrix platform for face subunit bioengineering. Annals of Surgery. 267 (6), 1191-1201 (2018).
- Lupon, E., et al. Engineering Vascularized composite allografts using natural scaffolds: A systematic review. Tissue Engineering Part B: Reviews. , (2021).
- Duisit, J., Maistriaux, L., Bertheuil, N., Lellouch, A. G. Engineering vascularized composite tissues by perfusion decellularization/recellularization: Review. Current Transplantation Reports. 8, 44-56 (2021).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration: Official Publication of the Wound Healing Society [and] the European Tissue Repair Society. 9 (2), 66-76 (2001).
- Haughey, B. H., Panje, W. R. A porcine model for multiple musculocutaneous flaps. The Laryngoscope. 99 (2), 204-212 (1989).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. Journal of Visualized Experiments. (80), e50475 (2013).
- Rosh, E. H., Vistnes, L. M., Ksander, G. A. The panniculus carnosus in the domestic pic. Plastic and Reconstructive Surgery. 59 (1), 94-97 (1977).
- Alessa, M. A., et al. Porcine as a training module for head and neck microvascular reconstruction. Journal of Visualized Experiments. (139), e58104 (2018).
- Minqiang, X., Jie, L., Dali, M., Lanhua, M. Transmidline abdominal skin flap model in pig: Refinements and advancements. Journal of Reconstructive Microsurgery. 28 (02), 111-118 (2012).
- Bodin, F., et al. Porcine model for free-flap breast reconstruction training. Journal of Plastic, Reconstructive & Aesthetic Surgery. 68 (10), 1402-1409 (2015).
- Kadono, K., Gruszynski, M., Azari, K., Kupiec-Weglinski, J. W. Vascularized composite allotransplantation versus solid organ transplantation: Innate-adaptive immune interphase. Current Opinion in Organ Transplantation. 24 (6), 714-720 (2019).
- Kruit, A. S., et al. Rectus Abdominis flap replantation after 18 h hypothermic extracorporeal perfusion-A Porcine Model. Journal of Clinical Medicine. 10 (17), 3858 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved