Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Vaskülarize Kompozit Allogreftler Biyomühendislik Çalışmaları için Güvenilir Bir Domuz Fasyo-Kutanöz Flap Modeli
Bu Makalede
Özet
Bu protokol domuz fasyo-kutanöz flep modelini ve vaskülarize kompozit doku araştırmalarında potansiyel kullanımını tanımlamaktadır.
Özet
El, yüz veya penis nakli gibi vaskülarize Kompozit Allogreftler (VCA), rekonstrüktif merdivenin ilk adımlarında başarısız olan yıkıcı cilt kusurları için en ileri tedaviyi temsil eder. Umut verici estetik ve fonksiyonel sonuçlara rağmen, ana sınırlayıcı faktör, yaşam boyu büyük ölçüde uygulanan immünsüpresyon ihtiyacı ve daha geniş endikasyonları önleyen iyi bilinen tıbbi riskleri olmaya devam etmektedir. Bu nedenle, VCA'da bağışıklık bariyerinin kaldırılması, etik ölçeği değiştirmek ve en gelişmiş cerrahi teknikleri kullanarak hastaların yaşam kalitesini artırmak için esastır. Hastaya özgü greftin de novo olarak oluşturulması, rekonstrüktif transplantasyonda yaklaşmakta olan atılımdır. Doku mühendisliği teknikleri kullanılarak, VCA'lar donör hücrelerden arındırılabilir ve perfüzyon-desellülarizasyon-resellülarizasyon yoluyla alıcı için özelleştirilebilir. Bu yeni teknolojileri geliştirmek için, büyük ölçekli bir hayvan VCA modeli gereklidir. Bu nedenle, deri, yağ, fasya ve damarlardan oluşan domuz fasyo-kutanöz flepleri, VCA'daki ön çalışmalar için ideal bir model oluşturmaktadır. Bununla birlikte, literatürde açıklanan VCA modellerinin çoğu kas ve kemiği içerir. Bu çalışma, domuzlarda safen fasiyo-kutanöz flep hasadı için güvenilir ve tekrarlanabilir bir teknik, çeşitli araştırma alanları, özellikle vaskülarize kompozit doku mühendisliği için pratik bir araç olduğunu bildirmektedir.
Giriş
Vaskülarize kompozit allogreftler (VCA), eller, yüz ve penis 1,2,3 gibi onarılması zor vücut parçası kayıplarının tedavisinde devrim yaratmıştır. Ne yazık ki, ilk uzun vadeli sonuçlar4, yüksek doz immünosüpresif ajanların ömür boyu uygulanmasının diyabet, enfeksiyonlar, neoplazi ve reno-vasküler disfonksiyon 5 dahil olmak üzere ciddi kollateral tıbbi durumlara yol açabileceğinigöstermiştir. Son zamanlarda, uzman VCA ekipleri greft kaybına yol açan kronik rejeksiyon riskini yönetmek ve ilk yüz retransplantasyon vakalarını gerçekleştirmek zorunda kalmıştır 6,7. VCA'da immünsüpresyon sınırlamalarının üstesinden gelmek için farklı stratejiler tanımlanmıştır. Birincisi, allogreft alıcısında immün karışık kimerizm durumunu indükleyerek uzun süreli greft toleransı oluşturmaya dayanır 8,9. İkincisi, doku mühendisliği yoluyla hastaya özgü bir greftin de novo olarak oluşturulmasını içerir.
Son zamanlarda, biyolojik dokuların perfüzyon desellülarizasyonu, tüm organların vasküler ağının ve doku mimarisinin korunmasını sağlayan doğal hücre dışı matriks (ECM) iskeleleri oluşturmuştur10. Bu nedenle, bu ECM'nin alıcıya özgü hücrelerle yeniden hücreselleştirilmesi, bağışıklık kısıtlamalarından arındırılmış özelleştirilmiş bir greft yaratacaktır. VCA biyomühendisliği üzerine yapılan araştırmalarda, birden fazla ekip hücreselden arındırılmış ve tüm mimariyi koruyan ECM'yi elde etmiştir11,12,13. Bununla birlikte, yeniden hücreselleştirme süreci zorlu olmaya devam etmektedir ve büyük hayvan modellerinde başarılı olamamıştır14,15. Bu çığır açan teknolojilerin geliştirilmesi, güvenilir ve tekrarlanabilir büyük hayvan kompozit doku modellerine ihtiyaç duyulmaktadır. Domuz modelleri, biyomühendislik gelişim boru hattında en üst düzeyde seçeneği temsil eder, çünkü domuz derisi insan cildine en yakın anatomik ve fizyolojik özellikleri sunar16. Fasyo-kutanöz fleplerin (FCF) kullanımı, 'kişiye özel' vaskülarize kompozit doku greftlerinin oluşturulmasına yönelik ilk adımlar sırasında idealdir. Gerçekten de, FCF cilt, yağ, fasya, endotel hücreleri içeren temel bir VCA modelidir. Domuz miyokutanöz flepleri17 ve osteomiyokutanöz flepler18'in tanımı literatürde bulunabilir. Bununla birlikte, fasyo-kutanöz flep hasat tekniklerine odaklanma eksikliği vardır.
Bu nedenle, bu çalışma, araştırmacılara domuz safen FCF tedarik tekniğinin ayrıntılı bir tanımını sunmayı ve özellikle vaskülarize kompozit doku mühendisliğinde olmak üzere birçok araştırma alanında kullanımı için flebin tüm özelliklerini göstermeyi amaçlamaktadır.
Protokol
Tüm hayvanlar, Laboratuvar Hayvanlarının Bakımı ve Kullanımı için Ulusal Sağlık Enstitüsü Kılavuzu'nu takiben insan bakımı aldı. Kurumsal Hayvan Bakımı ve Kullanımı Komitesi, deneysel protokolü (IACUC- protokol #2020N000015) onayladı. Tüm deneyler için yedi dişi Yorkshire domuzu (20-25 kg) kullanıldı.
1. Ameliyat öncesi bakım
- Ameliyattan 12 saat önce katı yiyecekler için hayvanı hızlı bir şekilde açın.
- Hayvanı 4.4 mg / kg Telazol, 2.2 mg / kg Ksilazin ve 0.04 mg / kg (IM) Atropin sülfat ile sakinleştirin (bkz.
- Bir kulak damarına 18 G periferik intravenöz kateter yerleştirin.
- Domuzu uygun bir endotrakeal tüp ile entübe edin (10-200 kg'lık domuzlar için 6-15 mm kullanılabilir) ve tüpü bir vantilatöre bağlayın. Preoperatif analjezi buprenorfin (0.05 mg/kg, IM) ile uygulayın (bakınız Tablo Materyalleri).
2. İntraoperatif monitörizasyon
- 1.5 L/dak oksijen akışı ile %1.5-%3 izofluran inhalasyon karışımı ile anesteziyi sürdürün.
- Kalp atış hızını, nabız oksimetresini ve gelgit sonu CO2'yi sürekli izleyin. Her 5 dakikada bir kan basıncını ve vücut ısısını değerlendirin.
NOT: Kalp atış hızı için hedef aralık 90-100 atım/dk arasındadır, oksijen doygunluğu %93'ten yüksek olmalıdır ve son gelgit CO 2 aralığı CO2'nin %5-%6'sıarasındadır. - 60 mmHg ile 90 mmHg arasındaki ortalama arteriyel basıncı düzenlemek için prosedür boyunca saatte 5-10 mL / kg% 0.9 salin uygulayın.
3. İki taraflı safen FCF tedariki
- Hayvanı sırtüstü pozisyona getirin. Hem kasıkları hem de arka bacakları tıraş edin ve ovalayın, cerrahi bölgedeki tüm arka bacakları dahil edin ve steril bir şekilde örtün.
- Patelladan safen arterin nabzını ~ 3 parmak genişliğinde medial palpe edin ve etiketleyin.
- Kapağın sınırlarını tanımlayın ve çizin.
NOT: Üstün sınır, 3 cm altındaki kasık kıvrımına paralel bir eksendir. Lateral sınır, anterior superior iliak omurgadan patellanın medial kısmına kadar olan bir eksendir. - Safen pedikülü üzerinde ortalanmış ve daha önce tarif edilen flep limitlerinde bulunan 10 cm çapında oval benzeri bir flep çizin (adım 3.3).
- Flep dönüm noktası üzerindeki pedikülün distal kısmı ile ilgili 1,5 cm'lik bir cilt kesisi yapın.
- Safen arterini ve iki venae komitantını ortaya çıkarmak için fasyayı ve künt diseksiyonu açın. Çift bitişik harf uygulayın ve tek bir pakette ayırın.
- Kapağın kalan derisini bir bıçakla kesin.
- Subkutan dokuyu ve çevresindeki fasyayı açmak için koter kullanın. Bipolar forseps kullanarak tam hemostaz yapın (bakınız Malzeme Tablosu).
- Flebin deri bileşenini, yanlışlıkla çekişi ve delici damarların bozulmasını önlemek için 3-0 emilemeyen dikişlerle altta yatan fasyaya takın.
- Fasyayı kastan uzaklaştırarak flebi gracilis'ten serbest bırakın.
NOT: Safen pedikülünün distal kısmı, gracilis kası ile fasyanın arasındaki bir düzlemde çalışır. Uygun gerginlik ve yan dalların temkinli bipolar hemostazı pedikül diseksiyonunu kolaylaştırmak için çok önemli unsurlardır. - Kasık kırışıklığında 12 cm'lik bir kesi yapmak için bir neşter kullanın. Kasık kıvrımını flebin proksimal kısmına bağlayan dik bir kesi yapın. Bağlanan cildi kaldırın ve koter kullanarak deri altı tabakasını açın.
- Safen damarlarını femur damarlarına doğru takip ederek pedikül diseksiyonuna devam edin.
NOT: Safen pedikülün proksimal kısmı intermüsküler septumdan geçebilir veya gracilis kasına dalabilir. - Femur damarlarını iskeletleştirin ve iki ayrı demet halinde safen dalına distal olarak bağlayın. Femoral damarların diseksiyonuna inguinal ligament seviyesine ulaşana kadar distalden proksimal olana kadar devam edin. Koterize etmek için bipolar forseps veya vasküler klipsler ve derin femur damarlarını bağlamak için 2-0 ipek bağları kullanın, sonra kesin.
NOT: Damarları kesmeden önce vasküler klipsler de kullanılabilir. - İkinci safen flebini hasat etmek için kontralateral arka bacak üzerinde 3.2-3.13 adımlarını tekrarlayın.
- 3.16. adımdan 5 dakika önce intravenöz (IV) heparin enjeksiyonu (100 IU / kg) ile hayvanı heparize edin.
- Femoral pedikülü (arter ve ven) mümkün olduğunca inguinal ligamente proksimal olarak bağlayın ve flebi donör domuzdan ayırın.
- Femur damarı uçlarını genişletin ve hem arter hem de ven içine 20 G'lik bir anjiyokateter yerleştirin. Kateteri damarlara sabitlemek için 3-0 ipek bağ kullanın.
- Fasiyo-kutanöz flep arterini, net bir venöz çıkış gözlenene kadar 10 mL heparin salin (100 IU / mL) ile yavaşça yıkayın (Şekil 1).
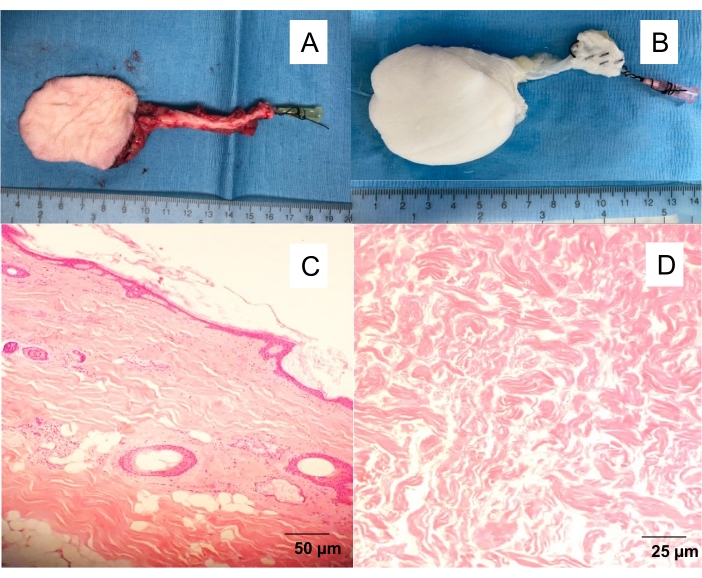
Şekil 1: Doğal ve desellülarize safen fasiyo-kutanöz flep . (A) Femoral artere yerleştirilen 20 G anjiyokateter ile izole deri flebi, flebin kandan yıkanmasına ve farklı deneylere (anjiyografi, perfüzyon deselülizasyon) devam edilmesine izin verir. (B) Desellülarize cilt flebi. Perfüzyon desellülarizasyonu, 10 günlük deterjan perfüzyonundan sonra beyaz, asellüler iskeleler verir. (C) doğal cilt flebinin ve (D) desellülarize cilt flebinin H & E boyalı tam kalınlıkta kesitleri. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- IV sodyum fenobarbital enjeksiyonu (100 mg / kg) ile hayvanı ötenazileştirin. Kalp atışı ve solunum hareketlerinin yokluğu ile ölümü onaylayın.
Sonuçlar
Canlı hayvanlar üzerinde yapılan bu çalışmadan önce üç kadavra örneği üzerinde safen perforazomun belirlenmesi yapılmıştır (Şekil 2). Arterden gelen spesifik vasküler ağı pasifize etmek için safen artere renkli bir dolgu çözeltisi enjekte edildi. Çözelti, 10 mL seyreltici madde ile karıştırılmış 10 mL mavi renkli gliserin ajanından oluşur (bkz. Bu, safen arter tarafından vaskülarize edilen cildin renkli bir haritasını oluşturdu ve safen ...
Tartışmalar
Bu makalede, domuz arka bacaklarında hasat edilen güvenilir ve tekrarlanabilir bir fasyokutanöz flep açıklanmaktadır. Bu adım adım cerrahi protokolü takip etmek, 2 saatten daha kısa bir sürede sadece bir hayvan üzerinde iki flep tedarik edilmesine izin verecektir. Ameliyatın en kritik adımı, gracilis kas lifleri içindeki vasküler pedikülün iskeletleştirilmesidir ve bu da yetenekli bir cerrah tarafından kapsamlı bir diseksiyon gerektirir. Kutanöz sütürler kullanarak cildin fasyaya sabitlenmesi, pe...
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, Shriners Çocuk Hastaneleri hibeleri #85127 (BEU ve CLC) ve #84702 (AA) tarafından finanse edildi. Yazarlar, "Gueules Cassées" vakfına, bu projede yer alan bursiyerlere maaş desteği için teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 18 G angiocatheter | BD Insyte Autoguard | 381409 | |
| 20 G angiocatheter | BD Insyte Autoguard | 381411 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Atropine Sulfate | AdvaCare | 212-868 | |
| Bipolar cords | ASSI | 228000C | |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Endotrachel tube | Jorgensen Labs | JO615X | size from 6 to 15mm depending on the pig weight |
| Ethilon 3-0 16 mm 3/8 | Ethicon | MPVCP683H | |
| Euthasol | Virbac AH | 200-071 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Metzenbaum scissors 180 mm | B Braun | BC606R | |
| Microfil blue | Flow tech | LMV-120 | |
| Microfil dilution | Flow tech | LMV-112 | colored filing solution |
| Monopolar knife | ASSI | 221230C | |
| N°15 scalpel blade | Swann Morton | NS11 | |
| Omnipaque | General Electric | 4080358 | contrast product |
| Perma-Hand Silk 3-0 | Ethicon | A184H | |
| Small Ligaclip | Ethicon | MCM20 | |
| Stevens scissors 115 mm | B Braun | BC008R | |
| Telazol | Zoetis | 106-111 | |
| Xylamed (xylazine) | Bimeda | 200-529 |
Referanslar
- Dubernard, J. M., et al. Human hand allograft: Report on first 6 months. The Lancet. 353 (9161), 1315-1320 (1999).
- Meningaud, J. P., et al. Procurement of total human face graft for allotransplantation: A preclinical study and the first clinical case. Plastic and Reconstructive Surgery. 126 (4), 1181-1190 (2010).
- Cetrulo, C. L., et al. Penis transplantation: First US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Lantieri, L., et al. Face transplant: Long-term follow-up and results of a prospective open study. Lancet. 388 (10052), 1398-1407 (2016).
- Derek, E., Dhanireddy, K. Immunosuppression. Current Opinion in Organ Transplantation. 17 (6), 616-618 (2012).
- Lantieri, L., et al. First human facial retransplantation: 30-month follow-up. Lancet. 396 (10264), 1758-1765 (2020).
- Kauke, M., et al. Full facial retransplantation in a female patient-Technical, immunologic, and clinical considerations. American Journal of Transplantation. 21 (10), 3472-3480 (2021).
- Leonard, D. A., et al. Vascularized composite allograft tolerance across MHC barriers in a large animal model. American Journal of Transplantation. 14 (2), 343-355 (2014).
- Kawai, T., et al. HLA-mismatched renal transplantation without maintenance immunosuppression. The New England Journal of Medicine. 368 (19), 1850-1852 (2013).
- Badylak, S. F., Taylor, D., Uygun, K. Whole-organ tissue engineering: Decellularization and recellularization of three-dimensional matrix scaffolds. Annual Review of Biomedical Engineering. 13, 27-53 (2011).
- Jank, B. J., et al. Creation of a bioengineered skin flap scaffold with a perfusable vascular pedicle. Tissue Engineering Part A. 23 (13-14), 696-707 (2017).
- Jank, B. J., et al. Engineered composite tissue as a bioartificial limb graft. Biomaterials. 61, 246-256 (2015).
- Duisit, J., et al. Decellularization of the porcine ear generates a biocompatible, nonimmunogenic extracellular matrix platform for face subunit bioengineering. Annals of Surgery. 267 (6), 1191-1201 (2018).
- Lupon, E., et al. Engineering Vascularized composite allografts using natural scaffolds: A systematic review. Tissue Engineering Part B: Reviews. , (2021).
- Duisit, J., Maistriaux, L., Bertheuil, N., Lellouch, A. G. Engineering vascularized composite tissues by perfusion decellularization/recellularization: Review. Current Transplantation Reports. 8, 44-56 (2021).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration: Official Publication of the Wound Healing Society [and] the European Tissue Repair Society. 9 (2), 66-76 (2001).
- Haughey, B. H., Panje, W. R. A porcine model for multiple musculocutaneous flaps. The Laryngoscope. 99 (2), 204-212 (1989).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. Journal of Visualized Experiments. (80), e50475 (2013).
- Rosh, E. H., Vistnes, L. M., Ksander, G. A. The panniculus carnosus in the domestic pic. Plastic and Reconstructive Surgery. 59 (1), 94-97 (1977).
- Alessa, M. A., et al. Porcine as a training module for head and neck microvascular reconstruction. Journal of Visualized Experiments. (139), e58104 (2018).
- Minqiang, X., Jie, L., Dali, M., Lanhua, M. Transmidline abdominal skin flap model in pig: Refinements and advancements. Journal of Reconstructive Microsurgery. 28 (02), 111-118 (2012).
- Bodin, F., et al. Porcine model for free-flap breast reconstruction training. Journal of Plastic, Reconstructive & Aesthetic Surgery. 68 (10), 1402-1409 (2015).
- Kadono, K., Gruszynski, M., Azari, K., Kupiec-Weglinski, J. W. Vascularized composite allotransplantation versus solid organ transplantation: Innate-adaptive immune interphase. Current Opinion in Organ Transplantation. 24 (6), 714-720 (2019).
- Kruit, A. S., et al. Rectus Abdominis flap replantation after 18 h hypothermic extracorporeal perfusion-A Porcine Model. Journal of Clinical Medicine. 10 (17), 3858 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır