Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Надежная модель фасцио-кожного лоскута свиней для биоинженерных исследований васкуляризированных композитных аллотрансплантатов
В этой статье
Резюме
Настоящий протокол описывает модель фасцио-кожного лоскута свиней и ее потенциальное использование в исследованиях васкуляризированных композитных тканей.
Аннотация
Васкуляризованные композитные аллотрансплантаты (VCA), такие как трансплантация рук, лица или полового члена, представляют собой передовое лечение разрушительных дефектов кожи, которое потерпело неудачу на первых ступенях реконструктивной лестницы. Несмотря на многообещающие эстетические и функциональные результаты, основным ограничивающим фактором остается необходимость резко применяемой пожизненной иммуносупрессии и ее хорошо известные медицинские риски, препятствующие более широким показаниям. Поэтому снятие иммунного барьера при VCA имеет важное значение для того, чтобы склонить этическую шкалу и улучшить качество жизни пациентов с использованием самых передовых хирургических методов. De novo создание специфического для пациента трансплантата является предстоящим прорывом в реконструктивной трансплантации. Используя методы тканевой инженерии, VCA могут быть освобождены от донорских клеток и настроены для реципиента посредством перфузии-децеллюляризации-рецеллюляризации. Для разработки этих новых технологий необходима крупномасштабная модель VCA животных. Следовательно, фасцио-кожные лоскуты свиней, состоящие из кожи, жира, фасций и сосудов, представляют собой идеальную модель для предварительных исследований в VCA. Тем не менее, большинство моделей VCA, описанных в литературе, включают мышцы и кости. В этой работе сообщается о надежной и воспроизводимой технике сбора подкожно-кожного лоскута у свиней, практическом инструменте для различных областей исследований, особенно васкуляризированной композитной тканевой инженерии.
Введение
Васкуляризованные композитные аллотрансплантаты (VCA) произвели революцию в лечении трудновосстанавливаемых потерь частей тела, таких как руки, лицо и пенис 1,2,3. К сожалению, первые долгосрочные исходы4 показали, что пожизненное введение высоких доз иммуносупрессантов может привести к тяжелым сопутствующим заболеваниям, включая диабет, инфекции, неоплазию и рено-сосудистую дисфункцию5. В последнее время экспертным командам VCA пришлось управлять риском хронического отторжения, приводящего к потере трансплантата, и выполнять первые случаи ретрансплантации лица 6,7. Были описаны различные стратегии для преодоления ограничений иммуносупрессии при VCA. Первый основан на установлении долгосрочной толерантности к трансплантату путем индуцирования состояния иммунного смешанного химеризма у реципиента аллотрансплантата 8,9. Второй включает в себя de novo создание специфического для пациента трансплантата с помощью тканевой инженерии.
В последнее время перфузионная децеллюляризация биологических тканей породила нативные каркасы внеклеточного матрикса (ECM), позволяющие сохранить сосудистую сеть и тканевую архитектуру целых органов10. Следовательно, рецеллюляризация этих ECM с реципиент-специфическими клетками создаст индивидуальный трансплантат, свободный от иммунных ограничений. В исследованиях по биоинженерии VCA несколько команд децеллюляризировали и получили такой ECM, сохранив всю архитектуру 11,12,13. Тем не менее, процесс рецеллюляризации остается сложным и не был успешным в моделях крупных животных14,15. Развитие этих прорывных технологий создает потребность в надежных и воспроизводимых моделях крупных композитных тканей животных. Модели свиней представляют собой наилучший выбор в биоинженерном процессе развития, поскольку свиная кожа представляет собой наиболее близкие анатомические и физиологические характеристики к коже человека16. Использование фасцио-кожных лоскутов (FCF) идеально подходит на первых шагах к созданию «индивидуальных» васкуляризированных композитных тканевых трансплантатов. Действительно, FCF является элементарной моделью VCA, содержащей кожу, жир, фасции и эндотелиальные клетки. Описание свиных миокожных лоскутов17 и остеомокожных лоскутов18 можно найти в литературе. Тем не менее, не уделяется внимания методам сбора фасцио-кожных клапанов.
Следовательно, это исследование направлено на то, чтобы предоставить исследователям подробное описание техники закупок FCF подкожной свиньи и изобразить все характеристики лоскута для его использования во многих областях исследований, особенно в васкуляризованной композитной тканевой инженерии.
протокол
Все животные получали человеческую помощь в соответствии с Руководством Национального института здравоохранения по уходу и использованию лабораторных животных. Институциональный комитет по уходу за животными и их использованию одобрил экспериментальный протокол (протокол IACUC #2020N000015). Для всех экспериментов использовались семь самок йоркширских свиней (20-25 кг).
1. Предоперационный уход
- Постигайте животное за твердую пищу за 12 ч до операции.
- Успокаивайте животное 4,4 мг/кг телазола, 2,2 мг/кг ксилазина и 0,04 мг/кг (в/м) атропина сульфата (см. Таблицу материалов).
- Поместите 18 г периферического внутривенного катетера в ушную вену.
- Интубировать свиней соответствующей эндотрахеальной трубкой (можно использовать 6-15 мм для свиней весом 10-200 кг) и подключить трубку к вентилятору. Вводят предоперационную анальгезию бупренорфином (0,05 мг/кг, в/м) (см. Таблицу материалов).
2. Интраоперационный мониторинг
- Поддерживайте анестезию ингаляционной смесью 1,5%-3% изофлурана с расходом кислорода 1,5 л/мин.
- Непрерывный мониторинг частоты сердечных сокращений, пульсоксиметрии и конечного прилива CO2. Оценивайте артериальное давление и температуру тела каждые 5 мин.
ПРИМЕЧАНИЕ: Целевой диапазон частоты сердечных сокращений составляет от 90 до 100 ударов в минуту, насыщение кислородом должно быть выше 93%, а конечный приливный диапазон CO2 составляет от 5% до 6% CO2. - Вводите 5-10 мл / кг в час 0,9% физиологического раствора на протяжении всей процедуры для регулирования среднего артериального давления между 60 мм рт.ст. и 90 мм рт.ст.
3. Двусторонние подкожные закупки FCF
- Поместите животное в лежачее положение. Брейте и скрабируйте как пах, так и задние конечности, включите все задние конечности в месте операции и задрапируйте стерильным способом.
- Пальпируйте пульс подкожной артерии ~3 пальца шириной медиаль от надколенника и пометьте его.
- Определите и нарисуйте пределы закрылка.
ПРИМЕЧАНИЕ: Верхний предел представляет собой ось, параллельную паховой складке на 3 см ниже нее. Латеральный предел представляет собой ось от переднего верхнего подвздошного отдела позвоночника до медиальной части надколенника. - Нарисуйте овальную заслонку диаметром 10 см, центрированную на подкожной ножке и содержащуюся в ранее описанных пределах закрылков (этап 3.3).
- Сделайте разрез кожи размером 1,5 см относительно дистальной части ножки на лоскуте.
- Откройте фасцию и тупое рассечение, чтобы обнажить подкожную артерию и две ее вены комитанты. Выполняют двойную лигатуру и разделяют в один пучок.
- Разрезайте оставшуюся кожу лоскута лезвием.
- Используйте прижигание, чтобы открыть подкожную клетчатку и окружающие фасции. Выполняют тщательный гемостаз с помощью биполярных щипцов (см. Таблицу материалов).
- Прикрепите кожный компонент лоскута к подлежащей фасции с помощью 3-0 нерассасывающихся швов, чтобы избежать непреднамеренного вытяжения и нарушения перфорации сосудов.
- Освободите лоскут от грацилиса, рассекая фасцию от мышцы.
ПРИМЕЧАНИЕ: Дистальная часть подкожной ножки проходит в плоскости между мышцей грацилиса и фасцией. Соответствующее напряжение и осторожный биполярный гемостаз боковых ветвей являются важнейшими элементами для облегчения рассечения ножки. - Используйте скальпель, чтобы сделать 12-сантиметровый разрез в паховой складке. Выполните перпендикулярный разрез, соединив паховую складку с проксимальной частью лоскута. Поднимите соединительную кожу и вскройте подкожный слой с помощью прижигания.
- Продолжайте рассечение ножки, следуя за подкожными сосудами вниз к бедренным сосудам.
ПРИМЕЧАНИЕ: Проксимальная часть подкожной ножки может либо проходить через межмышечную перегородку, либо погружаться в мышцу грацилиса. - Скелетонизируют бедренные сосуды и связывают их дистально к подкожной ветви двумя отдельными пучками. Продолжают рассечение бедренных сосудов от дистального до проксимального до достижения уровня паховой связки. Используйте биполярные щипцы для прижигания сосудистых зажимов и 2-0 шелковых завязок, чтобы перевязать глубокие бедренные сосуды, а затем разрезать.
ПРИМЕЧАНИЕ: Сосудистые клипсы также могут быть использованы перед разрезанием сосудов. - Повторите шаги 3.2-3.13 на контралатеральной задней конечности, чтобы собрать второй подкожный лоскут.
- Гепаринизировать животное внутривенной (IV) инъекцией гепарина (100 МЕ/кг) за 5 мин до шага 3.16.
- Разложить бедренную ножку (артерию и вену) как можно ближе к паховой связке и отделить лоскут от донорской свиньи.
- Расширьте концы бедренного сосуда и вставьте ангиокатетер 20 Г как в артерию, так и в вену. Используйте 3-0 шелковых завязок, чтобы закрепить катетер на сосудах.
- Медленно промывать фасцио-кожную лоскутную артерию 10 мл гепаринового физиологического раствора (100 МЕ/мл) до тех пор, пока не будет наблюдаться явный венозный отток (рисунок 1).
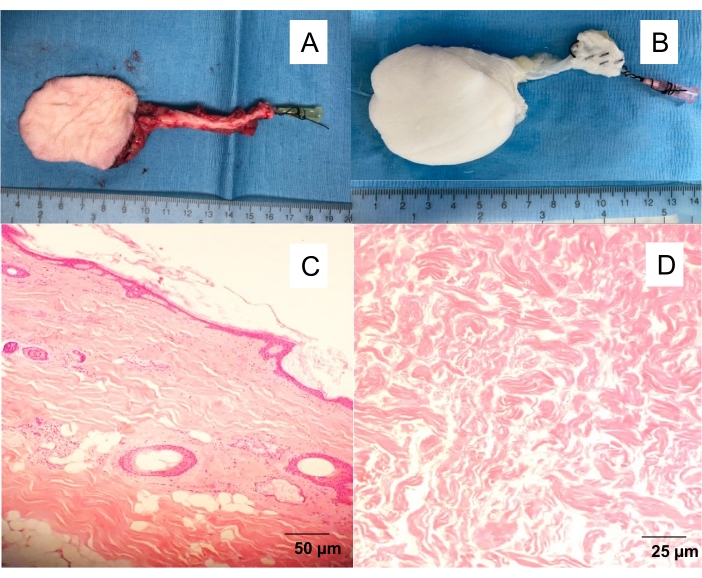
Рисунок 1: Нативный и децеллюляризованный подкожный фасцио-кожный лоскут. (А) Изолированный кожный лоскут с ангиокатетером 20 Г, вставленным в бедренную артерию, позволяющим промыть лоскут из крови и приступить к различным экспериментам (ангиография, перфузионная децеллюляризация). (B) Децеллюляризованный кожный лоскут. Перфузионная децеллюляризация, дающая белые, бесклеточные каркасы после 10 дней перфузии моющего средства. H&E-окрашенные полностью толщиной поперечные сечения (C) нативного кожного лоскута и (D) децеллюляризированного кожного лоскута. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Усыпить животное с помощью внутривенной инъекции фенобарбитала натрия (100 мг/кг). Подтверждают смерть отсутствием сердцебиения и дыхательных движений.
Результаты
Этой работе на живых животных предшествовало определение подкожной перфорасомы на трех трупных экземплярах (рисунок 2). Цветной пломбировочный раствор вводили в подкожную артерию для помутнения специфической сосудистой сети, исходящей из артерии. Раствор состоит из 10 ...
Обсуждение
В данной статье описывается надежный и воспроизводимый фасциокожный лоскут, заготовленный на задних конечностях свиней. Следование этому пошаговому хирургическому протоколу позволит приобрести два лоскута только на одном животном менее чем за 2 часа. Наиболее важным этапом операции ...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа финансировалась грантами Shriners Hospitals for Children #85127 (BEU и CLC) и #84702 (AA). Авторы хотели бы поблагодарить фонд "Gueules Cassées" за поддержку заработной платы стипендиатов, участвующих в этом проекте.
Материалы
| Name | Company | Catalog Number | Comments |
| 18 G angiocatheter | BD Insyte Autoguard | 381409 | |
| 20 G angiocatheter | BD Insyte Autoguard | 381411 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Atropine Sulfate | AdvaCare | 212-868 | |
| Bipolar cords | ASSI | 228000C | |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Endotrachel tube | Jorgensen Labs | JO615X | size from 6 to 15mm depending on the pig weight |
| Ethilon 3-0 16 mm 3/8 | Ethicon | MPVCP683H | |
| Euthasol | Virbac AH | 200-071 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Metzenbaum scissors 180 mm | B Braun | BC606R | |
| Microfil blue | Flow tech | LMV-120 | |
| Microfil dilution | Flow tech | LMV-112 | colored filing solution |
| Monopolar knife | ASSI | 221230C | |
| N°15 scalpel blade | Swann Morton | NS11 | |
| Omnipaque | General Electric | 4080358 | contrast product |
| Perma-Hand Silk 3-0 | Ethicon | A184H | |
| Small Ligaclip | Ethicon | MCM20 | |
| Stevens scissors 115 mm | B Braun | BC008R | |
| Telazol | Zoetis | 106-111 | |
| Xylamed (xylazine) | Bimeda | 200-529 |
Ссылки
- Dubernard, J. M., et al. Human hand allograft: Report on first 6 months. The Lancet. 353 (9161), 1315-1320 (1999).
- Meningaud, J. P., et al. Procurement of total human face graft for allotransplantation: A preclinical study and the first clinical case. Plastic and Reconstructive Surgery. 126 (4), 1181-1190 (2010).
- Cetrulo, C. L., et al. Penis transplantation: First US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Lantieri, L., et al. Face transplant: Long-term follow-up and results of a prospective open study. Lancet. 388 (10052), 1398-1407 (2016).
- Derek, E., Dhanireddy, K. Immunosuppression. Current Opinion in Organ Transplantation. 17 (6), 616-618 (2012).
- Lantieri, L., et al. First human facial retransplantation: 30-month follow-up. Lancet. 396 (10264), 1758-1765 (2020).
- Kauke, M., et al. Full facial retransplantation in a female patient-Technical, immunologic, and clinical considerations. American Journal of Transplantation. 21 (10), 3472-3480 (2021).
- Leonard, D. A., et al. Vascularized composite allograft tolerance across MHC barriers in a large animal model. American Journal of Transplantation. 14 (2), 343-355 (2014).
- Kawai, T., et al. HLA-mismatched renal transplantation without maintenance immunosuppression. The New England Journal of Medicine. 368 (19), 1850-1852 (2013).
- Badylak, S. F., Taylor, D., Uygun, K. Whole-organ tissue engineering: Decellularization and recellularization of three-dimensional matrix scaffolds. Annual Review of Biomedical Engineering. 13, 27-53 (2011).
- Jank, B. J., et al. Creation of a bioengineered skin flap scaffold with a perfusable vascular pedicle. Tissue Engineering Part A. 23 (13-14), 696-707 (2017).
- Jank, B. J., et al. Engineered composite tissue as a bioartificial limb graft. Biomaterials. 61, 246-256 (2015).
- Duisit, J., et al. Decellularization of the porcine ear generates a biocompatible, nonimmunogenic extracellular matrix platform for face subunit bioengineering. Annals of Surgery. 267 (6), 1191-1201 (2018).
- Lupon, E., et al. Engineering Vascularized composite allografts using natural scaffolds: A systematic review. Tissue Engineering Part B: Reviews. , (2021).
- Duisit, J., Maistriaux, L., Bertheuil, N., Lellouch, A. G. Engineering vascularized composite tissues by perfusion decellularization/recellularization: Review. Current Transplantation Reports. 8, 44-56 (2021).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration: Official Publication of the Wound Healing Society [and] the European Tissue Repair Society. 9 (2), 66-76 (2001).
- Haughey, B. H., Panje, W. R. A porcine model for multiple musculocutaneous flaps. The Laryngoscope. 99 (2), 204-212 (1989).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. Journal of Visualized Experiments. (80), e50475 (2013).
- Rosh, E. H., Vistnes, L. M., Ksander, G. A. The panniculus carnosus in the domestic pic. Plastic and Reconstructive Surgery. 59 (1), 94-97 (1977).
- Alessa, M. A., et al. Porcine as a training module for head and neck microvascular reconstruction. Journal of Visualized Experiments. (139), e58104 (2018).
- Minqiang, X., Jie, L., Dali, M., Lanhua, M. Transmidline abdominal skin flap model in pig: Refinements and advancements. Journal of Reconstructive Microsurgery. 28 (02), 111-118 (2012).
- Bodin, F., et al. Porcine model for free-flap breast reconstruction training. Journal of Plastic, Reconstructive & Aesthetic Surgery. 68 (10), 1402-1409 (2015).
- Kadono, K., Gruszynski, M., Azari, K., Kupiec-Weglinski, J. W. Vascularized composite allotransplantation versus solid organ transplantation: Innate-adaptive immune interphase. Current Opinion in Organ Transplantation. 24 (6), 714-720 (2019).
- Kruit, A. S., et al. Rectus Abdominis flap replantation after 18 h hypothermic extracorporeal perfusion-A Porcine Model. Journal of Clinical Medicine. 10 (17), 3858 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены