Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un modèle fiable de lambeau fascio-cutané porcin pour les études de bio-ingénierie des allogreffes composites vascularisées
Dans cet article
Résumé
Le présent protocole décrit le modèle du lambeau fascio-cutané porcin et son utilisation potentielle dans la recherche sur les tissus composites vascularisés.
Résumé
Les allogreffes composites vascularisées (AVC) telles que la greffe de main, de visage ou de pénis représentent le traitement de pointe pour les défauts cutanés dévastateurs, échoués par les premières étapes de l’échelle de reconstruction. Malgré des résultats esthétiques et fonctionnels prometteurs, le principal facteur limitant reste la nécessité d’une immunosuppression à vie appliquée de manière drastique et ses risques médicaux bien connus, empêchant des indications plus larges. Par conséquent, il est essentiel de lever la barrière immunitaire dans le VCA pour faire pencher la balance éthique et améliorer la qualité de vie des patients en utilisant les techniques chirurgicales les plus avancées. La création de novo d’une greffe spécifique au patient est la percée à venir dans la transplantation reconstructive. En utilisant des techniques d’ingénierie tissulaire, les VCA peuvent être libérés des cellules du donneur et personnalisés pour le receveur par perfusion-décellularisation-recellularisation. Pour développer ces nouvelles technologies, un modèle VCA animal à grande échelle est nécessaire. Par conséquent, les lambeaux fascio-cutanés porcins, composés de peau, de graisse, de fascia et de vaisseaux, représentent un modèle idéal pour les études préliminaires en AVC. Néanmoins, la plupart des modèles VCA décrits dans la littérature incluent les muscles et les os. Ce travail rapporte une technique fiable et reproductible pour la récolte du lambeau saphène fascio-cutané chez le porc, un outil pratique pour divers domaines de recherche, en particulier l’ingénierie tissulaire composite vascularisée.
Introduction
Les allogreffes composites vascularisées (ACV) ont révolutionné le traitement des pertes de parties du corps difficiles à réparer, telles que les mains, le visage et le pénis 1,2,3. Malheureusement, les premiers résultats à long terme4 ont montré que l’administration à vie d’agents immunosuppresseurs à forte dose peut entraîner de graves affections médicales collatérales, notamment le diabète, les infections, la néoplasie et le dysfonctionnement rénovasculaire5. Dernièrement, les équipes d’experts VCA ont dû gérer le risque de rejet chronique conduisant à la perte de greffon et effectuer les premiers cas de retransplantationfaciale 6,7. Différentes stratégies ont été décrites pour surmonter les limites de l’immunosuppression dans l’ACV. La première repose sur l’établissement d’une tolérance à long terme du greffon en induisant un état de chimérisme immunitaire mixte chez le receveur d’allogreffe 8,9. La seconde consiste à créer de novo une greffe spécifique au patient via l’ingénierie tissulaire.
Récemment, la décellularisation par perfusion des tissus biologiques a généré des échafaudages de matrice extracellulaire native (ECM), permettant la préservation du réseau vasculaire et de l’architecture tissulaire d’organes entiers10. Par conséquent, la recellularisation de ces ECM avec des cellules spécifiques au receveur créerait un greffon personnalisé exempt de contraintes immunitaires. Dans la recherche sur la bio-ingénierie VCA, plusieurs équipes ont décellularisé et obtenu un tel ECM préservant l’ensemble de l’architecture11,12,13. Cependant, le processus de recellularisation reste difficile et n’a pas été couronné de succès dans les grands modèles animaux14,15. Le développement de ces technologies révolutionnaires crée un besoin de modèles de tissus composites de grands animaux fiables et reproductibles. Les modèles porcins représentent le choix le plus important dans le pipeline de développement de la bio-ingénierie, car la peau porcine présente les caractéristiques anatomiques et physiologiques les plus proches de la peau humaine16. L’utilisation de lambeaux fascio-cutanés (FCF) est idéale lors des premières étapes vers la création de greffes tissulaires composites vascularisées « sur mesure ». En effet, FCF est un modèle VCA élémentaire contenant de la peau, de la graisse, des fascias et des cellules endothéliales. Une description des lambeaux myocutanésporcins 17 et des lambeaux ostéomyocutanés18 se trouve dans la littérature. Néanmoins, on ne se concentre pas suffisamment sur les techniques de récolte des lambeaux fascio-cutanés.
Par conséquent, cette étude vise à fournir aux chercheurs une description détaillée d’une technique d’approvisionnement en FCF saphène porcin et à décrire toutes les caractéristiques du lambeau pour son utilisation dans de nombreux domaines de recherche, en particulier en génie tissulaire composite vascularisé.
Protocole
Tous les animaux ont reçu des soins humains conformément au Guide de l’Institut national de la santé pour le soin et l’utilisation des animaux de laboratoire. Le Comité institutionnel de soin et d’utilisation des animaux a approuvé le protocole expérimental (protocole IACUC- #2020N000015). Sept porcs femelles du Yorkshire (20-25 kg) ont été utilisés pour toutes les expériences.
1. Soins préopératoires
- Jeûnez l’animal pour la nourriture solide 12 h avant la chirurgie.
- Sédatif l’animal avec 4,4 mg/kg de télazol, 2,2 mg/kg de xylazine et 0,04 mg/kg (IM) de sulfate d’atropine (voir le tableau des matières).
- Placez un cathéter intraveineux périphérique de 18 G dans une veine auriculaire.
- Intuber le porc avec un tube endotrachéal approprié (6-15 mm peut être utilisé pour les porcs de 10-200 kg) et connecter le tube à un ventilateur. Administrer une analgésie préopératoire avec de la buprénorphine (0,05 mg/kg, IM) (voir le tableau des matières).
2. Surveillance peropératoire
- Maintenir l’anesthésie avec un mélange d’isoflurane par inhalation de 1,5 % à 3 % avec un débit d’oxygène de 1,5 L/min.
- Surveillez en permanence la fréquence cardiaque, l’oxymétrie de pouls et le CO2 en fin de marée. Évaluez la pression artérielle et la température corporelle toutes les 5 minutes.
REMARQUE: La plage cible pour la fréquence cardiaque est comprise entre 90 et 100 battements / min, la saturation en oxygène doit être supérieure à 93% et la plage de CO 2 en fin de marée se situe entre 5% et 6% de CO2. - Administrer une solution saline à 0,9 % de 5 à 10 mL/kg par heure tout au long de la procédure pour réguler la pression artérielle moyenne entre 60 mmHg et 90 mmHg.
3. Passation de marchés bilatéraux de FCF saphène
- Placez l’animal en décubitus dorsal. Rasez et frottez les aines et les membres postérieurs, incluez les membres postérieurs entiers dans le site chirurgical et drapez de manière stérile.
- Palper le pouls de l’artère saphène ~3 largeurs de doigts médiales de la rotule et marquer-la.
- Identifiez et tracez les limites du rabat.
NOTE: La limite supérieure est un axe parallèle au pli inguinal 3 cm en dessous. La limite latérale est un axe allant de l’épine iliaque antérieure supérieure à la partie médiale de la rotule. - Dessiner un volet ovale de 10 cm de diamètre centré sur le pédicule saphène et contenu dans les limites du lambeau décrites précédemment (étape 3.3).
- Faites une incision cutanée de 1,5 cm concernant la partie distale du pédicule sur le repère du lambeau.
- Ouvrez le fascia et disséquez émoussé pour exposer l’artère saphène et ses deux veines comitantes. Effectuez une double ligature et séparez-la en un seul paquet.
- Inciser la peau restante du lambeau avec une lame.
- Utilisez la cautérisation pour ouvrir le tissu sous-cutané et le fascia environnant. Effectuer une hémostase complète à l’aide d’une pince bipolaire (voir le tableau des matériaux).
- Fixez le composant cutané du volet au fascia sous-jacent avec des sutures non résorbables 3-0 pour éviter la traction accidentelle et la perturbation des vaisseaux perforants.
- Libérez le lambeau du gracilis en disséquant le fascia loin du muscle.
NOTE: La partie distale du pédicule saphène court dans un plan entre le muscle gracilis et le fascia. Une tension appropriée et une hémostase bipolaire prudente des branches latérales sont des éléments cruciaux pour faciliter la dissection du pédicule. - Utilisez un scalpel pour faire une incision de 12 cm dans le pli inguinal. Effectuer une incision perpendiculaire reliant le pli inguinal à la partie proximale du lambeau. Soulevez la peau de connexion et ouvrez la couche sous-cutanée à l’aide de la cautérisation.
- Continuez la dissection pédiculaire en suivant les vaisseaux saphènes vers les vaisseaux fémoraux.
REMARQUE: La partie proximale du pédicule saphène peut traverser le septum intermusculaire ou plonger dans le muscle gracilis. - Squelettiser les vaisseaux fémoraux et les ligaturer distalement à la branche saphène en deux faisceaux distincts. Poursuivre la dissection des vaisseaux fémoraux de distal à proximal jusqu’à atteindre le niveau du ligament inguinal. Utilisez des pinces bipolaires pour cautériser ou des clips vasculaires et des attaches de soie 2-0 pour ligaturer les vaisseaux fémoraux profonds, puis coupez.
REMARQUE: Les clips vasculaires peuvent également être utilisés avant de couper les vaisseaux. - Répétez les étapes 3.2-3.13 sur le membre postérieur controlatéral pour récolter le deuxième lambeau saphène.
- Hépariniser l’animal par injection intraveineuse (IV) d’héparine (100 UI/kg) 5 min avant l’étape 3.16.
- Liférer le pédicule fémoral (artère et veine) aussi proximal que possible au ligament inguinal et séparer le lambeau du porc donneur.
- Dilater les extrémités du vaisseau fémoral et insérer un angiocathéter de 20 G dans l’artère et la veine. Utilisez des attaches en soie 3-0 pour fixer le cathéter aux vaisseaux.
- Rincer lentement l’artère du lambeau fascio-cutané avec 10 mL de solution saline d’héparine (100 UI/mL) jusqu’à ce qu’un écoulement veineux clair soit observé (Figure 1).
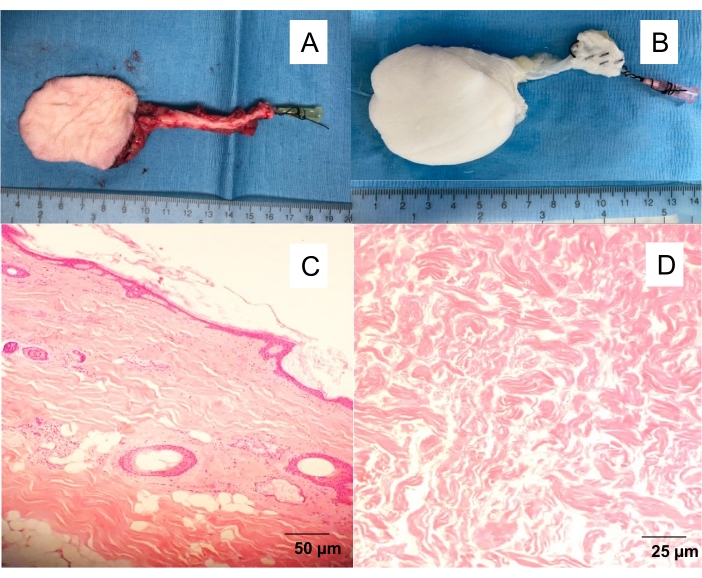
Figure 1 : lambeau saphène fascio-cutané natif et décellularisé. (A) lambeau cutané isolé avec un angiocathéter de 20 G inséré dans l’artère fémorale, permettant de laver le lambeau du sang et de procéder à différentes expériences (angiographie, décellularisation par perfusion). (B) lambeau cutané décellularisé. Décellularisation de perfusion produisant des échafaudages blancs et acellulaires après 10 jours de perfusion de détergent. Coupes transversales de pleine épaisseur colorées H & E de (C) lambeau cutané natif et (D) lambeau cutané décellularisé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Euthanasier l’animal avec une injection IV de phénobarbital de sodium (100 mg/kg). Confirmer la mort par l’absence de battements cardiaques et de mouvements respiratoires.
Résultats
Ce travail sur des animaux vivants a été précédé par la détermination du perforasome saphène sur trois spécimens cadavériques (Figure 2). Une solution de remplissage colorée a été injectée dans l’artère saphène pour opacifier le réseau vasculaire spécifique provenant de l’artère. La solution est composée de 10 mL d’agent glycérine de couleur bleue mélangé à 10 mL d’agent diluant (voir le tableau des matières). Cela a généré une carte color?...
Discussion
Cet article décrit un lambeau fasciocutané fiable et reproductible récolté sur les membres postérieurs du porc. Suivre ce protocole chirurgical étape par étape permettra l’obtention de deux lambeaux sur un seul animal en moins de 2 h. L’étape la plus critique de la chirurgie est le squelettisation du pédicule vasculaire dans les fibres musculaires gracilis, ce qui nécessite une dissection approfondie par un chirurgien qualifié. La fixation de la peau au fascia à l’aide de sutures cutanées est une astuc...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été financé par les subventions #85127 (BEU et CLC) et #84702 (AA) des Hôpitaux Shriners pour enfants. Les auteurs tiennent à remercier la fondation « Gueules Cassées » pour le soutien salarial des boursiers impliqués dans ce projet.
matériels
| Name | Company | Catalog Number | Comments |
| 18 G angiocatheter | BD Insyte Autoguard | 381409 | |
| 20 G angiocatheter | BD Insyte Autoguard | 381411 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Atropine Sulfate | AdvaCare | 212-868 | |
| Bipolar cords | ASSI | 228000C | |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Endotrachel tube | Jorgensen Labs | JO615X | size from 6 to 15mm depending on the pig weight |
| Ethilon 3-0 16 mm 3/8 | Ethicon | MPVCP683H | |
| Euthasol | Virbac AH | 200-071 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Metzenbaum scissors 180 mm | B Braun | BC606R | |
| Microfil blue | Flow tech | LMV-120 | |
| Microfil dilution | Flow tech | LMV-112 | colored filing solution |
| Monopolar knife | ASSI | 221230C | |
| N°15 scalpel blade | Swann Morton | NS11 | |
| Omnipaque | General Electric | 4080358 | contrast product |
| Perma-Hand Silk 3-0 | Ethicon | A184H | |
| Small Ligaclip | Ethicon | MCM20 | |
| Stevens scissors 115 mm | B Braun | BC008R | |
| Telazol | Zoetis | 106-111 | |
| Xylamed (xylazine) | Bimeda | 200-529 |
Références
- Dubernard, J. M., et al. Human hand allograft: Report on first 6 months. The Lancet. 353 (9161), 1315-1320 (1999).
- Meningaud, J. P., et al. Procurement of total human face graft for allotransplantation: A preclinical study and the first clinical case. Plastic and Reconstructive Surgery. 126 (4), 1181-1190 (2010).
- Cetrulo, C. L., et al. Penis transplantation: First US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Lantieri, L., et al. Face transplant: Long-term follow-up and results of a prospective open study. Lancet. 388 (10052), 1398-1407 (2016).
- Derek, E., Dhanireddy, K. Immunosuppression. Current Opinion in Organ Transplantation. 17 (6), 616-618 (2012).
- Lantieri, L., et al. First human facial retransplantation: 30-month follow-up. Lancet. 396 (10264), 1758-1765 (2020).
- Kauke, M., et al. Full facial retransplantation in a female patient-Technical, immunologic, and clinical considerations. American Journal of Transplantation. 21 (10), 3472-3480 (2021).
- Leonard, D. A., et al. Vascularized composite allograft tolerance across MHC barriers in a large animal model. American Journal of Transplantation. 14 (2), 343-355 (2014).
- Kawai, T., et al. HLA-mismatched renal transplantation without maintenance immunosuppression. The New England Journal of Medicine. 368 (19), 1850-1852 (2013).
- Badylak, S. F., Taylor, D., Uygun, K. Whole-organ tissue engineering: Decellularization and recellularization of three-dimensional matrix scaffolds. Annual Review of Biomedical Engineering. 13, 27-53 (2011).
- Jank, B. J., et al. Creation of a bioengineered skin flap scaffold with a perfusable vascular pedicle. Tissue Engineering Part A. 23 (13-14), 696-707 (2017).
- Jank, B. J., et al. Engineered composite tissue as a bioartificial limb graft. Biomaterials. 61, 246-256 (2015).
- Duisit, J., et al. Decellularization of the porcine ear generates a biocompatible, nonimmunogenic extracellular matrix platform for face subunit bioengineering. Annals of Surgery. 267 (6), 1191-1201 (2018).
- Lupon, E., et al. Engineering Vascularized composite allografts using natural scaffolds: A systematic review. Tissue Engineering Part B: Reviews. , (2021).
- Duisit, J., Maistriaux, L., Bertheuil, N., Lellouch, A. G. Engineering vascularized composite tissues by perfusion decellularization/recellularization: Review. Current Transplantation Reports. 8, 44-56 (2021).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration: Official Publication of the Wound Healing Society [and] the European Tissue Repair Society. 9 (2), 66-76 (2001).
- Haughey, B. H., Panje, W. R. A porcine model for multiple musculocutaneous flaps. The Laryngoscope. 99 (2), 204-212 (1989).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. Journal of Visualized Experiments. (80), e50475 (2013).
- Rosh, E. H., Vistnes, L. M., Ksander, G. A. The panniculus carnosus in the domestic pic. Plastic and Reconstructive Surgery. 59 (1), 94-97 (1977).
- Alessa, M. A., et al. Porcine as a training module for head and neck microvascular reconstruction. Journal of Visualized Experiments. (139), e58104 (2018).
- Minqiang, X., Jie, L., Dali, M., Lanhua, M. Transmidline abdominal skin flap model in pig: Refinements and advancements. Journal of Reconstructive Microsurgery. 28 (02), 111-118 (2012).
- Bodin, F., et al. Porcine model for free-flap breast reconstruction training. Journal of Plastic, Reconstructive & Aesthetic Surgery. 68 (10), 1402-1409 (2015).
- Kadono, K., Gruszynski, M., Azari, K., Kupiec-Weglinski, J. W. Vascularized composite allotransplantation versus solid organ transplantation: Innate-adaptive immune interphase. Current Opinion in Organ Transplantation. 24 (6), 714-720 (2019).
- Kruit, A. S., et al. Rectus Abdominis flap replantation after 18 h hypothermic extracorporeal perfusion-A Porcine Model. Journal of Clinical Medicine. 10 (17), 3858 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon