A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نموذج رفرف لفافة جلدية خزفية موثوقة لدراسات الهندسة الحيوية المركبة الوعائية
In This Article
Summary
يصف هذا البروتوكول نموذج السديلة الجلدية اللفافة الخنازير واستخدامه المحتمل في أبحاث الأنسجة المركبة الوعائية.
Abstract
تمثل الألوغرافيات المركبة الوعائية (VCA) مثل زراعة اليد أو الوجه أو القضيب العلاج المتطور لعيوب الجلد المدمرة ، التي فشلت في الخطوات الأولى من السلم الترميمي. على الرغم من النتائج الجمالية والوظيفية الواعدة ، يبقى العامل المحدد الرئيسي هو الحاجة إلى تثبيط المناعة مدى الحياة ومخاطره الطبية المعروفة ، مما يمنع المؤشرات الأوسع. لذلك ، فإن رفع الحاجز المناعي في VCA أمر ضروري لترجيح كفة المقياس الأخلاقي وتحسين نوعية حياة المرضى باستخدام التقنيات الجراحية الأكثر تقدما. De novo إنشاء الكسب غير المشروع الخاص بالمريض هو الاختراق القادم في الزرع الترميمي. باستخدام تقنيات هندسة الأنسجة ، يمكن تحرير VCAs من الخلايا المانحة وتخصيصها للمتلقي من خلال التروية - إزالة الخلايا - إعادة الخلايا. لتطوير هذه التقنيات الجديدة ، من الضروري وجود نموذج VCA حيواني واسع النطاق. وبالتالي ، فإن اللوحات الجلدية اللفافة الخنازير ، التي تتكون من الجلد والدهون واللفافة والأوعية ، تمثل نموذجا مثاليا للدراسات الأولية في VCA. ومع ذلك ، فإن معظم نماذج VCA الموصوفة في الأدبيات تشمل العضلات والعظام. يشير هذا العمل إلى تقنية موثوقة وقابلة للتكرار لحصاد السديلة اللفافة الجلدية الصافنة في الخنازير ، وهي أداة عملية لمختلف مجالات البحث ، وخاصة هندسة الأنسجة المركبة الوعائية.
Introduction
أحدثت الألوغرافات المركبة الوعائية (VCA) ثورة في علاج خسائر أجزاء الجسم التي يصعب إصلاحها ، مثل اليدين والوجه والقضيب1،2،3. لسوء الحظ ، أظهرت النتائج الأولى طويلة الأجل4 أن إعطاء جرعة عالية من العوامل المثبطة للمناعة لمدة طويلة يمكن أن يؤدي إلى حالات طبية جانبية شديدة ، بما في ذلك مرض السكري والالتهابات والأورام وخلل وظيفي الأوعية الدموية5. في الآونة الأخيرة ، كان على فرق VCA الخبيرة إدارة خطر الرفض المزمن الذي يؤدي إلى فقدان الكسب غير المشروع وإجراء أول حالات إعادة زرع الوجه 6,7. تم وصف استراتيجيات مختلفة للتغلب على قيود كبت المناعة في VCA. الأول يعتمد على إنشاء تحمل الكسب غير المشروع على المدى الطويل من خلال تحفيز حالة الوهم المختلط المناعي في متلقي allograft 8,9. والثاني ينطوي على إنشاء دي نوفو من الكسب غير المشروع الخاص بالمريض عن طريق هندسة الأنسجة.
في الآونة الأخيرة ، ولدت إزالة الخلايا من الأنسجة البيولوجية سقالات مصفوفة خارج الخلية (ECM) الأصلية ، مما يسمح بالحفاظ على شبكة الأوعية الدموية وبنية الأنسجة للأعضاء بأكملها10. وبالتالي ، فإن إعادة توطين هذه ECM مع خلايا خاصة بالمتلقي من شأنه أن يخلق ترقيعا مخصصا خاليا من القيود المناعية. في البحث حول الهندسة الحيوية VCA ، قامت فرق متعددة بإزالة الخلايا والحصول على مثل هذا ECM مع الحفاظ على الهندسة المعمارية بأكملها11،12،13. ومع ذلك ، لا تزال عملية إعادة التوطين صعبة ولم تكن ناجحة في النماذج الحيوانية الكبيرة14,15. إن تطوير هذه التقنيات المتقدمة يخلق حاجة إلى نماذج أنسجة مركبة حيوانية كبيرة موثوقة وقابلة للتكرار. تمثل نماذج الخنازير الخيار الأقصى في خط أنابيب تطوير الهندسة الحيوية ، حيث يقدم جلد الخنزير أقرب الخصائص التشريحية والفسيولوجية إلى جلد الإنسان16. يعد استخدام اللوحات اللفافة الجلدية (FCF) مثاليا خلال الخطوات الأولى نحو إنشاء ترقيع الأنسجة المركبة الوعائية "المخصصة". في الواقع ، FCF هو نموذج VCA أولي يحتوي على الجلد والدهون واللفافة والخلايا البطانية. يمكن العثور على وصف للسفار الجلدية العضليةللخنازير 17 واللوحات العظمية الجلدية18 في الأدب. ومع ذلك ، هناك نقص في التركيز على تقنيات حصاد اللوحات اللفافة الجلدية.
وبالتالي ، تهدف هذه الدراسة إلى تزويد الباحثين بوصف مفصل لتقنية شراء FCF الصافن الخنازير وتصوير جميع خصائص الرفرف لاستخدامها في العديد من المجالات البحثية ، وخاصة في هندسة الأنسجة المركبة الوعائية.
Protocol
تلقت جميع الحيوانات الرعاية البشرية وفقا لدليل المعهد الوطني للصحة لرعاية واستخدام المختبر. وافقت اللجنة المؤسسية لرعاية الحيوانات واستخدامها على البروتوكول التجريبي (بروتوكول IACUC - #2020N000015). تم استخدام سبع خنازير يوركشاير الإناث (20-25 كجم) لجميع التجارب.
1. الرعاية قبل الجراحة
- صوم الحيوان للحصول على الطعام الصلب قبل 12 ساعة من الجراحة.
- تخدير الحيوان مع 4.4 مغ/كغ من تيلازول، 2.2 مغ/كغ من زيلازين، و 0.04 مغ/كغ من كبريتات الأتروبين (انظر جدول المواد).
- ضع قسطرة وريدية محيطية سعة 18 جم في وريد الأذن.
- قم بتنبيب الخنازير بأنبوب مناسب للقصبة الهوائية (يمكن استخدام 6-15 مم للخنازير التي يتراوح وزنها بين 10 و 200 كجم) وقم بتوصيل الأنبوب بجهاز التنفس الصناعي. إدارة مسكن ما قبل الجراحة مع البوبرينورفين (0.05 مغ / كغم ، IM) (انظر جدول المواد).
2. المراقبة أثناء العملية الجراحية
- الحفاظ على التخدير مع خليط استنشاق من 1.5٪ -3٪ أيسوفلوران مع تدفق الأكسجين 1.5 لتر / دقيقة.
- راقب باستمرار معدل ضربات القلب وقياس التأكسج النبضي وثاني أكسيد الكربون2 في نهاية المد والجزر. تقييم ضغط الدم ودرجة حرارة الجسم كل 5 دقائق.
ملاحظة: يتراوح النطاق المستهدف لمعدل ضربات القلب بين 90-100 نبضة / دقيقة ، ويجب أن يكون تشبع الأكسجين أعلى من 93٪ ، ويتراوح نطاق ثاني أكسيد الكربونفي نهاية المد والجزر بين 5٪ -6٪ من ثاني أكسيد الكربون2. - إدارة 5-10 مل / كغم في الساعة 0.9٪ المالحة طوال الإجراء لتنظيم متوسط الضغط الشرياني بين 60 مم زئبق و 90 مم زئبق.
3. مشتريات FCF الصافن الثنائية
- ضع الحيوان في وضع ضعيف. حلق وفرك كل من الفخذين والأطراف الخلفية ، وتشمل الأطراف الخلفية بأكملها في الموقع الجراحي ، وستائر بطريقة معقمة.
- جس نبض الشريان الصافن ~ 3 عرض الإصبع الإنسي من الرضفة ووضع علامة عليه.
- تحديد ورسم حدود رفرف.
ملاحظة: الحد الأعلى هو محور مواز للتجعد الإربي على بعد 3 سم تحته. الحد الجانبي هو محور من العمود الفقري الحرقفي العلوي الأمامي إلى الجزء الإنسي من الرضفة. - ارسم رفرف بيضاوي الشكل قطره 10 سم يتمحور حول عنيق الصافن وموجود في حدود الرفرف الموصوفة سابقا (الخطوة 3.3).
- قم بعمل شق جلدي بطول 1.5 سم فيما يتعلق بالجزء البعيد من عنيق على معلم الرفرف.
- افتح اللفافة وتشريح حاد لفضح الشريان الصافن واثنين من الكوميتانتات الوريدية. أداء الرباط المزدوج وفصل في حزمة واحدة.
- شق الجلد المتبقي من رفرف مع شفرة.
- استخدم الكي لفتح الأنسجة تحت الجلد واللفافة المحيطة. قم بإجراء الإرقاء الشامل باستخدام ملقط ثنائي القطب (انظر جدول المواد).
- قم بتوصيل مكون الجلد من السديلة باللفافة الأساسية باستخدام 3-0 خيوط غير قابلة للامتصاص لتجنب الجر غير المقصود وتعطيل الأوعية المثقوبة.
- حرر الرفرف من الجراسيليس عن طريق تشريح اللفافة بعيدا عن العضلات.
ملاحظة: يمتد الجزء البعيد من عنيق الصافن في مستوى بين عضلة جراسيليس واللفافة. التوتر المناسب والارقاء ثنائي القطب الحذر للفروع الجانبية هي عناصر حاسمة لتخفيف تشريح عنيق. - استخدم مشرطا لعمل شق 12 سم في التجعد الأربي. قم بإجراء شق عمودي يربط التجعد الإربي بالجزء القريب من الرفرف. ارفع الجلد المتصل بعيدا وافتح الطبقة تحت الجلد باستخدام الكي.
- استمر في تشريح عنيق عن طريق اتباع الأوعية الصافنة نحو الأوعية الفخذية.
ملاحظة: يمكن للجزء القريب من عنيق الصافن إما أن يمر عبر الحاجز العضلي أو يغوص في عضلة جراسيليس. - قم بتخطيط أوعية الفخذ وربطها بشكل بعيد بالفرع الصافن في حزمتين منفصلتين. استمر في تشريح الأوعية الفخذية من البعيدة إلى القريبة حتى تصل إلى مستوى الرباط الأربي. استخدم ملقط ثنائي القطب للكي أو مقاطع الأوعية الدموية و 2-0 روابط حريرية لربط الأوعية الفخذية العميقة ، ثم قطعها.
ملاحظة: يمكن أيضا استخدام مشابك الأوعية الدموية قبل قطع الأوعية. - كرر الخطوات 3.2-3.13 على الطرف الخلفي المقابل لحصاد الرفرف الصافن الثاني.
- قم بتثبيط الحيوان عن طريق حقن الهيبارين في الوريد (IV) (100 وحدة دولية / كجم) قبل 5 دقائق من الخطوة 3.16.
- قم بربط عنيق الفخذ (الشريان والوريد) بالقرب من الرباط الإربي قدر الإمكان وافصل السديلة عن الخنزير المانح.
- قم بتوسيع أطراف الأوعية الفخذية وأدخل قسطرة وعائية 20 جم في كل من الشريان والوريد. استخدم 3-0 روابط حريرية لتثبيت القسطرة على الأوعية.
- اغسل ببطء الشريان الرفرف اللفائفي الجلدي ب 10 مل من محلول الهيبارين الملحي (100 وحدة دولية / مل) حتى يتم ملاحظة تدفق وريدي واضح (الشكل 1).
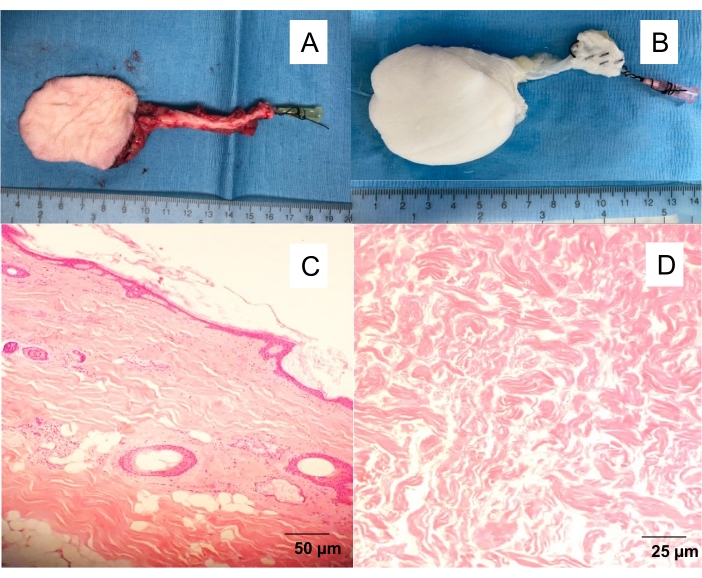
الشكل 1: رفرف اللفافة الجلدية الصافنة الأصلية والخلوية. (أ) رفرف جلدي معزول مع قسطرة وعائية 20 غرام يتم إدخالها في الشريان الفخذي ، مما يسمح بغسل السديلة من الدم والمضي قدما في تجارب مختلفة (تصوير الأوعية ، إزالة الخلايا من التروية). (ب) رفرف الجلد المنزوع الخلايا. إزالة الخلايا من التروية التي تنتج سقالات بيضاء غير خلوية بعد 10 أيام من تروية المنظفات. H & E - مقاطع عرضية كاملة السماكة ملطخة من (C) رفرف الجلد الأصلي و (D) رفرف الجلد غير الخلوي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- القتل الرحيم للحيوان عن طريق الحقن الوريدي من فينوباربيتال الصوديوم (100 ملغم / كغ). تأكد من الوفاة بسبب عدم وجود نبضات القلب وحركات الجهاز التنفسي.
النتائج
وقد سبق هذا العمل على الحيوانات الحية تحديد الثقب الصافن على ثلاث عينات من الجثث (الشكل 2). تم حقن محلول حشو ملون في الشريان الصافن لتعتيم شبكة الأوعية الدموية المحددة القادمة من الشريان. يتكون المحلول من عامل جلسرين أزرق اللون 10 مل ممزوج ب 10 مل من العامل المخفف (انظر جدو...
Discussion
تصف هذه المقالة رفرف لفافة جلدية موثوق به وقابل للتكرار يتم حصاده على الأطراف الخلفية للخنازير. بعد هذا البروتوكول الجراحي خطوة بخطوة سيسمح بشراء اثنين من اللوحات على واحد فقط في أقل من 2 ساعة. الخطوة الأكثر أهمية في الجراحة هي الهيكل العظمي للعنيق الوعائي داخل ألياف العضلات gracilis ، والتي ت...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم تمويل هذا العمل من قبل منح مستشفيات Shriners للأطفال # 85127 (BEU و CLC) و # 84702 (AA). ويود المؤلفان أن يشكرا مؤسسة "غوليس كاسيه" على دعم المرتبات للزملاء المشاركين في ذلك المشروع.
Materials
| Name | Company | Catalog Number | Comments |
| 18 G angiocatheter | BD Insyte Autoguard | 381409 | |
| 20 G angiocatheter | BD Insyte Autoguard | 381411 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Atropine Sulfate | AdvaCare | 212-868 | |
| Bipolar cords | ASSI | 228000C | |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Endotrachel tube | Jorgensen Labs | JO615X | size from 6 to 15mm depending on the pig weight |
| Ethilon 3-0 16 mm 3/8 | Ethicon | MPVCP683H | |
| Euthasol | Virbac AH | 200-071 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Metzenbaum scissors 180 mm | B Braun | BC606R | |
| Microfil blue | Flow tech | LMV-120 | |
| Microfil dilution | Flow tech | LMV-112 | colored filing solution |
| Monopolar knife | ASSI | 221230C | |
| N°15 scalpel blade | Swann Morton | NS11 | |
| Omnipaque | General Electric | 4080358 | contrast product |
| Perma-Hand Silk 3-0 | Ethicon | A184H | |
| Small Ligaclip | Ethicon | MCM20 | |
| Stevens scissors 115 mm | B Braun | BC008R | |
| Telazol | Zoetis | 106-111 | |
| Xylamed (xylazine) | Bimeda | 200-529 |
References
- Dubernard, J. M., et al. Human hand allograft: Report on first 6 months. The Lancet. 353 (9161), 1315-1320 (1999).
- Meningaud, J. P., et al. Procurement of total human face graft for allotransplantation: A preclinical study and the first clinical case. Plastic and Reconstructive Surgery. 126 (4), 1181-1190 (2010).
- Cetrulo, C. L., et al. Penis transplantation: First US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Lantieri, L., et al. Face transplant: Long-term follow-up and results of a prospective open study. Lancet. 388 (10052), 1398-1407 (2016).
- Derek, E., Dhanireddy, K. Immunosuppression. Current Opinion in Organ Transplantation. 17 (6), 616-618 (2012).
- Lantieri, L., et al. First human facial retransplantation: 30-month follow-up. Lancet. 396 (10264), 1758-1765 (2020).
- Kauke, M., et al. Full facial retransplantation in a female patient-Technical, immunologic, and clinical considerations. American Journal of Transplantation. 21 (10), 3472-3480 (2021).
- Leonard, D. A., et al. Vascularized composite allograft tolerance across MHC barriers in a large animal model. American Journal of Transplantation. 14 (2), 343-355 (2014).
- Kawai, T., et al. HLA-mismatched renal transplantation without maintenance immunosuppression. The New England Journal of Medicine. 368 (19), 1850-1852 (2013).
- Badylak, S. F., Taylor, D., Uygun, K. Whole-organ tissue engineering: Decellularization and recellularization of three-dimensional matrix scaffolds. Annual Review of Biomedical Engineering. 13, 27-53 (2011).
- Jank, B. J., et al. Creation of a bioengineered skin flap scaffold with a perfusable vascular pedicle. Tissue Engineering Part A. 23 (13-14), 696-707 (2017).
- Jank, B. J., et al. Engineered composite tissue as a bioartificial limb graft. Biomaterials. 61, 246-256 (2015).
- Duisit, J., et al. Decellularization of the porcine ear generates a biocompatible, nonimmunogenic extracellular matrix platform for face subunit bioengineering. Annals of Surgery. 267 (6), 1191-1201 (2018).
- Lupon, E., et al. Engineering Vascularized composite allografts using natural scaffolds: A systematic review. Tissue Engineering Part B: Reviews. , (2021).
- Duisit, J., Maistriaux, L., Bertheuil, N., Lellouch, A. G. Engineering vascularized composite tissues by perfusion decellularization/recellularization: Review. Current Transplantation Reports. 8, 44-56 (2021).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration: Official Publication of the Wound Healing Society [and] the European Tissue Repair Society. 9 (2), 66-76 (2001).
- Haughey, B. H., Panje, W. R. A porcine model for multiple musculocutaneous flaps. The Laryngoscope. 99 (2), 204-212 (1989).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. Journal of Visualized Experiments. (80), e50475 (2013).
- Rosh, E. H., Vistnes, L. M., Ksander, G. A. The panniculus carnosus in the domestic pic. Plastic and Reconstructive Surgery. 59 (1), 94-97 (1977).
- Alessa, M. A., et al. Porcine as a training module for head and neck microvascular reconstruction. Journal of Visualized Experiments. (139), e58104 (2018).
- Minqiang, X., Jie, L., Dali, M., Lanhua, M. Transmidline abdominal skin flap model in pig: Refinements and advancements. Journal of Reconstructive Microsurgery. 28 (02), 111-118 (2012).
- Bodin, F., et al. Porcine model for free-flap breast reconstruction training. Journal of Plastic, Reconstructive & Aesthetic Surgery. 68 (10), 1402-1409 (2015).
- Kadono, K., Gruszynski, M., Azari, K., Kupiec-Weglinski, J. W. Vascularized composite allotransplantation versus solid organ transplantation: Innate-adaptive immune interphase. Current Opinion in Organ Transplantation. 24 (6), 714-720 (2019).
- Kruit, A. S., et al. Rectus Abdominis flap replantation after 18 h hypothermic extracorporeal perfusion-A Porcine Model. Journal of Clinical Medicine. 10 (17), 3858 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved