Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Tipo de fibra y análisis subcelular específico del contenido de gotas lipídicas en el músculo esquelético
En este artículo
Resumen
La creciente evidencia indica que la infiltración excesiva de lípidos dentro del músculo esquelético resulta en lipotoxicidad y diabetes. Aquí, presentamos un protocolo completo, que incluye procesamiento de tejidos, tinción con Bodipy, adquisición de imágenes y análisis, para cuantificar el tamaño, la densidad y la distribución subcelular de las gotas lipídicas de una manera específica de tipo de fibra.
Resumen
La infiltración de lípidos del músculo esquelético, conocida como miosteatosis, aumenta con la obesidad y el envejecimiento. La miosteatosis también se ha descubierto recientemente como un factor de pronóstico negativo para varios otros trastornos como las enfermedades cardiovasculares y el cáncer. La infiltración excesiva de lípidos disminuye la masa muscular y la fuerza. También resulta en lipotoxicidad y resistencia a la insulina dependiendo del contenido total de lípidos intramiocelulares, la morfología de las gotas lipídicas (LD) y la distribución subcelular. El tipo de fibra (oxidativa vs glucolítica) también es importante, ya que las fibras oxidativas tienen una mayor capacidad para utilizar lípidos. Debido a sus implicaciones cruciales en la fisiopatología, se justifican estudios en profundidad sobre la dinámica y la función de la DA de una manera específica del tipo de fibra.
Aquí, se presenta un protocolo completo para la cuantificación del contenido de lípidos intramiocelulares y el análisis de la morfología de LD y la distribución subcelular de una manera específica del tipo de fibra. Con este fin, las criosecciones musculares en serie se tiñeron con el tinte fluorescente Bodipy y anticuerpos contra las isoformas de cadena pesada de miosina. Este protocolo permite el procesamiento simultáneo de diferentes músculos, ahorrando tiempo y evitando posibles artefactos y, gracias a una macro personalizada creada en Fiji, también es posible la automatización del análisis LD.
Introducción
La infiltración de lípidos del músculo esquelético, conocida como miosteatosis, aumenta con la obesidad y el envejecimiento. La miostetosis se correlaciona negativamente con la masa muscular y la fuerza y con la sensibilidad a la insulina1. Además, estudios recientes indican que el grado de miosteatosis podría usarse como factor pronóstico para otras afecciones como la enfermedad cardiovascular2, la enfermedad del hígado graso no alcohólico3 o el cáncer4. Los lípidos pueden acumularse en el músculo esquelético entre las fibras musculares como lípidos extramiocelulares o dentro de las fibras, como lípidos intramiocelulares (MMCL). Los MMCL se almacenan predominantemente como triglicéridos en gotas lipídicas (LD) que se utilizan como combustible metabólico durante el ejercicio físico 5,6. Sin embargo, cuando el suministro de lípidos excede la demanda, o cuando las mitocondrias se vuelven disfuncionales, las MMCL estarán implicadas en la resistencia muscular a la insulina, como se ve en individuos obesos metabólicamente insalubres y en pacientes con diabetes tipo 27. Curiosamente, los atletas de resistencia tienen niveles similares, si no más altos, de MMCL a los que se encuentran en pacientes obesos con diabetes mellitus tipo 2, mientras que mantienen una alta sensibilidad a la insulina. Este fenómeno se describe como la "paradoja del atleta"8,9, y se explica por una evaluación más matizada de los LD musculares, relacionados con su tamaño, densidad, localización, dinámica y composición de especies lipídicas.
En primer lugar, el tamaño de la DA está inversamente correlacionado con la sensibilidad a la insulina y la aptitud física10,11. De hecho, los LD más pequeños exhiben un área de superficie relativamente mayor para la acción de la lipasa y, por lo tanto, potencialmente tienen una mayor capacidad para movilizar lípidos12. En segundo lugar, la densidad de LD (número/superficie) juega un papel controvertido en la acción de la insulina 8,10; sin embargo, parece estar aumentado en los atletas. En tercer lugar, la localización subcelular de los LD es importante, ya que los LD situados justo debajo de la membrana superficial (subsarcolémmica o periférica) ejercen un efecto más perjudicial sobre la sensibilidad a la insulina que los centrales 8,9,13. Estos últimos proporcionan combustible a las mitocondrias centrales, que tienen una mayor actividad respiratoria y están más especializadas para satisfacer la alta demanda de energía requerida para la contracción14. Por el contrario, los LD periféricos suministran mitocondrias subsarcolemmales, que están involucradas en procesos relacionados con la membrana8. Finalmente, más allá de los triglicéridos, los lípidos complejos específicos dentro del músculo pueden ser más perjudiciales que otros. Por ejemplo, el diacilglicerol, el acil-CoA de cadena larga y las ceramidas pueden acumularse en el músculo cuando la tasa de renovación de triglicéridos es baja, lo que afecta la señalización de la insulina 9,15. Volviendo a la "paradoja del atleta", los atletas de resistencia tienen un alto número de LD centrales más pequeños con tasas de rotación elevadas en fibras tipo I (oxidativas), mientras que los pacientes obesos y diabéticos tienen LD periféricos más grandes con bajas tasas de renovación en fibras tipo II (glucolíticas) 8,15,16. Además de su papel en el almacenamiento y liberación de energía, los LD a través de ácidos grasos derivados (FA) y una proteína de capa (perilipina 5) también podrían funcionar como actores críticos involucrados en la regulación transcripcional de la oxidación de FA y la biogénesis mitocondrial8. Debido a sus implicaciones cruciales en fisiología y fisiopatología, se justifican estudios en profundidad sobre la dinámica y las funciones de los LD.
Aunque existen varias técnicas para estudiar las IGMCL, no todas son adecuadas para cuantificar con precisión el tamaño, la densidad y la distribución de la LD de una manera específica de la fibra. Por ejemplo, la evaluación de los MMCL por espectroscopia de resonancia magnética, si bien no es invasiva, ofrece un nivel de resolución que no es suficiente para estudiar el tamaño y la ubicación precisa de los LD dentro de la fibra, y no es específico del tipo de fibra17,18. Del mismo modo, las técnicas bioquímicas realizadas en homogeneizados de músculo entero19 no pueden evaluar la ubicación y el tamaño de los lípidos. En consecuencia, el método más adecuado para analizar la morfología y la ubicación de la DA es la microscopía electrónica de transmisión cuantitativa13, pero esta técnica es costosa y requiere mucho tiempo. Por lo tanto, la imagen de fluorescencia confocal en preparaciones con colorantes como Oil Red O (ORO)20,21, monodansilipentano (MDH)22 o Bodipy 23,24,25, se ha convertido en la mejor herramienta para estos estudios.
Aquí, se describe un protocolo completo, que incluye muestreo y procesamiento de tejidos, tinción de Bodipy y adquisición y análisis de imágenes confocales para cuantificar el tamaño, el número y la localización de LD en criosecciones musculares de ratón. Dado que los MMCL no están distribuidos uniformemente entre las fibras oxidativas y glucolíticas, y cada tipo de fibra regula la dinámica de la LD de manera diferente, el estudio de los MMCL debe ser específico del tipo de fibra 16,25,26,27. Por lo tanto, este protocolo utiliza inmunofluorescencia en secciones seriadas para identificar las isoformas de cadena pesada de miosina (MyHC) expresadas por cada fibra. Otra ventaja de este protocolo es el procesamiento simultáneo de un músculo glicolítico (extensor digitorum longus, EDL) y oxidativo (sóleo) colocados uno al lado del otro antes de la congelación (Figura 1). Este procesamiento simultáneo no solo ahorra tiempo, sino que también evita la variabilidad debido al procesamiento separado de las muestras.
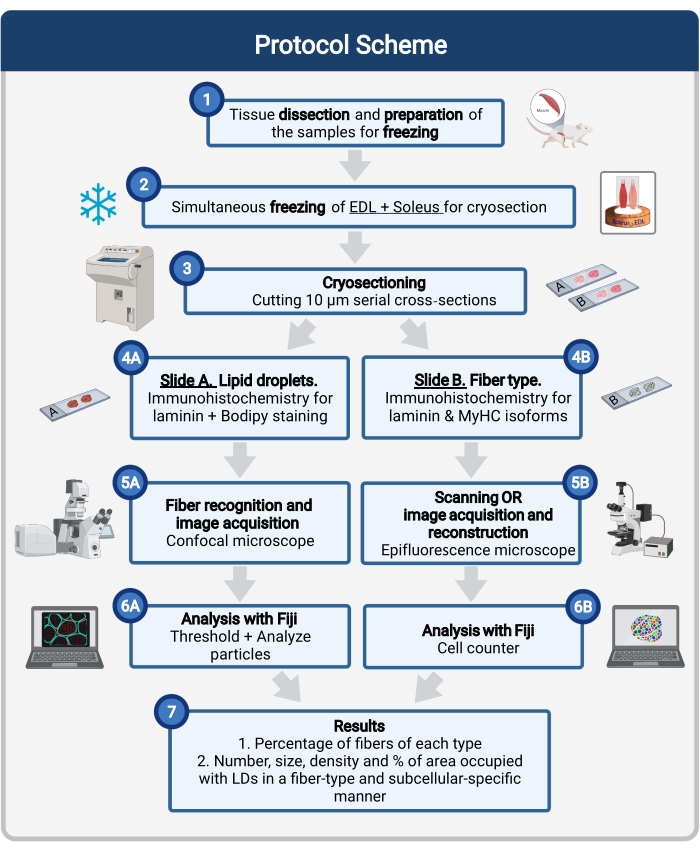
Figura 1: Descripción general esquemática del procedimiento. Después de la disección muscular (1), los músculos seleccionados de tamaño similar se preparan y congelan juntos (2). Las secciones transversales en serie de 10 μm se obtienen mediante un criostato y se montan directamente en portaobjetos de adhesión (3). A partir de dos diapositivas seriadas, la primera (4A) está inmunomarcada para laminina y teñida con Bodipy para reconocer las LD y la segunda (4B) está inmunoteñida con anticuerpos contra MyHCs para el reconocimiento de tipos de fibras musculares. Las imágenes se adquieren utilizando un microscopio confocal para Bodipy (5A) y un microscopio de epifluorescencia para tipos de fibras musculares (5B). Las imágenes se analizan en Fiji aplicando un umbral y cuantificando partículas (6A) para obtener el número, tamaño medio, densidad y porcentaje del área total ocupada por LD (7) o celdas de conteo (6B) para obtener el porcentaje de fibras de cada tipo en la sección (7). Abreviaturas: LD = gotas lipídicas; EDL = extensor digitorum longus; MyHCs = isoformas de cadena pesada de miosina. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Todos los procedimientos realizados en ratones fueron aprobados por el Comité Ético para la Experimentación Animal del Sector Médico de la Universidad Católica de Lovaina (2019/UCL/MD/013).
1. Disección y preparación de las muestras para su congelación
- Etiquete un trozo de corcho de 3 mm de grosor para cada par de músculos.
- A través de una pequeña incisión realizada con una cuchilla en el centro del corcho, insertar perpendicularmente una pieza rectangular de plástico rígido (0,5 cm W, 1 cm H) que servirá de soporte (Figura 2B).
NOTA: El tamaño de la pieza de plástico rectangular dependerá del tamaño del músculo. Aquí, las dimensiones descritas se adaptan al tamaño del sóleo (~ 9 mg, 1 cm L, 2-3 mm W) y EDL (~ 5 mg, 1 cm L, 2-3 mm W) de un ratón macho C57BL / 6J de 3 meses de edad. - En el momento de la disección, retire el sóleo y el EDL de la extremidad posterior del ratón. Para evitar que las muestras se sequen durante la disección, colóquelas en una compresa ligeramente humedecida con solución salina en una placa de Petri colocada sobre hielo.
NOTA: Ver Wang et al.28 para explicaciones sobre cómo diseccionar estos dos músculos de las extremidades. - Coloque una pequeña gota de compuesto de temperatura óptima de corte (OCT) en la unión corcho/plástico, evitando burbujas de aire.
- Elimine el exceso de humedad de las muestras secándolas suavemente con una toalla de papel (Figura 2A) y coloque ambos músculos sobre el plástico perpendicular al corcho (Figura 2C).
- Compruebe la orientación de las miofibras musculares bajo un microscopio estereoscópico (Figura 2D).
NOTA: Es importante no cubrir el músculo con OCT, ya que su efecto aislante evitaría la congelación rápida y producirá artefactos de congelación.
2. Congelación de muestras de músculo esquelético para criosecciona
PRECAUCIÓN: La congelación del músculo debe hacerse bajo una capucha química, usando el equipo de protección personal apropiado (consulte la Tabla de Materiales).
- Use un vaso de acero inoxidable (~ 8 cm H, 6 cm Ø) con dos correas laterales unidas a él de al menos 25 cm de largo (Figura 2F), y llene el vaso hasta 2/3 de su capacidad con isopentano.
- Agarrando el vaso por las correas, sumérjalo suavemente en una caja de poliestireno llena de nitrógeno líquido para que el nivel de nitrógeno fuera del recipiente esté por encima del nivel de isopentano en el interior (Figura 2F, G).
PRECAUCIÓN: Cuando el vaso entra en contacto con el nitrógeno, el choque térmico puede causar remolinos. Asegúrese de que el vaso esté lo suficientemente sumergido, pero evite la entrada de nitrógeno, ya que esto causaría precipitación de isopentano. Si esto sucede, deje que el isopentano se enfríe, llene el vaso con nuevo isopentano y comience de nuevo. - Cuando el interior del vaso esté completamente cubierto con una capa sólida blanca de isopentano, sáquelo de la caja de nitrógeno líquido (Figura 2H).
NOTA: La temperatura de fusión del isopentano es de -159 ° C, los bordes del vaso se volverán blancos cuando esté lo suficientemente frío. - Revuelva suavemente las piezas de isopentano sólido en el isopentano líquido restante con fórceps hasta que todo el volumen vuelva a ser líquido.
- Vuelva a sumergir el vaso en el nitrógeno líquido hasta que el isopentano forme guijarros blancos en toda la parte inferior y los bordes del vaso (Figura 2G, H).
NOTA: Este segundo paso de enfriamiento asegura la temperatura de congelación adecuada del isopentano. - Retire el vaso del nitrógeno líquido y sumerja rápidamente los músculos en la parte inferior del vaso, sosteniendo el corcho con pinzas de dientes de rata. Gire el corcho durante 15 s en el isopentano y guárdelo a -80 °C hasta su procesamiento (Figura 2I).
NOTA: Para el almacenamiento a corto plazo, las muestras se pueden mantener en un congelador de -20 °C. El protocolo completo para la congelación rápida del músculo esquelético ya se ha publicado en otros lugares. Para referencias detalladas y solución de problemas, ver: Meng et al.29, Kumar et al.30, y Leiva-Cepas et al.31.
3. Crioseccionación
- Llevar las muestras a la cámara de un criostato previamente enfriado a -20 °C y la temperatura de la cuchilla ajustada a -25 °C.
NOTA: Transporte las muestras desde el congelador de -20 °C/-80 °C hasta el criostato en una caja de poliestireno llena de hielo seco y permita que las muestras se equilibren durante al menos 20-30 minutos a la temperatura de la cámara antes del corte. - Retire el plástico del corcho con pinzas finas y coloque el disco de muestra de criostato en la placa de congelación rápida para que se enfríe. Una vez que la placa haya alcanzado los -50 °C, coloque un poco de OCT en el disco y coloque rápidamente el corcho en la parte superior del disco, presionando firmemente. Espere hasta que la OCT se solidifique y el corcho esté bien fijado en el disco.
- Coloque el disco en la cabeza del objeto en la orientación de corte deseada (Figura 2J, K) y recorte el bloque muscular más allá de al menos 1/3 de la longitud de los músculos y hasta que ambas secciones transversales de los músculos sean visibles.
- Ajuste el espesor de corte a 10 μm y coloque una sección en una diapositiva de adhesión para verificar la orientación correcta de las fibras en un microscopio de campo brillante.
NOTA: Verificar la orientación transversal de las fibras es crítico. Si las fibras no están adecuadamente orientadas, ajuste el ángulo de la cabeza del objeto, corte otra sección y verifique nuevamente. - Coloque dos secciones transversales en serie en dos diapositivas de adhesión preetiquetadas: una diapositiva para determinar los tipos de fibra, la otra para cuantificar el contenido de lípidos (Figura 2L).
NOTA: Se pueden obtener secciones transversales seriales adicionales y mantenerlas a -80 °C para otros estudios histológicos. Sin embargo, para evitar alterar el contenido de lípidos y la morfología intracelular24, es esencial procesar las dos primeras diapositivas inmediatamente después del corte para evitar el secado al aire. Congelar y descongelar las diapositivas para la cuantificación de LD tendría el mismo efecto y, por lo tanto, es muy desaconsejable.
4. Tipificación de fibra y tinción de Bodipy
- Detección inmunohistoquímica del tipo de fibra muscular
NOTA: Para el siguiente protocolo, un volumen total de solución de 250 μL es suficiente para cubrir toda la sección muscular rodeada por un círculo dibujado con una pluma hidrofóbica del tamaño aproximado de una moneda de 1 centavo.- Rodee las secciones con un contorno dibujado con una pluma hidrofóbica y enjuague con solución salina tamponada con fosfato (PBS) helada de 0,1 M durante 1 min a temperatura ambiente (RT). Coloque el portaobjetos en una cámara húmeda y bloquee durante 90 min a 37 °C en solución de bloqueo (10% de suero normal de cabra (NGS) y reactivo de bloqueo de ratón sobre ratón (MOM) 1:30 en PBS).
- Retire la solución bloqueadora e incube los portaobjetos durante 90 min a 37 °C con la solución que contiene los anticuerpos primarios (5% NGS, reactivo bloqueador MOM 1:30, los anticuerpos primarios del ratón para reconocer las fibras de tipo I (IgG2b, a 1:10), tipo IIa (IgG1, a 1:10) y tipo IIx (IgM, a 1:5) y una antilaminina de rata (cadena α2, 1:1.000) en PBS.
- Lave las diapositivas con PBS 3 x 5 min en RT.
- Incubar los portaobjetos en la oscuridad durante 1 h a RT con la solución que contiene los anticuerpos secundarios (cabra anti-IgG2b AF405 (1:500), cabra anti-IgG1 AF488 (1:500), cabra anti-IgM AF568 (1:1.000) y cabra anti-laminina AF647 (1:500) en PBS).
PRECAUCIÓN: Para el resto del protocolo, asegúrese de mantener las diapositivas alejadas de la luz para preservar la fluorescencia. - Lavar de nuevo 3 x 5 min en PBS, enjuagar en doble destilación H2O, eliminar el exceso de agua y montar con un reactivo antidesagras.
NOTA: Guarde las diapositivas a 4 °C, protegidas de la luz para preservar la fluorescencia hasta la adquisición de la imagen. Dado que las diapositivas no son fijas, se recomienda utilizar soluciones recién hechas para cada experimento, autoclave el PBS y adquirir las imágenes lo antes posible para evitar la contaminación de las secciones.
- Tinción de LD con Bodipy
NOTA: Similar al paso 4.1., un volumen total de solución de 250 μL es suficiente para cubrir toda la sección muscular rodeada por un círculo dibujado con una pluma hidrofóbica del tamaño aproximado de una moneda de 1 centavo.- Rodee las secciones con un contorno dibujado por una pluma hidrofóbica y enjuague con PBS 0.1 M helado durante 10 minutos en RT. Use PBS helado para todos los enjuagues y lavados.
- Fijar con paraformaldehído (PFA) al 4% en frío sin metanol durante 10 min a RT. Después de un primer enjuague rápido, lave las diapositivas con PBS 3 x 5 min en RT.
PRECAUCIÓN: Realice este paso bajo una capucha química. - Coloque el portaobjetos en una cámara húmeda y bloquee durante 1 h en RT con 5% NGS en PBS.
- Incubar los portaobjetos durante 90 min a 37 °C con la solución del anticuerpo primario (NGS al 2% y antilaminina de rata (cadena α2, 1:1.000) en PBS). Lave las diapositivas con PBS 3 x 5 min en RT.
PRECAUCIÓN: Para el resto del protocolo, asegúrese de mantener las diapositivas alejadas de la luz para preservar la fluorescencia. - Incubar durante 1 h a RT con la solución secundaria de anticuerpos que contiene anticuerpos anti-rat-AF647 de cabra (1:500) en PBS. Lave las diapositivas con PBS 3 x 5 min en RT.
- Incubar durante 20 min a RT con una solución de 4',6-diamidino-2-fenilindol (DAPI, 0,5 μg/mL) y BODIPY (1 μg/mL) en PBS.
NOTA: Para preparar la solución madre de BODIPY, disolverla en DMSO a una concentración de 1 mg/ml. Diferentes formulaciones de Bodipy están disponibles comercialmente para la tinción de LD. Dependiendo de la elección realizada, el método de tinción es el mismo (mismos pasos, concentración y tiempo de incubación); sin embargo, el método de adquisición será ligeramente diferente. - Después de un primer enjuague rápido, lave las diapositivas con PBS 3 x 5 min en RT, enjuague en H2O de doble destilación, elimine el exceso de agua y monte con un reactivo antifade.
NOTA: Guarde las diapositivas a 4 °C, protegidas de la luz, para preservar la fluorescencia hasta la adquisición de la imagen.
5. Adquisición de imágenes
NOTA: Una vez completados los protocolos de tinción, es importante proceder inmediatamente a la adquisición de la imagen (dentro de las siguientes 24 h), no solo para evitar la contaminación sino también para preservar la morfología, el tamaño y el número de LD.
- Adquisición de imágenes para evaluar los tipos de fibra de cada músculo muestreado
NOTA: Este paso podría lograrse con un microscopio de barrido de fluorescencia de portaobjetos completo o con un microscopio de epifluorescencia convencional. Con este último, se debe hacer una costura manual o automatizada de las imágenes para reconstruir la sección.- Para el reconocimiento de tipo de fibra, use un microscopio de epifluorescencia con un objetivo de 10x/ 0.3. Seleccione filtros de excitación para DAPI (405 nm), FITC, TRITC y Cy5 para detectar fibras de tipo I, IIa, IIx y laminina, respectivamente.
NOTA: Las fibras de tipo IIb no estarán inmunomarcadas. Se reconocerán como fibras teñidas por laminina en los límites del sarcolema con un sarcoplasma negro. - Ajuste el tiempo de exposición adecuado para cada canal.
- Cuando se utilice un microscopio de epifluorescencia convencional, adquirir siempre las imágenes de todo el músculo siguiendo el mismo orden para facilitar la reconstrucción muscular. Asegúrese de que las fibras en el borde derecho de una imagen también aparezcan en el borde izquierdo de la siguiente imagen. Lo mismo se aplica a las partes superior e inferior de las imágenes (Figura 3A).
NOTA: Como referencia, para una sección del EDL o el sóleo diseccionado de un ratón de 3 meses de edad, un promedio de seis y ocho imágenes, respectivamente, cubrirán toda la sección transversal muscular. - Después de escanear el músculo, cargue las imágenes digitales capturadas en cualquier software de procesamiento de imágenes para la reconstrucción (costura), según la morfología de la fibra (laminina) y la histología de la sección muscular, y guárdelo como un archivo TIFF, PNG o JPG con todos los canales (colores) fusionados (Figura 3A).
- Para el reconocimiento de tipo de fibra, use un microscopio de epifluorescencia con un objetivo de 10x/ 0.3. Seleccione filtros de excitación para DAPI (405 nm), FITC, TRITC y Cy5 para detectar fibras de tipo I, IIa, IIx y laminina, respectivamente.
- Adquisición de imágenes con laminina y co-tinción bodipy
NOTA: Para reconocer el tipo de fibra y tener una estimación del número de fibras para cada tipo capturado, es esencial tener la sección de tipo de fibra ya escaneada y los músculos reconstruidos antes de comenzar la adquisición de imágenes de Bodipy-laminin (Figura 3B).- Para la observación y adquisición de imágenes bodipy, utilice un microscopio confocal con una lente de objetivo de inmersión en aceite de 40x con una apertura numérica de 1.4.
- Utilice los siguientes ajustes: agujero de alfiler a 1 UA, resolución de 2.048 píxeles x 2.048 píxeles, tamaño de píxel a 0,08 μm, modo unidireccional, velocidad de escaneo a 4 (~4 μs/píxel), promedio de línea establecido en 4x y zoom digital establecido en 1.
- Para evitar la diafonía entre Bodipy-558/568 y laminina-AF647, utilice el modo de escaneo secuencial en el software confocal.
NOTA: Cuando el tinte elegido es Bodipy-493/503, es posible el escaneo láser confocal simultáneo sin diafonía entre el canal Bodipy y el canal laminina-AF647. Esto acelerará la adquisición de imágenes. - Excite Bodipy-493/503 usando la línea láser de 488 nm o la línea láser de argón, y excite Bodipy-555/568 usando la línea láser de diodo de 561 nm. Finalmente, detecte laminina-AF647 con una línea láser de diodo de 640 nm.
PRECAUCIÓN: Tenga en cuenta que las moléculas de Bodipy son muy sensibles al fotoblanqueo, así que evite el escaneo láser innecesario. Para reconocer las fibras, use solo el láser para laminina. - Dependiendo del tinte elegido, establezca los rangos de emisión en 570-650 nm para Bodipy-493/50324 y en 565-620 nm para Bodipy-558/568. Establezca el rango de emisión para laminina en 656-700 nm.
- Configure la ganancia y la ganancia digital de manera adecuada para que no se detecten píxeles saturados en el indicador de rango. Corrija la señal de fondo ajustando el desplazamiento.
NOTA: La selección del filtro y otros parámetros de escaneo mencionados anteriormente deben optimizarse para cada microscopio confocal. Es importante que todos los ajustes mencionados anteriormente se mantengan constantes para que se comparen todas las imágenes capturadas de las muestras. - Para identificar el tipo de fibra entre las visualizadas en el microscopio confocal, use una computadora portátil personal en la que se verifique la imagen de la sección reconstruida después de la inmunodetección de tipo fibra (Figura 3B).
- Una vez que un grupo de fibras está correctamente identificado, adquiere la imagen con los canales Bodipy y laminin.
NOTA: Se recomienda anotar el nombre de la imagen bodipy-laminin en la región del músculo donde se encuentran estas fibras en la imagen adquirida para el reconocimiento MyHC para facilitar el análisis posterior específico de la fibra de los LD.
6. Análisis de imágenes
- Análisis de los tipos de fibra en cada muestra muscular
- En Fiji (o ImageJ)32, abra el archivo TIFF, PNG o JPG con el músculo reconstruido obtenido de la fusión de todos los canales utilizados para detectar las isoformas de fibra.
- Para iniciar la herramienta de conteo de celdas , haga clic en Plugins | Analizar | | de contador de celdas Contador de celdas.
- En la ventana Contador de celdas , haga clic en Acciones | Inicializar.
- En Contadores de la misma ventana, seleccione Tipo 1.
- En la ventana principal de Fiji, seleccione la herramienta Varita .
- Para cuantificar el número de fibras de cada tipo, haga clic en cada fibra del mismo tipo, de modo que el programa registre el número de fibras en las que se hizo clic.
- Una vez terminado, selecciona el siguiente tipo de fibra y repite los mismos pasos.
- Cuando todas las fibras de la imagen se hayan asignado a un tipo de fibra determinado, haga clic en Resultados en la ventana Contador de celdas para mostrar los resultados en una tabla.
- Guarde esta tabla como una tabla de hoja de cálculo haciendo clic en archivo | Guardar como en la ventana Resultados .
- Guarde y vuelva a cargar las selecciones en la misma imagen en cualquier momento haciendo clic en Guardar marcadores o Cargar marcadores, respectivamente, en la ventana Recuento de celdas .
- Análisis de gotitas lipídicas de forma dependiente del tipo de fibra
- Analizar las imágenes de Bodipy y laminina obtenidas en el confocal utilizando Fiji para la cuantificación de LDs.
NOTA: Los autores diseñaron una macro personalizada para automatizar el análisis. Esta macro, junto con una explicación paso a paso sobre cómo usarla, está disponible como Archivo suplementario 1 y Archivo suplementario 2, respectivamente. - Abra cada imagen con la ayuda del Importador de Bioformatos de Fiji. En la opción Ver pila con , seleccione Hyperstack | Modo de color, predeterminado. Asegúrese de que la ventana Escala automática está seleccionada.
NOTA: Los siguientes pasos describirán el protocolo para el análisis de una fibra en la imagen, pero debe repetirse tantas veces como el número de fibras enteras aparezcan en la imagen. - Utilice la herramienta de selección a mano alzada para seleccionar manualmente el sarcolema de la fibra en función del canal de laminina (Figura 4A) y presione T en el teclado para grabar la selección o región de interés (ROI) en la ventana de ROI .
- Vaya a la ventana principal de Fiji y haga clic en Analizar | Establezca Medidas y, en la ventana emergente, seleccione Área y diámetro de Feret. Deje las casillas restantes sin marcar y otros parámetros tal como aparecen de forma predeterminada.
- Haga clic en Medir en la ventana ROI para obtener el Área y el Diámetro Mínimo de Feret (MF) de la fibra seleccionada, y anótelos para su uso posterior.
NOTA: Al analizar los LD, es importante tener en cuenta que su tamaño y densidad varían entre el centro y la periferia (región subsarcolemmal-SS) de la fibra. Por lo tanto, el análisis debe hacerse por separado. - Calcula el valor de 1/6 del MF para delimitar la parte central de la fibra.
NOTA: En la macro, el valor MF predeterminado se establece en 6, lo que significa que la reducción aplicada se establecerá como 1/6 del MF. Este valor se eligió en base a los datos empíricos obtenidos del sóleo de animales alimentados con una dieta alta en grasas. Sin embargo, cada investigador debe cambiar este número en función de los datos empíricos y el músculo analizado, el tipo de fibra y la condición animal. - En la ventana ROI , haga clic en Agregar para tener un duplicado del primer ROI y seleccione el segundo ROI que aparece en la ventana.
- En la ventana principal de Fiji, haga clic en Editar | Selección | Amplíe e introduzca el valor calculado previamente (del paso 6.2.6.) con un signo menos antes del número y haga clic en Aceptar. En la ventana roi, haga clic en Add[t] (debe aparecer un tercer ROI) y Delete, para eliminar el segundo ROI.
NOTA: El investigador puede verificar los resultados haciendo clic en el cuadro Mostrar todo en la ventana ROI . En este punto, deben aparecer dos ROI, uno que rodea todo el perímetro de la fibra (Figura 4B) y otro que se coloca en el centro (Figura 4C). - Seleccione ambos ROI en la ventana ROI y haga clic en Más | | XOR Añadir[t]. Espere a que aparezca un tercer ROI, que corresponde a la periferia de la fibra (Figura 4D).
- Guarde los ROI haciendo clic en Más | Ahorre para guardar los ROI en caso de que se necesite un reanálisis posterior de las mismas fibras.
- Seleccione el canal Bodipy y abra la herramienta Umbral haciendo clic en Imagen | Ajustar | Umbral en la ventana principal de Fiji.
- En la ventana emergente Umbral , establezca los valores en 70/255, seleccione Yen | Método B&W y haga clic en Fondo oscuro | Aplicar.
NOTA: Los valores aplicados en el umbral pueden variar en función de las condiciones del experimento y el umbral debe establecerse adecuadamente para optimizar el análisis. Debe aparecer una ventana en blanco y negro con la señal bodipy por encima del límite umbral que se muestra en blanco y el fondo en negro (compare la imagen original de Bodipy en la Figura 4E con la de la Figura 4F). - Vaya a la ventana principal de Fiji y haga clic en Analizar | Establezca Mediciones y, en la ventana emergente, seleccione Área, Fracción de área y Límite al umbral. Deje las casillas restantes sin marcar y otros parámetros tal como aparecen de forma predeterminada.
NOTA: Si el investigador desea analizar la "circularidad" de los LD, que es un índice de la morfología esférica que varía de 1 para una esfera perfecta a 0 para una línea, haga clic en el cuadro Descriptores de forma de la ventana emergente Establecer medidas . - Vaya a la ventana roi y seleccione el primer ROI. En la ventana principal de Fiji, haga clic en Analizar | Herramienta Analizar partículas.
NOTA: Esta herramienta cuantifica el número, el tamaño, el área cubierta y el porcentaje del área total cubierta por partículas en cada selección y guarda los resultados como un archivo de hoja de cálculo. - Establezca los valores de 2 a Infinito (2-Infinito) en la ventana Analizar partículas , marque la casilla Píxeles , mantenga los valores de circularidad predeterminados, seleccione Resumir y haga clic en Aceptar.
NOTA: Para comprobar los resultados en la fibra, en la opción Mostrar , seleccione cualquiera de las opciones disponibles. Para que la información de cada LD se reconozca en la selección en una tabla, marque la opción Mostrar resultados en la ventana Analizar partículas . Los resultados del análisis del área total de la fibra se promedian y resumen en una tabla con varias columnas (Conteo, Área Total, Tamaño promedio, % Área; estos corresponden al número de partículas [LD], el área ocupada por estas partículas, su tamaño promedio y el porcentaje del área total de la selección ocupada por partículas, respectivamente). Para calcular la densidad, divida el número de partículas por el área total de cada selección. - Para obtener los valores del centro y la periferia de la fibra, repita los pasos 6.2.14 y 6.2.15, seleccionando el segundo (centro) y el tercer ROI (periferia) cada vez.
- Guarde los resultados haciendo clic en archivo | Guardar como en la ventana Resumen .
NOTA: Incluya el tipo de fibra, la condición y el nombre de la imagen en el nombre asignado de los resultados para facilitar la unificación posterior y el análisis estadístico de los datos. Para analizar el resto de las fibras de la misma imagen, repita los pasos 6.2.3 a 6.2.17. Para el análisis estadístico, se deben analizar al menos 10-15 fibras de cada tipo por animal.
- Analizar las imágenes de Bodipy y laminina obtenidas en el confocal utilizando Fiji para la cuantificación de LDs.
Resultados
El protocolo descrito en este documento proporciona un método eficiente para cuantificar fácilmente los LD de una manera específica de tipo de fibra y subcelular. Muestra cómo, al congelar juntos dos músculos de tamaño similar, como el EDL y el sóleo, el tiempo y los recursos gastados en los siguientes pasos se reducen a la mitad.
Se proporciona un protocolo completo para la inmunotinción, la adquisición de imágenes y el análisis de las diferentes isoformas MyHC expresadas en los m?...
Discusión
El protocolo detallado aquí describe un método eficiente para cuantificar los LD etiquetados con Bodipy sobre una base específica de tipo de fibra y subcelular. En los últimos años, los colorantes lipídicos clásicos, como ORO o Sudan Black B, han sido sustituidos por una nueva gama de colorantes fluorescentes, lipofílicos y permeables a las células que se unen a lípidos neutros (por ejemplo, Bodipy). Disponible como diferentes conjugados, Bodipy ha demostrado ser muy eficaz en el etiquetado de LD para estudiar ...
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este trabajo fue apoyado por subvenciones del Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20) y la Société Francophone du Diabète (SFD-Roche Diabetes Care).C.M.S. es el receptor de una beca de doctorado de la FRIA (FNRS). M.A.D.-L.d.C. recibió una beca del Programa de Excelencia Internacional Wallonie-Bruxelles.
Los autores agradecen a Alice Monnier por su contribución al desarrollo de este protocolo y a Caroline Bouzin por su experiencia y ayuda técnica en el proceso de adquisición de imágenes. También agradecemos a la plataforma de imágenes 2IP-IREC por el acceso al criostato y los microscopios (2IP-IREC Imaging Platform, Institute of Experimental and Clinical Research, Université Catholique de Louvain, 1200 Bruselas, Bélgica). Finalmente, los autores desean agradecer a Nicolas Dubuisson, Romain Versele y Michel Abou-Samra por la crítica constructiva del manuscrito. Algunas de las figuras de estos artículos fueron creadas con BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24x50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors - 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
Referencias
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete's paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do's and don'ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados