Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İskelet Kasında Lipid Damlacık İçeriğinin Lif Tipi ve Subhücresel-Spesifik Analizi
Bu Makalede
Özet
Artan kanıtlar, iskelet kası içindeki lipitlerin aşırı infiltrasyonunun lipotoksisite ve diyabet ile sonuçlandığını göstermektedir. Burada, lipit damlacıklarının boyutunu, yoğunluğunu ve hücre altı dağılımını lif tipine özgü bir şekilde ölçmek için doku işleme, Bodipy ile boyama, görüntü elde etme ve analiz dahil olmak üzere eksiksiz bir protokol sunuyoruz.
Özet
Miyosteatoz olarak bilinen iskelet kası lipid infiltrasyonu, obezite ve yaşlanma ile birlikte artar. Miyostoeatoz ayrıca son zamanlarda kardiyovasküler hastalık ve kanser gibi diğer birçok bozukluk için negatif bir prognostik faktör olarak keşfedilmiştir. Aşırı lipid infiltrasyonu kas kütlesini ve gücünü azaltır. Ayrıca total intramiyosellüler lipid içeriğine, lipid damlacık (LD) morfolojisine ve hücre altı dağılımına bağlı olarak lipotoksisite ve insülin direnci ile sonuçlanır. Lif tipi (oksidatif vs glikolitik) de önemlidir, çünkü oksidatif lifler lipitleri kullanmak için daha büyük bir kapasiteye sahiptir. Patofizyolojideki önemli etkileri nedeniyle, LD dinamiği ve fonksiyonu üzerine lif tipine özgü bir şekilde derinlemesine çalışmalar yapılması gerekmektedir.
Bu çalışmada, intramiyosellüler lipid içeriğinin ölçülmesi ve LD morfolojisinin ve hücre altı dağılımının lif tipine özgü bir şekilde analizi için eksiksiz bir protokol sunulmaktadır. Bu amaçla, seri kas kriyolitleri floresan boya Bodipy ve miyozin ağır zincir izoformlarına karşı antikorlar ile boyandı. Bu protokol, farklı kasların aynı anda işlenmesini, zamandan tasarruf edilmesini ve olası eserlerin önlenmesini sağlar ve Fiji'de oluşturulan kişiselleştirilmiş bir makro sayesinde LD analizinin otomatikleştirilmesi de mümkündür.
Giriş
Miyosteatoz olarak bilinen iskelet kası lipid infiltrasyonu, obezite ve yaşlanma ile birlikte artar. Miyostoeatoz kas kütlesi ve gücü ile insülin duyarlılığı ile negatif ilişkilidir1. Ayrıca, son zamanlarda yapılan çalışmalar, miyosteatoz derecesinin kardiyovasküler hastalık2, alkolsüz yağlı karaciğer hastalığı3 veya kanser4 gibi diğer durumlar için prognostik bir faktör olarak kullanılabileceğini göstermektedir. Lipitler, kas lifleri arasındaki iskelet kasında ekstramiyosellüler lipitler olarak veya lifler içinde, hücre içi lipitler (IMCL'ler) olarak birikebilir. IMCL'ler ağırlıklı olarak fiziksel egzersiz sırasında metabolik yakıt olarak kullanılan lipit damlacıklarında (LD'ler) trigliseritler olarak depolanır 5,6. Bununla birlikte, lipit arzı talebi aştığında veya mitokondri işlevsiz hale geldiğinde, IMCL'ler metabolik olarak sağlıksız, obez bireylerde ve tip 2 diyabet hastalarında görüldüğü gibi kas insülin direncine neden olacaktır7. İlginçtir ki, dayanıklılık sporcuları, yüksek insülin duyarlılığını korurken, tip 2 diabetes mellituslu obez hastalarda bulunanlara benzer, daha yüksek olmasa da, IMCL seviyelerine sahiptir. Bu fenomen "sporcunun paradoksu"8,9 olarak tanımlanır ve kas LD'lerinin boyutları, yoğunlukları, lokalizasyonları, dinamikleri ve lipit türleri kompozisyonları ile ilgili daha nüanslı bir değerlendirmesi ile açıklanmaktadır.
İlk olarak, LD boyutu insülin duyarlılığı ve fiziksel uygunluk10,11 ile ters orantılıdır. Aslında, daha küçük LD'ler lipaz etkisi için nispeten daha büyük bir yüzey alanı sergiler ve bu nedenle lipitleri mobilize etmek için potansiyel olarak daha büyük bir kapasiteye sahiptir12. İkincisi, LD yoğunluğu (sayı / yüzey) insülin eyleminde tartışmalı bir rol oynar 8,10; ancak sporcularda artmış gibi görünüyor. Üçüncüsü, LD'lerin hücre altı lokalizasyonu önemlidir, çünkü yüzey zarının hemen altında bulunan LD'ler (subsarkolemmal veya periferik), insülin duyarlılığı üzerinde merkezi olanlardan daha zararlı bir etki gösterir 8,9,13. İkincisi, daha büyük bir solunum aktivitesine sahip olan ve kasılma için gereken yüksek enerji talebini karşılamak için daha uzmanlaşmış olan merkezi mitokondriye yakıt sağlar14. Buna karşılık, periferik LD'ler, membranla ilişkili süreçlerde yer alan subsarkolemmal mitokondrisağlar 8. Son olarak, trigliseritlerin ötesinde, kas içindeki spesifik kompleks lipitler diğerlerinden daha zararlı olabilir. Örneğin, diasilgliserol, uzun zincirli açil-CoA ve seramidler, trigliserit devir hızı düşük olduğunda kaslarda birikebilir ve böylece insülin sinyalini 9,15 oranında bozabilir. "Sporcunun paradoksu" na geri dönersek, dayanıklılık sporcuları tip I (oksidatif) liflerde yüksek devir hızlarına sahip çok sayıda daha küçük merkezi LD'ye sahipken, obez ve diyabetik hastalar tip II (glikolitik) liflerde düşük devir oranlarına sahip daha büyük periferik LD'lere sahiptir 8,15,16. Enerji depolama ve salınımındaki rollerine ek olarak, türetilmiş yağ asitleri (FA) ve bir kaplama proteini (perilipin 5) yoluyla LD'ler, FA oksidasyonu ve mitokondriyal biyogenez8'in transkripsiyonel düzenlenmesinde rol oynayan kritik oyuncular olarak da işlev görebilir. Fizyoloji ve patofizyolojideki önemli etkileri nedeniyle, LD'lerin dinamikleri ve fonksiyonları üzerine derinlemesine çalışmalar yapılması gerekmektedir.
IMCL'leri incelemek için çeşitli teknikler olmasına rağmen, hepsi LD boyutunu, yoğunluğunu ve dağılımını liflere özgü bir şekilde doğru bir şekilde ölçmek için uygun değildir. Örneğin, IMCL'lerin manyetik rezonans spektroskopisi ile değerlendirilmesi, invaziv olmamakla birlikte, fiber içindeki LD'lerin boyutunu ve kesin konumunu incelemek için yeterli olmayan bir çözünürlük seviyesi sunar ve fiber tipine özgüdeğildir 17,18. Benzer şekilde, tüm kas homojenatları üzerinde uygulanan biyokimyasal teknikler19, lipitlerin yerini ve boyutunu değerlendiremez. Sonuç olarak, LD morfolojisini ve yerini analiz etmek için en uygun yöntem kantitatif iletim elektronik mikroskopisi13'tür, ancak bu teknik pahalı ve zaman alıcıdır. Bu nedenle, Oil Red O (ORO)20,21, monodansylpentane (MDH)22 veya Bodipy23,24,25 gibi boyalı preparatlarda konfokal floresan görüntüleme bu çalışmalar için en iyi araç olarak ortaya çıkmıştır.
Burada, doku örneklemesi ve işleme, Bodipy boyama ve fare kası kriyökesimlerinde LD boyutunu, sayısını ve lokalizasyonunu ölçmek için konfokal görüntü elde etme ve analiz dahil olmak üzere eksiksiz bir protokol açıklanmaktadır. IMCL'ler oksidatif ve glikolitik lifler arasında eşit olarak dağılmadığından ve her lif tipi LD dinamiklerini farklı şekilde düzenlediğinden, IMCL'lerin incelenmesi lif tipine özgü 16,25,26,27 olmalıdır. Bu nedenle, bu protokol, her bir lif tarafından eksprese edilen miyozin ağır zincir (MyHC) izoformlarını tanımlamak için seri kesitlerde immünofloresan kullanır. Bu protokolün bir diğer avantajı, donmadan önce yan yana yerleştirilmiş bir glikolitik (ekstansör digitorum longus, EDL) ve oksidatif (soleus) bir kasın eşzamanlı olarak işlenmesidir (Şekil 1). Bu eşzamanlı işleme sadece zaman kazandırmakla kalmaz, aynı zamanda numunelerin ayrı ayrı işlenmesi nedeniyle değişkenliği de önler.
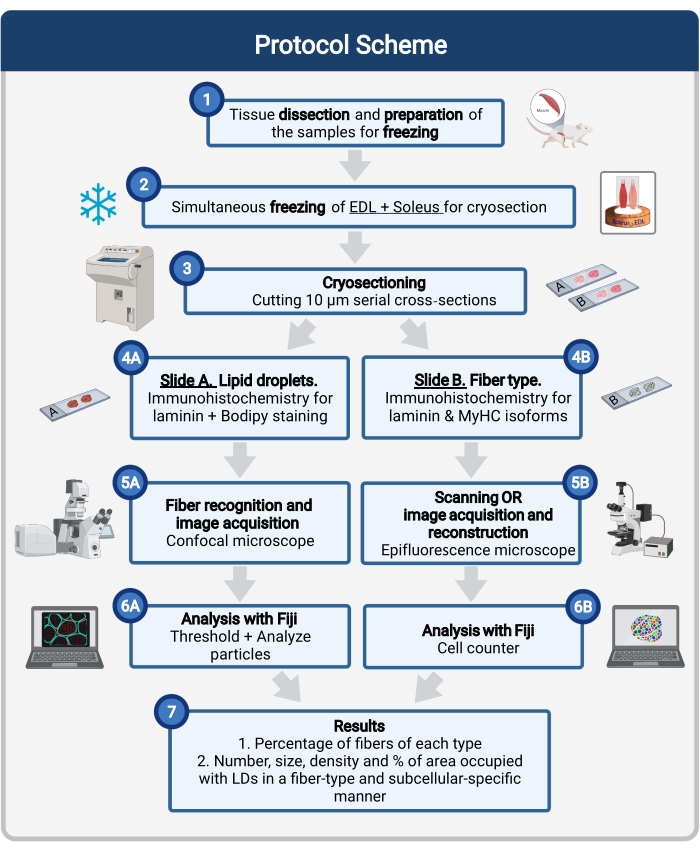
Şekil 1: Prosedüre şematik genel bakış. Kas diseksiyonundan sonra (1) benzer büyüklükte seçilmiş kaslar hazırlanır ve birlikte dondurulur (2). 10 μm'lik seri enine kesitler bir kriyostat kullanılarak elde edilir ve doğrudan yapışma kızaklarına monte edilir (3). İki seri slayttan, birincisi (4A) laminin için immüno-etiketlenir ve LD'leri tanımak için Bodipy ile boyanır ve ikincisi (4B) kas lifi tiplerinin tanınması için MyHC'lere karşı antikorlarla immünoboyalıdır. Görüntüler Bodipy (5A) için bir konfokal mikroskop ve kas lifi tipleri (5B) için bir epifloresan mikroskop kullanılarak elde edilir. Görüntüler, LD'lerin (7) kapladığı toplam alanın sayısını, ortalama boyutunu, yoğunluğunu ve yüzdesini elde etmek için bir eşik uygulanarak ve parçacıkları (6A) ölçerek veya bölümdeki (7) her bir tipteki liflerin yüzdesini elde etmek için hücreleri (6B) sayarak analiz edilir. Kısaltmalar: LD'ler = lipit damlacıkları; EDL = ekstansör digitorum longus; MyHC'ler = miyozin ağır zincir izoformları. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
Fareler üzerinde yürütülen tüm prosedürler, Université Catholique de Louvain'deki Tıp Sektöründen Hayvan Deneyleri Etik Komitesi tarafından onaylanmıştır (2019 / UCL / MD / 013).
1. Numunelerin dondurulması için diseksiyonu ve hazırlanması
- Her kas çifti için 3 mm kalınlığında bir mantar parçasını etiketleyin.
- Mantarın ortasına bir bıçakla yapılan küçük bir kesiden, dik olarak destek görevi görecek dikdörtgen bir sert plastik parçası (0,5 cm W, 1 cm H) yerleştirin (Şekil 2B).
NOT: Dikdörtgen plastik parçanın boyutu, kasın boyutuna bağlı olacaktır. Burada, tarif edilen boyutlar, 3 aylık bir C57BL / 6J erkek farenin soleus (~ 9 mg, 1 cm L, 2-3 mm W) ve EDL'sinin (~ 5 mg, 1 cm L, 2-3 mm W) boyutuna uyarlanmıştır. - Diseksiyon sırasında, fare arka bacağının soleus ve EDL'sini çıkarın. Diseksiyon sırasında numunelerin kurumasını önlemek için, buz üzerine yerleştirilmiş bir Petri kabında tuzlu su çözeltisi ile hafifçe nemlendirilmiş bir kompres üzerine yerleştirin.
NOT: Bu iki uzuv kasının nasıl diseke edileceğine dair açıklamalar için Wang ve ark.28'e bakınız. - Hava kabarcıklarını önleyerek mantar/plastik kavşağa küçük bir damla Optimum Kesme Sıcaklığı bileşiği (OCT) yerleştirin.
- Numunelerdeki fazla nemi, bir kağıt havluyla nazikçe kurutarak ortadan kaldırın (Şekil 2A) ve her iki kası da mantara dik plastik üzerine yerleştirin (Şekil 2C).
- Kas miyoliflerinin oryantasyonunu stereo mikroskop altında kontrol edin (Şekil 2D).
NOT: Kasın OCT ile örtülmemesi önemlidir, çünkü yalıtım etkisi hızlı donmayı önleyecek ve donma eserleri üretecektir.
2. Kriyoseksiyon için iskelet kası örneklerinin dondurulması
DİKKAT: Kasın dondurulması, uygun kişisel koruyucu ekipman giyilerek kimyasal bir başlık altında yapılmalıdır ( bkz.
- En az 25 cm uzunluğunda iki yan kayışı takılı paslanmaz çelik bir tambur (~8 cm H, 6 cm Ø) kullanın (Şekil 2F) ve tamburu kapasitesinin 2 / 3'üne kadar isopentan ile doldurun.
- Tamburu kayışlardan tutarak, sıvı azotla dolu bir polistiren kutuya hafifçe batırın, böylece kabın dışındaki azot seviyesi, içindeki isopentan seviyesinin üzerinde olur (Şekil 2F, G).
DİKKAT: Tambur azotla temas ettiğinde, termal şok dönmeye neden olabilir. Tambur yeterince daldırıldığından emin olun, ancak izonetan çökelmesine neden olacağından azot girişinden kaçının. Bu durumda, isopentanın soğumasına izin verin, tamburu yeni isopentan ile doldurun ve baştan başlayın. - Tamburun içi tamamen beyaz katı bir isopentan tabakası ile kaplandığında, sıvı azot kutusundan çıkarın (Şekil 2H).
NOT: İzopentanın erime sıcaklığı -159 °C olduğundan, tamburun kenarları yeterince soğuk olduğunda beyaza dönecektir. - Katı isopentan parçalarını, tüm hacim tekrar sıvı hale gelene kadar forseps ile kalan sıvı isopentana yavaşça karıştırın.
- İzopentan, tambur altta ve kenarlarında beyaz çakıl taşları oluşturana kadar tamburu sıvı azota tekrar daldırın (Şekil 2G, H).
NOT: Bu ikinci soğutma adımı, isopentanın uygun donma sıcaklığını sağlar. - Tamburu sıvı azottan çıkarın ve mantarı sıçan dişi cımbızla tutarak kasları tamburun dibine hızla batırın. Mantarı isopentanda 15 s döndürün ve işlenene kadar -80 ° C'de saklayın (Şekil 2I).
NOT: Kısa süreli depolama için, numuneler -20 °C dondurucuda muhafaza edilebilir. İskelet kasının hızlı bir şekilde dondurulması için tam protokol başka bir yerde yayınlanmıştır. Ayrıntılı referanslar ve sorun giderme için bakınız: Meng et al.29, Kumar et al.30 ve Leiva-Cepas et al.31.
3. Kriyoseksiyon
- Numuneleri daha önce -20 °C'ye soğutulmuş bir kriyostatın odasına ve bıçak sıcaklığını -25 °C'ye ayarlayın.
NOT: Numuneleri -20 °C/-80 °C dondurucudan kriyostata kuru buzla dolu polistiren bir kutuda taşıyın ve numunelerin kesimden önce oda sıcaklığına en az 20-30 dakika dengelenmesine izin verin. - Plastiği mantardan ince cımbızla çıkarın ve kriyostat numune diskini soğuması için hızlı dondurma plakasına yerleştirin. Plaka -50 ° C'ye ulaştığında, diske bir miktar OCT yerleştirin ve mantarı sıkıca bastırarak diskin üstüne hızlıca yerleştirin. OCT katılaşana ve mantar diske iyice sabitlenene kadar bekleyin.
- Diski nesne kafasına istenen kesme yönünde yerleştirin (Şekil 2J, K) ve kas bloğunu kasların uzunluğunun en az 1 / 3'ünün ötesinde ve kasların her iki kesiti görünene kadar kesin.
- Kesme kalınlığını 10 μm'ye ayarlayın ve parlak alan mikroskobunda liflerin doğru yönünü kontrol etmek için bir yapışma slaydına bir bölüm yerleştirin.
NOT: Liflerin enine yönünü kontrol etmek çok önemlidir. Lifler yeterince yönlendirilmemişse, nesne kafasının açısını ayarlayın, başka bir bölüm kesin ve tekrar kontrol edin. - Önceden etiketlenmiş iki adezyon slaydına iki seri kesit yerleştirin: biri fiber tiplerini belirlemek, diğeri lipit içeriğini ölçmek için slayttır (Şekil 2L).
NOT: Diğer histolojik çalışmalar için ek seri kesitler elde edilebilir ve -80 °C'de tutulabilir. Bununla birlikte, lipit içeriğinin ve hücre içi morfoloji24'ün değişmesini önlemek için, hava kurumasını önlemek için ilk iki slaytın kesimden hemen sonra işlenmesi esastır. LD ölçümü için slaytların dondurulması ve çözülmesi aynı etkiye sahip olacaktır ve bu nedenle oldukça tavsiye edilmez.
4. Lif tipleme ve Bodipy boyama
- Kas lifi tipinin immünohistokimyasal tespiti
NOT: Aşağıdaki protokol için, toplam 250 μL'lik bir çözelti hacmi, yaklaşık 1 sentlik bir madeni paranın büyüklüğünde hidrofobik bir kalemle çizilmiş bir daire ile çevrili tüm kas bölümünü kaplamak için yeterlidir.- Bölümleri hidrofobik kalemle çizilmiş bir taslakla çevreleyin ve oda sıcaklığında (RT) 1 dakika boyunca buz gibi soğuk 0,1 M fosfat tamponlu salin (PBS) ile durulayın. Slaytı nemli bir odaya yerleştirin ve bloke edici çözeltide 37 ° C'de 90 dakika boyunca bloke edin (PBS'de% 10 normal keçi serumu (NGS) ve fare üzerinde 1:30 fare (MOM) bloke edici reaktif).
- Bloke edici çözeltiyi çıkarın ve slaytları 37 ° C'de 90 dakika boyunca birincil antikorları (% 5 NGS, 1:30 MOM bloke edici reaktif, tip I (IgG2b, 1:10'da), tip IIa'yı (IgG1, 1:10'da) ve tip IIx (IgM, 1:5'te) lifleri ve bir sıçan anti-laminini (α2 zinciri, 1:1.000) PBS cinsinden.
- Slaytları RT'de PBS 3 x 5 dakika ile yıkayın.
- İkincil antikorları (keçi anti-IgG2b AF405 (1:500), keçi anti-IgG1 AF488 (1:500), keçi anti-IgM AF568 (1:1.000) ve PBS'de keçi anti-laminin AF647 (1:500) içeren çözelti ile RT'de karanlıkta slaytları 1 saat boyunca inkübe edin.
DİKKAT: Protokolün geri kalanında, floresanı korumak için slaytları ışıktan uzak tuttuğunuzdan emin olun. - PBS'de tekrar 3 x 5 dakika yıkayın, çift damıtılmışH2O'da durulayın, fazla suyu çıkarın ve bir antifade reaktifi ile monte edin.
NOT: Görüntü elde edilene kadar floresansı korumak için slaytları 4 °C'de ışıktan korunmuş olarak saklayın. Slaytlar sabit olmadığından, her deney için yeni yapılmış çözeltilerin kullanılması, PBS'nin otoklavlanması ve bölümlerin kirlenmesini önlemek için görüntülerin mümkün olan en kısa sürede elde edilmesi önerilir.
- LD'lerin Bodipy ile boyanması
NOT: Adım 4.1.'e benzer şekilde, toplam 250 μL'lik bir çözelti hacmi, yaklaşık 1 sentlik bir madeni paranın büyüklüğünde hidrofobik bir kalemle çizilmiş bir daire ile çevrili tüm kas bölümünü kaplamak için yeterlidir.- Bölümleri hidrofobik bir kalemle çizilmiş bir taslakla çevreleyin ve RT'de 10 dakika boyunca buz gibi soğuk 0,1 M PBS ile durulayın.
- RT'de 10 dakika boyunca metanol içermeyen soğuk% 4 paraformaldehit (PFA) ile sabitleyin. İlk hızlı durulamadan sonra, slaytları RT'de PBS 3 x 5 dakika ile yıkayın.
DİKKAT: Bu adımı kimyasal bir başlık altında gerçekleştirin. - Slaytı nemli bir odaya yerleştirin ve PBS'de% 5 NGS ile RT'de 1 saat boyunca bloke edin.
- Slaytları 37 ° C'de 90 dakika boyunca primer antikor çözeltisi (% 2 NGS ve sıçan anti-laminini (PBS'de α2 zinciri, 1:1.000) ile inkübe edin. Slaytları RT'de PBS 3 x 5 dakika ile yıkayın.
DİKKAT: Protokolün geri kalanında, floresanı korumak için slaytları ışıktan uzak tuttuğunuzdan emin olun. - PBS'de keçi anti-sıçan-AF647 antikoru (1:500) içeren ikincil antikor çözeltisi ile RT'de 1 saat boyunca inkübe edin. Slaytları RT'de PBS 3 x 5 dakika ile yıkayın.
- PBS'de 4',6-diamidino-2-fenilindol (DAPI, 0,5 μg/mL) ve BODIPY (1 μg/mL) çözeltisi ile RT'de 20 dakika boyunca inkübe edin.
NOT: BODIPY stok çözeltisini hazırlamak için, DMSO'da 1 mg / mL'lik bir konsantrasyonda çözün. LD boyama için farklı Bodipy formülasyonları ticari olarak temin edilebilir. Yapılan seçime bağlı olarak, boyama yöntemi aynıdır (aynı adımlar, konsantrasyon ve kuluçka süresi); ancak, satın alma yöntemi biraz farklı olacaktır. - İlk hızlı durulamadan sonra, slaytları RT'de PBS 3 x 5 dakika ile yıkayın, çift damıtılmışH2O'da durulayın, fazla suyu çıkarın ve bir antifade reaktifi ile monte edin.
NOT: Görüntü elde edilene kadar floresansı korumak için slaytları ışıktan korunan 4 °C'de saklayın.
5. Görüntülerin elde edilmesi
NOT: Boyama protokolleri tamamlandıktan sonra, sadece kontaminasyonu önlemek için değil, aynı zamanda LD'lerin morfolojisini, boyutunu ve sayısını korumak için görüntü yakalamaya (takip eden 24 saat içinde) hemen devam etmek önemlidir.
- Örneklenen her kasın lif tiplerini değerlendirmek için görüntülerin elde edilmesi
NOT: Bu adım, tam slaytlı floresan tarama mikroskobu veya geleneksel bir epifloresan mikroskobu ile gerçekleştirilebilir. İkincisi ile, bölümü yeniden oluşturmak için görüntülerin manuel veya otomatik olarak dikilmesi yapılmalıdır.- Fiber tipi tanıma için, 10x/0.3 hedefi olan bir epifloresan mikroskobu kullanın. Sırasıyla tip I, IIa, IIx lifleri ve laminini algılamak için DAPI (405 nm), FITC, TRITC ve Cy5 için uyarma filtreleri seçin.
NOT: Tip IIb lifleri immüno-etiketli olmayacaktır. Siyah bir sarkoplazma ile sarkolemmanın sınırlarında laminin tarafından boyanmış lifler olarak tanınacaklardır. - Her kanal için uygun pozlama süresini ayarlayın.
- Geleneksel bir epifloresan mikroskobu kullanırken, kas rekonstrüksiyonunu kolaylaştırmak için her zaman aynı sırayı izleyerek tüm kasın görüntülerini elde edin. Bir görüntünün sağ kenarındaki liflerin aşağıdaki görüntünün sol kenarında da göründüğünden emin olun. Aynı şey görüntülerin üst ve alt kısımları için de geçerlidir (Şekil 3A).
NOT: Referans olarak, EDL'nin bir bölümü veya 3 aylık bir fareden disseke edilmiş soleus için, sırasıyla ortalama altı ve sekiz görüntü, tüm kas kesitini kapsayacaktır. - Kas tarandıktan sonra, yakalanan dijital görüntüleri, fiber morfolojisine (laminin) ve kas bölümünün histolojisine dayanarak, yeniden yapılandırma (dikiş) için herhangi bir görüntü işleme yazılımına yükleyin ve tüm kanallar (renkler) birleştirilmiş bir TIFF, PNG veya JPG dosyası olarak kaydedin (Şekil 3A).
- Fiber tipi tanıma için, 10x/0.3 hedefi olan bir epifloresan mikroskobu kullanın. Sırasıyla tip I, IIa, IIx lifleri ve laminini algılamak için DAPI (405 nm), FITC, TRITC ve Cy5 için uyarma filtreleri seçin.
- Laminin ve Bodipy ko-boyama ile görüntülerin elde edilmesi
NOT: Lif tipini tanımak ve yakalanan her tip için lif sayısının bir tahminine sahip olmak için, vücut lamininin görüntü alımına başlamadan önce lif tipi bölümün önceden taranması ve kasların yeniden yapılandırılması esastır (Şekil 3B).- Bodipy görüntü gözlemi ve elde etmek için, sayısal diyafram açıklığı 1.4 olan 40x yağ daldırma objektif lensli bir konfokal mikroskop kullanın.
- Şu ayarları kullanın: 1 AU'da iğne deliği, 2.048 piksel x 2.048 piksel çözünürlük, 0,08 μm'de piksel boyutu, tek yönlü mod, 4'te tarama hızı (~4 μs/piksel), satır ortalaması 4x olarak ve dijital yakınlaştırma 1 olarak ayarlandı.
- Bodipy-558/568 ve laminin-AF647 arasında çapraz konuşmayı önlemek için, konfokal yazılımda sıralı tarama modunu kullanın.
NOT: Seçilen boya Bodipy-493/503 olduğunda, Bodipy kanalı ile laminin-AF647 kanalı arasında çapraz geçiş olmadan eşzamanlı konfokal lazer tarama mümkündür. Bu, görüntülerin elde edilmesini hızlandıracaktır. - 488 nm lazer çizgisini veya argon lazer hattını kullanarak Bodipy-493/503'ü uyarın ve 561 nm diyot lazer hattını kullanarak Bodipy-555/568'i uyarın. Son olarak, laminin-AF647'yi 640 nm diyot lazer hattı ile tespit edin.
DİKKAT: Bodipy moleküllerinin fotobeyazlatmaya karşı çok hassas olduğunu unutmayın, bu nedenle gereksiz lazer taramasından kaçının. Lifleri tanımak için, laminin için sadece lazer kullanın. - Seçilen boyaya bağlı olarak, emisyon aralıklarını Bodipy-493/50324 için 570-650 nm ve Bodipy-558/568 için 565-620 nm olarak ayarlayın. Laminin için emisyon aralığını 656-700 nm olarak ayarlayın.
- Aralık göstergesinde doymuş piksellerin algılanmaması için kazancı ve dijital kazancı uygun şekilde ayarlayın. Ofseti ayarlayarak arka plan sinyalini düzeltin.
NOT: Filtre seçimi ve yukarıda belirtilen diğer tarama parametreleri her konfokal mikroskop için optimize edilmelidir. Örneklerden yakalanan tüm görüntülerin karşılaştırılması için yukarıda belirtilen tüm ayarların sabit tutulması önemlidir. - Konfokal mikroskopta görselleştirilenler arasında lif tipini tanımlamak için, fiber tipi immüno-tespitten sonra yeniden yapılandırılan bölümün görüntüsünün kontrol edildiği kişisel bir dizüstü bilgisayar kullanın (Şekil 3B).
- Bir grup lif doğru bir şekilde tanımlandıktan sonra, görüntüyü Bodipy ve laminin kanalları ile elde edin.
NOT: LD'lerin daha sonraki liflere özgü analizini kolaylaştırmak için MyHC tanıma için elde edilen görüntüde bu liflerin bulunduğu kas bölgesinde Bodipy-laminin görüntü adının not edilmesi önerilir.
6. Görüntülerin analizi
- Her kas örneğindeki lif tiplerinin analizi
- Fiji (veya ImageJ)32'de, fiber izoformlarını tespit etmek için kullanılan tüm kanalların birleştirilmesinden elde edilen yeniden yapılandırılmış kas ile TIFF, PNG veya JPG dosyasını açın.
- Hücre Sayma aracını başlatmak için, Eklentiler | | analiz edin Hücre sayacı | Hücre sayacı.
- Hücre sayacı penceresinde, Eylemler | Başlat.
- Aynı penceredeki sayaçlar altında, Tür 1'i seçin.
- Fiji ana penceresinde Değnek aracını seçin.
- Her türün lif sayısını ölçmek için, aynı türdeki her bir fibere tıklayın, böylece program tıklanan lif sayısını kaydeder.
- İşiniz bittiğinde, bir sonraki fiber türünü seçin ve aynı adımları tekrarlayın.
- Görüntünün tüm lifleri belirli bir fiber türüne atandığında, sonuçları bir tabloda görüntülemek için Hücre Sayacı penceresindeki Sonuçlar'a tıklayın.
- Dosya |'nı tıklayarak bu tabloyu e-tablo olarak kaydedin Sonuçlar penceresinde Farklı Kaydet.
- Hücre Sayımı penceresinde sırasıyla İşaretçileri Kaydet veya İşaretleyicileri Yükle'ye tıklayarak seçimleri istediğiniz zaman aynı görüntüye kaydedin ve yeniden yükleyin.
- Lipid damlacıklarının lif tipine bağımlı bir şekilde analizi
- LD'lerin nicelleştirilmesi için Fiji kullanarak konfokal üzerinde elde edilen Bodipy ve laminin görüntülerini analiz edin.
NOT: Yazarlar, analizi otomatikleştirmek için özelleştirilmiş bir makro tasarlamışlardır. Bu makro, nasıl kullanılacağına ilişkin adım adım bir açıklamayla birlikte, sırasıyla Ek Dosya 1 ve Ek Dosya 2 olarak kullanılabilir. - Fiji'den Bio-Format Importer'ın yardımıyla her görüntüyü açın. Yığını Şununla Görüntüle seçeneğinin altında Hyperstack | Renk modu, Varsayılan. Otomatik ölçeklendirme penceresinin seçili olduğundan emin olun.
NOT: Aşağıdaki adımlar, görüntüdeki bir fiberin analizi için protokolü açıklayacaktır, ancak görüntüde görünen tüm fiber sayısı kadar tekrarlanmalıdır. - Laminin kanalına göre fiberin sarkolemasını manuel olarak seçmek için serbest seçim aracını kullanın (Şekil 4A) ve ROI penceresindeki seçimi veya İlgi Alanı'nı ( ROI ) kaydetmek için klavyede T tuşuna basın.
- Fiji'nin ana penceresine gidin ve Analiz Et'e | Ölçümler'i ayarlayın ve açılır pencerede Alan ve Feret'in çapı'nı seçin. Kalan kutuları ve diğer parametreleri varsayılan olarak göründükleri gibi işaretlemeden bırakın.
- Seçilen elyafın Alanını ve Minimum Feret Çapını (MF) elde etmek için ROI penceresindeki Ölç'e tıklayın ve daha sonra kullanmak üzere not edin.
NOT: LD'leri analiz ederken, boyutlarının ve yoğunluklarının lifin merkezi ve çevresi (subsarkolemmal bölge-SS) arasında değiştiğini akılda tutmak önemlidir. Bu nedenle, analiz ayrı ayrı yapılmalıdır. - Fiberin orta kısmını sınırlamak için MF'nin 1/6 değerini hesaplayın.
NOT: Makroda, varsayılan MF değeri 6 olarak ayarlanır, bu da uygulanan azaltmanın MF'nin 1/6'sı olarak ayarlanacağı anlamına gelir. Bu değer, yüksek yağlı bir diyetle beslenen hayvanların soleusundan elde edilen ampirik verilere dayanarak seçildi. Bununla birlikte, her araştırmacı ampirik verilere ve analiz edilen kaslara, lif türüne ve hayvan durumuna dayanarak bu sayıyı değiştirmelidir. - YG penceresinde, ilk YG'nin bir kopyasını almak için Ekle'ye tıklayın ve pencerede görünen ikinci YG'yi seçin.
- Fiji'nin ana penceresinde, Düzenle | Seçim | Daha önce hesaplanan değeri (adım 6.2.6'dan.) sayıdan önce eksi işaretiyle büyütün ve tanıtın ve Tamam'a tıklayın. YG penceresinde, ikinci YG'yi silmek için Add [t] (üçüncü bir YG görünmelidir) ve Sil'e tıklayın.
NOT: Araştırmacı, YG penceresindeki Tümünü Göster kutusuna tıklayarak sonuçları kontrol edebilir. Bu noktada, biri lifin tüm çevresini çevreleyen (Şekil 4B) ve diğeri merkeze yerleştirilmiş (Şekil 4C) olmak üzere iki ROI görünmelidir. - YG penceresinde her iki YG'yi de seçin ve Diğer | XOR | Ekle[t]. Lifin çevresine karşılık gelen üçüncü bir ROI'nin görünmesini bekleyin (Şekil 4D).
- Diğer |'e tıklayarak yatırım getirilerini kaydedin Aynı liflerin daha sonra yeniden analiz edilmesi gerektiğinde yatırım getirilerini kaydetmek için kaydedin.
- Bodipy kanalını seçin ve Resim | tıklayarak Eşik aracını açın | ayarlama Fiji'nin ana penceresindeki eşik.
- Eşik açılır penceresinde değerleri 70/255 olarak ayarlayın, Yen'i seçin | S&B yöntemiyle tıklayın ve Koyu arka plan | Başvurun.
NOT: Eşikte uygulanan değerler, deneyin koşullarına bağlı olarak değişebilir ve analizi optimize etmek için eşik uygun şekilde ayarlanmalıdır. Bodipy sinyalinin beyaz olarak gösterilen eşik sınırının üzerinde ve arka planın siyah renkte olduğu bir Siyah Beyaz penceresi görünmelidir (Şekil 4E'deki orijinal Bodipy görüntüsünü Şekil 4F'deki görüntüyle karşılaştırın). - Fiji'nin ana penceresine gidin ve Analiz Et'e | Ölçümler'i ayarlayın ve açılır pencerede Alan , Alan kesiri ve Eşikle sınırla'yı seçin. Kalan kutuları ve diğer parametreleri varsayılan olarak göründükleri gibi işaretlemeden bırakın.
NOT: Araştırmacı, mükemmel bir küre için 1'den bir çizgi için 0'a kadar değişen küresel morfolojinin bir dizini olan LD'lerin "daireselliğini" analiz etmek istiyorsa, Ölçümleri Ayarla açılır penceresinin Şekil tanımlayıcıları kutusuna tıklayın. - YG penceresine gidin ve ilk YG'yi seçin. Fiji'nin ana penceresinde, Analiz Et'e tıklayın | Parçacıkları analiz etme aracı.
NOT: Bu araç, her seçimde parçacıkların kapladığı toplam alanın sayısını, boyutunu, kaplanan alanını ve yüzdesini ölçer ve sonuçları bir elektronik tablo dosyası olarak kaydeder. - Parçacıkları Analiz Et penceresinde değerleri 2'den Sonsuzluğa (2-Sonsuz) ayarlayın, Pikseller kutusunu işaretleyin, varsayılan dairesellik değerlerini koruyun, Özetle'yi seçin ve Tamam'a tıklayın.
NOT: Fiber üzerindeki sonuçları kontrol etmek için, Göster seçeneğinin altında, mevcut seçeneklerden herhangi birini seçin. Her LD'nin bilgilerinin bir tablodaki seçimde tanınmasını sağlamak için, Parçacıkları Analiz Et penceresindeki Sonuçları görüntüle seçeneğini işaretleyin. Elyafın toplam alanının analizinden elde edilen sonuçların ortalaması alınır ve birkaç sütunlu bir tabloda özetlenir (Sayım, Toplam Alan, Ortalama boyut, % Alan; bunlar parçacıkların sayısına [LD'ler], bu parçacıkların kapladığı alana, ortalama boyutlarına ve parçacıkların kapladığı seçimin toplam alanının yüzdesine karşılık gelir, sırasıyla). Yoğunluğu hesaplamak için, parçacık sayısını her seçimin toplam alanına bölün. - Merkezin ve lifin çevresinin değerlerini elde etmek için, her seferinde ikinci (merkez) ve üçüncü ROI'yi (çevre) seçerek 6.2.14 ve 6.2.15 adımlarını tekrarlayın.
- Dosya |'na tıklayarak sonuçları kaydedin Özet penceresinde olduğu gibi kaydedin.
NOT: Verilerin daha sonra birleştirilmesini ve istatistiksel analizini kolaylaştırmak için sonuçların atanan adına fiber türünü, durumu ve görüntü adını ekleyin. Aynı görüntüdeki liflerin geri kalanını analiz etmek için, 6.2.3 ile 6.2.17 arasındaki adımları yineleyin. İstatistiksel analiz için, hayvan başına her türden en az 10-15 lif analiz edilmelidir.
- LD'lerin nicelleştirilmesi için Fiji kullanarak konfokal üzerinde elde edilen Bodipy ve laminin görüntülerini analiz edin.
Sonuçlar
Burada açıklanan protokol, LD'leri fiber tipinde ve hücre altına özgü bir şekilde kolayca ölçmek için etkili bir yöntem sağlar. EDL ve soleus gibi benzer büyüklükteki iki kasın birlikte dondurulmasıyla, aşağıdaki adımlara harcanan zaman ve kaynakların nasıl yarı yarıya azaldığını gösterir.
İmmün boyama, görüntü elde etme ve yetişkin fare kaslarında eksprese edilen farklı MyHC izoformlarının analizi için eksiksiz bir protokol sağlanır. Bu protokol, ilk...
Tartışmalar
Burada ayrıntılı olarak açıklanan protokol, Bodipy ile etiketlenmiş LD'leri fiber tipi ve hücre altı spesifik olarak ölçmek için etkili bir yöntemi açıklamaktadır. Son yıllarda, ORO veya Sudan Black B gibi klasik lipit boyaları, nötr lipitlere (örneğin, Bodipy) bağlanan yeni bir hücre geçirgen, lipofilik, floresan boya dizisi ile değiştirilmiştir. Farklı konjugatlar olarak mevcut olan Bodipy'nin, LD'leri morfolojilerini, dinamiklerini ve diğer organellerle etkileşimlerini incelemek için etik...
Açıklamalar
Yazarların beyan edecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20) ve Société Francophone du Diabète (SFD-Roche Diabetes Care) tarafından verilen hibelerle desteklenmiştir. M.A.D.-L.d.C., Wallonie-Bruxelles Uluslararası Mükemmellik Programı'ndan burs aldı.
Yazarlar, Alice Monnier'e bu protokolün geliştirilmesine katkılarından dolayı ve Caroline Bouzin'e görüntü edinme sürecindeki uzmanlığı ve teknik yardımı için teşekkür eder. Ayrıca kriyostat ve mikroskoplara erişim için 2IP-IREC görüntüleme platformuna teşekkür ederiz (2IP-IREC Görüntüleme Platformu, Deneysel ve Klinik Araştırma Enstitüsü, Université Catholique de Louvain, 1200 Brüksel, Belçika). Son olarak, yazarlar Nicolas Dubuisson, Romain Versele ve Michel Abou-Samra'ya el yazmasının yapıcı eleştirileri için teşekkür eder. Bu makalenin bazı figürleri BioRender.com oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24x50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors - 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
Referanslar
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete's paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do's and don'ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır