Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Тип волокна и субклеточный специфический анализ содержания липидных капель в скелетных мышцах
В этой статье
Резюме
Все больше доказательств указывает на то, что чрезмерная инфильтрация липидов внутри скелетных мышц приводит к липотоксичности и диабету. Здесь мы представляем полный протокол, включая обработку тканей, окрашивание с помощью Bodipy, получение изображений и анализ, для количественной оценки размера, плотности и субклеточного распределения липидных капель специфическим для типа волокна способом.
Аннотация
Липидная инфильтрация скелетных мышц, известная как миостеатоз, увеличивается с ожирением и старением. Миостеатоз также недавно был обнаружен как негативный прогностический фактор для нескольких других расстройств, таких как сердечно-сосудистые заболевания и рак. Чрезмерная липидная инфильтрация уменьшает мышечную массу и силу. Это также приводит к липотоксичности и резистентности к инсулину в зависимости от общего внутримиоцеллюлярного содержания липидов, морфологии липидных капель (LD) и субклеточного распределения. Тип волокна (окислительный против гликолитического) также важен, поскольку окислительные волокна обладают большей способностью использовать липиды. Из-за их решающего значения в патофизиологии необходимы углубленные исследования динамики и функционирования ЛД в зависимости от типа волокна.
Здесь представлен полный протокол для количественной оценки внутримиоцеллевого содержания липидов и анализа морфологии LD и субклеточного распределения специфическим для типа волокна способом. С этой целью серийные мышечные криосекции окрашивали флуоресцентным красителем Бодипи и антителами против изоформ тяжелой цепи миозина. Этот протокол позволяет одновременно обрабатывать различные мышцы, экономя время и избегая возможных артефактов, а благодаря персонализированному макросу, созданному на Фиджи, также возможна автоматизация анализа LD.
Введение
Липидная инфильтрация скелетных мышц, известная как миостеатоз, увеличивается с ожирением и старением. Миостеатоз отрицательно коррелирует с мышечной массой и силой, а также с чувствительностью к инсулину1. Более того, недавние исследования показывают, что степень миостеатоза может быть использована в качестве прогностического фактора для других состояний, таких как сердечно-сосудистые заболевания2, неалкогольная жировая болезнь печени3 или рак4. Липиды могут накапливаться в скелетных мышцах между мышечными волокнами в виде экстрамиоклеточных липидов или внутри волокон, как внутримиоклеточные липиды (IMCL). ИМКЛ преимущественно хранятся в виде триглицеридов в липидных каплях (ЛД), которые используются в качестве метаболического топлива во время физических упражнений 5,6. Однако, когда предложение липидов превышает спрос или когда митохондрии становятся дисфункциональными, ИМКЛ будут вовлечены в резистентность мышц к инсулину, как это видно у метаболически нездоровых, тучных людей и у пациентов с диабетом 2 типа7. Интересно, что спортсмены на выносливость имеют аналогичные, если не более высокие, уровни ИМКЛ с теми, которые встречаются у пациентов с ожирением с сахарным диабетом 2 типа, сохраняя при этом высокую чувствительность к инсулину. Это явление описывается как «парадокс спортсмена»8,9 и объясняется более тонкой оценкой мышечных ЛД, связанной с их размером, плотностью, локализацией, динамикой и липидным видовым составом.
Во-первых, размер LD обратно коррелирует с чувствительностью к инсулину и физической подготовкой10,11. Фактически, меньшие ЛД демонстрируют относительно большую площадь поверхности для действия липазы и, таким образом, потенциально обладают большей способностью мобилизовать липиды12. Во-вторых, плотность LD (количество/поверхность) играет спорную роль в действии инсулина 8,10; тем не менее, похоже, что он увеличивается у спортсменов. В-третьих, важна субклеточная локализация ЛД, так как ЛД, расположенные чуть ниже поверхностной мембраны (субсарколеммальной или периферической), оказывают более вредное воздействие на чувствительность к инсулину, чем центральные 8,9,13. Последние обеспечивают топливо для центральных митохондрий, которые обладают большей дыхательной активностью и более специализированы для удовлетворения высокой потребности в энергии, необходимой для сокращения14. Напротив, периферические ЛД поставляют субсарколеммальные митохондрии, которые участвуют в мембранных процессах8. Наконец, помимо триглицеридов, специфические сложные липиды в мышцах могут быть более вредными, чем другие. Например, диацилглицерин, длинноцепочечный ацил-КоА и керамиды могут накапливаться в мышцах, когда скорость оборота триглицеридов низкая, тем самым ухудшая передачу сигналов инсулина 9,15. Возвращаясь к «парадоксу спортсмена», спортсмены на выносливость имеют большое количество меньших центральных ЛД с повышенными показателями оборота в волокнах типа I (окислительные), в то время как пациенты с ожирением и диабетом имеют более крупные периферические ЛД с низкими показателями оборота в волокнах типа II (гликолитические) 8,15,16. В дополнение к своей роли в хранении и высвобождении энергии, ЛД через производные жирные кислоты (FA) и белок оболочки (перилипин 5) также могут функционировать как критические игроки, участвующие в транскрипционной регуляции окисления FA и митохондриального биогенеза8. Из-за их решающего значения в физиологии и патофизиологии необходимы углубленные исследования динамики и функций ЛД.
Хотя существует несколько методов изучения ИМКЛ, не все они подходят для точной количественной оценки размера, плотности и распределения ЛД в зависимости от волокна. Например, оценка ИМКЛ с помощью магнитно-резонансной спектроскопии, будучи неинвазивной, предлагает уровень разрешения, который недостаточен для изучения размера и точного расположения ЛД в волокне, и он не является специфическим для типа волокна17,18. Аналогичным образом, биохимические методы, выполняемые на гомогенатах19 целых мышц, не могут оценить местоположение и размер липидов. Следовательно, наиболее адекватным методом анализа морфологии и местоположения ЛД является количественная трансмиссионная электронная микроскопия13, но этот метод является дорогостоящим и трудоемким. Поэтому конфокальная флуоресцентная визуализация препаратов с красителями, такими как Oil Red O (ORO)20,21, монодансилпентан (MDH)22 или Bodipy 23,24,25, стала лучшим инструментом для этих исследований.
Здесь описан полный протокол, включая отбор и обработку тканей, окрашивание Бодипи и получение и анализ конфокальных изображений для количественной оценки размера, количества и локализации LD в криосекциях мышц мыши. Поскольку ИМКЛ неравномерно распределены между окислительными и гликолитическими волокнами, и каждый тип волокон регулирует динамику ЛД по-разному, исследование ИМКЛ должно быть специфичным для типа волокна 16,25,26,27. Поэтому этот протокол использует иммунофлуоресценцию на последовательных участках для идентификации изоформы (изоформ) тяжелой цепи миозина (MyHC), экспрессируемой каждым волокном. Еще одним преимуществом этого протокола является одновременная обработка гликолитической (extensor digitorum longus, EDL) и окислительной (камбаловидной) мышцы, расположенной бок о бок перед замораживанием (рисунок 1). Такая одновременная обработка не только экономит время, но и позволяет избежать изменчивости за счет раздельной обработки образцов.
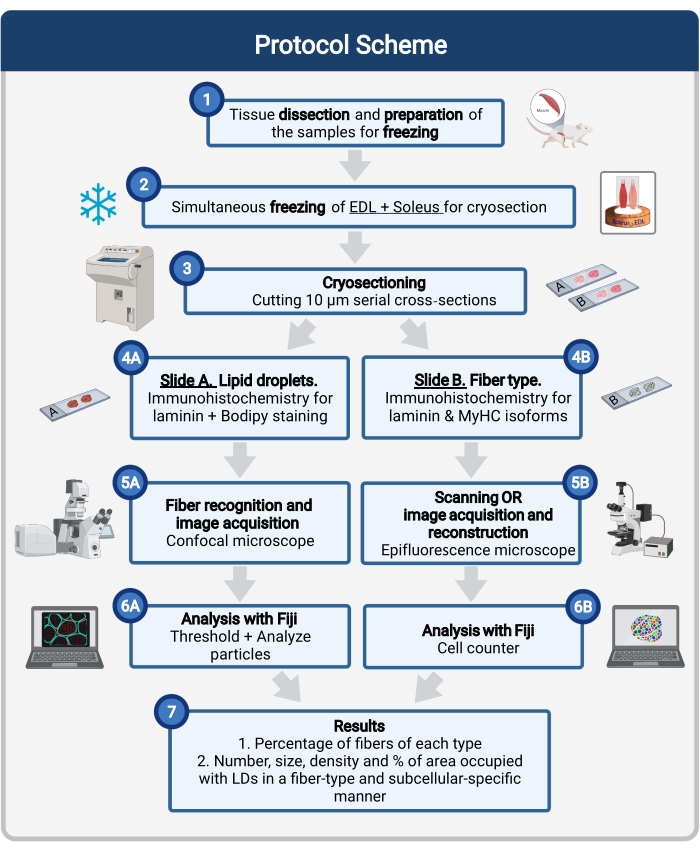
Рисунок 1: Схематический обзор процедуры. После рассечения мышц (1) выбранные мышцы аналогичного размера подготавливаются и замораживаются вместе (2). Последовательные поперечные сечения 10 мкм получают с помощью криостата и непосредственно монтируют на адгезионные слайды (3). Из двух последовательных слайдов первый (4A) иммуномаркирован для ламинина и окрашен Бодипи для распознавания ЛД, а второй (4B) иммуно загрязнен антителами против MyHC для распознавания типов мышечных волокон. Изображения получены с помощью конфокального микроскопа для Бодипи (5А) и эпифлуоресцентного микроскопа для типов мышечных волокон (5В). Изображения анализируются на Фиджи путем применения порога и количественной оценки частиц (6A) для получения количества, среднего размера, плотности и процента от общей площади, занимаемой ЛД (7) или счетными ячейками (6B) для получения процента волокон каждого типа в разделе (7). Сокращения: ЛД = липидные капли; EDL = разгибатель digitorum longus; MyHC = изоформы тяжелой цепи миозина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
протокол
Все процедуры, проведенные на мышах, были одобрены Этическим комитетом по экспериментам на животных из медицинского сектора в Католическом университете Лувена (2019 / UCL / MD / 013).
1. Вскрытие и подготовка образцов к замораживанию
- Нанесите на этикетку кусок пробки толщиной 3 мм для каждой пары мышц.
- Через небольшой разрез, выполненный лезвием по центру пробки, вставьте перпендикулярно прямоугольный кусок жесткого пластика (0,5 см W, 1 см H), который будет служить опорой (рисунок 2B).
ПРИМЕЧАНИЕ: Размер прямоугольного пластикового куска будет зависеть от размера мышцы. Здесь описанные размеры адаптированы к размеру камбалы (~9 мг, 1 см л, 2-3 мм W) и EDL (~5 мг, 1 см Л, 2-3 мм W) 3-месячного самца мыши C57BL/6J. - В момент рассечения удаляют камбалу и ЭДЛ задней конечности мыши. Чтобы образцы не высохли во время рассечения, поместите их на компресс, слегка смоченный солевым раствором, в чашку Петри, помещенную на лед.
ПРИМЕЧАНИЕ: См. Wang et al.28 для объяснений того, как препарировать эти две мышцы конечностей. - Поместите небольшую каплю компаунда оптимальной температуры резки (OCT) на стык пробки и пластика, избегая пузырьков воздуха.
- Удалите лишнюю влагу из образцов, аккуратно высушив их бумажным полотенцем (рисунок 2A) и поместив обе мышцы на пластик перпендикулярно пробке (рисунок 2C).
- Проверьте ориентацию мышечных миофибров под стереомикроскопом (рисунок 2D).
ПРИМЕЧАНИЕ: Важно не покрывать мышцу ОКТ, так как его изолирующий эффект предотвратит быстрое замерзание и приведет к образованию замерзающих артефактов.
2. Замораживание образцов скелетных мышц для криосекции
ВНИМАНИЕ: Замораживание мышцы должно производиться под химическим капюшоном, с использованием соответствующих средств индивидуальной защиты (см. Таблицу материалов).
- Используйте тумблер из нержавеющей стали (~8 см H, 6 см Ø) с двумя боковыми ремнями, прикрепленными к нему длиной не менее 25 см (рисунок 2F), и заполните тумблер до 2/3 его вместимости изопентаном.
- Захватив тумблер за ремни, осторожно погрузите его в полистирольную коробку, заполненную жидким азотом, чтобы уровень азота снаружи контейнера был выше уровня изопентана внутри (рисунок 2F, G).
ВНИМАНИЕ: Когда тумблер вступает в контакт с азотом, тепловой удар может вызвать закручивание. Убедитесь, что тумблер достаточно погружен, но избегайте попадания азота, так как это вызовет осаждение изопентана. Если это произойдет, дайте изопентану остыть, наполните тумблер новым изопентаном и начните все сначала. - Когда внутренняя часть тумблера будет полностью покрыта белым твердым слоем изопентана, выньте его из коробки с жидким азотом (рисунок 2H).
ПРИМЕЧАНИЕ: Температура плавления изопентана составляет -159 °C, края тумблера становятся белыми, когда будет достаточно холодно. - Осторожно перемешайте твердые кусочки изопентана в оставшийся жидкий изопентан щипцами, пока весь объем снова не станет жидким.
- Повторно погружайте стакан в жидкий азот до тех пор, пока изопентан не образует белую гальку по всему дну и краям тумблера (рисунок 2G,H).
ПРИМЕЧАНИЕ: Эта вторая стадия охлаждения обеспечивает соответствующую температуру замерзания изопентана. - Извлеките тумблер из жидкого азота и быстро окуните мышцы в нижнюю часть тумблера, удерживая пробку пинцетом зуба крысы. Закрутите пробку в течение 15 с в изопентане и храните при -80 °C до обработки (рисунок 2I).
ПРИМЕЧАНИЕ: Для краткосрочного хранения образцы могут храниться в морозильной камере при температуре -20 °C. Полный протокол быстрой заморозки скелетных мышц уже был опубликован в другом месте. Для получения подробных ссылок и устранения неполадок см.: Meng et al.29, Kumar et al.30 и Leiva-Cepas et al.31.
3. Криосечение
- Поместите образцы в камеру криостата, предварительно охлажденного до -20 °C, а температуру лопасти установите на -25 °C.
ПРИМЕЧАНИЕ: Транспортируйте образцы из морозильной камеры при температуре -20 °C/-80 °C в криостат в полистирольной коробке, заполненной сухим льдом, и позволяйте образцам уравновешиваться в течение не менее 20-30 мин до температуры камеры перед резкими. - Извлеките пластик из пробки тонким пинцетом и поместите диск с образцом криостата на пластину быстрой заморозки для охлаждения. Как только пластина достигнет -50 °C, поместите немного OCT на диск и быстро поместите пробку поверх диска, крепко надавливая. Подождите, пока OCT затвердеет и пробка хорошо закрепится на диске.
- Поместите диск на головку объекта в нужной режущей ориентации (рисунок 2J, K) и обрежьте мышечный блок за пределы по крайней мере 1/3 длины мышц и до тех пор, пока не будут видны оба поперечных сечения мышц.
- Установите толщину резания на 10 мкм и поместите одну секцию на адгезионный слайд, чтобы проверить правильную ориентацию волокон на микроскопе Brightfield.
ПРИМЕЧАНИЕ: Проверка поперечной ориентации волокон имеет решающее значение. Если волокна недостаточно ориентированы, отрегулируйте угол наклона головки объекта, вырежьте еще один участок и проверьте еще раз. - Поместите два последовательных поперечных сечения на два предварительно маркированных адгезионных слайда: один слайд для определения типов волокон, другой для количественной оценки содержания липидов (рисунок 2L).
ПРИМЕЧАНИЕ: Дополнительные последовательные поперечные сечения могут быть получены и сохранены при -80 °C для других гистологических исследований. Однако, чтобы избежать изменения содержания липидов и внутриклеточной морфологии24, важно обработать первые два слайда сразу после резки, чтобы предотвратить высыхание воздуха. Замораживание и размораживание слайдов для количественной оценки ЛД будет иметь тот же эффект и, таким образом, крайне нецелесообразно.
4. Типирование волокон и окрашивание Bodipy
- Иммуногистохимическое обнаружение типа мышечных волокон
ПРИМЕЧАНИЕ: Для следующего протокола общего объема раствора 250 мкл достаточно, чтобы покрыть весь мышечный участок, окруженный кругом, нарисованным гидрофобной ручкой приблизительного размера монеты в 1 цент.- Окружить участки контуром, нарисованным гидрофобной ручкой, и промыть ледяным 0,1 М фосфатно-буферным физиологическим раствором (PBS) в течение 1 мин при комнатной температуре (RT). Поместите слайд во влажную камеру и блокируйте в течение 90 мин при 37 °C в блокирующем растворе (10% нормальная козья сыворотка (NGS) и 1:30 мышиный (MOM) блокирующий реагент в PBS).
- Удалить блокирующий раствор и инкубировать слайды в течение 90 мин при 37 °C раствором, содержащим первичные антитела (5% NGS, 1:30 MOM блокирующий реагент, первичные антитела мыши для распознавания типа I (IgG2b, в 1:10), типа IIa (IgG1, в 1:10) и типа IIx (IgM, при 1:5) волокна и крысиный антиламинин (α2 цепь, 1:1,000) в PBS.
- Мойте слайды с помощью PBS 3 x 5 мин на RT.
- Инкубируйте слайды в темноте в течение 1 ч на RT раствором, содержащим вторичные антитела (козий анти-IgG2b AF405 (1:500), козий анти-IgG1 AF488 (1:500), козий анти-IgM AF568 (1:1000) и козий анти-ламинин AF647 (1:500) в PBS).
ВНИМАНИЕ: Для остальной части протокола убедитесь, что слайды держатся подальше от света, чтобы сохранить флуоресценцию. - Снова вымойте 3 х 5 мин в PBS, промойте в двойном дистиллированном H2O, удалите лишнюю воду и установите с помощью антизатухающего реагента.
ПРИМЕЧАНИЕ: Храните слайды при температуре 4 °C, защищенные от света, чтобы сохранить флуоресценцию до получения изображения. Поскольку слайды не фиксированы, рекомендуется использовать свежеприготовленные растворы для каждого эксперимента, автоклав PBS и получение изображений как можно скорее, чтобы избежать загрязнения секций.
- Окрашивание ЛД с помощью Bodipy
ПРИМЕЧАНИЕ: Подобно шагу 4.1, общий объем раствора в 250 мкл достаточен для покрытия всего мышечного участка, окруженного кругом, нарисованным гидрофобной ручкой приблизительного размера монеты в 1 цент.- Окружите секции контуром, нарисованным гидрофобной ручкой, и промойте ледяным 0,1 М PBS в течение 10 минут на RT. Используйте ледяной PBS для всех ополаскивателей и стирок.
- Зафиксировать с холодным 4% параформальдегидом (ПФА) без метанола в течение 10 мин при РТ. После первого быстрого ополаскивания вымойте слайды PBS 3 x 5 мин на RT.
ВНИМАНИЕ: Выполните этот шаг под химическим капотом. - Поместите затвор во влажную камеру и блокируйте на 1 ч при RT с 5% NGS в PBS.
- Инкубировать слайды в течение 90 мин при 37 °C раствором первичного антитела (2% NGS и крысиного антиламинина (α2 цепь, 1:1000) в PBS). Мойте слайды с помощью PBS 3 x 5 мин на RT.
ВНИМАНИЕ: Для остальной части протокола убедитесь, что слайды держатся подальше от света, чтобы сохранить флуоресценцию. - Инкубировать в течение 1 ч на RT с раствором вторичного антитела, содержащим антитело козьего анти-крысы-AF647 (1:500) в PBS. Мойте слайды с помощью PBS 3 x 5 мин на RT.
- Инкубировать в течение 20 мин на РТ раствором 4',6-диамидино-2-фенилиндола (DAPI, 0,5 мкг/мл) и БОДИПИ (1 мкг/мл) в PBS.
ПРИМЕЧАНИЕ: Для приготовления готового раствора BODIPY растворите его в ДМСО в концентрации 1 мг/мл. Различные составы Bodipy коммерчески доступны для окрашивания LD. В зависимости от сделанного выбора, метод окрашивания одинаков (одинаковые этапы, концентрация и время инкубации); однако метод приобретения будет несколько иным. - После первого быстрого ополаскивания промойте горки PBS 3 x 5 мин при RT, промойте в двойном дистиллированном H2O, удалите лишнюю воду и установите с помощью антитеплевидного реагента.
ПРИМЕЧАНИЕ: Храните слайды при температуре 4 °C, защищенные от света, чтобы сохранить флуоресценцию до получения изображения.
5. Получение изображений
ПРИМЕЧАНИЕ: После того, как протоколы окрашивания были завершены, важно немедленно приступить к получению изображения (в течение следующих 24 часов), не только чтобы избежать загрязнения, но и сохранить морфологию, размер и количество ЛД.
- Получение изображений для оценки типов волокон каждой отобранной мышцы
ПРИМЕЧАНИЕ: Этот шаг может быть достигнут с помощью цельноскользящего флуоресцентного сканирующего микроскопа или с помощью обычного эпифлуоресцентного микроскопа. С последним, ручная или автоматическая сшивка изображений должна быть выполнена для реконструкции раздела.- Для распознавания волоконного типа используйте эпифлуоресцентный микроскоп с объективом 10x/0.3. Выберите фильтры возбуждения для DAPI (405 нм), FITC, TRITC и Cy5 для обнаружения волокон типа I, IIa, IIx и ламинина соответственно.
ПРИМЕЧАНИЕ: Волокна типа IIb не будут иммуномаркированы. Они будут распознаваться как волокна, окрашенные ламинином на границах сарколеммы с черной саркоплазмой. - Отрегулируйте соответствующее время экспозиции для каждого канала.
- При использовании обычного эпифлуоресцентного микроскопа всегда получайте изображения всей мышцы в том же порядке, чтобы облегчить реконструкцию мышц. Убедитесь, что волокна на правом краю одного изображения также отображаются на левом краю следующего изображения. То же самое относится к верхней и нижней частям изображений (рисунок 3A).
ПРИМЕЧАНИЕ: В качестве справки, для участка EDL или камбалы, рассеченной у 3-месячной мыши, в среднем шесть и восемь изображений, соответственно, будут охватывать все поперечное сечение мышц. - После сканирования мышцы загрузите захваченные цифровые изображения в любое программное обеспечение для обработки изображений для реконструкции (сшивания) на основе морфологии волокна (ламинина) и гистологии мышечного отдела и сохраните его в виде файла TIFF, PNG или JPG со всеми объединенными каналами (цветами) (рисунок 3A).
- Для распознавания волоконного типа используйте эпифлуоресцентный микроскоп с объективом 10x/0.3. Выберите фильтры возбуждения для DAPI (405 нм), FITC, TRITC и Cy5 для обнаружения волокон типа I, IIa, IIx и ламинина соответственно.
- Получение изображений с помощью совместного окрашивания ламинина и бодипи
ПРИМЕЧАНИЕ: Чтобы распознать тип волокна и получить оценку количества захваченных волокон для каждого типа, важно, чтобы участок типа волокна уже был отсканирован, а мышцы реконструированы перед началом получения изображения Бодипи-ламинина (рисунок 3B).- Для наблюдения и получения изображений Bodipy используйте конфокальный микроскоп с 40-кратным масляным погружным объективом с числовой диафрагмой 1,4.
- Используйте следующие настройки: точечное отверстие при 1 а.е., разрешение 2 048 пикселей x 2 048 пикселей, размер пикселя 0,08 мкм, однонаправленный режим, скорость сканирования при 4 (~4 мкс/пиксель), усреднение линии в 4 раза и цифровой зум, равный 1.
- Чтобы избежать перекрестных помех между Bodipy-558/568 и laminin-AF647, используйте режим последовательного сканирования в конфокальном программном обеспечении.
ПРИМЕЧАНИЕ: Если выбран краситель Bodipy-493/503, возможно одновременное конфокальное лазерное сканирование без перекрестных помех между каналом Bodipy и каналом laminin-AF647. Это ускорит получение изображений. - Возбуждайте Бодипи-493/503 с помощью лазерной линии 488 нм или аргоновой лазерной линии и возбуждайте Бодипи-555/568 с помощью диодной лазерной линии 561 нм. Наконец, обнаружение ламинина-AF647 с помощью 640 нм диодной лазерной линии.
ВНИМАНИЕ: Имейте в виду, что молекулы Bodipy очень чувствительны к фотоотбеливанию, поэтому избегайте ненужного лазерного сканирования. Чтобы распознать волокна, используйте только лазер для ламинина. - В зависимости от выбранного красителя устанавливают диапазоны излучения на уровне 570-650 нм для Бодипи-493/50324 и на уровне 565-620 нм для Бодипи-558/568. Установите диапазон излучения для ламинина на уровне 656-700 нм.
- Установите коэффициент усиления и цифровой коэффициент усиления соответствующим образом, чтобы на индикаторе диапазона не обнаруживались насыщенные пиксели. Исправьте фоновый сигнал, отрегулировав смещение.
ПРИМЕЧАНИЕ: Выбор фильтра и другие вышеупомянутые параметры сканирования должны быть оптимизированы для каждого конфокального микроскопа. Важно, чтобы все вышеупомянутые настройки были постоянными для всех изображений, снятых из образцов, подлежащих сравнению. - Чтобы определить тип волокна среди визуализированных на конфокальном микроскопе, используйте персональный ноутбук, на котором проверяется изображение реконструированного после иммунодетекции по типу волокна (рисунок 3В).
- Как только группа волокон будет правильно идентифицирована, получите изображение с каналами Бодипи и Ламинина.
ПРИМЕЧАНИЕ: Рекомендуется отметить название изображения Bodipy-laminin на области мышцы, где эти волокна расположены на изображении, полученном для распознавания MyHC, чтобы облегчить более поздний анализ ЛД.
6. Анализ изображений
- Анализ типов волокон на каждом образце мышц
- На Фиджи (или ImageJ)32 откройте файл TIFF, PNG или JPG с реконструированной мышцей, полученной в результате слияния всех каналов, используемых для обнаружения изоформ волокон.
- Чтобы запустить инструмент «Подсчет клеток », нажмите « Плагины» | Анализ | счетчик ячеек | Счетчик ячеек.
- В окне Счетчик ячеек нажмите на Действия | Инициализация.
- В разделе Счетчики в том же окне выберите Тип 1.
- В главном окне Фиджи выберите инструмент «Палочка ».
- Чтобы количественно оценить количество волокон каждого типа, нажмите на каждое волокно одного типа, чтобы программа записывала количество нажатых волокон.
- После завершения выберите следующий тип волокна и повторите те же шаги.
- Когда все волокна изображения были назначены заданному типу волокна, нажмите « Результаты» в окне «Счетчик ячеек », чтобы отобразить результаты в таблице.
- Сохраните эту таблицу как таблицу электронной таблицы, щелкнув Файл | Сохранить как в окне Результаты .
- Сохраните и перезагрузите выделенные фрагменты на одном и том же изображении в любое время, нажав кнопку Сохранить маркеры или Загрузить маркеры соответственно в окне Подсчет ячеек .
- Анализ липидных капель в зависимости от типа волокна
- Проанализируйте изображения Бодипи и ламинина, полученные на конфокале с использованием Фиджи для количественной оценки ЛД.
ПРИМЕЧАНИЕ: Авторы разработали настраиваемый макрос для автоматизации анализа. Этот макрос вместе с пошаговым объяснением того, как его использовать, доступен в виде дополнительного файла 1 и дополнительного файла 2 соответственно. - Откройте каждое изображение с помощью импортера биоформатов из Фиджи. Под параметром View Stack with выберите Hyperstack | Цветовой режим, по умолчанию. Убедитесь, что выбрано окно Автомасштабирование .
ПРИМЕЧАНИЕ: Следующие шаги будут описывать протокол анализа одного волокна на изображении, но его необходимо повторять столько раз, сколько целых волокон появляется на изображении. - Используйте инструмент выбора от руки , чтобы вручную выбрать сарколемму волокна на основе канала ламинина (рисунок 4A) и нажать T на клавиатуре, чтобы записать выделение или область интереса (ROI) в окне ROI .
- Перейдите в главное окно Фиджи и нажмите « Анализировать | Установите параметр «Измерения» и во всплывающем окне выберите «Площадь » и диаметр Ферета. Оставьте остальные флажки неотмеченными, а другие параметры — такими, какими они отображаются по умолчанию.
- Нажмите « Измерить» в окне ROI , чтобы получить площадь и минимальный диаметр Ферета (MF) выбранного волокна, и запишите их для последующего использования.
ПРИМЕЧАНИЕ: При анализе ЛД важно иметь в виду, что их размер и плотность варьируются между центром и периферией (субсарколеммальной областью-SS) волокна. Поэтому анализ необходимо делать отдельно. - Рассчитайте значение 1/6 MF для разграничения центральной части волокна.
ПРИМЕЧАНИЕ: В макросе значение MF по умолчанию установлено равным 6, что означает, что примененное сокращение будет установлено как 1/6 MF. Это значение было выбрано на основе эмпирических данных, полученных от камбалы животных, которых кормили диетой с высоким содержанием жиров. Тем не менее, каждый исследователь должен изменить это число на основе эмпирических данных и проанализированных мышц, типа волокна и состояния животных. - В окне ROI нажмите Добавить , чтобы получить дубликат первого ROI, и выберите второй ROI, который появится в окне.
- В главном окне Фиджи нажмите редактировать | | выбора Увеличьте и введите ранее рассчитанное значение (из шага 6.2.6.) со знаком минус перед числом и нажмите OK. В окне ROI нажмите Add[t] (должен появиться третий ROI) и Delete, чтобы удалить второй ROI.
ПРИМЕЧАНИЕ: Исследователь может проверить результаты, нажав на поле Показать все в окне ROI . На этом этапе должны появиться два ROI, один из которых окружает весь периметр волокна (рисунок 4B), а другой расположен в центре (рисунок 4C). - Выберите оба ROI в окне ROI и нажмите «Подробнее» | | XOR Добавить[т]. Подождите, пока появится третья рентабельность инвестиций, которая соответствует периферии волокна (рисунок 4D).
- Сохраните рентабельность инвестиций, нажав кнопку Подробнее | Сохраните , чтобы сохранить ROI в случае, если потребуется последующий повторный анализ тех же волокон.
- Выберите канал Bodipy и откройте инструмент «Порог », нажав на Image | Отрегулируйте | Порог в главном окне Фиджи.
- Во всплывающем окне Порог установите значения 70/255, выберите Yen | Ч/Б метод и нажмите на Темный фон | Подать заявку.
ПРИМЕЧАНИЕ: Значения, применяемые к пороговому значению , могут варьироваться в зависимости от условий эксперимента, и пороговое значение должно быть соответствующим образом установлено для оптимизации анализа. Должно появиться ч/б окно с сигналом Bodipy выше порогового предела, показанного белым, и фоном в черном цвете (сравните исходное изображение Bodipy на рисунке 4E с изображением на рисунке 4F). - Перейдите в главное окно Фиджи и нажмите « Анализировать | Установите параметр «Измерения» и во всплывающем окне выберите «Площадь», «Доля области» и «Ограничить пороговым значением». Оставьте остальные флажки неотмеченными, а другие параметры — такими, какими они отображаются по умолчанию.
ПРИМЕЧАНИЕ: Если исследователь хочет проанализировать «цикличность» ЛД, которая представляет собой индекс сферической морфологии, который колеблется от 1 для идеальной сферы до 0 для линии, нажмите на поле Дескрипторы формы всплывающего окна «Набор измерений ». - Перейдите в окно ROI и выберите первый ROI. В главном окне Фиджи нажмите на Analyze | Инструмент анализа частиц.
ПРИМЕЧАНИЕ: Этот инструмент количественно определяет количество, размер, площадь покрытия и процент от общей площади, покрытой частицами на каждом выделении, и сохраняет результаты в виде файла электронной таблицы. - Установите значения от 2 до Infinity (2-Infinity) в окне Анализ частиц , установите флажок Пиксели , сохраните значения цикличности по умолчанию, выберите Суммировать и нажмите кнопку ОК.
ПРИМЕЧАНИЕ: Чтобы проверить результаты на волокне, в разделе Показать выберите любой из доступных вариантов. Чтобы информация о каждом LD распознавалась при выделении в таблице, установите флажок Отображать результаты в окне Анализ частиц . Результаты анализа общей площади волокна усредняются и обобщаются в таблице с несколькими столбцами (Count, Total Area, Average size, % Area; они соответствуют количеству частиц [LD], площади, занимаемой этими частицами, их среднему размеру и проценту от общей площади отбора, занимаемой частицами, соответственно). Чтобы вычислить плотность, разделите количество частиц на общую площадь каждого выделения. - Чтобы получить значения центра и периферии волокна, повторите шаги 6.2.14 и 6.2.15, каждый раз выбирая второй (центр) и третий ROI (периферия).
- Сохраните результаты, нажав на Файл | Сохраните как в окне Сводка .
ПРИМЕЧАНИЕ: Включите тип волокна, условие и имя изображения на присвоенное имя результатов, чтобы облегчить последующую унификацию и статистический анализ данных. Чтобы проанализировать остальные волокна на том же изображении, повторите шаги с 6.2.3 по 6.2.17. Для статистического анализа необходимо проанализировать не менее 10-15 волокон каждого типа на одно животное.
- Проанализируйте изображения Бодипи и ламинина, полученные на конфокале с использованием Фиджи для количественной оценки ЛД.
Access restricted. Please log in or start a trial to view this content.
Результаты
Протокол, описанный в настоящем описании, обеспечивает эффективный способ для легкой количественной оценки ЛД типом волокна и субклеточным специфическим способом. Он показывает, как, замораживая вместе две мышцы одинакового размера, такие как EDL и камбала, время и ресурсы, затрачиваем?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Протокол, подробно описанный здесь, описывает эффективный метод количественной оценки ЛД, помеченных Bodipy, на основе типа волокна и субклеточной основе. В последние годы классические липидные красители, такие как ORO или Sudan Black B, были заменены новым массивом клеточно-проницаемых, липофил...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликта интересов, о которых можно было бы заявить.
Благодарности
Эта работа была поддержана грантами Национального фонда научных исследований (FNRS-Crédit de Recherche J.0022.20) и Общества франкоязычных стран диабета (SFD-Roche Diabetes Care). C.M.S. является получателем стипендии Ph.D. от FRIA (FNRS). M.A.D.-L.d.C. получил стипендию от Международной программы передового опыта Валлония-Брюссель.
Авторы благодарят Элис Монье за ее вклад в разработку этого протокола и Кэролайн Бузин за ее опыт и техническую помощь в процессе получения изображений. Мы также благодарим платформу визуализации 2IP-IREC за доступ к криостату и микроскопам (2IP-IREC Imaging Platform, Институт экспериментальных и клинических исследований, Католический университет Лувена, 1200 Брюссель, Бельгия). Наконец, авторы хотели бы поблагодарить Николя Дюбюиссона, Ромена Верселя и Мишеля Абу-Самру за конструктивную критику рукописи. Некоторые из рисунков этой статьи были созданы с BioRender.com.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24x50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors - 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
Ссылки
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963(2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839(2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete's paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774(2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586(2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do's and don'ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793(2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327(2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273(2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , JTu3A.4 (Optical Society of America) (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168(2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , Chapter 24 (Unit 24.22) (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415(2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2(2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239(2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852(2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены