A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
סוג הסיבים וניתוח ספציפי תת-תאי של תכולת טיפות השומנים בשרירי השלד
In This Article
Summary
עדויות הולכות וגוברות מצביעות על כך שחדירה מוגזמת של שומנים בתוך שרירי השלד גורמת לליפטוקסיות ולסוכרת. כאן אנו מציגים פרוטוקול שלם, כולל עיבוד רקמות, צביעה עם Bodipy, רכישת תמונה וניתוח, כדי לכמת את הגודל, הצפיפות וההתפלגות התת-תאית של טיפות שומנים באופן ספציפי מסוג סיבים.
Abstract
חדירת שומנים בשריר השלד, המכונה מיואסטאטוזיס, עולה עם השמנת יתר והזדקנות. מיאוסטאטוזיס התגלתה לאחרונה גם כגורם פרוגנוסטי שלילי למספר הפרעות אחרות כגון מחלות לב וכלי דם וסרטן. חדירת שומנים מוגזמת מפחיתה את מסת השריר ואת כוחו. היא גם גורמת לליפטוקסיות ולתנגודת לאינסולין בהתאם לתכולת השומנים התוך-תאיים הכוללת, למורפולוגיה של טיפות השומנים (LD) ולפיזור התת-תאי. סוג הסיבים (חמצון לעומת גליקוליטי) חשוב גם הוא, שכן לסיבים חמצוניים יש יכולת גדולה יותר להשתמש בשומנים. בגלל ההשלכות הקריטיות שלהם בפתופיזיולוגיה, יש צורך במחקרים מעמיקים על דינמיקה ותפקוד של LD באופן ספציפי לסוג הסיבים.
להלן מוצג פרוטוקול מלא לכימות תכולת השומנים התוך-תאיים ולניתוח מורפולוגיה של LD והתפלגות תת-תאית באופן ספציפי לסוג הסיבים. לשם כך, קריוזקציות שרירים סדרתיות הוכתמו בצבע הפלואורסצנטי Bodipy ובנוגדנים נגד איזופורמים של שרשרת כבדה של מיוזין. פרוטוקול זה מאפשר עיבוד סימולטני של שרירים שונים, חוסך זמן ונמנע מממצאים אפשריים, ובזכות מאקרו מותאם אישית שנוצר בפיג'י, האוטומטיזציה של ניתוח LD אפשרית גם כן.
Introduction
חדירת שומנים בשריר השלד, המכונה מיואסטאטוזיס, עולה עם השמנת יתר והזדקנות. מיואסטאטוזיס מתואמת באופן שלילי עם מסת שריר וכוח ועם רגישות לאינסולין1. יתר על כן, מחקרים אחרונים מצביעים על כך שמידת המיוסטאטוזיס יכולה לשמש כגורם פרוגנוסטי למצבים אחרים כגון מחלות לב וכלי דם2, מחלת כבד שומני שאינה אלכוהולית3, או סרטן4. שומנים יכולים להצטבר בשרירי השלד בין סיבי השריר כשומנים חוץ-תאיים או בתוך הסיבים, כמו שומנים תוך-תאיים (IMCLs). IMCLs מאוחסנים בעיקר כטריגליצרידים בטיפות שומנים (LDs) המשמשים כדלק מטבולי במהלך פעילות גופנית 5,6. עם זאת, כאשר היצע השומנים עולה על הביקוש, או כאשר המיטוכונדריה הופכת לבלתי מתפקדת, IMCLs יהיו מעורבים בתנגודת לאינסולין בשרירים, כפי שניתן לראות אצל אנשים לא בריאים מבחינה מטבולית, שמנים ובחולי סוכרת מסוג 27. באופן מסקרן, לספורטאי סיבולת יש רמות דומות, אם לא גבוהות יותר, של IMCLs לאלה שנמצאו בחולים שמנים עם סוכרת מסוג 2, תוך שמירה על רגישות גבוהה לאינסולין. תופעה זו מתוארת כ"פרדוקס הספורטאי"8,9, והיא מוסברת על ידי הערכה ניואנסית יותר של LDs שרירים, הקשורים לגודלם, צפיפותם, לוקליזציה, דינמיקה והרכב מיני שומנים.
ראשית, גודל LD נמצא בקורלציה הפוכה לרגישות לאינסולין ולכושר גופני10,11. למעשה, LDs קטנים יותר מציגים שטח פנים גדול יחסית לפעולת ליפאז, ולכן, יש להם יכולת גדולה יותר לגייס שומנים12. שנית, צפיפות LD (מספר/משטח) ממלאת תפקיד שנוי במחלוקת בפעולתהאינסולין 8,10; עם זאת, נראה כי הוא גדל בספורטאים. שלישית, הלוקליזציה התת-תאית של LDs חשובה, שכן LDs הממוקמים ממש מתחת לממברנה של פני השטח (תת-סרקולמל או היקפי) מפעילים השפעה מזיקה יותר על הרגישות לאינסולין מאשר אלה המרכזיים 8,9,13. אלה האחרונים מספקים דלק למיטוכונדריה מרכזית, שיש לה פעילות נשימתית גדולה יותר ומתמחה יותר כדי לענות על הביקוש האנרגטי הגבוה הנדרש להתכווצות14. לעומת זאת, LDs היקפיים מספקים מיטוכונדריה תת-סרקולמלית, המעורבים בתהליכים הקשורים לממברנה8. לבסוף, מעבר לטריגליצרידים, שומנים מורכבים ספציפיים בתוך השריר עשויים להיות מזיקים יותר מאחרים. לדוגמה, דיאצילגליצרול, אציל-CoA ארוך שרשרת וסרמידים עשויים להצטבר בשריר כאשר שיעור תחלופת הטריגליצרידים נמוך, ובכך לפגוע באינסולין המאותתעל 9,15. אם נחזור ל"פרדוקס של הספורטאי", לספורטאי סיבולת יש מספר גבוה של LDs מרכזיים קטנים יותר עם שיעורי תחלופה גבוהים בסיבים מסוג I (חמצוניים), בעוד שלחולי השמנת יתר וסוכרת יש LD היקפיים גדולים יותר עם שיעורי תחלופה נמוכים יותר בסיבים מסוג II (גליקוליטי) 8,15,16. בנוסף לתפקידם באגירת ושחרור אנרגיה, LDs באמצעות חומצות שומן נגזרות (FA) וחלבון פרווה (פריליפין 5) יכולים גם לתפקד כשחקנים קריטיים המעורבים בוויסות השעתוק של חמצון FA וביוגנזה מיטוכונדריאלית8. בגלל ההשלכות המכריעות שלהם בפיזיולוגיה ובפתופיזיולוגיה, יש הצדקה למחקרים מעמיקים על דינמיקה ותפקודים של LDs.
למרות שישנן מספר טכניקות לחקר IMCLs, לא כולן מתאימות לכימות מדויק של גודל LD, צפיפותו והתפלגותו באופן ספציפי לסיבים. לדוגמה, ההערכה של IMCLs על ידי ספקטרוסקופיית תהודה מגנטית, למרות היותה לא פולשנית, מציעה רמת רזולוציה שאינה מספיקה כדי לחקור את הגודל והמיקום המדויק של LDs בתוך הסיבים, והיא אינה ספציפית מסוג סיבים17,18. כמו כן, טכניקות ביוכימיות המבוצעות על הומוגנטים של שרירים שלמים19 אינן יכולות להעריך את מיקומם וגודלם של שומנים. כתוצאה מכך, השיטה המתאימה ביותר לניתוח המורפולוגיה והמיקום של LD היא מיקרוסקופיה אלקטרונית של שידור כמותי13, אך טכניקה זו יקרה וגוזלת זמן רב. לכן, הדמיה פלואורסצנטית קונפוקלית על תכשירים עם צבעים כגון שמן אדום O (ORO)20,21, monodansylpentane (MDH)22, או Bodipy 23,24,25, התגלתה ככלי הטוב ביותר למחקרים אלה.
כאן מתואר פרוטוקול שלם, הכולל דגימה ועיבוד של רקמות, צביעת Bodipy, ורכישה וניתוח של תמונה קונפוקלית כדי לכמת את הגודל, המספר והלוקליזציה של LD בקריואזות שרירי העכבר. מאחר ש-IMCLs אינם מחולקים באופן שווה בין סיבים חמצוניים וגליקוליטיים, וכל סוג סיבים מווסת את הדינמיקה של LD באופן שונה, המחקר של IMCLs חייב להיות ספציפי מסוג סיבים 16,25,26,27. לכן, פרוטוקול זה משתמש באימונופלואורסצנציה בחתכים סדרתיים כדי לזהות איזופורמים של שרשרת כבדת מיוזין (MyHC) המבוטאים על ידי כל סיב. יתרון נוסף של פרוטוקול זה הוא עיבוד סימולטני של שריר גליקוליטי (extensor digitorum longus, EDL) ושריר חמצוני (סולוס) המונחים זה לצד זה לפני הקפאה (איור 1). עיבוד סימולטני זה לא רק חוסך זמן אלא גם מונע השתנות עקב עיבוד נפרד של הדגימות.
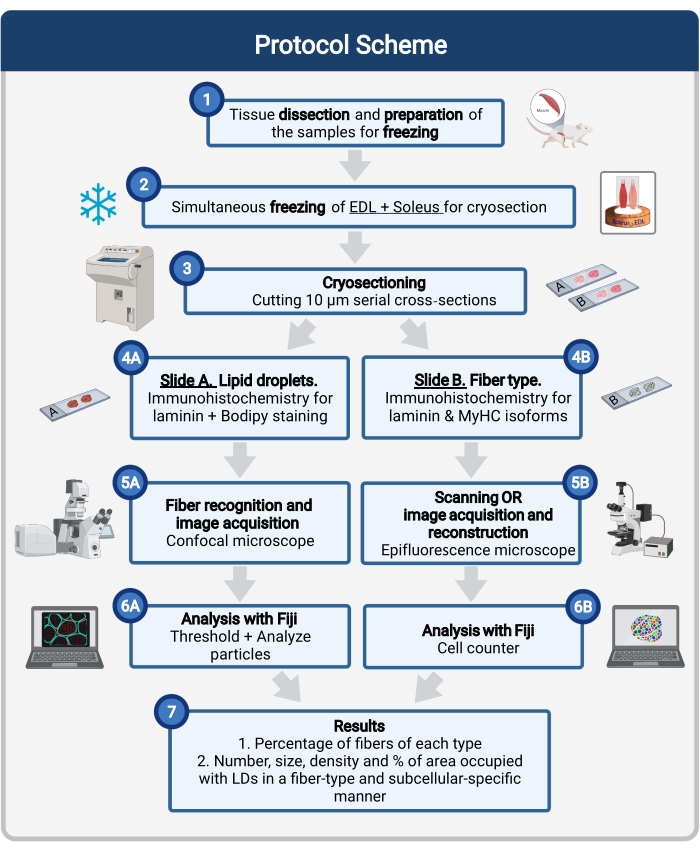
איור 1: סקירה סכמטית של ההליך. לאחר כריתת שרירים (1), השרירים שנבחרו בגודל דומה מוכנים ומקפואים יחד (2). מקטעים רוחביים טוריים של 10 מיקרומטר מתקבלים באמצעות קריוסטאט ומורכבים ישירות על שקופיות הידבקות (3). משתי שקופיות סדרתיות, הראשונה (4A) מסומנת באופן חיסוני ללאמינין ומוכתמת ב-Bodipy כדי לזהות LDs והשנייה (4B) מוכתמת בנוגדנים נגד MyHCs לזיהוי סוגי סיבי שריר. התמונות נרכשות באמצעות מיקרוסקופ קונפוקלי עבור Bodipy (5A) ומיקרוסקופ אפיפלואורסצנטי לסוגי סיבי שריר (5B). התמונות מנותחות בפיג'י על ידי החלת סף וכימות חלקיקים (6A) כדי לקבל את המספר, הגודל הממוצע, הצפיפות והאחוז של השטח הכולל שנכבש על ידי LDs (7) או ספירת תאים (6B) כדי לקבל את אחוז הסיבים מכל סוג בסעיף (7). קיצורים: LDs = טיפות שומנים; EDL = extensor digitorum longus; MyHCs = איזופורמים של שרשרת כבדה של מיוזין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
כל ההליכים שנערכו על עכברים אושרו על ידי הוועדה האתית לניסויים בבעלי חיים מהמגזר הרפואי באוניברסיטת קתוליק דה לוביין (2019/UCL/MD/013).
1. כריתה והכנת הדגימות להקפאה
- סמן פיסת פקק בעובי 3 מ"מ עבור כל זוג שרירים.
- באמצעות חתך קטן שנעשה עם להב במרכז הפקק, הוסיפו בניצב חתיכת פלסטיק מלבנית קשיחה (0.5 ס"מ רוחב, 1 ס"מ גובה) שתשמש כתמיכה (איור 2B).
הערה: גודל חתיכת הפלסטיק המלבנית יהיה תלוי בגודל השריר. כאן, הממדים המתוארים מותאמים לגודלם של הסולאוס (~9 מ"ג, 1 ס"מ ל', 2-3 מ"מ רוחב) ו-EDL (כ-5 מ"ג, 1 ס"מ ל', 2-3 מ"מ W) של עכבר זכר C57BL/6J בן 3 חודשים. - בזמן הנתיחה, הסר את הסולאוס וה- EDL של האיבר האחורי של העכבר. כדי למנוע מהדגימות להתייבש במהלך הנתיחה, הניחו אותן על קומפרס לח קלות עם תמיסת מלח בצלחת פטרי המונחת על קרח.
הערה: ראה Wang et al.28 להסברים כיצד לנתח את שני שרירי הגפיים הללו. - הניחו טיפה קטנה של תרכובת טמפרטורת חיתוך אופטימלית (OCT) בצומת השעם/פלסטיק, תוך הימנעות מבועות אוויר.
- יש למנוע לחות עודפת מהדגימות על-ידי ייבושן העדין במגבת נייר (איור 2A) ולהניח את שני השרירים על הפלסטיק בניצב לפקק (איור 2C).
- בדוק את הכיוון של שריר myofibers תחת מיקרוסקופ סטריאו (איור 2D).
הערה: חשוב לא לכסות את השריר עם OCT, שכן השפעת הבידוד שלו תמנע הקפאה מהירה ותיצור ממצאי הקפאה.
2. הקפאת דגימות שרירי השלד לצורך קריוזקציה
אזהרה: הקפאת השריר חייבת להיעשות תחת מכסה מנוע כימי, תוך לבישת ציוד מגן אישי מתאים (ראו טבלת החומרים).
- השתמשו בטומבלר מפלדת אל-חלד (כ-8 ס"מ גובה, 6 ס"מ Ø) עם שתי רצועות צד המחוברות אליו באורך של לפחות 25 ס"מ (איור 2F), ומלאו את הטמבלר עד 2/3 מקיבולתו באיזופנטן.
- תוך כדי אחיזת הטמבלר ברצועות, טבלו אותו בעדינות בקופסת פוליסטירן מלאה בחנקן נוזלי, כך שרמת החנקן שמחוץ למיכל תהיה מעל רמת האיזופנטן שבתוכה (איור 2F,G).
אזהרה: כאשר הטמבלר בא במגע עם החנקן, ההלם התרמי עלול לגרום למערבולת. ודא כי הטמבלר שקוע מספיק, אך הימנע מכניסת חנקן מכיוון שהדבר יגרום למשקעים איזופנטניים. אם זה קורה, תנו לאיזופנטן להתקרר, מלאו את הטמבלר באיזופנטן חדש והתחילו מחדש. - כאשר החלק הפנימי של הטמבלר מכוסה לחלוטין בשכבה מוצקה לבנה של איזופנטן, הוציאו אותו מקופסת החנקן הנוזלי (איור 2H).
הערה: טמפרטורת ההיתוך של איזופנטן היא -159 מעלות צלזיוס, הקצוות של הטמבלר יהפכו ללבנים כאשר הוא קר מספיק. - מערבבים בעדינות את חתיכות האיזופנטן המוצקות לתוך האיזופנטן הנוזלי שנותר עם מלקחיים עד שכל הנפח הופך שוב לנוזלי.
- לטבול מחדש את הטמבלר בחנקן הנוזלי עד איזופנטן יוצר חלוקי נחל לבנים בכל רחבי החלק התחתון והקצוות של הטמבלר (איור 2G,H).
הערה: שלב קירור שני זה מבטיח את טמפרטורת ההקפאה המתאימה של האיזופנטן. - מוציאים את הטמבלר מהחנקן הנוזלי ומטבלים במהירות את השרירים בתחתית הטמבלר, אוחזים את הפקק בפינצטה של שן חולדה. סובבו את הפקק במשך 15 שניות באיזופנטן ואחסנו אותו בטמפרטורה של -80 מעלות צלזיוס עד לעיבוד (איור 2I).
הערה: לאחסון לטווח קצר, ניתן לשמור את הדגימות במקפיא של -20 מעלות צלזיוס. הפרוטוקול המלא להקפאה מהירה של שרירי השלד כבר פורסם במקום אחר. להפניות מפורטות ולפתרון בעיות, ראו: Meng et al.29, Kumar et al.30, ו- Leiva-Cepas et al.31.
3. קריוזקציה
- הביאו את הדגימות לחדר של קריוסטאט שהתקרר בעבר ל-20 מעלות צלזיוס- וטמפרטורת הלהב נקבעה ל-25 מעלות צלזיוס.
הערה: להעביר דגימות מהמקפיא של -20 °C / -80 °C לקריוסטט בקופסת פוליסטירן מלאה בקרח יבש ולאפשר לדגימות להתאזן לפחות 20-30 דקות לטמפרטורת החדר לפני החיתוך. - מוציאים את הפלסטיק מהפקק עם פינצטה עדינה ומניחים את דיסק הדגימה הקריוסטטית על צלחת ההקפאה המהירה כדי להתקרר. לאחר שהצלחת הגיעה ל -50 מעלות צלזיוס, הניחו מעט OCT על הדיסק והניחו במהירות את הפקק על גבי הדיסק, תוך לחיצה חזקה. המתן עד שה- OCT יתמצק והפקק יתוקן היטב על הדיסק.
- מניחים את הדיסק על ראש העצם בכיוון החיתוך הרצוי (איור 2J,K) וחותכים את גוש השרירים מעבר לפחות ל-1/3 מאורך השרירים ועד ששני החתכים של השרירים נראים לעין.
- הגדר את עובי החיתוך ל-10 מיקרומטר והנח קטע אחד על שקופית הידבקות כדי לבדוק את הכיוון הנכון של הסיבים במיקרוסקופ שדה בהיר.
הערה: בדיקת הכיוון הרוחבי של הסיבים היא קריטית. אם הסיבים אינם מכוונים כראוי, התאם את זווית ראש האובייקט, חתך קטע אחר ובדוק שוב. - הניחו שני חתכים סדרתיים על שתי שקופיות הדבקה עם תווית מוקדמת: שקופית אחת לקביעת סוגי סיבים, והשנייה לכימות תכולת השומנים (איור 2L).
הערה: ניתן לקבל חתכים טוריים נוספים ולשמור אותם בטמפרטורה של -80 מעלות צלזיוס למחקרים היסטולוגיים אחרים. עם זאת, כדי להימנע משינוי תכולת השומנים והמורפולוגיה התוך תאית24, חיוני לעבד את שתי השקופיות הראשונות מיד לאחר החיתוך כדי למנוע ייבוש אוויר. להקפאה ולהפשרה של השקופיות לצורך כימות LD תהיה השפעה זהה ולכן היא מאוד לא רצויה.
4. הקלדת סיבים וצביעת בודיפי
- זיהוי אימונוהיסטוכימי של סוג סיבי השריר
הערה: עבור הפרוטוקול הבא, נפח תמיסה כולל של 250 μL מספיק כדי לכסות את כל חלק השרירים מוקף במעגל שצויר עם עט הידרופובי בגודל משוער של מטבע של 1 סנט.- הקיפו את המקטעים בקווי מתאר שצוירו בעט הידרופובי ושטפו עם מלח קר כקרח 0.1 מ' עם מאגר פוספט (PBS) למשך דקה אחת בטמפרטורת החדר (RT). הניחו את המגלשה בתא לח ובחסימה למשך 90 דקות בטמפרטורה של 37 מעלות צלזיוס בתמיסת חסימה (10% סרום עזים רגיל (NGS) ו-1:30 עכבר על עכבר (MOM) שחוסם ריאגנט ב-PBS).
- הסר את תמיסת החסימה ודגירה של השקופיות למשך 90 דקות ב- 37 °C עם התמיסה המכילה את הנוגדנים העיקריים (5% NGS, 1:30 MOM חוסם מגיב, הנוגדנים העיקריים של העכבר כדי לזהות את סוג I (IgG2b, בשעה 1:10), סוג IIa (IgG1, בשעה 1:10), וסוג IIx (IgM, בשעה 1:5) סיבים ואנטי-למינין של חולדה (שרשרת α2, 1:1,000) ב-PBS.
- שטפו את השקופיות עם PBS 3 x 5 דקות ב-RT.
- דגירה של המגלשות בחושך במשך שעה אחת ב-RT עם התמיסה המכילה את הנוגדנים המשניים (עזים נגד IgG2b AF405 (1:500), עזים נגד IgG1 AF488 (1:500), עזים נגד IgM AF568 (1:1,000), ועיזים נגד למינין AF647 (1:500) ב-PBS).
אזהרה: במשך שאר הפרוטוקול, הקפידו להרחיק את השקופיות מהאור כדי לשמר את הפלואורסצנציה. - יש לשטוף שוב 3 x 5 דקות ב-PBS, לשטוף ב-H2O מזוקק כפול, להסיר עודפי מים ולהרכיב עם מגיב אנטיפאדה.
הערה: אחסן את השקופיות בטמפרטורה של 4 °C (75 °F), מוגן מפני אור כדי לשמר את הפלואורסצנציה עד לרכישת התמונה. מכיוון שהשקופיות אינן קבועות, מומלץ להשתמש בפתרונות טריים לכל ניסוי, autoclave את ה- PBS, ולרכוש את התמונות בהקדם האפשרי כדי למנוע זיהום של החלקים.
- צביעה של LDs עם Bodipy
הערה: בדומה לשלב 4.1., נפח תמיסה כולל של 250 μL מספיק כדי לכסות את כל חלק השרירים המוקף בעיגול המצויר בעט הידרופובי בגודל משוער של מטבע של 1 סנט.- הקיפו את החלקים בקווי מתאר שצוירו על ידי עט הידרופובי ושטפו ב-0.1 M PBS קר כקרח למשך 10 דקות ב-RT. השתמשו ב-PBS קר כקרח לכל השטיפות והשטיפות.
- תקן עם פרפורמלדהיד קר של 4% (PFA) ללא מתנול למשך 10 דקות ב- RT. לאחר שטיפה מהירה ראשונה, שטפו את המגלשות עם PBS 3 x 5 דקות ב-RT.
אזהרה: בצעו שלב זה מתחת למכסה המנוע הכימי. - מקם את המגלשה בתא לח ובחסם למשך שעה אחת ב- RT עם 5% NGS ב- PBS.
- הדגירו את השקופיות למשך 90 דקות בטמפרטורה של 37 מעלות צלזיוס עם התמיסה של הנוגדן העיקרי (2% NGS ואנטי-למינין של חולדות (שרשרת α2, 1:1,000) ב-PBS). שטפו את השקופיות עם PBS 3 x 5 דקות ב-RT.
אזהרה: במשך שאר הפרוטוקול, הקפידו להרחיק את השקופיות מהאור כדי לשמר את הפלואורסצנציה. - דגירה במשך שעה אחת ב-RT עם תמיסת הנוגדן המשנית המכילה נוגדן נגד עזים נגד חולדה-AF647 (1:500) ב-PBS. שטפו את השקופיות עם PBS 3 x 5 דקות ב-RT.
- דגירה למשך 20 דקות ב-RT עם תמיסה של 4',6-דיאמידינו-2-פנילינדול (DAPI, 0.5 מיקרוגרם/מ"ל) ו-BODIPY (1 מיקרוגרם/מ"ל) ב-PBS.
הערה: כדי להכין תמיסת מלאי BODIPY, להמיס אותה ב- DMSO בריכוז של 1 מ"ג / מ"ל. פורמולציות שונות של Bodipy זמינות באופן מסחרי עבור צביעת LD. בהתאם לבחירה שנעשתה, שיטת ההכתמה זהה (אותם צעדים, ריכוז וזמן דגירה); עם זאת, שיטת הרכישה תהיה שונה במקצת. - לאחר שטיפה מהירה ראשונה, שטפו את המגלשות עם PBS 3 x 5 דקות ב-RT, שטפו ב-H2O מזוקק כפול, הסירו עודפי מים והרכיבו עם ריאגנט אנטיפאדה.
הערה: אחסן את השקופיות בטמפרטורה של 4 °C (75 °F), המוגנות מפני אור, כדי לשמר את הפלואורסצנציה עד לרכישת התמונה.
5. רכישת תמונות
הערה: לאחר השלמת פרוטוקולי ההכתמה, חשוב להמשיך מיד לרכישת התמונה (בתוך 24 השעות הבאות), לא רק כדי למנוע זיהום אלא גם כדי לשמר את המורפולוגיה, הגודל והמספר של LDs.
- רכישת תמונות להערכת סוגי הסיבים של כל שריר שנדגם
הערה: ניתן להשיג שלב זה באמצעות מיקרוסקופ סריקה פלואורסצנטית של שקופית שלמה או עם מיקרוסקופ אפיפלואורסצנטי קונבנציונלי. עם האחרון, תפירה ידנית או אוטומטית של התמונות חייבת להיעשות כדי לשחזר את הקטע.- לזיהוי מסוג סיבים, השתמש במיקרוסקופ אפיפלואורסצנטי עם מטרה של 10x/0.3. בחר מסנני עירור עבור DAPI (405 ננומטר), FITC, TRITC ו- Cy5 כדי לזהות סיבי I, IIa, IIx ולמינין מסוג I, בהתאמה.
הערה: סיבים מסוג IIb לא יהיו בעלי תווית חיסונית. הם יוכרו כסיבים המוכתמים על ידי למינין על גבולות הסרקולמה עם סרקופלזמה שחורה. - התאם את זמן החשיפה המתאים לכל ערוץ.
- בעת שימוש במיקרוסקופ אפיפלואורסצנציה קונבנציונלי, תמיד לרכוש את התמונות של השריר כולו בעקבות אותו סדר כדי להקל על שחזור השריר. ודא שהסיבים בקצה הימני של תמונה אחת מופיעים גם בקצה השמאלי של התמונה הבאה. כנ"ל לגבי החלק העליון והתחתון של התמונות (איור 3A).
הערה: כהפניה, עבור קטע של EDL או הסולאוס המנותח מעכבר בן 3 חודשים, ממוצע של שש ושמונה תמונות, בהתאמה, יכסה את כל חתך השרירים. - לאחר סריקת השריר, העלו את התמונות הדיגיטליות שנתפסו לכל תוכנת עיבוד תמונה לשחזור (תפירה), בהתבסס על מורפולוגיית הסיבים (למינין) וההיסטולוגיה של מקטע השרירים, ושמרו אותו כקובץ TIFF, PNG או JPG עם כל הערוצים (הצבעים) הממוזגים (איור 3A).
- לזיהוי מסוג סיבים, השתמש במיקרוסקופ אפיפלואורסצנטי עם מטרה של 10x/0.3. בחר מסנני עירור עבור DAPI (405 ננומטר), FITC, TRITC ו- Cy5 כדי לזהות סיבי I, IIa, IIx ולמינין מסוג I, בהתאמה.
- רכישת תמונות עם לכתם משותף של laminin ו- Bodipy
הערה: כדי לזהות את סוג הסיבים ולהעריך את מספר הסיבים עבור כל סוג שנלכד, חיוני שהחלק מסוג סיבים כבר ייסרק והשרירים ישוחזרו לפני שתתחיל ברכישת התמונה של Bodipy-laminin (איור 3B).- עבור תצפית ורכישה של תמונת Bodipy, השתמש במיקרוסקופ קונפוקלי עם עדשה אובייקטיבית של טבילת שמן 40x עם מפתח צמצם מספרי של 1.4.
- השתמש בהגדרות הבאות: חור הצמדה ברזולוציה של 1 AU, רזולוציה של 2,048 פיקסלים x 2,048 פיקסלים, גודל פיקסל ב- 0.08 מיקרומטר, מצב חד-כיווני, מהירות סריקה ב- 4 (~ 4 μs/pixel), ממוצע שורות המוגדר ל- 4x וזום דיגיטלי המוגדר ל- 1.
- כדי להימנע משיחות צולבות בין Bodipy-558/568 לבין laminin-AF647, השתמש במצב הסריקה הרציפה בתוכנת הקונפוקל.
הערה: כאשר הצבע שנבחר הוא Bodipy-493/503, סריקת לייזר קונפוקלית סימולטנית אפשרית ללא הצלבה בין ערוץ Bodipy לערוץ laminin-AF647. זה יאיץ את רכישת התמונות. - הפעל את Bodipy-493/503 באמצעות קו לייזר 488 ננומטר או קו לייזר ארגון, והלהיב את Bodipy-555/568 באמצעות קו הלייזר של דיודה 561 ננומטר. לבסוף, זהה למינין-AF647 עם קו לייזר דיודה של 640 ננומטר.
אזהרה: זכור כי מולקולות Bodipy רגישות מאוד להלבנת תמונות, לכן הימנע מסריקת לייזר מיותרת. כדי לזהות סיבים, השתמש רק בלייזר עבור laminin. - בהתאם לצבע שנבחר, הגדר את טווחי הפליטה על 570-650 ננומטר עבור Bodipy-493/50324 וב- 565-620 ננומטר עבור Bodipy-558/568. הגדר את טווח הפליטה עבור למינין על 656-700 ננומטר.
- הגדר את הרווח ואת הרווח הדיגיטלי בהתאם כך שלא יזוהו פיקסלים רוויים במחוון הטווח. תקן את אות הרקע על-ידי התאמת ההסטה.
הערה: יש למטב את בחירת המסנן ופרמטרים אחרים של סריקה שהוזכרו לעיל עבור כל מיקרוסקופ קונפוקלי. חשוב שכל ההגדרות הנ"ל יישמרו קבועות להשוואה בין כל התמונות שנלכדו מדגימות. - כדי לזהות את סוג הסיבים בקרב אלה המוצגים במיקרוסקופ הקונפוקלי, השתמשו במחשב נייד אישי שעליו נבדקת התמונה של הקטע ששוחזר לאחר אבחנה חיסונית מסוג סיבים (איור 3B).
- לאחר שקבוצת סיבים מזוהה כראוי, רכוש את התמונה עם תעלות Bodipy ו laminin.
הערה: מומלץ לציין את שם התמונה Bodipy-laminin על אזור השריר שבו סיבים אלה ממוקמים על התמונה שנרכשה עבור זיהוי MyHC כדי להקל על ניתוח מאוחר יותר ספציפי סיבים של LDs.
6. ניתוח תמונות
- ניתוח סוגי הסיבים על כל דגימת שריר
- בפיג'י (או ImageJ)32, פתח את קובץ ה- TIFF, PNG או JPG עם השריר המשוחזר המתקבל ממיזוג של כל הערוצים המשמשים לאיתור האיזופורמים של הסיבים.
- כדי להפעיל את הכלי ספירת תאים , לחץ על תוספים | לנתח | | מונה תאים מונה תאים.
- בחלון מונה התאים , לחץ על פעולות | אתחל.
- תחת מונים באותו חלון, בחר סוג 1.
- בחלון הראשי של פיג'י, בחר בכלי שרביט .
- כדי לכמת את מספר הסיבים של כל סוג, לחץ על כל סיב מאותו סוג, כך שהתוכנית מתעדת את מספר הסיבים שנלחצו.
- לאחר שתסיים, בחר את הסוג הבא של סיבים וחזור על אותם שלבים.
- כאשר כל הסיבים של התמונה הוקצו לסוג סיב נתון, לחץ על תוצאות בחלון מונה התאים כדי להציג את התוצאות בטבלה.
- שמור טבלה זו כטבלת גיליון אלקטרוני על-ידי לחיצה על קובץ | שמור בשם בחלון תוצאות .
- שמור וטען מחדש את הבחירות באותה תמונה בכל עת על-ידי לחיצה על שמור סמנים או טען סמני טעינה, בהתאמה, בחלון ספירת תאים .
- ניתוח של טיפות שומנים באופן התלוי בסיבים
- נתח את התמונות של Bodipy ו laminin שהושגו על confocal באמצעות פיג'י עבור כימות של LDs.
הערה: המחברים תכננו מאקרו מותאם אישית כדי להפוך את הניתוח לאוטומטי. מאקרו זה, יחד עם הסבר שלב אחר שלב על אופן השימוש בו, זמין כקובץ משלים 1 וקובץ משלים 2, בהתאמה. - פתח כל תמונה בעזרת יבואן ביו-פורמטים מפיג'י. תחת האפשרות הצג מחסנית עם , בחר Hyperstack | מצב צבע, ברירת מחדל. ודא שהאפשרות 'שינוי גודל אוטומטי ' נבחרה.
הערה: השלבים הבאים יתארו את הפרוטוקול לניתוח של סיב אחד בתמונה, אך יש לחזור עליו מספר פעמים רבות ככל שמספר הסיבים השלמים מופיע בתמונה. - השתמשו בכלי הבחירה ביד חופשית כדי לבחור באופן ידני את הסרקולמה של הסיבים בהתבסס על תעלת הלמין (איור 4A) ולחצו על T על המקלדת כדי להקליט את הבחירה או אזור העניין (ROI) בחלון ההחזר על ההשקעה .
- עבור אל החלון הראשי של פיג'י ולחץ על נתח | הגדר מדידות, ובחלון הקופץ, בחר אזור וקוטר של Feret. השאר את התיבות הנותרות ללא סימון ופרמטרים אחרים כפי שהם מופיעים כברירת מחדל.
- לחץ על מדידה בחלון ההחזר על ההשקעה כדי לקבל את האזור ואת קוטר ה-MF המינימלי של הסיבים שנבחרו, ושים לב אליהם לשימוש מאוחר יותר.
הערה: בעת ניתוח LDs, חשוב לזכור כי גודלם וצפיפותם משתנים בין המרכז לבין הפריפריה (אזור תת-סרקולמלי-SS) של הסיבים. לכן, הניתוח חייב להיעשות בנפרד. - חשב את הערך של 1/6 של ה- MF כדי לתחום את החלק המרכזי של הסיב.
הערה: במאקרו, ערך ה- MF המוגדר כברירת מחדל מוגדר ל- 6, כלומר ההפחתה שהוחלה תוגדר כ- 1/6 של ה- MF. ערך זה נבחר על סמך הנתונים האמפיריים שהתקבלו מסוליית בעלי חיים שניזונו מתזונה עתירת שומן. עם זאת, כל חוקר חייב לשנות מספר זה בהתבסס על הנתונים האמפיריים והשרירים שנותחו, סוג הסיבים ומצב בעלי החיים. - בחלון החזר ההשקעה , לחץ על הוסף כדי לקבל שכפול של ההחזר על ההשקעה הראשון ובחר את ההחזר השני שמופיע בחלון.
- בחלון הראשי של פיג'י, לחץ על ערוך | | בחירה הגדל והצג את הערך שחושב בעבר (משלב 6.2.6.) עם סימן חיסור לפני המספר ולחץ על אישור. בחלון ההחזר על ההשקעה, לחץ על הוסף[t] (החזר השקעה שלישי חייב להופיע) ומחק, כדי למחוק את ההחזר על ההשקעה השני.
הערה: החוקר יכול לבדוק את התוצאות על-ידי לחיצה על התיבה הצג הכל בחלון ההחזר על ההשקעה . בשלב זה, שני ROIs חייבים להופיע, אחד שמקיף את כל היקף הסיב (איור 4B) והשני שממוקם במרכז (איור 4C). - בחר את שני ה- ROIs בחלון ההחזר על ההשקעה ולחץ על עוד | | XOR הוסף[ט]. המתן להופעת החזר השקעה שלישי, התואם את שולי הסיבים (איור 4D).
- שמור את ה- ROIs על ידי לחיצה על עוד | שמור כדי לשמור את ה- ROIs למקרה שיהיה צורך בניתוח מחדש מאוחר יותר של אותם סיבים.
- בחר את ערוץ Bodipy ופתח את הכלי סף על-ידי לחיצה על תמונה | התאמת | סף בחלון הראשי של פיג'י.
- בחלון המוקפץ Threshold , הגדר את הערכים ל- 70/255, בחר ין | שיטת B&W, ולחץ על | רקע כהה הגש בקשה.
הערה: הערכים המוחלים על הסף עשויים להשתנות בהתאם לתנאי הניסוי ויש להגדיר את הסף כראוי כדי למטב את הניתוח. חלון B&W עם אות Bodipy מעל גבול הסף המוצג בלבן והרקע בשחור חייב להופיע (השווה את התמונה המקורית של Bodipy באיור 4E לזו שבאיור 4F). - עבור אל החלון הראשי של פיג'י ולחץ על נתח | הגדר מדידות ובחלון המוקפץ, בחר אזור, שבר אזור והגבלה לסף. השאר את התיבות הנותרות ללא סימון ופרמטרים אחרים כפי שהם מופיעים כברירת מחדל.
הערה: אם החוקר רוצה לנתח את ה"מעגליות" של LDs, שהיא אינדקס של המורפולוגיה הכדורית שנעה בין 1 עבור כדור מושלם ל-0 עבור שורה, לחץ על התיבה מתארי צורה של החלון הקופץ Set Measurements . - עבור אל חלון ההחזר על ההשקעה ובחר את ההחזר על ההשקעה הראשון. בחלון הראשי של פיג'י, לחץ על נתח | כלי ניתוח חלקיקים.
הערה: כלי זה מכמת את המספר, הגודל, השטח המכוסה ואחוז השטח הכולל המכוסה על ידי חלקיקים בכל בחירה ושומר את התוצאות כקובץ גיליון אלקטרוני. - הגדר את הערכים מ - 2 ל - Infinity (2-Infinity) בחלון ניתוח חלקיקים , סמן את התיבה פיקסלים , שמור על ערכי המעגליות המוגדרים כברירת מחדל, בחר סכם ולחץ על אישור.
הערה: כדי לבדוק את התוצאות בסיב, תחת האפשרות הצג , בחר בכל אחת מהאפשרויות הזמינות. כדי שהמידע של כל LD יוכר בבחירה בטבלה, עיין באפשרות הצג תוצאות בחלון ניתוח חלקיקים . התוצאות מניתוח השטח הכולל של הסיבים ממוצעות ומסוכמות בטבלה עם מספר עמודות (ספירה, שטח כולל, גודל ממוצע, % שטח; אלה תואמות את מספר החלקיקים [LDs], השטח שנכבש על ידי חלקיקים אלה, גודלם הממוצע, ואחוז השטח הכולל של הברירה תפוס על ידי חלקיקים, בהתאמה). כדי לחשב את הצפיפות, חלקו את מספר החלקיקים בשטח הכולל של כל בחירה. - כדי לקבל את ערכי המרכז ואת הפריפריה של הסיב, חזור על שלבים 6.2.14 ו- 6.2.15, ובחר את השני (מרכז) ואת ההחזר על ההשקעה השלישי (פריפריה) בכל פעם.
- שמור את התוצאות על-ידי לחיצה על קובץ | שמור כמו בחלון סיכום .
הערה: כלול את סוג הסיבים, את המצב ואת שם התמונה בשם שהוקצה של התוצאות כדי להקל על איחוד וניתוח סטטיסטי מאוחר יותר של הנתונים. כדי לנתח את שאר הסיבים באותה תמונה, חזור על שלבים 6.2.3 עד 6.2.17. עבור הניתוח הסטטיסטי, לפחות 10-15 סיבים מכל סוג חייב להיות מנותח לכל בעל חיים.
- נתח את התמונות של Bodipy ו laminin שהושגו על confocal באמצעות פיג'י עבור כימות של LDs.
תוצאות
הפרוטוקול המתואר כאן מספק שיטה יעילה לכימות קל של LDs בסוג סיבים ובאופן תת-תאי ספציפי. הוא מראה כיצד, על ידי הקפאת שני שרירים בגודל דומה, כגון ה- EDL והסולאוס, הזמן והמשאבים המושקעים בשלבים הבאים מצטמצמים בחצי.
פרוטוקול מלא מסופק עבור חיסון, רכישת תמונה וניתוח של האיזופורמים השו...
Discussion
הפרוטוקול המפורט כאן מתאר שיטה יעילה לכימות LDs המתויגים עם Bodipy על בסיס ספציפי לסוג סיבים ותת-תאיים. בשנים האחרונות, צבעי שומנים קלאסיים, כגון ORO או סודן שחור B, הוחלפו במערך חדש של צבעים חדירים לתאים, ליפופיליים, פלואורסצנטיים הנקשרים לשומנים ניטרליים (למשל, Bodipy). Bodipy, הזמין כמצומדים שונים, הו...
Disclosures
למחברים אין ניגודי עניינים להצהיר עליהם.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מה-Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20) ומ-Société Francophone du Diabète (טיפול בסוכרת SFD-Roche).C.M.S. הוא זוכה מלגת דוקטורט מטעם ה-FRIA (FNRS). M.A.D.-L.d.C. קיבל מלגה מתוכנית המצוינות הבינלאומית של וולוני-בריסל.
המחברים מודים לאליס מונייה על תרומתה לפיתוח פרוטוקול זה ולקרוליין בוזין על מומחיותה ועזרתה הטכנית בתהליך רכישת התמונה. אנו מודים גם לפלטפורמת ההדמיה 2IP-IREC על הגישה לקריוסטאט ולמיקרוסקופים (פלטפורמת הדמיה 2IP-IREC, המכון למחקר ניסויי וקליני, אוניברסיטת קתוליק דה לוביין, 1200 בריסל, בלגיה). לבסוף, המחברים מבקשים להודות לניקולס דובייסון, רומן ווסל ומישל אבו-סמרה על הביקורת הבונה על כתב היד. חלק מהדמויות של מאמרים אלה נוצרו עם BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24x50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors - 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
References
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete's paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do's and don'ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved