Method Article
Recopilación remota de datos por tomografía crioelectrónica y promedio de subtomografía
* Estos autores han contribuido por igual
En este artículo
Resumen
El presente protocolo describe la adquisición remota de datos por criotomografía electrónica de alta resolución utilizando Tomo5 y el posterior procesamiento de datos y el promedio de subtomografías utilizando emClarity. La apoferritina se utiliza como ejemplo para ilustrar procesos detallados paso a paso para lograr una estructura crio-ET a una resolución de 2,86 Å.
Resumen
La criotomografía electrónica (crio-ET) ha ido ganando impulso en los últimos años, especialmente desde la introducción de detectores de electrones directos, estrategias de adquisición automatizadas mejoradas, técnicas preparativas que amplían las posibilidades de lo que el microscopio electrónico puede visualizar a alta resolución utilizando crio-ET y nuevo software de promedio de subtomograma. Además, la adquisición de datos se ha simplificado cada vez más, haciéndola más accesible para muchos usuarios. La pandemia de SARS-CoV-2 ha acelerado aún más la recopilación remota de datos de criomicroscopía electrónica (crio-EM), especialmente para crio-EM de una sola partícula, en muchas instalaciones a nivel mundial, proporcionando acceso ininterrumpido de los usuarios a instrumentos de última generación durante la pandemia. Con los recientes avances en Tomo5 (software para tomografía electrónica 3D), la recopilación remota de datos crio-ET se ha vuelto robusta y fácil de manejar desde cualquier parte del mundo. Este artículo tiene como objetivo proporcionar un recorrido detallado, a partir de la configuración de recopilación de datos en el software de tomografía para el proceso de una sesión de recopilación de datos crio-ET (remota) con solución de problemas detallada. El protocolo de recopilación de datos (remoto) se complementa con el flujo de trabajo para la determinación de la estructura a una resolución casi atómica mediante un promedio de subtomograma con emClarity, utilizando apoferritina como ejemplo.
Introducción
La microscopía electrónica criogénica (crio-EM) es ampliamente conocida por haber experimentado un período de renacimiento, acelerándolo para convertirse en una herramienta central y centralmente útil en biología estructural. El desarrollo y la utilización de detectores de electrones directos 1,2,3, microscopios y fuentes de electrones mejorados 3,4,5, mejoras en la automatización/rendimiento 6,7,8,9 y avances computacionales en el análisis de partículas individuales10,11,12,13 14 y la tomografía15,16,17 son, en parte, responsables del reciente éxito de la técnica. Estos impulsores tecnológicos han desarrollado la capacidad de crio-EM para resolver estructuras macromoleculares biológicas en condiciones criogénicas y nativas. Las resoluciones que se pueden obtener fácilmente son suficientes para el modelado atómicamente preciso y han llevado la técnica a la vanguardia del campo de la biología estructural. Un enfoque reduccionista para expresar y purificar un objetivo biológico de interés ha demostrado ser exitoso en cristalografía macromolecular (MX) para la investigación biológica básica, el descubrimiento de fármacos y la ciencia traslacional. En el mismo enfoque, la crio-EM ahora puede ofrecer resultados paralelos a los estudios MX de alta resolución. El mayor éxito actual en la rama crio-EM de la biología estructural se llama análisis de partículas individuales (SPA), que adquiere imágenes de proyección 2D típicamente de una muestra de proteína purificada18 para obtener miles de vistas de una macromolécula biológica19. Estas imágenes (1) contienen información de una gama de vistas que representan completamente las orientaciones del objetivo en el espacio 3D y (2) capturan la heterogeneidad conformacional del objeto, que luego se puede separar e investigar.
Un enfoque alternativo para adquirir estas imágenes de proyección 2D de muestras biológicas, incluso in situ y sin purificación, es la criotomografía electrónica (crio-ET). Cryo-ET toma una serie de imágenes del mismo objeto en ángulos inclinados girando mecánicamente la muestra. Por lo tanto, las proyecciones 2D recogidas en SPA, que representan las poses angulares de la molécula de interés, se recopilan inherentemente como parte del experimento de imágenes crio-ET20. Las series de inclinación tomográfica se reconstruyen en un tomograma que contiene representaciones 3D de los complejos macromoleculares fotografiados. La naturaleza de la recopilación de datos tomográficos disminuye, hasta cierto punto, la dependencia del promedio para lograr una representación 3D completa de una molécula a partir de una colección de imágenes 2D. Sin embargo, debido a los diseños actuales de la etapa, el espécimen generalmente se inclina de -60 ° a + 60 °, dejando una cuña faltantede 21 de información en la reconstrucción tomográfica 3D.
Las reconstrucciones 3D en un solo tomograma tienen una cuña faltante de información y baja señal de ruido. Las macromoléculas individuales pueden extraerse como subtomogramas y promediarse juntas para abordar esto. Cuando cada macromolécula en un subtomograma se encuentra en una orientación diferente, la cuña faltante está orientada de manera diferente en cada subtomograma del objeto objetivo, por lo que promediar muchas copias completa la información debido a la cuña faltante. Los desarrollos recientes en el procesamiento de imágenes también han intentado entrenar redes neuronales de inteligencia artificial para llenar la cuña faltante con datos significativos22. Este proceso de promedio también aumenta la señal al ruido, similar al objetivo de promediar en el análisis de partículas individuales, por lo que la calidad y la resolución de la reconstrucción mejoran. Si la molécula de interés posee simetría, eso también puede definirse y emplearse durante el promedio, mejorando aún más la resolución de la reconstrucción. La extracción de volúmenes 3D de una macromolécula de un tomograma en un conjunto de subtomogramas y su posterior procesamiento se conoce como promedio de subtomografía (STA)23. Cuando cada subtomografía representa una copia única de la molécula que se está estudiando, cualquier heterogeneidad estructural puede ser interrogada utilizando el flujo de trabajo STA. Como se utiliza comúnmente en el flujo de trabajo de SPA, las técnicas de clasificación se pueden emplear durante STA para diseccionar los estados conformacionales del complejo de interés. Además de STA que permite la reconstrucción de alta resolución en crio-ET, este enfoque hace que la técnica sea una herramienta poderosa para interrogar los mecanismos estructurales de las macromoléculas en su entorno celular nativo o de objetivos a menudo no susceptibles de SPA24,25,26.
La tomografía electrónica tiene una larga historia de determinación de la ultraestructura 3D de muestras celulares a temperatura ambiente27. La adquisición de vistas por inclinación física del espécimen proporciona suficiente información para la reconstrucción 3D de un objeto a escalas de longitud celular y es particularmente importante cuando las estructuras celulares carecen de la regularidad para promediar. Las células también pueden congelarse en sustratos para obtener imágenes crio-ET en los bordes celulares donde la muestra es lo suficientemente delgada como para ser transparente a los electrones. Bajo estas condiciones, STA puede ser empleado para determinar estructuras macromoleculares en un ambiente celular, aunque cuando la muestra es lo suficientemente delgada como para ser transparente a loselectrones 28. Sin embargo, cuando se combina con técnicas preparativas adicionales, incluyendo microscopía criocorrelativa de luz y electrónica (crio-CLEM) y fresado de haz de iones enfocado (crio-FIB), la crio-ET puede ser utilizada para obtener imágenes dentro de células enteras en condiciones criogénicas29. Esto reúne el poder de la crio-ET para estudiar la ultraestructura celular con el poder de STA para determinar las estructuras de complejos macromoleculares in situ , identificando su ubicación celular30 y proporcionando instantáneas de complejos involucrados en procesos dinámicos31. La capacidad de la técnica para obtener imágenes de muestras celulares y emplear STA en varios estudios ha puesto de relieve el poder de la técnica para resolver estructuras macromoleculares in situ, incluso a resoluciones comparables a SPA32. Otro beneficio se encuentra en el conocimiento de la ubicación original de la macromolécula, representada por la reconstrucción 3D clasificada final en el tomograma30. Por lo tanto, la estructura macromolecular se puede correlacionar con la ultraestructura celular. Estas observaciones a través de escalas de longitud presumiblemente conducirán a hallazgos importantes donde los mecanismos estructurales pueden correlacionarse con cambios celulares en el contexto de estudios funcionales.
Cryo-ET y STA permiten la recopilación de datos en tres flujos de trabajo principales: tomografía molecular, celular y laminar. Las estructuras de los complejos macromoleculares purificados pueden determinarse mediante crio-ET mediante tomografía molecular. La determinación de las estructuras de proteínas en su entorno celular donde la célula es lo suficientemente delgada puede describirse como tomografía celular. Más recientemente, con el desarrollo de la orientación criogénica y la molienda, estas mismas técnicas se pueden aplicar en los flujos de trabajo de tomografía de láminas para determinar las estructuras de proteínas en el interior de la célula en su entorno nativo mientras se revela el contexto celular en el que se observan esas proteínas. Se pueden utilizar diferentes estrategias de recopilación de datos dependiendo de los paquetes de software disponibles y, lo más importante, dependiendo del requisito de la muestra. Las muestras moleculares o no adherentes en una rejilla TEM de cobre de una proteína purificada generalmente requieren menos manipulación y, por lo tanto, permanecen planas y sin daños en casos ideales. Los tomogramas electrónicos se pueden configurar fácilmente en serie a través de una rejilla de carbono agujereado para adquirir rápidamente decenas o cientos de tomogramas de manera sistemática. La forma más sencilla para que los usuarios configuren muestras de tomografía molecular donde las proteínas estén abundantemente presentes en la cuadrícula sería usar Tomo5 (software para tomografía electrónica 3D utilizado en el presente estudio, ver Tabla de materiales). Otro software de tomografía como Leginon9 y serialEM6 también están disponibles; Ofrecen más opciones de configuración para enfoques más personalizados para la recopilación de datos, pero son más complejos y, en consecuencia, pueden ser más difíciles de navegar, especialmente para los usuarios nuevos en la tomografía y los usuarios que acceden a su sesión de forma remota. Para una instalación con una base de usuarios grande y diversa, Tomo5 es fácil de operar en un entorno remoto y de capacitar a los usuarios. Para las células adherentes, las cuadrículas generalmente requieren más pasos de manejo, y la necesidad de usar frágiles rejillas doradas aumenta la necesidad de un mejor cuidado en las estrategias de manejo y recopilación de datos. Para facilitar la búsqueda de una región celular de interés y evitar la oclusión de la propia cuadrícula en ángulos de inclinación altos, también es beneficioso utilizar tamaños de malla más grandes, pero a costa de que son inherentemente más frágiles. Para las muestras de láminas, la fragilidad de la muestra está determinada por la calidad de la lámina, que puede ser variable. Estos factores aumentan el tiempo de configuración y las consideraciones, pero la mayor adaptabilidad y robustez nuevamente hacen que Tomo5 sea adecuado para este tipo de recopilación de datos. Sin embargo, existen escenarios de recopilación de datos especializados para cada flujo de trabajo. BISECT y PACE-tomo (ambos ejecutados en SerialEM) introducen la posibilidad de un cambio de imagen de haz guionado durante la adquisición de la tomografía para aumentar la velocidad de recolección del tomógrafo28, particularmente en tomografía molecular. Los montajes de magnificación media (MMM) en SerialEM 6,7,33 pueden identificar mejor y apuntar con precisión a las características moleculares en todos los flujos de trabajo, aunque, en el momento de escribir este artículo, estas características están comenzando a implementarse en Tomo5.
Al igual que SPA, cryo-ET y STA son cada vez más accesibles a través de las mejoras realizadas en el software de adquisición y una gran cantidad de paquetes disponibles para subtomografías con un promedio de 16,17,32,34,35,36,37,38. Además, durante la pandemia, permitir el acceso remoto a la instrumentación crioelectromagnética se volvió esencial para el funcionamiento continuo de instalaciones nacionales como el Centro de Bioimágenes de electrones (eBIC) en Diamond Light Source (DLS), Reino Unido. Estos desarrollos han hecho que la crio-ET sea más accesible y robusta para los investigadores que desean utilizar la técnica. Una vez adquiridos los datos, STA es una herramienta esencial para analizar objetos recurrentes para obtener la máxima resolución de reconstrucción y permitir la clasificación de la heterogeneidad macromolecular. El protocolo actual tiene como objetivo proporcionar un recorrido detallado de la preparación de un microscopio crio-TEM para la recopilación de datos crio-ET y cómo realizar el promedio de subtomografía utilizando emClarity en un conjunto de datos de tomografía molecular de apoferritina como ejemplo. El uso de emClarity (software para tomografía crioelectrónica de alta resolución y promedio de subtomograma, consulte la Tabla de materiales) requiere ejecutar scripts desde la línea de comandos, por lo que se asume un nivel de familiaridad con los sistemas Linux / UNIX.
La conexión remota depende del entorno de red en cada instituto/instalación. En eBIC, el sistema remoto utiliza programas que permiten la recopilación remota de datos en la configuración de red específica utilizada en Diamond. La conexión remota al microscopio se facilita mediante dos plataformas: NoMachine y TeamViewer (consulte la Tabla de materiales). Con el programa NoMachine, el usuario puede iniciar sesión en un escritorio remoto de Windows. El escritorio remoto de Windows proporcionado por NoMachine reside en la misma red que el microscopio y, por lo tanto, actúa como una PC de soporte virtual para el microscopio. Desde el PC de soporte virtual, el usuario se conecta al microscopio a través de TeamViewer proporcionando acceso directo y control al PC microscopio que ejecuta TUI y Tomo.
El presente protocolo consta de dos partes (paso 1 y paso 2). El paso 1 se centra en la adquisición remota de datos crio-ET utilizando Tomo5 (software para tomografía electrónica 3D). El recorrido para una sesión (remota) captura imágenes con aumentos cada vez más altos para permitir al usuario dirigir el software de tomografía a las áreas de muestras para la recolección de datos tomográficos. La figura 1 resume este proceso. El paso 2 detalla el procesamiento de datos cryo-ET STA utilizando emClarity (software para tomografía crioelectrónica de alta resolución y promedio de subtomograma). La figura 9 resume este proceso.
El protocolo está destinado a una audiencia remota. Asume que la persona físicamente en el microscopio y la carga de las muestras ha hecho las alineaciones directas y se ha encargado de la sintonización de la cámara y la adquisición de referencias. Para este protocolo, se asume un sistema de lentes de tres condensadores con un cargador automático. Para obtener instrucciones más detalladas sobre el software de tomografía, un manual detallado del fabricante está disponible en el botón Inicio de Windows desde donde se cargó el software.
Protocolo
Los paquetes de software utilizados en este estudio están parcialmente disponibles gratuitamente (ver Tabla de materiales).
1. Adquisición remota de datos crio-ET utilizando Tomo5
- Si el software no está cargado, comience iniciando este software desde el PC del servidor TEM (consulte la Tabla de materiales).
- Realice comprobaciones iniciales y configure la condición de imagen seleccionando Ajustes preestablecidos.
- Inicie la configuración de la sesión ajustando los parámetros de adquisición de imágenes en la pestaña "Preparación" en Ajustes preestablecidos (Figura 2A, B).
- Ajuste la "Ampliación general" para adaptarse al tamaño cuadrado de la cuadrícula y la dosis para obtener recuentos adecuados.
NOTA: Si se desconoce el aumento adecuado para el tipo de cuadrícula, vuelva a este paso después de cargar una cuadrícula. - "Altura eucéntrica" y "Ampliación de búsqueda" pueden ser lo mismo. Haga clic en Buscar en la pestaña "Tomografía" para configurar posiciones y asegurarse de que el aumento sea suficiente para mostrar el sello de interés y para ajustar el área "Exposición" y "Seguimiento / Enfoque" en el campo de visión (Figura 2C).
- Establezca "Ampliación de exposición" en el tamaño de píxel de destino deseado. Si esto es desconocido, establézcalo ajustando la ampliación al campo de visión deseado para que se ajuste a la región de interés.
- Ajuste la "Ampliación general" para adaptarse al tamaño cuadrado de la cuadrícula y la dosis para obtener recuentos adecuados.
- Copie los parámetros de adquisición de imágenes (Exposición) a todos los demás ajustes preestablecidos de gran aumento (Seguimiento, Deriva, Enfoque, Anillo de Thon, Pérdida cero,). Para hacerlo, presione Establecer para establecer "Exposición" en el microscopio y obtener los "Ajustes de exposición" para todos los demás aumentos altos después de seleccionarlos individualmente.
- Ajuste los tiempos de exposición, especialmente para "Enfoque" y "Seguimiento" para dar un número apropiado de conteos, considerando también el grosor a 60 °, es decir, tanto a 0 ° como a 60 °, para que pasen suficientes electrones a través de la muestra para proporcionar una señal fuerte para la correlación cruzada.
NOTA: Como estimación, los tiempos de exposición para "Seguimiento" y "Enfoque" iguales al preajuste "Exposición" son una buena primera medida. Para ver un ejemplo de cálculo de dosis para el ajuste preestablecido "Exposición", consulte la figura 3. Establezca el tiempo de exposición calculado para el ajuste preestablecido "Exposición" en la pestaña "Preparación".
- Ajuste los tiempos de exposición, especialmente para "Enfoque" y "Seguimiento" para dar un número apropiado de conteos, considerando también el grosor a 60 °, es decir, tanto a 0 ° como a 60 °, para que pasen suficientes electrones a través de la muestra para proporcionar una señal fuerte para la correlación cruzada.
- Ajuste el "Zero Loss Preset" para usar un tamaño de punto más brillante y más grande (un tamaño de punto más grande corresponde a un número más pequeño), ya que esto necesita una dosis más alta.
NOTA: Este ajuste preestablecido se utiliza mejor para alinear la rendija del filtro de energía si está presente en el microscopio.
- Inicie la configuración de la sesión ajustando los parámetros de adquisición de imágenes en la pestaña "Preparación" en Ajustes preestablecidos (Figura 2A, B).
- Realice la recopilación de atlas siguiendo los pasos a continuación.
- Para recopilar un atlas, haga clic en Nueva sesión en la pestaña "Atlas", establezca las preferencias de sesión, ingrese la ruta de almacenamiento y el formato de salida, y presione Aplicar. Seleccione Cribado (Figura 4) y, a continuación, marque todos los atlas que desea adquirir. Seleccione Close Col Valves (Cerrar válvulas collado) para dejar el microscopio sin supervisión; Esto cerrará las válvulas de columna después de que se hayan recopilado todos los atlas seleccionados. Para iniciar la proyección, pulse el botón Inicio .
- Inspeccione los atlas únicos o múltiples en busca de objetivos haciendo clic en la cuadrícula en el panel izquierdo debajo de "Detección" (Figura 4), luego haga clic izquierdo y arrastre el mouse para moverse y desplácese hacia el centro para acercar y alejar. Elija la cuadrícula para la configuración del destino, selecciónela y haga clic en Cargar muestra desde dentro del software.
- Para las calibraciones de desplazamiento de imagen, continúe utilizando la pestaña de detección de atlas para navegar dentro de la cuadrícula cargada. Encuentre una característica identificable que sea reconocible en todos los ajustes preestablecidos de aumento, es decir, un cristal de hielo superpuesto con el borde de un agujero u otra característica reconocible (Figura 5). Muévase a ese cuadrado con un clic derecho del mouse, luego "Mover escenario a cuadrado de cuadrícula".
NOTA: El escenario debe estar a una altura eucéntrica para implementar correctamente las calibraciones de desplazamiento de imagen.
- Realice la calibración del desplazamiento de imagen.
- En la pestaña "Funciones automáticas" (Figura 6), establezca el ajuste preestablecido en "Altura eucéntrica", navegue hasta "Auto-Eucéntrico por inclinación de escenario" y presione Inicio. Supervise la ventana de estado para asegurarse de que encontrar la altura eucéntrica sea exitosa y vigile las imágenes de inclinación positiva y negativa; deben correlacionarse.
NOTA: A partir de la versión 5.8 del software Tomo, el criterio para la aceptación de la altura eucéntrica se puede modificar; El valor predeterminado es 0,25 μm, y establecerlo en 0,5-0,8 μm da más margen de maniobra. Los valores dependen del rendimiento del microscopio, pero se recomienda que sean lo más pequeños posible.- Cuando esté a la altura eucéntrica y enfocada, centre el escenario en una característica. Recopile una vista previa utilizando el ajuste preestablecido "Atlas". Configure todos los "Presets" desde la pestaña "Preparación". Posteriormente, aumente la ampliación a Descripción general > función central > Vista previa, luego repita "Ampliación de búsqueda" y, finalmente, "Ampliación de exposición".
- Si la función permaneció centrada durante la orientación, omita las calibraciones de desplazamiento de imagen. De lo contrario, para calibrar el desplazamiento de imagen, vaya a la pestaña "Preparación", seleccione Calibrar desplazamiento de imagen y presione Inicio (Figura 5). Esto alineará iterativamente los aumentos más bajos con la función centrada en la ampliación de la exposición.
NOTA: Si el ajuste preestablecido inicial "Exposición" no está centrado en esta etapa, para volver a centrar, el software utilizará el cambio de etapa solo para este paso.- Pulse Proceder para el ajuste preestablecido "Exposición". La siguiente imagen que se mostrará será el "Ajuste preestablecido de búsqueda". Para calibrar el desplazamiento de imagen entre los ajustes preestablecidos, haga doble clic izquierdo en la vista previa "Buscar" hasta donde está el centro de la vista previa "Exposición", luego presione Volver a adquirir (Figura 5). Haga clic en Proceder para pasar al siguiente par de ajustes preestablecidos.
NOTA: Si se aplicó un desplazamiento de imagen en la ampliación del atlas durante esta calibración, asegúrese de volver a adquirir el atlas después de que se haya completado la calibración del desplazamiento de imagen. Seleccione el atlas deseado y pulse Restablecer seleccionado en el panel superior de la pestaña "Atlas". Confirme y comience a adquirir ese atlas nuevamente.
- Pulse Proceder para el ajuste preestablecido "Exposición". La siguiente imagen que se mostrará será el "Ajuste preestablecido de búsqueda". Para calibrar el desplazamiento de imagen entre los ajustes preestablecidos, haga doble clic izquierdo en la vista previa "Buscar" hasta donde está el centro de la vista previa "Exposición", luego presione Volver a adquirir (Figura 5). Haga clic en Proceder para pasar al siguiente par de ajustes preestablecidos.
- En la pestaña "Funciones automáticas" (Figura 6), establezca el ajuste preestablecido en "Altura eucéntrica", navegue hasta "Auto-Eucéntrico por inclinación de escenario" y presione Inicio. Supervise la ventana de estado para asegurarse de que encontrar la altura eucéntrica sea exitosa y vigile las imágenes de inclinación positiva y negativa; deben correlacionarse.
- Realice la configuración de la tomografía.
- Cree la configuración de recopilación de datos de tomografía en la pestaña "Tomografía".
NOTA: A menos que se indique específicamente, la configuración se realiza completamente en la pestaña "Tomografía". - Inicie una nueva sesión. En "Configuración de sesión" para muestras biológicas, elija Slab-like como tipo de muestra y seleccione Batch y Low Dose, seleccione el formato de salida y la carpeta de almacenamiento, opcionalmente agregue un destinatario de correo electrónico y luego presione Aplicar.
NOTA: Ahora estará disponible un elemento de menú "Posiciones de lote" (Figura 7A). El atlas cargado actualmente se importa automáticamente. "Descripción general" y "Buscar imágenes" se pueden adquirir y volver a visitar hasta que se adquiera una nueva imagen. Además, a partir de la versión 5.8, los mapas de búsqueda de 3 x 3, 4 x 4 y 5 x 5 se pueden adquirir con "Adquirir mapa de búsqueda" para facilitar la búsqueda y configuración de objetivos. Corresponden a una versión de montajes de magnificación media. - Para configurar objetivos, vaya a la "flecha Atlas", busque una región de interés y muévase allí seleccionando las opciones que aparecen con un clic derecho del mouse. Tome una imagen de descripción general para confirmar una buena posición para el ajuste de altura eucéntrica, luego presione Auto Eucentric; Esto ejecutará la rutina eucéntrica por etapa de inclinación. A continuación, vuelva a adquirir una nueva imagen de visión general para actualizar la altura eucéntrica.
NOTA: El botón "Auto Focus" no debería ser necesario si la posición está a la altura eucéntrica. Si la imagen de altura eucéntrica aparece muy desenfocada, la altura eucéntrica probablemente no sea correcta y deba rehacerse (para solucionar problemas de altura eucéntrica, consulte la sección de discusión). - Verifique el objetivo utilizando el ajuste preestablecido "Descripción general" antes de configurar la primera posición; seleccione el ajuste preestablecido "Descripción general" e incline el escenario a ±60° para comprobar a qué distancia de las barras de cuadrícula se pueden configurar las posiciones (Figura 8). Para ello, introduzca el valor del ángulo de inclinación deseado en la ventana "Definir inclinación" (Figura 8A).
- Inspeccione el cuadrado "Descripción general" o el "Mapa de búsqueda" adquirido, muévase a una región de interés y presione Adquirir búsqueda. Inspeccione la imagen "Buscar". Si la región de interés no está centrada, haga clic con el botón derecho en la posición deseada y, a continuación, repita Mover etapa aquí y Adquirir imagen. Establezca Inclinación (°) en 0,00 (o cualquier otro ángulo inicial que pueda manejar el escenario) para definir el ángulo inicial del tomograma.
- Para el primer tomograma, introduzca el Nombre para la convención de nomenclatura de tomograma deseada y el Desenfoque para establecer el valor de desenfoque deseado para cada tomograma.
- Opcionalmente, a partir de la versión 5.8 de Tomo, los valores de desenfoque se pueden cambiar sistemáticamente de una sola vez; para eso, haga clic en Seleccionar posiciones, seleccione las posiciones que desea cambiar o marque la marca de verificación para seleccionar todas las posiciones, y luego haga clic en Actualizar desenfoque y ajuste los parámetros (Figura 7A).
- Ajuste el área "Enfoque" y "Seguimiento" (Figura 2C). Haga clic con el botón izquierdo para arrastrar las áreas de seguimiento y enfoque (círculos amarillos y azules). Asegúrese de que el área de seguimiento / enfoque esté (principalmente) en carbono u otra característica de seguimiento adecuada, es decir, una característica similar a la región de interés; Evite grietas, contaminación por hielo, regiones demasiado gruesas y agujeros vacíos.
- Al elegir carbono en blanco sin muchas funciones de seguimiento, asegúrese de que el área comience a quemarse a la mitad de la tomografía eligiendo una dosis lo suficientemente alta para enfocar y rastreando para quemar lentamente la muestra a inclinaciones más altas. Esto puede ser beneficioso para mantener la precisión del seguimiento. Asegúrese de que el área de seguimiento/enfoque no exponga un área de adquisición posterior.
NOTA: Tenga cuidado con lo que está cerca y lo que entrará en la viga. Evite las áreas con características que intervendrán con el seguimiento y / o la exposición, incluidas las barras de cuadrícula.
- Al elegir carbono en blanco sin muchas funciones de seguimiento, asegúrese de que el área comience a quemarse a la mitad de la tomografía eligiendo una dosis lo suficientemente alta para enfocar y rastreando para quemar lentamente la muestra a inclinaciones más altas. Esto puede ser beneficioso para mantener la precisión del seguimiento. Asegúrese de que el área de seguimiento/enfoque no exponga un área de adquisición posterior.
- Presione Agregar posición una vez que se hayan establecido todos los parámetros y se definan la región de interés deseada y "Enfoque" y "Seguimiento". Repita para nuevos objetivos.
NOTA: Para comprobar que la altura eucéntrica está calibrada correctamente para las posiciones de lote que se han configurado, hay varias estrategias disponibles. Se recomienda elegir uno basado en el tipo de sesión de tomografía realizada (molecular, celular, lámina). - Para la tomografía molecular, suponiendo que las cuadrículas son bastante planas y se ha realizado una altura eucéntrica en el centro de cada cuadrado que contiene las posiciones objetivo, omita el procedimiento "Refinar todo" (o Refinar seleccionado si se han seleccionado posiciones, Figura 7A). Si Tomo tiene problemas con la rutina auto-eucéntrica por inclinación de etapa, posiblemente haga clic en Omitir Eucéntrico.
- Para muestras celulares o laminares, cada posición del lote puede estar a una altura z diferente. Use "Refinar todo" para ser cauteloso o no marque la opción "Omitir eucéntrico".
NOTA: "Refinar todo" iterará a través de todos los tomogramas que se han configurado o seleccionado a través de "Seleccionar posiciones"; Refine la altura eucéntrica y realice el seguimiento y el enfoque antes de la adquisición de datos. Este procedimiento puede exponer cualquier exposición superpuesta de la siguiente región de enfoque/seguimiento del tomograma (Figura 7B), que debe considerarse antes de continuar. - Verifique y vuelva a visitar las plazas que han fallado en el refinamiento. Con el botón derecho del ratón, haga clic en la posición fallida para ver las opciones. Si la altura eucéntrica falla, busque "Auto-eucéntrico por inclinación de etapa" (paso 1.4.1.), adquiera una nueva imagen "Buscar" para actualizar la altura z y "Agregar posición". Elimine la posición fallida/inicializada previamente. Haga clic en la opción Omitir eucéntrico , que se ha hecho con "Refinar todo".
NOTA: Si "Refinar todo" no se ejecuta, entonces "Omitir eucéntrico" no debe estar marcado. Tomo5 ejecutará el refinamiento eucéntrico antes de adquirir cada tomograma; De esta manera, se omitirán las posiciones que fallan en el refinamiento eucéntrico.
- Para muestras celulares o laminares, cada posición del lote puede estar a una altura z diferente. Use "Refinar todo" para ser cauteloso o no marque la opción "Omitir eucéntrico".
- Cree la configuración de recopilación de datos de tomografía en la pestaña "Tomografía".
- Realice funciones automáticas siguiendo los pasos a continuación.
- Compruebe los ajustes para realizar las alineaciones a través de la pestaña "Funciones automáticas" navegando en el atlas a un área de carbono. Lleve esa área a la altura eucéntrica y siga el orden de alineaciones como se indica a continuación.
- Ejecute Auto-eucéntrico por inclinación de etapa con el ajuste preestablecido "Altura eucéntrica".
- Ejecute la rutina de enfoque automático con el ajuste preestablecido "Enfoque".
- Ejecute la rutina Autostigmate con el ajuste preestablecido "Thon Ring".
- Ejecute la rutina Autocoma con el ajuste preestablecido "Thon Ring".
- Inserte la apertura objetiva deseada (Figura 6B), probablemente la apertura de 100 μm, como un buen compromiso para aumentar el contraste de la muestra y solo un pequeño corte en la señal a muy alta resolución.
- Repita la rutina Autostigmate después de la inserción de la apertura.
NOTA: Con ampliaciones con tamaños de píxel de alrededor de 3 Å y resoluciones más bajas, la rutina Autocoma podría fallar; en este caso, marque y alinee el Centro de rotación de Tomo en Alineaciones directas en la interfaz de usuario de TEM.
- Compruebe que la rutina de centrado automático de pérdida cero funciona en su muestra. Con la "pérdida cero" preestablecida en una dosis razonablemente alta (paso 1.2.3), es más probable que la rutina en las funciones automáticas tenga éxito.
- Compruebe los ajustes para realizar las alineaciones a través de la pestaña "Funciones automáticas" navegando en el atlas a un área de carbono. Lleve esa área a la altura eucéntrica y siga el orden de alineaciones como se indica a continuación.
- Realizar la recopilación de datos.
- Para iniciar la adquisición automatizada en la pestaña "Tomografía", seleccione la placa de adquisición de datos y establezca los parámetros deseados (Figura 7C). Configure los parámetros de adquisición de datos: Paso de inclinación (°), Ángulo positivo máx. (°), Ángulo negativo máx. (°), Esquema de seguimiento (recomendado: seleccione Seguimiento/Enfoque antes de la adquisición). Seleccione Cerrar válvulas de columna para el esquema de altura eucéntrica.
NOTA: Los parámetros que rara vez se utilizan son "Ajustar tiempo de exposición", "Ajustar ZLP", "Usar placa de fase" y "Pausa después de inclinación".- Utilice Ajustar tiempo de exposición para tomografías que no están diseñadas para STA para aumentar el tiempo de exposición en una proporción especificada a inclinaciones más altas.
- La opción Ajustar ZLP ejecutará un refinamiento ZLP después de cada tomograma, independientemente de la periodicidad establecida. Es lento, ocasionalmente falla sin razones obvias, y se saltará esa adquisición de posición. Sin embargo, puede ser útil para un ancho de hendidura muy estrecho, es decir, 3-5 eV en un filtro Selectris(X).
- La placa de fase de uso se usa raramente desde la introducción de DEDs con filtros de energía.
- Pause After Tilt pausa la adquisición, pero no permite ningún cambio en el software.
- Verifique dos veces los parámetros de recopilación de datos (en la pestaña "Preparación"), de acuerdo con el cálculo de la dosis y el esquema de inclinación deseado, especifique el número de fracciones (Nr.) en el ajuste preestablecido "Exposición" y luego comience la adquisición.
NOTA: El número de fracciones depende de la muestra, los parámetros de adquisición y los pasos de posprocesamiento planificados, es decir, STA vs. análisis morfológico, y debe mantenerse en valores donde la corrección de movimiento y la estimación de CTF obtengan suficiente señal. Un rango de 4-10 fracciones es una buena estimación, donde 4 es más adecuado para muestras más gruesas y 10 para muestras moleculares más delgadas.- Luego, haga clic en Iniciar para comenzar la recopilación de datos y monitorear la primera adquisición de tomogramas para asegurarse de que los tomogramas se adquieran según lo previsto.
NOTA: Las versiones recientes del software de tomografía tienen una placa adicional del reproductor de películas en la pestaña "Tomografía" donde se pueden ver las tomografías adquiridas. Sea paciente durante el proceso de carga.
- Luego, haga clic en Iniciar para comenzar la recopilación de datos y monitorear la primera adquisición de tomogramas para asegurarse de que los tomogramas se adquieran según lo previsto.
- Para iniciar la adquisición automatizada en la pestaña "Tomografía", seleccione la placa de adquisición de datos y establezca los parámetros deseados (Figura 7C). Configure los parámetros de adquisición de datos: Paso de inclinación (°), Ángulo positivo máx. (°), Ángulo negativo máx. (°), Esquema de seguimiento (recomendado: seleccione Seguimiento/Enfoque antes de la adquisición). Seleccione Cerrar válvulas de columna para el esquema de altura eucéntrica.
2. Cryo-ET STA de apoferritina usando emClarity
NOTA: Aquí, el software emClarity17 se utiliza para ilustrar la determinación de la estructura crio-ET por STA. La Figura 9 resume este proceso. Se tomaron como ejemplo seis series de apoferritina basculante (EMPIAR-10787). Se aplicó simetría octaédrica, y el mapa final tuvo una resolución de 2,86 Å, obtenida de sólo 4.800 partículas y cercana a la frecuencia de Nyquist (2,68 Å).
- Asegúrese de que el paquete de software emClarity39 esté descargado e instalado (consulte la Tabla de materiales). Instale IMOD para el procesamiento de software40.
NOTA: Se requieren conocimientos básicos de comandos de Linux. Un tutorial más detallado se puede encontrar en la referencia41, que toma un conjunto de datos de ribosomas (EMPIAR-10304) como ejemplo y describe los procedimientos paso a paso. Para diferentes tipos de muestras de proteínas, también está disponible un informe publicado anteriormente42. - Prepare los archivos y directorios de entrada.
NOTA: Los fotogramas sin procesar fueron corregidos por MotionCor2 (parche 5 x 5)43 (consulte la Tabla de materiales). Las imágenes corregidas por movimiento se apilaron para generar la serie de inclinación usando newstack (IMOD) y se alinearon manualmente con el seguimiento de parches usando Etomo (ver Tabla de materiales), seguido de emClarity. Para obtener mejores alineaciones, se recomienda realizar compensaciones y compensación de inclinación en Etomo. Las seis series de inclinación se renombran como TS1 a TS6. A continuación se muestran las instrucciones y comandos para la primera serie de inclinación (TS1) como ejemplo.- Establezca una carpeta de proyecto.
NOTA: La última versión del software es 1.5.3.11. Todos los registros de software relacionados se pueden encontrar en la carpeta del proyecto local (.../logFile/emClarity.logfile). - En la carpeta del proyecto, cree otra carpeta nueva, "fixedStacks", y prepare los archivos de entrada: TS1.fixed, TS1.xf y TS1.tlt.
NOTA: TS1.fixed: la serie de inclinación original, también conocida como TS1.st en Etomo. TS1.xf: este archivo contiene las coordenadas de transformación después de Etomo tiltalign. TS1.tlt: este archivo contiene ángulos de inclinación.
- Establezca una carpeta de proyecto.
- Calcule el desenfoque siguiendo los pasos a continuación.
- Calcula el desenfoque. Actualice el archivo de parámetros con el microscopio y los parámetros de imagen siguiendo la Tabla suplementaria 1. Copie un archivo de parámetros en la carpeta del proyecto, cambie su nombre a param_ctf.m y ejecute: emClarity ctf estimate param_ctf.m TS1.
NOTA: La plantilla de archivo de parámetros se puede encontrar en el archivo complementario 1 o en el directorio de instalación de software local (.../emClarity_1.5.3.11/docs/exampleParametersAndRunScript/).
- Calcula el desenfoque. Actualice el archivo de parámetros con el microscopio y los parámetros de imagen siguiendo la Tabla suplementaria 1. Copie un archivo de parámetros en la carpeta del proyecto, cambie su nombre a param_ctf.m y ejecute: emClarity ctf estimate param_ctf.m TS1.
- Compruebe los resultados de la estimación de CTF para cada pila.
- Compruebe las pilas alineadas (por ejemplo, aliStacks/TS1_ali1.fixed) utilizando 3dmod y asegúrese de que las cuentas fiduciarias se borran correctamente.
- Asegúrese de que el archivo de registro informa que la entrega es correcta, lo que se puede encontrar en logfile/emClarity.logfile (Figura 9).
- Compruebe el valor de desenfoque (por ejemplo, fixedStacks/ctf/TS_ali1_psRadial_1.pdf) y asegúrese de que coincide con la estimación teórica de CTF.
- Defina las subregiones.
- Generar un tomograma agrupado. En la carpeta del proyecto, ejecute: sh recScript2.sh -1.
NOTA: Una tomografía más pequeña (en tamaño) para cada pila se almacenará en una nueva carpeta "bin10". Para acelerar el proceso, las coordenadas de una o varias subregiones se pueden definir en un tomograma bin10. El archivo de script estará en el directorio de instalación del software local (.../emClarity_1.5.3.11/docs/). - Determine los límites eligiendo seis puntos, x min, x max, y min, ymax, zmin yz max, para crear una subregión. En la carpeta "bin10", ejecute: 3dmod TS1_bin10.rec.
NOTA: Si se van a crear cuatro subregiones en una serie de inclinaciones, elija 6 × 4 = 24 puntos. Cada pila debe tener un archivo de modelo (*.mod) en la carpeta "bin10". - Convierta los archivos del modelo al formato emClarity. Esto creará un nuevo reconocimiento de carpeta. Almacene todas las coordenadas de cada subregión en esta carpeta. En la carpeta del proyecto, ejecute: sh recScript2.sh TS1.
- Generar un tomograma agrupado. En la carpeta del proyecto, ejecute: sh recScript2.sh -1.
- Recoge partículas.
- Encuentra una plantilla de apoferritina para recoger partículas. Descargue una plantilla del Banco de datos de microscopía electrónica (EMD-10101)44. Asegúrese de que el tamaño de píxel de la plantilla coincida con el de los datos sin procesar. En la carpeta del proyecto, ejecute: emClarity rescale ApoF.mrc ApoF_Template_rescale.mrc 3.60 1.34 cpu.
- Genere tomogramas corregidos por CTF para la recolección de partículas. En la carpeta del proyecto, ejecute: emClarity ctf 3d param_ts.m templateSearch.
- Ejecute la recolección de partículas para cada subregión. Para el conjunto de datos de apoferritina, realice una búsqueda de plantillas en bin6. Modifique los parámetros Tmp_angleSearch (θ fuera, Δ fuera, θ dentro, Δ dentro) para determinar el rango de ángulo y los intervalos para la búsquedadentro ofuera del plano en grados. En la carpeta del proyecto, ejecute: emClarity templateSearch param_ts.m TS1 1 ApoF_Template_rescale.mrc O 1.
NOTA: Se generará una carpeta "convmap_wedge_Type2_bin6" en este paso. El archivo csv en esta carpeta (por ejemplo, TS1_1_bin6.csv) incluye toda la información sobre las partículas recogidas. - Elimine las partículas incorrectas usando 3dmod. En la carpeta "convmap_wedge_Type2_bin6", ejecute: 3dmod .. /cache/TS1_1_bin6.rec TS1_1_bin6.mod.
NOTA: Es común encontrar partículas incorrectas junto a los bordes de carbono o contaminaciones de hielo en esas áreas. Haga clic con el botón derecho del ratón en los puntos incorrectos y presione retroceso en el teclado para eliminarlos. En este paso, asegúrese de que la mayoría de los puntos falsos positivos se eliminan (Figura 10). - Cambie el nombre de la carpeta "convmap_wedge_Type2_bin6" a "convmap", ya que emClarity irá y buscará información de subregión en convmap en los siguientes pasos.
- Inicialice el proyecto. En la carpeta del proyecto, ejecute: emClarity init param0.m, para crear una base de datos para emClarity, ApoF.mat.
- Realizar la reconstrucción de tomogramas antes de STA y alineación. Para generar tomogramas de subregión corregidos por CTF en bin4, ejecute: emClarity ctf 3d param0.m.
NOTA: Los tomogramas corregidos por CTF (por ejemplo, cache/TS1_1_bin4.rec) se generarán en una nueva carpeta "caché". - Realizar STA y alineación.
- Realizar el promedio utilizando los subtomogramas corregidos por CTF a partir del bin4. En la carpeta del proyecto, ejecute: emClarity avg param0.m 0 RawAlignment.
- Continúe haciendo alineaciones y ejecute: emClarity alignRaw param0.m 0.
NOTA: El paso de promedio genera una referencia, que será utilizada por emClarity en este paso para alinear las partículas. Los parámetros Raw_angleSearch (θ fuera, Δfuera, θ dentro, Δdentro) se pueden cambiar para establecer el rango de ángulo y los tamaños de paso para cada ciclo. Como la mayoría de las partículas incorrectas se eliminan de la base de datos (Paso 2.6.4), estos ajustes angulares para la alineación pueden comenzar con un grado relativamente pequeño. - Actualice los parámetros Raw_angleSearch y ejecute algunos ciclos más (pasos 2.9.1 y 2.9.2). Para acelerar el proceso, realice alineaciones dentro y fuera del plano por separado.
NOTA: Para cada agrupación, se recomienda ejecutar varios ciclos y reducir gradualmente la configuración angular. Para el conjunto de datos de ApoF, se llevaron a cabo cinco ciclos más en el contenedor 4, y hay más detalles disponibles en la Tabla Suplementaria 2. Para cycle001, en la carpeta del proyecto, ejecute: emClarity avg param1.m 1 RawAlignment, seguido de emClarity alignRaw param1.m 1. - Limpie las partículas superpuestas. En la carpeta del proyecto, ejecute: emClarity removeDuplicates param5.m 5.
- Realice el refinamiento de la serie Tilt con tomoCPR.
NOTA: Este paso es opcional.- Ejecute tomoCPR para refinar la geometría de la pila. En la carpeta del proyecto, ejecute: emClarity tomoCPR param5.m 5.
- Genere pilas recién alineadas y actualice los archivos de geometría. En la carpeta del proyecto, ejecute: emClarity ctf update param6.m.
NOTA: Asegúrese de que los nuevos archivos de geometría (por ejemplo, fixedStacks/ctf/TS1_ali2_ctf.tlt) y las pilas recién alineadas (por ejemplo, aliStacks/TS1_ali2.fixed) se generan correctamente. - Crear nuevos sub-tomogramas en bin2. En la carpeta del proyecto, ejecute: emClarity ctf 3d param6.m.
NOTA: Esto será seguido por algunos ciclos para promediar y alinearse en bin2 (pasos 2.9.1, 2.9.2 y 2.9.3), limpieza duplicada (paso 2.9.4) y tomoCPR opcional (paso 2.10). Debido a la alta simetría, se llevaron a cabo otros cinco ciclos en bin2 para apoferritina. Actualice los parámetros Raw_angleSearch para cada ciclo.
- Realizar la reconstrucción final.
- Continúe ejecutando algunos ciclos en bin1 y tomoCPR (Paso 2.9 y Paso 2.10). Otros 10 ciclos más en bin1 se llevaron a cabo para el conjunto de datos de apoferritina. Más detalles sobre los comandos y parámetros se pueden encontrar en la Tabla 2.
- Realice la reconstrucción final combinando los dos conjuntos de datos de la mitad. En la carpeta del proyecto, ejecute: emClarity avg param21.m 21 RawAlignment, seguido de emClarity avg param21.m 21 FinalAlignment.
NOTA: Se generará el mapa final (por ejemplo, con un factor B de 10, cycle021_ApoF_class0_final_bFact-10.mrc), figura 11.
Resultados
Para las muestras celulares y láminas, la estrategia de recolección de datos depende en gran medida de la muestra y del objetivo del estudio de imagen (Figura 1). El enfoque de focalización depende de si el objetivo molecular está in situ o preparado a partir del complejo macromolecular purificado para muestras de reconstrucción de alta resolución que contienen objetivos moleculares. Para complejos purificados vitrificados en rejillas agujereadas (carbono), la focalización puede basarse simplemente en imágenes en los orificios de la película de soporte (carbono). Para el trabajo in situ , el enfoque de focalización requiere el conocimiento de la ubicación de la entidad molecular basado en datos correlativos o puntos de referencia celulares conocidos de bajo aumento. Los puntos de referencia celulares idealmente serían identificables al tomar imágenes generales y, si son suficientes para localizar aproximadamente las regiones de interés, pueden proporcionar una forma rápida de confirmar la identidad del objetivo con una imagen de búsqueda. Sin embargo, si los eventos observables son raros, entonces las imágenes de búsqueda de aumento medio pueden ser necesarias para calificar el objetivo es correcto. Los mapas de búsqueda son montajes de aumento medio de imágenes de búsqueda y, por lo tanto, pueden facilitar mucho la búsqueda de objetivos, donde se pueden adquirir con un aumento en el que la característica de interés es visible. Los mapas de búsqueda se pueden filtrar para encontrar y configurar las posiciones de los lotes de destino. Para las muestras que contienen características celulares para la reconstrucción ultraestructural, el enfoque de focalización es similar, aunque igualmente depende de la visibilidad del evento celular a varios aumentos y su prevalencia en la muestra.
También debe considerarse la estrategia de adquisición de datos; En todos los casos, el objetivo del estudio determina en gran medida cómo se recopilan los datos. Para la reconstrucción de la ultraestructura celular, un bajo aumento (20-5 Å / px) y un gran campo de visión pueden ser apropiados, pero se requieren aumentos altos para reconstruir detalles moleculares o de alta resolución (5-1 Å / px). Un conjunto de datos recopilado a 1,5 Å/px en condiciones ideales sólo será físicamente capaz de producir una reconstrucción a la frecuencia de Nyquist de 3,0 Å/px; Sin embargo, en realidad, muchos factores, incluyendo pero no limitado al grosor, tamaño y heterogeneidad de la muestra, todos afectan la calidad de reconstrucción obtenida. Los parámetros exactos de imagen también equilibran la ampliación basada en el objetivo del estudio con el campo de visión para contener suficiente información. Este artículo presenta un subtomografía con un promedio de casos que alcanza 2,86 Å, pero estudios adicionales 17,42,43,44,45 se presentan en la Tabla 1 para ilustrar los parámetros de recolección asociados con estudios dirigidos a diferentes resultados17,42,45,46.
Una vez que se establece un flujo de trabajo de focalización y un régimen de adquisición de datos para crio-ET, es posible la recopilación de datos de muchos tipos de muestras diferentes. Aquí se presentan tomogramas representativos de una variedad de especímenes: muestras moleculares como apoferritina (Película 1), procesos celulares delgados (Película 2) y láminas fresadas FIB de la muestra celular gruesa (Película 3).
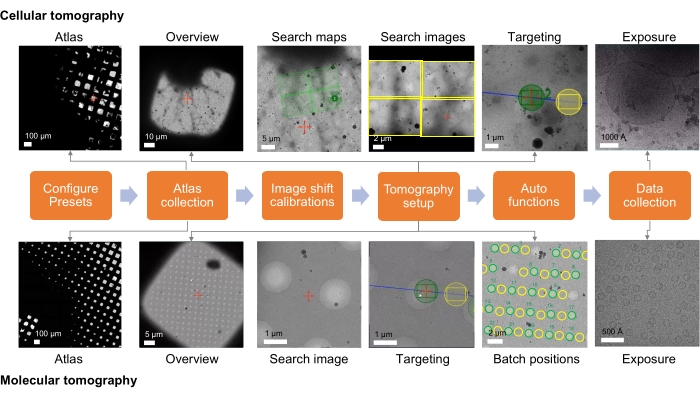
Figura 1: Descripción general de la configuración del flujo de trabajo de tomografía. El flujo de trabajo de imágenes crio-ET descrito en el protocolo se muestra como un diagrama de flujo. Las imágenes que se espera adquirir se muestran para el flujo de trabajo celular y molecular. El nombre presentado sigue la convención Tomo5, aunque la mayoría del software de adquisición de tomografía comparte principios comunes para recopilar estas imágenes. Haga clic aquí para ver una versión más grande de esta figura.
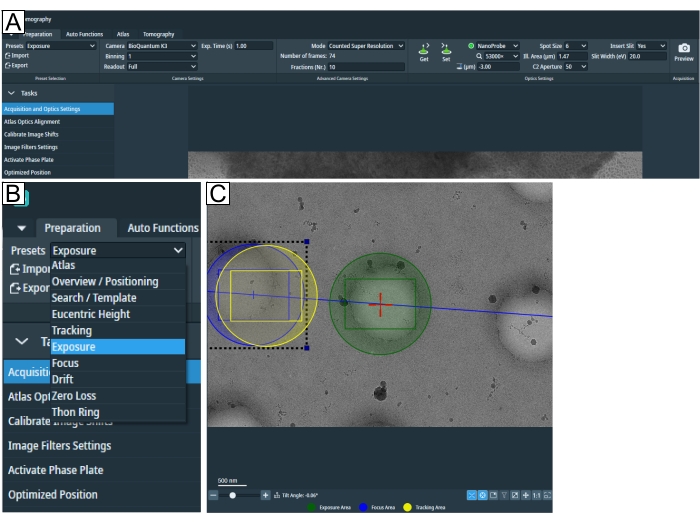
Figura 2: Pestaña de preparación y condiciones preestablecidas de búsqueda . (A) Imagen general de toda la pestaña. Los ajustes preestablecidos de condición de imagen se establecen en esta pestaña, y "Calibrar desplazamiento de imagen" y "Configuración de filtro de imagen" se pueden encontrar en el menú desplegable "Tareas". (B) Zoom del menú desplegable "Presets" donde se puede seleccionar cada ajuste preestablecido para la configuración de condiciones de imagen individuales. (C) Imagen que representa un aumento adecuado para ajustar tanto la exposición como el área de "Enfoque y seguimiento" en el campo de visión. Haga clic aquí para ver una versión más grande de esta figura.
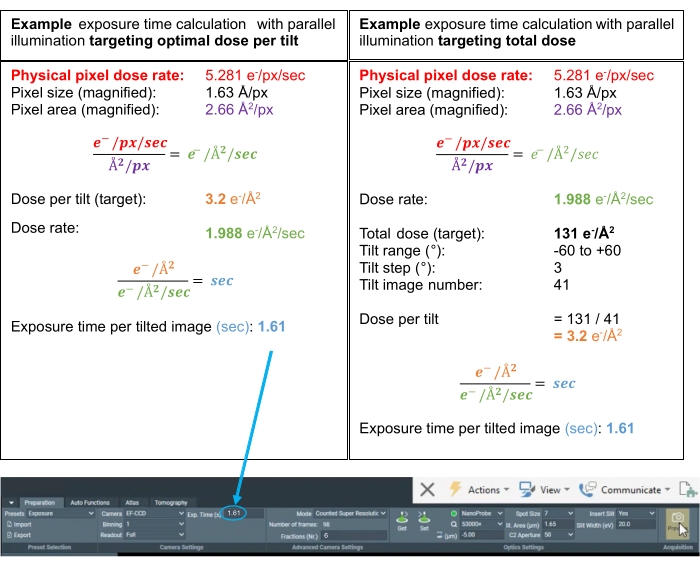
Figura 3: Cálculos de dosis. Ejemplos de cálculos de dosis para posibles esquemas de adquisición de tomografías donde la tasa de dosis se ha medido en vacío. Los dos cálculos determinan el tiempo de exposición para cada inclinación, ya sea apuntando a una dosis óptima por inclinación o a una dosis total óptima para la serie de inclinación completa. En el promedio de subtomogramas, es una práctica común apuntar a una dosis óptima por imagen inclinada en el rango de 3.0-3.5 e-/Å2. En ambos casos, las "fracciones (Nr.)" se establecen en 6 para lograr ~0.5 e-/Å2 de dosis por fotograma de película de la inclinación para una señal suficiente para realizar la corrección de movimiento. Haga clic aquí para ver una versión más grande de esta figura.
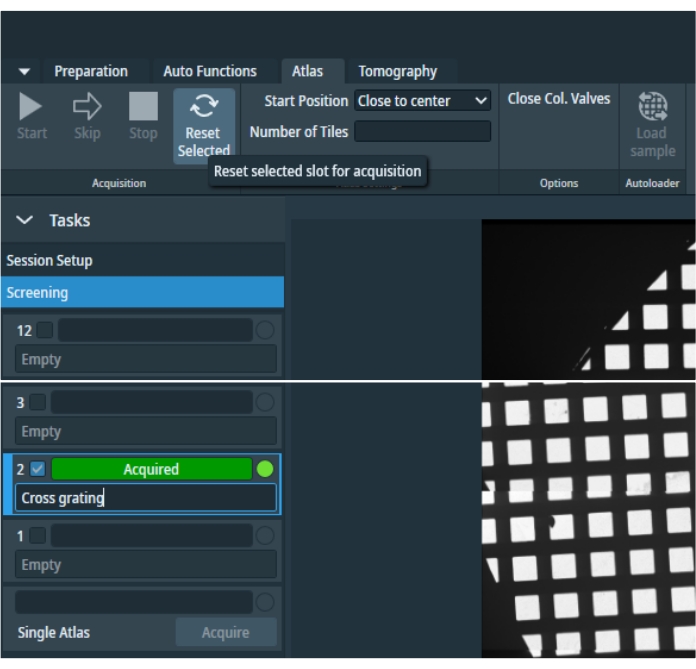
Figura 4: Pestaña Atlas. Imagen general de la pestaña "Atlas". La imagen se ha recortado para evitar espacios de posición de cuadrícula vacíos. El menú "Tareas" contiene preferencias de configuración de sesión y espacios de selección de cuadrícula para la selección individual de todas las cuadrículas inventariadas y una opción para adquirir un solo atlas después de que el casete se haya eliminado del cargador automático. Una cuadrícula seleccionada se puede restablecer y luego volver a adquirir. Haga clic aquí para ver una versión más grande de esta figura.
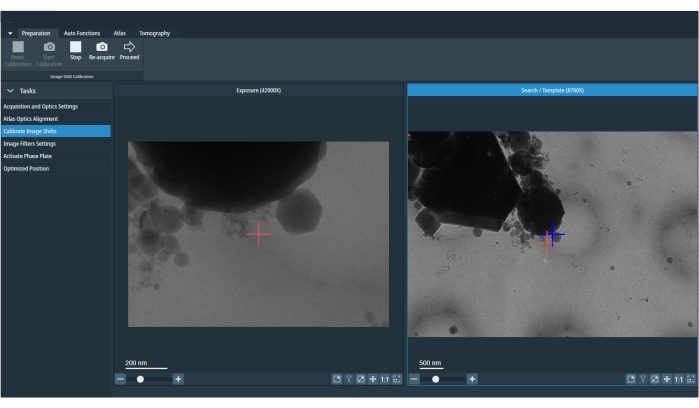
Figura 5: Cambios de imagen calibrados. La imagen muestra una imagen de exposición y búsqueda. La cruz roja en la imagen de búsqueda es el marcador desplazado para corregir el desplazamiento entre la exposición y la búsqueda. Uno debe rehacer las calibraciones de desplazamiento de imagen al inicio de la sesión o después de cambiar los ajustes preestablecidos de la condición de imagen. Haga clic aquí para ver una versión más grande de esta figura.
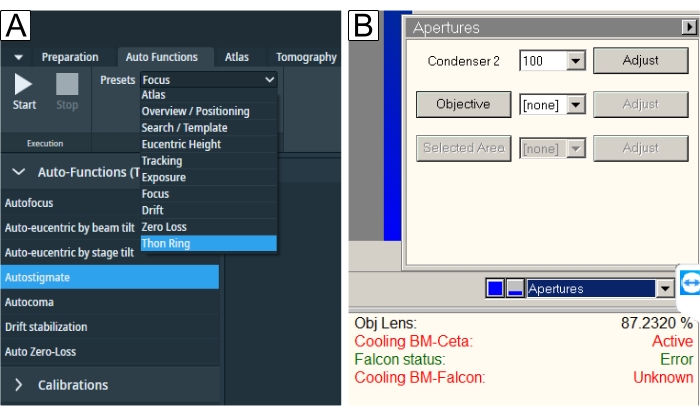
Figura 6: Funciones y aperturas automáticas. (A) La pestaña "Funciones automáticas" muestra el menú desplegable "Ajustes preestablecidos" y la selección "Tarea". Subrayado en azul está el ajuste preestablecido "Thon Ring" requerido para "Autostigmate" (también subrayado en azul) y "Autocoma". Uno debe seleccionar los ajustes preestablecidos respectivos para cada tarea y luego presionar el botón Inicio . (B) Las aperturas se encuentran en la interfaz de usuario de TEM. Seleccione la "Apertura objetiva" deseada después de que se hayan realizado las funciones automáticas y ejecute "Autoestigma" con la apertura adentro. Haga clic aquí para ver una versión más grande de esta figura.
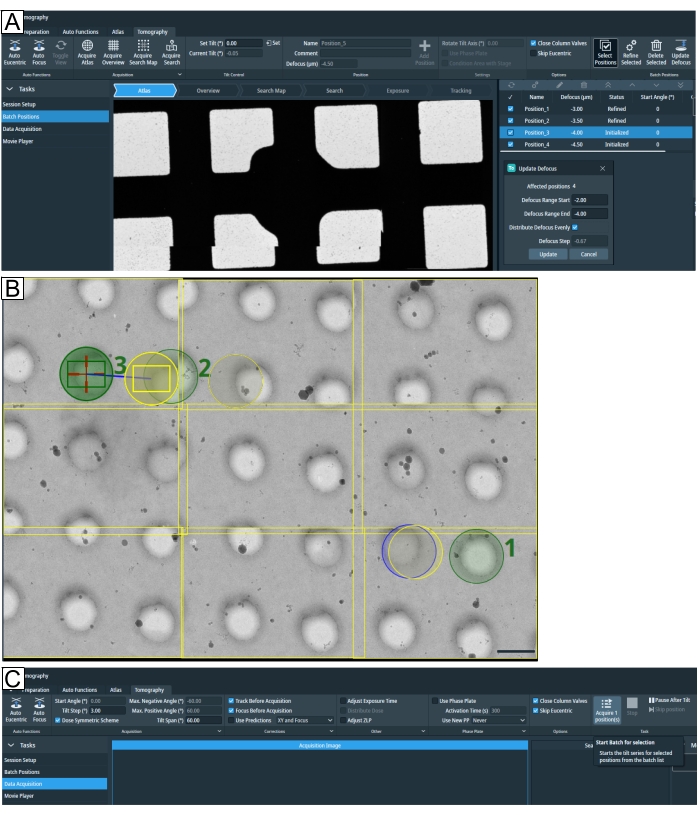
Figura 7: Descripción general de la pestaña Tomografía. Las imágenes muestran la interfaz de usuario de Tomo 5.8. (A) Posiciones de lote. Las últimas funciones representadas en la imagen: la opción "Adquirir mapa de búsqueda"; Las posiciones del tomograma se muestran en la vista Atlas con la opción de zoom; resaltado en la parte superior derecha está "Seleccionar posiciones"; a continuación, se han seleccionado las cuatro posiciones para "Actualizar desenfoque". (B) Se seleccionan tres posiciones en el mapa de búsqueda, etiquetadas como 1, 2 y 3. La posición 1 no planteará un problema cuando se ejecute "Refinar todo". Sin embargo, si en un ajuste de alta densidad de objetivos, como cuando se seleccionan las posiciones de las laminillas, como se muestra para la posición 2 y la posición 3, entonces "Refinar todo" ejecutará la rutina "Seguimiento" y "Enfoque" en la región de "Exposición" de la posición 2, exponiendo el objetivo antes de que se adquiera el tomograma. El tipo de cuadrícula es R1.2/1.3. Barra de escala = 1,2 μm. (C) Adquisición de datos. Las posiciones seleccionadas configuradas en "Posiciones por lotes" ahora se pueden adquirir individualmente. Haga clic aquí para ver una versión más grande de esta figura.
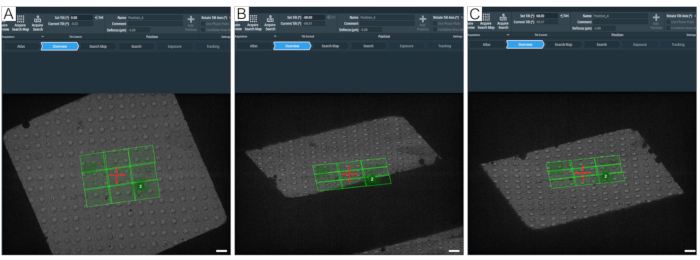
Figura 8: Definición del ángulo máximo de inclinación. La figura muestra un enfoque paso a paso para determinar el rango máximo de inclinación para la adquisición de tomogramas. (A) 0° visión general y un mapa de búsqueda en el centro del cuadrado de cuadrícula. Para probar el rango de inclinación, el ángulo se puede ajustar en el software de tomografía con "Establecer inclinación (°)" escribiendo el valor deseado y luego presionando Establecer. (B) El escenario se ha inclinado a -60°, lo que muestra que una esquina del mapa de búsqueda no se adquiriría completamente a -60°. (C) El escenario se ha inclinado a 60°. Al contar los agujeros que han desaparecido a ±60°, uno puede tener una idea sobre el rango de inclinación de un cuadrado de cuadrícula. Barras de escala = 2,5 μm. Haga clic aquí para ver una versión más grande de esta figura.
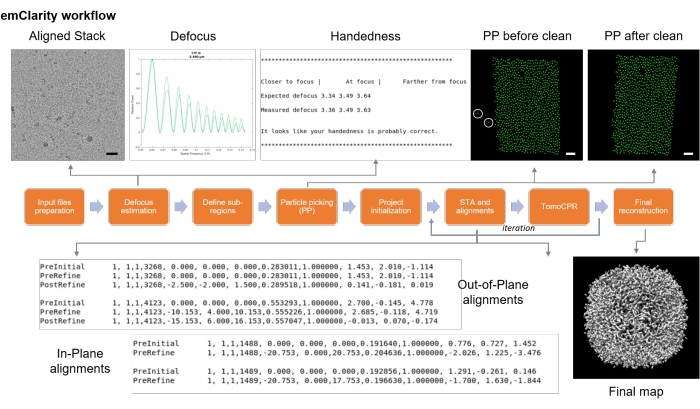
Figura 9: Diagrama de flujo de emClarity. El diagrama de flujo describió los diversos pasos para el promedio de subtomograma criogénico. Barras de escala = 50 nm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10: Coincidencia de plantillas usando emClarity . (A) Una micrografía típica de apoferritina en una cuadrícula recubierta de grafeno. Desenfoque: −3.430 μm. (B) Una porción del tomograma superpuesta con puntos de modelo después de la búsqueda de plantillas. (C) Una vista superior y (D) una proyección lateral de los puntos del modelo, que indican una sola capa plana de partículas de apoferritina monodispersas. Barras de escala = 50 nm. Haga clic aquí para ver una versión más grande de esta figura.
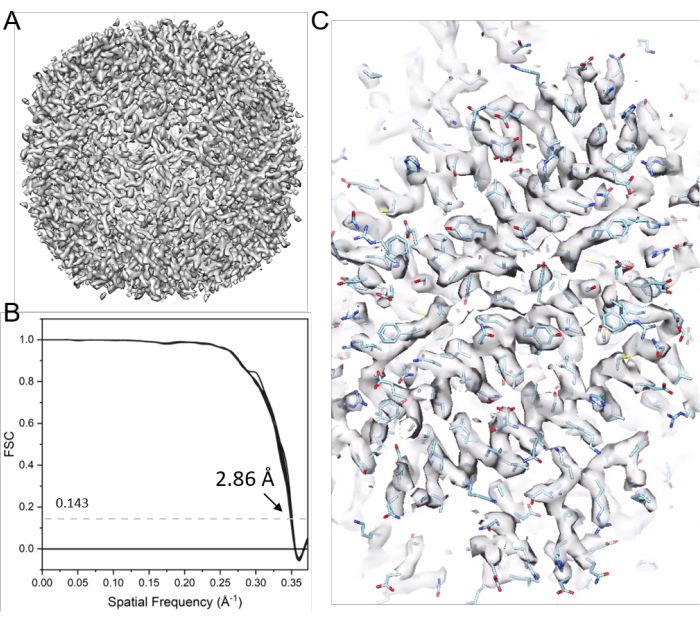
Figura 11: Cryo-ET STA de apoferritina . (A) El mapa final después de 21 ciclos de alineación de subtomograma. (B) La gráfica de correlación de conchas de Fourier (FSC) del mapa final con una resolución reportada de 2.86 Å, que contiene 38 FSC de cono. (C) Mapas de densidad representativos (equipados con el modelo PDB 6s6147). Haga clic aquí para ver una versión más grande de esta figura.
| Muestra | Tipo Cryo-ET | Å/px | Rango de inclinación (+/-) | Paso de inclinación (°) | Rango de desenfoque (μm) | Dosis total (e-/Å2) | Resolución | Datos brutos | Referencia |
| Apoferritina | Purificado/Molecular (STA) | 1.34 | 60 | 3 | 1.5 – 3.5 | 102 | 2.86 | EMPIAR-10787 | 17 & este documento |
| Mordaza sobre el VIH-1 | Purificado/Molecular (STA) | 1.35 | 60 | 3 | 1.5 – 3.96 | 120 | 3.1 | EMPIAR-10164 | 17 |
| Ribosoma | Purificado/Molecular (STA) | 2.1 | 60 | 3 | 2.2 – 4.3 | 120 | 7 | EMPIAR-10304 | 42 |
| Pico de SARS-CoV-2 | Lamela/Molecular (STA) | 2.13 | 54 | 3 | 2 – 7 | 120 | 16 | EMPIAR-10753 | 45 |
| Estructura del axón neuronal | Celular (ultraestructural) | 5.46 | 60 | 2 | 3.5 – 5 | 90 | N.D. | EMPIAR-10922 | 47 |
Tabla 1: Parámetros de recolección para varios estudios crio-ET. Estudios dirigidos a la reconstrucción de detalles moleculares a partir de proteínas purificadas o in situ en comparación con un estudio destinado a resolver y segmentar las características celulares ultraestructurales.
Película 1: Un tomograma de muestras de apoferritina en una cuadrícula EM normal y luego fotografiado con un crio-TEM equipado con una cámara de ultra alta resolución con un filtro compatible. Las series de inclinación se adquirieron con un esquema simétrico de dosis, con un intervalo de inclinación de 54° y una dosis total de 134 e-/A2 en el software de tomografía electrónica. Barra de escala = 50 nm. Haga clic aquí para descargar esta película.
Película 2: Una tomografía de una neurona primaria cultivada en una cuadrícula EM y luego fotografiada directamente con un crio-TEM equipado con una cámara de ultra alta resolución con un filtro compatible. Las series de inclinación se adquirieron con un esquema simétrico de dosis, con un intervalo de inclinación de 60° y una dosis total de 120 e-/A2 en el software de tomografía electrónica. Barra de escala = 100 nm. Haga clic aquí para descargar esta película.
Película 3: Un tomograma de una cianobacteria en una rejilla EM, sometida a molienda FIB y luego fotografiada con un crio-TEM equipado con una cámara de alta velocidad y un filtro compatible. Las series de inclinación se adquirieron con un esquema simétrico de dosis, con un intervalo de inclinación de 50° y una dosis total de 120 e-/A2 en el software de tomografía electrónica. Barra de escala = 87,2 nm. Haga clic aquí para descargar esta película.
Archivo complementario 1: la plantilla del archivo de parámetros para estimar el desenfoque. Haga clic aquí para descargar este archivo.
Tabla complementaria 1: Recopilación de datos y detalles de configuración del microscopio. Haga clic aquí para descargar esta tabla.
Tabla complementaria 2: Lista de comandos en el orden de ejecución. Haga clic aquí para descargar esta tabla.
Discusión
Tomo5
La descripción del flujo de trabajo del software de tomografía destaca una forma potencial y más simplificada para una configuración de sesión de tomografía por lotes (remota). Si bien el software es fácil para principiantes, algo de experiencia inicial en crio-EM y comprensión básica de la tomografía puede ayudar con la configuración. Los pasos críticos se resaltan en el protocolo y deberían ayudar a solucionar problemas incluso si se ha utilizado un enfoque de configuración diferente. El avance del software facilitará la recopilación de datos (remota) y hará que la crio-ET sea más accesible para una amplia base de usuarios. A continuación se describen algunos consejos y trucos que pueden ayudar a solucionar problemas comunes.
Un punto importante a discutir es la elección de las cuadrículas porque, al inclinar la muestra a ±60°, las barras de cuadrícula en inclinaciones altas pueden oscurecer la vista (Figura 8). En una cuadrícula TEM, el tamaño de malla se refiere al número de cuadrados de cuadrícula por unidad de longitud de la cuadrícula. Los números de malla más grandes tienen más cuadrados de cuadrícula por unidad de longitud, una mayor densidad de cuadrados de cuadrícula y cuadrados de cuadrícula más pequeños, es decir, una cuadrícula de 400 mallas tiene cuadrados más pequeños que una cuadrícula de 200 mallas. Una buena opción de rejillas para la tomografía son las rejillas de malla 200 o 300. Como se muestra en la Figura 8, el área disponible para recolectar se reduce a medida que se inclina la cuadrícula. Con una inclinación de ±60°, una cuadrícula de malla 300 tendrá un pequeño campo de visión en el que se puede adquirir una tomografía completa. Las ventajas de las cuadrículas de malla 200 son que los cuadrados de cuadrícula más grandes hacen que la configuración de la tomografía molecular sea más rápida, y con el aumento del área cuadrada de la cuadrícula, un cuadrado probablemente será suficiente para una colección durante la noche. La desventaja es que las rejillas de malla 200 son más frágiles, por lo que el manejo y el recorte requieren más delicadeza.
Además, si se utiliza una película de soporte agujereada (consulte la Tabla de materiales) en rejillas EM, se debe considerar el espaciado del orificio para la configuración de la región de enfoque y seguimiento en relación con la región de exposición. Idealmente, el diámetro del haz con el aumento deseado debe ser lo suficientemente pequeño como para cubrir el área de carbono adyacente al área de exposición a lo largo del eje de inclinación para una configuración óptima y rápida. De esta manera, se pueden adquirir regiones potenciales de interés en cada hoyo.
Como la rutina de altura eucéntrica del software actualmente no es tan robusta, como la rutina serialEM, los siguientes consejos pueden solucionar ese problema. Si la determinación de altura eucéntrica falla usando el ajuste preestablecido de altura eucéntrica, se puede usar el ajuste preestablecido de vista general en su lugar y volver a ejecutar "Auto-eucéntrico por inclinación de etapa"; Esto puede resolver problemas si la altura eucéntrica está muy lejos de 0. Si esto tiene éxito, se puede volver a ejecutar "Auto-eucéntrico por inclinación de etapa" con ajustes preestablecidos de "Altura eucéntrica" para mejorar la precisión. Si falla, se puede ejecutar "Auto-Eucéntrico por inclinación del haz" con la altura eucéntrica preestablecida y luego volver a ejecutar "Auto-Eucéntrico por inclinación de la etapa" o establecer manualmente la altura z consolidada por "Auto-Eucéntrico por inclinación del haz" en la interfaz de usuario de TEM en la configuración de "Escenario". En caso de que se utilicen cuadrículas con un patrón repetitivo de agujeros, pueden impedir la identificación de un solo pico de correlación cruzada. Se puede intentar alterar el preajuste de altura eucéntrica a un desplazamiento de desenfoque más bajo, como -25 μm y / o un tiempo de exposición más corto para reducir la correlación cruzada de los patrones de agujeros. Por otro lado, el uso de rejillas / láminas de encaje puede no proporcionar suficiente señal para un fuerte pico de correlación cruzada. Se puede intentar alterar el preajuste de altura eucéntrica a un mayor desplazamiento de desenfoque, como −75 μm y / o un tiempo de exposición extendido para mejorar el pico de correlación cruzada. Otra opción es ajustar la configuración del filtro de imagen; se pueden encontrar en la pestaña "Preparación". Las opciones para ajustar la configuración del filtro se pueden establecer para baja (Descripción general / cuadrícula), media (altura eucéntrica) y aumento alto (seguimiento / enfoque) para encontrar el pico de correlación cruzada óptimo para cada ajuste preestablecido. La entrada requerida es una imagen, es decir, a 0° y otra a 5°, seguida de hacer clic en Comparar para comparar ambas imágenes. El valor inicial recomendado para la longitud de onda más larga es un cuarto de la barra de escala en la imagen y para la longitud de onda más corta es una cuadragésima parte de la barra de escala. Si el pico no se identifica de manera robusta, se puede optimizar la configuración hasta que se pueda encontrar un pico convincente. No hay necesidad de volver a adquirir imágenes cada vez; simplemente presionar "Comparar" es suficiente. Si TOMO sigue sin encontrar automáticamente la altura eucéntrica, se puede utilizar la calibración manual de altura eucéntrica. Uno debe centrarse sobre un cristal de hielo razonablemente grande en la ampliación general en la pestaña "Preparación", luego ir al "Control de escenario" de la interfaz de usuario TEM, establecer alfa en -30 ° y ajustar el valor z de la etapa para volver a centrar el cristal usando la imagen de pantalla fluorescente. Seleccionar los ajustes de "Alta resolución" y "Alto contraste" en la interfaz de usuario de TEM lo simplificará (botones en la parte inferior de la ventana de la pantalla fluorescente). Opcionalmente, si hay acceso a una cámara con modo en vivo, esto se puede usar para determinar la altura eucéntrica; Será más fácil que en la pantalla fluorescente.
Las mayores limitaciones en las versiones de Tomo5 anteriores a 5.8 son los montajes de aumento medio que faltan, el esquema simétrico de dosis faltante y los problemas relacionados con la búsqueda de altura eucéntrica. Estos existen en serialEM, un programa gratuito con rápido desarrollo y soporte de la comunidad, una robusta rutina de altura eucéntrica y la opción de script, es decir, un esquema simétrico de dosis personalizado. Desde la versión 5.8 en adelante en Tomo5, el problema más común para encontrar la altura eucéntrica, es decir, un bucle fallido alrededor del valor z objetivo, se ha resuelto implementando la opción de establecer un criterio de aceptación de altura eucéntrica. Sin embargo, con diferentes tipos de cuadrícula y muestra, se recomienda encarecidamente ajustar la configuración del filtro de imagen para reflejar las condiciones de imagen únicas de las sesiones individuales y para proporcionar el mejor pico de correlación cruzada posible para encontrar la altura eucéntrica y para que la región de enfoque y seguimiento funcione de manera confiable durante la adquisición del tomograma.
En general, muchas instalaciones se han adaptado rápidamente a la operación remota durante la pandemia. El software Tomo5 proporciona un acceso fácil y una ruta fácil de usar a la tomografía que es muy adecuada para la operación remota. Los avances realizados en el software sin duda continuarán haciendo que las recopilaciones de datos remotas y la recopilación de tomografía en general sean más comunes en la comunidad.
emClarity
Como emClarity utiliza un método de selección de partículas basado en plantillas, necesita una plantilla para el objeto de interés. La selección de partículas (paso 2.6) es muy sensible y clave para la estructura final. Antes de promediar y alinearse (paso 2.9), uno debe asegurarse de verificar cuidadosamente y eliminar manualmente los falsos positivos. Cuando una plantilla no está disponible, emClarity puede no ser fácil de usar, pero es posible utilizar otro software, por ejemplo, Dynamo37 y PEET48, para crear un modelo inicial.
Para muestras heterogéneas, emClarity está equipado con un método de clasificación que permite a los usuarios centrarse en características específicas con diferentes escalas. Es útil ejecutar algunos ciclos de alineaciones antes de la clasificación y ejecutarlo en un binning más alto (como el contenedor 4 o el contenedor 3).
La versión actualizada del software (V1.5.3.11) tiene actualizaciones significativas en comparación con la primera versión (V1.0)17. Estos incluyen, pero no se limitan a, una verificación de mano durante la estimación de CTF (paso 2.3); simetría para alineaciones (CX, I, I2, O); cálculo de las funciones de muestreo 3D por partícula (3DSF); un cambio a MATLAB 2019a para compatibilidad y estabilidad; y reconstrucción utilizando las imágenes de proyección en bruto (cisTEM). El software continuará mejorando para varias muestras, y los anuncios más recientes se pueden encontrar en línea (consulte la Tabla de materiales).
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Agradecemos a Diamond Light Source por el acceso y el apoyo a las instalaciones crio-EM en el Centro Nacional de Bio-Imágenes Electrónicas (eBIC) del Reino Unido, financiado por Wellcome Trust, MRC y BBRSC. También nos gustaría agradecer a Andrew Howe por la adquisición del tomograma de apoferritina (Película 1), a Ishika Kumar por la preparación y adquisición del tomograma neuronal (Película 2) y a Craig MacGregor-Chatwin por la tomagrama de laminillas de cianobacterias (Película 3).
Materiales
| Name | Company | Catalog Number | Comments |
| Software | |||
| Tomography | Thermo Fisher Scientific | 5.9.0 | Internal terminology: Tomo5 in document |
| TEM server | Thermo Fisher Scientific | 7.10.1 | |
| TIA | Thermo Fisher Scientific | 5.10.1 | |
| DigitalMicrograph | Gatan | 3.44 | |
| emClarity | Open-Source software | 1.5.3.11 | Software for high-resolution cryo-electron tomography and subtomogram averaging |
| IMOD | Open-Source software | 4.11 | Modeling, display and image processing programs used for 3D reconstruction and modeling of microscopy images with a special emphasis on electron microscopy data |
| MotionCor2 | Free for academic use | 1.1.0 | A multi-GPU program that corrects beam-induced sample motion recorded on dose fractionated movie stacks |
| ETomo | Open-Source software | 4.11 | ETomo is an interface for running a subset of IMOD and PEET commands. |
| NoMachine | NoMachine, freeware | 7.9.2 | Remote desktop software |
| TeamViewer | TeamViewer AG | - | Remote access and remote control computer software |
| Materials | |||
| Quantifoil (holey support film) EM grids | Quantifoil | - | A flat film of carbon with pre-defined hole size, shape and arrangement |
| Instrumentation | |||
| Titan Krios microscope | Thermo Fisher Scientific | Titan Krios G2 | |
| K3 camera and GIB energy filter | Gatan | - | |
| Falcon 4 camera and Selectris X energy filter | Thermo Fisher Scientific | - | |
| Website | |||
| Website 1: https://github.com/bHimes/emClarity/ | - | - | Link to download the emClarity software package |
| Website 2: https://bio3d.colorado.edu/imod/ | - | - | Link to download IMOD |
| Website 3: https://github.com/ffyr2w/emClarity-tutorial | - | - | Link to the emClarity online tutorial |
| Website 4: https://emcore.ucsf.edu/ucsf-software | - | - | Link to download MotionCor2 |
| Website 5: https://github-wiki-see.page/m/bHimes/emClarity/wiki | - | - | Link to the newest announcements including updates and bug fixs for emClarity |
Referencias
- Bai, X. -. C., Fernandez, I. S., McMullan, G., Scheres, S. H. W. Ribosome structures to near-atomic resolution from thirty thousand cryo-EM particles. eLife. 2, 00461 (2013).
- Li, X., et al. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM. Nature Methods. 10 (6), 584-590 (2013).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. 587 (7832), 152-156 (2020).
- Kato, T., et al. CryoTEM with a cold field emission gun that moves structural biology into a new stage. Microscopy and Microanalysis. 25, 998-999 (2019).
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. 587 (7832), 157-161 (2020).
- Mastronarde, D. N. SerialEM: A program for automated tilt series acquisition on Tecnai microscopes using prediction of specimen position. Microscopy and Microanalysis. 9, 1182-1183 (2003).
- Schorb, M., Haberbosch, I., Hagen, W. J. H., Schwab, Y., Mastronarde, D. N. Software tools for automated transmission electron microscopy. Nature Methods. 16 (6), 471-477 (2019).
- Deng, Y., et al. Smart EPU: SPA getting intelligent. Microscopy and Microanalysis. 27 (1), 454-455 (2021).
- Carragher, B., et al. Leginon: An automated system for acquisition of images from vitreous ice specimens. Journal of Structural Biology. 132 (1), 33-45 (2000).
- Bell, J. M., Chen, M., Baldwin, P. R., Ludtke, S. J. High resolution single particle refinement in EMAN2.1. Methods. 100, 25-34 (2016).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. cryoSPARC: Algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. 14 (3), 290-296 (2017).
- Grant, T., Rohou, A., Grigorieff, N. cisTEM, user-friendly software for single-particle image processing. eLife. 7, 35383 (2018).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166 (2018).
- Kimanius, D., Dong, L., Sharov, G., Nakane, T., Scheres, S. H. W. New tools for automated cryo-EM single-particle analysis in RELION-4.0. Biochemical Journal. 478 (24), 4169-4185 (2021).
- Galaz-Montoya, J. G., Flanagan, J., Schmid, M. F., Ludtke, S. J. Single particle tomography in EMAN2. Journal of Structural Biology. 190 (3), 279-290 (2015).
- Bharat, T. A. M., Scheres, S. H. W. Resolving macromolecular structures from electron cryo-tomography data using subtomogram averaging in RELION. Nature protocols. 11 (11), 2054-2065 (2016).
- Himes, B. A., Zhang, P. emClarity: Software for high-resolution cryo-electron tomography and subtomogram averaging. Nature Methods. 15 (11), 955-961 (2018).
- Weissenberger, G., Henderikx, R. J. M., Peters, P. J. Understanding the invisible hands of sample preparation for cryo-EM. Nature Methods. 18 (5), 463-471 (2021).
- White, J. B. R., et al. Single particle cryo-electron microscopy: From sample to structure. Journal of Visualized Experiments. (171), e62415 (2021).
- Orlova, E. V., Saibil, H. R. Structural analysis of macromolecular assemblies by electron microscopy. Chemical Reviews. 111 (12), 7710-7748 (2011).
- Turk, M., Baumeister, W. The promise and the challenges of cryo-electron tomography. FEBS Letters. 594 (20), 3243-3261 (2020).
- Liu, Y. -. T., et al. Isotropic reconstruction of electron tomograms with deep learning. bioRxiv. , (2021).
- Briggs, J. A. G. Structural biology in situ-The potential of subtomogram averaging. Current Opinion in Structural Biology. 23 (2), 261-267 (2013).
- Grünewald, K., et al. Three-dimensional structure of herpes simplex virus from cryo-electron tomography. Science. 302 (5649), 1396-1398 (2003).
- Allegretti, M., et al. In-cell architecture of the nuclear pore and snapshots of its turnover. Nature. 586 (7831), 796-800 (2020).
- Wang, Z., et al. The molecular basis for sarcomere organization in vertebrate skeletal muscle. Cell. 184 (8), 2135-2150 (2021).
- Winey, M., Meehl, J. B., O'Toole, E. T., Giddings, T. H. Conventional transmission electron microscopy. Molecular Biology of the Cell. 25 (3), 319-323 (2014).
- Davies, K. M., et al. Macromolecular organization of ATP synthase and complex I in whole mitochondria. Proceedings of the National Academy of Sciences. 108 (34), 14121 (2011).
- Wagner, J., Schaffer, M., Fernández-Busnadiego, R. Cryo-electron tomography-The cell biology that came in from the cold. FEBS Letters. 591 (17), 2520-2533 (2017).
- Mahamid, J., et al. Visualizing the molecular sociology at the HeLa cell nuclear periphery. Science. 351 (6276), 969-972 (2016).
- Erdmann, P. S., et al. In situ cryo-electron tomography reveals gradient organization of ribosome biogenesis in intact nucleoli. Nature Communications. 12 (1), 5364 (2021).
- Tegunov, D., Xue, L., Dienemann, C., Cramer, P., Mahamid, J. Multi-particle cryo-EM refinement with M visualizes ribosome-antibiotic complex at 3.5 Å in cells. Nature Methods. 18 (2), 186-193 (2021).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152 (1), 36-51 (2005).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116 (1), 71-76 (1996).
- Heymann, J. B., Belnap, D. M. Bsoft: Image processing and molecular modeling for electron microscopy. Journal of Structural Biology. 157 (1), 3-18 (2007).
- Tang, G., et al. EMAN2: An extensible image processing suite for electron microscopy. Journal of Structural Biology. 157 (1), 38-46 (2007).
- Castaño-Díez, D., Kudryashev, M., Arheit, M., Stahlberg, H. Dynamo: A flexible, user-friendly development tool for subtomogram averaging of cryo-EM data in high-performance computing environments. Journal of Structural Biology. 178 (2), 139-151 (2012).
- Hrabe, T., et al. PyTom: A python-based toolbox for localization of macromolecules in cryo-electron tomograms and subtomogram analysis. Journal of Structural Biology. 178 (2), 177-188 (2012).
- Himes, B. A. emClarity. GitHub. , (2021).
- . The IMOD Home Page Available from: https://bio3d.colorado.edu/imod/ (2020)
- . GitHub: emClarity-tutorial Available from: https://github.com/ffyr2w/emClarity-tutorial (2021)
- Ni, T., et al. High-resolution in situ structure determination by cryo-electron tomography and subtomogram averaging using emClarity. Nature Protocols. 17 (2), 421-444 (2022).
- . MotionCor2 Available from: https://emcore.ucsf.edu/ucsf-software (2016)
- . Apoferritin from mouse at 1.84 angstrom resolution Available from: https://www.emdataresource.org/EMD-10101 (2022)
- Nedozralova, H., et al. In situ cryo-electron tomography reveals local cellular machineries for axon branch development. Journal of Cell Biology. 221 (4), 202106086 (2022).
- Mendonça, L., et al. Correlative multi-scale cryo-imaging unveils SARS-CoV-2 assembly and egress. Nature Communications. 12 (1), 4629 (2021).
- . Apoferritin from mouse at 1.84 angstrom resolution Available from: https://www.rcsb.org/structure/6s61 (2019)
- Nicastro, D., et al. The molecular architecture of axonemes revealed by cryoelectron tomography. Science. 313 (5789), 944-948 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados