Method Article
초저온 전자 단층 촬영 원격 데이터 수집 및 서브 단층 촬영 평균화
요약
본 프로토콜은 Tomo5를 사용한 고분해능 초저온 전자 단층 촬영 원격 데이터 수집과 emClarity를 사용한 후속 데이터 처리 및 서브 단층 촬영 평균화를 설명합니다. 아포페리틴은 2.86 Å 분해능에서 cryo-ET 구조를 달성하기 위한 자세한 단계별 프로세스를 설명하기 위한 예로 사용됩니다.
초록
초저온 전자 단층 촬영(cryo-ET)은 특히 직접 전자 검출기의 도입, 개선된 자동 획득 전략, 전자 현미경이 Cryo-ET를 사용하여 고해상도로 이미징할 수 있는 가능성을 확장하는 분취 기술 및 새로운 서브토모그램 평균화 소프트웨어의 도입 이후 최근 몇 년 동안 추진력을 얻고 있습니다. 또한 데이터 수집이 점점 간소화되어 많은 사용자가 더 쉽게 액세스할 수 있습니다. SARS-CoV-2 팬데믹은 전 세계 많은 시설에서 특히 단일 입자 Cryo-EM에 대한 원격 초저온 전자 현미경(Cryo-EM) 데이터 수집을 더욱 가속화하여 팬데믹 기간 동안 사용자가 최첨단 기기에 중단 없이 액세스할 수 있도록 했습니다. 최근 Tomo5(3D 전자 단층 촬영용 소프트웨어)의 발전으로 원격 cryo-ET 데이터 수집이 전 세계 어디에서나 강력하고 쉽게 취급할 수 있게 되었습니다. 이 문서는 자세한 문제 해결과 함께 (원격) cryo-ET 데이터 수집 세션 프로세스에 대한 단층 촬영 소프트웨어의 데이터 수집 설정부터 시작하여 자세한 연습을 제공하는 것을 목표로 합니다. (원격) 데이터 수집 프로토콜은 아포페리틴을 예로 사용하여 emClarity로 서브토모그램 평균화하여 거의 원자 분해능에서 구조 결정을 위한 워크플로로 더욱 보완됩니다.
서문
극저온 전자 현미경(Cryo-EM)은 르네상스 시대를 경험한 것으로 널리 알려져 있으며, 이를 가속화하여 구조 생물학에서 핵심적이고 중심적으로 유용한 도구가 되었습니다. 직접 전자 검출기 1,2,3의 개발 및 활용, 개선된 현미경 및 전자 소스 3,4,5, 자동화/처리량 개선 6,7,8,9, 단일 입자 분석의 계산 발전10,11,12,13 ,14 및 단층 촬영15,16,17은 모두 부분적으로 이 기술의 최근 성공에 책임이 있습니다. 이러한 기술적 동인은 극저온 및 기본 조건에서 생물학적 거대분자 구조를 해결할 수 있는 Cryo-EM의 기능을 개발했습니다. 쉽게 얻을 수있는 해상도는 원자 적으로 정확한 모델링에 충분하며이 기술을 구조 생물학 분야의 최전선에 가져 왔습니다. 관심 있는 생물학적 표적을 발현하고 정제하기 위한 환원주의적 접근 방식은 기초 생물학 연구, 약물 발견 및 중개 과학을 위한 고분자 결정학(MX)에서 오랫동안 성공적인 것으로 입증되었습니다. 동일한 접근 방식으로 Cryo-EM은 이제 고분해능 MX 연구와 유사한 결과를 제공할 수 있습니다. 구조 생물학의 Cryo-EM 분야에서 현재 주요 성공은 단일 입자 분석(SPA)이라고 하며, 이는 일반적으로 정제된 단백질 표본(18)의 2D 투영 이미지를 획득하여 생물학적 거대분자(19)의 수천 뷰를 얻습니다. 이러한 이미지에는 (1) 3D 공간에서 대상의 방향을 완전히 나타내는 다양한 보기의 정보가 포함되어 있으며 (2) 나중에 분리하고 조사할 수 있는 개체 구조적 이질성을 캡처합니다.
생물학적 샘플의 이러한 2D 투영 이미지를 획득하는 또 다른 방법은 현장에서 정제 없이 초저온 전자 단층 촬영(cryo-ET)입니다. Cryo-ET는 시편을 기계적으로 회전시켜 기울어진 각도로 동일한 물체의 일련의 이미지를 촬영합니다. 따라서, 관심 분자의 각도 포즈를 나타내는 SPA에서 수집된 2D 투영은 본질적으로 cryo-ET 이미징 실험(20)의 일부로서 수집된다. 그런 다음 단층 촬영 틸트 시리즈는 이미징 된 거대 분자 복합체의 3D 표현을 포함하는 단층 촬영으로 재구성됩니다. 단층 촬영 데이터 수집의 특성은 2D 이미지 모음에서 분자의 완전한 3D 표현을 달성하기 위해 평균화에 대한 의존도를 어느 정도 줄입니다. 그러나 현재 스테이지 설계로 인해 시편은 일반적으로 -60°에서 +60°로 기울어져 단층 촬영 3D 재구성에서 정보의 쐐기(21 )가 누락됩니다.
단일 단층 촬영의 3D 재구성은 정보의 쐐기가 누락되고 신호 대 잡음이 적습니다. 개별 거대분자는 서브 단층 촬영으로 추출되고 이를 해결하기 위해 함께 평균화될 수 있습니다. 서브 토모 그램의 각 거대 분자가 다른 방향에서 발견되는 경우, 누락 된 쐐기는 대상 물체의 각 서브 토모 그램에서 다르게 방향이 지정되므로 많은 사본에 대한 평균은 누락 된 쐐기로 인해 정보를 채 웁니다. 이미지 처리의 최근 발전은 또한 인공 지능 신경망을 훈련시켜 누락 된 쐐기를 의미있는 데이터22로 채우려고 시도했다. 이 평균화 프로세스는 또한 단일 입자 분석에서 평균화하는 목표와 유사하게 신호 대 잡음비를 증가시켜 재구성의 품질과 분해능을 향상시킵니다. 관심 분자가 대칭을 가지고 있다면, 그것도 평균화 중에 정의되고 사용되어 재구성 해상도를 더욱 향상시킬 수 있습니다. 단층 촬영에서 서브 토모 그램 세트로 거대 분자의 3D 부피를 추출하고 후속 처리하는 것을 서브 토모 그램 평균화 (STA) (STA)라고합니다.23. 각 서브 단층 촬영이 연구중인 분자의 고유 한 사본을 나타내는 경우, 구조적 이질성은 STA 워크 플로우를 사용하여 조사 될 수 있습니다. SPA 워크플로우에서 일반적으로 사용되는 바와 같이, STA 중에 분류 기술을 사용하여 관심 복합체의 구조적 상태를 분석할 수 있습니다. 이 접근 방식은 STA가 Cryo-ET에서 고분해능 재구성을 가능하게 할 뿐만 아니라 이 기술을 기본 세포 환경에서 거대분자의 구조적 메커니즘 또는 종종 SPA24,25,26에 적용할 수 없는 표적의 구조적 메커니즘을 조사하는 강력한 도구로 만듭니다.
전자 단층 촬영은 실온27에서 세포 표본의 3D 미세 구조를 결정하는 오랜 역사를 가지고 있습니다. 표본의 물리적 기울기에 의한 시야 획득은 세포 길이 척도에서 물체의 3D 재구성에 충분한 정보를 제공하며 세포 구조가 평균화를위한 규칙 성이 부족할 때 특히 중요합니다. 세포는 또한 표본이 전자가 투명할 만큼 충분히 얇은 세포 가장자리에서 Cryo-ET 이미징을 위해 기판 위에 동결될 수 있습니다. 이러한 조건 하에서, STA는 세포 환경에서 거대분자 구조를 결정하기 위해 사용될 수 있지만, 시편이 전자 투명(28)이 될 만큼 충분히 얇은 경우에도 마찬가지이다. 그러나, 극저온-상관광 및 전자 현미경(cryo-CLEM) 및 집속 이온 빔 밀링(cryo-FIB)을 포함하는 추가적인 분취 기술과 결합될 때, cryo-ET는 극저온 조건29 하에서 전체 세포 내부를 이미지화하는데 사용될 수 있다. 이것은 세포 미세 구조를 연구하는 Cryo-ET의 힘과 STA의 힘을 결합하여 현장에서 거대 분자 복합체의 구조를 결정하는 동시에 세포 위치30를 식별하고 동적 프로세스31에 관여하는 복합체의 스냅 샷을 제공합니다. 여러 연구에서 세포 표본을 이미지화하고 STA를 사용하는 이 기술의 능력은 SPA32에 필적하는 해상도에서도 현장에서 거대분자 구조를 해결하는 기술의 힘을 강조했습니다. 또 다른 이점은 단층 촬영(30)에서 최종적으로 분류된3D 재구성에 의해 표현되는 거대분자의 원래 위치에 대한 지식에서 발견된다. 따라서, 거대분자 구조는 세포 미세 구조와 상관 될 수있다. 길이 척도에 걸친 이러한 관찰은 아마도 구조적 메커니즘이 기능 연구의 맥락에서 세포 변화와 상관 될 수있는 중요한 발견으로 이어질 것입니다.
Cryo-ET 및 STA는 분자, 세포 및 라멜라 단층 촬영의 세 가지 주요 워크플로우에서 데이터 수집을 허용합니다. 정제된 거대분자 복합체의 구조는 분자 단층촬영에 의한 cryo-ET에 의해 결정될 수 있다. 세포가 충분히 얇은 세포 환경에서 단백질 구조를 결정하는 것은 세포 단층 촬영으로 설명 될 수 있습니다. 최근에는 극저온 표적화 및 밀링의 개발과 함께 이러한 동일한 기술을 라멜라 단층 촬영 워크 플로우에 적용하여 고유 환경에서 세포 내부의 깊은 단백질 구조를 결정하면서 이러한 단백질이 관찰되는 세포 맥락을 밝힐 수 있습니다. 사용 가능한 소프트웨어 패키지에 따라 다양한 데이터 수집 전략을 사용할 수 있으며, 가장 중요한 것은 표본의 요구 사항에 따라 사용할 수 있습니다. 정제된 단백질의 구리 TEM 그리드에 있는 분자 또는 비부착성 샘플은 일반적으로 취급이 덜 필요하므로 이상적인 경우 평평하고 손상되지 않은 상태로 유지됩니다. 전자 단층 촬영은 구멍이 뚫린 탄소 그리드를 가로질러 직렬로 쉽게 설정하여 체계적인 방식으로 수십에서 수백 개의 단층 촬영을 빠르게 획득할 수 있습니다. 사용자가 그리드에 단백질이 풍부하게 존재하는 분자 단층 촬영 샘플을 설정하는 가장 간단한 방법은 Tomo5 (본 연구에서 사용되는 3D 전자 단층 촬영 용 소프트웨어, 재료 표 참조)를 사용하는 것입니다. Leginon9 및 serialEM6과 같은 다른 단층 촬영 소프트웨어도 사용할 수 있습니다. 데이터 수집을 위한 보다 개인화된 접근 방식을 위해 더 많은 설정 옵션을 제공하지만 더 복잡하고 결과적으로 특히 단층 촬영을 처음 접하는 사용자와 원격으로 세션에 액세스하는 사용자의 경우 탐색하기가 더 어려울 수 있습니다. 크고 다양한 사용자 기반을 가진 시설의 경우 Tomo5는 원격 환경에서 쉽게 작동하고 사용자를 교육할 수 있습니다. 부착 세포의 경우 그리드는 일반적으로 더 많은 처리 단계가 필요하며 깨지기 쉬운 금 그리드를 사용해야 할 필요성으로 인해 처리 및 데이터 수집 전략에서 개선된 관리의 필요성이 증가합니다. 관심 있는 셀룰러 영역을 쉽게 찾고 높은 기울기 각도에서 그리드 자체의 폐색을 방지하려면 더 큰 메쉬 크기를 사용하는 것도 유리하지만 본질적으로 더 취약한 대가를 치르게 됩니다. 라멜라 샘플의 경우, 샘플의 취약성은 라멜라의 품질에 의해 결정되며, 이는 가변적 일 수 있습니다. 이러한 요인으로 인해 설정 시간과 고려 사항이 증가하지만 적응성과 견고성이 향상되어 Tomo5가 이러한 유형의 데이터 수집에 적합합니다. 그러나 각 워크플로에 대해 특수한 데이터 수집 시나리오가 있습니다. BISECT 및 PACE-tomo (둘 다 SerialEM에서 실행)는 단층 촬영 획득 중에 스크립팅 된 빔 이미지 이동의 가능성을 도입하여 특히 분자 단층 촬영에서 단층 촬영 수집 속도28을 증가시킵니다. SerialEM 6,7,33의 중간 배율 몽타주(MMM)는 모든 워크플로우에서 분자 특징을 더 잘 식별하고 정확하게 타겟팅할 수 있지만, 작성 당시에는 이러한 특징이 Tomo5에서 구현되기 시작했습니다.
SPA와 마찬가지로 cryo-ET 및 STA는 획득 소프트웨어의 개선 사항과 평균 16,17,32,34,35,36,37,38의 서브 토모그램에 사용할 수 있는 풍부한 패키지를 통해 점점 더 쉽게 액세스할 수 있게 되었습니다. 또한 팬데믹 기간 동안 Cryo-EM 기기에 대한 원격 액세스를 가능하게 하는 것은 영국 다이아몬드 광원(DLS)에 있는 전자 바이오 이미징 센터(eBIC)와 같은 국가 시설의 지속적인 운영에 필수적이 되었습니다. 이러한 개발로 인해 Cryo-ET는 이 기술을 활용하고자 하는 연구자들이 더 쉽게 접근할 수 있고 견고해졌습니다. 데이터가 수집되면 STA는 최대 분해능 재구성을 얻고 고분자 이질성을 분류할 수 있도록 반복 물체를 분석하는 데 필수적인 도구입니다. 현재 프로토콜은 Cryo-ET 데이터 수집을 위한 Cryo-TEM 현미경을 준비하는 방법과 예를 들어 아포페리틴의 분자 단층 촬영 데이터 세트에서 emClarity를 사용하여 서브 단층 촬영 평균화를 수행하는 방법에 대한 자세한 연습을 제공하는 것을 목표로 합니다. emClarity(고해상도 초저온 전자 단층 촬영 및 서브 단층 촬영 평균화용 소프트웨어, 재료 표 참조)를 사용하려면 명령줄에서 스크립트를 실행해야 하므로 Linux/UNIX 시스템에 어느 정도 익숙하다고 가정합니다.
원격 연결은 각 기관/시설의 네트워크 환경에 따라 다릅니다. eBIC에서 원격 시스템은 Diamond에서 사용되는 특정 네트워크 구성에서 원격 데이터 수집을 허용하는 프로그램을 사용합니다. 현미경에 대한 원격 연결은 NoMachine과 TeamViewer의 두 가지 플랫폼에 의해 촉진됩니다( 재료 표 참조). NoMachine 프로그램을 사용하여 사용자는 원격 Windows 데스크톱에 로그온 할 수 있습니다. NoMachine에서 제공하는 원격 Windows 데스크톱은 현미경과 동일한 네트워크에 상주하므로 현미경에 대한 가상 지원 PC 역할을 합니다. 가상 지원 PC에서 사용자는 TeamViewer를 통해 현미경에 연결하여 TUI 및 Tomo를 실행하는 현미경 PC에 직접 액세스하고 제어할 수 있습니다.
본 프로토콜은 두 부분으로 구성됩니다(단계 1 및 단계 2). 1단계는 Tomo5(3D 전자 단층 촬영용 소프트웨어)를 사용한 원격 cryo-ET 데이터 수집에 중점을 둡니다. (원격) 세션에 대한 연습은 점점 더 높은 배율로 이미지를 캡처하여 궁극적으로 사용자가 단층 촬영 소프트웨어를 단층 촬영 데이터 수집을 위한 표본 영역을 대상으로 하도록 지시할 수 있도록 합니다. 그림 1 에는 이 프로세스가 요약되어 있습니다. 2단계에서는 emClarity(고분해능 초저온 전자 단층 촬영 및 서브 단층 촬영 평균화를 위한 소프트웨어)를 사용한 cryo-ET STA 데이터 처리에 대해 자세히 설명합니다. 그림 9 에는 이 프로세스가 요약되어 있습니다.
이 프로토콜은 원격 사용자를 위한 것입니다. 사람이 물리적으로 현미경을 보고 샘플을 로드하면 직접 정렬을 수행하고 카메라 튜닝 및 게인 참조 획득을 처리했다고 가정합니다. 이 프로토콜의 경우 자동 로더가있는 3 응축기 렌즈 시스템이 가정합니다. 단층 촬영 소프트웨어에 대한 자세한 지침은 소프트웨어가 로드된 Windows 시작 단추에서 제조업체의 자세한 설명서를 사용할 수 있습니다.
프로토콜
이 연구에 사용 된 소프트웨어 패키지는 부분적으로 무료로 사용할 수 있습니다 ( 재료 표 참조).
1. Tomo5를 이용한 원격 극저온 ET 데이터 수집
- 소프트웨어가 로드되지 않은 경우 TEM 서버 PC에서 이 소프트웨어를 시작하여 시작하십시오( 재료 표 참조).
- 초기 점검을 수행하고 Presets(사전 설정)를 선택하여 이미징 조건을 구성합니다.
- 사전 설정의 "준비" 탭에서 이미지 수집 파라미터를 조정하여 세션 설정을 시작합니다(그림 2A,B).
- 그리드 사각형 크기와 선량에 맞게 "개요 배율"을 조정하여 적절한 카운트를 얻으십시오.
참고: 그리드 유형에 적합한 배율을 알 수 없는 경우 그리드를 로드한 후 이 단계로 돌아갑니다. - "유센트릭 높이"와 "검색 배율"은 동일할 수 있습니다. "단층 촬영" 탭에서 검색을 클릭하여 위치를 설정하고 배율이 관심 있는 특징을 표시하고 시야의 "노출" 및 "추적/초점" 영역에 맞는지 확인합니다(그림 2C).
- "노출 배율"을 원하는 대상 픽셀 크기로 설정합니다. 이것이 알려지지 않은 경우 관심 영역에 맞게 원하는 시야로 배율을 조정하여 설정하십시오.
- 그리드 사각형 크기와 선량에 맞게 "개요 배율"을 조정하여 적절한 카운트를 얻으십시오.
- 이미지 획득(노출) 매개변수를 다른 모든 고배율 사전 설정(추적, 드리프트, 초점, 톤 링, 제로 손실 등)에 복사합니다. 이렇게 하려면 설정을 눌러 현미경에 "노출"을 설정하고 Get 을 눌러 개별적으로 선택한 후 다른 모든 고배율에 대한 "노출 설정"을 가져옵니다.
- 노출 시간, 특히 "초점"및 "추적"에 대한 적절한 카운트를 제공하기 위해 적절한 수의 카운트를 제공하고 60 °의 두께, 즉 0 °와 60 ° 모두를 고려하여 충분한 전자가 샘플을 통과하여 상호 상관에 대한 강력한 신호를 제공합니다.
참고: 추정치로 "노출" 사전 설정과 동일한 "추적" 및 "초점"의 노출 시간이 좋은 첫 번째 측정입니다. "노출" 사전 설정에 대한 선량 계산 예는 그림 3을 참조하십시오. "준비" 탭에서 "노출" 사전 설정에 대해 계산된 노출 시간을 설정합니다.
- 노출 시간, 특히 "초점"및 "추적"에 대한 적절한 카운트를 제공하기 위해 적절한 수의 카운트를 제공하고 60 °의 두께, 즉 0 °와 60 ° 모두를 고려하여 충분한 전자가 샘플을 통과하여 상호 상관에 대한 강력한 신호를 제공합니다.
- 더 높은 용량이 필요하므로 더 밝고 더 큰 스폿 크기를 사용하도록 "제로 손실 사전 설정"을 조정하십시오(더 큰 스폿 크기는 더 작은 숫자에 해당).
참고: 이 사전 설정은 현미경에 있는 경우 에너지 필터의 슬릿을 정렬하는 데 가장 적합합니다.
- 사전 설정의 "준비" 탭에서 이미지 수집 파라미터를 조정하여 세션 설정을 시작합니다(그림 2A,B).
- 아래 단계에 따라 아틀라스 수집을 수행하십시오.
- 아틀라스를 수집하려면 "Atlas"탭에서 새 세션을 클릭하고 세션 기본 설정을 지정하고 저장 경로와 출력 형식을 입력 한 다음 적용을 누릅니다. 스크리닝 (그림 4)을 선택한 다음 획득할 모든 지도책을 선택합니다. 콜 밸브 닫기를 선택하여 현미경을 감독되지 않은 상태로 둡니다. 이렇게 하면 선택한 모든 지도책이 수집된 후 컬럼 밸브가 닫힙니다. 스크리닝을 시작하려면 시작 버튼을 누릅니다.
- 왼쪽 패널의 "Screening"(그림 4) 아래에 있는 그리드를 클릭하여 대상에 대한 단일 또는 다중 지도책을 검사한 다음 마우스 왼쪽 단추를 클릭하고 마우스를 끌어 이동하고 가운데 스크롤하여 확대 및 축소합니다. 대상 설정을 위해 그리드를 선택하고 선택한 다음 소프트웨어 내부에서 샘플 로드를 클릭합니다.
- 이미지 이동 보정의 경우 아틀라스 스크리닝 탭을 계속 사용하여 로드된 그리드 내에서 탐색합니다. 모든 배율 사전 설정에서 인식할 수 있는 식별 가능한 특징, 즉 구멍의 가장자리와 겹치는 얼음 결정 또는 다른 인식 가능한 형상을 찾습니다(그림 5). 마우스 오른쪽 버튼을 클릭하여 해당 사각형으로 이동 한 다음 "그리드 사각형으로 단계 이동".
참고: 스테이지는 이미지 이동 보정을 올바르게 구현하기 위해 유센트릭 높이에 있어야 합니다.
- 이미지 이동 보정을 수행합니다.
- "자동 기능" 탭(그림 6)에서 사전 설정을 "Eucentric Height"로 설정하고 "스테이지 기울기에 의한 자동 Eucent"로 이동한 다음 Start를 누릅니다. 상태 창을 모니터링하여 유센트릭 높이를 찾는 데 성공했는지 확인하고 포지티브 및 네거티브 기울기 이미지를 주시하십시오. 그들은 상관 관계가 있어야합니다.
참고: Tomo 소프트웨어 버전 5.8부터 유심 높이 수용 기준을 수정할 수 있습니다. 기본값은 0.25μm이며 0.5-0.8μm로 설정하면 더 많은 여유가 있습니다. 값은 현미경 성능에 따라 다르지만 가능한 한 작게 유지하는 것이 좋습니다.- 유센트릭 높이에 있고 초점이 맞춰지면 스테이지를 피처의 중앙에 배치합니다. "Atlas" 사전 설정을 사용하여 미리 보기를 수집합니다. "준비"탭에서 모든 "사전 설정"을 설정하십시오. 그런 다음 미리보기 > 개요 > 중앙 기능으로 확대를 늘린 다음 "검색 배율"을 반복하고 마지막으로 "노출 배율"을 반복합니다.
- 타겟팅 중에 피처가 중앙에 유지된 경우 이미지 이동 보정을 건너뜁니다. 그렇지 않고 이미지 시프트를 보정하려면 "준비" 탭으로 이동하여 이미지 시프트 보정을 선택하고 Start(시작 키)를 누릅니다(그림 5). 이렇게 하면 낮은 배율이 노출 배율을 중심으로 하는 피처에 반복적으로 정렬됩니다.
알림: 초기 사전 설정 "노출"이 이 단계에서 중앙에 있지 않은 경우 다시 중앙을 맞추기 위해 소프트웨어는 이 단계에만 스테이지 시프트를 사용합니다.- "노출" 사전 설정에 대해 진행을 누릅니다. 표시된 다음 이미지는 "검색 사전 설정"입니다. 사전 설정 간의 이미지 이동을 보정하려면 "검색" 미리 보기에서 "노출" 미리 보기의 중심이 있는 위치를 두 번 마우스 왼쪽 버튼으로 클릭한 다음 Re-Gather 를 누릅니다(그림 5). 진행 을 클릭하여 다음 사전 설정 쌍으로 이동합니다.
참고: 이 보정 중에 아틀라스 배율에서 이미지 이동이 적용된 경우 이미지 이동 보정이 완료된 후 아틀라스를 다시 획득해야 합니다. 원하는 아틀라스를 선택하고 "아틀라스"탭의 상단 패널에서 선택됨 재설정 을 누릅니다. 해당 아틀라스를 확인하고 다시 획득하십시오.
- "노출" 사전 설정에 대해 진행을 누릅니다. 표시된 다음 이미지는 "검색 사전 설정"입니다. 사전 설정 간의 이미지 이동을 보정하려면 "검색" 미리 보기에서 "노출" 미리 보기의 중심이 있는 위치를 두 번 마우스 왼쪽 버튼으로 클릭한 다음 Re-Gather 를 누릅니다(그림 5). 진행 을 클릭하여 다음 사전 설정 쌍으로 이동합니다.
- "자동 기능" 탭(그림 6)에서 사전 설정을 "Eucentric Height"로 설정하고 "스테이지 기울기에 의한 자동 Eucent"로 이동한 다음 Start를 누릅니다. 상태 창을 모니터링하여 유센트릭 높이를 찾는 데 성공했는지 확인하고 포지티브 및 네거티브 기울기 이미지를 주시하십시오. 그들은 상관 관계가 있어야합니다.
- 단층 촬영 설정을 수행하십시오.
- "단층 촬영" 탭에서 단층 촬영 데이터 수집 설정을 만듭니다.
참고: 특별히 언급되지 않는 한, 설정은 전적으로 "단층 촬영" 탭에서 수행됩니다. - 새 세션을 시작합니다. 생물학적 샘플에 대한 "세션 설정"에서 샘플 유형으로 슬래브 모양을 선택하고 배치 및 저용량을 선택하고 출력 형식 및 저장 폴더를 선택하고 선택적으로 이메일 수신자를 추가한 다음 적용을 누릅니다.
참고: 이제 "배치 위치" 메뉴 항목을 사용할 수 있게 되었습니다(그림 7A). 현재 로드된 아틀라스를 자동으로 가져옵니다. "개요" 및 "검색 이미지"는 새로운 이미지가 획득될 때까지 획득되고 재검토될 수 있다. 또한 버전 5.8부터 "검색 맵 획득"을 사용하여 3 x 3, 4 x 4 및 5 x 5 타일의 검색 맵을 획득하여 대상을 쉽게 찾고 설정할 수 있습니다. 그것들은 중간 배율 몽타주의 버전에 해당합니다. - 대상을 설정하려면 "Atlas 화살표"로 이동하여 관심 영역을 찾은 다음 마우스 오른쪽 버튼을 클릭하여 팝업되는 옵션을 선택하여 이동하십시오. 개요 이미지를 찍어 유센트릭 높이 조정을 위한 좋은 위치를 확인한 다음 Auto Eucentric을 누릅니다. 이것은 유센트릭 바이 스테이지 틸트 루틴을 실행합니다. 그런 다음 새 개요 이미지를 다시 획득하여 유센트릭 높이를 업데이트합니다.
알림: 위치가 유센트릭 높이에 있는 경우 "자동 초점" 버튼이 필요하지 않습니다. 유심 높이 이미지의 초점이 너무 흐트러진 경우 유심 높이가 올바르지 않을 수 있으므로 다시 실행해야 합니다(유심 높이 문제 해결은 토론 섹션 참조). - 첫 번째 위치를 설정하기 전에 "개요" 사전 설정을 사용하여 대상을 확인하십시오. "Overview" 사전 설정을 선택하고 스테이지를 ±60°로 기울여 그리드 막대에서 위치를 설정할 수 있는 거리를 확인합니다(그림 8). "Set Tilt(기울기 설정)" 창에 원하는 기울기 각도 값을 입력하여 이 작업을 수행합니다(그림 8A).
- 사각형 "개요" 또는 획득한 "검색 맵"을 검사하고 관심 영역으로 이동한 다음 검색 획득을 누릅니다. "검색" 이미지를 검사합니다. 관심 영역이 중앙에 있지 않으면 원하는 위치를 마우스 오른쪽 버튼으로 클릭한 다음 여기로 스테이지 이동 및 이미지 획득을 반복합니다. 기울기(°)를 0.00(또는 스테이지에서 처리할 수 있는 다른 시작 각도)으로 설정하여 단층 촬영의 시작 각도를 정의합니다.
- 첫 번째 단층 촬영의 경우 원하는 단층 촬영 명명 규칙의 이름을 입력하고 각 단층 촬영에 대해 원하는 초점 흐림 값을 설정하려면 초점 흐림 해제를 입력합니다.
- 선택적으로 Tomo 버전 5.8부터는 디 포커스 값을 한 번에 체계적으로 변경할 수 있습니다. 이를 위해 위치 선택을 클릭하고 변경할 위치를 선택하거나 확인 표시를 선택하여 모든 위치를 선택한 다음 디포커스 업데이트를 클릭하고 매개변수를 조정합니다(그림 7A).
- "초점" 및 "추적" 영역을 조정합니다(그림 2C). 마우스 왼쪽 버튼을 클릭하여 추적 및 초점 영역(노란색 및 파란색 원)을 끕니다. 추적/초점 영역이 (대부분) 탄소 또는 다른 적절한 추적 기능, 즉 관심 영역과 유사한 기능에 있는지 확인합니다. 균열, 얼음 오염, 지나치게 두꺼운 지역 및 빈 구멍을 피하십시오.
- 많은 추적 기능이없는 블랭크 카본을 선택할 때, 초점을 맞추기에 충분한 높은 선량을 선택하고 더 높은 기울기에서 샘플을 천천히 태우도록 추적하여 단층 촬영의 중간에 영역이 연소되기 시작하는지 확인하십시오. 이는 추적 정확도를 유지하는 데 도움이 될 수 있습니다. 추적/초점 영역이 이후 획득 영역에 노출되지 않도록 합니다.
알림: 가까운 것과 빔으로 들어오는 것에주의하십시오. 그리드 막대를 포함하여 추적 및/또는 노출에 개입할 수 있는 기능이 있는 영역은 피하십시오.
- 많은 추적 기능이없는 블랭크 카본을 선택할 때, 초점을 맞추기에 충분한 높은 선량을 선택하고 더 높은 기울기에서 샘플을 천천히 태우도록 추적하여 단층 촬영의 중간에 영역이 연소되기 시작하는지 확인하십시오. 이는 추적 정확도를 유지하는 데 도움이 될 수 있습니다. 추적/초점 영역이 이후 획득 영역에 노출되지 않도록 합니다.
- 모든 매개변수가 설정되고 원하는 관심 영역과 "초점" 및 "추적"이 정의되면 위치 추가를 누릅니다. 새 대상에 대해 반복합니다.
알림: 설정된 배치 위치에 대해 유센트릭 높이가 올바르게 보정되었는지 확인하려면 몇 가지 사용 가능한 전략이 있습니다. 수행되는 단층 촬영 세션의 유형 (분자, 세포, 라멜라)에 따라 하나를 선택하는 것이 좋습니다. - 분자 단층 촬영의 경우 그리드가 상당히 평평하고 목표 위치를 포함하는 각 사각형의 중앙에서 유심 높이가 수행되었다고 가정하면 "모두 다듬기"(또는 위치가 선택된 경우 선택 구체화, 그림 7A) 절차를 건너뜁니다. Tomo가 스테이지 틸트 루틴에 의한 자동 유센트릭 루틴에 어려움을 겪고 있다면 Eucentric 건너뛰기를 클릭할 수 있습니다.
- 셀룰러 또는 라멜라 샘플의 경우 각 배치 위치는 다른 z 높이에있을 수 있습니다. "모두 다듬기"를 사용하여 주의하거나 "유센트릭 건너뛰기" 옵션을 선택하지 마십시오.
참고: "모두 수정"은 "위치 선택"을 통해 설정되거나 선택된 모든 단층 촬영을 반복합니다. Eucentric 높이를 구체화하고 데이터 수집 전에 추적 및 초점을 수행합니다. 이 절차는 다음 단층 촬영 초점/추적 영역(그림 7B)에서 겹치는 노출을 노출할 수 있으며, 계속하기 전에 고려해야 합니다. - 개선에 실패한 사각형을 확인하고 다시 방문하십시오. 마우스 오른쪽 버튼으로 실패한 위치를 클릭하여 옵션을 확인합니다. 유센트릭 높이가 실패하면 "스테이지 틸트에 의한 자동 유센트릭"(1.4.1단계)을 찾고 새 "검색" 이미지를 획득하여 z-높이를 업데이트하고 "위치 추가"를 찾습니다. 실패한/이전에 초기화된 위치를 삭제합니다. "모두 다듬기"로 완료된 Eucentric 건너 뛰 기 옵션을 클릭하십시오.
참고: "모두 구체화"가 실행되지 않으면 "유센트릭 건너뛰기"를 선택하지 않아야 합니다. Tomo5는 각 단층 촬영을 획득하기 전에 유심 개선을 실행합니다. 이런 식으로 유심 개선에 실패한 위치는 건너 뜁니다.
- 셀룰러 또는 라멜라 샘플의 경우 각 배치 위치는 다른 z 높이에있을 수 있습니다. "모두 다듬기"를 사용하여 주의하거나 "유센트릭 건너뛰기" 옵션을 선택하지 마십시오.
- "단층 촬영" 탭에서 단층 촬영 데이터 수집 설정을 만듭니다.
- 아래 단계에 따라 자동 기능을 수행하십시오.
- 아틀라스에서 탄소 영역으로 이동하여 "자동 기능"탭을 통해 정렬을 수행하는 설정을 확인하십시오. 해당 영역을 유심 높이로 가져오고 아래에 명시된 정렬 순서를 따르십시오.
- "Eucentric Height" 사전 설정으로 스테이지 기울기로 자동 Eucentric 을 실행합니다.
- "초점" 사전 설정으로 자동 초점 루틴 을 실행합니다.
- "Thon Ring" 사전 설정으로 자동 낙인 찍기 루틴을 실행합니다.
- "Thon Ring" 사전 설정으로 Autocoma 루틴을 실행합니다.
- 원하는 대물 조리개(그림 6B)를 삽입하여 100μm 조리개를 삽입하여 샘플 대비를 높이고 매우 높은 분해능에서 신호를 약간 차단하는 좋은 절충안입니다.
- 조리개 삽입 후 자동 낙인 찍기 루틴을 반복합니다.
참고: 픽셀 크기가 약 3Å 이하인 배율에서는 Autocoma 루틴이 실패할 수 있습니다. 이 경우 TEM 사용자 인터페이스의 직접 정렬 아래에서 Tomo 회전 중심 을 확인하고 정렬 합니다.
- 샘플에서 자동 제로 손실 센터링 루틴이 작동하는지 확인하십시오. 합리적으로 높은 선량(1.2.3단계)으로 "제로 손실" 사전 설정을 사용하면 자동 기능의 루틴이 성공할 가능성이 더 큽니다.
- 아틀라스에서 탄소 영역으로 이동하여 "자동 기능"탭을 통해 정렬을 수행하는 설정을 확인하십시오. 해당 영역을 유심 높이로 가져오고 아래에 명시된 정렬 순서를 따르십시오.
- 데이터 수집을 수행합니다.
- "단층 촬영" 탭에서 자동 수집을 시작하려면 데이터 수집 슬래브아웃을 선택하고 원하는 파라미터를 설정합니다(그림 7C). 데이터 수집 파라미터 설정: 틸트 단계(°), 최대 포지티브 각도(°), 최대 네거티브 각도(°), 추적 방식(권장: 획득 전 트랙/초점 선택). 유센트릭 높이 구성표를 위해 컬럼 밸브 닫기를 선택합니다.
알림: 거의 사용되지 않는 매개 변수는 "노출 시간 조정", "ZLP 조정", "위상 판 사용"및 "기울기 후 일시 중지"입니다.- STA용이 아닌 단층 촬영에 노출 시간 조정을 사용하여 높은 기울기에서 지정된 비율로 노출 시간을 늘립니다.
- ZLP 조정 옵션은 주기성 설정에 관계없이 각 단층 촬영 후에 ZLP 미세 조정을 실행합니다. 느리고 때로는 명백한 이유없이 실패하며 해당 위치 획득을 건너 뜁니다. 그러나 매우 좁은 슬릿 폭, 즉 Selectris(X) 필터에서 3-5eV에 유용할 수 있습니다.
- 위상 플레이트 사용은 에너지 필터가있는 DED가 도입 된 이후로 거의 사용되지 않습니다.
- 틸트 후 일시 중지는 획득을 일시 중지하지만 소프트웨어 변경을 허용하지 않습니다.
- 데이터 수집 매개 변수 ( "준비"탭)를 다시 확인하고, 선량 계산 및 원하는 기울기 계획에 동의하고, "노출"사전 설정에서 분획 수 (Nr .)를 지정한 다음 수집을 시작하십시오.
참고: 분획 수는 샘플, 획득 매개변수 및 계획된 후처리 단계(예: STA 대 형태학적 분석)에 따라 달라지며 동작 보정 및 CTF 추정이 충분한 신호를 얻는 값으로 유지되어야 합니다. 4-10 분획의 범위는 좋은 추정치이며, 여기서 4는 두꺼운 샘플에 더 적합하고 10은 더 얇은 분자 샘플에 더 적합합니다.- 그런 다음 시작을 클릭하여 데이터 수집을 시작하고 첫 번째 단층 촬영 수집을 모니터링하여 단층 촬영이 의도한 대로 획득되었는지 확인합니다.
참고: 최신 단층 촬영 소프트웨어 버전에는 획득한 단층 촬영을 볼 수 있는 "단층 촬영" 탭에 추가 무비 플레이어 슬래브 아웃이 있습니다. 적재 과정에서 인내심을 가지십시오.
- 그런 다음 시작을 클릭하여 데이터 수집을 시작하고 첫 번째 단층 촬영 수집을 모니터링하여 단층 촬영이 의도한 대로 획득되었는지 확인합니다.
- "단층 촬영" 탭에서 자동 수집을 시작하려면 데이터 수집 슬래브아웃을 선택하고 원하는 파라미터를 설정합니다(그림 7C). 데이터 수집 파라미터 설정: 틸트 단계(°), 최대 포지티브 각도(°), 최대 네거티브 각도(°), 추적 방식(권장: 획득 전 트랙/초점 선택). 유센트릭 높이 구성표를 위해 컬럼 밸브 닫기를 선택합니다.
2. 엠클래리티를 이용한 아포페리틴의 Cryo-ET STA
참고: 여기서, emClarity 소프트웨어(17 )는 STA에 의한 cryo-ET 구조 결정을 설명하기 위해 사용된다. 도 9 는 이 프로세스를 요약한다. 아포페리틴의 6개의 틸트 시리즈(EMPIAR-10787)를 예로 들었습니다. 팔면체 대칭이 적용되었고 최종 지도의 해상도는 2.86Å로 4,800개의 입자에서 얻었고 나이퀴스트 주파수(2.68Å)에 가깝습니다.
- emClarity 소프트웨어 패키지39 가 다운로드 및 설치되었는지 확인합니다( 재료 표 참조). 소프트웨어 처리를 위한 IMOD를 설치합니다40.
참고: Linux 명령에 대한 기본 지식이 필요합니다. 더 자세한 튜토리얼은 리보솜 데이터 세트(EMPIAR-10304)를 예로 들어 단계별 절차를 설명하는 참조41에서 찾을 수 있습니다. 상이한 유형의 단백질 샘플에 대해, 이전에 공개된 보고서가 또한 이용가능하다(42). - 입력 파일 및 디렉터리를 준비합니다.
참고: 원시 프레임은 MotionCor2(패치 5 x 5)43 에 의해 모션 보정되었습니다( 재료 표 참조). 모션 보정 된 이미지를 쌓아 newstack (IMOD)을 사용하여 틸트 시리즈를 생성하고 Etomo ( 재료 표 참조)를 사용하여 패치 추적으로 수동으로 정렬 한 다음 emClarity를 사용했습니다. 더 나은 정렬을 얻으려면 Etomo에서 오프셋 및 기울기 보정을 수행하는 것이 좋습니다. 6 틸트 시리즈는 TS1에서 TS6으로 이름이 변경되었습니다. 다음은 첫 번째 틸트 시리즈(TS1)에 대한 지침과 명령입니다.- 프로젝트 폴더를 설정합니다.
참고: 소프트웨어의 최신 버전은 1.5.3.11입니다. 모든 관련 소프트웨어 로그는 로컬 프로젝트 폴더(.../logFile/emClarity.logfile)에서 찾을 수 있습니다. - 프로젝트 폴더 아래에 또 다른 새 폴더인 "fixedStacks"를 만들고 입력 파일인 TS1.fixed, TS1.xf 및 TS1.tlt를 준비합니다.
참고: TS1.fixed: Etomo에서 TS1.st 라고도 하는 원래 틸트 시리즈입니다. TS1.xf: 이 파일에는 Etomo 기울기 정렬 후의 변환 좌표가 포함되어 있습니다. TS1.tlt: 이 파일에는 틸트 각도가 포함되어 있습니다.
- 프로젝트 폴더를 설정합니다.
- 아래 단계에 따라 디포커스를 추정합니다.
- 디 포커스를 계산하십시오. 보충 표 1에 따라 현미경 및 이미징 매개변수로 매개변수 파일을 업데이트합니다. 매개 변수 파일을 프로젝트 폴더에 복사하고 이름을 param_ctf.m으로 변경한 다음 emClarity ctf 추정 param_ctf.m TS1을 실행합니다.
참고: 매개 변수 파일 템플릿은 보조 파일 1 또는 로컬 소프트웨어 설치 디렉터리(.../emClarity_1.5.3.11/docs/exampleParametersAndRunScript/)에서 찾을 수 있습니다.
- 디 포커스를 계산하십시오. 보충 표 1에 따라 현미경 및 이미징 매개변수로 매개변수 파일을 업데이트합니다. 매개 변수 파일을 프로젝트 폴더에 복사하고 이름을 param_ctf.m으로 변경한 다음 emClarity ctf 추정 param_ctf.m TS1을 실행합니다.
- 각 스택에 대한 CTF 추정 결과를 확인합니다.
- 3dmod를 사용하여 정렬된 스택(예: aliStacks/TS1_ali1.fixed)을 확인하고 기준 비드가 올바르게 지워졌는지 확인합니다.
- 로그 파일이 로그 파일/emClarity.logfile에서 찾을 수 있는 손잡이가 올바른지 보고하는지 확인합니다(그림 9).
- 디포커스 값(예: fixedStacks/ctf/TS_ali1_psRadial_1.pdf)을 확인하고 이론적인 CTF 추정치와 일치하는지 확인합니다.
- 하위 영역을 정의합니다.
- 비닝된 단층 촬영을 생성합니다. 프로젝트 폴더에서 sh recScript2.sh -1을 실행합니다.
참고: 각 스택에 대해 더 작은(크기) 단층 촬영은 새 폴더 "bin10"에 저장됩니다. 프로세스 속도를 높이기 위해 하나 또는 여러 하위 영역의 좌표를 bin10 단층 촬영으로 정의할 수 있습니다. 스크립트 파일은 로컬 소프트웨어 설치 디렉토리(.../emClarity_1.5.3.11/docs/)에 있습니다. - 하나의 하위 영역을 만들기 위해 xmin, x max, y min, y max, zmin 및 z max의 6개 점을 선택하여 경계를 결정합니다. "bin10"폴더에서 3dmod TS1_bin10.rec를 실행하십시오.
참고: 하나의 틸트 시리즈에 4개의 하위 영역을 만들려면 6 × 4 = 24포인트를 선택합니다. 각 스택에는 "bin10" 폴더 아래에 하나의 모델 파일(*.mod)이 있어야 합니다. - 모델 파일을 emClarity 형식으로 변환합니다. 그러면 새 폴더 정찰이 생성됩니다. 이 폴더 아래에 각 하위 영역의 모든 좌표를 저장합니다. 프로젝트 폴더에서 sh recScript2.sh TS1을 실행합니다.
- 비닝된 단층 촬영을 생성합니다. 프로젝트 폴더에서 sh recScript2.sh -1을 실행합니다.
- 입자를 선택합니다.
- 입자 채취를 위한 아포페리틴 템플릿을 찾으십시오. 전자 현미경 데이터 뱅크(EMD-10101)44에서 템플릿을 다운로드합니다. 템플릿의 픽셀 크기가 원시 데이터의 픽셀 크기와 일치하는지 확인합니다. 프로젝트 폴더에서 다음을 실행합니다. emClarity rescale ApoF.mrc ApoF_Template_rescale.mrc 3.60 1.34 cpu.
- 입자 피킹을 위해 CTF 보정 단층 촬영을 생성합니다. 프로젝트 폴더에서 emClarity ctf 3d param_ts.m templateSearch를 실행합니다.
- 각 하위 영역에 대해 입자 선택을 실행합니다. 아포페리틴 데이터 세트의 경우 bin6에서 템플릿 검색을 수행합니다. Tmp_angleSearch 파라미터(θ out, Δout, θ in, Δin)를 수정하여 평면 내 또는 평면 외 검색의 각도 범위와 간격을 도 단위로 결정합니다. 프로젝트 폴더에서 다음을 실행합니다. emClarity 템플릿검색 param_ts.m TS1 1 ApoF_Template_rescale.mrc O 1.
참고: 폴더 "convmap_wedge_Type2_bin6" 이 단계에서 생성됩니다. 이 폴더 아래의 csv 파일(예: TS1_1_bin6.csv)에는 선택한 입자에 대한 모든 정보가 포함됩니다. - 3dmod를 사용하여 잘못된 입자를 제거합니다. "convmap_wedge_Type2_bin6"폴더에서 3dmod를 실행하십시오. /cache/TS1_1_bin6.rec TS1_1_bin6.mod.
알림: 해당 영역에서 탄소 가장자리 또는 얼음 오염 옆에 잘못된 입자를 찾는 것이 일반적입니다. 잘못된 점을 마우스 오른쪽 버튼으로 클릭하고 키보드의 백스페이스 키를 눌러 삭제합니다. 이 단계에서는 대부분의 가양성 지점이 제거되었는지 확인합니다(그림 10). - 폴더 이름 "convmap_wedge_Type2_bin6"을 "convmap"으로 변경하면 emClarity가 다음 단계에서 convmap에서 하위 지역 정보를 찾습니다.
- 프로젝트를 초기화합니다. 프로젝트 폴더에서 emClarity init param0.m을 실행하여 emClarity, ApoF.mat에 대한 데이터베이스를 만듭니다.
- STA 및 정렬 전에 단층 촬영 재구성을 수행합니다. bin4에서 CTF 보정 하위 영역 단층 촬영을 생성하려면 emClarity ctf 3d param0.m을 실행합니다.
참고: CTF 보정 단층 촬영(예: cache/TS1_1_bin4.rec) 은 새 폴더 "캐시"에 생성됩니다. - STA 및 정렬을 수행합니다.
- bin4에서 시작하는 CTF 보정 하위 단층 촬영을 사용하여 평균화를 수행합니다. 프로젝트 폴더에서 emClarity avg param0.m 0 RawAlignment를 실행합니다.
- 계속해서 정렬을 수행하고 다음을 실행합니다: emClarity alignRaw 매개변수0.m 0.
참고: 평균화 단계는 참조를 생성하며, 이 단계에서 emClarity에서 파티클을 정렬하는 데 사용됩니다. Raw_angleSearch 파라미터(θ out, Δout, θ in, Δin)를 변경하여 각 사이클에 대한 각도 범위와 스텝 크기를 설정할 수 있습니다. 대부분의 잘못된 파티클이 데이터베이스에서 제거되므로(2.6.4단계) 정렬을 위한 이러한 각도 설정은 비교적 작은 각도로 시작할 수 있습니다. - Raw_angleSearch 매개 변수를 업데이트하고 몇 주기를 더 실행합니다(2.9.1단계 및 2.9.2단계). 프로세스 속도를 높이려면 평면 내 정렬과 평면 외 정렬을 별도로 수행합니다.
알림: 각 범주화에 대해 여러 사이클을 실행하고 각도 설정을 점차적으로 줄이는 것이 좋습니다. ApoF 데이터 세트의 경우 빈 4에서 5 번의 사이클이 더 수행되었으며 자세한 내용은 보충 표 2에서 확인할 수 있습니다. cycle001의 경우 프로젝트 폴더에서 emClarity avg param1.m 1 RawAlignment를 실행한 다음 emClarity alignRaw param1.m 1을 실행합니다. - 겹쳐진 입자를 청소하십시오. 프로젝트 폴더에서 다음을 실행합니다: emClarity remove중복 매개 변수5.m 5.
- tomoCPR로 틸트 시리즈 미세 조정을 수행합니다.
참고: 이 단계는 선택 사항입니다.- tomoCPR을 실행하여 스택 지오메트리를 미세 조정합니다. 프로젝트 폴더에서 다음을 실행합니다: emClarity tomoCPR param5.m 5.
- 새로 정렬된 스택을 생성하고 지오메트리 파일을 업데이트합니다. 프로젝트 폴더에서 emClarity ctf update param6.m을 실행합니다.
참고: 새 지오메트리 파일(예: fixedStacks/ctf/TS1_ali2_ctf.tlt)과 새로 정렬된 스택(예: aliStacks/TS1_ali2.fixed)이 올바르게 생성되었는지 확인합니다. - bin2에서 새 하위 단층 촬영을 만듭니다. 프로젝트 폴더에서 emClarity ctf 3d param6.m을 실행합니다.
알림: 그 다음에는 bin2(2.9.1단계, 2.9.2단계 및 2.9.3단계), 중복 청소(2.9.4단계) 및 선택적 tomoCPR(2.10단계)에서 평균화 및 정렬을 위한 몇 주기가 이어집니다. 높은 대칭성으로 인해, bin2에서 또 다른 5 사이클이 아포 페리틴에 대해 수행되었다. 각 주기에 대한 Raw_angleSearch 매개 변수를 업데이트합니다.
- 최종 재구성을 수행합니다.
- bin1 및 tomoCPR에서 몇 주기를 계속 실행합니다(2.9단계 및 2.10단계). bin1에서 또 다른 10 사이클이 아포 페리틴 데이터 세트에 대해 수행되었습니다. 명령 및 매개 변수에 대한 자세한 내용은 표 2에서 확인할 수 있습니다.
- 두 개의 절반 데이터 세트를 결합하여 최종 재구성을 수행합니다. 프로젝트 폴더에서 emClarity avg param21.m 21 RawAlignment를 실행한 다음 emClarity avg param21.m 21 FinalAlignment를 실행합니다.
참고: 최종 맵(예: B-계수 10, cycle021_ApoF_class0_final_bFact-10.mrc)이 생성됩니다( 그림 11).
결과
세포 및 라멜라 샘플의 경우 데이터 수집 전략은 샘플과 이미징 연구의 목표에 따라 크게 달라집니다(그림 1). 표적화 접근법은 분자 표적이 in situ 상태인지 또는 분자 표적을 포함하는 고해상도 재구성 표본을 위해 정제된 거대분자 복합체로부터 준비되었는지에 따라 달라집니다. 구멍이 뚫린 (탄소) 그리드 상에 유리화된 정제된 복합체의 경우, 타겟팅은 단순히 (탄소) 지지 필름의 구멍 내의 이미징에 기초할 수 있다. 현장 작업의 경우 타겟팅 접근 방식에는 상관 데이터 또는 알려진 저배율 셀룰러 랜드마크를 기반으로 분자 개체의 위치에 대한 지식이 필요합니다. 셀룰러 랜드마크는 개요 이미지를 촬영할 때 이상적으로 식별할 수 있으며, 관심 영역을 대략적으로 현지화하기에 충분한 경우 검색 이미지로 대상 ID를 빠르게 확인할 수 있는 방법을 제공할 수 있습니다. 그러나, 관찰 가능한 이벤트들이 드문 경우, 타겟이 정확하다는 것을 검증하기 위해 중간 배율 검색 이미지들이 필요할 수 있다. 검색 맵은 검색 이미지의 중간 배율 몽타주이며, 따라서 관심 있는 특징이 보이는 배율로 획득할 수 있는 표적 찾기를 훨씬 쉽게 만들 수 있습니다. 그런 다음 검색 맵을 선별하여 대상 배치 위치를 찾고 설정할 수 있습니다. 초구조적 재구성을 위한 세포 특징을 포함하는 표본의 경우, 표적화 접근법은 유사하지만 다양한 배율에서 세포 이벤트의 가시성과 샘플에서의 유병률에 동등하게 의존합니다.
데이터 수집 전략도 고려해야 합니다. 모든 경우에 연구의 목표는 주로 데이터 수집 방법을 결정합니다. 세포 미세 구조의 재구성을 위해서는 저배율 (20-5 Å / px)과 넓은 시야가 적절할 수 있지만 분자 또는 고해상도 세부 사항 (5-1 Å / px)을 재구성하려면 고배율이 필요합니다. 이상적인 조건에서 1.5 Å / px로 수집 된 데이터 세트는 3.0 Å / px의 Nyquist 주파수에서만 물리적으로 재구성을 생성 할 수 있습니다. 그러나 실제로는 시편 두께, 크기 및 이질성을 포함하되 이에 국한되지 않는 많은 요소가 모두 얻어진 재구성 품질에 영향을 미칩니다. 정확한 이미징 매개 변수는 또한 연구의 목표에 따른 배율과 충분한 정보를 포함하는 시야의 균형을 유지합니다. 이 기사는 2.86 Å에 도달하는 서브 단층 촬영 평균 사례를 제시하지만, 다른 결과17,42,45,46을 대상으로하는 연구와 관련된 수집 매개 변수를 설명하기 위해 추가 연구 17,42,43,44,45가 표 1에 제시됩니다.
Cryo-ET에 대한 타겟팅 워크플로우 및 데이터 수집 체계가 구축되면 다양한 샘플 유형의 데이터 수집이 가능합니다. 다양한 표본의 대표적인 단층 촬영이 여기에 제시됩니다 : 아포 페리틴 (영화 1), 얇은 세포 과정 (영화 2) 및 두꺼운 세포 표본의 FIB 분쇄 라멜라 (영화 3)와 같은 분자 샘플.
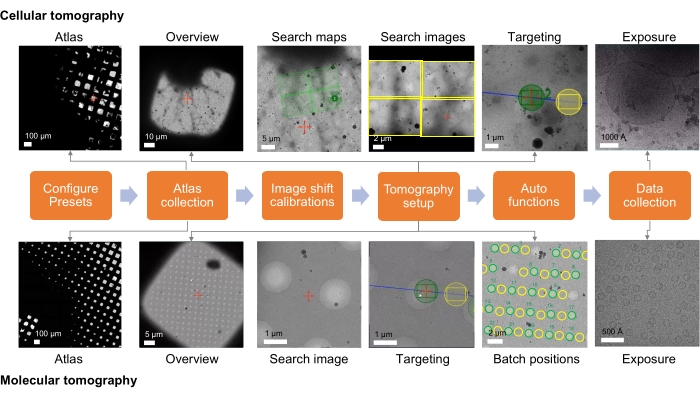
그림 1: 단층 촬영 워크플로 설정 개요. 프로토콜에 설명된 Cryo-ET 이미징 워크플로우는 순서도로 표시됩니다. 획득될 것으로 예상되는 이미지는 세포 및 분자 워크플로우에 대해 표시됩니다. 제시된 명명은 Tomo5 규칙을 따르지만 대부분의 단층 촬영 수집 소프트웨어는 이러한 이미지를 수집하기위한 공통 원칙을 공유합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
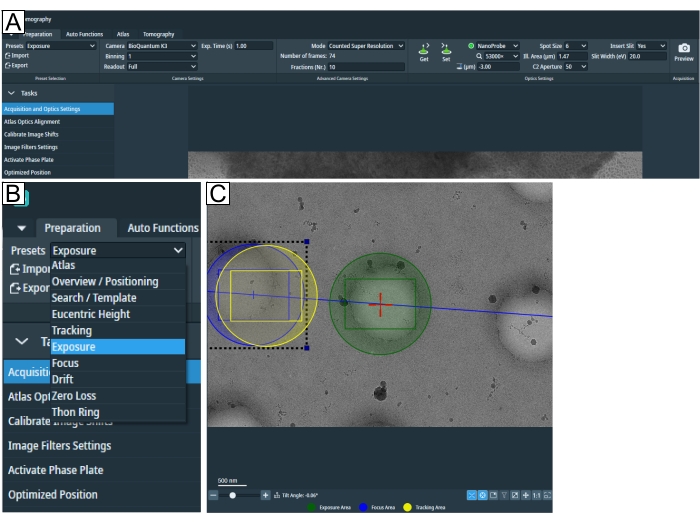
그림 2: 준비 탭 및 검색 사전 설정 조건 . (ᅡ) 전체 탭의 개요 이미지. 이미징 조건 사전 설정은 이 탭에서 설정되며 "이미지 시프트 보정" 및 "이미지 필터 설정"은 "작업" 드롭다운에서 찾을 수 있습니다. (B) 개별 이미징 조건 설정을 위해 각 사전 설정을 선택할 수 있는 "사전 설정" 드롭다운을 확대합니다. (C) 노출과 "초점 및 추적" 영역을 시야에 맞추기 위해 적절한 배율을 묘사한 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
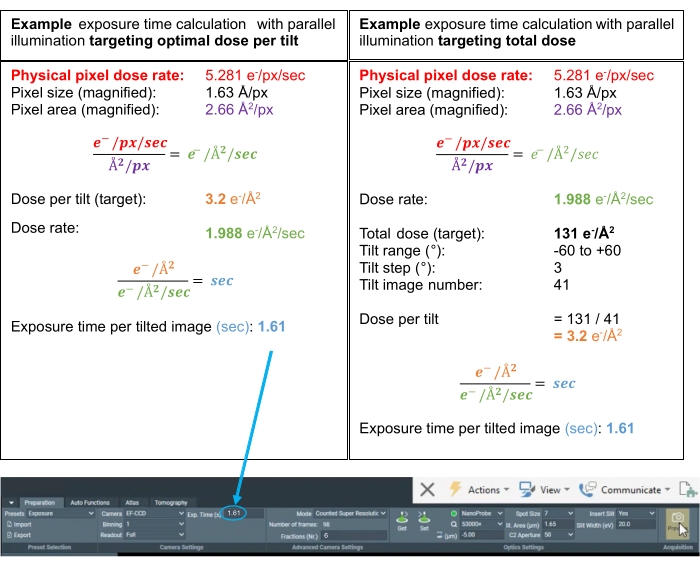
그림 3: 선량 계산. 선량률이 진공을 통해 측정된 가능한 단층 촬영 계획에 대한 선량 계산의 예. 두 가지 계산은 각 틸트에 대한 노출 시간을 결정하며, 틸트당 최적 선량을 목표로 하는지 또는 전체 틸트 시리즈에 대한 최적의 총 선량을 목표로 하는지 여부를 결정합니다. 서브 토모 그램 평균화에서는 3.0-3.5 e- / Å2 범위에서 기울어 진 이미지 당 최적의 선량을 목표로하는 것이 일반적입니다. 두 경우 모두에서, "분획(Nr.)"은 모션 보정을 수행하기에 충분한 신호에 대한 틸트의 무비 프레임당 ~0.5 e-/Å2 선량을 달성하기 위해 6으로 설정된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
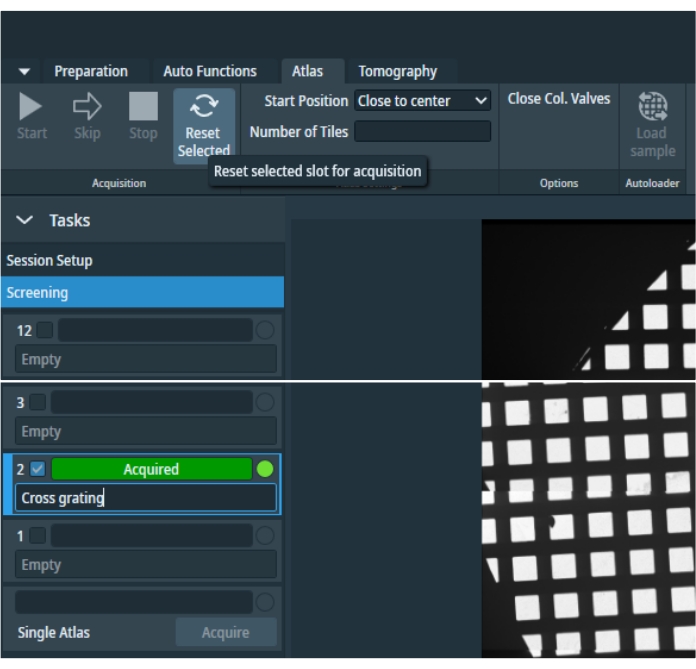
그림 4: 아틀라스 탭. "아틀라스" 탭의 개요 이미지입니다. 빈 격자 위치 공간을 피하기 위해 이미지가 잘렸습니다. "작업" 메뉴에는 인벤토리에 포함된 모든 그리드를 개별적으로 선택할 수 있는 세션 설정 기본 설정과 그리드 선택 공간과 자동 로더에서 카세트를 제거한 후 단일 아틀라스를 획득할 수 있는 옵션이 포함되어 있습니다. 선택한 그리드를 재설정한 다음 다시 획득할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
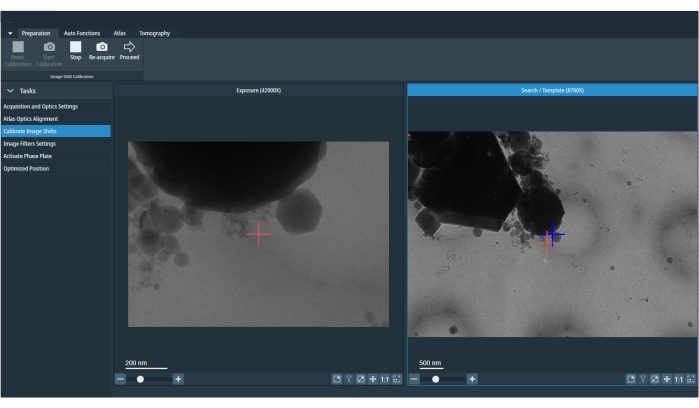
그림 5: 보정된 이미지 이동 이미지는 노출 및 검색 이미지를 나타냅니다. 검색 이미지의 빨간색 십자 표시는 노출과 검색 사이의 오프셋을 수정하기 위해 이동된 마커입니다. 세션 시작 시 또는 이미징 조건 사전 설정을 변경한 후에 이미지 이동 보정을 다시 실행해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
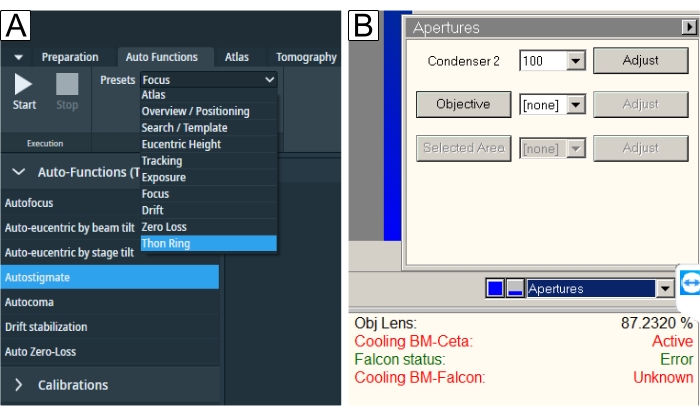
그림 6: 자동 기능 및 조리개. (ᅡ) "자동 기능" 탭에는 "사전 설정" 드롭다운과 "작업" 선택이 표시됩니다. 파란색 밑줄은 "Autostigmate"(파란색 밑줄로 표시됨) 및 "Autocoma"에 필요한 "Thon Ring" 사전 설정입니다. 각 작업에 대해 각각의 사전 설정을 선택한 다음 시작 버튼을 눌러야 합니다. (B) 조리개는 TEM 사용자 인터페이스에서 찾을 수 있습니다. 자동 기능이 수행된 후 원하는 "대물 조리개"를 선택하고 조리개를 넣은 상태에서 "자동 낙인찍기"를 실행합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
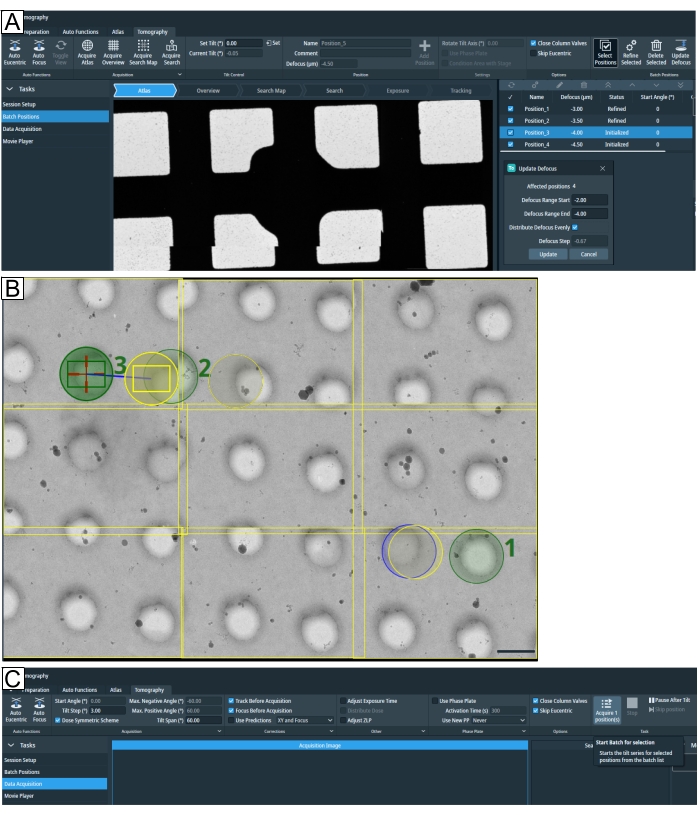
그림 7: 단층 촬영 탭 개요. 이미지는 Tomo 5.8 사용자 인터페이스를 보여줍니다. (A) 배치 위치. 이미지에 묘사 된 최신 기능 : "검색지도 획득"옵션; 단층 촬영 위치는 확대 옵션과 함께 아틀라스보기에 표시됩니다. 오른쪽 상단에 강조 표시된 것은 "위치 선택"입니다. 아래 네 위치 모두 "디포커스 업데이트" 매개변수로 선택되었습니다. (B) 검색 맵에서 1, 2, 3으로 표시된 세 개의 위치가 선택됩니다. 위치 1은 "모두 구체화"를 실행할 때 문제가 되지 않습니다. 그러나 위치 2 및 위치 3에 표시된 대로 라멜라 위치를 선택할 때와 같이 표적 밀도가 높은 설정에서 "모두 조정"은 위치 2의 "노출" 영역에서 "추적" 및 "초점" 루틴을 실행하여 단층 촬영을 획득하기 전에 대상을 노출합니다. 그리드 유형은 R1.2/1.3입니다. 스케일 바 = 1.2 μm. (C) 데이터 수집. 이제 "배치 위치"에서 선택한 위치를 개별적으로 획득할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
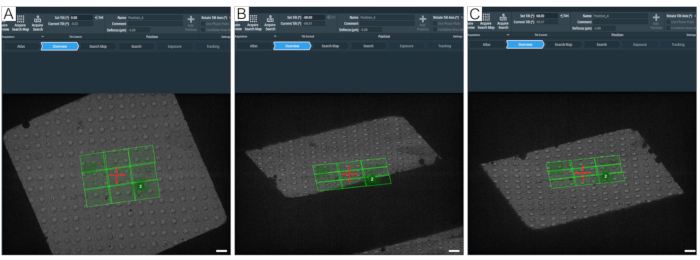
그림 8: 최대 기울기 각도 정의. 그림은 단층 촬영 획득을위한 최대 기울기 범위를 결정하는 단계별 접근 방식을 보여줍니다. (A) 0° 개요 및 그리드 사각형 중앙에 있는 검색 지도. 틸트 범위를 테스트하려면 단층 촬영 소프트웨어에서 원하는 값을 입력한 다음 Set을 눌러 "Set Tilt(°)"로 각도를 설정할 수 있습니다. (B) 스테이지가 -60°로 기울어져 검색 맵의 모서리가 -60°에서 완전히 획득되지 않음을 보여줍니다. (C) 스테이지가 60°로 기울어졌습니다. ±60°에서 사라진 구멍을 세면 격자 사각형의 기울기 범위에 대한 아이디어를 얻을 수 있습니다. 스케일 바 = 2.5 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
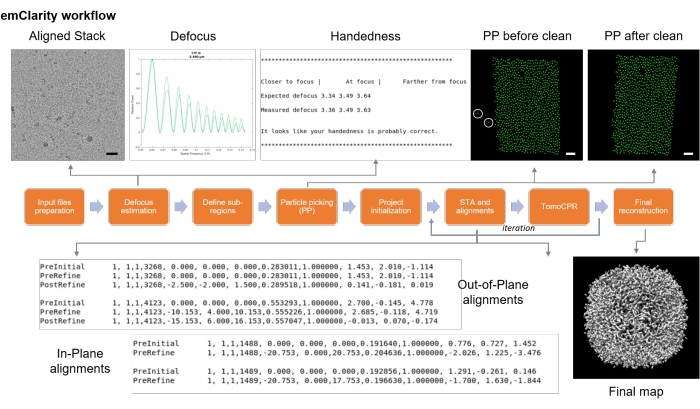
그림 9: 명확성 순서도. 순서도는 cryo 하위 단층 촬영 평균화를위한 다양한 단계를 설명했습니다. 스케일 바 = 50nm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 10: emClarity를 사용한 템플릿 일치 . (A) 그래핀 코팅 그리드에 대한 아포페리틴의 전형적인 현미경 사진. 디 포커스 : −3.430 μm. (B) 템플릿 검색 후 모델 포인트로 오버레이 된 단층 촬영 조각. (C) 단면 및 (D) 모델 포인트의 측면 투영도는 단분산 아포페리틴 입자의 단일 평면 층을 나타냅니다. 스케일 바 = 50nm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
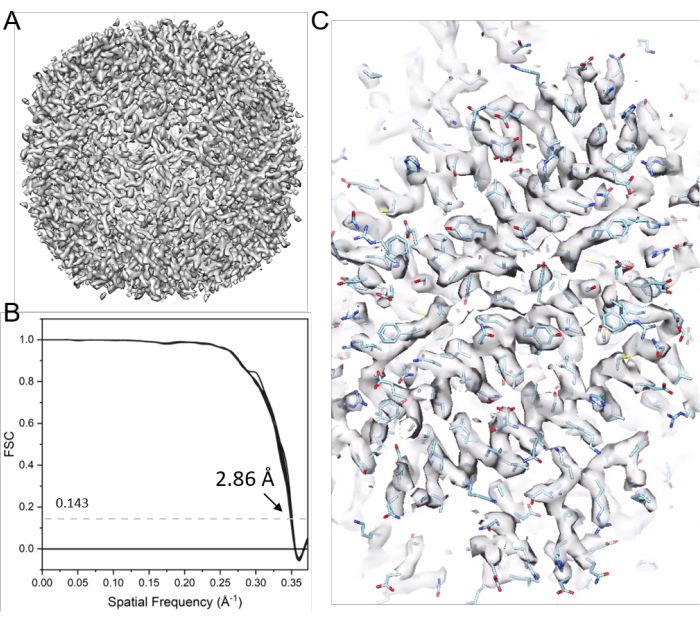
그림 11: 아포페리틴의 Cryo-ET STA . (A) 서브 단층 촬영 정렬의 21주기 후 최종 맵. (B) 38개의 원뿔 FSC를 포함하는 보고된 분해능이 2.86Å인 최종 맵의 푸리에 쉘 상관(FSC) 플롯. (C) 대표 밀도 맵(PDB 모델 6s6147 장착). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 견본 | 극저온 ET 타입 | Å/px | 틸트 범위(+/-) | 틸트 단계(°) | 디 포커스 범위 (μm) | 총 복용량 (e- / Å2) | 해상도 | 원시 데이터 | 참조 |
| 아포 페리틴 | 정제/분자(STA) | 1.34 | 60 | 3 | 1.5 – 3.5 | 102 | 2.86 | 엠피아-10787 | 17 & 이 논문 |
| HIV-1 개그 | 정제/분자(STA) | 1.35 | 60 | 3 | 1.5 – 3.96 | 120 | 3.1 | 엠피아-10164 | 17 |
| 리보솜 | 정제/분자(STA) | 2.1 | 60 | 3 | 2.2 – 4.3 | 120 | 7 | 엠피아-10304 | 42 |
| 사스-코로나 2 급증 | 라멜라 / 분자 (STA) | 2.13 | 54 | 3 | 2 – 7 | 120 | 16 | 엠피아-10753 | 45 |
| 뉴런 축삭 구조 | 세포 (초 구조) | 5.46 | 60 | 2 | 3.5 – 5 | 90 | 증권 시세 표시기 | 엠피아-10922 | 47 |
표 1: 여러 Cryo-ET 연구에 대한 수집 매개변수. 미세 구조적 세포 특징을 해결하고 분할하는 것을 목표로 하는 연구와 비교하여 정제된 또는 현장 단백질에서 분자 세부 사항의 재구성을 목표로 하는 연구.
동영상 1: 일반 EM 그리드에서 아포페리틴 샘플의 단층 촬영을 한 다음 호환 필터가 있는 초고해상도 카메라가 장착된 Cryo-TEM으로 이미지화합니다. 틸트 시리즈는 전자 단층 촬영 소프트웨어에서 틸트 스팬이 54°이고 총 선량이 134 e-/A2 인 선량 대칭 방식으로 획득되었습니다. 스케일 바 = 50nm. 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 2: EM 그리드에서 성장한 후 호환 필터가 있는 초고해상도 카메라가 장착된 Cryo-TEM으로 직접 이미징한 1차 뉴런의 단층 촬영. 틸트 시리즈는 전자 단층 촬영 소프트웨어에서 틸트 스팬이 60°이고 총 선량이 120 e-/A2 인 선량 대칭 방식으로 획득되었습니다. 스케일 바 = 100nm. 이 영화를 다운로드하려면 여기를 클릭하십시오.
영화 3 : EM 그리드에서 시아 노 박테리아의 단층 촬영, FIB 밀링을 거친 다음 고속 카메라와 호환 필터가 장착 된 cryo-TEM으로 이미지화. 틸트 시리즈는 전자 단층 촬영 소프트웨어에서 틸트 스팬이 50°이고 총 선량이 120e-/A2 인 선량 대칭 방식으로 획득되었습니다. 스케일 바 = 87.2 nm. 이 영화를 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 디포커스를 추정하기 위한 매개변수 파일 템플릿입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 1: 데이터 수집 및 현미경 설정 세부 정보. 이 표를 다운로드하려면 여기를 클릭하십시오.
보충 표 2: 실행 순서의 명령 목록. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
토모5
단층 촬영 소프트웨어의 워크플로우 설명은 (원격) 배치 단층 촬영 세션 설정을 위한 한 가지 잠재적이고 가장 간소화된 방법을 강조합니다. 이 소프트웨어는 초보자도 쉽게 사용할 수 있지만, 초기 Cryo-EM 경험과 기본적인 단층 촬영 이해가 설정에 도움이 될 수 있습니다. 중요한 단계는 프로토콜에서 강조 표시되며 다른 설정 방법을 사용한 경우에도 문제를 해결하는 데 도움이 됩니다. 소프트웨어의 발전으로 (원격) 데이터 수집이 용이해지고 광범위한 사용자 기반이 cryo-ET에 더 쉽게 액세스할 수 있습니다. 일반적으로 발생하는 문제를 해결하는 데 도움이 되는 몇 가지 팁과 요령이 아래에 설명되어 있습니다.
논의해야 할 한 가지 중요한 점은 그리드를 선택하는 것인데, 시편을 ±60°로 기울일 때 높은 기울기의 그리드 막대가 시야를 가릴 수 있기 때문입니다(그림 8). TEM 그리드에서 메쉬 크기는 그리드의 단위 길이당 그리드 제곱 수를 나타냅니다. 더 큰 메쉬 수는 단위 길이당 더 많은 그리드 사각형, 더 높은 그리드 사각형의 밀도 및 더 작은 그리드 사각형, 즉 400 메쉬 그리드는 200 메쉬 그리드보다 더 작은 사각형을 갖습니다. 단층 촬영을위한 그리드의 좋은 선택은 200 메쉬 또는 300 메쉬 그리드입니다. 그림 8에 표시된 것처럼 그리드가 기울어짐에 따라 수집 가능한 영역이 줄어듭니다. ±60° 기울기에서 300메쉬 그리드는 전체 단층 촬영을 획득할 수 있는 작은 시야를 갖게 됩니다. 200 메쉬 그리드의 장점은 더 큰 그리드 사각형이 분자 단층 촬영 설정을 더 빠르게 만들고 그리드 사각형 면적이 증가하면 하나의 사각형으로 하룻밤 사이에 수집하기에 충분하다는 것입니다. 단점은 200 메쉬 그리드가 더 깨지기 쉽기 때문에 처리 및 클리핑에 더 많은 기교가 필요하다는 것입니다.
또한 EM 그리드에 구멍이 뚫린 지지 필름( 재료 표 참조)을 사용하는 경우 노출 영역과 관련된 초점 및 추적 영역을 설정할 때 구멍 간격을 고려해야 합니다. 이상적으로, 원하는 배율의 빔 직경은 최적의 빠른 설정을 위해 틸트 축을 따라 노출 영역에 인접한 탄소 영역을 덮을 수있을만큼 작아야합니다. 이렇게 하면 각 구멍의 잠재적 관심 영역을 획득할 수 있습니다.
소프트웨어의 유심 높이 루틴은 현재 serialEM 루틴과 같이 강력하지 않으므로 다음 팁으로 해당 문제를 해결할 수 있습니다. 유센트릭 높이 사전 설정을 사용하여 유센트릭 높이 결정이 실패하면 대신 개요 사전 설정을 사용하고 "스테이지 기울기에 의한 자동 유센트릭"을 다시 실행할 수 있습니다. 이것은 Eucentric 높이가 0에서 멀리 떨어져 있는 경우 문제를 해결할 수 있습니다. 이 작업이 성공하면 "Eucentric Height" 사전 설정을 사용하여 "스테이지 기울기에 의한 자동 유센트릭"을 다시 실행하여 정밀도를 향상시킬 수 있습니다. 실패하면 유센트릭 높이 사전 설정으로 "빔 틸트에 의한 자동 유센트릭"을 실행한 다음 "스테이지 틸트에 의한 자동 유센트릭"을 다시 실행하거나 TEM 사용자 인터페이스의 "스테이지" 설정에서 "빔 틸트에 의한 자동 유센트릭"으로 통합된 z-높이를 수동으로 설정할 수 있습니다. 구멍의 반복 패턴이 있는 그리드를 사용하는 경우 단일 상호 상관 피크의 식별을 방지할 수 있습니다. 구멍 패턴과의 교차 상관을 줄이기 위해 -25μm와 같은 더 낮은 디포커스 오프셋 및/또는 더 짧은 노출 시간으로 유센트릭 높이 사전 설정을 변경할 수 있습니다. 반면에 레이스 그리드 / 라멜라를 사용하면 강한 교차 상관 피크에 대한 충분한 신호를 제공하지 못할 수 있습니다. 유센트릭 높이 사전 설정을 -75μm와 같은 더 큰 디포커스 오프셋 및/또는 확장된 노출 시간으로 변경하여 교차 상관 피크를 향상시킬 수 있습니다. 또 다른 옵션은 이미지 필터 설정을 조정하는 것입니다. "준비"탭에서 찾을 수 있습니다. 필터 설정을 조정하는 옵션은 낮음(개요/그리드스퀘어), 중간(Eucentric 높이) 및 고배율(추적/초점)에 대해 설정하여 각 사전 설정에 대한 최적의 교차 상관 피크를 찾을 수 있습니다. 필요한 입력은 하나의 이미지(예: 0° 및 5° 이미지)이며 비교를 클릭하여 두 이미지를 비교 합니다. 가장 긴 파장에 권장되는 시작 값은 이미지 비율 막대의 1/4이고 가장 짧은 파장에 대한 권장 시작 값은 눈금 막대의 1/40입니다. 피크가 확실하게 식별되지 않으면 설득력있는 피크를 찾을 수있을 때까지 설정을 최적화 할 수 있습니다. 매번 이미지를 다시 가져올 필요가 없습니다. "비교"를 누르는 것만으로도 충분합니다. TOMO가 여전히 유심 높이를 자동으로 찾지 못하면 수동 유심 높이 보정을 사용할 수 있습니다. "준비" 탭의 개요 배율에서 합리적으로 큰 얼음 결정 중앙에 배치한 다음 TEM 사용자 인터페이스의 "스테이지 제어"로 이동하여 알파를 -30°로 설정하고 스테이지 z 값을 조정하여 형광 스크린 이미지를 사용하여 결정을 다시 중앙에 배치해야 합니다. TEM 사용자 인터페이스에서 "고해상도" 및 "고대비" 설정을 선택하면 이 작업이 간단해집니다(형광등 화면 창 하단의 버튼). 선택적으로 라이브 모드가있는 카메라에 액세스 할 수있는 경우 eucentric 높이를 결정하는 데 사용할 수 있습니다. 형광등보다 쉬울 것입니다.
5.8 이전 Tomo5 버전의 가장 큰 제한 사항은 중간 배율 몽타주 누락, 선량 대칭 체계 누락 및 유심 높이 찾기와 관련된 문제입니다. 이들은 serialEM, 신속한 개발 및 커뮤니티 지원, 강력한 유센트릭 높이 루틴, 스크립팅 옵션(예: 맞춤형 용량 대칭 구성표)을 갖춘 프리웨어에 존재합니다. Tomo5의 버전 5.8부터 유센트릭 높이를 찾는 데 가장 일반적으로 발생하는 문제, 즉 대상 z-값 주위의 실패한 루프는 유센트릭 높이 허용 기준을 설정하는 옵션을 구현하여 해결되었습니다. 그러나 그리드 및 샘플 유형이 다르면 개별 세션의 고유한 이미징 조건을 반영하고 유센트릭 높이를 찾고 단층 촬영 중에 초점 및 추적 영역이 안정적으로 작동하도록 가능한 최상의 교차 상관 피크를 제공하도록 이미지 필터 설정을 조정하는 것이 좋습니다.
전반적으로 많은 시설이 팬데믹 기간 동안 원격 운영에 빠르게 적응했습니다. Tomo5 소프트웨어는 원격 조작에 적합한 단층 촬영에 대한 쉬운 액세스와 사용자 친화적인 경로를 제공합니다. 소프트웨어의 발전은 의심 할 여지없이 원격 데이터 수집 및 단층 촬영 수집을 일반적으로 커뮤니티에서 주류로 만들 것입니다.
엠클래리티
emClarity는 템플릿 기반 파티클 피킹 방법을 사용하므로 관심 개체에 대한 템플릿이 필요합니다. 입자 피킹(2.6단계)은 매우 민감하며 최종 구조의 핵심입니다. 평균화 및 정렬 (2.9 단계)하기 전에주의 깊게 확인하고 오 탐지를 수동으로 제거해야합니다. 템플릿을 사용할 수 없는 경우 emClarity를 사용하기가 쉽지 않을 수 있지만 Dynamo37 및 PEET48과 같은 다른 소프트웨어를 사용하여 초기 모형을 작성할 수 있습니다.
이기종 샘플의 경우 emClarity는 사용자가 다양한 스케일의 특정 기능에 집중할 수 있는 분류 방법을 갖추고 있습니다. 분류 전에 정렬 주기를 몇 번 실행하고 더 높은 범주화(예: bin 4 또는 bin 3)에서 실행하는 것이 좋습니다.
소프트웨어의 최신 버전(V1.5.3.11)은 첫 번째 릴리스(V1.0)17에 비해 크게 업데이트되었습니다. 여기에는 CTF 추정 중 손잡이 검사가 포함되지만 이에 국한되지는 않습니다 (단계 2.3); 정렬을위한 대칭 (CX, I, I2, O); 입자 당 3D 샘플링 기능 (3DSF) 계산; 호환성 및 안정성을 위해 MATLAB 2019a로 전환; 및 원시 투영 이미지(cisTEM)를 사용하여 재구성합니다. 소프트웨어는 다양한 샘플에 대해 계속 개선될 것이며 최신 발표는 온라인에서 찾을 수 있습니다( 재료 표 참조).
공개
저자는 이해 상충이 없습니다.
감사의 말
우리는 Wellcome Trust, MRC 및 BBRSC가 자금을 지원하는 영국 국립 전자 바이오 이미징 센터(eBIC)의 Cryo-EM 시설에 대한 액세스 및 지원에 대해 Diamond Light Source를 인정합니다. 또한 아포페리틴 단층촬영(영화 1)을 획득한 앤드류 하우(Andrew Howe), 뉴런 단층촬영(영화 2)을 준비하고 획득한 Ishika Kumar, 시아노박테리아 라멜라-단층촬영(영화 3)을 제작한 크레이그 맥그리거-채트윈(Craig MacGregor-Chatwin)에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Software | |||
| Tomography | Thermo Fisher Scientific | 5.9.0 | Internal terminology: Tomo5 in document |
| TEM server | Thermo Fisher Scientific | 7.10.1 | |
| TIA | Thermo Fisher Scientific | 5.10.1 | |
| DigitalMicrograph | Gatan | 3.44 | |
| emClarity | Open-Source software | 1.5.3.11 | Software for high-resolution cryo-electron tomography and subtomogram averaging |
| IMOD | Open-Source software | 4.11 | Modeling, display and image processing programs used for 3D reconstruction and modeling of microscopy images with a special emphasis on electron microscopy data |
| MotionCor2 | Free for academic use | 1.1.0 | A multi-GPU program that corrects beam-induced sample motion recorded on dose fractionated movie stacks |
| ETomo | Open-Source software | 4.11 | ETomo is an interface for running a subset of IMOD and PEET commands. |
| NoMachine | NoMachine, freeware | 7.9.2 | Remote desktop software |
| TeamViewer | TeamViewer AG | - | Remote access and remote control computer software |
| Materials | |||
| Quantifoil (holey support film) EM grids | Quantifoil | - | A flat film of carbon with pre-defined hole size, shape and arrangement |
| Instrumentation | |||
| Titan Krios microscope | Thermo Fisher Scientific | Titan Krios G2 | |
| K3 camera and GIB energy filter | Gatan | - | |
| Falcon 4 camera and Selectris X energy filter | Thermo Fisher Scientific | - | |
| Website | |||
| Website 1: https://github.com/bHimes/emClarity/ | - | - | Link to download the emClarity software package |
| Website 2: https://bio3d.colorado.edu/imod/ | - | - | Link to download IMOD |
| Website 3: https://github.com/ffyr2w/emClarity-tutorial | - | - | Link to the emClarity online tutorial |
| Website 4: https://emcore.ucsf.edu/ucsf-software | - | - | Link to download MotionCor2 |
| Website 5: https://github-wiki-see.page/m/bHimes/emClarity/wiki | - | - | Link to the newest announcements including updates and bug fixs for emClarity |
참고문헌
- Bai, X. -. C., Fernandez, I. S., McMullan, G., Scheres, S. H. W. Ribosome structures to near-atomic resolution from thirty thousand cryo-EM particles. eLife. 2, 00461 (2013).
- Li, X., et al. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM. Nature Methods. 10 (6), 584-590 (2013).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. 587 (7832), 152-156 (2020).
- Kato, T., et al. CryoTEM with a cold field emission gun that moves structural biology into a new stage. Microscopy and Microanalysis. 25, 998-999 (2019).
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. 587 (7832), 157-161 (2020).
- Mastronarde, D. N. SerialEM: A program for automated tilt series acquisition on Tecnai microscopes using prediction of specimen position. Microscopy and Microanalysis. 9, 1182-1183 (2003).
- Schorb, M., Haberbosch, I., Hagen, W. J. H., Schwab, Y., Mastronarde, D. N. Software tools for automated transmission electron microscopy. Nature Methods. 16 (6), 471-477 (2019).
- Deng, Y., et al. Smart EPU: SPA getting intelligent. Microscopy and Microanalysis. 27 (1), 454-455 (2021).
- Carragher, B., et al. Leginon: An automated system for acquisition of images from vitreous ice specimens. Journal of Structural Biology. 132 (1), 33-45 (2000).
- Bell, J. M., Chen, M., Baldwin, P. R., Ludtke, S. J. High resolution single particle refinement in EMAN2.1. Methods. 100, 25-34 (2016).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. cryoSPARC: Algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. 14 (3), 290-296 (2017).
- Grant, T., Rohou, A., Grigorieff, N. cisTEM, user-friendly software for single-particle image processing. eLife. 7, 35383 (2018).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166 (2018).
- Kimanius, D., Dong, L., Sharov, G., Nakane, T., Scheres, S. H. W. New tools for automated cryo-EM single-particle analysis in RELION-4.0. Biochemical Journal. 478 (24), 4169-4185 (2021).
- Galaz-Montoya, J. G., Flanagan, J., Schmid, M. F., Ludtke, S. J. Single particle tomography in EMAN2. Journal of Structural Biology. 190 (3), 279-290 (2015).
- Bharat, T. A. M., Scheres, S. H. W. Resolving macromolecular structures from electron cryo-tomography data using subtomogram averaging in RELION. Nature protocols. 11 (11), 2054-2065 (2016).
- Himes, B. A., Zhang, P. emClarity: Software for high-resolution cryo-electron tomography and subtomogram averaging. Nature Methods. 15 (11), 955-961 (2018).
- Weissenberger, G., Henderikx, R. J. M., Peters, P. J. Understanding the invisible hands of sample preparation for cryo-EM. Nature Methods. 18 (5), 463-471 (2021).
- White, J. B. R., et al. Single particle cryo-electron microscopy: From sample to structure. Journal of Visualized Experiments. (171), e62415 (2021).
- Orlova, E. V., Saibil, H. R. Structural analysis of macromolecular assemblies by electron microscopy. Chemical Reviews. 111 (12), 7710-7748 (2011).
- Turk, M., Baumeister, W. The promise and the challenges of cryo-electron tomography. FEBS Letters. 594 (20), 3243-3261 (2020).
- Liu, Y. -. T., et al. Isotropic reconstruction of electron tomograms with deep learning. bioRxiv. , (2021).
- Briggs, J. A. G. Structural biology in situ-The potential of subtomogram averaging. Current Opinion in Structural Biology. 23 (2), 261-267 (2013).
- Grünewald, K., et al. Three-dimensional structure of herpes simplex virus from cryo-electron tomography. Science. 302 (5649), 1396-1398 (2003).
- Allegretti, M., et al. In-cell architecture of the nuclear pore and snapshots of its turnover. Nature. 586 (7831), 796-800 (2020).
- Wang, Z., et al. The molecular basis for sarcomere organization in vertebrate skeletal muscle. Cell. 184 (8), 2135-2150 (2021).
- Winey, M., Meehl, J. B., O'Toole, E. T., Giddings, T. H. Conventional transmission electron microscopy. Molecular Biology of the Cell. 25 (3), 319-323 (2014).
- Davies, K. M., et al. Macromolecular organization of ATP synthase and complex I in whole mitochondria. Proceedings of the National Academy of Sciences. 108 (34), 14121 (2011).
- Wagner, J., Schaffer, M., Fernández-Busnadiego, R. Cryo-electron tomography-The cell biology that came in from the cold. FEBS Letters. 591 (17), 2520-2533 (2017).
- Mahamid, J., et al. Visualizing the molecular sociology at the HeLa cell nuclear periphery. Science. 351 (6276), 969-972 (2016).
- Erdmann, P. S., et al. In situ cryo-electron tomography reveals gradient organization of ribosome biogenesis in intact nucleoli. Nature Communications. 12 (1), 5364 (2021).
- Tegunov, D., Xue, L., Dienemann, C., Cramer, P., Mahamid, J. Multi-particle cryo-EM refinement with M visualizes ribosome-antibiotic complex at 3.5 Å in cells. Nature Methods. 18 (2), 186-193 (2021).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152 (1), 36-51 (2005).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116 (1), 71-76 (1996).
- Heymann, J. B., Belnap, D. M. Bsoft: Image processing and molecular modeling for electron microscopy. Journal of Structural Biology. 157 (1), 3-18 (2007).
- Tang, G., et al. EMAN2: An extensible image processing suite for electron microscopy. Journal of Structural Biology. 157 (1), 38-46 (2007).
- Castaño-Díez, D., Kudryashev, M., Arheit, M., Stahlberg, H. Dynamo: A flexible, user-friendly development tool for subtomogram averaging of cryo-EM data in high-performance computing environments. Journal of Structural Biology. 178 (2), 139-151 (2012).
- Hrabe, T., et al. PyTom: A python-based toolbox for localization of macromolecules in cryo-electron tomograms and subtomogram analysis. Journal of Structural Biology. 178 (2), 177-188 (2012).
- Himes, B. A. emClarity. GitHub. , (2021).
- . The IMOD Home Page Available from: https://bio3d.colorado.edu/imod/ (2020)
- . GitHub: emClarity-tutorial Available from: https://github.com/ffyr2w/emClarity-tutorial (2021)
- Ni, T., et al. High-resolution in situ structure determination by cryo-electron tomography and subtomogram averaging using emClarity. Nature Protocols. 17 (2), 421-444 (2022).
- . MotionCor2 Available from: https://emcore.ucsf.edu/ucsf-software (2016)
- . Apoferritin from mouse at 1.84 angstrom resolution Available from: https://www.emdataresource.org/EMD-10101 (2022)
- Nedozralova, H., et al. In situ cryo-electron tomography reveals local cellular machineries for axon branch development. Journal of Cell Biology. 221 (4), 202106086 (2022).
- Mendonça, L., et al. Correlative multi-scale cryo-imaging unveils SARS-CoV-2 assembly and egress. Nature Communications. 12 (1), 4629 (2021).
- . Apoferritin from mouse at 1.84 angstrom resolution Available from: https://www.rcsb.org/structure/6s61 (2019)
- Nicastro, D., et al. The molecular architecture of axonemes revealed by cryoelectron tomography. Science. 313 (5789), 944-948 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유