Method Article
Coleta remota de dados de tomografia crio-elétron e média de subtomograma
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O presente protocolo descreve a aquisição remota de dados remotos crio-elétrons de alta resolução usando Tomo5 e processamento de dados subsequente e média de subtomogramas usando a emClarity. A apoferritina é usada como exemplo para ilustrar processos passo a passo detalhados para alcançar uma estrutura crio-ET com resolução de 2,86 Å.
Resumo
A tomografia crio-elétron (crio-ET) vem ganhando força nos últimos anos, especialmente desde a introdução de detectores de elétrons diretos, estratégias de aquisição automatizadas aprimoradas, técnicas preparatórias que expandem as possibilidades do que o microscópio eletrônico pode imaginar em alta resolução usando crio-ET e novo software de média de subtomograma. Além disso, a aquisição de dados tem se tornado cada vez mais simplificada, tornando-a mais acessível a muitos usuários. A pandemia SARS-CoV-2 acelerou ainda mais a coleta remota de dados de microscopia crio-elétron (crio-EM), especialmente para crio-EM de partículas únicas, em muitas instalações em todo o mundo, fornecendo acesso ininterrupto ao usuário a instrumentos de última geração durante a pandemia. Com os recentes avanços no Tomo5 (software para tomografia eletrônica 3D), a coleta remota de dados crio-ET tornou-se robusta e fácil de manusear de qualquer lugar do mundo. Este artigo tem como objetivo fornecer um passo a passo detalhado, a partir da configuração de coleta de dados no software de tomografia para o processo de uma sessão (remota) de coleta de dados crio-ET com solução detalhada de problemas. O protocolo de coleta de dados (remoto) é ainda mais complementado com o fluxo de trabalho para determinação da estrutura em resolução quase atômica por subtomograma em média com a emClaridade, usando a apoferritina como exemplo.
Introdução
A microscopia eletrônica criogênica (crio-EM) é amplamente conhecida por ter experimentado um período renascentista, acelerando-a para se tornar uma ferramenta central e centralmente útil na biologia estrutural. O desenvolvimento e utilização de detectores eletrônicos diretos 1,2,3, microscópios melhorados e fontes eletrônicas 3,4,5, melhorias na automação/throughput 6,7,8,9 e avanços computacionais na análise de partículas únicas 10,11,12,13 14 e tomografia 15,16,17 são, em parte, responsáveis pelo sucesso recente da técnica. Esses drivers tecnológicos desenvolveram a capacidade da crio-EM de resolver estruturas macromoleculares biológicas sob condições criogênicas e nativas. As resoluções prontamente obtidas são suficientes para modelagem atomicamente precisa e trouxeram a técnica para a vanguarda da arena de biologia estrutural. Uma abordagem reducionista para expressar e purificar um alvo biológico de interesse tem se mostrado há muito bem sucedida na cristalografia macromolecular (MX) para pesquisa biológica básica, descoberta de medicamentos e ciência translacional. Na mesma abordagem, o crio-EM agora pode fornecer resultados que os estudos paralelos de MX de alta resolução. O grande sucesso atual no ramo crio-EM da biologia estrutural é chamado de análise de partículas únicas (SPA), que adquire imagens de projeção 2D tipicamente de um espécime de proteína purificado18 para obter milhares de visualizações de uma macromolécula biológica19. Essas imagens (1) contêm informações de uma gama de visualizações que representam plenamente as orientações do alvo no espaço 3D e (2) capturam a heterogeneidade conformacional do objeto, que pode ser posteriormente separada e investigada.
Uma abordagem alternativa para a aquisição dessas imagens de projeção 2D de amostras biológicas, mesmo in situ e sem purificação, é a tomografia crio-elétron (crio-ET). Cryo-ET tira uma série de imagens do mesmo objeto em ângulos inclinados girando mecanicamente o espécime. Assim, as projeções 2D coletadas em SPA, representando as poses angulares da molécula de interesse, são inerentemente coletadas como parte do experimento de imagem crio-ET20. As séries de inclinação tomográfica são então reconstruídas em um tomograma que contém representações 3D dos complexos macromoleculares imaged. A natureza da coleta de dados tomográficos, em grau, diminui a dependência da média para alcançar uma representação 3D completa de uma molécula a partir de uma coleção de imagens 2D. No entanto, devido aos desenhos de estágio atuais, o espécime é tipicamente inclinado de −60° a +60°, deixando uma cunha faltando21 de informações na reconstrução 3D tomográfica.
As reconstruções 3D em um único tomograma têm uma cunha de informação faltando e baixo sinal para ruído. Macromoléculas individuais podem ser extraídas como subtomogramas e mediadas juntas para lidar com isso. Quando cada macromolécula em um subtomograma é encontrada em uma orientação diferente, a cunha ausente é orientada de forma diferente em cada subtomograma do objeto alvo, portanto, a média de muitas cópias preenche informações devido à cunha faltante. Desenvolvimentos recentes no processamento de imagens também tentaram treinar redes neurais de inteligência artificial para preencher a cunha faltante com dados significativos22. Esse processo de média também aumenta o sinal para ruído, semelhante ao objetivo de média na análise de partículas únicas, para que a qualidade e resolução da reconstrução melhorem. Se a molécula de interesse possui simetria, isso também pode ser definido e empregado durante a média, melhorando ainda mais a resolução da reconstrução. A extração de volumes 3D de uma macromolécula de um tomograma em um conjunto de subtomogramas e seu processamento subsequente é conhecido como média de subtomograma (STA)23. Quando cada subtomograma representa uma cópia única da molécula em estudo, qualquer heterogeneidade estrutural pode ser interrogada usando o fluxo de trabalho STA. Como comumente utilizado no fluxo de trabalho spa, as técnicas de classificação podem ser empregadas durante a STA para dissecar os estados conformais do complexo de interesse. Além da STA permitir a reconstrução de alta resolução no crio-ET, essa abordagem torna a técnica uma ferramenta poderosa para interrogar os mecanismos estruturais das macromoléculas em seu ambiente celular nativo ou de alvos muitas vezes não permitidos ao SPA 24,25,26.
A tomografia eletrônica tem uma longa história de determinar a ultraestrutura 3D de espécimes celulares à temperatura ambiente27. A aquisição de vistas por inclinação física da amostra fornece informações suficientes para a reconstrução 3D de um objeto em escalas de comprimento celular e é particularmente importante quando as estruturas celulares não têm regularidade para a média. As células também podem ser congeladas em substratos para imagens crio-ET nas bordas celulares onde o espécime é fino o suficiente para ser transparente por elétrons. Nessas condições, a STA pode ser empregada para determinar estruturas macromoleculares em um ambiente celular, embora quando o espécime é fino o suficiente para ser elétron transparente28. No entanto, quando combinado com técnicas preparatórias adicionais, incluindo luz crio-correlativa e microscopia eletrônica (crio-CLEM) e moagem de feixe de íons focalizada (crio-FIB), o crio-ET pode ser usado para imagem dentro de células inteiras sob condições criogênicas29. Isso reúne o poder do crio-ET de estudar a ultraestrutura celular com o poder de STA para determinar as estruturas dos complexos macromoleculares in situ , identificando sua localização celular30 e fornecendo instantâneos de complexos envolvidos em processos dinâmicos31. A capacidade da técnica de imagem de amostras celulares e empregar STA em diversos estudos tem destacado o poder da técnica para resolver estruturas macromoleculares in situ, mesmo em resoluções comparáveis ao SPA32. Outro benefício é encontrado no conhecimento da localização original da macromolécula, representada pela reconstrução 3D classificada final no tomograma30. Portanto, a estrutura macromolecular pode ser correlacionada com a ultraestrutura celular. Essas observações em escalas de comprimento presumivelmente levarão a importantes achados onde mecanismos estruturais podem estar correlacionados com mudanças celulares no contexto de estudos funcionais.
Cryo-ET e STA permitem a coleta de dados em três grandes fluxos de trabalho: tomografia molecular, celular e lamella. As estruturas dos complexos macromoleculares purificados podem ser determinadas por crio-ET por tomografia molecular. Determinar estruturas proteicas em seu ambiente celular onde a célula é fina o suficiente pode ser descrito como tomografia celular. Mais recentemente, com o desenvolvimento da segmentação criogênica e da fresagem, essas mesmas técnicas podem ser aplicadas em fluxos de trabalho de tomografia lamella para determinar as estruturas proteicas no interior da célula em seu ambiente nativo, ao mesmo tempo em que revelam o contexto celular em que essas proteínas são observadas. Diferentes estratégias de coleta de dados podem ser usadas dependendo dos pacotes de software disponíveis e, o mais importante, dependendo da exigência da amostra. Amostras moleculares ou não aderentes em uma grade TEM de cobre de uma proteína purificada normalmente requerem menos manuseio e, portanto, permanecem planas e não danificadas em casos ideais. Os tomogramas de elétrons podem ser facilmente configurais em série através de uma grade de carbono furado para adquirir rapidamente dezenas a centenas de tomogramas de forma sistemática. A maneira mais simples para os usuários configurarem amostras de tomografia molecular onde as proteínas estão abundantemente presentes na rede seria usar o Tomo5 (software para tomografia eletrônica 3D usado no presente estudo, ver Tabela de Materiais). Outros softwares de tomografia, como Leginon9 e serialEM6, também estão disponíveis; eles oferecem mais opções de configuração para abordagens mais personalizadas para coleta de dados, mas são mais complexas e, consequentemente, podem ser mais difíceis de navegar, especialmente para usuários novos para tomografia e usuários acessando sua sessão remotamente. Para uma instalação com uma grande e diversificada base de usuários, o Tomo5 é fácil de operar em um ambiente remoto e treinar os usuários. Para células aderentes, as grades normalmente requerem mais etapas de manuseio, e a necessidade de usar grades de ouro frágeis aumenta a necessidade de um melhor cuidado nas estratégias de manuseio e coleta de dados. Para facilitar encontrar uma região celular de interesse e evitar a oclusão da própria rede em ângulos de inclinação alta, também é benéfico usar tamanhos de malha maiores, mas ao custo de que eles são inerentemente mais frágeis. Para as amostras de lamella, a fragilidade da amostra é determinada pela qualidade da lamella, que pode ser variável. Esses fatores aumentam o tempo de configuração e considerações, mas o aumento da adaptabilidade e robustez tornam o Tomo5 adequado para esse tipo de coleta de dados. No entanto, existem cenários especializados de coleta de dados para cada fluxo de trabalho. BISECT e PACE-tomo (ambos executados em SerialEM) introduz a possibilidade de mudança de imagem de feixe roteirizada durante a aquisição da tomografia para aumentar a velocidade de coleta de tomograma28, particularmente na tomografia molecular. Montagens médias de ampliação (MMM) em SerialEM 6,7,33 podem identificar melhor e direcionar com precisão características moleculares em todos os fluxos de trabalho, embora, no momento da escrita, essas características estejam começando a ser implementadas no Tomo5.
Assim como o SPA, o crio-ET e o STA estão se tornando cada vez mais acessíveis através das melhorias feitas no software de aquisição e uma riqueza de pacotes disponíveis para subtomograma, com média de 16,17,32,34,35,36,37,38. Além disso, durante a pandemia, permitir o acesso remoto à instrumentação crio-EM tornou-se essencial para a operação contínua de instalações nacionais como o Electron Bio-Imaging Centre (eBIC) na Diamond Light Source (DLS), Reino Unido. Esses desenvolvimentos tornaram o crio-ET mais acessível e robusto para pesquisadores que desejam utilizar a técnica. Uma vez adquiridos dados, o STA é uma ferramenta essencial para analisar objetos recorrentes para obter a reconstrução máxima da resolução e permitir a classificação da heterogeneidade macromolecular. O protocolo atual visa fornecer um passo-a-passo detalhado da preparação de um microscópio crio-TEM para coleta de dados crio-ET e como realizar a média do subtomograma usando a emClaridade em um conjunto de dados de tomografia molecular de apoferritina como exemplo. O uso de emClarity (software para tomografia crio-elétron de alta resolução e média de subtomograma, ver Tabela de Materiais) requer a execução de scripts da linha de comando, de modo que um nível de familiaridade com sistemas Linux/UNIX é assumido.
A conexão remota depende do ambiente de rede em cada instituto/instalação. No eBIC, o sistema remoto usa programas que permitem a coleta remota de dados na configuração específica da rede usada na Diamond. A conexão remota com o microscópio é facilitada por duas plataformas: NoMachine e TeamViewer (ver Tabela de Materiais). Usando o programa NoMachine, o usuário pode entrar em uma área de trabalho remota do Windows. A área de trabalho remota do Windows fornecida pelo NoMachine reside na mesma rede do microscópio e, portanto, atua como um PC de suporte virtual para o microscópio. A partir do PC de suporte virtual, o usuário se conecta ao microscópio via TeamViewer fornecendo acesso direto e controle ao pc de microscópio executando TUI e Tomo.
O presente protocolo consiste em duas partes (etapa 1 e etapa 2). A etapa 1 se concentra na aquisição remota de dados crio-ET usando o Tomo5 (software para tomografia eletrônica 3D). O passo a passo para uma sessão (remota) captura imagens em ampliações cada vez mais altas para, em última análise, permitir que o usuário direcione o software de tomografia para direcionar áreas de espécimes para coleta de dados tomográficos. A Figura 1 resume esse processo. A etapa 2 detalha o processamento de dados crio-ET STA usando emClarity (software para tomografia crio-elétron de alta resolução e média de subtomograma). A Figura 9 resume esse processo.
O protocolo é destinado a uma audiência remota. Ele assume que a pessoa fisicamente no microscópio e carregando as amostras fez os alinhamentos diretos e cuidou da sintonia da câmera e ganhar aquisição de referência. Para este protocolo, um sistema de lente de três condensadores com um carregador automático é assumido. Para obter mais diretrizes detalhadas sobre o software de tomografia, um manual detalhado do fabricante está disponível no botão Windows Start de onde o software foi carregado.
Protocolo
Os pacotes de software utilizados neste estudo estão parcialmente disponíveis livremente (ver Tabela de Materiais).
1. Aquisição remota de dados crio-ET usando Tomo5
- Se o software não estiver carregado, comece iniciando este software a partir do PC servidor TEM (ver Tabela de Materiais).
- Realize verificações iniciais e configure a condição de imagem selecionando Predefinições.
- Inicie a configuração da sessão ajustando os parâmetros de aquisição de imagem na guia "Preparação" em Predefinições (Figura 2A,B).
- Ajuste a "ampliação da visão geral" para se adequar ao tamanho da grade quadrada e dose para obter contagens adequadas.
NOTA: Se a ampliação adequada for desconhecida para o tipo de grade, retorne a esta etapa após o carregamento de uma grade. - "Altura Eucêntrica" e "Ampliação de Pesquisa" podem ser as mesmas. Clique em Pesquisar na aba "Tomografia" para configurar posições e garantir que a ampliação seja suficiente para mostrar a marca de interesse e se encaixar na área "Exposição" e "Rastreamento/Foco" no campo de visão (Figura 2C).
- Defina "Ampliação de exposição" ao tamanho do pixel alvo desejado. Se isso for desconhecido, estabeleça-o ajustando a ampliação ao campo de visão desejado para se adequar à região de interesse.
- Ajuste a "ampliação da visão geral" para se adequar ao tamanho da grade quadrada e dose para obter contagens adequadas.
- Copie os parâmetros de aquisição de imagens (Exposição) para todas as outras predefinições de alta ampliação (Rastreamento, Drift, Focus, Thon Ring, Zero Loss,). Para isso, pressione Defina "Exposição" ao microscópio e Obtenha as "Configurações de exposição" para todas as outras altas ampliações depois de selecioná-las individualmente.
- Ajuste os tempos de exposição, especialmente para "Foco" e "Rastreamento" para dar um número adequado de contagens, considerando também a espessura em 60°, o que significa tanto a 0° quanto 60°, para que elétrons suficientes passem pela amostra para fornecer um forte sinal de correlação cruzada.
NOTA: Como estimativa, os tempos de exposição para "Rastreamento" e "Foco" iguais à predefinição de "Exposição" são uma boa primeira medida. Para obter um exemplo de cálculo de dose para a predefinição "Exposição", consulte a Figura 3. Defina o tempo de exposição calculado para a predefinição "Exposição" na guia "Preparação".
- Ajuste os tempos de exposição, especialmente para "Foco" e "Rastreamento" para dar um número adequado de contagens, considerando também a espessura em 60°, o que significa tanto a 0° quanto 60°, para que elétrons suficientes passem pela amostra para fornecer um forte sinal de correlação cruzada.
- Ajuste o "Predefinito de Perda Zero" para usar um tamanho de ponto mais brilhante e maior (um tamanho maior de manchas corresponde a um número menor), pois isso precisa de uma dose maior.
NOTA: Esta predefinição é melhor usada para alinhar a fenda do filtro de energia se estiver presente no microscópio.
- Inicie a configuração da sessão ajustando os parâmetros de aquisição de imagem na guia "Preparação" em Predefinições (Figura 2A,B).
- Realize a coleta atlas seguindo as etapas abaixo.
- Para coletar um atlas, clique em Nova Sessão na guia "Atlas", defina as preferências da sessão, digite o caminho de armazenamento e o formato de saída e pressione Aplicar. Selecione A triagem (Figura 4) e, em seguida, marque todos os atlas para serem adquiridos. Selecione Válvulas de col fechado para deixar o microscópio sem supervisão; isso fechará as válvulas da coluna depois que todos os atlas selecionados forem coletados. Para iniciar a triagem, pressione o botão Iniciar.
- Inspecione os atlas únicos ou múltiplos para obter alvos clicando na grade do painel esquerdo em "Triagem" (Figura 4), em seguida, clique à esquerda e arraste o mouse para se mover e rolar para ampliar e sair. Escolha grade para configuração de destino, selecione-a e clique em Coletar amostras de carga dentro do software.
- Para as calibrações de mudança de imagem, continue usando a guia de triagem atlas para navegar dentro da grade carregada. Encontre um recurso identificável que será reconhecível em todas as predefinições de ampliação, ou seja, um cristal de gelo sobrepondo-se com uma borda de um buraco ou outra característica reconhecível (Figura 5). Mova-se para esse quadrado por um clique direito do mouse, em seguida, "Mova o palco para grid square".
NOTA: O estágio precisa estar na altura eucêntrica para implementar as calibrações de mudança de imagem corretamente.
- Execute a calibração da mudança de imagem.
- Na aba "Funções automáticas" (Figura 6), defina a predefinição para "Altura Eucêntrica", navegue até "Auto-Eucentric by Stage Tilt" e pressione Start. Monitore a janela de status para garantir que a altura eucêntrica seja bem sucedida e fique de olho nas imagens de inclinação positiva e negativa; eles devem se correlacionar.
NOTA: A partir da versão 5.8 do software Tomo, o critério para aceitação de altura eucêntrica pode ser modificado; o padrão é de 0,25 μm, e defini-lo para 0,5-0,8 μm dá mais margem de manobra. Os valores dependem do desempenho do microscópio, mas é recomendado que eles sejam o menor possível.- Quando em altura eucêntrica e em foco, centralizar o palco em uma característica. Colete uma visualização usando a predefinição "Atlas". Defina todas as "Predefinições" da guia "Preparação". Posteriormente, aumente a ampliação para o recurso de centro de visão geral > > Visualização, em seguida, repita "Ampliação de pesquisa" e, finalmente, "Ampliação de Exposição".
- Se o recurso permanecer centrado durante o direcionamento, pule as calibrações de mudança de imagem. Caso contrário, para calibrar a mudança de imagem, vá para a guia "Preparação", selecione Calibrar a mudança de imagem e pressione Iniciar (Figura 5). Isso alinhará iterativamente ampliações mais baixas ao recurso centrado na ampliação da exposição.
NOTA: Se a predefinição inicial "Exposição" não estiver centrada nesta fase, para a recentring, o software usará o shift de palco apenas para esta etapa.- Pressione Proceder para a predefinição de "Exposição". A próxima imagem mostrada será a "Pré-set de pesquisa". Para calibrar a mudança de imagem entre as predefinições, clique duplo à esquerda na visualização "Pesquisar" para onde está o centro da visualização "Exposição" e pressione Re-acquire (Figura 5). Clique em Prosseguir para mover-se para o próximo par de predefinições.
NOTA: Se uma mudança de imagem na ampliação do atlas foi aplicada durante esta calibração, certifique-se de reaproscar o atlas após a calibração da mudança de imagem ter sido concluída. Selecione o atlas desejado e pressione Redefinir Selecionado no painel superior na guia "Atlas". Confirme e comece a adquirir o atlas novamente.
- Pressione Proceder para a predefinição de "Exposição". A próxima imagem mostrada será a "Pré-set de pesquisa". Para calibrar a mudança de imagem entre as predefinições, clique duplo à esquerda na visualização "Pesquisar" para onde está o centro da visualização "Exposição" e pressione Re-acquire (Figura 5). Clique em Prosseguir para mover-se para o próximo par de predefinições.
- Na aba "Funções automáticas" (Figura 6), defina a predefinição para "Altura Eucêntrica", navegue até "Auto-Eucentric by Stage Tilt" e pressione Start. Monitore a janela de status para garantir que a altura eucêntrica seja bem sucedida e fique de olho nas imagens de inclinação positiva e negativa; eles devem se correlacionar.
- Faça a tomografia.
- Crie a configuração de coleta de dados de tomografia na guia "Tomografia".
NOTA: Salvo indicado especificamente, a configuração é feita totalmente na guia "Tomografia". - Comece uma nova sessão. Em "Configuração de sessão" para amostras biológicas, escolha slab-like como o tipo de amostra e selecione Batch e Low Dose, selecione o formato de saída e pasta de armazenamento, adicione opcionalmente um destinatário de e-mail e, em seguida, pressione Aplicar.
NOTA: Um item do menu "Posições em Lote" agora está disponível (Figura 7A). O atlas atualmente carregado é importado automaticamente. "Visão geral" e "Pesquisar imagens" podem ser adquiridas e revisitadas até que uma nova imagem seja adquirida. Além disso, a partir da versão 5.8, mapas de pesquisa de 3 x 3, 4 x 4 e 5 x 5 podem ser adquiridos com "Acquire Search Map" para facilitar a localização e configuração do alvo. Correspondem a uma versão de montagens de ampliação média. - Para configurar os alvos, vá até a "seta Atlas", encontre uma região de interesse e mova-se para lá selecionando as opções que aparecem com um clique do mouse direito. Faça uma imagem geral para confirmar uma boa posição para ajuste de altura eucêntrico e pressione o Auto Eucentric; isso vai executar o eucêntrico pela rotina de inclinação de palco. Em seguida, reaprodam uma nova imagem de visão geral para atualizar a altura eucêntrica.
NOTA: O botão "Auto Focus" não deve ser necessário se a posição estiver na altura eucêntrica. Se a imagem de altura eucêntrica aparecer muito fora de foco, a altura eucêntrica provavelmente não está correta e precisa ser refeita (para solução de problemas de altura eucêntrica, veja a seção de discussão). - Verifique o destino usando a predefinição "Visão geral" antes de configurar a primeira posição; selecione a predefinição "Visão geral" e incline o palco para ±60° para verificar qual distância das barras de grade as posições podem ser configuradas (Figura 8). Execute isso digitando o valor de ângulo de inclinação desejado na janela "Definir inclinação" (Figura 8A).
- Inspecione a praça "Visão geral" ou o "Mapa de Pesquisa" adquirido, mova-se para uma região de interesse e pressione a Pesquisa de Aquisição. Inspecione a imagem "Pesquisar". Se a região de interesse não estiver centrada, clique à direita na posição desejada e, em seguida, repita Mover o Estágio Aqui e Adquirir imagem. Defina inclinar (°) para 0,00 (ou qualquer outro ângulo de partida que o estágio possa suportar) para definir o ângulo de partida do tomograma.
- Para o primeiro tomograma, digite o Nome para a convenção de nomeação de tomograma desejada e o Defocus para definir o valor de desfoco desejado para cada tomograma.
- Opcionalmente, a partir da versão 5.8 do Tomo em diante, os valores de desfoco podem ser sistematicamente alterados de uma só vez; para isso, clique em Selecionar posições, selecione as posições a serem alteradas ou marque a marca de verificação para selecionar todas as posições e clique em Desfocus de atualização e ajuste os parâmetros (Figura 7A).
- Ajuste a área "Foco" e "Rastreamento" (Figura 2C). Clique à esquerda para arrastar as áreas de rastreamento e foco (círculos amarelo e azul). Certifique-se de que a área de rastreamento/foco esteja (principalmente) em carbono ou outro recurso de rastreamento adequado, ou seja, um recurso semelhante à região de interesse; evitar rachaduras, contaminação do gelo, regiões excessivamente grossas e buracos vazios.
- Ao escolher carbono em branco sem muitas características de rastreamento, certifique-se de que a área comece a queimar no meio do tomograma, escolhendo uma dose alta o suficiente para o foco, e rastreamento para queimar lentamente a amostra em inclinações mais altas. Isso pode ser benéfico para manter a precisão de rastreamento. Certifique-se de que a área de rastreamento/foco não exponha uma área de aquisição posterior.
NOTA: Tenha cuidado com o que está próximo e o que entrará na viga. Evite áreas com recursos que intervenham com rastreamento e/ou exposição, incluindo barras de grade.
- Ao escolher carbono em branco sem muitas características de rastreamento, certifique-se de que a área comece a queimar no meio do tomograma, escolhendo uma dose alta o suficiente para o foco, e rastreamento para queimar lentamente a amostra em inclinações mais altas. Isso pode ser benéfico para manter a precisão de rastreamento. Certifique-se de que a área de rastreamento/foco não exponha uma área de aquisição posterior.
- Pressione Adicionar posição uma vez que todos os parâmetros são definidos e a região de interesse desejada e "Foco" e "Rastreamento" são definidos. Repita para novos alvos.
NOTA: Para verificar se a altura eucêntrica está corretamente calibrada para as posições em lote que foram configuradas, existem várias estratégias disponíveis. Recomenda-se a escolha de uma com base no tipo de sessão de tomografia realizada (molecular, celular, lamella). - Para a tomografia molecular, supondo que as grades sejam bastante planas e a altura eucêntrica tenha sido feita no centro de cada quadrado contendo posições-alvo, pule o procedimento "Refine All" (ou Refine Selected se as posições tiverem sido selecionadas, Figura 7A). Se Tomo se esforça com a rotina auto-eucêntrica por inclinação de palco, possivelmente clique em Skip Eucentric.
- Para amostras de celular ou lamella, cada posição do lote pode estar em uma altura z diferente. Use "Refine All" para ser cauteloso ou não marcar a opção "Skip Eucentric".
NOTA: "Refinar tudo" será iterado através de todos os tomogramas que foram configurados ou selecionados através de "Posições Selecionadas"; refinar a altura eucêntrica e realizar o rastreamento e o foco antes da aquisição de dados. Este procedimento pode expor qualquer exposição sobreposta da próxima região de foco/rastreamento do tomograma (Figura 7B), que deve ser considerada antes de prosseguir. - Verifique e reveja as praças que falharam no refinamento. Com o botão direito do mouse, clique na posição falha para ver as opções. Se a altura eucêntrica falhar, encontre "Auto-eucentric by stage-tilt" (passo 1.4.1.), adquira uma nova imagem "Pesquisar" para atualizar a altura z e "Adicionar posição". Exclua a posição inicializada com falha/anteriormente. Clique na opção Skip Eucentric , que foi feita com "Refine all".
NOTA: Se "Refinar Tudo" não for executado, então "Skip Eucentric" não deve ser verificado. O Tomo5 executará o refinamento eucêntrico antes que cada tomograma seja adquirido; desta forma, posições que falham no refinamento eucêntrico serão ignoradas.
- Para amostras de celular ou lamella, cada posição do lote pode estar em uma altura z diferente. Use "Refine All" para ser cauteloso ou não marcar a opção "Skip Eucentric".
- Crie a configuração de coleta de dados de tomografia na guia "Tomografia".
- Execute funções automáticas seguindo as etapas abaixo.
- Verifique as configurações para realizar os alinhamentos através da guia "Funções Automáticas", navegando no atlas até uma área de carbono. Leve essa área à altura eucêntrica e siga a ordem dos alinhamentos conforme indicado abaixo.
- Execute auto-eucentric por inclinação de palco com predefinição "Eucentric Height".
- Execute a rotina de foco automático com a predefinição "Focus".
- Execute a rotina do Autostigmate com a predefinição "Thon Ring".
- Execute a rotina autocoma com a predefinição "Thon Ring".
- Insira a abertura objetiva desejada (Figura 6B), provavelmente a abertura de 100 μm, como um bom compromisso para o aumento do contraste amostral e apenas um pequeno corte no sinal em resolução muito alta.
- Repita a rotina do Autostigmate após a inserção de abertura.
NOTA: Em ampliações com tamanhos de pixels em torno de 3 Å e resoluções inferiores, a rotina do Autocoma pode falhar; neste caso, verifique e alinhe o Tomo Rotation Center sob os Alinhamentos Diretos na interface do usuário TEM.
- Verifique se a rotina de centro de perda zero automática funciona em sua amostra. Com a predefinição "Zero Loss" em uma dose razoavelmente alta (passo 1.2.3), a rotina em Funções Automáticas provavelmente terá sucesso.
- Verifique as configurações para realizar os alinhamentos através da guia "Funções Automáticas", navegando no atlas até uma área de carbono. Leve essa área à altura eucêntrica e siga a ordem dos alinhamentos conforme indicado abaixo.
- Realizar a coleta de dados.
- Para iniciar a aquisição automatizada na guia "Tomografia", selecione a laje de Aquisição de Dados e defina os parâmetros desejados (Figura 7C). Configure os parâmetros de aquisição de dados: Tilt Step (°), Max. Positive Angle (°), Max. Negative Angle (°), esquema de rastreamento (recomendado: selecionar Track/Focus Antes da Aquisição). Selecione Válvulas de coluna fechada para obter um esquema de altura eucêntrico.
NOTA: Os parâmetros raramente utilizados são "Ajuste o tempo de exposição", "Ajuste ZLP", "Use placa de fase" e "Pausa após inclinação".- Use o Tempo de Exposição de Ajuste para tomogramas que não são destinados ao STA para aumentar o tempo de exposição em uma razão especificada em inclinações mais altas.
- A opção Ajustar ZLP executará um refinamento ZLP após cada tomograma, não importa o conjunto de periodicidade. É lento, ocasionalmente falha sem razões óbvias, e vai pular essa posição de aquisição. No entanto, pode ser útil para largura de fenda muito estreita, ou seja, 3-5 eV em um filtro Selectris(X).
- Use A placa de fase é raramente utilizada desde a introdução de DEDs com filtros de energia.
- Pausa Após a inclinação pausa a aquisição, mas não permite alterações no software.
- Verifique novamente os parâmetros de coleta de dados (na guia "Preparação"), concorde com o cálculo da dose e o esquema de inclinação desejado, especifique o número de Frações (Nr.) na predefinição de "Exposição" e, em seguida, comece a aquisição.
NOTA: O número de frações depende da amostra, dos parâmetros de aquisição e das etapas planejadas pós-processamento, ou seja, análise STA vs. morfológica, e deve ser mantido em valores onde a correção de movimento e a estimativa de CTF obtenham sinal suficiente. Uma faixa de 4-10 frações é uma boa estimativa, onde 4 é mais adequado para amostras mais grossas e 10 para amostras moleculares mais finas.- Em seguida, clique em Iniciar a coleta de dados e monitore a primeira aquisição de tomograma para garantir que os tomogramas sejam adquiridos conforme o planejado.
NOTA: Versões recentes do software de tomografia têm uma laje adicional do Movie Player na guia "Tomografia", onde os tomogramas adquiridos podem ser assistidos. Seja paciente durante o processo de carregamento.
- Em seguida, clique em Iniciar a coleta de dados e monitore a primeira aquisição de tomograma para garantir que os tomogramas sejam adquiridos conforme o planejado.
- Para iniciar a aquisição automatizada na guia "Tomografia", selecione a laje de Aquisição de Dados e defina os parâmetros desejados (Figura 7C). Configure os parâmetros de aquisição de dados: Tilt Step (°), Max. Positive Angle (°), Max. Negative Angle (°), esquema de rastreamento (recomendado: selecionar Track/Focus Antes da Aquisição). Selecione Válvulas de coluna fechada para obter um esquema de altura eucêntrico.
2. Crio-ET STA de apoferritina usando emClarity
NOTA: Aqui, o software emClarity17 é usado para ilustrar a determinação da estrutura crio-ET pela STA. A Figura 9 resume esse processo. Seis séries inclinadas de apoferritina (EMPIAR-10787) foram tomadas como exemplo. A simetria octadista foi aplicada, e o mapa final teve uma resolução de 2,86 Å, obtida de apenas 4.800 partículas e próxima à frequência nyquista (2,68 Å).
- Certifique-se de que o pacote de software emClarity39 seja baixado e instalado (ver Tabela de Materiais). Instale o IMOD para o processamento do software40.
NOTA: É necessário conhecimento básico dos comandos Linux. Um tutorial mais detalhado pode ser encontrado na referência41, que toma um conjunto de dados ribossomo (EMPIAR-10304) como exemplo e descreve os procedimentos passo a passo. Para diferentes tipos de amostras de proteína, um relatório publicado anteriormente também está disponível42. - Prepare os arquivos de entrada e diretórios.
NOTA: Os quadros brutos foram corrigidos por MotionCor2 (patch 5 x 5)43 (ver Tabela de Materiais). As imagens corrigidas por movimento foram empilhadas para gerar a série de inclinação usando newstack (IMOD) e alinhadas manualmente com o rastreamento de patches usando Etomo (ver Tabela de Materiais), seguido por emClarity. Para obter melhores alinhamentos, recomenda-se realizar compensações e compensação de inclinação em Etomo. As séries de seis inclinações são renomeadas como TS1 para TS6. Abaixo estão as instruções e comandos para a primeira série de inclinação (TS1) como exemplo.- Estabeleça uma pasta de projeto.
NOTA: A versão mais recente do software é 1.5.3.11. Todos os registros de software relacionados podem ser encontrados na pasta de projeto local (.../logFile/emClarity.logfile). - Na pasta do projeto, faça outra nova pasta, "fixedStacks", e prepare os arquivos de entrada: TS1.fixed, TS1.xf e TS1.tlt.
NOTA: TS1.fix: a série de inclinação original, também conhecida como TS1.st em Etomo. TS1.xf: este arquivo contém as coordenadas de transformação após o tiltalign Etomo. TS1.tlt: este arquivo contém ângulos de inclinação.
- Estabeleça uma pasta de projeto.
- Estime o desfoco seguindo os passos abaixo.
- Calcule o desfoco. Atualize o arquivo do parâmetro com o microscópio e parâmetros de imagem seguindo a Tabela Complementar 1. Copie um arquivo de parâmetro para a pasta do projeto, altere seu nome para param_ctf.m e execute: emClarity ctf estima param_ctf.m TS1.
NOTA: O modelo de arquivo do parâmetro pode ser encontrado no Arquivo Suplementar 1 ou no diretório local de instalação de software (.../emClarity_1.5.3.11/docs/exemploParametrosAndRunScript/).
- Calcule o desfoco. Atualize o arquivo do parâmetro com o microscópio e parâmetros de imagem seguindo a Tabela Complementar 1. Copie um arquivo de parâmetro para a pasta do projeto, altere seu nome para param_ctf.m e execute: emClarity ctf estima param_ctf.m TS1.
- Verifique os resultados de estimativas da CTF para cada pilha.
- Verifique as pilhas alinhadas (por exemplo, aliStacks/TS1_ali1.fixed) usando 3dmod e certifique-se de que as contas fiduciárias sejam apagadas corretamente.
- Certifique-se de que o arquivo de registro informa a destreza está correta, o que pode ser encontrado em logfile/emClarity.logfile (Figura 9).
- Verifique o valor do desfoco (por exemplo, fixoSS/ctf/TS_ali1_psRadial_1.pdf) e certifique-se de que corresponde à estimativa teórica do CTF.
- Defina as sub-regiões.
- Gere um tomograma binned. Na pasta do projeto, execute: sh recScript2.sh -1.
NOTA: Um tomograma menor (em tamanho) para cada pilha será armazenado em uma nova pasta "bin10". Para acelerar o processo, as coordenadas de uma ou várias sub-regiões podem ser definidas em um tomograma bin10. O arquivo de script estará no diretório local de instalação de software (.../emClarity_1.5.3.11/docs/). - Determine os limites escolhendo seis pontos, xmin, xmax, ymin, ymax, zmin e zmax, para criar uma sub-região. Na pasta "bin10", execute: 3dmod TS1_bin10.rec.
NOTA: Se quatro sub-regiões forem criadas em uma série de inclinação, escolha 6 × 4 = 24 pontos. Cada pilha deve ter um arquivo modelo (*.mod) sob a pasta "bin10". - Converta os arquivos do modelo para o formato emClarity. Isso criará um novo reconhecimento de pasta. Armazene todas as coordenadas de cada sub-região sob esta pasta. Na pasta do projeto, execute: sh recScript2.sh TS1.
- Gere um tomograma binned. Na pasta do projeto, execute: sh recScript2.sh -1.
- Escolha partículas.
- Encontre um modelo de apoferritina para colher partículas. Baixe um modelo do Electron Microscopy Data Bank (EMD-10101)44. Certifique-se de que o tamanho do pixel do modelo corresponde ao dos dados brutos. Na pasta do projeto, execute: emClarity rescale ApoF.mrc ApoF_Template_rescale.mrc 3.60 1.34 cpu.
- Gerar tomografias corrigidas por CTF para a colheita de partículas. Na pasta do projeto, execute: emClarity ctf 3d param_ts.m templateSearch.
- Executar a colheita de partículas para cada sub-região. Para o conjunto de dados de apoferritina, realize uma pesquisa de modelo no bin6. Modifique os parâmetros Tmp_angleSearch (φout, Δout, φin, Δin) para determinar o alcance de ângulo e intervalos para a busca no plano ou fora do avião em graus. Na pasta do projeto, execute: modelo emClaritySearch param_ts.m TS1 1 ApoF_Template_rescale.mrc O 1.
NOTA: Uma pasta "convmap_wedge_Type2_bin6" será gerada nesta etapa. O arquivo csv sob esta pasta (por exemplo, TS1_1_bin6.csv) inclui todas as informações sobre as partículas colhidas. - Remova as partículas incorretas usando 3dmod. Na pasta "convmap_wedge_Type2_bin6", execute: 3dmod .. /cache/TS1_1_bin6.rec TS1_1_bin6.mod.
NOTA: É comum encontrar partículas erradas próximas a bordas de carbono ou contaminações de gelo nessas áreas. Execute um mouse direito clique nos pontos incorretos e pressione o backspace no teclado para excluí-los. Nesta etapa, certifique-se de que a maioria dos pontos falsos positivos sejam removidos (Figura 10). - Altere o nome da pasta "convmap_wedge_Type2_bin6" para "convmap", pois a emClaridade irá e encontrará informações de sub-região sob convmap nas etapas seguintes.
- Inicialize o projeto. Na pasta do projeto, execute: emClarity init param0.m, para criar um banco de dados para emClarity, ApoF.mat.
- Realize a reconstrução de tomogramas antes da STA e alinhamento. Para gerar tomogramas de sub-região corrigidos pelo CTF na bin4, execute: emClarity ctf 3d param0.m.
NOTA: Os tomogramas corrigidos pelo CTF (por exemplo, cache/TS1_1_bin4.rec) serão gerados em uma nova pasta "cache". - Executar STA e alinhamento.
- Realize a média usando os sub-tomogramas corrigidos pelo CTF a partir de bin4. Na pasta do projeto, execute: emClarity avg param0.m 0 RawAlignment.
- Continue fazendo alinhamentos e executar: emClarity alignRaw param0.m 0.
NOTA: A etapa média gera uma referência, que será usada pela emClaridade nesta etapa para alinhar as partículas. Os parâmetros Raw_angleSearch (φout, Δout, φin, Δin) podem ser alterados para definir a faixa de ângulo e tamanhos de passo para cada ciclo. Como a maioria das partículas incorretas são removidas do banco de dados (Passo 2.6.4), essas configurações angulares para alinhamento podem começar com um grau relativamente pequeno. - Atualize os parâmetros Raw_angleSearch e execute mais alguns ciclos (Etapas 2.9.1 e 2.9.2). Para acelerar o processo, realize alinhamentos dentro e fora do avião separadamente.
NOTA: Para cada binning, recomenda-se executar vários ciclos e reduzir gradualmente as configurações angulares. Para o conjunto de dados ApoF, foram realizados mais cinco ciclos na caixa 4, e mais detalhes estão disponíveis na Tabela Suplementar 2. Para o cycle001, na pasta do projeto, execute: emClarity avg param1.m 1 RawAlignment, seguido por emClarity alignRaw param1.m 1. - Limpe as partículas sobrepostas. Na pasta do projeto, execute: emClarity removeDuplicates param5.m 5.
- Execute o refinamento da série Tilt com tomoCPR.
NOTA: Esta etapa é opcional.- Corra para o tomoCPR para refinar a geometria da pilha. Na pasta do projeto, execute: emClarity tomoCPR param5.m 5.
- Gere pilhas recém-alinhadas e atualize os arquivos de geometria. Na pasta do projeto, executar: emClarity CTF update param6.m.
NOTA: Certifique-se de que os novos arquivos de geometria (por exemplo, fixosStacks/ctf/TS1_ali2_ctf.tlt) e as pilhas recém-alinhadas (por exemplo, aliStacks/TS1_ali2.fixed) sejam corretamente gerados. - Crie novos sub-tomogramas no bin2. Na pasta do projeto, executar: emClarity ctf 3d param6.m.
NOTA: Este será seguido por alguns ciclos para média e alinhamento no bin2 (etapas 2.9.1, 2.9.2 e 2.9.3), limpeza duplicada (etapa 2.9.4) e tomoCPR opcional (passo 2.10). Devido à alta simetria, outros cinco ciclos na bin2 foram realizados para apoferritina. Atualize os parâmetros de Raw_angleSearch para cada ciclo.
- Faça a reconstrução final.
- Continue a rodar alguns ciclos em bin1 e tomoCPR (Passo 2.9 e Passo 2.10). Outros 10 ciclos a mais na bin1 foram realizados para o conjunto de dados de apoferritina. Mais detalhes sobre os comandos e parâmetros podem ser encontrados na Tabela 2.
- Realize a reconstrução final combinando os dois conjuntos de dados de metade. Na pasta do projeto, execute: emClarity avg param21.m 21 RawAlignment, seguido pela emClarity avg param21.m 21 FinalAlignment.
NOTA: Será gerado o mapa final (por exemplo, com fator B de 10, cycle021_ApoF_class0_final_bFact-10.mrc), Figura 11.
Resultados
Para amostras de celular e lamella, a estratégia de coleta de dados depende em grande parte da amostra e do objetivo do estudo de imagem (Figura 1). A abordagem de alvo depende se o alvo molecular está in situ ou preparado a partir do complexo macromolecular purificado para espécimes de reconstrução de alta resolução contendo alvos moleculares. Para complexos purificados vitrificados em redes furadas (carbono), o alvo pode ser simplesmente baseado em imagens nos orifícios do filme de suporte (carbono). Para o trabalho in situ , a abordagem de direcionamento requer conhecimento da localização da entidade molecular com base em dados correlativos ou marcos celulares conhecidos de baixa ampliação. Os marcos celulares seriam idealmente identificáveis ao tirar imagens de visão geral e, se suficientes para localizar aproximadamente regiões de interesse, podem fornecer uma maneira rápida de confirmar a identidade do alvo com uma imagem de pesquisa. No entanto, se os eventos observáveis forem raros, então imagens médias de pesquisa de ampliação podem ser necessárias para qualificar o alvo está correto. Mapas de pesquisa são montagens de ampliação média de imagens de pesquisa e podem, assim, tornar a localização do alvo muito mais fácil, onde elas podem ser adquiridas em uma ampliação na qual a característica de interesse é visível. Os mapas de pesquisa podem então ser selecionados para encontrar e configurar posições de lote alvo. Para espécimes contendo características celulares para reconstrução ultraestrutural, a abordagem de segmentação é semelhante, embora igualmente dependente da visibilidade do evento celular em várias ampliações e sua prevalência na amostra.
A estratégia de aquisição de dados também deve ser considerada; em todos os casos, o objetivo do estudo determina em grande parte como os dados são coletados. Para a reconstrução da ultraestrutura celular, uma baixa ampliação (20-5 Å/px) e um grande campo de visão podem ser apropriados, mas altas ampliações são necessárias para reconstruir detalhes moleculares ou de alta resolução (5-1 Å/px). Um conjunto de dados coletado a 1,5 Å/px em condições ideais só poderá produzir fisicamente uma reconstrução na frequência nyquist de 3,0 Å/px; no entanto, na realidade, muitos fatores, incluindo, mas não se limitando à espessura, tamanho e heterogeneidade do espécime, todos afetam a qualidade da reconstrução obtida. Os parâmetros exatos de imagem também equilibram a ampliação com base no objetivo do estudo com o campo de visão para conter informações suficientes. Este artigo apresenta um caso de média de subtomograma que atinge 2,86 Å, mas estudos adicionais 17,42,43,44,45 são apresentados na Tabela 1 para ilustrar os parâmetros de coleta associados a estudos que visam diferentes desfechos 17,42,45,46.
Uma vez estabelecido um regime de fluxo de trabalho e aquisição de dados para crio-ET, a coleta de dados de muitos tipos de amostra diferentes é possível. São apresentados tomogramas representativos de uma variedade de espécimes: amostras moleculares como apoferritina (Filme 1), processos celulares finos (Filme 2) e lamella moída fib da espessa amostra celular (Filme 3).
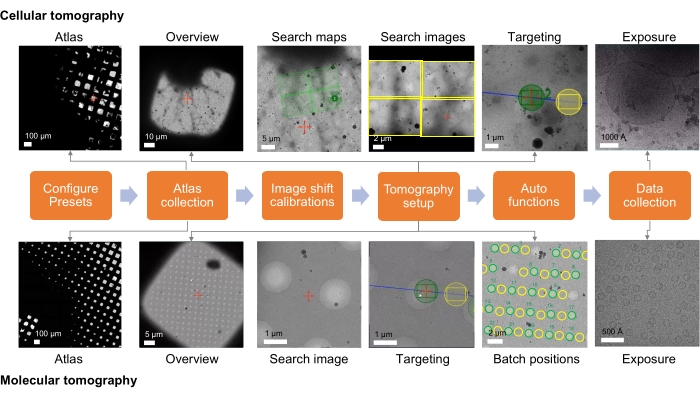
Figura 1: Visão geral da configuração do fluxo de trabalho da tomografia. O fluxo de trabalho de imagem crio-ET descrito no protocolo é mostrado como um fluxograma. As imagens previstas para serem adquiridas são mostradas para o fluxo de trabalho celular e molecular. A nomeação apresentada segue a convenção Tomo5, embora a maioria dos softwares de aquisição de tomografias compartilhe princípios comuns para a coleta dessas imagens. Clique aqui para ver uma versão maior desta figura.
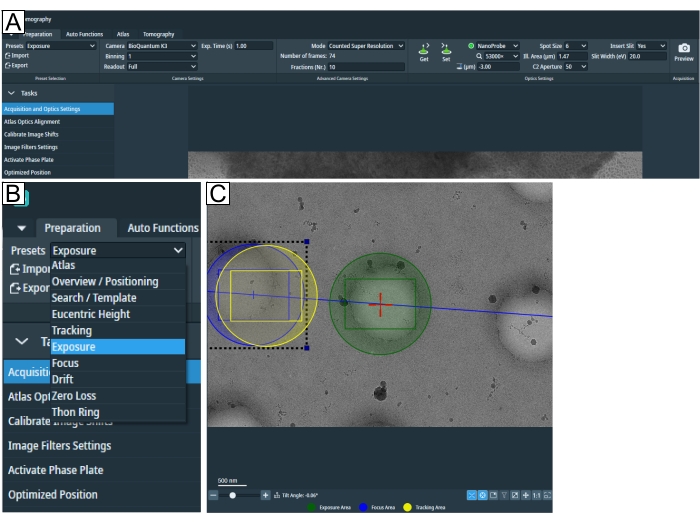
Figura 2: Guia de preparação e condições de predefinição de pesquisa. (A) Imagem de visão geral de toda a guia. As predefinições de condição de imagem são definidas nesta guia, e as "Calibrar a mudança de imagem" e as "Configurações do filtro de imagem" podem ser encontradas na queda de "Tarefas". (B) Zoom-in da queda de "Predefinições", onde cada predefinição pode ser selecionada para a configuração de condições individuais de imagem. (C) Imagem que retrata uma ampliação adequada para encaixar tanto a exposição quanto a área "Foco e Rastreamento" no campo de visão. Clique aqui para ver uma versão maior desta figura.
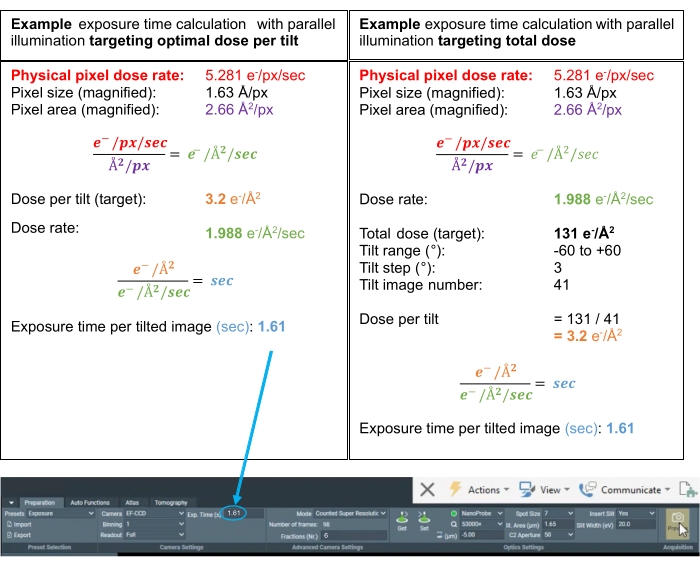
Figura 3: Cálculos de dose. Exemplos de cálculos de dose para possíveis esquemas de aquisição de tomogramas onde a taxa de dose foi medida sobre o vácuo. Os dois cálculos determinam o tempo de exposição (s) para cada inclinação, seja visando uma dose ideal por inclinação ou uma dose total ideal para a série de inclinação completa. Na média do subtomograma, é prática comum direcionar uma dose ideal por imagem inclinada na faixa de 3,0-3,5 e-/Å2. Em ambos os casos, as "Frações (Nr.)" são definidas como 6 para alcançar ~0,5 e-/Å2 de dose por quadro de filme da inclinação para sinal suficiente para realizar a correção de movimento. Clique aqui para ver uma versão maior desta figura.
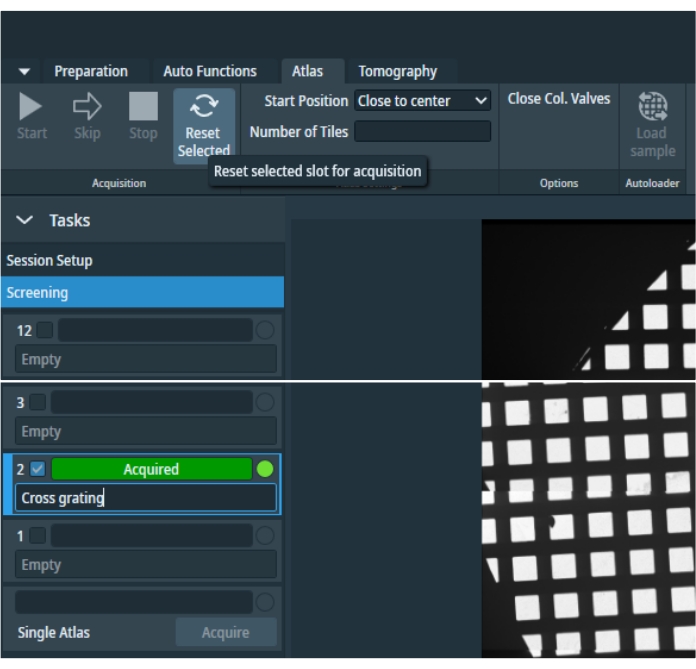
Figura 4: Guia Atlas. Imagem de visão geral da guia "Atlas". A imagem foi cortada para evitar espaços vazios de posição da grade. O menu "Tarefas" contém preferências de configuração de sessão e espaços de seleção de grade para seleção individual de todas as grades inventariadas e uma opção para adquirir um único atlas após a retirada do do carregador automático. Uma grade selecionada pode ser redefinida e depois reaprida. Clique aqui para ver uma versão maior desta figura.
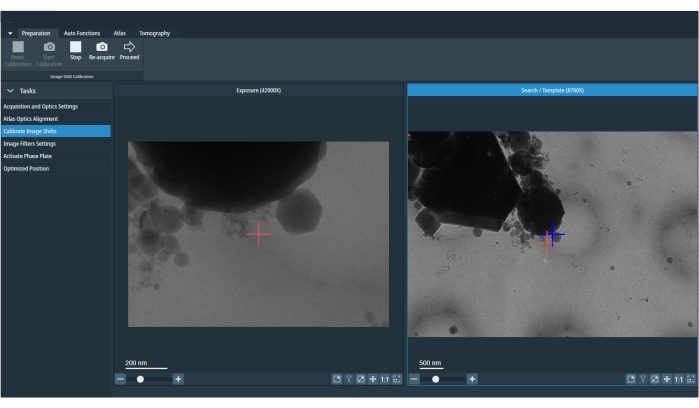
Figura 5: Mudanças de imagem calibradas. A imagem retrata uma imagem de exposição e pesquisa. A cruz vermelha na imagem de pesquisa é o marcador deslocado para corrigir o deslocamento entre exposição e pesquisa. Deve-se refazer as calibrações de mudança de imagem no início da sessão ou depois de alterar as predefinições da condição de imagem. Clique aqui para ver uma versão maior desta figura.
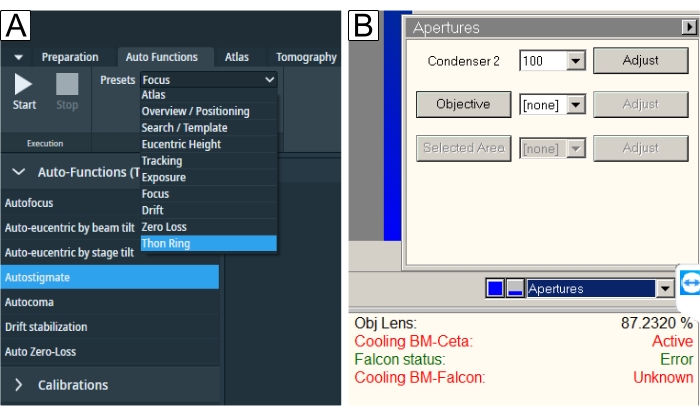
Figura 6: Funções automáticas e aberturas. (A) A guia "Funções automáticas" retrata a queda de "Predefinições" e a seleção "Tarefa". Sublinhado em azul está o predefinição "Thon Ring" necessário para "Autostigmate" (também sublinhado em azul) e "Autocoma". Deve-se selecionar as respectivas predefinições para cada tarefa e, em seguida, pressionar o botão Iniciar . (B) As aberturas são encontradas na interface de usuário TEM. Selecione a "abertura objetiva" desejada após a execução das funções automáticas e execute "Autostigmate" com a abertura. Por favor, clique aqui para ver uma versão maior desta figura.
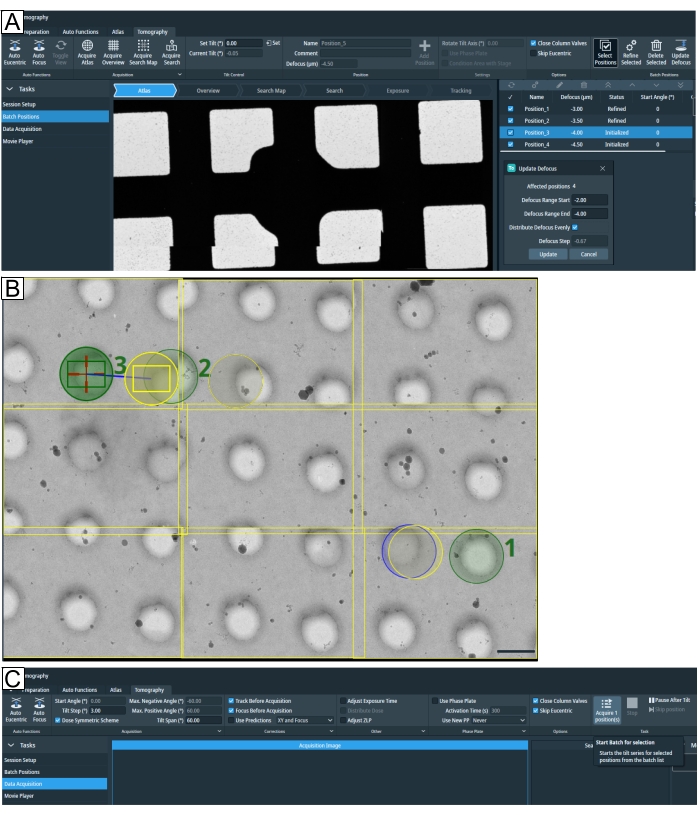
Figura 7: Visão geral da guia tomografia. As imagens mostram a interface de usuário Tomo 5.8. (A) Posições em lote. As últimas funções retratadas na imagem: a opção "Adquirir mapa de pesquisa"; as posições do tomograma são mostradas na exibição atlas com a opção zoom-in; destacado no canto superior direito é "Seleções posições"; abaixo todas as quatro posições foram selecionadas para parâmetros de "Atualizar defoco". (B) Três posições são selecionadas no mapa de pesquisa, com o rótulo 1, 2 e 3. A posição 1 não será um problema quando "Refinar Tudo" for executado. No entanto, se em um ajuste de alta densidade de alvo, como quando as posições lamellae são selecionadas, como descrito para a posição 2 e a posição 3, então "Refinar Tudo" executará a rotina "Rastreamento" e "Foco" na região de "Exposição" da posição 2, expondo o alvo antes que o tomograma seja adquirido. O tipo de grade é R1.2/1.3. Barra de escala = 1,2 μm. (C) Aquisição de dados. A configuração de posições selecionadas em "Posições em Lote" agora pode ser adquirida individualmente. Clique aqui para ver uma versão maior desta figura.
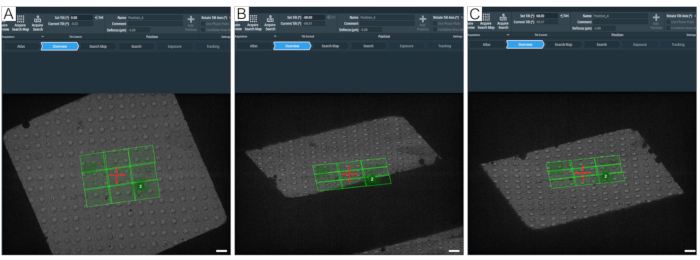
Figura 8: Definindo o ângulo máximo de inclinação. A figura retrata uma abordagem passo a passo para determinar a faixa máxima de inclinação para aquisições de tomogramas. (A) visão geral de 0° e um mapa de pesquisa no centro da grade quadrada. Para testar a faixa de inclinação, o ângulo pode ser definido no software de tomografia com "Definir inclinação (°)" digitando o valor desejado e, em seguida, pressionando o conjunto. (B) O estágio foi inclinado para −60°, mostrando que um canto do mapa de pesquisa não seria totalmente adquirido a −60°. (C) O palco foi inclinado para 60°. Contando os buracos que desapareceram em ±60°, pode-se ter uma ideia sobre a faixa de inclinação de um quadrado de grade. Barras de escala = 2,5 μm. Clique aqui para ver uma versão maior desta figura.
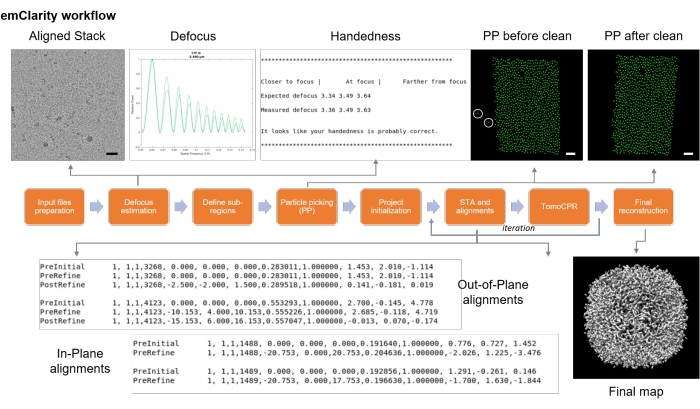
Figura 9: fluxograma de emClaridade. O fluxograma descreveu os vários passos para a média do sub-tomograma criogênico. Barras de escala = 50 nm. Clique aqui para ver uma versão maior desta figura.

Figura 10: Correspondência de modelos usando emClarity. (A) Um micrografo típico de apoferritina em uma grade revestida de grafeno. Defoco: −3.430 μm. (B) Uma fatia do tomograma sobreposto com pontos de modelo após a pesquisa do modelo. (C) Uma visão superior e (D) de projeção lateral dos pontos do modelo, indicando uma única camada plana de partículas de apoferritina monodispersada. Barras de escala = 50 nm. Clique aqui para ver uma versão maior desta figura.
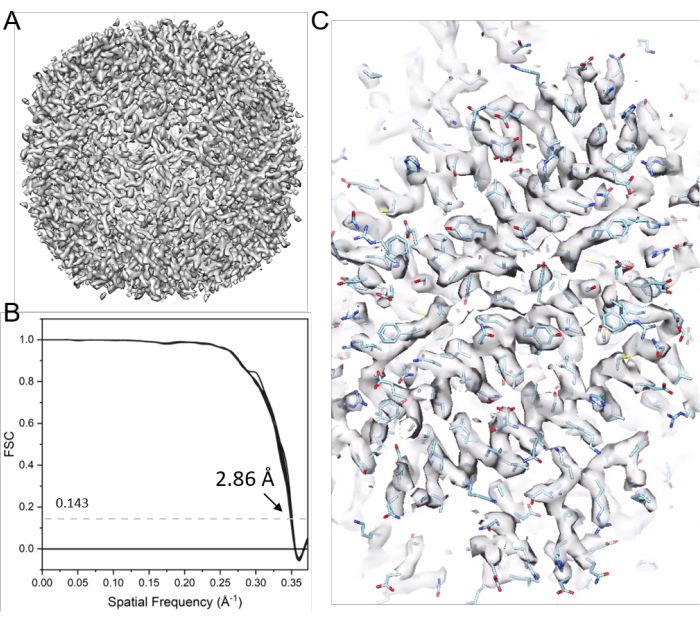
Figura 11: Crio-ET STA de apoferritina. (A) O mapa final após 21 ciclos de alinhamento sub-tomograma. (B) O gráfico de correlação de conchas Fourier (FSC) do mapa final com uma resolução relatada de 2,86 Å, contendo mapas de densidade representativa de 38 cones (C) (equipados com modelo PDB 6s6147). Clique aqui para ver uma versão maior desta figura.
| Amostra | Tipo Cryo-ET | Å/px | Faixa de inclinação (+/-) | Passo de inclinação (°) | Alcance de defocus (μm) | Dose total (e-/Å2) | Resolução | Dados brutos | Referência |
| Apoferritina | Purificado/Molecular (STA) | 1.34 | 60 | 3 | 1.5 – 3.5 | 102 | 2.86 | EMPIAR-10787 | 17 e este papel |
| HIV-1 Gag | Purificado/Molecular (STA) | 1.35 | 60 | 3 | 1.5 – 3.96 | 120 | 3.1 | EMPIAR-10164 | 17 |
| Ribossoma | Purificado/Molecular (STA) | 2.1 | 60 | 3 | 2.2 – 4.3 | 120 | 7 | EMPIAR-10304 | 42 |
| Pico SARS-CoV-2 | Lamella/Molecular (STA) | 2.13 | 54 | 3 | 2 – 7 | 120 | 16 | EMPIAR-10753 | 45 |
| Estrutura do axônio neurônio | Celular (ultraestrutural) | 5.46 | 60 | 2 | 3.5 – 5 | 90 | N.D. | EMPIAR-10922 | 47 |
Tabela 1: Parâmetros de coleta para diversos estudos crio-ET. Estudos voltados à reconstrução de detalhes moleculares a partir de proteínas purificadas ou in situ em comparação com um estudo com o objetivo de resolver e segmentar as características celulares ultraestruturais.
Filme 1: Um tomograma de amostras de apoferritina em uma grade EM normal e, em seguida, imagedo com um crio-TEM equipado com uma câmera de ultra-alta resolução com um filtro compatível. As séries tilt foram adquiridas com um esquema simétrico de dose, com um comprimento de inclinação de 54° e uma dose total de 134 e-/A2 no software de tomografia eletrônica. Barra de escala = 50 nm. Clique aqui para baixar este Filme.
Filme 2: Um tomograma de um neurônio primário cultivado em uma grade EM e, em seguida, diretamente imagedo com um crio-TEM equipado com uma câmera de ultra-alta resolução com um filtro compatível. A série de inclinação foi adquirida com um esquema simétrico de dose, com um comprimento de inclinação de 60° e uma dose total de 120 e-/A2 no software de tomografia eletrônica. Barra de escala = 100 nm. Clique aqui para baixar este Filme.
Filme 3: Um tomograma de uma Cianobactéria em uma grade EM, submetido à fresagem FIB e, em seguida, imagedo com um crio-TEM equipado com uma câmera de alta velocidade e um filtro compatível. A série inclinação foi adquirida com um esquema simétrico de dose, com um comprimento de inclinação de 50° e uma dose total de 120 e-/A2 no software de tomografia eletrônica. Barra de escala = 87,2 nm. Clique aqui para baixar este Filme.
Arquivo suplementar 1: O modelo de arquivo do parâmetro para estimar o desfoco. Clique aqui para baixar este Arquivo.
Tabela suplementar 1: Detalhes de coleta de dados e configuração de microscópio. Clique aqui para baixar esta Tabela.
Tabela Complementar 2: Lista de comandos na ordem de execução. Clique aqui para baixar esta Tabela.
Discussão
Tomo5
A descrição do fluxo de trabalho do software de tomografia destaca uma maneira potencial e mais simplificada para uma configuração de sessão de tomografia em lote (remota). Embora o software seja fácil para iniciantes, alguma experiência crio-EM inicial e a compreensão da tomografia básica podem ajudar na configuração. As etapas críticas são destacadas no protocolo e devem ajudar a solucionar problemas mesmo que uma abordagem de configuração diferente tenha sido usada. O avanço do software facilitará a coleta de dados (remoto) e tornará o crio-ET mais acessível a uma ampla base de usuários. Algumas dicas e truques que podem ajudar a solucionar problemas comumente encontrados são descritos abaixo.
Um ponto importante a ser discutido é a escolha das grades porque, ao inclinar o espécime para ±60°, as barras de grade em inclinações altas podem obscurecer a visão (Figura 8). Em uma grade TEM, o tamanho da malha refere-se ao número de quadrados de grade por unidade de comprimento da grade. Números maiores de malha têm mais quadrados de grade por unidade de comprimento, maior densidade de quadrados de grade e quadrados de grade menores, ou seja, uma grade de 400 malha tem quadrados menores do que uma grade de 200 malhas. Uma boa escolha de grades para tomografia é grade de 200 malhas ou 300 malhas. Como mostrado na Figura 8, a área disponível para coleta é reduzida à medida que a grade é inclinada. Com ± 60° inclinação, uma grade de 300 malha terá um pequeno campo de visão no qual um tomograma completo pode ser adquirido. As vantagens das grades de 200 malhas são que os quadrados de grade maior tornam a configuração da tomografia molecular mais rápida, e com o aumento da área quadrada da grade, um quadrado provavelmente será suficiente para uma coleção noturna. A desvantagem é que as grades de 200 malhas são mais frágeis, por isso o manuseio e o recorte exigem mais finesse.
Além disso, se usar filme de suporte furado (ver Tabela de Materiais) nas grades EM, o espaçamento do orifício deve ser considerado para a configuração da região de foco e rastreamento em relação à região de exposição. Idealmente, o diâmetro do feixe na ampliação desejada deve ser pequeno o suficiente para cobrir a área de carbono adjacente à área de exposição ao longo do eixo de inclinação para uma configuração ideal e rápida. Dessa forma, podem ser adquiridas regiões potenciais de interesse em cada buraco.
Como a rotina de altura eucêntrica do software atualmente não é tão robusta, como a rotina serialEM, as seguintes dicas podem contornar esse problema. Se a determinação de altura eucêntrica falhar usando a predefinição de altura eucêntrica, pode-se usar a predefinição da visão geral e re-executar "Auto-eucentric por inclinação de palco"; isso pode resolver problemas se a altura eucêntrica estiver longe de 0. Se isso for bem sucedido, pode-se re-executar "Auto-eucentric by stage tilt" com predefinições "Eucentric Height" para melhorar a precisão. Se ele falhar, pode-se executar "Auto-Eucentric by beam tilt" com a predefinição de altura eucêntrica e, em seguida, re-executar "Auto-Eucentric by stage tilt" ou definir manualmente a altura z consolidada por "Auto-Eucentric by beam tilt" na interface do usuário TEM em configurações "Stage". No caso de grades com um padrão repetitivo de orifícios serem usadas, elas podem impedir a identificação de um único pico de correlação cruzada. Pode-se tentar alterar a predefinição de altura eucêntrica para um deslocamento de desfoco mais baixo, como −25 μm e/ou um tempo de exposição mais curto para reduzir a correlação cruzada dos padrões dos orifícios. Por outro lado, o uso de grades lacey/lamella pode não fornecer sinal suficiente para um forte pico de correlação cruzada. Pode-se tentar alterar a predefinição de altura eucêntrica para um maior deslocamento de desfoco, como −75 μm e/ou um tempo de exposição prolongado para melhorar o pico de correlação cruzada. Outra opção é ajustar as configurações do filtro de imagem; eles podem ser encontrados na guia "Preparação". As opções para ajustar as configurações do filtro podem ser definidas para baixo (Overview/Gridsquare), médio (Altura Eucêntrica) e alta ampliação (Rastreamento/Foco) para encontrar o pico de correlação cruzada ideal para cada predefinição. A entrada necessária é uma imagem, ou seja, a 0° e outra a 5°, seguida pelo clique em Comparar para comparar ambas as imagens. O valor inicial recomendado para o comprimento de onda mais longo é um quarto da barra de escala na imagem e para o comprimento de onda mais curto é um décimoninho da barra de escala. Se o pico não for identificado de forma robusta, pode-se otimizar as configurações até que um pico convincente possa ser encontrado. Não há necessidade de reaprodir imagens todas as vezes; simplesmente pressionar "Compare" é suficiente. Se o TOMO ainda não encontrar automaticamente a altura eucêntrica, a calibração manual de altura eucêntrica pode ser usada. Deve-se centralizar sobre um cristal de gelo razoavelmente grande na ampliação da visão geral na aba "Preparação", em seguida, ir para o "Controle de palco" da Interface do Usuário TEM, definir alfa para −30°, e ajustar o valor z estágio para recentar o cristal usando a imagem de tela fluorescente. Selecionar as configurações "Alta Resolução" e "Alto Contraste" na interface do usuário TEM tornará isso simples (botões na parte inferior da janela de tela fluorescente). Opcionalmente, se houver acesso a uma câmera com modo ao vivo, isso pode ser usado para determinar a altura eucêntrica; será mais fácil do que na tela fluorescente.
As maiores limitações nas versões de Tomo5 antes do 5.8 são as montagens de ampliação média ausentes, o esquema simétrico da dose ausente e os problemas relacionados à descoberta da altura eucêntrica. Estes existem no serialEM, um freeware com rápido desenvolvimento e suporte à comunidade, uma rotina robusta de altura eucêntrica e a opção de script, ou seja, um esquema simétrico de dose personalizada. A partir da versão 5.8 em diante em Tomo5, o problema mais encontrado para encontrar a altura eucêntrica, ou seja, um looping mal sucedido em torno do valor z alvo, foi resolvido implementando a opção de definir um critério de aceitação de altura eucêntrico. No entanto, com diferentes tipos de grade e amostra, é altamente recomendável ajustar as configurações do filtro de imagem para refletir as condições únicas de imagem de sessões individuais e dar o melhor pico de correlação transversal possível para encontrar a altura eucêntrica e para que a região de foco e rastreamento funcione de forma confiável durante a aquisição do tomograma.
No geral, muitas instalações se adaptaram rapidamente à operação remota durante a pandemia. O software Tomo5 fornece uma rota fácil de acesso e fácil de usar para a tomografia que é bem adequada para operação remota. Os avanços feitos no software, sem dúvida, continuarão a tornar a coleta remota de dados e a coleta de tomografias em geral mais mainstream na comunidade.
emClaridade
Como a emClarity usa um método de coleta de partículas baseada em modelo, ele precisa de um modelo para o objeto de interesse. A colheita de partículas (passo 2.6) é muito sensível e fundamental para a estrutura final. Antes da média e alinhamento (etapa 2.9), deve-se garantir verificar cuidadosamente e manualmente os falsos positivos. Quando um modelo não está disponível, a emClarity pode não ser fácil de usar, mas é possível usar outros softwares, por exemplo, Dynamo37 e PEET48, para criar um modelo inicial.
Para amostras heterogêneas, a emClarity é equipada com um método de classificação que permite que os usuários se concentrem em recursos específicos com diferentes escalas. É útil executar alguns ciclos de alinhamentos antes da classificação e executá-lo em um binning mais alto (como bin 4 ou bin 3).
A versão atualizada do software (V1.5.3.11) tem atualizações significativas em comparação com a primeira versão (V1.0)17. Estes incluem, mas não se limitam a, uma verificação de handedness durante a estimativa ctf (etapa 2.3); simetria para alinhamentos (CX, I, I2, O); cálculo das funções amostrais 3D por partícula (3DSF); uma mudança para o MATLAB 2019a para compatibilidade e estabilidade; e reconstrução utilizando as imagens de projeção bruta (cisTEM). O software continuará a melhorar para várias amostras, e os anúncios mais novos podem ser encontrados online (ver Tabela de Materiais).
Divulgações
Os autores não têm conflitos de interesse.
Agradecimentos
Reconhecemos a Diamond Light Source para acesso e suporte às instalações crio-EM no Centro Nacional de Bioimagem eletrônica (eBIC) do Reino Unido, financiado pelo Wellcome Trust, MRC e BBRSC. Também gostaríamos de agradecer a Andrew Howe pela aquisição do tomograma de Apoferritina (Filme 1), Ishika Kumar pela preparação e aquisição do tomograma de neurônios (Filme 2), e Craig MacGregor-Chatwin para o Cyanobacteria lamella-tomogram (Filme 3).
Materiais
| Name | Company | Catalog Number | Comments |
| Software | |||
| Tomography | Thermo Fisher Scientific | 5.9.0 | Internal terminology: Tomo5 in document |
| TEM server | Thermo Fisher Scientific | 7.10.1 | |
| TIA | Thermo Fisher Scientific | 5.10.1 | |
| DigitalMicrograph | Gatan | 3.44 | |
| emClarity | Open-Source software | 1.5.3.11 | Software for high-resolution cryo-electron tomography and subtomogram averaging |
| IMOD | Open-Source software | 4.11 | Modeling, display and image processing programs used for 3D reconstruction and modeling of microscopy images with a special emphasis on electron microscopy data |
| MotionCor2 | Free for academic use | 1.1.0 | A multi-GPU program that corrects beam-induced sample motion recorded on dose fractionated movie stacks |
| ETomo | Open-Source software | 4.11 | ETomo is an interface for running a subset of IMOD and PEET commands. |
| NoMachine | NoMachine, freeware | 7.9.2 | Remote desktop software |
| TeamViewer | TeamViewer AG | - | Remote access and remote control computer software |
| Materials | |||
| Quantifoil (holey support film) EM grids | Quantifoil | - | A flat film of carbon with pre-defined hole size, shape and arrangement |
| Instrumentation | |||
| Titan Krios microscope | Thermo Fisher Scientific | Titan Krios G2 | |
| K3 camera and GIB energy filter | Gatan | - | |
| Falcon 4 camera and Selectris X energy filter | Thermo Fisher Scientific | - | |
| Website | |||
| Website 1: https://github.com/bHimes/emClarity/ | - | - | Link to download the emClarity software package |
| Website 2: https://bio3d.colorado.edu/imod/ | - | - | Link to download IMOD |
| Website 3: https://github.com/ffyr2w/emClarity-tutorial | - | - | Link to the emClarity online tutorial |
| Website 4: https://emcore.ucsf.edu/ucsf-software | - | - | Link to download MotionCor2 |
| Website 5: https://github-wiki-see.page/m/bHimes/emClarity/wiki | - | - | Link to the newest announcements including updates and bug fixs for emClarity |
Referências
- Bai, X. -. C., Fernandez, I. S., McMullan, G., Scheres, S. H. W. Ribosome structures to near-atomic resolution from thirty thousand cryo-EM particles. eLife. 2, 00461 (2013).
- Li, X., et al. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM. Nature Methods. 10 (6), 584-590 (2013).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. 587 (7832), 152-156 (2020).
- Kato, T., et al. CryoTEM with a cold field emission gun that moves structural biology into a new stage. Microscopy and Microanalysis. 25, 998-999 (2019).
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. 587 (7832), 157-161 (2020).
- Mastronarde, D. N. SerialEM: A program for automated tilt series acquisition on Tecnai microscopes using prediction of specimen position. Microscopy and Microanalysis. 9, 1182-1183 (2003).
- Schorb, M., Haberbosch, I., Hagen, W. J. H., Schwab, Y., Mastronarde, D. N. Software tools for automated transmission electron microscopy. Nature Methods. 16 (6), 471-477 (2019).
- Deng, Y., et al. Smart EPU: SPA getting intelligent. Microscopy and Microanalysis. 27 (1), 454-455 (2021).
- Carragher, B., et al. Leginon: An automated system for acquisition of images from vitreous ice specimens. Journal of Structural Biology. 132 (1), 33-45 (2000).
- Bell, J. M., Chen, M., Baldwin, P. R., Ludtke, S. J. High resolution single particle refinement in EMAN2.1. Methods. 100, 25-34 (2016).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. cryoSPARC: Algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. 14 (3), 290-296 (2017).
- Grant, T., Rohou, A., Grigorieff, N. cisTEM, user-friendly software for single-particle image processing. eLife. 7, 35383 (2018).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166 (2018).
- Kimanius, D., Dong, L., Sharov, G., Nakane, T., Scheres, S. H. W. New tools for automated cryo-EM single-particle analysis in RELION-4.0. Biochemical Journal. 478 (24), 4169-4185 (2021).
- Galaz-Montoya, J. G., Flanagan, J., Schmid, M. F., Ludtke, S. J. Single particle tomography in EMAN2. Journal of Structural Biology. 190 (3), 279-290 (2015).
- Bharat, T. A. M., Scheres, S. H. W. Resolving macromolecular structures from electron cryo-tomography data using subtomogram averaging in RELION. Nature protocols. 11 (11), 2054-2065 (2016).
- Himes, B. A., Zhang, P. emClarity: Software for high-resolution cryo-electron tomography and subtomogram averaging. Nature Methods. 15 (11), 955-961 (2018).
- Weissenberger, G., Henderikx, R. J. M., Peters, P. J. Understanding the invisible hands of sample preparation for cryo-EM. Nature Methods. 18 (5), 463-471 (2021).
- White, J. B. R., et al. Single particle cryo-electron microscopy: From sample to structure. Journal of Visualized Experiments. (171), e62415 (2021).
- Orlova, E. V., Saibil, H. R. Structural analysis of macromolecular assemblies by electron microscopy. Chemical Reviews. 111 (12), 7710-7748 (2011).
- Turk, M., Baumeister, W. The promise and the challenges of cryo-electron tomography. FEBS Letters. 594 (20), 3243-3261 (2020).
- Liu, Y. -. T., et al. Isotropic reconstruction of electron tomograms with deep learning. bioRxiv. , (2021).
- Briggs, J. A. G. Structural biology in situ-The potential of subtomogram averaging. Current Opinion in Structural Biology. 23 (2), 261-267 (2013).
- Grünewald, K., et al. Three-dimensional structure of herpes simplex virus from cryo-electron tomography. Science. 302 (5649), 1396-1398 (2003).
- Allegretti, M., et al. In-cell architecture of the nuclear pore and snapshots of its turnover. Nature. 586 (7831), 796-800 (2020).
- Wang, Z., et al. The molecular basis for sarcomere organization in vertebrate skeletal muscle. Cell. 184 (8), 2135-2150 (2021).
- Winey, M., Meehl, J. B., O'Toole, E. T., Giddings, T. H. Conventional transmission electron microscopy. Molecular Biology of the Cell. 25 (3), 319-323 (2014).
- Davies, K. M., et al. Macromolecular organization of ATP synthase and complex I in whole mitochondria. Proceedings of the National Academy of Sciences. 108 (34), 14121 (2011).
- Wagner, J., Schaffer, M., Fernández-Busnadiego, R. Cryo-electron tomography-The cell biology that came in from the cold. FEBS Letters. 591 (17), 2520-2533 (2017).
- Mahamid, J., et al. Visualizing the molecular sociology at the HeLa cell nuclear periphery. Science. 351 (6276), 969-972 (2016).
- Erdmann, P. S., et al. In situ cryo-electron tomography reveals gradient organization of ribosome biogenesis in intact nucleoli. Nature Communications. 12 (1), 5364 (2021).
- Tegunov, D., Xue, L., Dienemann, C., Cramer, P., Mahamid, J. Multi-particle cryo-EM refinement with M visualizes ribosome-antibiotic complex at 3.5 Å in cells. Nature Methods. 18 (2), 186-193 (2021).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152 (1), 36-51 (2005).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116 (1), 71-76 (1996).
- Heymann, J. B., Belnap, D. M. Bsoft: Image processing and molecular modeling for electron microscopy. Journal of Structural Biology. 157 (1), 3-18 (2007).
- Tang, G., et al. EMAN2: An extensible image processing suite for electron microscopy. Journal of Structural Biology. 157 (1), 38-46 (2007).
- Castaño-Díez, D., Kudryashev, M., Arheit, M., Stahlberg, H. Dynamo: A flexible, user-friendly development tool for subtomogram averaging of cryo-EM data in high-performance computing environments. Journal of Structural Biology. 178 (2), 139-151 (2012).
- Hrabe, T., et al. PyTom: A python-based toolbox for localization of macromolecules in cryo-electron tomograms and subtomogram analysis. Journal of Structural Biology. 178 (2), 177-188 (2012).
- Himes, B. A. emClarity. GitHub. , (2021).
- . The IMOD Home Page Available from: https://bio3d.colorado.edu/imod/ (2020)
- . GitHub: emClarity-tutorial Available from: https://github.com/ffyr2w/emClarity-tutorial (2021)
- Ni, T., et al. High-resolution in situ structure determination by cryo-electron tomography and subtomogram averaging using emClarity. Nature Protocols. 17 (2), 421-444 (2022).
- . MotionCor2 Available from: https://emcore.ucsf.edu/ucsf-software (2016)
- . Apoferritin from mouse at 1.84 angstrom resolution Available from: https://www.emdataresource.org/EMD-10101 (2022)
- Nedozralova, H., et al. In situ cryo-electron tomography reveals local cellular machineries for axon branch development. Journal of Cell Biology. 221 (4), 202106086 (2022).
- Mendonça, L., et al. Correlative multi-scale cryo-imaging unveils SARS-CoV-2 assembly and egress. Nature Communications. 12 (1), 4629 (2021).
- . Apoferritin from mouse at 1.84 angstrom resolution Available from: https://www.rcsb.org/structure/6s61 (2019)
- Nicastro, D., et al. The molecular architecture of axonemes revealed by cryoelectron tomography. Science. 313 (5789), 944-948 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados