Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelo de dolor de espalda de ratón inducido por activador del plasminógeno de tipo uroquinasa
En este artículo
Resumen
Aquí se proporcionan métodos para la inducción simple y rápida de un modelo de dolor de espalda en ratones utilizando una inyección intraligamentosa de activador del plasminógeno urinario.
Resumen
Se puede inducir un modelo de dolor lumbar persistente en ratones con la metodología simple descrita en este documento. Aquí se proporcionan métodos paso a paso para la inducción simple y rápida de un modelo de dolor de espalda persistente en ratones utilizando una inyección de activador del plasminógeno de tipo uroquinasa (uroquinasa), una serina proteasa presente en humanos y otros animales. La metodología para la inducción del dolor lumbar persistente en ratones implica una simple inyección de uroquinasa a lo largo de la región de inserción ligamentosa de la columna lumbar. El agente inflamatorio de la uroquinasa activa el plasminógeno a plasmina. Normalmente, el modelo puede inducirse en 10 minutos y la hipersensibilidad persiste durante al menos 8 semanas.
La hipersensibilidad, la alteración de la marcha y otras medidas estándar similares a la ansiedad y la depresión se pueden probar en el modelo persistente. El dolor de espalda es el tipo de dolor más prevalente. Para mejorar la concienciación sobre el dolor de espalda, la Asociación Internacional para el Estudio del Dolor (IASP) nombró a 2021 el "Año Mundial sobre el Dolor de Espalda" y a 2022 el "Año Mundial para Trasladar el Conocimiento del Dolor a la Práctica". Una limitación del avance terapéutico de la terapéutica del dolor es la falta de modelos adecuados para evaluar el dolor persistente y crónico. Las características de este modelo son adecuadas para probar posibles terapias dirigidas a la reducción del dolor de espalda y sus características auxiliares, lo que contribuye a que la IASP haya nombrado 2022 como el Año Mundial para Trasladar el Conocimiento del Dolor a la Práctica.
Introducción
El dolor lumbar es una de las causas más comunes de discapacidad, ya que 1 de cada 5 personas losufre en todo el mundo. A pesar de estos esfuerzos, pocos modelos animales confiables de dolor de espalda se utilizan popularmente en la investigación con animales en el campo del dolor, especialmente en ratones. Los modelos anteriores han utilizado casi exclusivamente ratas para la inducción de dolor de espalda crónico (CBP), como los inducidos por la inyección de un activador del plasminógeno urinario (uPA) en la articulación facetaria lumbar 2,3, la inyección de factor de crecimiento nervioso (NGF) en la musculatura del tronco4, o yodoacetato monosódico (MIA)5 o interleucina-1beta6 Inyección en el disco intravertebral. Por supuesto, las ratas son las preferidas para estos modelos principalmente debido a su mayor tamaño y facilidad de acceso para la inyección de agentes inflamatorios.
Para ser claros, existen modelos de ratón de dolor de espalda, como el modelo de ratón de degeneración del disco intervertebral sin SPARC, utilizado durante muchos años7, pero su establecimiento es más costoso y requiere más tiempo que los modelos basados en inyecciones. Un estudio reciente con ratones estableció un modelo de dolor lumbar mediante la combinación de la inyección de NGF en los músculos de la espalda baja con el estrés de restricción crónica vertical8. En el siguiente protocolo, hemos adaptado el modelo de CBP inducido por uPA de ratas para ratones2. La hipersensibilidad se establece en 1 semana y persiste hasta 6-8 semanas. Además, establecemos que los ratones desarrollan comportamientos similares a la ansiedad y la depresión. Dada la prevalencia del dolor de espalda y el uso más común de ratones en la investigación molecular del dolor, este modelo duradero se establece fácilmente para su uso en el desarrollo de nuevas estrategias de tratamiento para el alivio del dolor de espalda.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los procedimientos con animales descritos cumplen con la Guía de los NIH para el Cuidado y Uso de Animales de Laboratorio. Los estudios fueron aprobados por el Comité de Cuidado y Uso Institucional local (IACUC #23-201364-HSC) del Centro de Ciencias de la Salud de la Universidad de Nuevo México. Todos los estudios cumplen con las políticas bajo los auspicios de una Garantía de Cumplimiento de la OLAW (A3002-01) sobre el uso de animales en investigación, como se describe en la Parte III. II. Garantías y certificaciones. Los animales se alojan en las instalaciones de alojamiento del Centro de Recursos Animales (ARC, por sus siglas en inglés) mantenidas por el personal del laboratorio y el personal de la División de Recursos de Laboratorio y Animales (DLAR, por sus siglas en inglés). El método de eutanasia (100 μL de 59 mg/ml de pentobarbital inyectable) es rápido y fiable y permite la disección y recogida de diversos tejidos para su posterior investigación.
1. Animales
- Ratones BALB/c machos y hembras adultos domésticos (~3-4 semanas de edad) (20-25 g) en un ciclo inverso de luz:oscuridad de 12 h:12 h, por lo que su tiempo activo en la oscuridad se produce durante las horas de trabajo en el laboratorio.
NOTA: Esto permitirá evaluar todos los parámetros durante el tiempo de actividad natural de los animales, ya que los roedores son animales nocturnos por naturaleza. Esto reduce la contribución de las alteraciones del reloj circadiano, por lo que los animales pueden ser examinados durante su tiempo activo, que ahora es diurno. - Vigile a los animales dos veces al día.
- Mantenga a los ratones en comida normal para reproductores, que es más baja en contenido de proteína de soja en comparación con la comida estándar para roedores (conocida por alterar la hipersensibilidad) si se evalúan los efectos de los medicamentos en los comportamientos relacionados con el dolor.
- Pesar a los animales una vez a la semana para asegurar el mantenimiento de un aumento de peso saludable.
NOTA: No se observaron diferencias grupales en el peso a lo largo de los estudios de 8 a 10 semanas, lo que permitió el cegamiento del estudio.
2. Inducción del modelo
- Realice la inducción del modelo en una superficie plana estéril y tibia equipada con un medio para colocar restricciones de estabilización para mantener el mouse en su lugar (Figura 1A). Realice la cirugía con un microscopio de disección sobre una superficie esterilizada.
NOTA: Utilice una campana extractora de grado químico si no se dispone de la captura de anestesia. - Use seda quirúrgica o incluso hilo con gomas anudadas en el extremo de las cuerdas enganchadas a los bordes acanalados de la placa como sujeciones si usa la placa base recomendada en la Tabla de Materiales.
- Coloque una estación de recuperación de almohadillas térmicas en una superficie adyacente a la configuración de la cirugía para la transferencia de ratones a la estación inmediatamente después de la inyección (Figura 1B).
NOTA: Coloque una jaula vacía sobre la almohadilla térmica al menos 10 minutos antes de la inyección para permitir que la jaula se caliente a una temperatura agradable (37 °C). Coloque la jaula a la mitad de la almohadilla, para permitir que el ratón despierto prefiera las temperaturas de recuperación. - Preparar la uroquinasa diluyéndola en agua estéril. Alcohol limpie la jeringa Hamilton y enjuáguela con agua estéril. Prepare la solución con anticipación para que el ratón esté bajo anestesia durante el menor tiempo posible. Utilice 5 μL de activador del plasminógeno urinario de 2 mg/mL para el modelo; para las simulaciones, use 5 μL de solución salina estéril.
- Configure la estación de anestesia de isoflurano a un nivel del 4% o menos para este breve procedimiento. Coloque el ratón en la cámara de inducción; Por lo general, la frecuencia respiratoria rápida del ratón se ralentizará en 1-2 minutos, pasando del movimiento de la parte superior del pecho a la parte inferior del pecho.
- Utilice un nivel de oxígeno de 1,5 L/min y un bote de carbón activado F o trabaje bajo una campana de evacuación de flujo biológico o superior para frotar el isoflurano y evitar la exposición al cirujano animal. Si no está disponible, realice el procedimiento en una campana de seguridad química.
- Cambie rápidamente el ratón y el flujo de anestésico a la zona quirúrgica en una almohadilla térmica a 37 °C, colocando la nariz del ratón en la nariz para mantener el nivel de anestesia (Figura 1C, D). Verifique que el mouse no tenga un movimiento reflejo para pellizcar los dedos de los pies y luego sujete el mouse en la placa base.
NOTA: Si hay movimiento, vuelva a colocar el mouse en la cámara de inducción y repita esto. - Limpie el área de la piel de la espalda con un hisopo con alcohol. Ajuste la iluminación LED según sea necesario para tener una visión clara de la espalda del ratón anestesiado.
NOTA: Si es necesario, use una afeitadora eléctrica para eliminar el vello de la espalda del ratón para que haya una vista sin obstrucciones de las crestas de la columna vertebral debajo de la piel. Si se afeita a los ratones experimentales, también se afeita la espalda de los ratones ingenuos y falsos para cegarlos en el estudio. - Inyecte el ratón mientras está completamente anestesiado e inmovilizado (sin reflejo de enderezamiento y retirada de pellizco del dedo del pie). Use dos dedos para sentir suavemente dónde se encuentra la parte inferior de la caja torácica del ratón con la columna vertebral (Figura 2A). Por debajo de ese punto se encuentran los segmentos espinales de madera; apunte la inyección aquí a L2-L3.
- Coloque la punta de la jeringa Hamilton junto a la columna vertebral (Figura 2B, C). Apunte la jeringa en un ángulo de ~45° hacia el ligamento interespinoso inmediatamente adyacente al hueso.
NOTA: Dependiendo de la dureza de la piel del ratón, a veces confiar en la gravedad en lugar de la presión activa y un ángulo de 90° puede funcionar mejor. - Inserte la punta de la aguja suave pero firmemente en el ligamento interespinoso (Figura 3B, C).
NOTA: El objetivo no es romper la cavidad abdominal, sino inyectar el ligamento. - Vacíe lentamente el contenido de la aguja. Si en algún momento hay líquido en la punta, la aguja no atraviesa la piel. Continúe hasta que se hayan inyectado los 5 μL.
- Mantenga la aguja en su lugar durante ~ 5 s para evitar el reflujo de la inyección. Se recomienda el uso de colorante azul en ensayos piloto terminales o agudos.
NOTA: Si se hace correctamente, el líquido debe extenderse hacia el ligamento como se muestra (Figura 3A). - Retire la aguja suave y lentamente. Asegúrese de que no haya sangre ni secreción.
- Coloque el ratón en la estación de recuperación de calor con una jaula superior hasta que se despierte y se mueva antes de devolverlo a la jaula de origen.
NOTA: Suponiendo que el procedimiento se haya realizado rápidamente, no debería pasar más de un minuto antes de que el ratón se despierte. - Revise a los ratones durante 1 hora después de la cirugía para asegurarse de que toda la función motora normal continúe como precaución.
NOTA: Si se hace correctamente, no debería haber complicaciones de este procedimiento. - Revise a los ratones diariamente durante la semana posterior a la cirugía, incluida la evaluación del peso y la inspección del lugar de la inyección para asegurarse de que no se hayan producido infecciones ni complicaciones. No utilice el ratón para seguir experimentando si hay un cambio en el comportamiento, como pérdida de peso y letargo.

Figura 1: Configuración para la inducción de CBP con uroquinasa. (A) La placa base de Fine Science Tools recomendada para cirugías con ratones. Los bordes acanalados pueden tener una cuerda en forma de gancho para mantener el mouse en su lugar. (B) Estación de recuperación. Se recomienda una jaula de alojamiento vacía, mitad en la almohadilla térmica, mitad apagada. Se coloca un paño limpio en la parte inferior para darle al mouse un área de descanso cómoda. (C) Recomendación de configuración de la máquina de anestesia. Usando un sistema de administración de dos canales, coloque una manguera en la cámara de inducción y otra en la estación de cirugía. (D) Una vista de las restricciones del ratón. Dos cuerdas se anudan en los bordes acanalados de la placa base, luego se tiran suavemente a través del cuello y la parte trasera del mouse, respectivamente. Asegúrese de no sujetar al ratón con demasiada fuerza para que pueda respirar normalmente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Inducción de CBP por inyección de uroquinasa. (A) Una vista de la ubicación del sitio de inyección. Como se muestra, palpa con los dedos para encontrar la parte inferior de la caja torácica del ratón como punto de referencia para L4-L5. (B) Una vista del proceso de inyección, que muestra el ángulo para una inyección adecuada. (C) Un ángulo de 45° es preferible aquí, pero ajústelo según sea necesario para asegurarse de que la aguja llegue a donde necesita. Si es necesario, afeite el sitio de la inyección para una mejor visualización. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Diagrama del lugar de la inyección. (A) Una fotografía de la ubicación del sitio de inyección. La tinta se utiliza aquí para indicar dónde entrará el líquido en el ligamento interespinoso entre las vértebras L2 y L3. (B) Un diagrama que muestre la posición correcta de la aguja y la ubicación del sitio de inyección, mostrado desde una vista lateral. (C) Un diagrama que muestra una vista de arriba hacia abajo de las vértebras y los sitios de inyección para los ligamentos interespinosos. Por lo general, las inyecciones se realizan en los ligamentos interespinosos junto a la columna vertebral, pero la aguja también se puede insertar en el espacio entre las vértebras intertransversas. Se recomienda el uso de colorante azul en ensayos piloto como se muestra en (A). Haga clic aquí para ver una versión más grande de esta figura.
3. Ensayos conductuales
- Prueba de umbral de respuesta del reflejo mecánico de von Frey
NOTA: El umbral de extracción mecánica es la fuerza mínima necesaria para provocar una respuesta el 50% del tiempo con una serie de 8 monofilamentos de von Frey graduados en diámetro con aumentos de ~ 0,2 g, proporcionando cambios de paso logarítmico en la fuerza mecánica (Tabla de materiales).- Prueba de estimulación mecánica con fibras de von Frey aplicadas a la pata trasera, el territorio de inervación de los nervios lumbosacros. Determine los valores basales de retiro de la pata antes de la cirugía. Después de la cirugía, determine el umbral mecánico una vez a la semana durante el experimento crónico.
- Retire a los animales de la sala de alojamiento y aclimaténgalos en la sala de pruebas durante 30 minutos en sus jaulas domésticas antes de la prueba. A partir de ahí, mueva a los animales para sujetarlos individualmente en pequeños cubículos transparentes en la mesa de pruebas con pantalla durante 15-20 minutos, dependiendo de su nivel de actividad.
NOTA: Las pruebas pueden comenzar después de que los ratones se hayan acomodado en una posición de reposo y no estén girando ni moviéndose en la cámara. La aclimatación al cubículo de sujeción minimiza los efectos inducidos por el estrés. Si los ratones se han mantenido en un ciclo de luz inverso, las pruebas deben realizarse en condiciones de luz roja. - Proceda con las pruebas utilizando series graduadas de fibras de von Frey como se describe a continuación y en Chaplan et al.9.
- Pruebe la almohadilla de la pata en un lugar consistente en cada animal utilizando el filamento de von Frey 3,61 que, cuando se dobla, provoca una fuerza de 0,4 g (Tabla de materiales). A continuación, estimula con el filamento de von Frey 4,08 que provoca una fuerza de 1,0 g .
NOTA: Ninguna de estas fibras provoca respuestas en animales ingenuos y aclimatados. - Aplique cada filamento 5 veces a intervalos de >5 s perpendiculares a la almohadilla del pie, teniendo cuidado de no tocar un pliegue/hendidura o vello. Una respuesta positiva es la retirada del pie a tres de los cinco estímulos. Aplicar el siguiente filamento más débil de la serie hasta que el animal no responda a la estimulación mecánica; En ese momento, utiliza el siguiente filamento más alto. Si provoca una respuesta, utilice de nuevo el filamento inferior hasta que se hayan aplicado cuatro ensayos después del cambio de respuesta a la estimulación mecánica de la almohadilla del pie.
- Utilice el patrón de respuesta resultante para calcular el umbral de retirada mecánica, la cantidad mínima de fuerza necesaria para obtener una respuesta el 50% de las veces, utilizando un algoritmo de ajuste de curva9. Una disminución en la fuerza requerida para provocar una respuesta de retirada del pie en comparación con los ratones ingenuos o la propia línea de base del animal indica una mayor sensibilidad del animal.
- Pruebe la almohadilla de la pata en un lugar consistente en cada animal utilizando el filamento de von Frey 3,61 que, cuando se dobla, provoca una fuerza de 0,4 g (Tabla de materiales). A continuación, estimula con el filamento de von Frey 4,08 que provoca una fuerza de 1,0 g .
- Prueba de umbral de respuesta del reflejo térmico
NOTA: Los umbrales de respuesta al calor y al frío se determinan con las pruebas de Hargreaves y de placa fría, respectivamente.- Prueba de Hargreaves
- Coloque a los ratones en cubículos sobre una superficie de vidrio que se calienta con un emisor de infrarrojos desde abajo. Registre la latencia para retirar el pie como el tiempo en segundos desde la aplicación del estímulo de luz infrarroja (50 °C) proporcionado por el aparato sobre la pata trasera del ratón hasta la retirada de la estimulación.
- Prueba de placa fría
- Coloque los ratones en el aparato de placa fría enfriado a -9 °C. Registre la latencia para retirar el pie como el tiempo en segundos desde la colocación del mouse en el aparato hasta que el mouse comienza a levantar el pie.
- Alternativamente, coloque una sonda fría enfriada a -9 ° C debajo de la pata trasera del ratón mientras el ratón está enjaulado encima de una malla de alambre. Registre la latencia de retirada como el tiempo en segundos desde la colocación del aparato debajo de la pata trasera hasta que el ratón comienza a levantar el pie, lamer o sacudir. Para evitar evocar una respuesta nociceptiva, acostumbre al ratón a ser tocado por la sonda a temperatura ambiente.
- Prueba de Hargreaves
- Ensayos conductuales dependientes de la cognición y las emociones
NOTA: La hipersensibilidad de larga duración en animales produce disfunción emocional y cognicionaria. Por lo general, se miden solo una vez en la semana 6 después de la inducción del modelo de dolor para evitar los efectos de la práctica.- Pruebas de ansiedad
NOTA: La ansiedad y la depresión también se pueden probar de manera confiable para determinar la efectividad del modelo. Es mejor esperar al menos hasta las semanas 4-6 después de la inyección de inducción para permitir que se desarrollen las comorbilidades. La preferencia por la cámara oscura en lugar de la cámara clara es una medida de la ansiedad relacionada con la nocicepción. En la prueba de laberinto cero o más, los ratones modelo de dolor pasan menos tiempo en los cuadrantes abiertos que los animales de control ingenuos, una muestra de comportamiento similar a la ansiedad10,11.- Prueba de preferencia de lugar claro/oscuro: coloque cada animal en la caja de prueba de preferencia de lugar con un pasillo entre dos cámaras (10 x 10 x 10 cm3). Una cámara del aparato está brillantemente iluminada, mientras que el lado opuesto permanece oscuro. Durante cada prueba de 10 minutos, monitoree la ubicación del animal por computadora para determinar los tiempos de ocupación de luz y oscuridad y el número de transiciones.
NOTA: Alternativamente, monte una cámara de video sobre la cámara de prueba y registre manualmente el tiempo que pasa en cada cámara. - Laberintos elevados más o cero: coloque el modelo de roedores o animales ingenuos en el laberinto y use un cronómetro para evaluar el tiempo que pasan en las partes cerradas del laberinto. Determine el tiempo que se pasa en las dos áreas "seguras" amuralladas y las dos áreas abiertas "inseguras". Los animales con dolor prefieren áreas cerradas y seguras.
NOTA: El comportamiento similar a la ansiedad se puede probar en un laberinto de cero o más (10 minutos). El laberinto cero es una pista circular a diferencia del laberinto plus, que tiene "forma de signo más". Ambos tienen dos cuadrantes abiertos y dos cerrados que permiten un comportamiento exploratorio continuo. Ambos se elevan a 1 m del suelo, ya sea una pasarela circular o en forma de más dividida en cuatro cuadrantes de igual tamaño.
- Prueba de preferencia de lugar claro/oscuro: coloque cada animal en la caja de prueba de preferencia de lugar con un pasillo entre dos cámaras (10 x 10 x 10 cm3). Una cámara del aparato está brillantemente iluminada, mientras que el lado opuesto permanece oscuro. Durante cada prueba de 10 minutos, monitoree la ubicación del animal por computadora para determinar los tiempos de ocupación de luz y oscuridad y el número de transiciones.
- Prueba de depresión por salpicaduras de sacarosa
NOTA: La prueba de salpicaduras de sacarosa se utiliza para determinar el comportamiento similar a la depresión. La prueba de salpicaduras permite medir la ausencia de un comportamiento normal de aseo como síntoma de depresión resultante del dolor crónico.- Marque la frecuencia, la duración y la latencia del acicalamiento durante 10 minutos después de rociar una solución de sacarosa al 10-30% en la capa dorsal (~ 250 μL cerca de la base de la cola). Hacer que los observadores ciegos cuenten el número de maniobras de acicalamiento a partir de grabaciones de video12.
NOTA: Se ha informado que este índice se ve afectado en modelos de trastornos del estado de ánimo en roedores, como el estrés crónico leve, y que se corrige con el tratamiento antidepresivo crónico13.
- Marque la frecuencia, la duración y la latencia del acicalamiento durante 10 minutos después de rociar una solución de sacarosa al 10-30% en la capa dorsal (~ 250 μL cerca de la base de la cola). Hacer que los observadores ciegos cuenten el número de maniobras de acicalamiento a partir de grabaciones de video12.
- Prueba de objetos novedosos
NOTA: La disfunción cognitiva se puede medir con la prueba del objeto novedoso.- Aclimatar a los ratones individualmente a una jaula de plástico transparente con la parte superior abierta (56 x 30 x 20 cm) durante 1 h. Añade dos minifiguras de juguete idénticas en esquinas opuestas de la jaula durante 5 minutos.
- El día de la prueba, vuelva a aclimatar a los animales a la jaula transparente durante 1 hora antes de colocar las dos minifiguras idénticas en las mismas posiciones de la jaula durante 5 minutos antes de devolverlas a la jaula de origen.
- Reemplace una de las figuras originales con un objeto novedoso claramente diferente, devuelva los ratones a la jaula de prueba 4 h más tarde y registre el tiempo dedicado a explorar los objetos.
- Calcule el Índice de Reconocimiento (IR) reportado como el porcentaje de tiempo dedicado a explorar el objeto novedoso del tiempo total de exploración del objeto14.
- Evaluación de la función motora
NOTA: La prueba de movilidad y alteración de la marcha con manchas de tinta15 evalúa la función motora en el modelo de dolor de espalda.- Construye un túnel a partir de un tubo de papel toalla cortado a lo largo en un borde. Extienda el túnel sobre una hoja de papel de impresora limpia.
- Sostén a los ratones suavemente envueltos en una toalla hasta que estén calmados. Coloque las patas en una almohadilla humedecida con tinta china no tóxica para cubrirlas con tinta o pinte la tinta en la parte inferior de las patas del ratón con un hisopo de algodón. Suelta a los ratones en la entrada del túnel y déjalos correr por el túnel, capturándolos al final.
- Puntúa las huellas de las patas en función de tres parámetros: longitud de zancada (la distancia vertical desde el extremo posterior de una huella a la siguiente), anchura de zancada (distancia horizontal entre huellas) y extensión de los dedos (la distancia entre los dedos de los pies en los lados opuestos de la pata).
NOTA: Las golosinas aprobadas también se pueden usar para alentar al ratón a pasar por el túnel. Si las huellas de las patas están manchadas o no son claras, se debe repetir el experimento.
- Pruebas de ansiedad
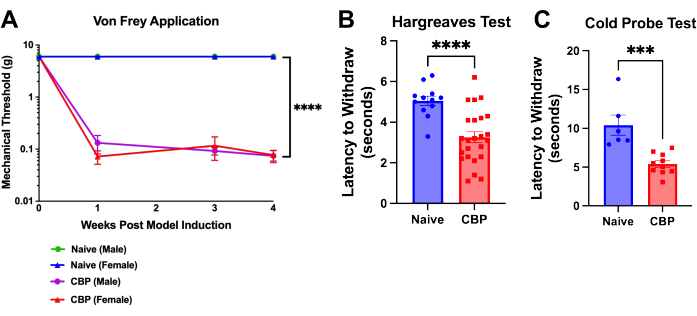
Figura 4: Hipersensibilidad mecánica y térmica tras la inducción de CBP. El dolor se puede medir una semana después de la inducción del modelo y persiste durante 8 semanas. (A) Prueba de von Frey. La prueba de umbral mecánico se realiza con filamentos von Frey aplicados a la almohadilla del pie a través de una mesa superior de malla con el método de arriba hacia abajo como se muestra aquí en el transcurso de 4 semanas. El umbral del macho ingenuo (verde) está oculto debajo de la línea azul para los ratones hembra ingenuos. Los ratones CBP (n = 4 machos, 4 hembras) mostraron un aumento significativo de la sensibilidad mecánica en comparación con los controles ingenuos (n = 2 machos, 2 hembras). Sobre estos datos se realizó un ANOVA de dos vías (prueba de comparaciones múltiples de Dunnett): n = 4 por grupo. En los análisis post-hoc , el ajuste de Bonferroni a todos los valores de P para las comparaciones semana a semana de CBP versus Naïve arrojó los 11 valores < 0,0011. p < 0,0001. (B) Prueba de Hargreaves. El umbral de calor se probó en la almohadilla del pie con la prueba de Hargreaves (50 °C). Los ratones CBP (n = 12 machos, 12 hembras) mostraron una sensibilidad al calor significativamente mayor en comparación con los controles ingenuos (n = 6 machos, 6 hembras). Se realizó la prueba t de Mann-Whitney de dos colas para comprobar la significación (p < 0,0001). (C) Sensibilidad al frío. La prueba de sonda fría se realizó colocando ratones en el aparato de placa fría enfriado a -9 °C. La latencia para retirarse se registró como el tiempo en segundos desde la colocación del mouse en el aparato hasta que el mouse comienza a levantar el pie, lamer o sacudir. En los datos mostrados, se colocó una sonda fría enfriada a -9 °C debajo de la pata trasera del ratón mientras el ratón estaba enjaulado encima de una malla de alambre. Todos los ratones se sometieron a pruebas de 1 a 3 semanas después de la inyección. Los ratones CBP (n = 4 machos, 6 hembras) mostraron una sensibilidad al frío significativamente mayor en comparación con los controles ingenuos (n = 2 machos, 4 hembras). Se realizó la prueba t de dos colas de Mann-Whitney para comprobar la significación (p = 0,0002). Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Pruebas conductuales relacionadas con la nociceptividad y análisis de datos
Medidas evocadas
La hipersensibilidad en la almohadilla del pie se desarrolla dentro de un día después de la inyección de uroquinasa. En 1 semana, el umbral de retirada se reduce significativamente y persiste hasta la eutanasia; esto se muestra a lo largo de la semana postquirúrgica 4 (Figura 4A). La latencia de retirada de las patas se analiza mediante el método up-down ...
Access restricted. Please log in or start a trial to view this content.
Discusión
Este modelo de dolor de espalda crónico es fácil de inducir, y la hipersensibilidad establecida en 1 semana puede durar hasta (y posiblemente más) 8 semanas. Esto permite un estudio preciso del estado de dolor crónico a diferencia de otros modelos agudos que solo duran una o dos semanas. Si bien mostramos el modelo en ratones, el modelo CBP inducido por uPA también se puede establecer en ratas2. Una ventaja del modelo es que el curso prolongado del tiempo provoca el desarrollo de comportamien...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores declaran que no hay intereses financieros contrapuestos. KNW reconoce la consulta no remunerada con NeuroChronix, Bessor Pharma y USA Elixeria BioPharm, Inc.
Agradecimientos
La subvención fue proporcionada por NIH HEAL UG3 NS123958. Las instalaciones de alojamiento fueron inspeccionadas y acreditadas por AAALAC. Los animales fueron alojados en las instalaciones de alojamiento del Centro de Recursos Animales (ARC, por sus siglas en inglés) mantenidas por el personal del laboratorio y el personal de la División de Recursos de Laboratorio y Animales (DLAR, por sus siglas en inglés). Los procedimientos para las pruebas conductuales son métodos estándar en el campo aprobados por la Sociedad Americana del Dolor y la Asociación Internacional para el Estudio del Dolor. El método de eutanasia es consistente con las recomendaciones del Panel de Eutanasia de la Asociación Americana de Medicina Veterinaria.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Animals and Consumables | |||
| 70% ethanol | Local Source | ||
| BALB/c mice | Envigo | 20-25 g | |
| Cotton balls | Fisher Scientific | 19-090-702 | |
| Cotton-tipped applicators | Fisher Scientific | 19-062-616 | |
| Isoflurane inhalant anesthetic | MedVet | RXISO-250 | |
| Labeling tape | Fisher Scientific | NGFP7002 | |
| Nitrile exam gloves | Fisher Scientific | ||
| Oxygen tank | Local Source | ||
| Surgical drape, Steri-Drape Utility Sheet, Absorbent Prevention | VWR | 76246-788 | cut into 15 x 15 cm pieces |
| Tygon tubing with 3 mm inner diameter | Grainger | 22XH87 | |
| Equipment | |||
| #11 carbon steel scalpel blades | VWR | 21909-612 | |
| Anesthesia induction chamber | Summit Medical Equipment Company | AS-01-0530-LG | |
| Autoclave | Local Unit | ||
| Biology Dumont #5 forceps | Fine Science Tools | 11252-30 | |
| Glass bead sterilizer Germinator 500 | VWR | 102095-946 | |
| IITC Life Sciences Series 8 Model PE34 Hot/Cold Plate Analgesia Meter | IITC | PE34 | |
| Integra Miltex cotton & dressing pliers | Safco Dental Supply | 66-317 | |
| OPTIKA CL31 double arm LED illuminator | New York Microscope Company | OPCL-31 | |
| Plantar Test System with InfraRed Emitter, i. e. Hargreaves Apparatus | Ugo Basile | 37370-001 and 37370-002 | |
| Scalpel Handle No. 3 | VWR | 25607-947 | |
| Small animal heating pad | Valley Vet Supply | 47375 | |
| Student Vannas spring scissors, straight blade | Fine Science Tools | 91500-09 | |
| Table top animal research portable anesthesia workstation “PAM” | Patterson Scientific | AS-01-0007 | |
| Von Frey Filaments | Ugo Basile | 37450-275 |
Referencias
- O'Sullivan, P. B., et al. Back to basics: 10 facts every person should know about back pain. British Journal of Sports Medicine. 54 (12), 698-699 (2020).
- Nauta, H. J., McIlwrath, S. L., Westlund, K. N. Punctate midline myelotomy reduces pain responses in a rat model of lumbar spine pain: evidence that the postsynaptic dorsal column pathway conveys pain from the axial spine. Cureus. 10 (3), 2371(2018).
- Shuang, F., et al. Establishment of a rat model of lumbar facet joint osteoarthritis using intraarticular injection of urinary plasminogen activator. Scientific Reports. 5 (1), 9828(2015).
- Reed, N. R., et al. Somatosensory behavioral alterations in a NGF-induced persistent low back pain model. Behavioural Brain Research. 418, 113617(2022).
- Suh, H. R., Cho, H. -Y., Han, H. C. Development of a novel model of intervertebral disc degeneration by the intradiscal application of monosodium iodoacetate (MIA) in rat. The Spine Journal. 22 (1), 183-192 (2022).
- Kim, H., Hong, J. Y., Lee, J., Jeon, W. -J., Ha, I. -H. IL-1β promotes disc degeneration and inflammation through direct injection of intervertebral disc in a rat lumbar disc herniation model. The Spine Journal. 21 (6), 1031-1041 (2021).
- Millecamps, M., Tajerian, M., Sage, E. H., Stone, L. S. Behavioral signs of chronic back pain in the SPARC-null mouse. Spine. 36 (2), 95-102 (2011).
- La Porta, C., Tappe-Theodor, A. Differential impact of psychological and psychophysical stress on low back pain in mice. Pain. 161 (7), 1442-1458 (2020).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. Journal of Neuroscience Methods. 53 (1), 55-63 (1994).
- Takao, K., Miyakawa, T. Light/dark transition test for mice. Journal of Visualized Experiments JoVE. (1), e104(2006).
- Deuis, J. R., Dvorakova, L. S., Vetter, I. Methods used to evaluate pain behaviors in rodents. Frontiers in Molecular Neuroscience. 10, 284(2017).
- David, D. J., et al. Neurogenesis-dependent and -independent effects of fluoxetine in an animal model of anxiety/depression. Neuron. 62 (4), 479-493 (2009).
- Yalcin, I., et al. A time-dependent history of mood disorders in a murine model of neuropathic pain. Biological Psychiatry. 70 (10), 946-953 (2011).
- Madathil, S. K., et al. Astrocyte-specific overexpression of insulin-like growth factor-1 protects hippocampal neurons and reduces behavioral deficits following traumatic brain injury in mice. PloS One. 8 (6), e67204(2013).
- Sugimoto, H., Kawakami, K. Low-cost protocol of footprint analysis and hanging box test for mice applied the chronic restraint stress. Journal of Visualized Experiments: JoVE. (143), e59027(2019).
- Hassan, S., et al. Identifying chronic low back pain phenotypic domains and characteristics accounting for individual variation: a systematic review. Pain. , (2023).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados